|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gold | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | metallic yellow | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Au) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gold in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 79 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 4f14 5d10 6s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
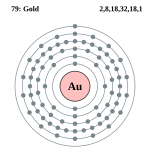
| Electrons per shell | 2, 8, 18, 32, 18, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1337.33 K (1064.18 °C, 1947.52 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 3243 K (2970 °C, 5378 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 19.3 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 17.31 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 12.55 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 342 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 25.418 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −3, −2, −1, 0,[2] +1, +2, +3, +5 (an amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 144 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 136±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 166 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of gold |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 2030 m/s (at r.t.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 14.2 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 318 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 22.14 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −28.0×10−6 cm3/mol (at 296 K)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tensile strength | 120 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 79 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 27 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 180 GPa[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 2.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 188–216 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 188–245 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-57-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | from Latin aurum, meaning gold | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | In the Middle East (before 6000 BCE) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «Au»: from Latin aurum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of gold
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Gold is a chemical element with the symbol Au (from Latin: aurum) and atomic number 79. This makes it one of the higher atomic number elements that occur naturally. It is a bright, slightly orange-yellow, dense, soft, malleable, and ductile metal in a pure form. Chemically, gold is a transition metal and a group 11 element. It is one of the least reactive chemical elements and is solid under standard conditions. Gold often occurs in free elemental (native state), as nuggets or grains, in rocks, veins, and alluvial deposits. It occurs in a solid solution series with the native element silver (as electrum), naturally alloyed with other metals like copper and palladium, and mineral inclusions such as within pyrite. Less commonly, it occurs in minerals as gold compounds, often with tellurium (gold tellurides).
Gold is resistant to most acids, though it does dissolve in aqua regia (a mixture of nitric acid and hydrochloric acid), forming a soluble tetrachloroaurate anion. Gold is insoluble in nitric acid alone, which dissolves silver and base metals, a property long used to refine gold and confirm the presence of gold in metallic substances, giving rise to the term ‘acid test’. Gold dissolves in alkaline solutions of cyanide, which are used in mining and electroplating. Gold also dissolves in mercury, forming amalgam alloys, and as the gold acts simply as a solute, this is not a chemical reaction.
A relatively rare element,[6][7] gold is a precious metal that has been used for coinage, jewelry, and other arts throughout recorded history. In the past, a gold standard was often implemented as a monetary policy. Gold coins ceased to be minted as a circulating currency in the 1930s, and the world gold standard was abandoned for a fiat currency system after the Nixon shock measures of 1971.
In 2020, the world’s largest gold producer was China, followed by Russia and Australia.[8] A total of around 201,296 tonnes of gold exists above ground, as of 2020.[9] This is equal to a cube with each side measuring roughly 21.7 meters (71 ft). The world consumption of new gold produced is about 50% in jewelry, 40% in investments and 10% in industry.[10] Gold’s high malleability, ductility, resistance to corrosion and most other chemical reactions, and conductivity of electricity have led to its continued use in corrosion-resistant electrical connectors in all types of computerized devices (its chief industrial use). Gold is also used in infrared shielding, production of colored glass, gold leafing, and tooth restoration. Certain gold salts are still used as anti-inflammatories in medicine.
Characteristics
Gold can be drawn into a monatomic wire, and then stretched more before it breaks.[11]
A gold nugget of 5 mm (0.20 in) in size can be hammered into a gold foil of about 0.5 m2 (5.4 sq ft) in area.
Gold is the most malleable of all metals. It can be drawn into a wire of single-atom width, and then stretched considerably before it breaks.[11] Such nanowires distort via formation, reorientation and migration of dislocations and crystal twins without noticeable hardening.[12] A single gram of gold can be beaten into a sheet of 1 square metre (11 sq ft), and an avoirdupois ounce into 300 square feet (28 m2). Gold leaf can be beaten thin enough to become semi-transparent. The transmitted light appears greenish-blue, because gold strongly reflects yellow and red.[13] Such semi-transparent sheets also strongly reflect infrared light, making them useful as infrared (radiant heat) shields in visors of heat-resistant suits, and in sun-visors for spacesuits.[14] Gold is a good conductor of heat and electricity.
Gold has a density of 19.3 g/cm3, almost identical to that of tungsten at 19.25 g/cm3; as such, tungsten has been used in counterfeiting of gold bars, such as by plating a tungsten bar with gold,[15][16][17][18] or taking an existing gold bar, drilling holes, and replacing the removed gold with tungsten rods.[19] By comparison, the density of lead is 11.34 g/cm3, and that of the densest element, osmium, is 22.588±0.015 g/cm3.[20]
Color
Different colors of Ag–Au–Cu alloys
Whereas most metals are gray or silvery white, gold is slightly reddish-yellow.[21] This color is determined by the frequency of plasma oscillations among the metal’s valence electrons, in the ultraviolet range for most metals but in the visible range for gold due to relativistic effects affecting the orbitals around gold atoms.[22][23] Similar effects impart a golden hue to metallic caesium.
Common colored gold alloys include the distinctive eighteen-karat rose gold created by the addition of copper. Alloys containing palladium or nickel are also important in commercial jewelry as these produce white gold alloys. Fourteen-karat gold-copper alloy is nearly identical in color to certain bronze alloys, and both may be used to produce police and other badges. Fourteen- and eighteen-karat gold alloys with silver alone appear greenish-yellow and are referred to as green gold. Blue gold can be made by alloying with iron, and purple gold can be made by alloying with aluminium. Less commonly, addition of manganese, indium, and other elements can produce more unusual colors of gold for various applications.[24]
Colloidal gold, used by electron-microscopists, is red if the particles are small; larger particles of colloidal gold are blue.[25]
Isotopes
Gold has only one stable isotope, 197
Au, which is also its only naturally occurring isotope, so gold is both a mononuclidic and monoisotopic element. Thirty-six radioisotopes have been synthesized, ranging in atomic mass from 169 to 205. The most stable of these is 195
Au with a half-life of 186.1 days. The least stable is 171
Au, which decays by proton emission with a half-life of 30 µs. Most of gold’s radioisotopes with atomic masses below 197 decay by some combination of proton emission, α decay, and β+ decay. The exceptions are 195
Au, which decays by electron capture, and 196
Au, which decays most often by electron capture (93%) with a minor β− decay path (7%).[26] All of gold’s radioisotopes with atomic masses above 197 decay by β− decay.[27]
At least 32 nuclear isomers have also been characterized, ranging in atomic mass from 170 to 200. Within that range, only 178
Au, 180
Au, 181
Au, 182
Au, and 188
Au do not have isomers. Gold’s most stable isomer is 198m2
Au with a half-life of 2.27 days. Gold’s least stable isomer is 177m2
Au with a half-life of only 7 ns. 184m1
Au has three decay paths: β+ decay, isomeric transition, and alpha decay. No other isomer or isotope of gold has three decay paths.[27]
Synthesis
The possible production of gold from a more common element, such as lead, has long been a subject of human inquiry, and the ancient and medieval discipline of alchemy often focused on it; however, the transmutation of the chemical elements did not become possible until the understanding of nuclear physics in the 20th century. The first synthesis of gold was conducted by Japanese physicist Hantaro Nagaoka, who synthesized gold from mercury in 1924 by neutron bombardment.[28] An American team, working without knowledge of Nagaoka’s prior study, conducted the same experiment in 1941, achieving the same result and showing that the isotopes of gold produced by it were all radioactive.[29] In 1980, Glenn Seaborg transmuted several thousand atoms of bismuth into gold at the Lawrence Berkeley Laboratory.[30][31] Gold can be manufactured in a nuclear reactor, but doing so is highly impractical and would cost far more than the value of the gold that is produced.[32]
Chemistry
Gold(III) chloride solution in water
Although gold is the most noble of the noble metals,[33][34] it still forms many diverse compounds. The oxidation state of gold in its compounds ranges from −1 to +5, but Au(I) and Au(III) dominate its chemistry. Au(I), referred to as the aurous ion, is the most common oxidation state with soft ligands such as thioethers, thiolates, and organophosphines. Au(I) compounds are typically linear. A good example is Au(CN)−2, which is the soluble form of gold encountered in mining. The binary gold halides, such as AuCl, form zigzag polymeric chains, again featuring linear coordination at Au. Most drugs based on gold are Au(I) derivatives.[35]
Au(III) (referred to as the auric) is a common oxidation state, and is illustrated by gold(III) chloride, Au2Cl6. The gold atom centers in Au(III) complexes, like other d8 compounds, are typically square planar, with chemical bonds that have both covalent and ionic character. Gold(I,III) chloride is also known, an example of a mixed-valence complex.
Gold does not react with oxygen at any temperature[36] and, up to 100 °C, is resistant to attack from ozone.[37]
Some free halogens react with gold.[38] Gold is strongly attacked by fluorine at dull-red heat[39] to form gold(III) fluoride AuF3. Powdered gold reacts with chlorine at 180 °C to form gold(III) chloride AuCl3.[40] Gold reacts with bromine at 140 °C to form gold(III) bromide AuBr3, but reacts only very slowly with iodine to form gold(I) iodide AuI.
Gold does not react with sulfur directly,[41] but gold(III) sulfide can be made by passing hydrogen sulfide through a dilute solution of gold(III) chloride or chlorauric acid.
Gold readily dissolves in mercury at room temperature to form an amalgam, and forms alloys with many other metals at higher temperatures. These alloys can be produced to modify the hardness and other metallurgical properties, to control melting point or to create exotic colors.[24]
Gold is unaffected by most acids. It does not react with hydrofluoric, hydrochloric, hydrobromic, hydriodic, sulfuric, or nitric acid. It does react with selenic acid, and is dissolved by aqua regia, a 1:3 mixture of nitric acid and hydrochloric acid. Nitric acid oxidizes the metal to +3 ions, but only in minute amounts, typically undetectable in the pure acid because of the chemical equilibrium of the reaction. However, the ions are removed from the equilibrium by hydrochloric acid, forming AuCl−4 ions, or chloroauric acid, thereby enabling further oxidation.
Gold is similarly unaffected by most bases. It does not react with aqueous, solid, or molten sodium or potassium hydroxide. It does however, react with sodium or potassium cyanide under alkaline conditions when oxygen is present to form soluble complexes.[41]
Common oxidation states of gold include +1 (gold(I) or aurous compounds) and +3 (gold(III) or auric compounds). Gold ions in solution are readily reduced and precipitated as metal by adding any other metal as the reducing agent. The added metal is oxidized and dissolves, allowing the gold to be displaced from solution and be recovered as a solid precipitate.
Rare oxidation states
Less common oxidation states of gold include −1, +2, and +5.
The −1 oxidation state occurs in aurides, compounds containing the Au− anion. Caesium auride (CsAu), for example, crystallizes in the caesium chloride motif;[42] rubidium, potassium, and tetramethylammonium aurides are also known.[43] Gold has the highest electron affinity of any metal, at 222.8 kJ/mol, making Au− a stable species,[44] analogous to the halides.
Gold also has a –1 oxidation state in covalent complexes with the group 4 transition metals, such as in titanium tetraauride and the analogous zirconium and hafnium compounds. These chemicals are expected to form gold-bridged dimers in a manner similar to titanium(IV) hydride.[45]
Gold(II) compounds are usually diamagnetic with Au–Au bonds such as [Au(CH2)2P(C6H5)2]2Cl2. The evaporation of a solution of Au(OH)3 in concentrated H2SO4 produces red crystals of gold(II) sulfate, Au2(SO4)2. Originally thought to be a mixed-valence compound, it has been shown to contain Au4+2 cations, analogous to the better-known mercury(I) ion, Hg2+2.[46][47] A gold(II) complex, the tetraxenonogold(II) cation, which contains xenon as a ligand, occurs in [AuXe4](Sb2F11)2.[48]
Gold pentafluoride, along with its derivative anion, AuF−6, and its difluorine complex, gold heptafluoride, is the sole example of gold(V), the highest verified oxidation state.[49]
Some gold compounds exhibit aurophilic bonding, which describes the tendency of gold ions to interact at distances that are too long to be a conventional Au–Au bond but shorter than van der Waals bonding. The interaction is estimated to be comparable in strength to that of a hydrogen bond.
Well-defined cluster compounds are numerous.[43] In some cases, gold has a fractional oxidation state. A representative example is the octahedral species {Au(P(C6H5)3)}2+6.
Origin
Gold production in the universe
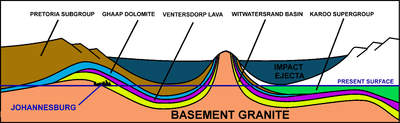
Schematic of a NE (left) to SW (right) cross-section through the 2.020-billion-year-old Vredefort impact structure in South Africa and how it distorted the contemporary geological structures. The present erosion level is shown. Johannesburg is located where the Witwatersrand Basin (the yellow layer) is exposed at the «present surface» line, just inside the crater rim, on the left. Not to scale.
Gold is thought to have been produced in supernova nucleosynthesis, and from the collision of neutron stars,[50] and to have been present in the dust from which the Solar System formed.[51]
Traditionally, gold in the universe is thought to have formed by the r-process (rapid neutron capture) in supernova nucleosynthesis,[52] but more recently it has been suggested that gold and other elements heavier than iron may also be produced in quantity by the r-process in the collision of neutron stars.[53] In both cases, satellite spectrometers at first only indirectly detected the resulting gold.[54] However, in August 2017, the spectroscopic signatures of heavy elements, including gold, were observed by electromagnetic observatories in the GW170817 neutron star merger event, after gravitational wave detectors confirmed the event as a neutron star merger.[55] Current astrophysical models suggest that this single neutron star merger event generated between 3 and 13 Earth masses of gold. This amount, along with estimations of the rate of occurrence of these neutron star merger events, suggests that such mergers may produce enough gold to account for most of the abundance of this element in the universe.[56]
Asteroid origin theories
Because the Earth was molten when it was formed, almost all of the gold present in the early Earth probably sank into the planetary core. Therefore, most of the gold that is in the Earth’s crust and mantle has in one model thought to have been delivered to Earth later, by asteroid impacts during the Late Heavy Bombardment, about 4 billion years ago.[57][58]
Gold which is reachable by humans has, in one case, been associated with a particular asteroid impact. The asteroid that formed Vredefort impact structure 2.020 billion years ago is often credited with seeding the Witwatersrand basin in South Africa with the richest gold deposits on earth.[59][60][61][62] However, this scenario is now questioned. The gold-bearing Witwatersrand rocks were laid down between 700 and 950 million years before the Vredefort impact.[63][64] These gold-bearing rocks had furthermore been covered by a thick layer of Ventersdorp lavas and the Transvaal Supergroup of rocks before the meteor struck, and thus the gold did not actually arrive in the asteroid/meteorite. What the Vredefort impact achieved, however, was to distort the Witwatersrand basin in such a way that the gold-bearing rocks were brought to the present erosion surface in Johannesburg, on the Witwatersrand, just inside the rim of the original 300 km (190 mi) diameter crater caused by the meteor strike. The discovery of the deposit in 1886 launched the Witwatersrand Gold Rush. Some 22% of all the gold that is ascertained to exist today on Earth has been extracted from these Witwatersrand rocks.[64]
Mantle return theories
Notwithstanding the impact above, much of the rest of the gold on Earth is thought to have been incorporated into the planet since its very beginning, as planetesimals formed the planet’s mantle, early in Earth’s creation. In 2017, an international group of scientists, established that gold «came to the Earth’s surface from the deepest regions of our planet»,[65] the mantle, evidenced by their findings at Deseado Massif in the Argentinian Patagonia.[66][clarification needed]
Occurrence
On Earth, gold is found in ores in rock formed from the Precambrian time onward.[67] It most often occurs as a native metal, typically in a metal solid solution with silver (i.e. as a gold/silver alloy). Such alloys usually have a silver content of 8–10%. Electrum is elemental gold with more than 20% silver, and is commonly known as white gold. Electrum’s color runs from golden-silvery to silvery, dependent upon the silver content. The more silver, the lower the specific gravity.
Native gold occurs as very small to microscopic particles embedded in rock, often together with quartz or sulfide minerals such as «fool’s gold», which is a pyrite.[68] These are called lode deposits. The metal in a native state is also found in the form of free flakes, grains or larger nuggets[67] that have been eroded from rocks and end up in alluvial deposits called placer deposits. Such free gold is always richer at the exposed surface of gold-bearing veins, owing to the oxidation of accompanying minerals followed by weathering; and by washing of the dust into streams and rivers, where it collects and can be welded by water action to form nuggets.
Gold sometimes occurs combined with tellurium as the minerals calaverite, krennerite, nagyagite, petzite and sylvanite (see telluride minerals), and as the rare bismuthide maldonite (Au2Bi) and antimonide aurostibite (AuSb2). Gold also occurs in rare alloys with copper, lead, and mercury: the minerals auricupride (Cu3Au), novodneprite (AuPb3) and weishanite ((Au,Ag)3Hg2).
Recent research suggests that microbes can sometimes play an important role in forming gold deposits, transporting and precipitating gold to form grains and nuggets that collect in alluvial deposits.[69]
Another recent study has claimed water in faults vaporizes during an earthquake, depositing gold. When an earthquake strikes, it moves along a fault. Water often lubricates faults, filling in fractures and jogs. About 10 kilometres (6.2 mi) below the surface, under very high temperatures and pressures, the water carries high concentrations of carbon dioxide, silica, and gold. During an earthquake, the fault jog suddenly opens wider. The water inside the void instantly vaporizes, flashing to steam and forcing silica, which forms the mineral quartz, and gold out of the fluids and onto nearby surfaces.[70]
Seawater
The world’s oceans contain gold. Measured concentrations of gold in the Atlantic and Northeast Pacific are 50–150 femtomol/L or 10–30 parts per quadrillion (about 10–30 g/km3). In general, gold concentrations for south Atlantic and central Pacific samples are the same (~50 femtomol/L) but less certain. Mediterranean deep waters contain slightly higher concentrations of gold (100–150 femtomol/L) attributed to wind-blown dust and/or rivers. At 10 parts per quadrillion the Earth’s oceans would hold 15,000 tonnes of gold.[71] These figures are three orders of magnitude less than reported in the literature prior to 1988, indicating contamination problems with the earlier data.
A number of people have claimed to be able to economically recover gold from sea water, but they were either mistaken or acted in an intentional deception. Prescott Jernegan ran a gold-from-seawater swindle in the United States in the 1890s, as did an English fraudster in the early 1900s.[72] Fritz Haber did research on the extraction of gold from sea water in an effort to help pay Germany’s reparations following World War I.[73] Based on the published values of 2 to 64 ppb of gold in seawater a commercially successful extraction seemed possible. After analysis of 4,000 water samples yielding an average of 0.004 ppb it became clear that extraction would not be possible and he ended the project.[74]
History
Oldest golden artifacts in the world (4600 BC — 4200 BC) from Varna necropolis, Bulgaria — grave offerings on exposition in Varna Museum.
The Muisca raft, between circa 600-1600 AD. The figure refers to the ceremony of the legend of El Dorado. The zipa used to cover his body in gold dust, and from his raft, he offered treasures to the Guatavita goddess in the middle of the sacred lake. This old Muisca tradition became the origin of the legend of El Dorado.
This Muisca raft figure is on display in the Gold Museum, Bogotá, Colombia.
The earliest recorded metal employed by humans appears to be gold, which can be found free or «native». Small amounts of natural gold have been found in Spanish caves used during the late Paleolithic period, c. 40,000 BC.[76]
The oldest gold artifacts in the world are from Bulgaria and are dating back to the 5th millennium BC (4,600 BC to 4,200 BC), such as those found in the Varna Necropolis near Lake Varna and the Black Sea coast, thought to be the earliest «well-dated» finding of gold artifacts in history.[77][67][78][79] Several prehistoric Bulgarian finds are considered no less old – the golden treasures of Hotnitsa, Durankulak, artifacts from the Kurgan settlement of Yunatsite near Pazardzhik, the golden treasure Sakar, as well as beads and gold jewelry found in the Kurgan settlement of Provadia – Solnitsata (“salt pit”). However, Varna gold is most often called the oldest since this treasure is the largest and most diverse.[80]
Gold artifacts probably made their first appearance in Ancient Egypt at the very beginning of the pre-dynastic period, at the end of the fifth millennium BC and the start of the fourth, and smelting was developed during the course of the 4th millennium; gold artifacts appear in the archeology of Lower Mesopotamia during the early 4th millennium.[81] As of 1990, gold artifacts found at the Wadi Qana cave cemetery of the 4th millennium BC in West Bank were the earliest from the Levant.[82] Gold artifacts such as the golden hats and the Nebra disk appeared in Central Europe from the 2nd millennium BC Bronze Age.
The oldest known map of a gold mine was drawn in the 19th Dynasty of Ancient Egypt (1320–1200 BC), whereas the first written reference to gold was recorded in the 12th Dynasty around 1900 BC.[83] Egyptian hieroglyphs from as early as 2600 BC describe gold, which King Tushratta of the Mitanni claimed was «more plentiful than dirt» in Egypt.[84] Egypt and especially Nubia had the resources to make them major gold-producing areas for much of history. One of the earliest known maps, known as the Turin Papyrus Map, shows the plan of a gold mine in Nubia together with indications of the local geology. The primitive working methods are described by both Strabo and Diodorus Siculus, and included fire-setting. Large mines were also present across the Red Sea in what is now Saudi Arabia.
Gold is mentioned in the Amarna letters numbered 19[85] and 26[86] from around the 14th century BC.[87][88]
Gold is mentioned frequently in the Old Testament, starting with Genesis 2:11 (at Havilah), the story of the golden calf, and many parts of the temple including the Menorah and the golden altar. In the New Testament, it is included with the gifts of the magi in the first chapters of Matthew. The Book of Revelation 21:21 describes the city of New Jerusalem as having streets «made of pure gold, clear as crystal». Exploitation of gold in the south-east corner of the Black Sea is said to date from the time of Midas, and this gold was important in the establishment of what is probably the world’s earliest coinage in Lydia around 610 BC.[89] The legend of the golden fleece dating from eighth century BCE may refer to the use of fleeces to trap gold dust from placer deposits in the ancient world. From the 6th or 5th century BC, the Chu (state) circulated the Ying Yuan, one kind of square gold coin.
In Roman metallurgy, new methods for extracting gold on a large scale were developed by introducing hydraulic mining methods, especially in Hispania from 25 BC onwards and in Dacia from 106 AD onwards. One of their largest mines was at Las Medulas in León, where seven long aqueducts enabled them to sluice most of a large alluvial deposit. The mines at Roşia Montană in Transylvania were also very large, and until very recently, still mined by opencast methods. They also exploited smaller deposits in Britain, such as placer and hard-rock deposits at Dolaucothi. The various methods they used are well described by Pliny the Elder in his encyclopedia Naturalis Historia written towards the end of the first century AD.
During Mansa Musa’s (ruler of the Mali Empire from 1312 to 1337) hajj to Mecca in 1324, he passed through Cairo in July 1324, and was reportedly accompanied by a camel train that included thousands of people and nearly a hundred camels where he gave away so much gold that it depressed the price in Egypt for over a decade, causing high inflation.[90] A contemporary Arab historian remarked:
Gold was at a high price in Egypt until they came in that year. The mithqal did not go below 25 dirhams and was generally above, but from that time its value fell and it cheapened in price and has remained cheap till now. The mithqal does not exceed 22 dirhams or less. This has been the state of affairs for about twelve years until this day by reason of the large amount of gold which they brought into Egypt and spent there […].
Gold coin of Eucratides I (171–145 BC), one of the Hellenistic rulers of ancient Ai-Khanoum. This is the largest known gold coin minted in antiquity (169.2 g (5.97 oz); 58 mm (2.3 in)).[92]
The European exploration of the Americas was fueled in no small part by reports of the gold ornaments displayed in great profusion by Native American peoples, especially in Mesoamerica, Peru, Ecuador and Colombia. The Aztecs regarded gold as the product of the gods, calling it literally «god excrement» (teocuitlatl in Nahuatl), and after Moctezuma II was killed, most of this gold was shipped to Spain.[93] However, for the indigenous peoples of North America gold was considered useless and they saw much greater value in other minerals which were directly related to their utility, such as obsidian, flint, and slate.[94] El Dorado is applied to a legendary story in which precious stones were found in fabulous abundance along with gold coins. The concept of El Dorado underwent several transformations, and eventually accounts of the previous myth were also combined with those of a legendary lost city. El Dorado, was the term used by the Spanish Empire to describe a mythical tribal chief (zipa) of the Muisca native people in Colombia, who, as an initiation rite, covered himself with gold dust and submerged in Lake Guatavita. The legends surrounding El Dorado changed over time, as it went from being a man, to a city, to a kingdom, and then finally to an empire.
Beginning in the early modern period, European exploration and colonization of West Africa was driven in large part by reports of gold deposits in the region, which was eventually referred to by Europeans as the «Gold Coast».[95] From the late 15th to early 19th centuries, European trade in the region was primarily focused in gold, along with ivory and slaves.[96] The gold trade in West Africa was dominated by the Ashanti Empire, who initially traded with the Portuguese before branching out and trading with British, French, Spanish and Danish merchants.[97] British desires to secure control of West African gold deposits played a role in the Anglo-Ashanti wars of the late 19th century, which saw the Ashanti Empire annexed by Britain.[98]
Gold played a role in western culture, as a cause for desire and of corruption, as told in children’s fables such as Rumpelstiltskin—where Rumpelstiltskin turns hay into gold for the peasant’s daughter in return for her child when she becomes a princess—and the stealing of the hen that lays golden eggs in Jack and the Beanstalk.
The top prize at the Olympic Games and many other sports competitions is the gold medal.
75% of the presently accounted for gold has been extracted since 1910, two-thirds since 1950.
One main goal of the alchemists was to produce gold from other substances, such as lead — presumably by the interaction with a mythical substance called the philosopher’s stone. Trying to produce gold led the alchemists to systematically find out what can be done with substances, and this laid the foundation for today’s chemistry, which can produce gold (albeit uneconomically) by using nuclear transmutation.[99] Their symbol for gold was the circle with a point at its center (☉), which was also the astrological symbol and the ancient Chinese character for the Sun.
The Dome of the Rock is covered with an ultra-thin golden glassier. The Sikh Golden temple, the Harmandir Sahib, is a building covered with gold. Similarly the Wat Phra Kaew emerald Buddhist temple (wat) in Thailand has ornamental gold-leafed statues and roofs. Some European king and queen’s crowns were made of gold, and gold was used for the bridal crown since antiquity. An ancient Talmudic text circa 100 AD describes Rachel, wife of Rabbi Akiva, receiving a «Jerusalem of Gold» (diadem). A Greek burial crown made of gold was found in a grave circa 370 BC.
-
Ancient Egyptian statuette of Amun; 945–715 BC; gold; 175 mm × 47 mm (6.9 in × 1.9 in); Metropolitan Museum of Art
-
Ancient Egyptian signet ring; 664–525 BC; gold; diameter: 30 mm × 34 mm (1.2 in × 1.3 in); British Museum (London)
-
Etruscan funerary wreath; 4th–3rd century BC; length: 333 mm (13.1 in); Metropolitan Museum of Art
-
Quimbaya lime container; 5th–9th century; gold; height: 230 mm (9.1 in); Metropolitan Museum of Art
-
-
Pre-Columbian pendant with two bat-head warriors who carry spears; 11th–16th century; gold; overall: 76.2 mm (3.00 in); from the Chiriqui Province (Panama); Metropolitan Museum of Art
-
English Neoclassical box; 1741; overall: 44 mm × 116 mm × 92 mm (1.7 in × 4.6 in × 3.6 in); Metropolitan Museum of Art
-
French Rococo glass bottle mounted in gold; circa 1775; overall: 70 mm × 29 mm (2.8 in × 1.1 in); Cleveland Museum of Art
Etymology
An early mention of gold in the Beowulf
«Gold» is cognate with similar words in many Germanic languages, deriving via Proto-Germanic *gulþą from Proto-Indo-European *ǵʰelh₃- («to shine, to gleam; to be yellow or green»).[100][101]
The symbol Au is from the Latin: aurum, the Latin word for «gold».[102] The Proto-Indo-European ancestor of aurum was *h₂é-h₂us-o-, meaning «glow». This word is derived from the same root (Proto-Indo-European *h₂u̯es- «to dawn») as *h₂éu̯sōs, the ancestor of the Latin word Aurora, «dawn».[103] This etymological relationship is presumably behind the frequent claim in scientific publications that aurum meant «shining dawn».[104]
Culture
In popular culture gold is a high standard of excellence, often used in awards.[44] Great achievements are frequently rewarded with gold, in the form of gold medals, gold trophies and other decorations. Winners of athletic events and other graded competitions are usually awarded a gold medal. Many awards such as the Nobel Prize are made from gold as well. Other award statues and prizes are depicted in gold or are gold plated (such as the Academy Awards, the Golden Globe Awards, the Emmy Awards, the Palme d’Or, and the British Academy Film Awards).[105]
Aristotle in his ethics used gold symbolism when referring to what is now known as the golden mean. Similarly, gold is associated with perfect or divine principles, such as in the case of the golden ratio and the golden rule. Gold is further associated with the wisdom of aging and fruition. The fiftieth wedding anniversary is golden. A person’s most valued or most successful latter years are sometimes considered «golden years». The height of a civilization is referred to as a golden age.[106]
Religion
In some forms of Christianity and Judaism, gold has been associated both with the sacred and evil. In the Book of Exodus, the Golden Calf is a symbol of idolatry, while in the Book of Genesis, Abraham was said to be rich in gold and silver, and Moses was instructed to cover the Mercy Seat of the Ark of the Covenant with pure gold. In Byzantine iconography the halos of Christ, Virgin Mary and the saints are often golden.[107]
In Islam,[108] gold (along with silk)[109][110] is often cited as being forbidden for men to wear.[111] Abu Bakr al-Jazaeri, quoting a hadith, said that «[t]he wearing of silk and gold are forbidden on the males of my nation, and they are lawful to their women».[112] This, however, has not been enforced consistently throughout history, e.g. in the Ottoman Empire.[113] Further, small gold accents on clothing, such as in embroidery, may be permitted.[114]
In ancient Greek religion and mythology, Theia was seen as the goddess of gold, silver and other gems.[115]
According to Christopher Columbus, those who had something of gold were in possession of something of great value on Earth and a substance to even help souls to paradise.[116]
Wedding rings are typically made of gold. It is long lasting and unaffected by the passage of time and may aid in the ring symbolism of eternal vows before God and the perfection the marriage signifies. In Orthodox Christian wedding ceremonies, the wedded couple is adorned with a golden crown (though some opt for wreaths, instead) during the ceremony, an amalgamation of symbolic rites.
On 24 August 2020, Israeli archaeologists discovered a trove of early Islamic gold coins near the central city of Yavne. Analysis of the extremely rare collection of 425 gold coins indicated that they were from the late 9th century. Dating to around 1,100 years back, the gold coins were from the Abbasid Caliphate.[117]
Production
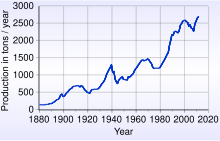
Time trend of gold production
According to the United States Geological Survey in 2016, about 5,726,000,000 troy ounces (178,100 t) of gold has been accounted for, of which 85% remains in active use.[118]
Mining and prospecting
Since the 1880s, South Africa has been the source of a large proportion of the world’s gold supply, and about 22% of the gold presently accounted is from South Africa. Production in 1970 accounted for 79% of the world supply, about 1,480 tonnes. In 2007 China (with 276 tonnes) overtook South Africa as the world’s largest gold producer, the first time since 1905 that South Africa had not been the largest.[119]
In 2020, China was the world’s leading gold-mining country, followed in order by Russia, Australia, the United States, Canada, and Ghana.[8]
Relative sizes of an 860 kg (1,900 lb) block of gold ore and the 30 g (0.96 ozt) of gold that can be extracted from it, Toi gold mine, Japan.
In South America, the controversial project Pascua Lama aims at exploitation of rich fields in the high mountains of Atacama Desert, at the border between Chile and Argentina.
It has been estimated that up to one-quarter of the yearly global gold production originates from artisanal or small scale mining.[120][121][122]
The city of Johannesburg located in South Africa was founded as a result of the Witwatersrand Gold Rush which resulted in the discovery of some of the largest natural gold deposits in recorded history. The gold fields are confined to the northern and north-western edges of the Witwatersrand basin, which is a 5–7 km (3.1–4.3 mi) thick layer of archean rocks located, in most places, deep under the Free State, Gauteng and surrounding provinces.[123] These Witwatersrand rocks are exposed at the surface on the Witwatersrand, in and around Johannesburg, but also in isolated patches to the south-east and south-west of Johannesburg, as well as in an arc around the Vredefort Dome which lies close to the center of the Witwatersrand basin.[63][123] From these surface exposures the basin dips extensively, requiring some of the mining to occur at depths of nearly 4,000 m (13,000 ft), making them, especially the Savuka and TauTona mines to the south-west of Johannesburg, the deepest mines on earth. The gold is found only in six areas where archean rivers from the north and north-west formed extensive pebbly Braided river deltas before draining into the «Witwatersrand sea» where the rest of the Witwatersrand sediments were deposited.[123]
The Second Boer War of 1899–1901 between the British Empire and the Afrikaner Boers was at least partly over the rights of miners and possession of the gold wealth in South Africa.
During the 19th century, gold rushes occurred whenever large gold deposits were discovered. The first documented discovery of gold in the United States was at the Reed Gold Mine near Georgeville, North Carolina in 1803.[124] The first major gold strike in the United States occurred in a small north Georgia town called Dahlonega.[125] Further gold rushes occurred in California, Colorado, the Black Hills, Otago in New Zealand, a number of locations across Australia, Witwatersrand in South Africa, and the Klondike in Canada.
Grasberg mine located in Papua, Indonesia is the largest gold mine in the world.[126]
Extraction and refining
Gold extraction is most economical in large, easily mined deposits. Ore grades as little as 0.5 parts per million (ppm) can be economical. Typical ore grades in open-pit mines are 1–5 ppm; ore grades in underground or hard rock mines are usually at least 3 ppm. Because ore grades of 30 ppm are usually needed before gold is visible to the naked eye, in most gold mines the gold is invisible.
The average gold mining and extraction costs were about $317 per troy ounce in 2007, but these can vary widely depending on mining type and ore quality; global mine production amounted to 2,471.1 tonnes.[127]
After initial production, gold is often subsequently refined industrially by the Wohlwill process which is based on electrolysis or by the Miller process, that is chlorination in the melt. The Wohlwill process results in higher purity, but is more complex and is only applied in small-scale installations.[128][129] Other methods of assaying and purifying smaller amounts of gold include parting and inquartation as well as cupellation, or refining methods based on the dissolution of gold in aqua regia.[130]
As of 2020, the amount of carbon dioxide CO2 produced in mining a kilogram of gold is 16 tonnes, while recycling a kilogram of gold produces 53 kilograms of CO2 equivalent. Approximately 30 percent of the global gold supply is recycled and not mined as of 2020.[131]
Corporations are starting to adopt gold recycling including jewelry companies such as Generation Collection and computer companies including Dell.[132]
Consumption
|
|
This article needs to be updated. Please help update this article to reflect recent events or newly available information. (May 2022) |
| Country | 2009 | 2010 | 2011 | 2012 | 2013 |
|---|---|---|---|---|---|
| 442.37 | 745.70 | 986.3 | 864 | 974 | |
| 376.96 | 428.00 | 921.5 | 817.5 | 1120.1 | |
| 150.28 | 128.61 | 199.5 | 161 | 190 | |
| 75.16 | 74.07 | 143 | 118 | 175.2 | |
| 77.75 | 72.95 | 69.1 | 58.5 | 72.2 | |
| 60.12 | 67.50 | 76.7 | 81.9 | 73.3 | |
| 67.60 | 63.37 | 60.9 | 58.1 | 77.1 | |
| 56.68 | 53.43 | 36 | 47.8 | 57.3 | |
| 41.00 | 32.75 | 55 | 52.3 | 68 | |
| 31.75 | 27.35 | 22.6 | 21.1 | 23.4 | |
| Other Persian Gulf Countries | 24.10 | 21.97 | 22 | 19.9 | 24.6 |
| 21.85 | 18.50 | −30.1 | 7.6 | 21.3 | |
| 18.83 | 15.87 | 15.5 | 12.1 | 17.5 | |
| 15.08 | 14.36 | 100.8 | 77 | 92.2 | |
| 7.33 | 6.28 | 107.4 | 80.9 | 140.1 | |
| Total | 1466.86 | 1770.71 | 2786.12 | 2477.7 | 3126.1 |
| Other Countries | 251.6 | 254.0 | 390.4 | 393.5 | 450.7 |
| World Total | 1718.46 | 2024.71 | 3176.52 | 2871.2 | 3576.8 |
The consumption of gold produced in the world is about 50% in jewelry, 40% in investments, and 10% in industry.[10][136]
According to the World Gold Council, China was the world’s largest single consumer of gold in 2013, overtaking India.[137]
Pollution
Gold production is associated with contribution to hazardous pollution.[138][139]
Low-grade gold ore may contain less than one ppm gold metal; such ore is ground and mixed with sodium cyanide to dissolve the gold. Cyanide is a highly poisonous chemical, which can kill living creatures when exposed in minute quantities. Many cyanide spills[140] from gold mines have occurred in both developed and developing countries which killed aquatic life in long stretches of affected rivers. Environmentalists consider these events major environmental disasters.[141][142] Up to thirty tons of used ore can dumped as waste for producing one troy ounce of gold.[143] Gold ore dumps are the source of many heavy elements such as cadmium, lead, zinc, copper, arsenic, selenium and mercury. When sulfide-bearing minerals in these ore dumps are exposed to air and water, the sulfide transforms into sulfuric acid which in turn dissolves these heavy metals facilitating their passage into surface water and ground water. This process is called acid mine drainage. These gold ore dumps are long-term, highly hazardous wastes second only to nuclear waste dumps.[143]
It was once common to use mercury to recover gold from ore, but today the use of mercury is largely limited to small-scale individual miners.[144] Minute quantities of mercury compounds can reach water bodies, causing heavy metal contamination. Mercury can then enter into the human food chain in the form of methylmercury. Mercury poisoning in humans causes incurable brain function damage and severe retardation.[145]
Gold extraction is also a highly energy-intensive industry, extracting ore from deep mines and grinding the large quantity of ore for further chemical extraction requires nearly 25 kWh of electricity per gram of gold produced.[146]
Monetary use
Gold has been widely used throughout the world as money,[147] for efficient indirect exchange (versus barter), and to store wealth in hoards. For exchange purposes, mints produce standardized gold bullion coins, bars and other units of fixed weight and purity.
The first known coins containing gold were struck in Lydia, Asia Minor, around 600 BC.[89] The talent coin of gold in use during the periods of Grecian history both before and during the time of the life of Homer weighed between 8.42 and 8.75 grams.[148] From an earlier preference in using silver, European economies re-established the minting of gold as coinage during the thirteenth and fourteenth centuries.[149]
Bills (that mature into gold coin) and gold certificates (convertible into gold coin at the issuing bank) added to the circulating stock of gold standard money in most 19th century industrial economies.
In preparation for World War I the warring nations moved to fractional gold standards, inflating their currencies to finance the war effort.
Post-war, the victorious countries, most notably Britain, gradually restored gold-convertibility, but international flows of gold via bills of exchange remained embargoed; international shipments were made exclusively for bilateral trades or to pay war reparations.
After World War II gold was replaced by a system of nominally convertible currencies related by fixed exchange rates following the Bretton Woods system. Gold standards and the direct convertibility of currencies to gold have been abandoned by world governments, led in 1971 by the United States’ refusal to redeem its dollars in gold. Fiat currency now fills most monetary roles. Switzerland was the last country to tie its currency to gold; this was ended by a referendum in 1999.[150]
Central banks continue to keep a portion of their liquid reserves as gold in some form, and metals exchanges such as the London Bullion Market Association still clear transactions denominated in gold, including future delivery contracts. Today, gold mining output is declining.[151] With the sharp growth of economies in the 20th century, and increasing foreign exchange, the world’s gold reserves and their trading market have become a small fraction of all markets and fixed exchange rates of currencies to gold have been replaced by floating prices for gold and gold future contract. Though the gold stock grows by only 1% or 2% per year, very little metal is irretrievably consumed. Inventory above ground would satisfy many decades of industrial and even artisan uses at current prices.
The gold proportion (fineness) of alloys is measured by karat (k). Pure gold (commercially termed fine gold) is designated as 24 karat, abbreviated 24k. English gold coins intended for circulation from 1526 into the 1930s were typically a standard 22k alloy called crown gold,[152] for hardness (American gold coins for circulation after 1837 contain an alloy of 0.900 fine gold, or 21.6 kt).[153]
Although the prices of some platinum group metals can be much higher, gold has long been considered the most desirable of precious metals, and its value has been used as the standard for many currencies. Gold has been used as a symbol for purity, value, royalty, and particularly roles that combine these properties. Gold as a sign of wealth and prestige was ridiculed by Thomas More in his treatise Utopia. On that imaginary island, gold is so abundant that it is used to make chains for slaves, tableware, and lavatory seats. When ambassadors from other countries arrive, dressed in ostentatious gold jewels and badges, the Utopians mistake them for menial servants, paying homage instead to the most modestly dressed of their party.
The ISO 4217 currency code of gold is XAU.[154] Many holders of gold store it in form of bullion coins or bars as a hedge against inflation or other economic disruptions, though its efficacy as such has been questioned; historically, it has not proven itself reliable as a hedging instrument.[155] Modern bullion coins for investment or collector purposes do not require good mechanical wear properties; they are typically fine gold at 24k, although the American Gold Eagle and the British gold sovereign continue to be minted in 22k (0.92) metal in historical tradition, and the South African Krugerrand, first released in 1967, is also 22k (0.92).[156]
The special issue Canadian Gold Maple Leaf coin contains the highest purity gold of any bullion coin, at 99.999% or 0.99999, while the popular issue Canadian Gold Maple Leaf coin has a purity of 99.99%. In 2006, the United States Mint began producing the American Buffalo gold bullion coin with a purity of 99.99%. The Australian Gold Kangaroos were first coined in 1986 as the Australian Gold Nugget but changed the reverse design in 1989. Other modern coins include the Austrian Vienna Philharmonic bullion coin and the Chinese Gold Panda.[157]
Price
Gold price history in 1960–2020.
As of September 2017, gold is valued at around $42 per gram ($1,300 per troy ounce).
Like other precious metals, gold is measured by troy weight and by grams. The proportion of gold in the alloy is measured by karat (k), with 24 karat (24k) being pure gold (100%), and lower karat numbers proportionally less (18k = 75%). The purity of a gold bar or coin can also be expressed as a decimal figure ranging from 0 to 1, known as the millesimal fineness, such as 0.995 being nearly pure.
The price of gold is determined through trading in the gold and derivatives markets, but a procedure known as the Gold Fixing in London, originating in September 1919, provides a daily benchmark price to the industry. The afternoon fixing was introduced in 1968 to provide a price when US markets are open.[158]
History
Historically gold coinage was widely used as currency; when paper money was introduced, it typically was a receipt redeemable for gold coin or bullion. In a monetary system known as the gold standard, a certain weight of gold was given the name of a unit of currency. For a long period, the United States government set the value of the US dollar so that one troy ounce was equal to $20.67 ($0.665 per gram), but in 1934 the dollar was devalued to $35.00 per troy ounce ($0.889/g). By 1961, it was becoming hard to maintain this price, and a pool of US and European banks agreed to manipulate the market to prevent further currency devaluation against increased gold demand.[159]
On 17 March 1968, economic circumstances[clarification needed] caused the collapse of the gold pool, and a two-tiered pricing scheme was established whereby gold was still used to settle international accounts at the old $35.00 per troy ounce ($1.13/g) but the price of gold on the private market was allowed to fluctuate; this two-tiered pricing system was abandoned in 1975 when the price of gold was left to find its free-market level.[citation needed] Central banks still hold historical gold reserves as a store of value although the level has generally been declining.[citation needed] The largest gold depository in the world is that of the U.S. Federal Reserve Bank in New York, which holds about 3%[160] of the gold known to exist and accounted for today, as does the similarly laden U.S. Bullion Depository at Fort Knox.
In 2005 the World Gold Council estimated total global gold supply to be 3,859 tonnes and demand to be 3,754 tonnes, giving a surplus of 105 tonnes.[161]
After 15 August 1971 Nixon shock, the price began to greatly increase,[162] and between 1968 and 2000 the price of gold ranged widely, from a high of $850 per troy ounce ($27.33/g) on 21 January 1980, to a low of $252.90 per troy ounce ($8.13/g) on 21 June 1999 (London Gold Fixing).[163] Prices increased rapidly from 2001, but the 1980 high was not exceeded until 3 January 2008, when a new maximum of $865.35 per troy ounce was set.[164] Another record price was set on 17 March 2008, at $1023.50 per troy ounce ($32.91/g).[164]
In late 2009, gold markets experienced renewed momentum upwards due to increased demand and a weakening US dollar.[citation needed] On 2 December 2009, gold reached a new high closing at $1,217.23.[165] Gold further rallied hitting new highs in May 2010 after the European Union debt crisis prompted further purchase of gold as a safe asset.[166][167] On 1 March 2011, gold hit a new all-time high of $1432.57, based on investor concerns regarding ongoing unrest in North Africa as well as in the Middle East.[168]
From April 2001 to August 2011, spot gold prices more than quintupled in value against the US dollar, hitting a new all-time high of $1,913.50 on 23 August 2011,[169] prompting speculation that the long secular bear market had ended and a bull market had returned.[170] However, the price then began a slow decline towards $1200 per troy ounce in late 2014 and 2015.
In August 2020, the gold price picked up to US$2060 per ounce after a complexive growth of 59% from August 2018 to October 2020, a period during which it outplaced the Nasdaq total return of 54%.[171]
Gold futures are traded on the COMEX exchange.[172] These contacts are priced in USD per troy ounce (1 troy ounce = 31.1034768 grams).[173] Below are the CQG contract specifications outlining the futures contracts:
| Gold (GCA) | |
|---|---|
| Exchange: | COMEX |
| Sector: | Metal |
| Tick Size: | 0.1 |
| Tick Value: | 10 USD |
| BPV: | 100 |
| Denomination: | USD |
| Decimal Place: | 1 |
Medicinal uses
Medicinal applications of gold and its complexes have a long history dating back thousands of years.[174] Several gold complexes have been applied to treat rheumatoid arthritis, the most frequently used being aurothiomalate, aurothioglucose, and auranofin. Both gold(I) and gold(III) compounds have been investigated as possible anti-cancer drugs. For gold(III) complexes, reduction to gold(0/I) under physiological conditions has to be considered. Stable complexes can be generated using different types of bi-, tri-, and tetradentate ligand systems, and their efficacy has been demonstrated in vitro and in vivo.[175]
Other applications
Jewelry
Because of the softness of pure (24k) gold, it is usually alloyed with base metals for use in jewelry, altering its hardness and ductility, melting point, color and other properties. Alloys with lower karat rating, typically 22k, 18k, 14k or 10k, contain higher percentages of copper or other base metals or silver or palladium in the alloy.[24] Nickel is toxic, and its release from nickel white gold is controlled by legislation in Europe.[24] Palladium-gold alloys are more expensive than those using nickel.[176] High-karat white gold alloys are more resistant to corrosion than are either pure silver or sterling silver. The Japanese craft of Mokume-gane exploits the color contrasts between laminated colored gold alloys to produce decorative wood-grain effects.
By 2014, the gold jewelry industry was escalating despite a dip in gold prices. Demand in the first quarter of 2014 pushed turnover to $23.7 billion according to a World Gold Council report.
Gold solder is used for joining the components of gold jewelry by high-temperature hard soldering or brazing. If the work is to be of hallmarking quality, the gold solder alloy must match the fineness (purity) of the work, and alloy formulas are manufactured to color-match yellow and white gold. Gold solder is usually made in at least three melting-point ranges referred to as Easy, Medium and Hard. By using the hard, high-melting point solder first, followed by solders with progressively lower melting points, goldsmiths can assemble complex items with several separate soldered joints. Gold can also be made into thread and used in embroidery.
Electronics
Only 10% of the world consumption of new gold produced goes to industry,[10] but by far the most important industrial use for new gold is in fabrication of corrosion-free electrical connectors in computers and other electrical devices. For example, according to the World Gold Council, a typical cell phone may contain 50 mg of gold, worth about 2 dollars 82 cents. But since nearly one billion cell phones are produced each year, a gold value of US$2.82 in each phone adds to US$2.82 billion in gold from just this application.[177] (Prices updated to November 2022)
Though gold is attacked by free chlorine, its good conductivity and general resistance to oxidation and corrosion in other environments (including resistance to non-chlorinated acids) has led to its widespread industrial use in the electronic era as a thin-layer coating on electrical connectors, thereby ensuring good connection. For example, gold is used in the connectors of the more expensive electronics cables, such as audio, video and USB cables. The benefit of using gold over other connector metals such as tin in these applications has been debated; gold connectors are often criticized by audio-visual experts as unnecessary for most consumers and seen as simply a marketing ploy. However, the use of gold in other applications in electronic sliding contacts in highly humid or corrosive atmospheres, and in use for contacts with a very high failure cost (certain computers, communications equipment, spacecraft, jet aircraft engines) remains very common.[178]
Besides sliding electrical contacts, gold is also used in electrical contacts because of its resistance to corrosion, electrical conductivity, ductility and lack of toxicity.[179] Switch contacts are generally subjected to more intense corrosion stress than are sliding contacts. Fine gold wires are used to connect semiconductor devices to their packages through a process known as wire bonding.
The concentration of free electrons in gold metal is 5.91×1022 cm−3.[180] Gold is highly conductive to electricity, and has been used for electrical wiring in some high-energy applications (only silver and copper are more conductive per volume, but gold has the advantage of corrosion resistance). For example, gold electrical wires were used during some of the Manhattan Project’s atomic experiments, but large high-current silver wires were used in the calutron isotope separator magnets in the project.
It is estimated that 16% of the world’s presently-accounted-for gold and 22% of the world’s silver is contained in electronic technology in Japan.[181]
Medicine
Metallic and gold compounds have long been used for medicinal purposes. Gold, usually as the metal, is perhaps the most anciently administered medicine (apparently by shamanic practitioners)[182] and known to Dioscorides.[183][184] In medieval times, gold was often seen as beneficial for the health, in the belief that something so rare and beautiful could not be anything but healthy. Even some modern esotericists and forms of alternative medicine assign metallic gold a healing power.
In the 19th century gold had a reputation as an anxiolytic, a therapy for nervous disorders. Depression, epilepsy, migraine, and glandular problems such as amenorrhea and impotence were treated, and most notably alcoholism (Keeley, 1897).[185]
The apparent paradox of the actual toxicology of the substance suggests the possibility of serious gaps in the understanding of the action of gold in physiology.[186] Only salts and radioisotopes of gold are of pharmacological value, since elemental (metallic) gold is inert to all chemicals it encounters inside the body (e.g., ingested gold cannot be attacked by stomach acid). Some gold salts do have anti-inflammatory properties and at present two are still used as pharmaceuticals in the treatment of arthritis and other similar conditions in the US (sodium aurothiomalate and auranofin). These drugs have been explored as a means to help to reduce the pain and swelling of rheumatoid arthritis, and also (historically) against tuberculosis and some parasites.[187]
Gold alloys are used in restorative dentistry, especially in tooth restorations, such as crowns and permanent bridges. The gold alloys’ slight malleability facilitates the creation of a superior molar mating surface with other teeth and produces results that are generally more satisfactory than those produced by the creation of porcelain crowns. The use of gold crowns in more prominent teeth such as incisors is favored in some cultures and discouraged in others.
Colloidal gold preparations (suspensions of gold nanoparticles) in water are intensely red-colored, and can be made with tightly controlled particle sizes up to a few tens of nanometers across by reduction of gold chloride with citrate or ascorbate ions. Colloidal gold is used in research applications in medicine, biology and materials science. The technique of immunogold labeling exploits the ability of the gold particles to adsorb protein molecules onto their surfaces. Colloidal gold particles coated with specific antibodies can be used as probes for the presence and position of antigens on the surfaces of cells.[188] In ultrathin sections of tissues viewed by electron microscopy, the immunogold labels appear as extremely dense round spots at the position of the antigen.[189]
Gold, or alloys of gold and palladium, are applied as conductive coating to biological specimens and other non-conducting materials such as plastics and glass to be viewed in a scanning electron microscope. The coating, which is usually applied by sputtering with an argon plasma, has a triple role in this application. Gold’s very high electrical conductivity drains electrical charge to earth, and its very high density provides stopping power for electrons in the electron beam, helping to limit the depth to which the electron beam penetrates the specimen. This improves definition of the position and topography of the specimen surface and increases the spatial resolution of the image. Gold also produces a high output of secondary electrons when irradiated by an electron beam, and these low-energy electrons are the most commonly used signal source used in the scanning electron microscope.[190]
The isotope gold-198 (half-life 2.7 days) is used in nuclear medicine, in some cancer treatments and for treating other diseases.[191][192]
Cuisine
- Gold can be used in food and has the E number 175.[193] In 2016, the European Food Safety Authority published an opinion on the re-evaluation of gold as a food additive. Concerns included the possible presence of minute amounts of gold nanoparticles in the food additive, and that gold nanoparticles have been shown to be genotoxic in mammalian cells in vitro.[194]
- Gold leaf, flake or dust is used on and in some gourmet foods, notably sweets and drinks as decorative ingredient.[195] Gold flake was used by the nobility in medieval Europe as a decoration in food and drinks,[196] in the form of leaf, flakes or dust, either to demonstrate the host’s wealth or in the belief that something that valuable and rare must be beneficial for one’s health.[citation needed]
- Danziger Goldwasser (German: Gold water of Danzig) or Goldwasser (English: Goldwater) is a traditional German herbal liqueur[197] produced in what is today Gdańsk, Poland, and Schwabach, Germany, and contains flakes of gold leaf. There are also some expensive (c. $1000) cocktails which contain flakes of gold leaf. However, since metallic gold is inert to all body chemistry, it has no taste, it provides no nutrition, and it leaves the body unaltered.[198]
- Vark is a foil composed of a pure metal that is sometimes gold,[199] and is used for garnishing sweets in South Asian cuisine.
Miscellanea
- Gold produces a deep, intense red color when used as a coloring agent in cranberry glass.
- In photography, gold toners are used to shift the color of silver bromide black-and-white prints towards brown or blue tones, or to increase their stability. Used on sepia-toned prints, gold toners produce red tones. Kodak published formulas for several types of gold toners, which use gold as the chloride.[200]
- Gold is a good reflector of electromagnetic radiation such as infrared and visible light, as well as radio waves. It is used for the protective coatings on many artificial satellites, in infrared protective faceplates in thermal-protection suits and astronauts’ helmets, and in electronic warfare planes such as the EA-6B Prowler.
- Gold is used as the reflective layer on some high-end CDs.
- Automobiles may use gold for heat shielding. McLaren uses gold foil in the engine compartment of its F1 model.[201]
- Gold can be manufactured so thin that it appears semi-transparent. It is used in some aircraft cockpit windows for de-icing or anti-icing by passing electricity through it. The heat produced by the resistance of the gold is enough to prevent ice from forming.[202]
- Gold is attacked by and dissolves in alkaline solutions of potassium or sodium cyanide, to form the salt gold cyanide—a technique that has been used in extracting metallic gold from ores in the cyanide process. Gold cyanide is the electrolyte used in commercial electroplating of gold onto base metals and electroforming.
- Gold chloride (chloroauric acid) solutions are used to make colloidal gold by reduction with citrate or ascorbate ions. Gold chloride and gold oxide are used to make cranberry or red-colored glass, which, like colloidal gold suspensions, contains evenly sized spherical gold nanoparticles.[203]
- Gold, when dispersed in nanoparticles, can act as a heterogeneous catalyst of chemical reactions.
Toxicity
Pure metallic (elemental) gold is non-toxic and non-irritating when ingested[204] and is sometimes used as a food decoration in the form of gold leaf.[205] Metallic gold is also a component of the alcoholic drinks Goldschläger, Gold Strike, and Goldwasser. Metallic gold is approved as a food additive in the EU (E175 in the Codex Alimentarius). Although the gold ion is toxic, the acceptance of metallic gold as a food additive is due to its relative chemical inertness, and resistance to being corroded or transformed into soluble salts (gold compounds) by any known chemical process which would be encountered in the human body.
Soluble compounds (gold salts) such as gold chloride are toxic to the liver and kidneys. Common cyanide salts of gold such as potassium gold cyanide, used in gold electroplating, are toxic by virtue of both their cyanide and gold content. There are rare cases of lethal gold poisoning from potassium gold cyanide.[206][207] Gold toxicity can be ameliorated with chelation therapy with an agent such as dimercaprol.
Gold metal was voted Allergen of the Year in 2001 by the American Contact Dermatitis Society; gold contact allergies affect mostly women.[208] Despite this, gold is a relatively non-potent contact allergen, in comparison with metals like nickel.[209]
A sample of the fungus Aspergillus niger was found growing from gold mining solution; and was found to contain cyano metal complexes, such as gold, silver, copper, iron and zinc. The fungus also plays a role in the solubilization of heavy metal sulfides.[210]
See also
Iron pyrite or «fool’s gold»
- Bulk leach extractable gold, for sampling ores
- Chrysiasis (dermatological condition)
- Digital gold currency, form of electronic currency
- GFMS business consultancy
- Gold fingerprinting, use impurities to identify an alloy
- Gold standard in banking
- List of countries by gold production
- Tumbaga, alloy of gold and copper
- Iron pyrite, fool’s gold
- Nordic gold, non-gold copper alloy
References
- ^ «Standard Atomic Weights: Gold». CIAAW. 2017.
- ^ Mézaille, Nicolas; Avarvari, Narcis; Maigrot, Nicole; Ricard, Louis; Mathey, François; Le Floch, Pascal; Cataldo, Laurent; Berclaz, Théo; Geoffroy, Michel (1999). «Gold(I) and Gold(0) Complexes of Phosphinine‐Based Macrocycles». Angewandte Chemie International Edition. 38 (21): 3194–3197. doi:10.1002/(SICI)1521-3773(19991102)38:21<3194::AID-ANIE3194>3.0.CO;2-O. PMID 10556900.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Kelly, P. F. (2015). Properties of Materials. CRC Press. p. 355. ISBN 978-1-4822-0624-1.
- ^ Duckenfield, Mark (2016). The Monetary History of Gold: A Documentary History, 1660–1999. Routledge. p. 4. ISBN 9781315476124.
Its scarcity makes it a useful store of value; however, its relative rarity reduced its utility as a currency, especially for transactions in small denominations.
- ^ Pearce, Susan M. (1993). Museums, Objects, and Collections: A Cultural Study. Smithsonian Books. p. 53. ISBN 9781588345172.
Its scarcity makes it a useful store of value; however, its relative rarity reduced its utility as a currency, especially for transactions in small denominations. … Rarity is, nevertheless, in itself a source of value, and so is the degree of difficulty which surrounds the winning of the raw material, especially if it is exotic and has to be brought some distance. Gold is, geologically, a relatively rare material on earth and occurs only in specific places which are remote from most other places.
- ^ a b «Gold Production & Mining Data by Country».
- ^ «Above-ground stocks». gold.org. Retrieved 18 October 2021.
- ^ a b c Soos, Andy (6 January 2011). «Gold Mining Boom Increasing Mercury Pollution Risk». Advanced Media Solutions, Inc. Oilprice.com. Retrieved 26 March 2011.
- ^ a b Kizuka, Tokushi (1 April 2008). «Atomic configuration and mechanical and electrical properties of stable gold wires of single-atom width» (PDF). Physical Review B. 77 (15): 155401. Bibcode:2008PhRvB..77o5401K. doi:10.1103/PhysRevB.77.155401. hdl:2241/99261. ISSN 1098-0121. Archived (PDF) from the original on 16 July 2021.
- ^ Che Lah, Nurul Akmal; Trigueros, Sonia (2019). «Synthesis and modelling of the mechanical properties of Ag, Au and Cu nanowires». Science and Technology of Advanced Materials. 20 (1): 225–261. Bibcode:2019STAdM..20..225L. doi:10.1080/14686996.2019.1585145. PMC 6442207. PMID 30956731.
- ^ «Gold: causes of color». Retrieved 6 June 2009.
- ^ Mallan, Lloyd (1971). Suiting up for space: the evolution of the space suit. John Day Co. p. 216. ISBN 978-0-381-98150-1.
- ^ Gray, Theo (14 March 2008). «How to Make Convincing Fake-Gold Bars». Popular Science. Retrieved 18 June 2008.
- ^ Willie, Jim (18 November 2009) «Zinc Dimes, Tungsten Gold & Lost Respect Archived 8 October 2011 at the Wayback Machine». Kitco
- ^ «Largest Private Refinery Discovers Gold-Plated Tungsten Bar | Coin Update». news.coinupdate.com.
- ^ Reuters (22 December 1983). «Austrians Seize False Gold Tied to London Bullion Theft». The New York Times. Retrieved 25 March 2012.
- ^ Tungsten filled Gold bars Archived 26 March 2012 at the Wayback Machine, ABC Bullion, Thursday, 22 March 2012
- ^ Arblaster, J. W. (1995). «Osmium, the Densest Metal Known» (PDF). Platinum Metals Review. 39 (4): 164. Archived from the original (PDF) on 18 October 2016. Retrieved 14 October 2016.
- ^ Encyclopædia of Chemistry, Theoretical, Practical, and Analytical, as Applied to the Arts and Manufacturers: Glass-zinc. J.B. Lippincott & Company. 1880. pp. 70–.
- ^ «Relativity in Chemistry». Math.ucr.edu. Retrieved 5 April 2009.
- ^ Schmidbaur, Hubert; Cronje, Stephanie; Djordjevic, Bratislav; Schuster, Oliver (2005). «Understanding gold chemistry through relativity». Chemical Physics. 311 (1–2): 151–161. Bibcode:2005CP….311..151S. doi:10.1016/j.chemphys.2004.09.023.
- ^ a b c d Jewellery Alloys. World Gold Council
- ^ Electron Microscopy in Microbiology. Academic Press. 1988. ISBN 978-0-08-086049-7.
- ^ «Nudat 2». National Nuclear Data Center. Retrieved 12 April 2012.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Miethe, A. (1924). «Der Zerfall des Quecksilberatoms». Die Naturwissenschaften. 12 (29): 597–598. Bibcode:1924NW…..12..597M. doi:10.1007/BF01505547. S2CID 35613814.
- ^ Sherr, R.; Bainbridge, K. T. & Anderson, H. H. (1941). «Transmutation of Mercury by Fast Neutrons». Physical Review. 60 (7): 473–479. Bibcode:1941PhRv…60..473S. doi:10.1103/PhysRev.60.473.
- ^
Aleklett, K.; Morrissey, D.; Loveland, W.; McGaughey, P.; Seaborg, G. (1981). «Energy dependence of 209Bi fragmentation in relativistic nuclear collisions». Physical Review C. 23 (3): 1044. Bibcode:1981PhRvC..23.1044A. doi:10.1103/PhysRevC.23.1044. - ^ Matthews, Robert (2 December 2001). «The Philosopher’s Stone». The Daily Telegraph. Retrieved 22 September 2020.
- ^ Shipman, James; Wilson, Jerry D.; Higgins, Charles A. (2012). An Introduction to Physical Science (13th ed.). Cengage Learning. p. 273. ISBN 9781133709497.
- ^ Hammer, B.; Norskov, J. K. (1995). «Why gold is the noblest of all the metals». Nature. 376 (6537): 238–240. Bibcode:1995Natur.376..238H. doi:10.1038/376238a0. S2CID 4334587.
- ^ Johnson, P. B.; Christy, R. W. (1972). «Optical Constants of the Noble Metals». Physical Review B. 6 (12): 4370–4379. Bibcode:1972PhRvB…6.4370J. doi:10.1103/PhysRevB.6.4370.
- ^ Shaw III, C. F. (1999). «Gold-Based Medicinal Agents». Chemical Reviews. 99 (9): 2589–2600. doi:10.1021/cr980431o. PMID 11749494.
- ^ «Chemistry of Oxygen». Chemwiki UC Davis. 2 October 2013. Retrieved 1 May 2016.
- ^ Craig, B. D.; Anderson, D. B., eds. (1995). Handbook of Corrosion Data. Materials Park, Ohio: ASM International. p. 587. ISBN 978-0-87170-518-1.
- ^ Wiberg, Egon; Wiberg, Nils & Holleman, Arnold Frederick (2001). Inorganic Chemistry (101st ed.). Academic Press. p. 1286. ISBN 978-0-12-352651-9.
- ^ Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry. Academic Press. p. 404. ISBN 978-0-12-352651-9.
- ^ Wiberg, Wiberg & Holleman 2001, pp. 1286–1287
- ^ a b Emery, J. F.; Ledditcotte, G. W. (May 1961). «Nuclear Science Series (NAS-NS 3036) The Radio Chemistry of Gold» (PDF). Oak Ridge, TN: National Academy of Sciences — National Research Council — Subcommittee on Radio Chemistry. US Atomic Energy Commission. Archived (PDF) from the original on 10 November 2004. Retrieved 24 February 2021.
- ^ Jansen, Martin (2005). «Effects of relativistic motion of electrons on the chemistry of gold and platinum». Solid State Sciences. 7 (12): 1464–1474. Bibcode:2005SSSci…7.1464J. doi:10.1016/j.solidstatesciences.2005.06.015.
- ^ a b Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ a b Jansen, Martin (2008). «The chemistry of gold as an anion». Chemical Society Reviews. 37 (9): 1826–1835. doi:10.1039/b708844m. PMID 18762832.
- ^ Jung, Jaehoon; Kim, Hyemi; Kim, Jong Chan; Park, Min Hee; Han, Young-Kyu (2011). «Gold Behaves as Hydrogen in the Intermolecular Self-Interaction of Metal Aurides MAu4 (M=Ti, Zr, and Hf)». Chemistry: An Asian Journal. 6 (3): 868–872. doi:10.1002/asia.201000742. PMID 21225974.
- ^ Wickleder, Mathias S. (2001). «AuSO4: A True Gold(II) Sulfate with an Au24+ Ion». Journal of Inorganic and General Chemistry. 627 (9): 2112–2114. doi:10.1002/1521-3749(200109)627:9<2112::AID-ZAAC2112>3.0.CO;2-2.
- ^ Wickleder, Mathias S. (2007). Devillanova, Francesco A. (ed.). Handbook of chalcogen chemistry: new perspectives in sulfur, selenium and tellurium. Royal Society of Chemistry. pp. 359–361. ISBN 978-0-85404-366-8.
- ^ Seidel, S.; Seppelt, K. (2000). «Xenon as a Complex Ligand: The Tetra Xenono Gold(II) Cation in AuXe42+(Sb2F11−)2«. Science. 290 (5489): 117–118. Bibcode:2000Sci…290..117S. doi:10.1126/science.290.5489.117. PMID 11021792.
- ^ Riedel, S.; Kaupp, M. (2006). «Revising the Highest Oxidation States of the 5d Elements: The Case of Iridium(+VII)». Angewandte Chemie International Edition. 45 (22): 3708–3711. doi:10.1002/anie.200600274. PMID 16639770.
- ^ «Earth’s Gold Came from Colliding Dead Stars». David A. Aguilar & Christine Pulliam. cfa.harvard.edu. 17 July 2013. Retrieved 18 February 2018.
- ^ Seeger, Philip A.; Fowler, William A.; Clayton, Donald D. (1965). «Nucleosynthesis of Heavy Elements by Neutron Capture». The Astrophysical Journal Supplement Series. 11: 121. Bibcode:1965ApJS…11..121S. doi:10.1086/190111.
- ^ «Supernovas & Supernova Remnants». Chandra X-ray Observatory. Retrieved 28 February 2014.
- ^ Berger, E.; Fong, W.; Chornock, R. (2013). «An r-process Kilonova Associated with the Short-hard GRB 130603B». The Astrophysical Journal Letters. 774 (2): 4. arXiv:1306.3960. Bibcode:2013ApJ…774L..23B. doi:10.1088/2041-8205/774/2/L23. S2CID 669927.
- ^ «we have no spectroscopic evidence that [such] elements have truly been produced,» wrote author Stephan Rosswog.Rosswog, Stephan (29 August 2013). «Astrophysics: Radioactive glow as a smoking gun». Nature. 500 (7464): 535–536. Bibcode:2013Natur.500..535R. doi:10.1038/500535a. PMID 23985867. S2CID 4401544.
- ^ «LIGO and Virgo make first detection of gravitational waves produced by colliding neutron stars» (PDF). LIGO & Virgo collaborations. 16 October 2017. Archived (PDF) from the original on 31 October 2017. Retrieved 15 February 2018.
- ^ «Neutron star mergers may create much of the universe’s gold». Sid Perkins. Science AAAS. 20 March 2018. Retrieved 24 March 2018.
- ^ Willbold, Matthias; Elliott, Tim; Moorbath, Stephen (2011). «The tungsten isotopic composition of the Earth’s mantle before the terminal bombardment». Nature. 477 (7363): 195–8. Bibcode:2011Natur.477..195W. doi:10.1038/nature10399. PMID 21901010. S2CID 4419046.
- ^ Battison, Leila (8 September 2011). «Meteorites delivered gold to Earth». BBC.
- ^ «Mangalisa Project». Superior Mining International Corporation. Retrieved 29 December 2014.
- ^ Therriault, A. M.; Grieve, R. A. F. & Reimold, W. U. (1997). «Original size of the Vredefort Structure: Implications for the geological evolution of the Witwatersrand Basin». Meteoritics. 32: 71–77. Bibcode:1997M&PS…32…71T. doi:10.1111/j.1945-5100.1997.tb01242.x.
- ^ Meteor craters may hold untapped wealth. Cosmos Magazine (28 July 2008). Retrieved on 12 September 2013.
- ^ Corner, B.; Durrheim, R. J.; Nicolaysen, L. O. (1990). «Relationships between the Vredefort structure and the Witwatersrand basin within the tectonic framework of the Kaapvaal craton as interpreted from regional gravity and aeromagnetic data». Tectonophysics. 171 (1): 49–61. Bibcode:1990Tectp.171…49C. doi:10.1016/0040-1951(90)90089-Q.
- ^ a b McCarthy, T., Rubridge, B. (2005). The Story of Earth and Life. Struik Publishers, Cape Town. pp. 89–90, 102–107, 134–136. ISBN 1 77007 148 2
- ^ a b Norman, N., Whitfield, G. (2006) Geological Journeys. Struik Publishers, Cape Town. pp. 38–49, 60–61. ISBN 9781770070622
- ^ University of Granada (21 November 2017). «Scientists reveals the mystery about the origin of gold». ScienceDaily. Retrieved 27 March 2018.
- ^ Tassara, Santiago; González-Jiménez, José M.; Reich, Martin; Schilling, Manuel E.; Morata, Diego; Begg, Graham; Saunders, Edward; Griffin, William L.; O’Reilly, Suzanne Y.; Grégoire, Michel; Barra, Fernando; Corgne, Alexandre (2017). «Plume-subduction interaction forms large auriferous provinces». Nature Communications. 8 (1): 843. Bibcode:2017NatCo…8..843T. doi:10.1038/s41467-017-00821-z. ISSN 2041-1723. PMC 5634996. PMID 29018198.
- ^ a b c La Niece, Susan (senior metallurgist in the British Museum Department of Conservation and Scientific Research) (15 December 2009). Gold. Harvard University Press. p. 10. ISBN 978-0-674-03590-4. Retrieved 10 April 2012.
- ^ Heike, Brian. «Formation of Lode Gold Deposits». Arizona Gold Prospectors. Archived from the original on 22 January 2013. Retrieved 24 February 2021.
- ^ «Environment & Nature News – Bugs grow gold that looks like coral». abc.net.au. 28 January 2004. Retrieved 22 July 2006. This is doctoral research undertaken by Frank Reith at the Australian National University, published 2004.
- ^ «Earthquakes Turn Water into Gold|18 March 2013». Retrieved 18 March 2013.
- ^ Kenison Falkner, K.; Edmond, J. (1990). «Gold in seawater». Earth and Planetary Science Letters. 98 (2): 208–221. Bibcode:1990E&PSL..98..208K. doi:10.1016/0012-821X(90)90060-B.
- ^ Plazak, Dan A Hole in the Ground with a Liar at the Top (Salt Lake: Univ. of Utah Press, 2006) ISBN 0-87480-840-5 (contains a chapter on gold-from seawater swindles)
- ^ Haber, F. (1927). «Das Gold im Meerwasser». Zeitschrift für Angewandte Chemie. 40 (11): 303–314. Bibcode:1927AngCh..40..303H. doi:10.1002/ange.19270401103.
- ^ McHugh, J. B. (1988). «Concentration of gold in natural waters». Journal of Geochemical Exploration. 30 (1–3): 85–94. doi:10.1016/0375-6742(88)90051-9. Archived from the original on 7 March 2020.
- ^ «Furthermore the second member of Delegation XVIII is carrying four small but evidently heavy jars on a yoke, probably containing the gold dust which was the tribute paid by the Indians.» in Iran, Délégation archéologique française en (1972). Cahiers de la Délégation archéologique française en Iran. Institut français de recherches en Iran (section archéologique). p. 146.
- ^ «History of Gold». Gold Digest. Retrieved 4 February 2007.
- ^ «Mystery of the Varna Gold: What Caused These Ancient Societies to Disappear?».
- ^ [1] Archived 1 November 2022 at the Wayback Machine Gems and Gemstones: Timeless Natural Beauty of the Mineral World, By Lance Grande
- ^ «World’s Oldest Gold Object May Have Just Been Unearthed in Bulgaria».
- ^ «Archaeologists have discovered the oldest treasure in the world — Afrinik».
- ^ Sutherland, C.H.V, Gold (London, Thames & Hudson, 1959) p 27 ff.
- ^ Gopher, A.; Tsuk, T.; Shalev, S. & Gophna, R. (August–October 1990). «Earliest Gold Artifacts in the Levant». Current Anthropology. 31 (4): 436–443. doi:10.1086/203868. JSTOR 2743275. S2CID 143173212.
- ^ Pohl, Walter L. (2011) Economic Geology Principles and Practice. Wiley. p. 208. doi:10.1002/9781444394870.ch2. ISBN 9781444394870
- ^ Montserrat, Dominic (21 February 2003). Akhenaten: History, Fantasy and Ancient Egypt. ISBN 978-0-415-30186-2.
- ^ Moran, William L., 1987, 1992. The Amarna Letters, pp. 43–46.
- ^ Moran, William L. 1987, 1992. The Amarna Letters. EA 245, «To the Queen Mother: Some Missing Gold Statues», pp. 84–86.
- ^ «Akhenaten» Archived 11 June 2008 at the Wayback Machine. Encyclopaedia Britannica
- ^ Dodson, Aidan and Hilton, Dyan (2004). The Complete Royal Families of Ancient Egypt. Thames & Hudson. ISBN 0-500-05128-3
- ^ a b «A Case for the World’s Oldest Coin: Lydian Lion». Rg.ancients.info. 2 October 2003. Retrieved 27 October 2013.
- ^ Mansa Musa. Black History Pages
- ^ «Kingdom of Mali – Primary Source Documents». African studies Center. Boston University. Retrieved 30 January 2012.
- ^ Monnaie, Eucratide I. (roi de Bactriane) Autorité émettrice de. [Monnaie : 20 Statères, Or, Incertain, Bactriane, Eucratide I].
- ^ Berdan, Frances; Anawalt, Patricia Rieff (1992). The Codex Mendoza. Vol. 2. University of California Press. p. 151. ISBN 978-0-520-06234-4.
- ^ Sierra Nevada Virtual Museum. Sierra Nevada Virtual Museum. Retrieved on 4 May 2012.
- ^ Anderson, James Maxwell (2000). The History of Portugal. Greenwood Publishing Group. ISBN 0-313-31106-4.
- ^ Newitt, Malyn (28 June 2010). The Portuguese in West Africa, 1415–1670: A Documentary History. Cambridge University Press. ISBN 978-1-139-49129-7.
- ^ Green, Toby (31 January 2019). A fistful of shells : West Africa from the rise of the slave trade to the age of revolution (Penguin Books Ltd. Kindle-Version ed.). London. pp. 108, 247. ISBN 978-0-241-00328-2.
- ^ Edgerton, Robert B. (2010). The Fall of the Asante Empire: The Hundred-Year War For Africa’s Gold Coast. ISBN 9781451603736.
- ^ Matson, John (31 January 2014). «Fact or Fiction?: Lead Can Be Turned into Gold». scientificamerican.com. Retrieved 21 November 2021.
- ^ Harper, Douglas. «gold». Online Etymology Dictionary.
- ^ Hesse, R W. (2007) Jewelrymaking Through History: An Encyclopedia Archived 1 November 2022 at the Wayback Machine, Greenwood Publishing Group. ISBN 0313335079
- ^ Notre Dame University Latin Dictionary Archived 5 February 2016 at the Wayback Machine Retrieved 7 June 2012
- ^ de Vaan, Michel (2008). Etymological Dictionary of Latin and the other Italic languages. Leiden: Boston: Brill. p. 63. ISBN 978-90-04-16797-1.
- ^ Christie, A and Brathwaite, R. (Last updated 2 November 2011) Mineral Commodity Report 14 — Gold, Institute of geological and Nuclear sciences Ltd – Retrieved 7 June 2012
- ^ H. G. Bachmann, The lure of gold : an artistic and cultural history (2006).
- ^ Lubna Umar and Sarwet Rasul, «Critical Metaphor Analysis: Nawaz Sharif and the Myth of a Golden Time» NUML Journal of Critical Inquiry 15#2, (Dec 2017): 78-102.
- ^ Alborn, Timothy (2017). «The Greatest Metaphor Ever Mixed: Gold in the British Bible, 1750–1850». Journal of the History of Ideas. 78 (3): 427–447. doi:10.1353/jhi.2017.0024. PMID 28757488. S2CID 27312741.
- ^ Moors, Annelies (2013). «Wearing gold, owning gold: the multiple meanings of gold jewelry». Etnofoor. 25 (1): 78–89. ISSN 0921-5158. OCLC 858949147.
- ^ Boulanouar, Aisha Wood (2011). Myths and Reality: Meaning in Moroccan Muslim Women’s Dress (Thesis, Doctor of Philosophy). University of Otago. CiteSeerX 10.1.1.832.2031. hdl:10523/1748.
- ^ Poonai, Anand (2015). «Islamic Male Clothing». Who We Are & What We Wear. Retrieved 17 June 2020.
- ^ Aziz, Rookhsana (November 2010). «Hijab – The Islamic Dress Code: Its historical development, evidence from sacred sources and views of selected Muslim scholars». UNISA EDT (Electronic Theses and Dissertations) (Thesis, Master of Arts). University of South Africa. CiteSeerX 10.1.1.873.8651. hdl:10500/4888.
- ^ Toronto, James A. (1 October 2001). «Many Voices, One Umma: Sociopolitical Debate in the Muslim Community». BYU Studies Quarterly. 40 (4): 29–50.
- ^ Jirousek, Charlotte (2004). «Islamic Clothing». Encyclopedia of Islam. Retrieved 17 June 2020.
- ^ Omar, Sara (28 March 2014). «Dress». The Encyclopedia of Islam and Law, Oxford Islamic Studies Online.[permanent dead link]
- ^ Daly, Kathleen N.; Rengel, Marian (1992). Greek and Roman Mythology, A to Z. Chelsea House Publishers. p. 153. ISBN 978-1-60413-412-4.
- ^ Bernstein, Peter L. (2004). The Power of Gold: The History of an Obsession. John Wiley & Sons. p. 1. ISBN 978-0-471-43659-1.
- ^ «Israeli dig unearths large trove of early Islamic gold coins». Associated Press. Retrieved 24 August 2020.
- ^ Munteen, John L.; Davis, David A.; Ayling, Bridget (2017). The Nevada Mineral Industry 2016 (PDF) (Report). University of Nevada, Reno. OCLC 1061602920. Archived from the original (PDF) on 9 February 2019. Retrieved 9 February 2019.
- ^ Mandaro, Laura (17 January 2008). «China now world’s largest gold producer; foreign miners at door». MarketWatch. Retrieved 5 April 2009.
- ^ Fritz, Morgane; McQuilken, James; Collins, Nina; Weldegiorgis, Fitsum (January 2018). «Global Trends in Artisanal and Small-Scale Mining (ASM): A review of key numbers and issues» (PDF) (Report). Winnipeg Canada: International Institute for Sustainable Development. Retrieved 24 February 2021 – via Intergovernmental Forum on Mining, Minerals, Metals and Sustainable Development.
- ^ Reuters Staff (15 January 2020). «What is artisanal gold and why is it booming?». reuters.com. Rueters. Retrieved 24 February 2021.
- ^ Beinhoff, Christian. «Removal of Barriers to the Abatement of Global Mercury Pollution from Artisanal Gold Mining» (PDF) (Report). Archived from the original (PDF) on 26 January 2016. Retrieved 29 December 2014.
- ^ a b c Truswell, J.F. (1977). The Geological Evolution of South Africa. pp. 21–28. Purnell, Cape Town. ISBN 9780360002906
- ^ Moore, Mark A. (2006). «Reed Gold Mine State Historic Site». North Carolina Office of Archives and History. Archived from the original on 15 January 2012. Retrieved 13 December 2008.
- ^ Garvey, Jane A. (2006). «Road to adventure». Georgia Magazine. Archived from the original on 2 March 2007. Retrieved 23 January 2007.
- ^ «Grasberg Open Pit, Indonesia». Mining Technology. Retrieved 16 October 2017.
- ^ O’Connell, Rhona (13 April 2007). «Gold mine production costs up by 17% in 2006 while output fell». Archived from the original on 6 October 2014.
- ^ Noyes, Robert (1993). Pollution prevention technology handbook. William Andrew. p. 342. ISBN 978-0-8155-1311-7.
- ^ Pletcher, Derek & Walsh, Frank (1990). Industrial electrochemistry. Springer. p. 244. ISBN 978-0-412-30410-1.
- ^ Marczenko, Zygmunt & Balcerzak, María (2000). Separation, preconcentration, and spectrophotometry in inorganic analysis. Elsevier. p. 210. ISBN 978-0-444-50524-8.
- ^ Baraniuk, Chris (27 October 2020). «Why it’s getting harder to mine gold». BBC. Retrieved 29 October 2020.
- ^ Paton, Elizabeth (23 April 2021). «Does Recycled Gold Herald a Greener Future for Jewelry?». The New York Times. ISSN 0362-4331. Archived from the original on 28 December 2021. Retrieved 17 May 2021.
- ^ «Gold jewellery consumption by country». Reuters. 28 February 2011. Archived from the original on 12 January 2012.
- ^ «Gold Demand Trends | Investment | World Gold Council». Gold.org. Retrieved 12 September 2013.
- ^ «Gold Demand Trends». 12 November 2015.
- ^ «Country wise gold demand». Retrieved 2 October 2015.
- ^ Harjani, Ansuya (18 February 2014). «It’s official: China overtakes India as top consumer of gold». CNBC. Retrieved 2 July 2014.
- ^ Abdul-Wahab, Sabah Ahmed; Ameer, Marikar, Fouzul (24 October 2011). «The environmental impact of gold mines: pollution by heavy metals». Central European Journal of Engineering. 2 (2): 304–313. Bibcode:2012CEJE….2..304A. doi:10.2478/s13531-011-0052-3. S2CID 3916088.
- ^ Summit declaration, Peoples’ Gold summit, San Juan Ridge, California in June 1999 Archived 25 March 2020 at the Wayback Machine. Scribd.com (22 February 2012). Retrieved on 4 May 2012.
- ^ Cyanide spills from gold mine compared to Chernobyls nuclear disaster Archived 14 July 2018 at the Wayback Machine. Deseretnews.com (14 February 2000). Retrieved on 4 May 2012.
- ^ Death of a river Archived 9 January 2009 at the Wayback Machine. BBC News (15 February 2000). Retrieved on 4 May 2012.
- ^ Cyanide spill second only to Chernobyl Archived 25 May 2017 at the Wayback Machine. Abc.net.au. 11 February 2000. Retrieved on 4 May 2012.
- ^ a b Behind gold’s glitter, torn lands and pointed questions Archived 8 April 2015 at the Wayback Machine, The New York Times, 24 October 2005
- ^ «Pollution from Artisanal Gold Mining, Blacksmith Institute Report 2012» (PDF). Archived (PDF) from the original on 2 April 2015. Retrieved 22 September 2015.
- ^ Wroblewski, William (12 January 2022). «‘Babies here are born sick’: are Bolivia’s gold mines poisoning its indigenous people?». The Guardian. Retrieved 12 January 2022.
- ^ Norgate, Terry; Haque, Nawshad (2012). «Using life cycle assessment to evaluate some environmental impacts of gold». Journal of Cleaner Production. 29–30: 53–63. doi:10.1016/j.jclepro.2012.01.042.
- ^ Rothbard, Murray N. (2009). Man, Economy, and State, Scholar’s Edition. Ludwig von Mises Institute. ISBN 978-1-933550-99-2.
- ^ Seltman, C. T. (1924). Athens, Its History and Coinage Before the Persian Invasion. ISBN 978-0-87184-308-1. Retrieved 4 June 2012.
- ^ Postan, M. M.; Miller, E. (1967). The Cambridge Economic History of Europe: Trade and industry in the Middle Ages. Cambridge University Press, 28 August 1987. ISBN 978-0-521-08709-4.
- ^ «Swiss Narrowly Vote to Drop Gold Standard». The New York Times. 19 April 1999. Retrieved 1 July 2022.
- ^ King, Byron (20 July 2009). «Gold mining decline». BullionVault.com. Archived from the original on 15 May 2016. Retrieved 23 November 2009.
- ^ Lawrence, Thomas Edward (1948). The Mint: A Day-book of the R.A.F. Depot Between August and December 1922, with Later Notes. p. 103.
- ^ Tucker, George (1839). The theory of money and banks investigated. C. C. Little and J. Brown.
- ^ «Currency codes – ISO 4217». International Organization for Standardization. Retrieved 25 December 2014.
- ^ Valenta, Philip (22 June 2018). «On hedging inflation with gold». Medium. Retrieved 30 November 2018.
- ^ «The Ever Popular Krugerrand». americansilvereagletoday.com. 2010. Archived from the original on 3 February 2011. Retrieved 30 August 2011.
- ^ «What Are the Different Purities of Sovereign Gold Coins?». goldsilver.com. Retrieved 29 March 2021.
- ^ Warwick-Ching, Tony (28 February 1993). The International Gold Trade. p. 26. ISBN 978-1-85573-072-4.
- ^ Elwell, Craig K. (2011). Brief History of the Gold Standard (GS) in the United States. pp. 11–13. ISBN 978-1-4379-8889-5.
- ^ Hitzer, Eckhard; Perwass, Christian (22 November 2006). «The hidden beauty of gold» (PDF). Proceedings of the International Symposium on Advanced Mechanical and Power Engineering 2007 (ISAMPE 2007) between Pukyong National University (Korea), University of Fukui (Japan) and University of Shanghai for Science and Technology (China), 22–25 November 2006, hosted by the University of Fukui (Japan), pp. 157–167. (Figs 15,16,17,23 revised.). Archived from the original (PDF) on 27 January 2012. Retrieved 10 May 2011.
- ^ «World Gold Council > value > research & statistics > statistics > supply and demand statistics». Archived from the original on 19 July 2006. Retrieved 22 July 2006.
- ^ «historical charts:gold – 1833–1999 yearly averages». kitco. Retrieved 30 June 2012.
- ^ Kitco.com Archived 14 July 2018 at the Wayback Machine, Gold – London PM Fix 1975 – present (GIF), Retrieved 22 July 2006.
- ^ a b «LBMA statistics». Lbma.org.uk. 31 December 2008. Archived from the original on 10 February 2009. Retrieved 5 April 2009.
- ^ «Gold hits yet another record high». BBC News. 2 December 2009. Retrieved 6 December 2009.
- ^ «PRECIOUS METALS: Comex Gold Hits All-Time High». The Wall Street Journal. 11 May 2012. Retrieved 4 August 2010.[dead link]
- ^ Gibson, Kate; Chang, Sue (11 May 2010). «Gold futures hit closing record as investors fret rescue deal». MarketWatch. Retrieved 4 August 2010.
- ^ Valetkevitch, Caroline (1 March 2011). «Gold hits record, oil jumps with Libya unrest». Reuters. Archived from the original on 15 October 2015. Retrieved 1 March 2011.
- ^ Sim, Glenys (23 August 2011). «Gold Extends Biggest Decline in 18 Months After CME Raises Futures Margins». www.bloomberg.com. Archived from the original on 10 January 2014. Retrieved 24 February 2021.
- ^ «Financial Planning|Gold starts 2006 well, but this is not a 25-year high!». Ameinfo.com. Archived from the original on 21 April 2009. Retrieved 5 April 2009.
- ^ Mandruzzato, GianLuigi (14 October 2020). «Gold, monetary policy and the US dollar».
- ^ a b «Historical Gold Intraday Futures Data (GCA)». PortaraCQG. Retrieved 28 April 2022.
- ^ «Troy Ounce». Investopedia. Retrieved 28 April 2022.
- ^ Berners-Price, Susan J. (2011) [2011]. «Gold-Based Therapeutic Agents: A New Perspective». In Alessio, E. (ed.). Bioinorganic Medicinal Chemistry. Weinheim: Wiley-VCH Verlag GmbH. pp. 197–221. doi:10.1002/9783527633104.ch7. ISBN 9783527633104.
- ^ Casini, Angela; Wai-Yin-Sun, Raymond; Ott, Ingo (2018). «Chapter 7. Medicinal Chemistry of Gold Anticancer Metallodrugs». In Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland K. O. (eds.). Metallo-Drugs:Development and Action of Anticancer Agents. Metal Ions in Life Sciences. Vol. 18. pp. 199–217. doi:10.1515/9783110470734-013. ISBN 9783110470734. PMID 29394026.
- ^ Revere, Alan (1 May 1991). Professional goldsmithing: a contemporary guide to traditional jewelry techniques. Van Nostrand Reinhold. ISBN 978-0-442-23898-8.
- ^ Uses of gold Archived 4 November 2014 at archive.today Accessed 4 November 2014
- ^ Krech III, Shepard; Merchant, Carolyn; McNeill, John Robert, eds. (2004). Encyclopedia of World Environmental History. Vol. 2: F–N. Routledge. pp. 597–. ISBN 978-0-415-93734-4.
- ^ «General Electric Contact Materials». Electrical Contact Catalog (Material Catalog). Tanaka Precious Metals. 2005. Archived from the original on 3 March 2001. Retrieved 21 February 2007.
- ^ Fulay, Pradeep; Lee, Jung-Kun (2016). Electronic, Magnetic, and Optical Materials, Second Edition. CRC Press. ISBN 978-1-4987-0173-0.
- ^ Peckham, James (23 August 2016). «Japan wants citizens to donate their old phone to make 2020 Olympics medals». TechRadar.
- ^ Kean, W. F.; Kean, I. R. L. (2008). «Clinical pharmacology of gold». Inflammopharmacology. 16 (3): 112–25. doi:10.1007/s10787-007-0021-x. PMID 18523733. S2CID 808858.
- ^ Moir, David Macbeth (1831). Outlines of the ancient history of medicine. William Blackwood. p. 225.
- ^ Mortier, Tom. An experimental study on the preparation of gold nanoparticles and their properties Archived 5 October 2013 at the Wayback Machine, PhD thesis, University of Leuven (May 2006)
- ^ Richards, Douglas G.; McMillin, David L.; Mein, Eric A. & Nelson, Carl D. (January 2002). «Gold and its relationship to neurological/glandular conditions». The International Journal of Neuroscience. 112 (1): 31–53. doi:10.1080/00207450212018. PMID 12152404. S2CID 41188687.
- ^ Merchant, B. (1998). «Gold, the Noble Metal and the Paradoxes of its Toxicology». Biologicals. 26 (1): 49–59. doi:10.1006/biol.1997.0123. PMID 9637749.
- ^ Messori, L.; Marcon, G. (2004). «Gold Complexes in the treatment of Rheumatoid Arthritis». In Sigel, Astrid (ed.). Metal ions and their complexes in medication. CRC Press. pp. 280–301. ISBN 978-0-8247-5351-1.
- ^ Faulk, W. P.; Taylor, G. M. (1971). «An immunocolloid method for the electron microscope». Immunochemistry. 8 (11): 1081–3. doi:10.1016/0019-2791(71)90496-4. PMID 4110101.
- ^ Roth, J.; Bendayan, M.; Orci, L. (1980). «FITC-protein A-gold complex for light and electron microscopic immunocytochemistry». Journal of Histochemistry and Cytochemistry. 28 (1): 55–7. doi:10.1177/28.1.6153194. PMID 6153194.
- ^ Bozzola, John J. & Russell, Lonnie Dee (1999). Electron microscopy: principles and techniques for biologists. Jones & Bartlett Learning. p. 65. ISBN 978-0-7637-0192-5.
- ^ «Nanoscience and Nanotechnology in Nanomedicine: Hybrid Nanoparticles In Imaging and Therapy of Prostate Cancer». Radiopharmaceutical Sciences Institute, University of Missouri-Columbia. Archived from the original on 14 March 2009.
- ^ Hainfeld, James F.; Dilmanian, F. Avraham; Slatkin, Daniel N.; Smilowitz, Henry M. (2008). «Radiotherapy enhancement with gold nanoparticles». Journal of Pharmacy and Pharmacology. 60 (8): 977–85. doi:10.1211/jpp.60.8.0005. PMID 18644191. S2CID 32861131.
- ^ «Current EU approved additives and their E Numbers». Food Standards Agency, UK. 27 July 2007.
- ^ «Scientific Opinion on the re-evaluation of gold (E 175) as a food additive». EFSA Journal. 14 (1): 4362. 2016. doi:10.2903/j.efsa.2016.4362. ISSN 1831-4732.
- ^ «The Food Dictionary: Varak». Barron’s Educational Services, Inc. 1995. Archived from the original on 23 May 2006. Retrieved 27 May 2007.
- ^ Kerner, Susanne; Chou, Cynthia; Warmind, Morten (2015). Commensality: From Everyday Food to Feast. Bloomsbury Publishing. p. 94. ISBN 978-0-85785-719-4.
- ^ Baedeker, Karl (1865). «Danzig». Deutschland nebst Theilen der angrenzenden Länder (in German). Karl Baedeker.
- ^ King, Hobart M. «The Many Uses of Gold». geology.com. Retrieved 6 June 2009.
- ^ Gold in Gastronomy Archived 4 March 2016 at the Wayback Machine. deLafee, Switzerland (2008)
- ^ Toning black-and-white materials. Kodak Technical Data/Reference sheet G-23, May 2006.
- ^ Martin, Keith. 1997 McLaren F1.
- ^ «The Demand for Gold by Industry» (PDF). Gold bulletin. Archived from the original (PDF) on 26 July 2011. Retrieved 6 June 2009.
- ^ «Colored glass chemistry». Retrieved 6 June 2009.
- ^ Dierks, S. (May 2005). «Gold MSDS». Electronic Space Products International. Archived from the original on 10 November 2006. Retrieved 21 December 2021.
- ^ Louis, Catherine; Pluchery, Olivier (2012). Gold Nanoparticles for Physics, Chemistry and Biology. World Scientific. ISBN 978-1-84816-807-7.
- ^ Wright, I. H.; Vesey, J. C. (1986). «Acute poisoning with gold cyanide». Anaesthesia. 41 (79): 936–939. doi:10.1111/j.1365-2044.1986.tb12920.x. PMID 3022615. S2CID 32434351.
- ^ Wu, Ming-Ling; Tsai, Wei-Jen; Ger, Jiin; Deng, Jou-Fang; Tsay, Shyh-Haw; et al. (2001). «Cholestatic Hepatitis Caused by Acute Gold Potassium Cyanide Poisoning». Clinical Toxicology. 39 (7): 739–743. doi:10.1081/CLT-100108516. PMID 11778673. S2CID 44722156.
- ^ Tsuruta, Kyoko; Matsunaga, Kayoko; Suzuki, Kayoko; Suzuki, Rie; Akita, Hirotaka; Washimi, Yasuko; Tomitaka, Akiko; Ueda, Hiroshi (2001). «Female predominance of gold allergy». Contact Dermatitis. 44 (1): 48–49. doi:10.1034/j.1600-0536.2001.440107-22.x. PMID 11156030. S2CID 42268840.
- ^ Brunk, Doug (15 February 2008). «Ubiquitous nickel wins skin contact allergy award for 2008». Archived from the original on 24 June 2011.
- ^ Singh, Harbhajan (2006). Mycoremediation: Fungal Bioremediation. p. 509. ISBN 978-0-470-05058-3.
Further reading
- Bachmann, H. G. The lure of gold : an artistic and cultural history (2006) online
- Bernstein, Peter L. The Power of Gold: The History of an Obsession (2000) online
- Brands, H.W. The Age of Gold: The California Gold Rush and the New American Dream (2003) excerpt
- Buranelli, Vincent. Gold : an illustrated history (1979) online’ wide-ranging popular history
- Cassel, Gustav. «The restoration of the gold standard.» Economica 9 (1923): 171–185. online
- Eichengreen, Barry. Golden Fetters: The Gold Standard and the Great Depression, 1919–1939 (Oxford UP, 1992).
- Ferguson, Niall. The Ascent of Money — Financial History of the World (2009) online
- Hart, Matthew, Gold: The Race for the World’s Most Seductive Metal Gold : the race for the world’s most seductive metal», New York: Simon & Schuster, 2013. ISBN 9781451650020
- Johnson, Harry G. «The gold rush of 1968 in retrospect and prospect». American Economic Review 59.2 (1969): 344–348. online
- Kwarteng, Kwasi. War and Gold: A Five-Hundred-Year History of Empires, Adventures, and Debt (2014) online
- Vilar, Pierre. A History of Gold and Money, 1450–1920 (1960). online
- Vilches, Elvira. New World Gold: Cultural Anxiety and Monetary Disorder in Early Modern Spain (2010).
External links
Wikiquote has quotations related to Gold.
Wikimedia Commons has media related to Gold.
Look up gold in Wiktionary, the free dictionary.
- «Gold» . Encyclopædia Britannica. Vol. 11 (11th ed.). 1911.
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry’s Chemistry World: Gold www.rsc.org
- Gold at The Periodic Table of Videos (University of Nottingham)
- Getting Gold 1898 book, www.lateralscience.co.uk
- Technical Document on Extraction and Mining of Gold at the Wayback Machine (archived 7 March 2008), www.epa.gov
- Gold element information — rsc.org
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gold | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | metallic yellow | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Au) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gold in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 79 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 4f14 5d10 6s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 18, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1337.33 K (1064.18 °C, 1947.52 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 3243 K (2970 °C, 5378 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 19.3 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 17.31 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 12.55 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 342 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 25.418 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −3, −2, −1, 0,[2] +1, +2, +3, +5 (an amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 144 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 136±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 166 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of gold |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 2030 m/s (at r.t.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 14.2 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 318 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 22.14 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −28.0×10−6 cm3/mol (at 296 K)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tensile strength | 120 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 79 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 27 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 180 GPa[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 2.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 188–216 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 188–245 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-57-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | from Latin aurum, meaning gold | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | In the Middle East (before 6000 BCE) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «Au»: from Latin aurum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of gold
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Gold is a chemical element with the symbol Au (from Latin: aurum) and atomic number 79. This makes it one of the higher atomic number elements that occur naturally. It is a bright, slightly orange-yellow, dense, soft, malleable, and ductile metal in a pure form. Chemically, gold is a transition metal and a group 11 element. It is one of the least reactive chemical elements and is solid under standard conditions. Gold often occurs in free elemental (native state), as nuggets or grains, in rocks, veins, and alluvial deposits. It occurs in a solid solution series with the native element silver (as electrum), naturally alloyed with other metals like copper and palladium, and mineral inclusions such as within pyrite. Less commonly, it occurs in minerals as gold compounds, often with tellurium (gold tellurides).
Gold is resistant to most acids, though it does dissolve in aqua regia (a mixture of nitric acid and hydrochloric acid), forming a soluble tetrachloroaurate anion. Gold is insoluble in nitric acid alone, which dissolves silver and base metals, a property long used to refine gold and confirm the presence of gold in metallic substances, giving rise to the term ‘acid test’. Gold dissolves in alkaline solutions of cyanide, which are used in mining and electroplating. Gold also dissolves in mercury, forming amalgam alloys, and as the gold acts simply as a solute, this is not a chemical reaction.
A relatively rare element,[6][7] gold is a precious metal that has been used for coinage, jewelry, and other arts throughout recorded history. In the past, a gold standard was often implemented as a monetary policy. Gold coins ceased to be minted as a circulating currency in the 1930s, and the world gold standard was abandoned for a fiat currency system after the Nixon shock measures of 1971.
In 2020, the world’s largest gold producer was China, followed by Russia and Australia.[8] A total of around 201,296 tonnes of gold exists above ground, as of 2020.[9] This is equal to a cube with each side measuring roughly 21.7 meters (71 ft). The world consumption of new gold produced is about 50% in jewelry, 40% in investments and 10% in industry.[10] Gold’s high malleability, ductility, resistance to corrosion and most other chemical reactions, and conductivity of electricity have led to its continued use in corrosion-resistant electrical connectors in all types of computerized devices (its chief industrial use). Gold is also used in infrared shielding, production of colored glass, gold leafing, and tooth restoration. Certain gold salts are still used as anti-inflammatories in medicine.
Characteristics
Gold can be drawn into a monatomic wire, and then stretched more before it breaks.[11]
A gold nugget of 5 mm (0.20 in) in size can be hammered into a gold foil of about 0.5 m2 (5.4 sq ft) in area.
Gold is the most malleable of all metals. It can be drawn into a wire of single-atom width, and then stretched considerably before it breaks.[11] Such nanowires distort via formation, reorientation and migration of dislocations and crystal twins without noticeable hardening.[12] A single gram of gold can be beaten into a sheet of 1 square metre (11 sq ft), and an avoirdupois ounce into 300 square feet (28 m2). Gold leaf can be beaten thin enough to become semi-transparent. The transmitted light appears greenish-blue, because gold strongly reflects yellow and red.[13] Such semi-transparent sheets also strongly reflect infrared light, making them useful as infrared (radiant heat) shields in visors of heat-resistant suits, and in sun-visors for spacesuits.[14] Gold is a good conductor of heat and electricity.
Gold has a density of 19.3 g/cm3, almost identical to that of tungsten at 19.25 g/cm3; as such, tungsten has been used in counterfeiting of gold bars, such as by plating a tungsten bar with gold,[15][16][17][18] or taking an existing gold bar, drilling holes, and replacing the removed gold with tungsten rods.[19] By comparison, the density of lead is 11.34 g/cm3, and that of the densest element, osmium, is 22.588±0.015 g/cm3.[20]
Color
Different colors of Ag–Au–Cu alloys
Whereas most metals are gray or silvery white, gold is slightly reddish-yellow.[21] This color is determined by the frequency of plasma oscillations among the metal’s valence electrons, in the ultraviolet range for most metals but in the visible range for gold due to relativistic effects affecting the orbitals around gold atoms.[22][23] Similar effects impart a golden hue to metallic caesium.
Common colored gold alloys include the distinctive eighteen-karat rose gold created by the addition of copper. Alloys containing palladium or nickel are also important in commercial jewelry as these produce white gold alloys. Fourteen-karat gold-copper alloy is nearly identical in color to certain bronze alloys, and both may be used to produce police and other badges. Fourteen- and eighteen-karat gold alloys with silver alone appear greenish-yellow and are referred to as green gold. Blue gold can be made by alloying with iron, and purple gold can be made by alloying with aluminium. Less commonly, addition of manganese, indium, and other elements can produce more unusual colors of gold for various applications.[24]
Colloidal gold, used by electron-microscopists, is red if the particles are small; larger particles of colloidal gold are blue.[25]
Isotopes
Gold has only one stable isotope, 197
Au, which is also its only naturally occurring isotope, so gold is both a mononuclidic and monoisotopic element. Thirty-six radioisotopes have been synthesized, ranging in atomic mass from 169 to 205. The most stable of these is 195
Au with a half-life of 186.1 days. The least stable is 171
Au, which decays by proton emission with a half-life of 30 µs. Most of gold’s radioisotopes with atomic masses below 197 decay by some combination of proton emission, α decay, and β+ decay. The exceptions are 195
Au, which decays by electron capture, and 196
Au, which decays most often by electron capture (93%) with a minor β− decay path (7%).[26] All of gold’s radioisotopes with atomic masses above 197 decay by β− decay.[27]
At least 32 nuclear isomers have also been characterized, ranging in atomic mass from 170 to 200. Within that range, only 178
Au, 180
Au, 181
Au, 182
Au, and 188
Au do not have isomers. Gold’s most stable isomer is 198m2
Au with a half-life of 2.27 days. Gold’s least stable isomer is 177m2
Au with a half-life of only 7 ns. 184m1
Au has three decay paths: β+ decay, isomeric transition, and alpha decay. No other isomer or isotope of gold has three decay paths.[27]
Synthesis
The possible production of gold from a more common element, such as lead, has long been a subject of human inquiry, and the ancient and medieval discipline of alchemy often focused on it; however, the transmutation of the chemical elements did not become possible until the understanding of nuclear physics in the 20th century. The first synthesis of gold was conducted by Japanese physicist Hantaro Nagaoka, who synthesized gold from mercury in 1924 by neutron bombardment.[28] An American team, working without knowledge of Nagaoka’s prior study, conducted the same experiment in 1941, achieving the same result and showing that the isotopes of gold produced by it were all radioactive.[29] In 1980, Glenn Seaborg transmuted several thousand atoms of bismuth into gold at the Lawrence Berkeley Laboratory.[30][31] Gold can be manufactured in a nuclear reactor, but doing so is highly impractical and would cost far more than the value of the gold that is produced.[32]
Chemistry
Gold(III) chloride solution in water
Although gold is the most noble of the noble metals,[33][34] it still forms many diverse compounds. The oxidation state of gold in its compounds ranges from −1 to +5, but Au(I) and Au(III) dominate its chemistry. Au(I), referred to as the aurous ion, is the most common oxidation state with soft ligands such as thioethers, thiolates, and organophosphines. Au(I) compounds are typically linear. A good example is Au(CN)−2, which is the soluble form of gold encountered in mining. The binary gold halides, such as AuCl, form zigzag polymeric chains, again featuring linear coordination at Au. Most drugs based on gold are Au(I) derivatives.[35]
Au(III) (referred to as the auric) is a common oxidation state, and is illustrated by gold(III) chloride, Au2Cl6. The gold atom centers in Au(III) complexes, like other d8 compounds, are typically square planar, with chemical bonds that have both covalent and ionic character. Gold(I,III) chloride is also known, an example of a mixed-valence complex.
Gold does not react with oxygen at any temperature[36] and, up to 100 °C, is resistant to attack from ozone.[37]
Some free halogens react with gold.[38] Gold is strongly attacked by fluorine at dull-red heat[39] to form gold(III) fluoride AuF3. Powdered gold reacts with chlorine at 180 °C to form gold(III) chloride AuCl3.[40] Gold reacts with bromine at 140 °C to form gold(III) bromide AuBr3, but reacts only very slowly with iodine to form gold(I) iodide AuI.
Gold does not react with sulfur directly,[41] but gold(III) sulfide can be made by passing hydrogen sulfide through a dilute solution of gold(III) chloride or chlorauric acid.
Gold readily dissolves in mercury at room temperature to form an amalgam, and forms alloys with many other metals at higher temperatures. These alloys can be produced to modify the hardness and other metallurgical properties, to control melting point or to create exotic colors.[24]
Gold is unaffected by most acids. It does not react with hydrofluoric, hydrochloric, hydrobromic, hydriodic, sulfuric, or nitric acid. It does react with selenic acid, and is dissolved by aqua regia, a 1:3 mixture of nitric acid and hydrochloric acid. Nitric acid oxidizes the metal to +3 ions, but only in minute amounts, typically undetectable in the pure acid because of the chemical equilibrium of the reaction. However, the ions are removed from the equilibrium by hydrochloric acid, forming AuCl−4 ions, or chloroauric acid, thereby enabling further oxidation.
Gold is similarly unaffected by most bases. It does not react with aqueous, solid, or molten sodium or potassium hydroxide. It does however, react with sodium or potassium cyanide under alkaline conditions when oxygen is present to form soluble complexes.[41]
Common oxidation states of gold include +1 (gold(I) or aurous compounds) and +3 (gold(III) or auric compounds). Gold ions in solution are readily reduced and precipitated as metal by adding any other metal as the reducing agent. The added metal is oxidized and dissolves, allowing the gold to be displaced from solution and be recovered as a solid precipitate.
Rare oxidation states
Less common oxidation states of gold include −1, +2, and +5.
The −1 oxidation state occurs in aurides, compounds containing the Au− anion. Caesium auride (CsAu), for example, crystallizes in the caesium chloride motif;[42] rubidium, potassium, and tetramethylammonium aurides are also known.[43] Gold has the highest electron affinity of any metal, at 222.8 kJ/mol, making Au− a stable species,[44] analogous to the halides.
Gold also has a –1 oxidation state in covalent complexes with the group 4 transition metals, such as in titanium tetraauride and the analogous zirconium and hafnium compounds. These chemicals are expected to form gold-bridged dimers in a manner similar to titanium(IV) hydride.[45]
Gold(II) compounds are usually diamagnetic with Au–Au bonds such as [Au(CH2)2P(C6H5)2]2Cl2. The evaporation of a solution of Au(OH)3 in concentrated H2SO4 produces red crystals of gold(II) sulfate, Au2(SO4)2. Originally thought to be a mixed-valence compound, it has been shown to contain Au4+2 cations, analogous to the better-known mercury(I) ion, Hg2+2.[46][47] A gold(II) complex, the tetraxenonogold(II) cation, which contains xenon as a ligand, occurs in [AuXe4](Sb2F11)2.[48]
Gold pentafluoride, along with its derivative anion, AuF−6, and its difluorine complex, gold heptafluoride, is the sole example of gold(V), the highest verified oxidation state.[49]
Some gold compounds exhibit aurophilic bonding, which describes the tendency of gold ions to interact at distances that are too long to be a conventional Au–Au bond but shorter than van der Waals bonding. The interaction is estimated to be comparable in strength to that of a hydrogen bond.
Well-defined cluster compounds are numerous.[43] In some cases, gold has a fractional oxidation state. A representative example is the octahedral species {Au(P(C6H5)3)}2+6.
Origin
Gold production in the universe
Schematic of a NE (left) to SW (right) cross-section through the 2.020-billion-year-old Vredefort impact structure in South Africa and how it distorted the contemporary geological structures. The present erosion level is shown. Johannesburg is located where the Witwatersrand Basin (the yellow layer) is exposed at the «present surface» line, just inside the crater rim, on the left. Not to scale.
Gold is thought to have been produced in supernova nucleosynthesis, and from the collision of neutron stars,[50] and to have been present in the dust from which the Solar System formed.[51]
Traditionally, gold in the universe is thought to have formed by the r-process (rapid neutron capture) in supernova nucleosynthesis,[52] but more recently it has been suggested that gold and other elements heavier than iron may also be produced in quantity by the r-process in the collision of neutron stars.[53] In both cases, satellite spectrometers at first only indirectly detected the resulting gold.[54] However, in August 2017, the spectroscopic signatures of heavy elements, including gold, were observed by electromagnetic observatories in the GW170817 neutron star merger event, after gravitational wave detectors confirmed the event as a neutron star merger.[55] Current astrophysical models suggest that this single neutron star merger event generated between 3 and 13 Earth masses of gold. This amount, along with estimations of the rate of occurrence of these neutron star merger events, suggests that such mergers may produce enough gold to account for most of the abundance of this element in the universe.[56]
Asteroid origin theories
Because the Earth was molten when it was formed, almost all of the gold present in the early Earth probably sank into the planetary core. Therefore, most of the gold that is in the Earth’s crust and mantle has in one model thought to have been delivered to Earth later, by asteroid impacts during the Late Heavy Bombardment, about 4 billion years ago.[57][58]
Gold which is reachable by humans has, in one case, been associated with a particular asteroid impact. The asteroid that formed Vredefort impact structure 2.020 billion years ago is often credited with seeding the Witwatersrand basin in South Africa with the richest gold deposits on earth.[59][60][61][62] However, this scenario is now questioned. The gold-bearing Witwatersrand rocks were laid down between 700 and 950 million years before the Vredefort impact.[63][64] These gold-bearing rocks had furthermore been covered by a thick layer of Ventersdorp lavas and the Transvaal Supergroup of rocks before the meteor struck, and thus the gold did not actually arrive in the asteroid/meteorite. What the Vredefort impact achieved, however, was to distort the Witwatersrand basin in such a way that the gold-bearing rocks were brought to the present erosion surface in Johannesburg, on the Witwatersrand, just inside the rim of the original 300 km (190 mi) diameter crater caused by the meteor strike. The discovery of the deposit in 1886 launched the Witwatersrand Gold Rush. Some 22% of all the gold that is ascertained to exist today on Earth has been extracted from these Witwatersrand rocks.[64]
Mantle return theories
Notwithstanding the impact above, much of the rest of the gold on Earth is thought to have been incorporated into the planet since its very beginning, as planetesimals formed the planet’s mantle, early in Earth’s creation. In 2017, an international group of scientists, established that gold «came to the Earth’s surface from the deepest regions of our planet»,[65] the mantle, evidenced by their findings at Deseado Massif in the Argentinian Patagonia.[66][clarification needed]
Occurrence
On Earth, gold is found in ores in rock formed from the Precambrian time onward.[67] It most often occurs as a native metal, typically in a metal solid solution with silver (i.e. as a gold/silver alloy). Such alloys usually have a silver content of 8–10%. Electrum is elemental gold with more than 20% silver, and is commonly known as white gold. Electrum’s color runs from golden-silvery to silvery, dependent upon the silver content. The more silver, the lower the specific gravity.
Native gold occurs as very small to microscopic particles embedded in rock, often together with quartz or sulfide minerals such as «fool’s gold», which is a pyrite.[68] These are called lode deposits. The metal in a native state is also found in the form of free flakes, grains or larger nuggets[67] that have been eroded from rocks and end up in alluvial deposits called placer deposits. Such free gold is always richer at the exposed surface of gold-bearing veins, owing to the oxidation of accompanying minerals followed by weathering; and by washing of the dust into streams and rivers, where it collects and can be welded by water action to form nuggets.
Gold sometimes occurs combined with tellurium as the minerals calaverite, krennerite, nagyagite, petzite and sylvanite (see telluride minerals), and as the rare bismuthide maldonite (Au2Bi) and antimonide aurostibite (AuSb2). Gold also occurs in rare alloys with copper, lead, and mercury: the minerals auricupride (Cu3Au), novodneprite (AuPb3) and weishanite ((Au,Ag)3Hg2).
Recent research suggests that microbes can sometimes play an important role in forming gold deposits, transporting and precipitating gold to form grains and nuggets that collect in alluvial deposits.[69]
Another recent study has claimed water in faults vaporizes during an earthquake, depositing gold. When an earthquake strikes, it moves along a fault. Water often lubricates faults, filling in fractures and jogs. About 10 kilometres (6.2 mi) below the surface, under very high temperatures and pressures, the water carries high concentrations of carbon dioxide, silica, and gold. During an earthquake, the fault jog suddenly opens wider. The water inside the void instantly vaporizes, flashing to steam and forcing silica, which forms the mineral quartz, and gold out of the fluids and onto nearby surfaces.[70]
Seawater
The world’s oceans contain gold. Measured concentrations of gold in the Atlantic and Northeast Pacific are 50–150 femtomol/L or 10–30 parts per quadrillion (about 10–30 g/km3). In general, gold concentrations for south Atlantic and central Pacific samples are the same (~50 femtomol/L) but less certain. Mediterranean deep waters contain slightly higher concentrations of gold (100–150 femtomol/L) attributed to wind-blown dust and/or rivers. At 10 parts per quadrillion the Earth’s oceans would hold 15,000 tonnes of gold.[71] These figures are three orders of magnitude less than reported in the literature prior to 1988, indicating contamination problems with the earlier data.
A number of people have claimed to be able to economically recover gold from sea water, but they were either mistaken or acted in an intentional deception. Prescott Jernegan ran a gold-from-seawater swindle in the United States in the 1890s, as did an English fraudster in the early 1900s.[72] Fritz Haber did research on the extraction of gold from sea water in an effort to help pay Germany’s reparations following World War I.[73] Based on the published values of 2 to 64 ppb of gold in seawater a commercially successful extraction seemed possible. After analysis of 4,000 water samples yielding an average of 0.004 ppb it became clear that extraction would not be possible and he ended the project.[74]
History
Oldest golden artifacts in the world (4600 BC — 4200 BC) from Varna necropolis, Bulgaria — grave offerings on exposition in Varna Museum.
The Muisca raft, between circa 600-1600 AD. The figure refers to the ceremony of the legend of El Dorado. The zipa used to cover his body in gold dust, and from his raft, he offered treasures to the Guatavita goddess in the middle of the sacred lake. This old Muisca tradition became the origin of the legend of El Dorado.
This Muisca raft figure is on display in the Gold Museum, Bogotá, Colombia.
The earliest recorded metal employed by humans appears to be gold, which can be found free or «native». Small amounts of natural gold have been found in Spanish caves used during the late Paleolithic period, c. 40,000 BC.[76]
The oldest gold artifacts in the world are from Bulgaria and are dating back to the 5th millennium BC (4,600 BC to 4,200 BC), such as those found in the Varna Necropolis near Lake Varna and the Black Sea coast, thought to be the earliest «well-dated» finding of gold artifacts in history.[77][67][78][79] Several prehistoric Bulgarian finds are considered no less old – the golden treasures of Hotnitsa, Durankulak, artifacts from the Kurgan settlement of Yunatsite near Pazardzhik, the golden treasure Sakar, as well as beads and gold jewelry found in the Kurgan settlement of Provadia – Solnitsata (“salt pit”). However, Varna gold is most often called the oldest since this treasure is the largest and most diverse.[80]
Gold artifacts probably made their first appearance in Ancient Egypt at the very beginning of the pre-dynastic period, at the end of the fifth millennium BC and the start of the fourth, and smelting was developed during the course of the 4th millennium; gold artifacts appear in the archeology of Lower Mesopotamia during the early 4th millennium.[81] As of 1990, gold artifacts found at the Wadi Qana cave cemetery of the 4th millennium BC in West Bank were the earliest from the Levant.[82] Gold artifacts such as the golden hats and the Nebra disk appeared in Central Europe from the 2nd millennium BC Bronze Age.
The oldest known map of a gold mine was drawn in the 19th Dynasty of Ancient Egypt (1320–1200 BC), whereas the first written reference to gold was recorded in the 12th Dynasty around 1900 BC.[83] Egyptian hieroglyphs from as early as 2600 BC describe gold, which King Tushratta of the Mitanni claimed was «more plentiful than dirt» in Egypt.[84] Egypt and especially Nubia had the resources to make them major gold-producing areas for much of history. One of the earliest known maps, known as the Turin Papyrus Map, shows the plan of a gold mine in Nubia together with indications of the local geology. The primitive working methods are described by both Strabo and Diodorus Siculus, and included fire-setting. Large mines were also present across the Red Sea in what is now Saudi Arabia.
Gold is mentioned in the Amarna letters numbered 19[85] and 26[86] from around the 14th century BC.[87][88]
Gold is mentioned frequently in the Old Testament, starting with Genesis 2:11 (at Havilah), the story of the golden calf, and many parts of the temple including the Menorah and the golden altar. In the New Testament, it is included with the gifts of the magi in the first chapters of Matthew. The Book of Revelation 21:21 describes the city of New Jerusalem as having streets «made of pure gold, clear as crystal». Exploitation of gold in the south-east corner of the Black Sea is said to date from the time of Midas, and this gold was important in the establishment of what is probably the world’s earliest coinage in Lydia around 610 BC.[89] The legend of the golden fleece dating from eighth century BCE may refer to the use of fleeces to trap gold dust from placer deposits in the ancient world. From the 6th or 5th century BC, the Chu (state) circulated the Ying Yuan, one kind of square gold coin.
In Roman metallurgy, new methods for extracting gold on a large scale were developed by introducing hydraulic mining methods, especially in Hispania from 25 BC onwards and in Dacia from 106 AD onwards. One of their largest mines was at Las Medulas in León, where seven long aqueducts enabled them to sluice most of a large alluvial deposit. The mines at Roşia Montană in Transylvania were also very large, and until very recently, still mined by opencast methods. They also exploited smaller deposits in Britain, such as placer and hard-rock deposits at Dolaucothi. The various methods they used are well described by Pliny the Elder in his encyclopedia Naturalis Historia written towards the end of the first century AD.
During Mansa Musa’s (ruler of the Mali Empire from 1312 to 1337) hajj to Mecca in 1324, he passed through Cairo in July 1324, and was reportedly accompanied by a camel train that included thousands of people and nearly a hundred camels where he gave away so much gold that it depressed the price in Egypt for over a decade, causing high inflation.[90] A contemporary Arab historian remarked:
Gold was at a high price in Egypt until they came in that year. The mithqal did not go below 25 dirhams and was generally above, but from that time its value fell and it cheapened in price and has remained cheap till now. The mithqal does not exceed 22 dirhams or less. This has been the state of affairs for about twelve years until this day by reason of the large amount of gold which they brought into Egypt and spent there […].
Gold coin of Eucratides I (171–145 BC), one of the Hellenistic rulers of ancient Ai-Khanoum. This is the largest known gold coin minted in antiquity (169.2 g (5.97 oz); 58 mm (2.3 in)).[92]
The European exploration of the Americas was fueled in no small part by reports of the gold ornaments displayed in great profusion by Native American peoples, especially in Mesoamerica, Peru, Ecuador and Colombia. The Aztecs regarded gold as the product of the gods, calling it literally «god excrement» (teocuitlatl in Nahuatl), and after Moctezuma II was killed, most of this gold was shipped to Spain.[93] However, for the indigenous peoples of North America gold was considered useless and they saw much greater value in other minerals which were directly related to their utility, such as obsidian, flint, and slate.[94] El Dorado is applied to a legendary story in which precious stones were found in fabulous abundance along with gold coins. The concept of El Dorado underwent several transformations, and eventually accounts of the previous myth were also combined with those of a legendary lost city. El Dorado, was the term used by the Spanish Empire to describe a mythical tribal chief (zipa) of the Muisca native people in Colombia, who, as an initiation rite, covered himself with gold dust and submerged in Lake Guatavita. The legends surrounding El Dorado changed over time, as it went from being a man, to a city, to a kingdom, and then finally to an empire.
Beginning in the early modern period, European exploration and colonization of West Africa was driven in large part by reports of gold deposits in the region, which was eventually referred to by Europeans as the «Gold Coast».[95] From the late 15th to early 19th centuries, European trade in the region was primarily focused in gold, along with ivory and slaves.[96] The gold trade in West Africa was dominated by the Ashanti Empire, who initially traded with the Portuguese before branching out and trading with British, French, Spanish and Danish merchants.[97] British desires to secure control of West African gold deposits played a role in the Anglo-Ashanti wars of the late 19th century, which saw the Ashanti Empire annexed by Britain.[98]
Gold played a role in western culture, as a cause for desire and of corruption, as told in children’s fables such as Rumpelstiltskin—where Rumpelstiltskin turns hay into gold for the peasant’s daughter in return for her child when she becomes a princess—and the stealing of the hen that lays golden eggs in Jack and the Beanstalk.
The top prize at the Olympic Games and many other sports competitions is the gold medal.
75% of the presently accounted for gold has been extracted since 1910, two-thirds since 1950.
One main goal of the alchemists was to produce gold from other substances, such as lead — presumably by the interaction with a mythical substance called the philosopher’s stone. Trying to produce gold led the alchemists to systematically find out what can be done with substances, and this laid the foundation for today’s chemistry, which can produce gold (albeit uneconomically) by using nuclear transmutation.[99] Their symbol for gold was the circle with a point at its center (☉), which was also the astrological symbol and the ancient Chinese character for the Sun.
The Dome of the Rock is covered with an ultra-thin golden glassier. The Sikh Golden temple, the Harmandir Sahib, is a building covered with gold. Similarly the Wat Phra Kaew emerald Buddhist temple (wat) in Thailand has ornamental gold-leafed statues and roofs. Some European king and queen’s crowns were made of gold, and gold was used for the bridal crown since antiquity. An ancient Talmudic text circa 100 AD describes Rachel, wife of Rabbi Akiva, receiving a «Jerusalem of Gold» (diadem). A Greek burial crown made of gold was found in a grave circa 370 BC.
-
Ancient Egyptian statuette of Amun; 945–715 BC; gold; 175 mm × 47 mm (6.9 in × 1.9 in); Metropolitan Museum of Art
-
Ancient Egyptian signet ring; 664–525 BC; gold; diameter: 30 mm × 34 mm (1.2 in × 1.3 in); British Museum (London)
-
Etruscan funerary wreath; 4th–3rd century BC; length: 333 mm (13.1 in); Metropolitan Museum of Art
-
Quimbaya lime container; 5th–9th century; gold; height: 230 mm (9.1 in); Metropolitan Museum of Art
-
-
Pre-Columbian pendant with two bat-head warriors who carry spears; 11th–16th century; gold; overall: 76.2 mm (3.00 in); from the Chiriqui Province (Panama); Metropolitan Museum of Art
-
English Neoclassical box; 1741; overall: 44 mm × 116 mm × 92 mm (1.7 in × 4.6 in × 3.6 in); Metropolitan Museum of Art
-
French Rococo glass bottle mounted in gold; circa 1775; overall: 70 mm × 29 mm (2.8 in × 1.1 in); Cleveland Museum of Art
Etymology
An early mention of gold in the Beowulf
«Gold» is cognate with similar words in many Germanic languages, deriving via Proto-Germanic *gulþą from Proto-Indo-European *ǵʰelh₃- («to shine, to gleam; to be yellow or green»).[100][101]
The symbol Au is from the Latin: aurum, the Latin word for «gold».[102] The Proto-Indo-European ancestor of aurum was *h₂é-h₂us-o-, meaning «glow». This word is derived from the same root (Proto-Indo-European *h₂u̯es- «to dawn») as *h₂éu̯sōs, the ancestor of the Latin word Aurora, «dawn».[103] This etymological relationship is presumably behind the frequent claim in scientific publications that aurum meant «shining dawn».[104]
Culture
In popular culture gold is a high standard of excellence, often used in awards.[44] Great achievements are frequently rewarded with gold, in the form of gold medals, gold trophies and other decorations. Winners of athletic events and other graded competitions are usually awarded a gold medal. Many awards such as the Nobel Prize are made from gold as well. Other award statues and prizes are depicted in gold or are gold plated (such as the Academy Awards, the Golden Globe Awards, the Emmy Awards, the Palme d’Or, and the British Academy Film Awards).[105]
Aristotle in his ethics used gold symbolism when referring to what is now known as the golden mean. Similarly, gold is associated with perfect or divine principles, such as in the case of the golden ratio and the golden rule. Gold is further associated with the wisdom of aging and fruition. The fiftieth wedding anniversary is golden. A person’s most valued or most successful latter years are sometimes considered «golden years». The height of a civilization is referred to as a golden age.[106]
Religion
In some forms of Christianity and Judaism, gold has been associated both with the sacred and evil. In the Book of Exodus, the Golden Calf is a symbol of idolatry, while in the Book of Genesis, Abraham was said to be rich in gold and silver, and Moses was instructed to cover the Mercy Seat of the Ark of the Covenant with pure gold. In Byzantine iconography the halos of Christ, Virgin Mary and the saints are often golden.[107]
In Islam,[108] gold (along with silk)[109][110] is often cited as being forbidden for men to wear.[111] Abu Bakr al-Jazaeri, quoting a hadith, said that «[t]he wearing of silk and gold are forbidden on the males of my nation, and they are lawful to their women».[112] This, however, has not been enforced consistently throughout history, e.g. in the Ottoman Empire.[113] Further, small gold accents on clothing, such as in embroidery, may be permitted.[114]
In ancient Greek religion and mythology, Theia was seen as the goddess of gold, silver and other gems.[115]
According to Christopher Columbus, those who had something of gold were in possession of something of great value on Earth and a substance to even help souls to paradise.[116]
Wedding rings are typically made of gold. It is long lasting and unaffected by the passage of time and may aid in the ring symbolism of eternal vows before God and the perfection the marriage signifies. In Orthodox Christian wedding ceremonies, the wedded couple is adorned with a golden crown (though some opt for wreaths, instead) during the ceremony, an amalgamation of symbolic rites.
On 24 August 2020, Israeli archaeologists discovered a trove of early Islamic gold coins near the central city of Yavne. Analysis of the extremely rare collection of 425 gold coins indicated that they were from the late 9th century. Dating to around 1,100 years back, the gold coins were from the Abbasid Caliphate.[117]
Production
Time trend of gold production
According to the United States Geological Survey in 2016, about 5,726,000,000 troy ounces (178,100 t) of gold has been accounted for, of which 85% remains in active use.[118]
Mining and prospecting
Since the 1880s, South Africa has been the source of a large proportion of the world’s gold supply, and about 22% of the gold presently accounted is from South Africa. Production in 1970 accounted for 79% of the world supply, about 1,480 tonnes. In 2007 China (with 276 tonnes) overtook South Africa as the world’s largest gold producer, the first time since 1905 that South Africa had not been the largest.[119]
In 2020, China was the world’s leading gold-mining country, followed in order by Russia, Australia, the United States, Canada, and Ghana.[8]
Relative sizes of an 860 kg (1,900 lb) block of gold ore and the 30 g (0.96 ozt) of gold that can be extracted from it, Toi gold mine, Japan.
In South America, the controversial project Pascua Lama aims at exploitation of rich fields in the high mountains of Atacama Desert, at the border between Chile and Argentina.
It has been estimated that up to one-quarter of the yearly global gold production originates from artisanal or small scale mining.[120][121][122]
The city of Johannesburg located in South Africa was founded as a result of the Witwatersrand Gold Rush which resulted in the discovery of some of the largest natural gold deposits in recorded history. The gold fields are confined to the northern and north-western edges of the Witwatersrand basin, which is a 5–7 km (3.1–4.3 mi) thick layer of archean rocks located, in most places, deep under the Free State, Gauteng and surrounding provinces.[123] These Witwatersrand rocks are exposed at the surface on the Witwatersrand, in and around Johannesburg, but also in isolated patches to the south-east and south-west of Johannesburg, as well as in an arc around the Vredefort Dome which lies close to the center of the Witwatersrand basin.[63][123] From these surface exposures the basin dips extensively, requiring some of the mining to occur at depths of nearly 4,000 m (13,000 ft), making them, especially the Savuka and TauTona mines to the south-west of Johannesburg, the deepest mines on earth. The gold is found only in six areas where archean rivers from the north and north-west formed extensive pebbly Braided river deltas before draining into the «Witwatersrand sea» where the rest of the Witwatersrand sediments were deposited.[123]
The Second Boer War of 1899–1901 between the British Empire and the Afrikaner Boers was at least partly over the rights of miners and possession of the gold wealth in South Africa.
During the 19th century, gold rushes occurred whenever large gold deposits were discovered. The first documented discovery of gold in the United States was at the Reed Gold Mine near Georgeville, North Carolina in 1803.[124] The first major gold strike in the United States occurred in a small north Georgia town called Dahlonega.[125] Further gold rushes occurred in California, Colorado, the Black Hills, Otago in New Zealand, a number of locations across Australia, Witwatersrand in South Africa, and the Klondike in Canada.
Grasberg mine located in Papua, Indonesia is the largest gold mine in the world.[126]
Extraction and refining
Gold extraction is most economical in large, easily mined deposits. Ore grades as little as 0.5 parts per million (ppm) can be economical. Typical ore grades in open-pit mines are 1–5 ppm; ore grades in underground or hard rock mines are usually at least 3 ppm. Because ore grades of 30 ppm are usually needed before gold is visible to the naked eye, in most gold mines the gold is invisible.
The average gold mining and extraction costs were about $317 per troy ounce in 2007, but these can vary widely depending on mining type and ore quality; global mine production amounted to 2,471.1 tonnes.[127]
After initial production, gold is often subsequently refined industrially by the Wohlwill process which is based on electrolysis or by the Miller process, that is chlorination in the melt. The Wohlwill process results in higher purity, but is more complex and is only applied in small-scale installations.[128][129] Other methods of assaying and purifying smaller amounts of gold include parting and inquartation as well as cupellation, or refining methods based on the dissolution of gold in aqua regia.[130]
As of 2020, the amount of carbon dioxide CO2 produced in mining a kilogram of gold is 16 tonnes, while recycling a kilogram of gold produces 53 kilograms of CO2 equivalent. Approximately 30 percent of the global gold supply is recycled and not mined as of 2020.[131]
Corporations are starting to adopt gold recycling including jewelry companies such as Generation Collection and computer companies including Dell.[132]
Consumption
|
|
This article needs to be updated. Please help update this article to reflect recent events or newly available information. (May 2022) |
| Country | 2009 | 2010 | 2011 | 2012 | 2013 |
|---|---|---|---|---|---|
| 442.37 | 745.70 | 986.3 | 864 | 974 | |
| 376.96 | 428.00 | 921.5 | 817.5 | 1120.1 | |
| 150.28 | 128.61 | 199.5 | 161 | 190 | |
| 75.16 | 74.07 | 143 | 118 | 175.2 | |
| 77.75 | 72.95 | 69.1 | 58.5 | 72.2 | |
| 60.12 | 67.50 | 76.7 | 81.9 | 73.3 | |
| 67.60 | 63.37 | 60.9 | 58.1 | 77.1 | |
| 56.68 | 53.43 | 36 | 47.8 | 57.3 | |
| 41.00 | 32.75 | 55 | 52.3 | 68 | |
| 31.75 | 27.35 | 22.6 | 21.1 | 23.4 | |
| Other Persian Gulf Countries | 24.10 | 21.97 | 22 | 19.9 | 24.6 |
| 21.85 | 18.50 | −30.1 | 7.6 | 21.3 | |
| 18.83 | 15.87 | 15.5 | 12.1 | 17.5 | |
| 15.08 | 14.36 | 100.8 | 77 | 92.2 | |
| 7.33 | 6.28 | 107.4 | 80.9 | 140.1 | |
| Total | 1466.86 | 1770.71 | 2786.12 | 2477.7 | 3126.1 |
| Other Countries | 251.6 | 254.0 | 390.4 | 393.5 | 450.7 |
| World Total | 1718.46 | 2024.71 | 3176.52 | 2871.2 | 3576.8 |
The consumption of gold produced in the world is about 50% in jewelry, 40% in investments, and 10% in industry.[10][136]
According to the World Gold Council, China was the world’s largest single consumer of gold in 2013, overtaking India.[137]
Pollution
Gold production is associated with contribution to hazardous pollution.[138][139]
Low-grade gold ore may contain less than one ppm gold metal; such ore is ground and mixed with sodium cyanide to dissolve the gold. Cyanide is a highly poisonous chemical, which can kill living creatures when exposed in minute quantities. Many cyanide spills[140] from gold mines have occurred in both developed and developing countries which killed aquatic life in long stretches of affected rivers. Environmentalists consider these events major environmental disasters.[141][142] Up to thirty tons of used ore can dumped as waste for producing one troy ounce of gold.[143] Gold ore dumps are the source of many heavy elements such as cadmium, lead, zinc, copper, arsenic, selenium and mercury. When sulfide-bearing minerals in these ore dumps are exposed to air and water, the sulfide transforms into sulfuric acid which in turn dissolves these heavy metals facilitating their passage into surface water and ground water. This process is called acid mine drainage. These gold ore dumps are long-term, highly hazardous wastes second only to nuclear waste dumps.[143]
It was once common to use mercury to recover gold from ore, but today the use of mercury is largely limited to small-scale individual miners.[144] Minute quantities of mercury compounds can reach water bodies, causing heavy metal contamination. Mercury can then enter into the human food chain in the form of methylmercury. Mercury poisoning in humans causes incurable brain function damage and severe retardation.[145]
Gold extraction is also a highly energy-intensive industry, extracting ore from deep mines and grinding the large quantity of ore for further chemical extraction requires nearly 25 kWh of electricity per gram of gold produced.[146]
Monetary use
Gold has been widely used throughout the world as money,[147] for efficient indirect exchange (versus barter), and to store wealth in hoards. For exchange purposes, mints produce standardized gold bullion coins, bars and other units of fixed weight and purity.
The first known coins containing gold were struck in Lydia, Asia Minor, around 600 BC.[89] The talent coin of gold in use during the periods of Grecian history both before and during the time of the life of Homer weighed between 8.42 and 8.75 grams.[148] From an earlier preference in using silver, European economies re-established the minting of gold as coinage during the thirteenth and fourteenth centuries.[149]
Bills (that mature into gold coin) and gold certificates (convertible into gold coin at the issuing bank) added to the circulating stock of gold standard money in most 19th century industrial economies.
In preparation for World War I the warring nations moved to fractional gold standards, inflating their currencies to finance the war effort.
Post-war, the victorious countries, most notably Britain, gradually restored gold-convertibility, but international flows of gold via bills of exchange remained embargoed; international shipments were made exclusively for bilateral trades or to pay war reparations.
After World War II gold was replaced by a system of nominally convertible currencies related by fixed exchange rates following the Bretton Woods system. Gold standards and the direct convertibility of currencies to gold have been abandoned by world governments, led in 1971 by the United States’ refusal to redeem its dollars in gold. Fiat currency now fills most monetary roles. Switzerland was the last country to tie its currency to gold; this was ended by a referendum in 1999.[150]
Central banks continue to keep a portion of their liquid reserves as gold in some form, and metals exchanges such as the London Bullion Market Association still clear transactions denominated in gold, including future delivery contracts. Today, gold mining output is declining.[151] With the sharp growth of economies in the 20th century, and increasing foreign exchange, the world’s gold reserves and their trading market have become a small fraction of all markets and fixed exchange rates of currencies to gold have been replaced by floating prices for gold and gold future contract. Though the gold stock grows by only 1% or 2% per year, very little metal is irretrievably consumed. Inventory above ground would satisfy many decades of industrial and even artisan uses at current prices.
The gold proportion (fineness) of alloys is measured by karat (k). Pure gold (commercially termed fine gold) is designated as 24 karat, abbreviated 24k. English gold coins intended for circulation from 1526 into the 1930s were typically a standard 22k alloy called crown gold,[152] for hardness (American gold coins for circulation after 1837 contain an alloy of 0.900 fine gold, or 21.6 kt).[153]
Although the prices of some platinum group metals can be much higher, gold has long been considered the most desirable of precious metals, and its value has been used as the standard for many currencies. Gold has been used as a symbol for purity, value, royalty, and particularly roles that combine these properties. Gold as a sign of wealth and prestige was ridiculed by Thomas More in his treatise Utopia. On that imaginary island, gold is so abundant that it is used to make chains for slaves, tableware, and lavatory seats. When ambassadors from other countries arrive, dressed in ostentatious gold jewels and badges, the Utopians mistake them for menial servants, paying homage instead to the most modestly dressed of their party.
The ISO 4217 currency code of gold is XAU.[154] Many holders of gold store it in form of bullion coins or bars as a hedge against inflation or other economic disruptions, though its efficacy as such has been questioned; historically, it has not proven itself reliable as a hedging instrument.[155] Modern bullion coins for investment or collector purposes do not require good mechanical wear properties; they are typically fine gold at 24k, although the American Gold Eagle and the British gold sovereign continue to be minted in 22k (0.92) metal in historical tradition, and the South African Krugerrand, first released in 1967, is also 22k (0.92).[156]
The special issue Canadian Gold Maple Leaf coin contains the highest purity gold of any bullion coin, at 99.999% or 0.99999, while the popular issue Canadian Gold Maple Leaf coin has a purity of 99.99%. In 2006, the United States Mint began producing the American Buffalo gold bullion coin with a purity of 99.99%. The Australian Gold Kangaroos were first coined in 1986 as the Australian Gold Nugget but changed the reverse design in 1989. Other modern coins include the Austrian Vienna Philharmonic bullion coin and the Chinese Gold Panda.[157]
Price
Gold price history in 1960–2020.
As of September 2017, gold is valued at around $42 per gram ($1,300 per troy ounce).
Like other precious metals, gold is measured by troy weight and by grams. The proportion of gold in the alloy is measured by karat (k), with 24 karat (24k) being pure gold (100%), and lower karat numbers proportionally less (18k = 75%). The purity of a gold bar or coin can also be expressed as a decimal figure ranging from 0 to 1, known as the millesimal fineness, such as 0.995 being nearly pure.
The price of gold is determined through trading in the gold and derivatives markets, but a procedure known as the Gold Fixing in London, originating in September 1919, provides a daily benchmark price to the industry. The afternoon fixing was introduced in 1968 to provide a price when US markets are open.[158]
History
Historically gold coinage was widely used as currency; when paper money was introduced, it typically was a receipt redeemable for gold coin or bullion. In a monetary system known as the gold standard, a certain weight of gold was given the name of a unit of currency. For a long period, the United States government set the value of the US dollar so that one troy ounce was equal to $20.67 ($0.665 per gram), but in 1934 the dollar was devalued to $35.00 per troy ounce ($0.889/g). By 1961, it was becoming hard to maintain this price, and a pool of US and European banks agreed to manipulate the market to prevent further currency devaluation against increased gold demand.[159]
On 17 March 1968, economic circumstances[clarification needed] caused the collapse of the gold pool, and a two-tiered pricing scheme was established whereby gold was still used to settle international accounts at the old $35.00 per troy ounce ($1.13/g) but the price of gold on the private market was allowed to fluctuate; this two-tiered pricing system was abandoned in 1975 when the price of gold was left to find its free-market level.[citation needed] Central banks still hold historical gold reserves as a store of value although the level has generally been declining.[citation needed] The largest gold depository in the world is that of the U.S. Federal Reserve Bank in New York, which holds about 3%[160] of the gold known to exist and accounted for today, as does the similarly laden U.S. Bullion Depository at Fort Knox.
In 2005 the World Gold Council estimated total global gold supply to be 3,859 tonnes and demand to be 3,754 tonnes, giving a surplus of 105 tonnes.[161]
After 15 August 1971 Nixon shock, the price began to greatly increase,[162] and between 1968 and 2000 the price of gold ranged widely, from a high of $850 per troy ounce ($27.33/g) on 21 January 1980, to a low of $252.90 per troy ounce ($8.13/g) on 21 June 1999 (London Gold Fixing).[163] Prices increased rapidly from 2001, but the 1980 high was not exceeded until 3 January 2008, when a new maximum of $865.35 per troy ounce was set.[164] Another record price was set on 17 March 2008, at $1023.50 per troy ounce ($32.91/g).[164]
In late 2009, gold markets experienced renewed momentum upwards due to increased demand and a weakening US dollar.[citation needed] On 2 December 2009, gold reached a new high closing at $1,217.23.[165] Gold further rallied hitting new highs in May 2010 after the European Union debt crisis prompted further purchase of gold as a safe asset.[166][167] On 1 March 2011, gold hit a new all-time high of $1432.57, based on investor concerns regarding ongoing unrest in North Africa as well as in the Middle East.[168]
From April 2001 to August 2011, spot gold prices more than quintupled in value against the US dollar, hitting a new all-time high of $1,913.50 on 23 August 2011,[169] prompting speculation that the long secular bear market had ended and a bull market had returned.[170] However, the price then began a slow decline towards $1200 per troy ounce in late 2014 and 2015.
In August 2020, the gold price picked up to US$2060 per ounce after a complexive growth of 59% from August 2018 to October 2020, a period during which it outplaced the Nasdaq total return of 54%.[171]
Gold futures are traded on the COMEX exchange.[172] These contacts are priced in USD per troy ounce (1 troy ounce = 31.1034768 grams).[173] Below are the CQG contract specifications outlining the futures contracts:
| Gold (GCA) | |
|---|---|
| Exchange: | COMEX |
| Sector: | Metal |
| Tick Size: | 0.1 |
| Tick Value: | 10 USD |
| BPV: | 100 |
| Denomination: | USD |
| Decimal Place: | 1 |
Medicinal uses
Medicinal applications of gold and its complexes have a long history dating back thousands of years.[174] Several gold complexes have been applied to treat rheumatoid arthritis, the most frequently used being aurothiomalate, aurothioglucose, and auranofin. Both gold(I) and gold(III) compounds have been investigated as possible anti-cancer drugs. For gold(III) complexes, reduction to gold(0/I) under physiological conditions has to be considered. Stable complexes can be generated using different types of bi-, tri-, and tetradentate ligand systems, and their efficacy has been demonstrated in vitro and in vivo.[175]
Other applications
Jewelry
Because of the softness of pure (24k) gold, it is usually alloyed with base metals for use in jewelry, altering its hardness and ductility, melting point, color and other properties. Alloys with lower karat rating, typically 22k, 18k, 14k or 10k, contain higher percentages of copper or other base metals or silver or palladium in the alloy.[24] Nickel is toxic, and its release from nickel white gold is controlled by legislation in Europe.[24] Palladium-gold alloys are more expensive than those using nickel.[176] High-karat white gold alloys are more resistant to corrosion than are either pure silver or sterling silver. The Japanese craft of Mokume-gane exploits the color contrasts between laminated colored gold alloys to produce decorative wood-grain effects.
By 2014, the gold jewelry industry was escalating despite a dip in gold prices. Demand in the first quarter of 2014 pushed turnover to $23.7 billion according to a World Gold Council report.
Gold solder is used for joining the components of gold jewelry by high-temperature hard soldering or brazing. If the work is to be of hallmarking quality, the gold solder alloy must match the fineness (purity) of the work, and alloy formulas are manufactured to color-match yellow and white gold. Gold solder is usually made in at least three melting-point ranges referred to as Easy, Medium and Hard. By using the hard, high-melting point solder first, followed by solders with progressively lower melting points, goldsmiths can assemble complex items with several separate soldered joints. Gold can also be made into thread and used in embroidery.
Electronics
Only 10% of the world consumption of new gold produced goes to industry,[10] but by far the most important industrial use for new gold is in fabrication of corrosion-free electrical connectors in computers and other electrical devices. For example, according to the World Gold Council, a typical cell phone may contain 50 mg of gold, worth about 2 dollars 82 cents. But since nearly one billion cell phones are produced each year, a gold value of US$2.82 in each phone adds to US$2.82 billion in gold from just this application.[177] (Prices updated to November 2022)
Though gold is attacked by free chlorine, its good conductivity and general resistance to oxidation and corrosion in other environments (including resistance to non-chlorinated acids) has led to its widespread industrial use in the electronic era as a thin-layer coating on electrical connectors, thereby ensuring good connection. For example, gold is used in the connectors of the more expensive electronics cables, such as audio, video and USB cables. The benefit of using gold over other connector metals such as tin in these applications has been debated; gold connectors are often criticized by audio-visual experts as unnecessary for most consumers and seen as simply a marketing ploy. However, the use of gold in other applications in electronic sliding contacts in highly humid or corrosive atmospheres, and in use for contacts with a very high failure cost (certain computers, communications equipment, spacecraft, jet aircraft engines) remains very common.[178]
Besides sliding electrical contacts, gold is also used in electrical contacts because of its resistance to corrosion, electrical conductivity, ductility and lack of toxicity.[179] Switch contacts are generally subjected to more intense corrosion stress than are sliding contacts. Fine gold wires are used to connect semiconductor devices to their packages through a process known as wire bonding.
The concentration of free electrons in gold metal is 5.91×1022 cm−3.[180] Gold is highly conductive to electricity, and has been used for electrical wiring in some high-energy applications (only silver and copper are more conductive per volume, but gold has the advantage of corrosion resistance). For example, gold electrical wires were used during some of the Manhattan Project’s atomic experiments, but large high-current silver wires were used in the calutron isotope separator magnets in the project.
It is estimated that 16% of the world’s presently-accounted-for gold and 22% of the world’s silver is contained in electronic technology in Japan.[181]
Medicine
Metallic and gold compounds have long been used for medicinal purposes. Gold, usually as the metal, is perhaps the most anciently administered medicine (apparently by shamanic practitioners)[182] and known to Dioscorides.[183][184] In medieval times, gold was often seen as beneficial for the health, in the belief that something so rare and beautiful could not be anything but healthy. Even some modern esotericists and forms of alternative medicine assign metallic gold a healing power.
In the 19th century gold had a reputation as an anxiolytic, a therapy for nervous disorders. Depression, epilepsy, migraine, and glandular problems such as amenorrhea and impotence were treated, and most notably alcoholism (Keeley, 1897).[185]
The apparent paradox of the actual toxicology of the substance suggests the possibility of serious gaps in the understanding of the action of gold in physiology.[186] Only salts and radioisotopes of gold are of pharmacological value, since elemental (metallic) gold is inert to all chemicals it encounters inside the body (e.g., ingested gold cannot be attacked by stomach acid). Some gold salts do have anti-inflammatory properties and at present two are still used as pharmaceuticals in the treatment of arthritis and other similar conditions in the US (sodium aurothiomalate and auranofin). These drugs have been explored as a means to help to reduce the pain and swelling of rheumatoid arthritis, and also (historically) against tuberculosis and some parasites.[187]
Gold alloys are used in restorative dentistry, especially in tooth restorations, such as crowns and permanent bridges. The gold alloys’ slight malleability facilitates the creation of a superior molar mating surface with other teeth and produces results that are generally more satisfactory than those produced by the creation of porcelain crowns. The use of gold crowns in more prominent teeth such as incisors is favored in some cultures and discouraged in others.
Colloidal gold preparations (suspensions of gold nanoparticles) in water are intensely red-colored, and can be made with tightly controlled particle sizes up to a few tens of nanometers across by reduction of gold chloride with citrate or ascorbate ions. Colloidal gold is used in research applications in medicine, biology and materials science. The technique of immunogold labeling exploits the ability of the gold particles to adsorb protein molecules onto their surfaces. Colloidal gold particles coated with specific antibodies can be used as probes for the presence and position of antigens on the surfaces of cells.[188] In ultrathin sections of tissues viewed by electron microscopy, the immunogold labels appear as extremely dense round spots at the position of the antigen.[189]
Gold, or alloys of gold and palladium, are applied as conductive coating to biological specimens and other non-conducting materials such as plastics and glass to be viewed in a scanning electron microscope. The coating, which is usually applied by sputtering with an argon plasma, has a triple role in this application. Gold’s very high electrical conductivity drains electrical charge to earth, and its very high density provides stopping power for electrons in the electron beam, helping to limit the depth to which the electron beam penetrates the specimen. This improves definition of the position and topography of the specimen surface and increases the spatial resolution of the image. Gold also produces a high output of secondary electrons when irradiated by an electron beam, and these low-energy electrons are the most commonly used signal source used in the scanning electron microscope.[190]
The isotope gold-198 (half-life 2.7 days) is used in nuclear medicine, in some cancer treatments and for treating other diseases.[191][192]
Cuisine
- Gold can be used in food and has the E number 175.[193] In 2016, the European Food Safety Authority published an opinion on the re-evaluation of gold as a food additive. Concerns included the possible presence of minute amounts of gold nanoparticles in the food additive, and that gold nanoparticles have been shown to be genotoxic in mammalian cells in vitro.[194]
- Gold leaf, flake or dust is used on and in some gourmet foods, notably sweets and drinks as decorative ingredient.[195] Gold flake was used by the nobility in medieval Europe as a decoration in food and drinks,[196] in the form of leaf, flakes or dust, either to demonstrate the host’s wealth or in the belief that something that valuable and rare must be beneficial for one’s health.[citation needed]
- Danziger Goldwasser (German: Gold water of Danzig) or Goldwasser (English: Goldwater) is a traditional German herbal liqueur[197] produced in what is today Gdańsk, Poland, and Schwabach, Germany, and contains flakes of gold leaf. There are also some expensive (c. $1000) cocktails which contain flakes of gold leaf. However, since metallic gold is inert to all body chemistry, it has no taste, it provides no nutrition, and it leaves the body unaltered.[198]
- Vark is a foil composed of a pure metal that is sometimes gold,[199] and is used for garnishing sweets in South Asian cuisine.
Miscellanea
- Gold produces a deep, intense red color when used as a coloring agent in cranberry glass.
- In photography, gold toners are used to shift the color of silver bromide black-and-white prints towards brown or blue tones, or to increase their stability. Used on sepia-toned prints, gold toners produce red tones. Kodak published formulas for several types of gold toners, which use gold as the chloride.[200]
- Gold is a good reflector of electromagnetic radiation such as infrared and visible light, as well as radio waves. It is used for the protective coatings on many artificial satellites, in infrared protective faceplates in thermal-protection suits and astronauts’ helmets, and in electronic warfare planes such as the EA-6B Prowler.
- Gold is used as the reflective layer on some high-end CDs.
- Automobiles may use gold for heat shielding. McLaren uses gold foil in the engine compartment of its F1 model.[201]
- Gold can be manufactured so thin that it appears semi-transparent. It is used in some aircraft cockpit windows for de-icing or anti-icing by passing electricity through it. The heat produced by the resistance of the gold is enough to prevent ice from forming.[202]
- Gold is attacked by and dissolves in alkaline solutions of potassium or sodium cyanide, to form the salt gold cyanide—a technique that has been used in extracting metallic gold from ores in the cyanide process. Gold cyanide is the electrolyte used in commercial electroplating of gold onto base metals and electroforming.
- Gold chloride (chloroauric acid) solutions are used to make colloidal gold by reduction with citrate or ascorbate ions. Gold chloride and gold oxide are used to make cranberry or red-colored glass, which, like colloidal gold suspensions, contains evenly sized spherical gold nanoparticles.[203]
- Gold, when dispersed in nanoparticles, can act as a heterogeneous catalyst of chemical reactions.
Toxicity
Pure metallic (elemental) gold is non-toxic and non-irritating when ingested[204] and is sometimes used as a food decoration in the form of gold leaf.[205] Metallic gold is also a component of the alcoholic drinks Goldschläger, Gold Strike, and Goldwasser. Metallic gold is approved as a food additive in the EU (E175 in the Codex Alimentarius). Although the gold ion is toxic, the acceptance of metallic gold as a food additive is due to its relative chemical inertness, and resistance to being corroded or transformed into soluble salts (gold compounds) by any known chemical process which would be encountered in the human body.
Soluble compounds (gold salts) such as gold chloride are toxic to the liver and kidneys. Common cyanide salts of gold such as potassium gold cyanide, used in gold electroplating, are toxic by virtue of both their cyanide and gold content. There are rare cases of lethal gold poisoning from potassium gold cyanide.[206][207] Gold toxicity can be ameliorated with chelation therapy with an agent such as dimercaprol.
Gold metal was voted Allergen of the Year in 2001 by the American Contact Dermatitis Society; gold contact allergies affect mostly women.[208] Despite this, gold is a relatively non-potent contact allergen, in comparison with metals like nickel.[209]
A sample of the fungus Aspergillus niger was found growing from gold mining solution; and was found to contain cyano metal complexes, such as gold, silver, copper, iron and zinc. The fungus also plays a role in the solubilization of heavy metal sulfides.[210]
See also
Iron pyrite or «fool’s gold»
- Bulk leach extractable gold, for sampling ores
- Chrysiasis (dermatological condition)
- Digital gold currency, form of electronic currency
- GFMS business consultancy
- Gold fingerprinting, use impurities to identify an alloy
- Gold standard in banking
- List of countries by gold production
- Tumbaga, alloy of gold and copper
- Iron pyrite, fool’s gold
- Nordic gold, non-gold copper alloy
References
- ^ «Standard Atomic Weights: Gold». CIAAW. 2017.
- ^ Mézaille, Nicolas; Avarvari, Narcis; Maigrot, Nicole; Ricard, Louis; Mathey, François; Le Floch, Pascal; Cataldo, Laurent; Berclaz, Théo; Geoffroy, Michel (1999). «Gold(I) and Gold(0) Complexes of Phosphinine‐Based Macrocycles». Angewandte Chemie International Edition. 38 (21): 3194–3197. doi:10.1002/(SICI)1521-3773(19991102)38:21<3194::AID-ANIE3194>3.0.CO;2-O. PMID 10556900.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Kelly, P. F. (2015). Properties of Materials. CRC Press. p. 355. ISBN 978-1-4822-0624-1.
- ^ Duckenfield, Mark (2016). The Monetary History of Gold: A Documentary History, 1660–1999. Routledge. p. 4. ISBN 9781315476124.
Its scarcity makes it a useful store of value; however, its relative rarity reduced its utility as a currency, especially for transactions in small denominations.
- ^ Pearce, Susan M. (1993). Museums, Objects, and Collections: A Cultural Study. Smithsonian Books. p. 53. ISBN 9781588345172.
Its scarcity makes it a useful store of value; however, its relative rarity reduced its utility as a currency, especially for transactions in small denominations. … Rarity is, nevertheless, in itself a source of value, and so is the degree of difficulty which surrounds the winning of the raw material, especially if it is exotic and has to be brought some distance. Gold is, geologically, a relatively rare material on earth and occurs only in specific places which are remote from most other places.
- ^ a b «Gold Production & Mining Data by Country».
- ^ «Above-ground stocks». gold.org. Retrieved 18 October 2021.
- ^ a b c Soos, Andy (6 January 2011). «Gold Mining Boom Increasing Mercury Pollution Risk». Advanced Media Solutions, Inc. Oilprice.com. Retrieved 26 March 2011.
- ^ a b Kizuka, Tokushi (1 April 2008). «Atomic configuration and mechanical and electrical properties of stable gold wires of single-atom width» (PDF). Physical Review B. 77 (15): 155401. Bibcode:2008PhRvB..77o5401K. doi:10.1103/PhysRevB.77.155401. hdl:2241/99261. ISSN 1098-0121. Archived (PDF) from the original on 16 July 2021.
- ^ Che Lah, Nurul Akmal; Trigueros, Sonia (2019). «Synthesis and modelling of the mechanical properties of Ag, Au and Cu nanowires». Science and Technology of Advanced Materials. 20 (1): 225–261. Bibcode:2019STAdM..20..225L. doi:10.1080/14686996.2019.1585145. PMC 6442207. PMID 30956731.
- ^ «Gold: causes of color». Retrieved 6 June 2009.
- ^ Mallan, Lloyd (1971). Suiting up for space: the evolution of the space suit. John Day Co. p. 216. ISBN 978-0-381-98150-1.
- ^ Gray, Theo (14 March 2008). «How to Make Convincing Fake-Gold Bars». Popular Science. Retrieved 18 June 2008.
- ^ Willie, Jim (18 November 2009) «Zinc Dimes, Tungsten Gold & Lost Respect Archived 8 October 2011 at the Wayback Machine». Kitco
- ^ «Largest Private Refinery Discovers Gold-Plated Tungsten Bar | Coin Update». news.coinupdate.com.
- ^ Reuters (22 December 1983). «Austrians Seize False Gold Tied to London Bullion Theft». The New York Times. Retrieved 25 March 2012.
- ^ Tungsten filled Gold bars Archived 26 March 2012 at the Wayback Machine, ABC Bullion, Thursday, 22 March 2012
- ^ Arblaster, J. W. (1995). «Osmium, the Densest Metal Known» (PDF). Platinum Metals Review. 39 (4): 164. Archived from the original (PDF) on 18 October 2016. Retrieved 14 October 2016.
- ^ Encyclopædia of Chemistry, Theoretical, Practical, and Analytical, as Applied to the Arts and Manufacturers: Glass-zinc. J.B. Lippincott & Company. 1880. pp. 70–.
- ^ «Relativity in Chemistry». Math.ucr.edu. Retrieved 5 April 2009.
- ^ Schmidbaur, Hubert; Cronje, Stephanie; Djordjevic, Bratislav; Schuster, Oliver (2005). «Understanding gold chemistry through relativity». Chemical Physics. 311 (1–2): 151–161. Bibcode:2005CP….311..151S. doi:10.1016/j.chemphys.2004.09.023.
- ^ a b c d Jewellery Alloys. World Gold Council
- ^ Electron Microscopy in Microbiology. Academic Press. 1988. ISBN 978-0-08-086049-7.
- ^ «Nudat 2». National Nuclear Data Center. Retrieved 12 April 2012.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Miethe, A. (1924). «Der Zerfall des Quecksilberatoms». Die Naturwissenschaften. 12 (29): 597–598. Bibcode:1924NW…..12..597M. doi:10.1007/BF01505547. S2CID 35613814.
- ^ Sherr, R.; Bainbridge, K. T. & Anderson, H. H. (1941). «Transmutation of Mercury by Fast Neutrons». Physical Review. 60 (7): 473–479. Bibcode:1941PhRv…60..473S. doi:10.1103/PhysRev.60.473.
- ^
Aleklett, K.; Morrissey, D.; Loveland, W.; McGaughey, P.; Seaborg, G. (1981). «Energy dependence of 209Bi fragmentation in relativistic nuclear collisions». Physical Review C. 23 (3): 1044. Bibcode:1981PhRvC..23.1044A. doi:10.1103/PhysRevC.23.1044. - ^ Matthews, Robert (2 December 2001). «The Philosopher’s Stone». The Daily Telegraph. Retrieved 22 September 2020.
- ^ Shipman, James; Wilson, Jerry D.; Higgins, Charles A. (2012). An Introduction to Physical Science (13th ed.). Cengage Learning. p. 273. ISBN 9781133709497.
- ^ Hammer, B.; Norskov, J. K. (1995). «Why gold is the noblest of all the metals». Nature. 376 (6537): 238–240. Bibcode:1995Natur.376..238H. doi:10.1038/376238a0. S2CID 4334587.
- ^ Johnson, P. B.; Christy, R. W. (1972). «Optical Constants of the Noble Metals». Physical Review B. 6 (12): 4370–4379. Bibcode:1972PhRvB…6.4370J. doi:10.1103/PhysRevB.6.4370.
- ^ Shaw III, C. F. (1999). «Gold-Based Medicinal Agents». Chemical Reviews. 99 (9): 2589–2600. doi:10.1021/cr980431o. PMID 11749494.
- ^ «Chemistry of Oxygen». Chemwiki UC Davis. 2 October 2013. Retrieved 1 May 2016.
- ^ Craig, B. D.; Anderson, D. B., eds. (1995). Handbook of Corrosion Data. Materials Park, Ohio: ASM International. p. 587. ISBN 978-0-87170-518-1.
- ^ Wiberg, Egon; Wiberg, Nils & Holleman, Arnold Frederick (2001). Inorganic Chemistry (101st ed.). Academic Press. p. 1286. ISBN 978-0-12-352651-9.
- ^ Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry. Academic Press. p. 404. ISBN 978-0-12-352651-9.
- ^ Wiberg, Wiberg & Holleman 2001, pp. 1286–1287
- ^ a b Emery, J. F.; Ledditcotte, G. W. (May 1961). «Nuclear Science Series (NAS-NS 3036) The Radio Chemistry of Gold» (PDF). Oak Ridge, TN: National Academy of Sciences — National Research Council — Subcommittee on Radio Chemistry. US Atomic Energy Commission. Archived (PDF) from the original on 10 November 2004. Retrieved 24 February 2021.
- ^ Jansen, Martin (2005). «Effects of relativistic motion of electrons on the chemistry of gold and platinum». Solid State Sciences. 7 (12): 1464–1474. Bibcode:2005SSSci…7.1464J. doi:10.1016/j.solidstatesciences.2005.06.015.
- ^ a b Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ a b Jansen, Martin (2008). «The chemistry of gold as an anion». Chemical Society Reviews. 37 (9): 1826–1835. doi:10.1039/b708844m. PMID 18762832.
- ^ Jung, Jaehoon; Kim, Hyemi; Kim, Jong Chan; Park, Min Hee; Han, Young-Kyu (2011). «Gold Behaves as Hydrogen in the Intermolecular Self-Interaction of Metal Aurides MAu4 (M=Ti, Zr, and Hf)». Chemistry: An Asian Journal. 6 (3): 868–872. doi:10.1002/asia.201000742. PMID 21225974.
- ^ Wickleder, Mathias S. (2001). «AuSO4: A True Gold(II) Sulfate with an Au24+ Ion». Journal of Inorganic and General Chemistry. 627 (9): 2112–2114. doi:10.1002/1521-3749(200109)627:9<2112::AID-ZAAC2112>3.0.CO;2-2.
- ^ Wickleder, Mathias S. (2007). Devillanova, Francesco A. (ed.). Handbook of chalcogen chemistry: new perspectives in sulfur, selenium and tellurium. Royal Society of Chemistry. pp. 359–361. ISBN 978-0-85404-366-8.
- ^ Seidel, S.; Seppelt, K. (2000). «Xenon as a Complex Ligand: The Tetra Xenono Gold(II) Cation in AuXe42+(Sb2F11−)2«. Science. 290 (5489): 117–118. Bibcode:2000Sci…290..117S. doi:10.1126/science.290.5489.117. PMID 11021792.
- ^ Riedel, S.; Kaupp, M. (2006). «Revising the Highest Oxidation States of the 5d Elements: The Case of Iridium(+VII)». Angewandte Chemie International Edition. 45 (22): 3708–3711. doi:10.1002/anie.200600274. PMID 16639770.
- ^ «Earth’s Gold Came from Colliding Dead Stars». David A. Aguilar & Christine Pulliam. cfa.harvard.edu. 17 July 2013. Retrieved 18 February 2018.
- ^ Seeger, Philip A.; Fowler, William A.; Clayton, Donald D. (1965). «Nucleosynthesis of Heavy Elements by Neutron Capture». The Astrophysical Journal Supplement Series. 11: 121. Bibcode:1965ApJS…11..121S. doi:10.1086/190111.
- ^ «Supernovas & Supernova Remnants». Chandra X-ray Observatory. Retrieved 28 February 2014.
- ^ Berger, E.; Fong, W.; Chornock, R. (2013). «An r-process Kilonova Associated with the Short-hard GRB 130603B». The Astrophysical Journal Letters. 774 (2): 4. arXiv:1306.3960. Bibcode:2013ApJ…774L..23B. doi:10.1088/2041-8205/774/2/L23. S2CID 669927.
- ^ «we have no spectroscopic evidence that [such] elements have truly been produced,» wrote author Stephan Rosswog.Rosswog, Stephan (29 August 2013). «Astrophysics: Radioactive glow as a smoking gun». Nature. 500 (7464): 535–536. Bibcode:2013Natur.500..535R. doi:10.1038/500535a. PMID 23985867. S2CID 4401544.
- ^ «LIGO and Virgo make first detection of gravitational waves produced by colliding neutron stars» (PDF). LIGO & Virgo collaborations. 16 October 2017. Archived (PDF) from the original on 31 October 2017. Retrieved 15 February 2018.
- ^ «Neutron star mergers may create much of the universe’s gold». Sid Perkins. Science AAAS. 20 March 2018. Retrieved 24 March 2018.
- ^ Willbold, Matthias; Elliott, Tim; Moorbath, Stephen (2011). «The tungsten isotopic composition of the Earth’s mantle before the terminal bombardment». Nature. 477 (7363): 195–8. Bibcode:2011Natur.477..195W. doi:10.1038/nature10399. PMID 21901010. S2CID 4419046.
- ^ Battison, Leila (8 September 2011). «Meteorites delivered gold to Earth». BBC.
- ^ «Mangalisa Project». Superior Mining International Corporation. Retrieved 29 December 2014.
- ^ Therriault, A. M.; Grieve, R. A. F. & Reimold, W. U. (1997). «Original size of the Vredefort Structure: Implications for the geological evolution of the Witwatersrand Basin». Meteoritics. 32: 71–77. Bibcode:1997M&PS…32…71T. doi:10.1111/j.1945-5100.1997.tb01242.x.
- ^ Meteor craters may hold untapped wealth. Cosmos Magazine (28 July 2008). Retrieved on 12 September 2013.
- ^ Corner, B.; Durrheim, R. J.; Nicolaysen, L. O. (1990). «Relationships between the Vredefort structure and the Witwatersrand basin within the tectonic framework of the Kaapvaal craton as interpreted from regional gravity and aeromagnetic data». Tectonophysics. 171 (1): 49–61. Bibcode:1990Tectp.171…49C. doi:10.1016/0040-1951(90)90089-Q.
- ^ a b McCarthy, T., Rubridge, B. (2005). The Story of Earth and Life. Struik Publishers, Cape Town. pp. 89–90, 102–107, 134–136. ISBN 1 77007 148 2
- ^ a b Norman, N., Whitfield, G. (2006) Geological Journeys. Struik Publishers, Cape Town. pp. 38–49, 60–61. ISBN 9781770070622
- ^ University of Granada (21 November 2017). «Scientists reveals the mystery about the origin of gold». ScienceDaily. Retrieved 27 March 2018.
- ^ Tassara, Santiago; González-Jiménez, José M.; Reich, Martin; Schilling, Manuel E.; Morata, Diego; Begg, Graham; Saunders, Edward; Griffin, William L.; O’Reilly, Suzanne Y.; Grégoire, Michel; Barra, Fernando; Corgne, Alexandre (2017). «Plume-subduction interaction forms large auriferous provinces». Nature Communications. 8 (1): 843. Bibcode:2017NatCo…8..843T. doi:10.1038/s41467-017-00821-z. ISSN 2041-1723. PMC 5634996. PMID 29018198.
- ^ a b c La Niece, Susan (senior metallurgist in the British Museum Department of Conservation and Scientific Research) (15 December 2009). Gold. Harvard University Press. p. 10. ISBN 978-0-674-03590-4. Retrieved 10 April 2012.
- ^ Heike, Brian. «Formation of Lode Gold Deposits». Arizona Gold Prospectors. Archived from the original on 22 January 2013. Retrieved 24 February 2021.
- ^ «Environment & Nature News – Bugs grow gold that looks like coral». abc.net.au. 28 January 2004. Retrieved 22 July 2006. This is doctoral research undertaken by Frank Reith at the Australian National University, published 2004.
- ^ «Earthquakes Turn Water into Gold|18 March 2013». Retrieved 18 March 2013.
- ^ Kenison Falkner, K.; Edmond, J. (1990). «Gold in seawater». Earth and Planetary Science Letters. 98 (2): 208–221. Bibcode:1990E&PSL..98..208K. doi:10.1016/0012-821X(90)90060-B.
- ^ Plazak, Dan A Hole in the Ground with a Liar at the Top (Salt Lake: Univ. of Utah Press, 2006) ISBN 0-87480-840-5 (contains a chapter on gold-from seawater swindles)
- ^ Haber, F. (1927). «Das Gold im Meerwasser». Zeitschrift für Angewandte Chemie. 40 (11): 303–314. Bibcode:1927AngCh..40..303H. doi:10.1002/ange.19270401103.
- ^ McHugh, J. B. (1988). «Concentration of gold in natural waters». Journal of Geochemical Exploration. 30 (1–3): 85–94. doi:10.1016/0375-6742(88)90051-9. Archived from the original on 7 March 2020.
- ^ «Furthermore the second member of Delegation XVIII is carrying four small but evidently heavy jars on a yoke, probably containing the gold dust which was the tribute paid by the Indians.» in Iran, Délégation archéologique française en (1972). Cahiers de la Délégation archéologique française en Iran. Institut français de recherches en Iran (section archéologique). p. 146.
- ^ «History of Gold». Gold Digest. Retrieved 4 February 2007.
- ^ «Mystery of the Varna Gold: What Caused These Ancient Societies to Disappear?».
- ^ [1] Archived 1 November 2022 at the Wayback Machine Gems and Gemstones: Timeless Natural Beauty of the Mineral World, By Lance Grande
- ^ «World’s Oldest Gold Object May Have Just Been Unearthed in Bulgaria».
- ^ «Archaeologists have discovered the oldest treasure in the world — Afrinik».
- ^ Sutherland, C.H.V, Gold (London, Thames & Hudson, 1959) p 27 ff.
- ^ Gopher, A.; Tsuk, T.; Shalev, S. & Gophna, R. (August–October 1990). «Earliest Gold Artifacts in the Levant». Current Anthropology. 31 (4): 436–443. doi:10.1086/203868. JSTOR 2743275. S2CID 143173212.
- ^ Pohl, Walter L. (2011) Economic Geology Principles and Practice. Wiley. p. 208. doi:10.1002/9781444394870.ch2. ISBN 9781444394870
- ^ Montserrat, Dominic (21 February 2003). Akhenaten: History, Fantasy and Ancient Egypt. ISBN 978-0-415-30186-2.
- ^ Moran, William L., 1987, 1992. The Amarna Letters, pp. 43–46.
- ^ Moran, William L. 1987, 1992. The Amarna Letters. EA 245, «To the Queen Mother: Some Missing Gold Statues», pp. 84–86.
- ^ «Akhenaten» Archived 11 June 2008 at the Wayback Machine. Encyclopaedia Britannica
- ^ Dodson, Aidan and Hilton, Dyan (2004). The Complete Royal Families of Ancient Egypt. Thames & Hudson. ISBN 0-500-05128-3
- ^ a b «A Case for the World’s Oldest Coin: Lydian Lion». Rg.ancients.info. 2 October 2003. Retrieved 27 October 2013.
- ^ Mansa Musa. Black History Pages
- ^ «Kingdom of Mali – Primary Source Documents». African studies Center. Boston University. Retrieved 30 January 2012.
- ^ Monnaie, Eucratide I. (roi de Bactriane) Autorité émettrice de. [Monnaie : 20 Statères, Or, Incertain, Bactriane, Eucratide I].
- ^ Berdan, Frances; Anawalt, Patricia Rieff (1992). The Codex Mendoza. Vol. 2. University of California Press. p. 151. ISBN 978-0-520-06234-4.
- ^ Sierra Nevada Virtual Museum. Sierra Nevada Virtual Museum. Retrieved on 4 May 2012.
- ^ Anderson, James Maxwell (2000). The History of Portugal. Greenwood Publishing Group. ISBN 0-313-31106-4.
- ^ Newitt, Malyn (28 June 2010). The Portuguese in West Africa, 1415–1670: A Documentary History. Cambridge University Press. ISBN 978-1-139-49129-7.
- ^ Green, Toby (31 January 2019). A fistful of shells : West Africa from the rise of the slave trade to the age of revolution (Penguin Books Ltd. Kindle-Version ed.). London. pp. 108, 247. ISBN 978-0-241-00328-2.
- ^ Edgerton, Robert B. (2010). The Fall of the Asante Empire: The Hundred-Year War For Africa’s Gold Coast. ISBN 9781451603736.
- ^ Matson, John (31 January 2014). «Fact or Fiction?: Lead Can Be Turned into Gold». scientificamerican.com. Retrieved 21 November 2021.
- ^ Harper, Douglas. «gold». Online Etymology Dictionary.
- ^ Hesse, R W. (2007) Jewelrymaking Through History: An Encyclopedia Archived 1 November 2022 at the Wayback Machine, Greenwood Publishing Group. ISBN 0313335079
- ^ Notre Dame University Latin Dictionary Archived 5 February 2016 at the Wayback Machine Retrieved 7 June 2012
- ^ de Vaan, Michel (2008). Etymological Dictionary of Latin and the other Italic languages. Leiden: Boston: Brill. p. 63. ISBN 978-90-04-16797-1.
- ^ Christie, A and Brathwaite, R. (Last updated 2 November 2011) Mineral Commodity Report 14 — Gold, Institute of geological and Nuclear sciences Ltd – Retrieved 7 June 2012
- ^ H. G. Bachmann, The lure of gold : an artistic and cultural history (2006).
- ^ Lubna Umar and Sarwet Rasul, «Critical Metaphor Analysis: Nawaz Sharif and the Myth of a Golden Time» NUML Journal of Critical Inquiry 15#2, (Dec 2017): 78-102.
- ^ Alborn, Timothy (2017). «The Greatest Metaphor Ever Mixed: Gold in the British Bible, 1750–1850». Journal of the History of Ideas. 78 (3): 427–447. doi:10.1353/jhi.2017.0024. PMID 28757488. S2CID 27312741.
- ^ Moors, Annelies (2013). «Wearing gold, owning gold: the multiple meanings of gold jewelry». Etnofoor. 25 (1): 78–89. ISSN 0921-5158. OCLC 858949147.
- ^ Boulanouar, Aisha Wood (2011). Myths and Reality: Meaning in Moroccan Muslim Women’s Dress (Thesis, Doctor of Philosophy). University of Otago. CiteSeerX 10.1.1.832.2031. hdl:10523/1748.
- ^ Poonai, Anand (2015). «Islamic Male Clothing». Who We Are & What We Wear. Retrieved 17 June 2020.
- ^ Aziz, Rookhsana (November 2010). «Hijab – The Islamic Dress Code: Its historical development, evidence from sacred sources and views of selected Muslim scholars». UNISA EDT (Electronic Theses and Dissertations) (Thesis, Master of Arts). University of South Africa. CiteSeerX 10.1.1.873.8651. hdl:10500/4888.
- ^ Toronto, James A. (1 October 2001). «Many Voices, One Umma: Sociopolitical Debate in the Muslim Community». BYU Studies Quarterly. 40 (4): 29–50.
- ^ Jirousek, Charlotte (2004). «Islamic Clothing». Encyclopedia of Islam. Retrieved 17 June 2020.
- ^ Omar, Sara (28 March 2014). «Dress». The Encyclopedia of Islam and Law, Oxford Islamic Studies Online.[permanent dead link]
- ^ Daly, Kathleen N.; Rengel, Marian (1992). Greek and Roman Mythology, A to Z. Chelsea House Publishers. p. 153. ISBN 978-1-60413-412-4.
- ^ Bernstein, Peter L. (2004). The Power of Gold: The History of an Obsession. John Wiley & Sons. p. 1. ISBN 978-0-471-43659-1.
- ^ «Israeli dig unearths large trove of early Islamic gold coins». Associated Press. Retrieved 24 August 2020.
- ^ Munteen, John L.; Davis, David A.; Ayling, Bridget (2017). The Nevada Mineral Industry 2016 (PDF) (Report). University of Nevada, Reno. OCLC 1061602920. Archived from the original (PDF) on 9 February 2019. Retrieved 9 February 2019.
- ^ Mandaro, Laura (17 January 2008). «China now world’s largest gold producer; foreign miners at door». MarketWatch. Retrieved 5 April 2009.
- ^ Fritz, Morgane; McQuilken, James; Collins, Nina; Weldegiorgis, Fitsum (January 2018). «Global Trends in Artisanal and Small-Scale Mining (ASM): A review of key numbers and issues» (PDF) (Report). Winnipeg Canada: International Institute for Sustainable Development. Retrieved 24 February 2021 – via Intergovernmental Forum on Mining, Minerals, Metals and Sustainable Development.
- ^ Reuters Staff (15 January 2020). «What is artisanal gold and why is it booming?». reuters.com. Rueters. Retrieved 24 February 2021.
- ^ Beinhoff, Christian. «Removal of Barriers to the Abatement of Global Mercury Pollution from Artisanal Gold Mining» (PDF) (Report). Archived from the original (PDF) on 26 January 2016. Retrieved 29 December 2014.
- ^ a b c Truswell, J.F. (1977). The Geological Evolution of South Africa. pp. 21–28. Purnell, Cape Town. ISBN 9780360002906
- ^ Moore, Mark A. (2006). «Reed Gold Mine State Historic Site». North Carolina Office of Archives and History. Archived from the original on 15 January 2012. Retrieved 13 December 2008.
- ^ Garvey, Jane A. (2006). «Road to adventure». Georgia Magazine. Archived from the original on 2 March 2007. Retrieved 23 January 2007.
- ^ «Grasberg Open Pit, Indonesia». Mining Technology. Retrieved 16 October 2017.
- ^ O’Connell, Rhona (13 April 2007). «Gold mine production costs up by 17% in 2006 while output fell». Archived from the original on 6 October 2014.
- ^ Noyes, Robert (1993). Pollution prevention technology handbook. William Andrew. p. 342. ISBN 978-0-8155-1311-7.
- ^ Pletcher, Derek & Walsh, Frank (1990). Industrial electrochemistry. Springer. p. 244. ISBN 978-0-412-30410-1.
- ^ Marczenko, Zygmunt & Balcerzak, María (2000). Separation, preconcentration, and spectrophotometry in inorganic analysis. Elsevier. p. 210. ISBN 978-0-444-50524-8.
- ^ Baraniuk, Chris (27 October 2020). «Why it’s getting harder to mine gold». BBC. Retrieved 29 October 2020.
- ^ Paton, Elizabeth (23 April 2021). «Does Recycled Gold Herald a Greener Future for Jewelry?». The New York Times. ISSN 0362-4331. Archived from the original on 28 December 2021. Retrieved 17 May 2021.
- ^ «Gold jewellery consumption by country». Reuters. 28 February 2011. Archived from the original on 12 January 2012.
- ^ «Gold Demand Trends | Investment | World Gold Council». Gold.org. Retrieved 12 September 2013.
- ^ «Gold Demand Trends». 12 November 2015.
- ^ «Country wise gold demand». Retrieved 2 October 2015.
- ^ Harjani, Ansuya (18 February 2014). «It’s official: China overtakes India as top consumer of gold». CNBC. Retrieved 2 July 2014.
- ^ Abdul-Wahab, Sabah Ahmed; Ameer, Marikar, Fouzul (24 October 2011). «The environmental impact of gold mines: pollution by heavy metals». Central European Journal of Engineering. 2 (2): 304–313. Bibcode:2012CEJE….2..304A. doi:10.2478/s13531-011-0052-3. S2CID 3916088.
- ^ Summit declaration, Peoples’ Gold summit, San Juan Ridge, California in June 1999 Archived 25 March 2020 at the Wayback Machine. Scribd.com (22 February 2012). Retrieved on 4 May 2012.
- ^ Cyanide spills from gold mine compared to Chernobyls nuclear disaster Archived 14 July 2018 at the Wayback Machine. Deseretnews.com (14 February 2000). Retrieved on 4 May 2012.
- ^ Death of a river Archived 9 January 2009 at the Wayback Machine. BBC News (15 February 2000). Retrieved on 4 May 2012.
- ^ Cyanide spill second only to Chernobyl Archived 25 May 2017 at the Wayback Machine. Abc.net.au. 11 February 2000. Retrieved on 4 May 2012.
- ^ a b Behind gold’s glitter, torn lands and pointed questions Archived 8 April 2015 at the Wayback Machine, The New York Times, 24 October 2005
- ^ «Pollution from Artisanal Gold Mining, Blacksmith Institute Report 2012» (PDF). Archived (PDF) from the original on 2 April 2015. Retrieved 22 September 2015.
- ^ Wroblewski, William (12 January 2022). «‘Babies here are born sick’: are Bolivia’s gold mines poisoning its indigenous people?». The Guardian. Retrieved 12 January 2022.
- ^ Norgate, Terry; Haque, Nawshad (2012). «Using life cycle assessment to evaluate some environmental impacts of gold». Journal of Cleaner Production. 29–30: 53–63. doi:10.1016/j.jclepro.2012.01.042.
- ^ Rothbard, Murray N. (2009). Man, Economy, and State, Scholar’s Edition. Ludwig von Mises Institute. ISBN 978-1-933550-99-2.
- ^ Seltman, C. T. (1924). Athens, Its History and Coinage Before the Persian Invasion. ISBN 978-0-87184-308-1. Retrieved 4 June 2012.
- ^ Postan, M. M.; Miller, E. (1967). The Cambridge Economic History of Europe: Trade and industry in the Middle Ages. Cambridge University Press, 28 August 1987. ISBN 978-0-521-08709-4.
- ^ «Swiss Narrowly Vote to Drop Gold Standard». The New York Times. 19 April 1999. Retrieved 1 July 2022.
- ^ King, Byron (20 July 2009). «Gold mining decline». BullionVault.com. Archived from the original on 15 May 2016. Retrieved 23 November 2009.
- ^ Lawrence, Thomas Edward (1948). The Mint: A Day-book of the R.A.F. Depot Between August and December 1922, with Later Notes. p. 103.
- ^ Tucker, George (1839). The theory of money and banks investigated. C. C. Little and J. Brown.
- ^ «Currency codes – ISO 4217». International Organization for Standardization. Retrieved 25 December 2014.
- ^ Valenta, Philip (22 June 2018). «On hedging inflation with gold». Medium. Retrieved 30 November 2018.
- ^ «The Ever Popular Krugerrand». americansilvereagletoday.com. 2010. Archived from the original on 3 February 2011. Retrieved 30 August 2011.
- ^ «What Are the Different Purities of Sovereign Gold Coins?». goldsilver.com. Retrieved 29 March 2021.
- ^ Warwick-Ching, Tony (28 February 1993). The International Gold Trade. p. 26. ISBN 978-1-85573-072-4.
- ^ Elwell, Craig K. (2011). Brief History of the Gold Standard (GS) in the United States. pp. 11–13. ISBN 978-1-4379-8889-5.
- ^ Hitzer, Eckhard; Perwass, Christian (22 November 2006). «The hidden beauty of gold» (PDF). Proceedings of the International Symposium on Advanced Mechanical and Power Engineering 2007 (ISAMPE 2007) between Pukyong National University (Korea), University of Fukui (Japan) and University of Shanghai for Science and Technology (China), 22–25 November 2006, hosted by the University of Fukui (Japan), pp. 157–167. (Figs 15,16,17,23 revised.). Archived from the original (PDF) on 27 January 2012. Retrieved 10 May 2011.
- ^ «World Gold Council > value > research & statistics > statistics > supply and demand statistics». Archived from the original on 19 July 2006. Retrieved 22 July 2006.
- ^ «historical charts:gold – 1833–1999 yearly averages». kitco. Retrieved 30 June 2012.
- ^ Kitco.com Archived 14 July 2018 at the Wayback Machine, Gold – London PM Fix 1975 – present (GIF), Retrieved 22 July 2006.
- ^ a b «LBMA statistics». Lbma.org.uk. 31 December 2008. Archived from the original on 10 February 2009. Retrieved 5 April 2009.
- ^ «Gold hits yet another record high». BBC News. 2 December 2009. Retrieved 6 December 2009.
- ^ «PRECIOUS METALS: Comex Gold Hits All-Time High». The Wall Street Journal. 11 May 2012. Retrieved 4 August 2010.[dead link]
- ^ Gibson, Kate; Chang, Sue (11 May 2010). «Gold futures hit closing record as investors fret rescue deal». MarketWatch. Retrieved 4 August 2010.
- ^ Valetkevitch, Caroline (1 March 2011). «Gold hits record, oil jumps with Libya unrest». Reuters. Archived from the original on 15 October 2015. Retrieved 1 March 2011.
- ^ Sim, Glenys (23 August 2011). «Gold Extends Biggest Decline in 18 Months After CME Raises Futures Margins». www.bloomberg.com. Archived from the original on 10 January 2014. Retrieved 24 February 2021.
- ^ «Financial Planning|Gold starts 2006 well, but this is not a 25-year high!». Ameinfo.com. Archived from the original on 21 April 2009. Retrieved 5 April 2009.
- ^ Mandruzzato, GianLuigi (14 October 2020). «Gold, monetary policy and the US dollar».
- ^ a b «Historical Gold Intraday Futures Data (GCA)». PortaraCQG. Retrieved 28 April 2022.
- ^ «Troy Ounce». Investopedia. Retrieved 28 April 2022.
- ^ Berners-Price, Susan J. (2011) [2011]. «Gold-Based Therapeutic Agents: A New Perspective». In Alessio, E. (ed.). Bioinorganic Medicinal Chemistry. Weinheim: Wiley-VCH Verlag GmbH. pp. 197–221. doi:10.1002/9783527633104.ch7. ISBN 9783527633104.
- ^ Casini, Angela; Wai-Yin-Sun, Raymond; Ott, Ingo (2018). «Chapter 7. Medicinal Chemistry of Gold Anticancer Metallodrugs». In Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland K. O. (eds.). Metallo-Drugs:Development and Action of Anticancer Agents. Metal Ions in Life Sciences. Vol. 18. pp. 199–217. doi:10.1515/9783110470734-013. ISBN 9783110470734. PMID 29394026.
- ^ Revere, Alan (1 May 1991). Professional goldsmithing: a contemporary guide to traditional jewelry techniques. Van Nostrand Reinhold. ISBN 978-0-442-23898-8.
- ^ Uses of gold Archived 4 November 2014 at archive.today Accessed 4 November 2014
- ^ Krech III, Shepard; Merchant, Carolyn; McNeill, John Robert, eds. (2004). Encyclopedia of World Environmental History. Vol. 2: F–N. Routledge. pp. 597–. ISBN 978-0-415-93734-4.
- ^ «General Electric Contact Materials». Electrical Contact Catalog (Material Catalog). Tanaka Precious Metals. 2005. Archived from the original on 3 March 2001. Retrieved 21 February 2007.
- ^ Fulay, Pradeep; Lee, Jung-Kun (2016). Electronic, Magnetic, and Optical Materials, Second Edition. CRC Press. ISBN 978-1-4987-0173-0.
- ^ Peckham, James (23 August 2016). «Japan wants citizens to donate their old phone to make 2020 Olympics medals». TechRadar.
- ^ Kean, W. F.; Kean, I. R. L. (2008). «Clinical pharmacology of gold». Inflammopharmacology. 16 (3): 112–25. doi:10.1007/s10787-007-0021-x. PMID 18523733. S2CID 808858.
- ^ Moir, David Macbeth (1831). Outlines of the ancient history of medicine. William Blackwood. p. 225.
- ^ Mortier, Tom. An experimental study on the preparation of gold nanoparticles and their properties Archived 5 October 2013 at the Wayback Machine, PhD thesis, University of Leuven (May 2006)
- ^ Richards, Douglas G.; McMillin, David L.; Mein, Eric A. & Nelson, Carl D. (January 2002). «Gold and its relationship to neurological/glandular conditions». The International Journal of Neuroscience. 112 (1): 31–53. doi:10.1080/00207450212018. PMID 12152404. S2CID 41188687.
- ^ Merchant, B. (1998). «Gold, the Noble Metal and the Paradoxes of its Toxicology». Biologicals. 26 (1): 49–59. doi:10.1006/biol.1997.0123. PMID 9637749.
- ^ Messori, L.; Marcon, G. (2004). «Gold Complexes in the treatment of Rheumatoid Arthritis». In Sigel, Astrid (ed.). Metal ions and their complexes in medication. CRC Press. pp. 280–301. ISBN 978-0-8247-5351-1.
- ^ Faulk, W. P.; Taylor, G. M. (1971). «An immunocolloid method for the electron microscope». Immunochemistry. 8 (11): 1081–3. doi:10.1016/0019-2791(71)90496-4. PMID 4110101.
- ^ Roth, J.; Bendayan, M.; Orci, L. (1980). «FITC-protein A-gold complex for light and electron microscopic immunocytochemistry». Journal of Histochemistry and Cytochemistry. 28 (1): 55–7. doi:10.1177/28.1.6153194. PMID 6153194.
- ^ Bozzola, John J. & Russell, Lonnie Dee (1999). Electron microscopy: principles and techniques for biologists. Jones & Bartlett Learning. p. 65. ISBN 978-0-7637-0192-5.
- ^ «Nanoscience and Nanotechnology in Nanomedicine: Hybrid Nanoparticles In Imaging and Therapy of Prostate Cancer». Radiopharmaceutical Sciences Institute, University of Missouri-Columbia. Archived from the original on 14 March 2009.
- ^ Hainfeld, James F.; Dilmanian, F. Avraham; Slatkin, Daniel N.; Smilowitz, Henry M. (2008). «Radiotherapy enhancement with gold nanoparticles». Journal of Pharmacy and Pharmacology. 60 (8): 977–85. doi:10.1211/jpp.60.8.0005. PMID 18644191. S2CID 32861131.
- ^ «Current EU approved additives and their E Numbers». Food Standards Agency, UK. 27 July 2007.
- ^ «Scientific Opinion on the re-evaluation of gold (E 175) as a food additive». EFSA Journal. 14 (1): 4362. 2016. doi:10.2903/j.efsa.2016.4362. ISSN 1831-4732.
- ^ «The Food Dictionary: Varak». Barron’s Educational Services, Inc. 1995. Archived from the original on 23 May 2006. Retrieved 27 May 2007.
- ^ Kerner, Susanne; Chou, Cynthia; Warmind, Morten (2015). Commensality: From Everyday Food to Feast. Bloomsbury Publishing. p. 94. ISBN 978-0-85785-719-4.
- ^ Baedeker, Karl (1865). «Danzig». Deutschland nebst Theilen der angrenzenden Länder (in German). Karl Baedeker.
- ^ King, Hobart M. «The Many Uses of Gold». geology.com. Retrieved 6 June 2009.
- ^ Gold in Gastronomy Archived 4 March 2016 at the Wayback Machine. deLafee, Switzerland (2008)
- ^ Toning black-and-white materials. Kodak Technical Data/Reference sheet G-23, May 2006.
- ^ Martin, Keith. 1997 McLaren F1.
- ^ «The Demand for Gold by Industry» (PDF). Gold bulletin. Archived from the original (PDF) on 26 July 2011. Retrieved 6 June 2009.
- ^ «Colored glass chemistry». Retrieved 6 June 2009.
- ^ Dierks, S. (May 2005). «Gold MSDS». Electronic Space Products International. Archived from the original on 10 November 2006. Retrieved 21 December 2021.
- ^ Louis, Catherine; Pluchery, Olivier (2012). Gold Nanoparticles for Physics, Chemistry and Biology. World Scientific. ISBN 978-1-84816-807-7.
- ^ Wright, I. H.; Vesey, J. C. (1986). «Acute poisoning with gold cyanide». Anaesthesia. 41 (79): 936–939. doi:10.1111/j.1365-2044.1986.tb12920.x. PMID 3022615. S2CID 32434351.
- ^ Wu, Ming-Ling; Tsai, Wei-Jen; Ger, Jiin; Deng, Jou-Fang; Tsay, Shyh-Haw; et al. (2001). «Cholestatic Hepatitis Caused by Acute Gold Potassium Cyanide Poisoning». Clinical Toxicology. 39 (7): 739–743. doi:10.1081/CLT-100108516. PMID 11778673. S2CID 44722156.
- ^ Tsuruta, Kyoko; Matsunaga, Kayoko; Suzuki, Kayoko; Suzuki, Rie; Akita, Hirotaka; Washimi, Yasuko; Tomitaka, Akiko; Ueda, Hiroshi (2001). «Female predominance of gold allergy». Contact Dermatitis. 44 (1): 48–49. doi:10.1034/j.1600-0536.2001.440107-22.x. PMID 11156030. S2CID 42268840.
- ^ Brunk, Doug (15 February 2008). «Ubiquitous nickel wins skin contact allergy award for 2008». Archived from the original on 24 June 2011.
- ^ Singh, Harbhajan (2006). Mycoremediation: Fungal Bioremediation. p. 509. ISBN 978-0-470-05058-3.
Further reading
- Bachmann, H. G. The lure of gold : an artistic and cultural history (2006) online
- Bernstein, Peter L. The Power of Gold: The History of an Obsession (2000) online
- Brands, H.W. The Age of Gold: The California Gold Rush and the New American Dream (2003) excerpt
- Buranelli, Vincent. Gold : an illustrated history (1979) online’ wide-ranging popular history
- Cassel, Gustav. «The restoration of the gold standard.» Economica 9 (1923): 171–185. online
- Eichengreen, Barry. Golden Fetters: The Gold Standard and the Great Depression, 1919–1939 (Oxford UP, 1992).
- Ferguson, Niall. The Ascent of Money — Financial History of the World (2009) online
- Hart, Matthew, Gold: The Race for the World’s Most Seductive Metal Gold : the race for the world’s most seductive metal», New York: Simon & Schuster, 2013. ISBN 9781451650020
- Johnson, Harry G. «The gold rush of 1968 in retrospect and prospect». American Economic Review 59.2 (1969): 344–348. online
- Kwarteng, Kwasi. War and Gold: A Five-Hundred-Year History of Empires, Adventures, and Debt (2014) online
- Vilar, Pierre. A History of Gold and Money, 1450–1920 (1960). online
- Vilches, Elvira. New World Gold: Cultural Anxiety and Monetary Disorder in Early Modern Spain (2010).
External links
Wikiquote has quotations related to Gold.
Wikimedia Commons has media related to Gold.
Look up gold in Wiktionary, the free dictionary.
- «Gold» . Encyclopædia Britannica. Vol. 11 (11th ed.). 1911.
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry’s Chemistry World: Gold www.rsc.org
- Gold at The Periodic Table of Videos (University of Nottingham)
- Getting Gold 1898 book, www.lateralscience.co.uk
- Technical Document on Extraction and Mining of Gold at the Wayback Machine (archived 7 March 2008), www.epa.gov
- Gold element information — rsc.org
Золото (Au, от латинского Aurum) — химический элемент, который находится в I группе Таблицы Менделеева, входит в группу благородных металлов. К этой группе, помимо золота, относятся также серебро, платина, рутений, родий, палладий, осмий, иридий и иногда рений. Это название вышеперечисленные металлы получили благодаря высокой химической стойкости. Золото очень ценится во всем мире ещё с самых древних времен. О его особой ценности говорит тот факт, что любой средневековый алхимик считал целью своей жизни получить золото из других веществ, чаще всего в качестве исходного использовалась ртуть. Существуют легенды, что некоторым, таким как Николя Фламель, это даже удалось.
Золото и его история
Невероятно, но золото — самый первый металл который узнало человечество! Его открытие датируется эпохой неолита, т.е. примерно 11000 лет назад! Золото широко использовалось во всех древнейших цивилизациях, его называли “царем металлов” и обозначали тем же иероглифом, что и солнце. Существуют археологические находки золотых украшений, которые были изготовлены в третьем тысячелетии до н. э.
Вся история человечества находится в тесной связи с золотом. Подавляющее большинство войн до начала применения нефти велось именно из-за этого благородного металла. Как метко подметил Гёте в своем “Фаусте”: “Люди гибнут за металл!”. Золото явилось одной из предпосылок Великих географических открытий, т.е. периода в истории, во время которого европейцы открывали новые материки и морские маршруты в Африку, Америку, Азию и Океанию. В XV веке из-за кризиса экономики и постоянных войн имела место острая нехватка драгоценных металлов для изготовления денег, поэтому королевские дворы искали новые торговые рынки, а, главное, места, где много дешевого золота. Именно так мы узнали о существовании Америки и Австралии!
Первоначально человечество использовало золото только для изготовления украшений и предметов роскоши, но постепенно стало служить средством обмена, т.е. начало выполнять функцию денег. В таком качестве золото применялось еще за 1500 лет до н. э. в Китае и Египте. В государстве Лидия (территория современной Турции), которое обладало огромными месторождениями золота, впервые начали чеканить золотые монеты. Количество золота в этом государстве превосходило все имевшиеся на тот момент запасы этого металла в других государствах настолько, что имя лидийского царя Креза вошло в поговорку и стало синонимом несметного богатства. Говорят “Богат, как Крез”.
В Средние века и позднее основным источником золота была Южная Америка. Но вначале XIX века были открыты большие месторождения золота на Урале и в Сибири, поэтому в течение нескольких десятилетий Россия занимала первое место по его добыче. Позже были открыты богатые месторождения в Австралии и ЮАР. Таким образом произошло резкое увеличение добычи золота. До этого времени наряду с золотом из драгоценных металлов для производства монет использовалось серебро. Но прилив золота из вышеупомянутых стран обеспечил вытеснение серебра. Поэтому уже к началу XX века золото утвердилось в качестве стандарта. Само по себе золото редко используется в качестве материала для монет, т.к. оно очень мягкое и пластичное (1 грамм золота можно растянуть на 1 км), а поэтому быстро истиралось, в основном его используют в виде сплавов, повышающих твердость материала. Но поначалу монеты чеканились из чистого золота и одним из способов проверки монеты было попробовать её “на зубок”, монету зажимали зубами, если оставался приличный след, считалось, что монета не фальшивая.
Распространение золота в природе
Золото не очень сильно распространено на нашей планете, но и не является редкостью, содержание его в литосфере около 4,3·10-7%, а в одном литре морской воды его содержится около 4·10-9 г. Некоторое количество золота находится в почве, оттуда его получают растения. Кукуруза является отличным источником природного золота для питания человека, это растение имеет способность концентрировать его в себе. Добыча золота крайне сложное занятие, именно за счет этого оно и имеет такую высокую цену. Как говорят геологи, “золото любит одиночество”, т.к. чаще всего его находят в виде самородков, т.е. оно находится в руде в чистом виде. Лишь в крайне редких случаях встречаются соединения золота с висмутом и селеном. Очень небольшое его количество имеется в магматических горных породах, в застывшей лаве. Но из них добыть золото стоит еще большего труда, а содержание его очень низкое. Поэтому способ добычи из магматических пород не находит применения ввиду своей нерентабельности.
Основные запасы золота сосредоточены в России, ЮАР и Канаде.
Химические свойства золота
Чаще всего золото имеет валентность равную +1 или +3. Это очень стойкий к агрессивному воздействию металл. Золото совершенно не подвержено окислению, т.е. кислород при нормальных условиях не оказывает на него никакого влияния. Однако, если нагреть золото выше 100° C на его поверхности образуется очень тонкая окисная пленка, которая не исчезает даже при охлаждении. При температуре 20 °C толщина пленки равна примерно 0,000001 мм. Сера, фосфор, водород и азот не реагируют с золотом.
Золото не подвержено действию кислот. Но только в том случае если они действуют на него по отдельности. Единственной чистой кислотой, в которой можно растворить золото, является горячая концентрированная селеновая кислота H2SeO4. При комнатной температуре благородный металл растворяется в так называемой “царской водке”, т.е. смеси “азотная кислота + соляная кислота”. Также при нормальных условиях золото очень подвержено воздействию растворов иодида калия и йода.
Применение золота
С древнейших времен золото используется в ювелирном искусстве, в качестве предметов роскоши и власти. Благодаря своей исключительной пластичности и ковкости ювелиры могут создавать из этого металла настоящие произведения искусства. В промышленности золото используется в виде сплавов с другими металлами. Во-первых, это повышает прочность сплава, а во-вторых, удешевляет производство. Содержание золота в сплаве называют “пробой”, которая выражается каким то целым стандартным числом. Например, в килограмме сплава 750 пробы содержится 750 граммов золота. Остальные 250 — это другие примеси. Следовательно, чем выше проба, тем выше содержание золота в сплаве. Существует стандарт на это содержание: используются 375, 500, 585, 750, 900, 916, 958 пробы.
Знаете ли вы что?
Для того чтобы изготовить одно золотое кольцо, требуется переработать тонну золотосодержащей руды!
В других отраслях промышленности золото применяется для различных целей в химическом и нефтехимическом производствах, в энергетике и электронике, в авиации и космической технике. Этот благородный металл используется везде, где ни в коем случае нежелательно появление коррозии. Также оно широко применяется в медицине с незапамятных времен из-за стойкости к окислению. В египетских гробницах были найдены мумии с золотыми коронками зубов. В настоящее время для зубных протезов и коронок используются золотые сплавы повышенной прочности. Помимо этого золото используется в фармакологии. Здесь используют различные соединения драгметалла, которые входят как в состав препаратов, так и применяются отдельно. Золотые нити используют в косметологии, тут они помогают омоложению кожи.
Знаете ли вы что?
В японском городе Сува работает завод, на котором из пепла оставшегося после сжигания промышленных отходов добывают золото! Причем в этом пепле его содержание больше, чем в любой золотоносной шахте. Этот факт объясняется тем, что в городе очень много заводов производящих электронику, в которой широко применяется этот благородный металл.
Подведем итог. Золото сохраняет свое инвестиционное, промышленное, ювелирное и медицинское назначение на протяжении уже нескольких тысячелетий и подобная тенденция вряд ли прервется в обозримом будущем. Золото всегда будет олицетворением роскоши и богатства!
| Золото | |
|---|---|
| Атомный номер | 79 |
| Внешний вид простого вещества |
Мягкий ковкий жёлтый металл
|
| Свойства атома | |
|
Атомная масса (молярная масса) |
196,96654 а. е. м. (г/моль) |
| Радиус атома | 146 пм |
|
Энергия ионизации (первый электрон) |
889,3 (9,22) кДж/моль (эВ) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s1 |
| Химические свойства | |
| Ковалентный радиус | 134 пм |
| Радиус иона | (+3e) 85 (+1e) 137 пм |
|
Электроотрицательность (по Полингу) |
2,54 |
| Электродный потенциал |
Au←Au-3 1,50 В Au←Au+ 1,70В |
| Степени окисления | -3, 1 |
| Термодинамические свойства простого вещества | |
| Плотность | 19,3 г/см³ |
| Молярная теплоёмкость | 25,39[1] Дж/(K·моль) |
| Теплопроводность | 318 Вт/(м·K) |
| Температура плавления | 1337,58 K |
| Теплота плавления | 12,68 кДж/моль |
| Температура кипения | 3080 K |
| Теплота испарения | ~340 кДж/моль |
| Молярный объём | 10,2 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Параметры решётки | 4,080 Å |
| Отношение c/a | n/a |
| Температура Дебая | 170,00 K |
| Au | 79 |
| 196,96654 | |
| [Xe]4f145d106s1 | |
| Золото |
Золото — элемент побочной подгруппы первой группы, шестого периода периодической системы химических элементов, с атомным номером 79. Обозначается символом Au (лат. Aurum). Простое вещество золото (CAS-номер: 7440-57-5) — благородный металл жёлтого цвета.
Схема атома золота
Праславянское *zolto (русск. золото, укр. золото, ст.-слав. злато, польск. złoto) родственно лит. geltonas «жёлтый», латыш. zelts «золото, золотой»; с другим вокализмом: готск. gulþ, нем. Gold, англ. gold; далее санскр. hiraṇyam, авест. zaranya «золото», также санскр. hari «жёлтый, золотистый, зеленоватый», от праиндоевропейского корня *ǵʰel- «жёлтый, зелёный, яркий». Отсюда же названия цветов: жёлтый, зелёный.
Связь с корнем «солнце» (sol, др.-греч. ἥλιος) сомнительна.
Свойства золота
Физические свойства
Чистое золото — мягкий металл жёлтого цвета. Красноватый оттенок некоторым изделиям из золота, например, монетам, придают примеси других металлов, в частности меди. В тонких плёнках золото просвечивает зелёным. Золото обладает исключительно высокой теплопроводностью и низким электрическим сопротивлением. Золото — очень тяжёлый металл: шар из чистого золота диаметром 46 мм имеет массу 1 кг. Литровая бутыль, заполненная золотым песком, весит приблизительно16 кг.
Тяжесть золота — плюс для его добычи. Самые простые технологические процессы, такие, как, например, промывка на шлюзах, могут обеспечить весьма высокую степень извлечения золота из промываемой породы.
Золото очень ковко и тягуче. Из кусочка золота массой в один грамм можно вытянуть проволоку длиной в три километра или изготовить золотую фольгу в 500 раз тоньше человеческого волоса (0,0001 мм). Через такой листочек фольги луч света просвечивает зеленоватым цветом. Мягкость чистого золота настолько велика, что его можно царапать ногтем. Поэтому в ювелирных изделиях золото всегда сплавляется с медью или серебром. Состав таких сплавов выражается пробой, которая указывает число весовых частей золота в 1000 частей сплава(в российской практике). Проба химически чистого золота соответствует 999.9 пробе — его ещё называют «банковским» золотом, так как из такого золота изготавливают слитки.
Химические свойства
Золото — самый инертный металл, стоящий в ряду напряжений правее всех других металлов, при нормальных условиях оно не взаимодействует с большинством кислот и не образует оксидов, благодаря чему было отнесено к благородным металлам, в отличие от металлов обычных, легко разрушающихся под действием окружающей среды. Затем была открыта способность царской водки растворять золото, что поколебало уверенность в его инертности.
Наиболее устойчивая степень окисления золота в соединениях +3, в этой степени окисления оно легко образует с однозарядными анионами (F−, Cl−. CN−) устойчивые плоские квадратные комплексы [AuX4]−. Относительно устойчивы также соединения со степенью окисления +1, дающие линейные комплексы [AuX2]−. Долгое время считалось, что +3 — высшая из возможных степеней окисления золота, однако, используя дифторид криптона, удалось получить соединения Au+5 (фторид AuF5, соли комплекса [AuF6]−). Соединения золота(V) стабильны лишь со фтором и являются сильнейшими окислителями.
Степень окисления +2 для золота нехарактерна, в веществах, в которых она формально равна 2, половина золота, как правило, окислена до +1, а половина — до +3, например, правильной ионной формулой сульфата золота(II) AuSO4 будет не Au2+(SO4)2−, а Au1+Au3+(SO4)2−2. Недавно обнаружены комплексы в которых золото все-таки имеет степень окисления +2.
Из чистых кислот золото растворяется только в горячей концентрированной селеновой кислоте:
- 2Au + 6H2SeO4 = Au2(SeO4)3 + 3H2SeO3 + 3H2O
Золото сравнительно легко реагирует с кислородом и другими окислителями при участии комплексобразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты:
- 4Au + 8CN− + 2H2O + O2 → 4[Au(CN)2]− + 4 OH−
В случае реакции с хлором возможность комплексообразования также значительно облегчает ход реакции: если с сухим хлором золото реагирует при ~200 °C с образованием хлорида золота(III), то в концентрированном водном растворе соляной и азотной кислот (царская водка) золото растворяется с образованием хлораурат-иона уже при комнатной температуре:
- 2Au + 3Cl2 + 2Cl− → 2[AuCl4]−
Золото легко реагирует с жидким бромом и его растворами в воде и органических растворителях, давая трибромид AuBr3.
Со фтором золото реагирует в интервале температур 300−400°C, при более низких реакция не идёт, а при более высоких фториды золота разлагаются.
Золото также растворяется во ртути, фактически образуя легкоплавкий сплав (амальгаму).
Физиологическое воздействие
Некоторые соединения золота токсичны, накапливаются в почках, печени, селезёнке и гипоталамусе, что может привести к органическим заболеваниям и дерматитам, стоматитам, тромбоцитопении.
Геохимия золота
Содержание золота в земной коре очень низкое — 3 мкг/кг, но месторождения и участки, резко обогащённые металлом, весьма многочисленны. Золото содержится и в воде. 1 л и морской, и речной воды несёт примерно 4*10−9 г золота.
Для золота характерна самородная форма. Среди других его форм стоит отметить электрум, сплав золота с серебром, который обладает зеленоватым оттенком и относительно легко разрушается при переносе водой. В горных породах золото обычно рассеяно на атомарном уровне. В месторождениях оно зачастую заключено в сульфиды и арсениды.
Различаются первичные месторождения золота, россыпи, в которые оно попадает в результате разрушения рудных месторождений и месторождения с комплексными рудами, в которых золото извлекается в качестве попутного компонента.
Добыча золота
Люди добывают золото с незапамятных времён. С золотом человечество столкнулось уже в V тыс. до н. э. в эпоху неолита благодаря его распространению в самородном состоянии.
По предположению археологов, начало системной добычи было положено на Ближнем Востоке, откуда золотые украшения поставлялись, в частности, в Египет. Именно в Египте в гробнице королевы Зер и одной из королев Пу-аби Ур в Шумерской цивилизации были найдены первые золотые украшения, датируемые III тыс. до н. э.
В России принято считать началом золотодобычи 21 мая (1 июня) 1745 г., когда Ерофей Марков, нашедший золото на Урале, объявил о своем открытии в Канцелярии Главного правления заводов в Екатеринбурге.
За всю историю человечеством добыто около 140 тыс. т золота.
В 2007 году добыли 2 380 т золота, а в 2008 — 2 330 т. Лидерами добычи стали: Китай (добыл в 2007 году 275 т, а в 2008 г. — 295 т), ЮАР (252/250), США (238/230), Австралия (246/225), Перу (170/175), Россия (157/165), Канада (101/100), Индонезия (118/90), Узбекистан (85/85), Гана (84/84), Папуа — Новая Гвинея (65/65), Чили (42/42), Мексика (39/41), Бразилия (40/40).
В России существует около 16 золотодобывающих компаний. Лидером добычи золота в России является компания Полюс Золото на которую приходится около 20 % рынка. Наибольшее количество золота добывается в Чукотском АО, Красноярском крае и Амурской области. [3]
Разведанные мировые запасы золота оцениваются в 100 тыс. т.
Получение
Золотой самородок
Для получения золота используются его основные физические и химические свойства: присутствие в природе в самородном состоянии, способность реагировать лишь с немногими веществами (ртуть, цианиды). C развитием современных технологий более популярными становятся химические способы.
Промывка
Метод промывки основан на высокой плотности золота, благодаря которой в потоке воды, минералы с плотностью меньше золота (а это почти все минералы земной коры) смываются и металл концентрируется в тяжёлой фракции, песка состоящего из минералов повышенной плотности, который называется шлихом. Этот процесс называется отмывкой шлиха или шлихованием. В небольших объёмах её можно проводить вручную, при помощи промывочного лотка. Этот способ используется с древнейших времён, и до сих пор для отработки маленьких россыпных месторождений старателями, но основное его применение — поиск месторождений золота, алмазов и других ценных металлов.
Промывка используется для разработки крупных россыпных месторождений, но при этом применяются специальные технические устройства: драги и промывочные устройства. Полученные шлихи, кроме золота, содержат множество других плотных минералов и металл из них извлекается, например, путём амальгамации.
Методом промывки разрабатываются все россыпные месторождения золота, ограничено он применяется на коренных месторождениях. Для этого породу дробят и затем подвергают промывке. Этот метод не может быть применён на месторождениях с рассеянным золотом, где оно так распылено в породе, что после дробления не обособляется в отдельные зёрна и смывается при промывке вместе с другими минералами. К сожалению, при промывке теряется не только мелкое золото, которое легко смывается с промывочной колоды, но и крупные самородки, гидравлическая крупность которых не позволяет им спокойно оседать в ячейках коврика. Поэтому на драгах и на промприборах обязательно следят за крупными катящимися обломками — это вполне могут оказаться самородки!
Этот метод добычи золота исторически был первым, и он очень дёшев, потому что не требует строительства дорогих заводов, и в случае речных отложений не нужно дробить породу. Экономически рентабельна отработка россыпей с содержанием золота более 0,1 г на 1 кубический метр рыхлой породы (песков, суглинков и т. д.).
Амальгамация
Метод амальгамации основан на способности ртути образовывать сплавы — амальгамы с различными металлами, в том числе и с золотом. В этом методе увлажнённая дроблёная порода смешивалась со ртутью и подвергалась дополнительному измельчению в мельницах — бегунных чашах. Амальгаму золота (и сопутствующих металлов) извлекали из получившегося шлама промывкой, после чего ртуть отгонялась из собранной амальгамы и использовалась повторно. Метод амальгамации известен с I века до н. э., наибольшие масштабы приобрёл в американских колониях Испании начиная с XVI века: это стало возможным благодаря наличию в Испании огромного ртутного месторождения — Альмаден. В более позднее время использовался метод внешней амальгамации, когда дроблёная золотоносная порода при промывке пропускалась через обогатительные шлюзы, выстланные медными листами, покрытыми тонким слоем ртути. Метод амальгамации применим только на месторождениях с высоким содержанием золота или уже при его обогащении. Сейчас он используется очень редко, главным образом старателями в Африке и Южной Америке.
Цианирование
Золото растворяется в растворах синильной кислоты и её солей, и это его свойство дало начало ряду методов извлечения путем цианирования руд.
Метод цианирования основан на реакции золота с цианидами в присутствии кислорода воздуха: измельчённая золотоносная порода обрабатывается разбавленным (0,3-0,03 %) раствором цианида натрия, золото из образующегося раствора цианоаурата натрия Na[Au(CN)2] осаждается либо цинковой пылью, либо на специальных ионнообменых смолах.
Метод цианирования первоначально применялся на крупных заводах, где порода дробилась и цианирование проводилось в специальных чанах. Однако развитие технологии привело к появлению метода кучного выщелачивания, который заключается в следующем: готовится водонепроницаемая площадка, на неё насыпается руда и её орошают растворами цианидов, которые, просачиваясь через толщу породы, растворяют золото. После этого они поступают в специальные сорбционные колонны, в которых золото осаждается, а регенерированный раствор вновь отправляется на кучу.
Метод цианирования ограничен минеральным составом руд, он неприменим, если руда содержит большое количество сульфидов или арсенидов, так как цианиды реагируют с этими минералами. Поэтому цианированием перерабатываются малосульфидные руды или руды из зоны окисления, в которой сульфиды и арсениды окислены атмосферным кислородом.
Для извлечения золота из сульфидных руд используются сложные многоэтапные технологии. Золото, добытое из месторождений, содержит различные примеси, поэтому его подвергают специальным процессам высокой очистки, которые производятся на аффинажных заводах.
Регенерация
Осуществляется действием 10 % раствора щелочи на растворы солей золота с последующим осаждением аффинажного золота на алюминий из горячего раствора гидрооксида.
Применение
Имеющееся в настоящее время в мире золото распределено так: около 10 % — в промышленных изделиях, остальное делится приблизительно поровну между централизованными запасами (в основном, в виде стандартных слитков химически чистого золота), собственностью частных лиц в виде слитков и ювелирными изделиями.
Как объект инвестирования
Золото является важнейшим элементом мировой финансовой системы, поскольку данный металл не подвержен коррозии, имеет много сфер технического применения, а запасы его невелики. Золото практически не терялось в процессе исторических катаклизмов, а лишь накапливалось и переплавлялось. В настоящее время мировые банковские резервы золота оцениваются в 32 тыс. тонн (если сплавить все это золото воедино, получится куб со стороной всего лишь 12 м).
Золото издавна использовалось многими народами в качестве денег. Золотые монеты — самый хорошо сохраняющийся памятник старины. Однако как монопольный денежный товар оно утвердилось только к XIX веку. Вплоть до Первой мировой войны все мировые валюты были основаны на золотом стандарте (период 1870—1914 называют «золотым веком»). Бумажные купюры в это время выполняли роль удостоверений о наличии золота. Они свободно обменивались на золото.
В промышленности
По своей химической стойкости и механической прочности золото уступает большинству платиноидов, но незаменимо, как материал для электрических контактов. Поэтому в микроэлектронике золотые проводники и гальванические покрытия золотом контактных поверхностей, разъёмов, печатных плат используются очень широко.
Золото используется в качестве мишени в ядерных исследованиях, в качестве покрытия зеркал, работающих в дальнем инфракрасном диапазоне, в качестве специальной оболочки в нейтронной бомбе.
Золотые припои очень хорошо смачивают различные металлические поверхности и применяются при пайке металлов. Тонкие прокладки, изготовленные из мягких сплавов золота, используются в технике сверхвысокого вакуума.
Золочение металлов (в древности — исключительно амальгамный метод, в настоящее время — преимущественно гальваническое) широко используется в качестве метода защиты от коррозии. Хотя такое покрытие неблагородных металлов имеет существенные недостатки (мягкость покрытия, высокий потенциал при точечной коррозии), оно распространено также из-за того, что готовое изделие приобретает вид очень дорогого, «золотого».
Золото зарегистрировано в качестве пищевой добавки Е175.
В ювелирных изделиях
Золотые изделия. Золотая медаль полученная художником Гореловым Г.Н. в 1909 на Международной выставке в Мюнхене за картину «Осмеяние еретиков» и золотые обручальные кольца супругов Горелова Г.Н и Гореловой Т. Н.
Традиционным и самым крупным потребителем золота является ювелирная промышленность. Ювелирные изделия изготавливают не из чистого золота, а из его сплавов с другими металлами, значительно превосходящими золото по механической прочности и стойкости. В настоящее время для этого служат сплавы Au-Ag-Cu, которые могут содержать добавки цинка, никеля, кобальта, палладия. Стойкость к коррозии таких сплавов определяются, в основном, содержанием в них золота, а цветовые оттенки и механические свойства — соотношением серебра и меди.
Важнейшей характеристикой ювелирных изделий является их проба, характеризующая содержание в них золота.
В стоматологии
Значительные количества золота потребляет стоматология: коронки и зубные протезы изготовляют из сплавов золота с серебром, медью, никелем, платиной, цинком. Такие сплавы сочетают коррозионную стойкость с высокими механическими свойствами.
В фармакологии
Соединения золота входят в состав некоторых медицинских препаратов, используемых для лечения ряда заболеваний (туберкулёза,ревматоидных артритов и т. д.). Радиоактивное золото используют при лечении злокачественных опухолей
Цены на золото
Цены на золото после дефолта США по золоту
В 1792 в США было установлено, что 1 унция золота будет стоить 19,3 $. В 1834 году за унцию давали уже 20,67 $, поскольку США не имели достаточного золотого запаса, чтобы обеспечить весь объём выпущенных денег, и курс валюты приходилось снижать.
После Первой мировой войны девальвация продолжалась. В 1934 году за 1 унцию золота давали 35 $. Несмотря на экономический кризис, США пытались сохранить фиксированную привязку доллара к золоту, ради этого поднималась учётная ставка, но это не помогло. Однако в связи с последовавшими войнами золото из Старого Света стало перемещаться в Новый, что восстановило на время привязку доллара к золоту.
В 1944 было принято Бреттон-Вудское соглашение. Был введен золотодевизный стандарт, основанный на золоте и двух валютах — долларе США и фунте стерлингов Великобритании, что положило конец монополии золотого стандарта. Согласно новым правилам, доллар становился единственной валютой, напрямую привязанной к золоту. Казначейство США обязывалось обменивать доллары на золото иностранным правительственным учреждениям и центральным банкам в соотношении 35 $ за тройскую унцию. Фактически золото превратилось из основной в резервную валюту.
В конце 1960-х годов высокая инфляция в США вновь сделала невозможным сохранение золотой привязки на прежнем уровне, ситуацию осложнял и внешнеторговый дефицит США. Рыночная цена золота стала ощутимо превышать официально установленную. В 1971 содержание золота в долларе было снижено до 38 $ за унцию, а в 1973 — до 42,22 $ за унцию. В 1971 президент США Ричард Никсон отменил привязку доллара к золоту, хотя официально этот шаг был подтвержден лишь в 1976, когда была создана так называемая ямайская валютная система плавающих курсов. Это означало, что доллар больше не был обеспечен ничем, кроме долговых обязательств США.
Цены на золото с учетом инфляции
После этого золото превратилось в особый инвестиционный товар. Инвесторы на протяжении многих лет доверяли исключительно золоту. К концу 1974 цены на золото подскочили до 195 $ за унцию, а к 1978 — до 200 $ за унцию. К началу 1980 года цена на золото достигло рекордной отметки — 850 $ за унцию (свыше 2000 в ценах 2008 года), после чего она начала постепенно падать. В конце 1987 года она составляла около 500 $ за унцию. Самое быстрое падение произошло в 1996—1999 гг., когда цена на золото снизилась с 420 до 260 $ за унцию.
Как бы то ни было, падение прекратилось и снова начался рост цены на золото в связи с соглашением ведущих центральных банков об ограничении продаж золота в 1999 году. К концу 2006 года цена на унцию золота достигла 620 $, а к концу 2007 года уже около 800 $. В начале 2008 года цена золота превысила рубеж в 1000 долларов за унцию. Тем не менее, в сравнимых ценах золото не дошло до пика 80х — выше 2000$. В середине октября 2009 года цена золота колебалась в пределах 1060 $ — 1070 $ за тройскую унцию.[4]
Золото для инвестиций выступает в нескольких формах — золотые слитки, золотые монеты, золотой песок. Инвестиционные монеты являются лучшим средством для инвестиций в РФ: покупатель не платит НДС. Тем не менее, цена за 1 грамм золота в монетах в России превышает цену 1 грамма в слитках даже с учетом НДС и процентов на спред последнего (например, в Сбербанке РФ). В отличие от аукционов E-bay, где стоимость чётко коррелирует с мировой ценой. Золото в монетах чеканки Uncirculated (название чеканки для инвестиционных монет) может стоить на 20-30 % дороже золота в слитках 50 или 100 граммовых, даже с учетом того, что за золото в слитке платится 18 % НДС и проценты так называемого «спреда» банку (около 2 % на покупку золота банком и 2 % на его продажу Вам, то есть в сумме около 4 % помимо НДС).
Кроме того, динамика цен на золото является важнейшим экономическим индикатором, позволяя оценить склонность инвесторов к риску. Зачастую можно наблюдать, что цена на золото и фондовые индексы движутся в противофазе, так как в периоды неустойчивой экономической ситуации инвесторы предпочитают консервативные активы, защищенные от полного обесценивания. И наоборот, когда ожидания роста экономики становятся оптимистичнее, аппетиты к повышенной доходности растут, заставляя котировки жёлтого металла снижаться.
Золотой запас России
Предполагаемые золотые резервы стран мира в 2006
Запасы золота в государственном резерве России в декабре 2008 г. составили 495,9 тонн (2,2 % от всех государств мира).[5] Доля золота в общем объёме золотовалютных резервов России в марте 2006 составила 3,8 %. Россия занимает 9 место в мире по объёму золота, находящегося в государственном резерве.
Уровень международных резервов
Международные резервы стран мира в 2006
| № | Страна | млрд. USD (на конец месяца) |
|---|---|---|
| 1 | КНР | $1953 (Март 2009) |
| 2 | Япония | $1042,34 (Август 2009) |
| — | Еврозона | $531 (Февраль 2009) |
| 3 | Россия | $413 (Июль 2009) |
| 4 | Китайская Республика | $305 (Апрель 2009) |
| 5 | Индия | $256 (Май 2009) |
| 6 | Республика Корея | $212 (Апрель 2009) |
| 7 | Бразилия | $203 (Март 2009) |
| 8 | Гонконг | $186 (Март 2009) |
| 9 | Сингапур | $166 (Март 2009) |
| 10 | Германия | $144 (Февраль 2009) |
В десятке данных стран находится более 50 процентов от общих международных резервов мира.
Меры чистоты золота
Британская каратная система
Традиционно чистота золота измеряется в британских каратах. 1 британский карат равен одной двадцать четвёртой части массы сплава. 24-каратное золото (24K) является чистым, без каких-либо примесей.
Чтобы изменить качественные характеристики золота, для различных целей (например, увеличить твёрдость) изготавливают сплавы с различными примесями. Например, 18-каратное золото (18K) означает содержание в сплаве 18 частей золота и 6 частей примесей.
Российская система проб
Принятая в России система отличается от британской и аналогична принятой в Германии. В России чистота золота измеряется пробой.
Проба варьируется от 0 до 1000 и показывает содержание золота в тысячных долях. Так, 18-каратное золото соответствует 750-й пробе. Золото 999,96-й пробы считается «практически чистым», именно такой пробы оно и бывает в слитках. Золото 999,99 пробы крайне дорого в получении и употребляется только в химии. В отечественной ювелирной промышленности изготавливаются ювелирные изделия из золота 375, 500, 585, 750, 900, 916 и 958 пробы. По просьбе физического лица пробирная инспекция может поставить 583 пробу, хотя во многих странах бывшего СССР отказались от 583 пробы и оставили 585,например в Латвии.
Периодическая система химических элементов Менделеева:
|
IA |
IIA |
IIIB |
IVB |
VB |
VIB |
VIIB |
—- |
VIIIB |
—- |
IB |
IIB |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
| Период | ||||||||||||||||||
| 1 |
1
H |
2
He |
||||||||||||||||
| 2 |
3
Li |
4
Be |
5
B |
6
C |
7
N |
8
O |
9
F |
10
Ne |
||||||||||
| 3 |
11
Na |
12
Mg |
13
Al |
14
Si |
15
P |
16
S |
17
Cl |
18
Ar |
||||||||||
| 4 |
19
K |
20
Ca |
21
Sc |
22
Ti |
23
V |
24
Cr |
25
Mn |
26
Fe |
27
Co |
28
Ni |
29
Cu |
30
Zn |
31
Ga |
32
Ge |
33
As |
34
Se |
35
Br |
36
Kr |
| 5 |
37
Rb |
38
Sr |
39
Y |
40
Zr |
41
Nb |
42
Mo |
(43)
Tc |
44
Ru |
45
Rh |
46
Pd |
47
Ag |
48
Cd |
49
In |
50
Sn |
51
Sb |
52
Te |
53
I |
54
Xe |
| 6 |
55
Cs |
56
Ba |
* |
72
Hf |
73
Ta |
74
W |
75
Re |
76
Os |
77
Ir |
78
Pt |
79
Au |
80
Hg |
81
Tl |
82
Pb |
83
Bi |
(84)
Po |
(85)
At |
86
Rn |
| 7 |
87
Fr |
88
Ra |
** |
(104)
Rf |
(105)
Db |
(106)
Sg |
(107)
Bh |
(108)
Hs |
(109)
Mt |
(110)
Ds |
(111)
Rg |
(112)
Cp |
(113)
Uut |
(114)
Uuq |
(115)
Uup |
(116)
Uuh |
(117)
Uus |
(118)
Uuo |
| 8 |
(119)
Uue |
(120)
Ubn |
||||||||||||||||
| Лантаноиды * |
57
La |
58
Ce |
59
Pr |
60
Nd |
(61)
Pm |
62
Sm |
63
Eu |
64
Gd |
65
Tb |
66
Dy |
67
Ho |
68
Er |
69
Tm |
70
Yb |
71
Lu |
|||
| Актиноиды ** |
89
Ac |
90
Th |
91
Pa |
92
U |
(93)
Np |
(94)
Pu |
(95)
Am |
(96)
Cm |
(97)
Bk |
(98)
Cf |
(99)
Es |
(100)
Fm |
(101)
Md |
(102)
No |
(103)
Lr |
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
ЗО́ЛОТО (лат. Aurum), Au (читается «аурум»), химический элемент с атомным номером 79, атомная масса 196,9665. Известно с глубокой древности. В природе один стабильный изотоп 197Au. Конфигурация внешней и предвнешней электронных оболочек 5s2p6d106s1. Расположено в IВ группе и 6-м периоде периодической системы, относится к благородным металлам. Степени окисления 0, +1, +3, +5 (валентности от I, III, V).
Металлический радиус атома золота 0,137 нм, радиус иона Au+ — 0,151 нм для координационного числа 6, иона Au3+ — 0,084 нм и 0,099 нм для координационных чисел 4 и 6. Энергии ионизации Au0 — Au+ — Au2+ — Au3+ соответственно равны 9,23, 20,5 и 30,47 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 2,4.
Нахождение в природе
Содержание в земной коре 4,3·10–7% по массе, в воде морей и океанов менее 5·10–6% мг/л. Относится к рассеянным элементам. Известно более 20 минералов, из которых главный — самородное золото (электрум, медистое, палладиевое, висмутовое золото). Самородки большого размера встречаются крайне редко и, как правило, имеют именные названия. Химические соединения золота в природе редки, в основном это теллуриды — калеверит AuTe2, креннерит (Au,Ag)Te2 и другие. Золото может присутствовать в виде примеси в различных сульфидных минералах: пирите (см. ПИРИТ), халькопирите (см. ХАЛЬКОПИРИТ), сфалерите (см. СФАЛЕРИТ) и других.
Современные методы химического анализа позволяют обнаружить присутствие ничтожных количеств Au в организмах растений и животных, в винах и коньяках, в минеральных водах и в морской воде.
История открытия
Золото было известно человечеству с древнейших времен. Возможно, оно явилось первым металлом, с которым познакомился человек. Имеются данные о добыче золота и изготовлении изделий из него в Древнем Египте (4100—3900 годы до н. э.), Индии и Индокитае (2000—1500 годы до н. э.), где из него изготавливали деньги, дорогие украшения, произведений культа и искусства.
Получение
Источники золота при его промышленном получении — руды и пески золотых россыпных и коренных месторождений, содержание золота в которых составляет 5—15 г на тонну исходного материала, а также промежуточные продукты (0,5—3 г/т) свинцово-цинкового, медного, уранового и некоторых других производств.
Процесс получения золота из россыпей основан на разнице плотностей золота и песка. С помощью мощных струй воды измельченную золотоносную породу переводят во взвешенное в воде состояние. Полученная пульпа стекает в драге по наклонной плоскости. При этом тяжелые частицы золота оседают, а песчинки уносятся водой.
Другим способом золото извлекают из руды, обрабатывая ее жидкой ртутью и получая жидкий сплав — амальгаму. Далее амальгаму нагревают, ртуть испаряется, а золото остается. Применяют и цианидный способ извлечения золота из руд. В этом случае золотоносную руду обрабатывают раствором цианида натрия NaCN. В присутствии кислорода воздуха золото переходит в раствор:
4Au + O2 + 8NaCN + 2H2O = 4Na[Au(CN)2] + 4NaOH
Далее полученный раствор комплекса золота обрабатывают цинковой пылью:
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4) + 2AuЇ
Очищают золото растворением в царской водке (см. ЦАРСКАЯ ВОДКА):
Au + HNO3 + 4HCl = H[AuCl4] + NO +H2O
с последующим избирательным осаждением золота из раствора, например, с помощью FeSO4.
Физические и химические свойства
Золото — желтый металл с кубической гранецентрированной решеткой (a = 0,40786 нм). Температура плавления 1064,4 °C, температура кипения 2880 °C, плотность 19,32 кг/дм3. Обладает исключительной пластичностью, теплопроводностью и электропроводимостью. Шарик золота диаметром в 1 мм можно расплющить в тончайший лист, просвечивающий голубовато-зеленым цветом, площадью 50 м2. Толщина самых тонких листочков золота 0,1 мкм. Из золота можно вытянуть тончайшие нити.
Золото устойчиво на воздухе и в воде. С кислородом (см. КИСЛОРОД), азотом (см. АЗОТ), водородом (см. ВОДОРОД), фосфором (см. ФОСФОР), сурьмой (см. СУРЬМА) и углеродом (см. УГЛЕРОД) непосредственно не взаимодействует. Антимонид AuSb2 и фосфид золота Au2P3 получают косвенными путями.
В ряду стандартных потенциалов золото расположено правее водорода, поэтому с неокисляющими кислотами в реакции не вступает. Растворяется в горячей селеновой кислоте:
2Au + 6H2SeO4 = Au2(SeO4)3 + 3H2SeO3 + 3H2O,
в концентрированной соляной кислоте при пропускании через раствор хлора:
2Au + 3Cl2 + 2HCl = 2H[AuCl4]
При аккуратном упаривании получаемого раствора можно получить желтые кристаллы золотохлористоводородной кислоты HAuCl4·3H2O.
С галогенами (см. ГАЛОГЕНЫ) без нагревания в отсутствие влаги золото не реагирует. При нагревании порошка золота с галогенами или с дифторидом ксенона образуются галогениды золота:
2Au + 3Cl2 = 2AuCl3,
2Au + 3XeF2 = 2AuF3 + 3Xe
В воде растворимы только AuCl3 и AuBr3, состоящие из димерных молекул:
Термическим разложением гексафторауратов (V), например, O2+[AuF6]– получены фториды золота AuF5 и AuF7. Их также можно получить, окисляя золото или его трифторид с помощью KrF2 и XeF6.
Моногалогениды золота AuCl, AuBr и AuI образуются при нагревании в вакууме соответствующих высших галогенидов. При нагревании они или разлагаются:
2AuCl = 2Au + Cl2
или диспропорционируют:
3AuBr = AuBr3 + 2Au.
Соединения золота неустойчивы и в водных растворах гидролизуются, легко восстанавливаясь до металла.
Гидроксид золота (III) Au(OH)3 образуется при добавлении щелочи или Mg(OH)2 к раствору H[AuCl4]:
H[AuCl4] + 2Mg(OH)2 = Au(OH)3Ї + 2MgCl2 + H2O
При нагревании Au(OH)3 легко дегидратируется, образуя оксид золота (III):
2Au(OH)3 = Au2O3 + 3H2O
Гидроксид золота (III) проявляет амфотерные свойства, реагируя с растворами кислот и щелочей:
Au(OH)3 + 4HCl = H[AuCl4] + 3H2O,
Au(OH)3 + NaOH = Na[Au(OH)4]
Другие кислородные соединения золота неустойчивы и легко образуют взрывчатые смеси. Соединение оксида золота (III) с аммиаком Au2O3·4NH3 — «гремучее золото», взрывается при нагревании.
При восстановлении золота из разбавленных растворов его солей, а также при электрическом распылении золота в воде образуется стойкий коллоидный раствор золота:
2AuCl3 + 3SnCl2 = 3SnCl4 +2Au
Окраска коллоидных растворов золота зависит от степени дисперсности частиц золота, а интенсивность от их концентрации. Частицы золота в растворе всегда отрицательно заряжены.
Применение
Золото и его сплавы используют для изготовления ювелирных изделий, монет, медалей, зубных протезов, деталей химической аппаратуры, электрических контактов и проводов, изделий микроэлектроники, для плакирования труб в химической промышленности, в производстве припоев, катализаторов, часов, для окрашивания стекол, изготовления перьев для авторучек, нанесения покрытий на металлические поверхности. Обычно золото используют в сплаве с серебром или палладием (белое золото; также называют сплав золота с платиной и другими металлами). Содержание золота в сплаве обозначают государственным клеймом. Золото 583 пробы является сплавом с 58,3% золота по массе. См также Золото (в экономике) (см. ЗОЛОТО (в экономике)).
Физиологическое действие
Некоторые соединения золота токсичны, накапливаются в почках, печени, селезенке и гипоталамусе, что может привести к органическим заболеваниям и дерматитам, стоматитам, тромбоцитопении.
Энциклопедический словарь.
2009.
Один из наиболее распространенных материалов в давние времена и сегодня – золото, в таблице Менделеева находится среди других драгоценных металлов (иридий, платина, серебро, палладий и др.). Его отличает от них не только формула и характеристики, но и ценность, а также происхождение. Однако главная особенность Au заключается в противоречивых свойствах. Так, твердость золота по шкале Мооса одна из самых низких, но зато ценность – высокая. Несмотря на подобные тонкости, изделия из золотого сплава применяются достаточно широко, металл добывается на протяжении веков (история золота насчитывает многие тысячелетия). Au продолжает образовываться до сих пор.
Название металла aurum читается на латинском языке как «аурум» (пишется так же, как и слышится/произносится). Распространено сокращенное обозначение (используются буквы – Au). Именно такой вариант применяется в химии при составлении формул веществ, соединений. Это элемент периодической таблицы Менделеева, относится к 6 периоду.
Главные отличительные признаки: желтый цвет, нехарактерный для других драгоценных металлов звук при ударе, мягкость. Если интересно, как обозначается золото в таблице Менделеева, нужно искать элемент под номером 79.
Этимология слова, которым называется драгметалл, включает в себя разные расшифровки значения:
- старинный славянский вариант – в основе лежит слово «злато»;
- литовское значение geltonas – «желтый»;
- латинское название золота в переводе соответствует характерному цвету драгоценного металла – «желтый».
Строение атома и физические свойства
В таблице золото располагается в шестом периоде в подгруппе меди 11 группы. Его обозначение буквами — Au. Элемент имеет порядковый номер — 79. В ядре атома металла находится 79 протонов и 117 нейтронов. На шести энергетических уровнях атома располагаются 79 электронов. Природный элемент существует в виде химически устойчивого изотопа 197Au. Остальные нестабильны и возможны только в условиях ядерного реактора.
Распределение электронов по орбиталям в электронной формуле золота — 1s22s22p63s23p63d104s24p64f145s25p65d106s1. В своих соединениях металл проявляет валентность I. Это обусловлено наличием одного неспаренного электрона. Но для элемента также характерна валентность II.
Золото относится к группе переходных металлов. Абсолютно чистое вещество характеризуется ярко-жёлтым цветом. Если в минерале есть примеси меди, тогда он может обладать красноватым оттенком. Химическому элементу характерна гранецентрированная кубическая кристаллическая решётка.
Основные физические характеристики золота:
- температура плавления — 1064,18 °C;
- температура кипения — 2856 °C;
- атомная масса — 196,96655;
- плотность — 19,3 г/см3;
- молярный объём — 10,2 см3/моль;
- твёрдость по шкале Мооса — 2,5.
Вещество характеризуется пластичностью и гибкостью. Золото — самый мягкий среди всех металлов, оно отлично поддаётся обработке. Изделия из этого вещества высокой пробы возможно погнуть и повредить, поэтому их нужно беречь от любых механических повреждений. При изготовлении столовых приборов производители добавляют в золото дополнительные сплавы, которые повышают прочность предметов. Жидкое вещество летучее и способно испаряться ещё до температуры плавления.
Минерал отличается высокой стойкостью к химическим реакциям и процессам. Это отличный проводник, который быстро транспортирует электрический ток и тепловую энергию. Металл легко полируется, после обработки приобретает мягкий блеск. Тонкая пластина, изготовленная из золота, способна пропускать свет. Поскольку температура вещества падает, его можно применять для тонировки окон.
История появления металла
Существует немало теорий, объясняющих, что такое золото, где образовалось, почему оказалось в земной коре и ядре планеты. Ранее было принято считать, что Au во вселенной – это следствие процессов в структуре звезд (нуклеосинтеза). Однако позднее появились новые предположения, откуда берет начало история золота. Так, существует теория, что частицы металла – следствие разрушения нейтронных звезд.
Aurum отличается существенным весом. Даже после распада частицы будут стремительно падать. Они проходят через атмосферу вместе с астероидами (как при поздней тяжелой бомбардировке, во времена, соответствующие периоду 3,8 млрд лет назад). Это вероятный путь попадания драгметалла в кору планеты. Можно предположить, откуда на Земле появилось золото. Пыль, оставшаяся после взрыва звезды, постепенно конденсируется. В таком виде попадает на планету.
Если интересно, откуда берется золото в природе, следует учитывать, что существенная его доля содержится в земном ядре. Туда металл попал, опять же, благодаря значительному весу. Это один из главных признаков, позволяющих определить, является ли изделие из аурума оригинальным (они всегда тяжелее многих прочих: из серебра, латуни). Кроме того, строятся и другие теории, как появилось золото на Земле, а оказалось в ядре. Считается, что это результат воздействия высоких температур, когда планета находилась в расплавленном состоянии.
Драгоценный металл — золото
Однако теории, на основании которых делаются предположения, откуда появилось золото, не всегда имеют под собой основания. Например, версия о том, что звездная пыль (золотая) попадает в открытый космос, а затем оседает на Земле, поразила несоответствием фактов, например, нет информации, что подобные процессы действительно развиваются. Ученые пока не дают конкретных данных, но делают заявления, что такие предположения (касательно падающей золотой пыли) – косвенные. Нет достаточной информации, а подтвердить теорию невозможно из-за особенностей работы спутниковых спектроскопов.
Интересно: Аурум находится в земной коре, мантии, ядре планеты, а также в воде. Считается, что 1 км2 содержит 1 кг драгметалла.
Меры чистоты золота
Государства контролируют оборот драгметалла. Век назад почти в каждой стране работала своя система пробирования, но сейчас большинство приведено к общему знаменателю.
Британская каратная система
В каратной системе (США, Канада, Швейцария) за 100 % принято число 24. Клеймо «18 K» говорит о том, что украшение состоит на 75 % из драгоценного металла, а на 25 % из чего-то ещё — например меди и палладия.
Метрическая система
В России, СНГ, Германии число на клейме — это количество промилле (тысячных долей) золота в сплаве. 500 ‰ — проба 500, 375 ‰ —375. Не существует только пробы 1000 — вместо нее 999,9. Она содержит микроскопическое количество примесей и условно считается чистой.
Золотниковая система
Золотниковая система проб действовала в Российской империи, РСФСР и СССР в 1798–1927 годах. Она основана на русском фунте, равном 96 золотникам, аналогична каратной математически, но делит целое не на 24, а на 96 долей.
Таблица соответствия проб
Посмотрим на три системы в сравнении. Существует также лотовая проба — она по сути повторяет каратную, но берет за сто процентов 16 единиц (лот). Лотовая проба использовалась для пробирования серебра в Европе до введения метрической системы и не имеет отношения к золоту.
| Метрическая система проб | 999 | 958 | 916 | 900 | 750 | 585 | 500 | 375 |
| Каратная система проб | 24 | 23 | 22 | 21,6 | 18 | 14 | 12 | 9 |
| Золотниковая система проб | 96 | 92 | 88 | 86,4 | 72 | 56 | 48 | 36 |
Золото в природе: первичные и вторичные месторождения
Если интересно, как образуется золото в природе, необходимо рассмотреть 2 способа:
- первичный или коренной;
- вторичный (рассыпные месторождения).
Первый из вариантов – самородное золото. Это результат магматических процессов, что подтверждает содержание наибольшего количества золота в ядре Земли. Появляется драгметалл на поверхности вследствие извержения вулканов.
Причем состав золота необычный – чаще всего это чистое вещество.
Его образование обусловлено процессом плавления, когда при смешении легкоплавких соединений в составе жидкой лавы происходит их постепенное остывание (при выходе массы на поверхность). Как результат, разрушаются сторонние соединения (включая соль), остается чистый аурум – подобие камня, но с другими свойствами. Преимуществом металла является однородность структуры.
Золото в природе
Разработка вторичных месторождений – основной способ добычи драгметалла. Такое золото входит в состав различных минералов. Не весь объем Au, содержащийся в магме, образует самородки, немалое количество остается смешанным. С учетом этого свойства золота могут отличаться. Минералы и соединения, из которых состоит драгоценная смесь:
- кварц;
- железо;
- сульфид цинка и свинца;
- медный колчедан.
Чаще всего аурум обнаруживается вместе с кварцем, серебром и медью. Еще один популярный вариант – смесь с платиной. Появляясь из земного ядра или коры, драгметаллы сплавляются, поэтому чаще всего Au обнаруживается при разработке месторождений минералов, других металлов и веществ.
Сферы применения
Золото давно используется различными странами в виде монет. Однако в качестве монопольного денежного средства их утвердили только к XIX веку.
Сегодня драгметалл используется во многих сферах жизни общества:
- Ювелирная промышленность. Именно на эту область приходится большой объём добываемой горной породы. Украшения и аксессуары производят не из чистого вещества, а из его сплавов с другими металлами, которые повышают механическую прочность и стойкость изделий. Обычно золото соединяют с серебром и медью. Дополнительными компонентами служат цинк, кобальт, никель или палладий. Драгметалл определяет устойчивость сплава к коррозии, соотношение меди и серебра — оттенок и механические особенности. Важная характеристика таких изделий — проба. Она определяется содержанием золота в них.
- Промышленность. Вещество используется для электрических контактов. Микроэлектроника не обходится без золотых проводников и гальванических покрытий металлом. Обработка оконных стёкол этим материалом позволяет уменьшить потери тепла зимой и предохранить помещения от нагревания ультрафиолетовыми лучами летом. Золотыми припоями смачивают поверхности из разных металлов. Вещество применяется для защиты от коррозии и придания другим материалам дорогого вида.
- Стоматология. Золотые сплавы применяют для производства коронок и зубных протезов, которые не портятся.
- Фармакология. Вещество часто служит дополнительным компонентом в лекарствах от туберкулёза и ревматоидных артритов. Радиоактивный изотоп, который обозначается 198Au, применяется для лечения злокачественных опухолей. Перед использованием препаратов необходимо убедиться в том, что у пациента нет негативных реакций на золото.
- Пищевая промышленность. Элементом в качестве пищевой добавки E175 декорируют различные блюда.
Во все времена золото служило важным элементом финансовой системы. Этот металл не подвержен коррозии, поэтому ему стараются найти применение в различных областях. Периодически роль металла снижалась в качестве международной валюты, однако банки в любых странах хранят его как самый важный источник ликвидности.
Технологии добычи драгоценного металла
Стародавняя и современная история золота разнообразна, раскрывает несколько методов добычи Au. Чтобы он смог появиться из земной коры, выполняются разные манипуляции. Из крупных водоемов аурум не добывают – это неоправданно дорого, а результат слабый. Основные источники – поверхностные и более глубокие слои грунта. Чтобы поднять драгметалл с глубины, очистить от примесей, используют несколько основных технологий.
Шлихование (промывка) – древний способ отмывания золотого песка
Такой метод лучший, если необходимо вести поисковые работы, чтобы обнаружить аурум. Основан на опробовании мелких водоемов (речек, ручьев). Частицы драгметалла начинают распространяться вследствие разрушения горных пород, частью которых стали. Этому способствуют мелкие водоемы – речки, ручьи. Аурум выглядит, как блестящие частицы желтого цвета. Это шлих, обозначающий, что здесь есть драгметалл. Такая особенность объясняет, почему Au обнаруживается преимущественно на Урале и других северных регионах России.
Шлиховой метод добычи золота
Амальгамация с помощью ртути
Метод основан на способности аурума реагировать на воздействие ртути. Чтобы из пустой породы получить драгметалл, нужно браться за процесс основательно. Для этого требуется смачивать жидким металлом aurum, результат будет интересным – образуется амальгама, что позволяет диспергировать Au, а позднее – восстановить его первоначальную форму.
Цианирование – добыча золота из руды
Процесс называется выщелачиванием. Нужно вспомнить, что аурум устойчив к окислению при обычной температуре. Учитывая эти свойства золота, можно получить драгметалл из породы, воздействуя на него растворами цианида. Свободный от примесей металл восстанавливают до первоначальных свойств.
Недостатком метода является возможность получить меньше драгметалла, чем изначально содержала порода. Кроме того, цианид используют для работы с низкокачественной рудой.
Как получают
Основные способы получения золота в промышленных масштабах дополняют друг друга — например, шлих можно очистить от плотных примесей путем амальгамации.
Промывка
Промывка (шлихование) — древний метод добычи золотого песка (шлиха) из вторичных месторождений. Песок отмывается благодаря плотности: менее плотные минералы вымываются водой, а шлих оседает.
Масштабная добыча золота автоматизирована: вместо людей работают промывочные устройства и экскаваторы. Однако принцип их действия за последние 2000 лет почти не изменился.
Шлих — не чистое золото. Существуют элементы плотнее — они оседают с песком на дне промывочной емкости. Для финальной очистки используются другие, в частности химические, способы.
Амальгамация
Этот метод тоже известен с древности, но описан в XVI веке. Он возможен благодаря свойству ртути образовывать сплавы (амальгамы) с другими металлами без дополнительного термического или химического воздействия. После избавления от фрагментов пустой породы химические элементы механически разделяются.
Мнение эксперта
Всеволод Козловский
6 лет в ювелирном деле. Знает все о пробах и может определить подделку за 12 секунд
Амальгамация применяется не везде: в ряде стран (с 1988 года — в России) запрещено использовать ртуть из-за смертельной опасности этого элемента для человека.
Цианирование
Способ извлечения драгоценного элемента из руды цианированием основывается на способности золота растворяться в синильной кислоте (цианистом водороде, HCN) и ее солях. Руда обрабатывается слабым (0,03–0,3 %) раствором цианида. Благородный металл реагирует раньше других химических элементов, а после химической реакции осаждается из раствора.
Таблица: соответствие проб разных систем
В зависимости от свойств и состава драгметалла определяют не только стоимость готовых изделий, но и правила обращения с ними. Например, чистый металл требует более бережного отношения, т. к. подвержен воздействию механических нагрузок. Украшения для мужчин и женщин могут содержать минимум аурума. При этом проба самая низкая.
Наилучший вариант – драгоценности, которые содержат 50-70% драгметалла. Это могут быть браслеты, серьги, кулоны в виде знака зодиака, обручальные кольца и даже деньги (когда существовала Золотая Орда, и позднее, на территории России была востребована чеканка монет).
Сегодня платежных систем множество, как и способов определения чистоты золота, влияющего на валюту: каратная, метрическая. Чтобы уметь самостоятельно определять пробу, нужно изучить таблицу.
| Метрическая | Каратная | Золотниковая |
| 1000/999 | 24 | 96 |
| 958 | 23 | 92 |
| 875 | 21 | 84 |
| 750 | 18 | 72 |
| 583/585 | 14 | 56 |
| 500 | 12 | 48 |
| 375 | 9 | 36 |
Химия вещества
Вещество было найдено намного раньше, чем появилось золото в системе Менделеева. Но и в таблице у металла есть большое значение. Химики во все времена пытались проводить опыты над материалом, старались превратить другие ископаемые в драгоценные крупицы. Сера и кислород плохо влияют на другие элементы из системы Менделеева, но золото устойчиво к их воздействию. Незначительную реакцию проявляют только атомы на поверхности металла.
По содержанию материала определяют его характеристики и свойства. С некоторыми веществами реакции происходят даже при комнатной температуре, другие не изменяются под химическим воздействием при нагревании или разложении на атомы. Золото не поддаётся влиянию минеральных кислот, именно этим способом определяют качество металла. В школьном курсе химии проходят то, как называется золото по таблице Менделеева. Его название Aurum, элемент занимает 79 место в шестом периоде. Его атомная масса — 196,67, температура плавления — 1064, 43 градуса.
Ювелиры для проверки подлинности изделий используют азотную кислоту. Предмет опускают в ёмкость с жидкостью и оставляют на 5−10 минут. Если вещество не поменяло свой цвет, то оно является настоящим. Поддельное золото вступит в химическую реакцию с кислотой, изменит свой оттенок на зелёный.
Определение мировой стоимости золота и его статус на фондовом рынке
Аурум влияет на цену различных валют. На фондовых биржах ежедневно устанавливают стоимость драгметаллов, что позволяет отслеживать малейшие изменения. Однако сильных колебаний никто не ожидает, учитывая, что золото имеет статус безопасного актива, а значит, планируется устойчивый рост цены на Au. Но стоимость все же колеблется, что зависит от внешних факторов, среди них: количество добываемого металла, инфляция, спрос и предложение на аурум разных форм (украшения, слитки, монеты и др.).
Экономические сведения
Золото в экономике играет роль общенационального эквивалента. С его помощью выражают стоимость всех товаров, в некоторых случаях оно становится полноценными деньгами или средством обмена. Есть несколько физических и химических свойств, которые позволяют выделять золото в товарном мире:
- делимость;
- однородность;
- пластичность и ковкость;
- портативность — значительная стоимость при небольшой массе;
- лёгкая обработка.
Во многих государствах драгметалл используется для чеканки монет, а его слитки хранятся в банковских учреждениях.
Его применяют не только в ювелирной сфере, для какой его добывал изначально, но и для производства некоторых деталей электроники, промышленной и бытовой техники. Сначала вещество использовали только для отделки украшений и одежды, но в 1500 году до нашей эры в Китае, Месопотамии, Египте и Индии оно стало играть роль денежных средств. Вместе с золотом эти функции выполняли серебро и медь.
Желание разбогатеть подталкивало добытчиков к поиску новых месторождений. Так были открыты и колонизованы многие территории. Источники полезного ископаемого нашли в Европе, Азии, Африке, Южной и Северной Америке, Австралии. Его активно вывозили в развитые страны — Англию, Испанию, Францию, Германию. Великобритания стала первым государством, которое перешло на монометаллическую политику и исключило из обихода серебряные монеты. К XX веку эта валюта была утверждена в большинстве мировых стран.
После этого наступает кризис капитализма, государства начинают использовать бумажные деньги, которые нельзя разменять на золото. На некоторых территориях ограничивают и запрещают вывоз и ввоз металла, подготавливаются специальные рынки для работы с ним. Сегодня многие предприниматели и экономисты инвестируют в этот материал и получают неплохую прибыль за операции с ним.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Значение в искусстве
С самого начала разработки месторождений золото применяют для производства ювелирных изделий, украшений, религиозной и дворцовой утвари, посуды и столовых приборов. Мягкость и ковкость металла позволяет чеканить из него монеты, покрывать предметы гравировкой, заниматься литьём и изготовлением проволоки. Вещество применяется для создания филиграни, полировки поверхностей, которая будет после обработки переливаться световыми бликами с богатой игрой света и тени. Золото красиво смотрится в сочетании с другими материалами — серебром, платиной, жемчугом, драгоценными камнями, эмалью и чернью.
В медицине металл содержится в отечественных и импортных препаратах: взвеси масла, кризанил, миокризин, а также водорастворимых лекарствах, применяемых для приготовления растворов. Лекарства могут вызывать некоторые побочные эффекты, среди которых выделяют проблемы с почками, повышение температуры, раздражение кишечника. Нельзя прописывать средства, содержащие крупицы золота, тем, кто страдает от тяжёлых форм туберкулёза, почечной и печёночной недостаточности, заболеваний сосудистой системы и сахарного диабета.
Бета- и гамма-терапия подразумевает ввод в мягкие ткани гранул и штифтов из золота. Оно необходимо при лечении опухолей, но только в сочетании с хирургической и медикаментозной терапией. Предварительно проводят диагностику внутренних органов организма.
Золото играет большую роль в жизни человечества. Оно используется во многих сферах: экономической, ювелирной, медицинской, промышленной. Драгоценный металл имеет высокую стоимость, что обусловлено его физическими и химическими свойствами.
https://ru.wikipedia.org/wiki/%D0%97%D0%BE%D0%BB%D0%BE%D1%82%D0%BE
| Золото / Aurum (Au) | |
|---|---|
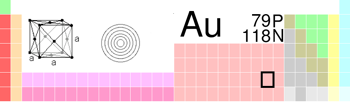  Атомный номер
ковкий жёлтый |
|
| Свойства атома | |
| Атомная масса (молярная масса) |
196,96654 а. е. м. (г/моль) |
| Радиус атома | 146 пм |
| Энергия ионизации (первый электрон) |
889,3 (9,22) кДж/моль (эВ) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s1 |
| Химические свойстваa | |
| Ковалентный радиус | 134 пм |
| Радиус иона | 42(+4e)271(-4e)пм |
| Электроотрицательность (по Полингу) |
2,54 |
| Электродный потенциал | Au←Au3+ 1,50В Au←Au + 1,70В |
| Степени окисления | 3,1 |
| Термодинамические свойства | |
| Плотность | 19,3 г/см³ |
| Удельная теплоёмкость | 0,129 Дж/(K·моль) |
| Теплопроводность | 318 Вт/(м·K) |
| Температура плавления | 1 337,58 K |
| Теплота плавления | 12,68 кДж/моль |
| Температура кипения | 3 080K |
| Теплота испарения | ~340 кДж/моль |
| Молярный объём | 10,2 см³/моль |
| Кристаллическая решётка | |
| Структура решётки | кубическая
гранецентрированая |
| Период решётки | 4,080 Å |
| Отношение c/a | n/a |
| Температура Дебая | 170,00 K |
Золото — 79-й элемент периодической системы элементов.
История
Золото — пожалуй, первый металл, с которым познакомилось человечество (см. подробнее благородные металлы).
В России первым золотодобытчиком считается Ерофей Марков, памятник которому стоит в городе Берёзовский близ Екатеринбурга.
Об истории добычи золота см. золотая лихорадка в Сибири, золотая лихорадка на Аляске.
Происхождение названия
Поскольку золото было известно, вероятно, ещё до появления письменности, проследить историю его названия, скорее всего, невозможно. Известно, однако, что в славянских языках слово золото имело в древности общий корень со словом «жёлтый», первоначальный вариант слова записывают как zolto. Некоторые связывают происхождения слова «золото» со словом «солнце» (корень sol). Однако достаточно достоверных версий происхождения названия нет.
Слово gold в европейских языках связано с греческим богом Солнца Гелиосом. Латинское aurum означает «жёлтое» и родственно с «Авророй» (Aurora) — утренней зарёй.
Физические свойства
Схема атома золота
Химический элемент периодической системы Менделеева; п. н 79, ат. В. 196,967; относится к благородным металлам. Известен лишь один устойчивый изотоп Au197. Из искусственно радиоактивных изотопов наиболее важны Au195 и Au198. Конфигураия внешних электронов атома золота. : 5d10 6s1. Энергия ионизации Au – Au+ 9,22 эВ.
Чистое золото — мягкий металл чисто желтого цвета. Красноватый оттенок некоторым изделиям из золота, например, монетам, придают примеси других металлов, в частности меди. В тонких пленках золото просвечивает зеленым. Золото обладает исключительно высокой теплопроводностью и низким сопротивлением.
Золото — очень тяжёлый металл: шар из чистого золота диаметром 46 мм имеет массу 1 кг. Литровая бутыль, заполненная золотым песком, весит приблизительно 16 кг. Тяжесть золота — плюс для его добычи. Самые простые технологические процессы, такие, как, например, промывка на шлюзах, могут обеспечить весьма высокую степень извлечения золота из промываемой породы.
Золото очень ковко и тягуче. Из кусочка золота весом в один грамм можно вытянуть проволоку длиной в три километра или изготовить золотую фольгу в 500 раз тоньше человеческого волоса (0,0001 мм). Через такой листочек фольги луч света просвечивает зеленоватым цветом. Мягкость чистого золота настолько велика, что его можно царапать ногтём. Поэтому в ювелирных изделиях золото всегда сплавляется с медью или серебром. Состав таких сплавов выражается пробой, которая указывает число весовых частей золота в 1000 частей сплава(в российской практике). Проба химически чистого золота соответствует 999.9 пробе — его ещё называют «банковским» золотом, так как из такого золота и изготавливают слитки.
Химические свойства
Золото относительно инертный металл, при нормальных условиях оно не реагирует с большинством кислот и не образует оксидов, благодаря чему было отнесено к благородным металлам, в отличие от металлов обычных, легко разрушающихся под действие окружающей среды. Затем была открыта способность царской водки растворять золото, что поколебало уверенность в его инертности.
Золото сравнительно легко реагирует с кислородом и другими окислителями при участии комплексобразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты:
- 4Au + 8CN— + 2H2O + O2 → 4[Au(CN)2]— + 4 OH—
В случае реакции с хлором возможность комплексообразования также значительно облегчает ход реакции: если с сухим хлором золото реагирует при ~200 °С с образованием хлорида золота(III), то в водном растворе (царская водка) золото растворяется с образованием хлораурат-иона уже при комнатной температуре:
- 2Au + 3Cl2 + 2Cl— → 2[AuCl4]—
Золото также растворяется в ртути, фактически образуя легкоплавкий сплав (амальгаму).
Физиологическое воздействие
Некоторые соединения золота токсичны, накапливаются в почках, печени, селезёнке и гипоталамусе, что может привести к органическим заболеваниям и дерматитам, стоматитам, тромбоцитопении.
Геохимия золота
Содержание золота в земной коре очень низкое — 3 мг/т, но месторождения и участки, резко обогащённые металлом, весьма многочисленны.
Для золота харатерна самородная форма. Среди других его форм стоит отметить электрум, сплав золота с серебром, который обладает зеленоватым оттенком и относительно легко разрушается при переносе водой. В горных породах золото обычно рассеяно на атомарном уровне. В месторождения оно зачастую заключено в сульфиды и арсениды.
Различаются первичные месторождения золота, россыпи, в которые оно попадает в результате разрушения рудных месторождений и месторождения с комплексными рудами, в которых золото извлекается в качестве попутного компонента.
Получение
Золотой самородок
Для получения золота используются его основные химические свойства: присутствие в природе в самородном состоянии, способность реагировать лишь с немногими веществами (ртуть, цианиды).
Промывка
Метод промывки основан на высокой плотности золота, благодаря которой в потоке воды, минералы с плотностью меньше золота (а это почти все минералы земной коры) смываются и металл концентрируется в тяжелой фракции, песка состоящего из минералов повышенной плотности, который называется шлихом. Этот процесс называется отмывкой шлиха или шлихованием. В небольших объёмах её можно проводить вручную, при помощи промывочного лотка. Этот способ используется с древнейших времен, и до сих пор для отработки маленьких россыпных месторождений старателями, но основное его применение — поиск месторождений золота, алмазов и других ценных металлов.
Промывка используется для разработки крупных россыпных месторождений, но при этом применяются специальные технические устройства: драги и промывочные устройства. Полученные шлихи кроме золота содержат множество других плотных минералов и металл из них извлекается, например, путем амальгамации.
Методом промывки разрабатываются все россыпные месторождения золота, ограничено он применяется на коренных месторождениях. Для этого породу дробят и затем подвергают промывке. Этот метод не может быть применен на месторождениях с рассеянным золотом, где оно так распылено в породе, что после дробления не обособляется в отдельные зерна и смывается при промывке вместе с другими минералами.
Этот метод добычи золота исторически был первым, и он очень дешев, потому, что не требует строительства дорогих заводов, и в случае речных отложений не нужно дробить породы. Экономически рентабельна отработка россыпей с содержанием золота 0,5 г/т.
Амальгамация
Метод амальгамации основан на способности ртути образовывать сплавы — амальгамы с различными металлами, в том числе и с золотом. В случае метода внутренней увлажнённая дроблёная порода смешивалась со ртутью и подвергалась дополнительному измельчению в мельницах — бегунных чашах. Амальгаму золота (и сопутствующих металлов) извлекали из получившегося шлама промывкой, после чего ртуть отгонялась из собранной амальгамы и использовалась повторно. Метод амальгамации известен с I века до н. э. наибольшие масштабы приобрёл в американских колониях Испании начиная с XVI века: это стало возможным благодаря наличию в Испании огромного ртутного месторождения — Альмаден. В более позднее время использовался метод внешней амальгамции, когда дроблёная золотоносная порода при промывке пропускалась через обогатительные шлюзы, выстланные медными листами, покрытыми тонким слоем ртути. Метод амальгамации применим только на месторождениях с высоким содержанием золота или уже при его обогащении. Сейчас он используется очень редко, главным образом старателями в Африке и Южной Америке.
Цианирование
Золото растворяется в растворах синильной кислоты и её солей, и это его свойство дало начало ряду методов извлечения путем цианирования руд.
Метод цианирования основан на реакции золота с цианидами в присутствии кислорода воздуха: измельчённая золотоносная порода обрабатывается разбавленным (0,3-0,03 %) раствором цианида натрия, золото из образующегося раствора цианоаурата натрия Na[Au(CN)2] осаждается либо цинковой пылью, либо на специальных ионнообменых смолах.
Метод цианирования первоначально применялся на крупных заводах, где порода дробилась и цианирование проводилось в специальных чанах. Однако развитие технологии привело к появлению метода кучного выщелачивания, который заключается в следующем: готовится водонепроницаемая площадка, на неё насыпается руда и её заливают растворами цианидов, которые просачиваясь через толщу породы растворяют золото, после этого они поступают в специальные колонны, в которых золото осаждается, а регенерированный раствор вновь отправляется на кучу.
Метод цианирования ограничен минеральным составом руд, он не применим если руда содержит большое количество сульфидов или арсенидов, так как цианиды реагируют с этими минералами. Поэтому цианированием перерабатываются малосульфидные руды, или руды из зоны окисления, в которой сульфиды и арсениды окислены атмосферным кислородом.
Для извлечения золота из сульфидных руд используются сложные многоэтапные технологии. Золото добытое из месторождений содержит различные примеси, поэтому его подвергают специальным процессам высокой очистки, которые производятся на аффинажных заводах.
Применение
Золото в промышленности
По своей химической стойкости и механической прочности ,золото уступает большинству платиноидов, но незаменимо, как материал для электрических контактов. Поэтому в микроэлектронике золотые проводники и гальванические покрытия золотом (контактных поверхностей, разъёмов, печатных плат) используются очень широко.
Золото используется в качестве мишени в ядерных исследованиях, в качестве покрытия зеркал работающих в дальнем инфракрасном диапазоне, в качестве специальной оболочки в нейтронной бомбе.
Золотые припои очень хорошо смачивают различные металлические поверхности и применяются при пайке металлов. Тонкие прокладки, изготовленные из мягких сплавов золота, используются в технике сверхвысокого вакуума.
Золочение металлов (в древности — исключительно амальгамный метод, в настоящее время — преимущественно гальваническое) широко используется в качестве метода защиты от коррозии. Хотя такое покрытие неблагородных металлов имеет существенные недостатки (мягкость покрытия, высокий потенциал при точечной коррозии), оно распространено также из-за того, что готовое изделие приобретает вид очень дорогого, «золотого».
Золото в экономике
Золотые слитки
Золото является важнейшим элементом мировой финансовой системы, поскольку данный металл не подвержен коррозии, внешне привлекателен и запасы его невелики. Мировые банковские резервы золота оцениваются в 32 тыс. тонн (если сплавить все это золото воедино, получится куб со стороной всего лишь 12 м).
Золото издавна использовалось многими народами в качестве денег. Золотые монеты — самый хорошо сохраняющийся памятник старины. Однако как монопольный денежный товар оно утвердилось только к XIX веку. Вплоть до Первой мировой войны золото являлось мерилом всех мировых валют (период 1870—1914 называют «золотым веком»). Бумажные купюры в это время выполняли роль удостоверений о наличии золота. Они свободно обменивались на золото.
В 1792 в США было установлено, что 1 унция золота содержится в 19,3 $. В 1834 году за унцию давали уже 20,67 $, поскольку США не имели достаточного золотого запаса, чтобы обеспечить весь объём выпущенных денег, и курс валюты приходилось снижать.
После Первой мировой войны девальвация продолжалась. В 1934 году за 1 унцию золота давали 35 $. Несмотря на экономический кризис, США пытались сохранить фиксированную привязку доллара к золоту, ради этого поднималась учётная ставка, но это не помогло. Однако в связи с последовавшими войнами золото из Старого Света стало перемещаться в Новый, что восстановило на время привязку доллара к золоту.
В 1944 было принято Бреттон-Вудское соглашение. Был введен золотодевизный стандарт, основанный на золоте и двух валютах — долларе США и фунте стерлингов Великобритании, что положило конец монополии золотого стандарта. Согласно новым правилам, доллар становился единственной валютой, напрямую привязанной к золоту. Казначейство США обязывалось обменивать доллары на золото иностранным правительственным учреждениям и центральным банкам в соотношении 35 $ за тройскую унцию. Фактически золото превратилось из основной в резервную валюту.
В конце 1960-х годов высокая инфляция в США вновь сделала невозможным сохранение золотой привязки на прежнем уровне, ситуацию осложнял и внешнеторговый дефицит США. Рыночная цена золота стала ощутимо превышать официально установленную. В 1971 содержание золота в долларе было снижено до 38 $ за унцию, а в 1973 — до 42,22 $ за унцию. В 1971 президент США Ричард Никсон отменил привязку доллара к золоту, хотя официально этот шаг был подтвержден лишь в 1976, когда была создана так называемая ямайская валютная система плавающих курсов. Это означало, что золото перестало быть валютой вообще, а доллар превратился в резервную валюту.
После этого золото превратилось в особый инвестиционный товар. Инвесторы на протяжении многих лет доверяли исключительно золоту. К концу 1974 цены на золото подскочили до 195 $ за унцию, а к 1978 — до 200 $ за унцию. К началу 1980 года цена на золото достигло рекордной отметки — 850 $ за унцию, после чего она начала постепенно падать. В конце 1987 года она составляла около 500 $ за унцию. Самое быстрое падение произошло в 1996—1999 гг., когда цена на золото снизилась с 420 до 260 $ за унцию. Среди аналитиков нет единого мнения по поводу причин столь быстрого снижения цены на золото: одни объясняют это объективными экономическими факторами, другие говорят о глобальном заговоре крупнейших стран во главе с США.
Как бы то ни было, падение прекратилось и снова начался рост цены на золота в связи с соглашением ведущих центральных банков об ограничении продаж золота в 1999 году. К концу 2004 году цена на золото достигла 450 $. Аналитики предсказывают, что по причине нестабильности экономики США и мирового финансового климата в целом цена на золото может вырасти до 1000 $ за унцию.
Золото для инвестиций выступает в двух формах — золотые слитки и золотые монеты.
Золотой запас России
См. также Золотой запас Российской Империи
Запасы золота в государственном резерве России в марте 2006 г. составили 386,6 тонны (без учета золота в операциях swap). Доля золота в общем объёме золотовалютных резервов России в марте 2006 составила 3,8 %. Россия занимает 14 место в мире по объёму золота, находящегося в государственном резерве.
Золото, как материал для ювелирных изделий
Золотые сплавы в стоматологии
Благодаря высокой коррозионной стойкости и лёгкости обработки, золото издавно использовалось, как материал для зубных протезов. Для придания изделиям высокой прочности, применяют специальные сплавы.
Меры чистоты золота
Британская каратная система
Традиционно чистота золота измеряется в британских каратах. 1 британский карат равен одной двадцать четвертой части массы сплава. 24-каратное золото (24K) является чистым, без каких-либо примесей.
Чтобы изменить качественные характеристики золота, для различных целей (например, увеличить твердость) изготавливают сплавы с различными примесями. Например, 18-каратное золото (18K) означает содержание в сплаве 18 частей золота и 6 частей примесей.
Российская система проб
Принятая в России система отличается от общемировой. В России чистота золота измеряется пробой.
Проба варьируется от 0 до 1000 и показывает содержание золота в тысячных долях. Так, 18-каратное золото соответствует 750-й пробе. Золото 996-й пробы считается «практически чистым» и используется в ювелирных изделиях. Золото более высоких проб крайне дорого в получении и употребляется только в химии.
См. также
- Сусальное золото
- Белое золото
- Хлорид золота
- Червонец
Устойчивые выражения
- Золотые руки
- Золотой теленок
- Золотое кольцо России
- Золото партии
- Золотая Орда
- Золотой Берег
- Золотой Рог
- Золотые ворота
- Золотые Пески
Ссылки
- Золото на Webelements
- Золото в Популярной библиотеке химических элементов
- Золото на www.booksite.ru
- Русский Золотой Портал: Золото как инвестиции
| 1 | H |
|
He | |||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| Iа | IIа | IIIб | IIIб: лантаноиды и актиноиды | IVб | Vб | VIб | VIIб | VIIIб | Iб | IIб | IIIа | IVа | Vа | VIа | VIIа | VIIIа | ||||||||||||||||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
|
Выделить Золото и найти в:
|
|
|
- Страница 0 — краткая статья
- Страница 1 — энциклопедическая статья
- Разное — на страницах: 2 , 3 , 4 , 5
- Прошу вносить вашу информацию в «Золото 1», чтобы сохранить ее
Комментарии читателей:
На чтение 14 мин.
Один из наиболее распространенных материалов в давние времена и сегодня – золото, в таблице Менделеева находится среди других драгоценных металлов (иридий, платина, серебро, палладий и др.). Его отличает от них не только формула и характеристики, но и ценность, а также происхождение. Однако главная особенность Au заключается в противоречивых свойствах. Так, твердость золота по шкале Мооса одна из самых низких, но зато ценность – высокая. Несмотря на подобные тонкости, изделия из золотого сплава применяются достаточно широко, металл добывается на протяжении веков (история золота насчитывает многие тысячелетия). Au продолжает образовываться до сих пор.
Золото Au – aurum (аурум): этимология слова
Название металла aurum читается на латинском языке как «аурум» (пишется так же, как и слышится/произносится). Распространено сокращенное обозначение (используются буквы – Au). Именно такой вариант применяется в химии при составлении формул веществ, соединений. Это элемент периодической таблицы Менделеева, относится к 6 периоду.
Главные отличительные признаки: желтый цвет, нехарактерный для других драгоценных металлов звук при ударе, мягкость. Если интересно, как обозначается золото в таблице Менделеева, нужно искать элемент под номером 79.
Этимология слова, которым называется драгметалл, включает в себя разные расшифровки значения:
- старинный славянский вариант – в основе лежит слово «злато»;
- литовское значение geltonas – «желтый»;
- латинское название золота в переводе соответствует характерному цвету драгоценного металла – «желтый».
Кроме того, аурум ассоциируется с солнцем, поэтому в древние времена использовался соответствующий знак/символ для обозначения такого металла. В продолжение логической цепочки отмечается взаимосвязь между цветом Au и солнца. По этой причине во многих странах среди фактов о золоте можно найти и единственно возможное значение его названия. Это цвет – желтый. Еще одно объяснение этого – праиндоевропейский корень «желтый, зеленый, яркий».
Существует немало теорий, объясняющих, что такое золото, где образовалось, почему оказалось в земной коре и ядре планеты. Ранее было принято считать, что Au во вселенной – это следствие процессов в структуре звезд (нуклеосинтеза). Однако позднее появились новые предположения, откуда берет начало история золота. Так, существует теория, что частицы металла – следствие разрушения нейтронных звезд.
Aurum отличается существенным весом. Даже после распада частицы будут стремительно падать. Они проходят через атмосферу вместе с астероидами (как при поздней тяжелой бомбардировке, во времена, соответствующие периоду 3,8 млрд лет назад). Это вероятный путь попадания драгметалла в кору планеты. Можно предположить, откуда на Земле появилось золото. Пыль, оставшаяся после взрыва звезды, постепенно конденсируется. В таком виде попадает на планету.
Если интересно, откуда берется золото в природе, следует учитывать, что существенная его доля содержится в земном ядре. Туда металл попал, опять же, благодаря значительному весу. Это один из главных признаков, позволяющих определить, является ли изделие из аурума оригинальным (они всегда тяжелее многих прочих: из серебра, латуни). Кроме того, строятся и другие теории, как появилось золото на Земле, а оказалось в ядре. Считается, что это результат воздействия высоких температур, когда планета находилась в расплавленном состоянии.
Однако теории, на основании которых делаются предположения, откуда появилось золото, не всегда имеют под собой основания. Например, версия о том, что звездная пыль (золотая) попадает в открытый космос, а затем оседает на Земле, поразила несоответствием фактов, например, нет информации, что подобные процессы действительно развиваются. Ученые пока не дают конкретных данных, но делают заявления, что такие предположения (касательно падающей золотой пыли) – косвенные. Нет достаточной информации, а подтвердить теорию невозможно из-за особенностей работы спутниковых спектроскопов.
Интересно: Аурум находится в земной коре, мантии, ядре планеты, а также в воде. Считается, что 1 км2 содержит 1 кг драгметалла.
Место 79 в периодической таблице Менделеева. История открытия элемента
Au – элемент таблицы, который находится под номером 79. Описание начинают, освещая особенности металла:
- относится к первой группе таблицы;
- представляет тяжелые металлы;
- благодаря свойствам есть возможность узнать все о золоте, например, драгметалл не взаимодействует с неметаллами, исключение составляют галогены.
Аурум считается наиболее давним металлом. Его открыли первым, а произошло это примерно 11 тыс. лет назад. Разные источники называют другие даты: VI и IV века до н. э. Однако все они имеют право на существование, т. к. появились на фоне свидетельств обнаружения изделий из этого драгметалла. Один из примеров – найдены украшения возрастом 3 тыс. лет до н. э. Ранее изделия из золота считались наиболее ценными, т. к. материал получил статус «царь металлов».
По мере разработки новых месторождений в прежние времена обнаруживали источники нефти. Однако ранее не было достаточно информации о данном полезном ископаемом. Нефть не была популярной, тогда еще не открыли ее свойств, не оценили степень пользы для человечества. А значит, искали, прежде всего, аурум. Нефть же и сопутствующие полезные ископаемые – находились случайно во время разработки грунта.
Постепенно золотодобыча стала набирать обороты. В поисках Au, во время разработки земель, где еще никто не бывал, происходило открытие новых месторождений, т. к. постепенно запасы драгметалла иссякали. Чтобы пополнить их, совершали походы на другие территории. Достоверно неизвестно, кто открыл золото, т. к. уже сложно воспроизвести цепочку давних событий. Это сделали люди, жившие много тысяч лет назад. История открытия золота предполагает необходимость учета всех упоминаний, а они встречаются в разные века и на различных территориях.
Золото в природе: первичные и вторичные месторождения
Если интересно, как образуется золото в природе, необходимо рассмотреть 2 способа:
- первичный или коренной;
- вторичный (рассыпные месторождения).
Первый из вариантов – самородное золото. Это результат магматических процессов, что подтверждает содержание наибольшего количества золота в ядре Земли. Появляется драгметалл на поверхности вследствие извержения вулканов.
Причем состав золота необычный – чаще всего это чистое вещество.
Его образование обусловлено процессом плавления, когда при смешении легкоплавких соединений в составе жидкой лавы происходит их постепенное остывание (при выходе массы на поверхность). Как результат, разрушаются сторонние соединения (включая соль), остается чистый аурум – подобие камня, но с другими свойствами. Преимуществом металла является однородность структуры.
Разработка вторичных месторождений – основной способ добычи драгметалла. Такое золото входит в состав различных минералов. Не весь объем Au, содержащийся в магме, образует самородки, немалое количество остается смешанным. С учетом этого свойства золота могут отличаться. Минералы и соединения, из которых состоит драгоценная смесь:
- кварц;
- железо;
- сульфид цинка и свинца;
- медный колчедан.
Чаще всего аурум обнаруживается вместе с кварцем, серебром и медью. Еще один популярный вариант – смесь с платиной. Появляясь из земного ядра или коры, драгметаллы сплавляются, поэтому чаще всего Au обнаруживается при разработке месторождений минералов, других металлов и веществ.
Причем аурум содержится в виде мелких частиц, поэтому требуется использовать специальные средства для поиска и очистки драгметалла от добавочных компонентов. Это рассыпные месторождения – следствие отделения аурума от большей части примесей благодаря его свойствам (например, существенной массе).
Золото в химии: химические и физические свойства, формула, электронная конфигурация, кристаллическая решетка, из чего состоит, масса элемента
Химическая формула золота – это неопределенное понятие, т. к. она зависит от состава материала. Металл соединяется с малым количеством веществ, примесей и соединений. В результате меняются и физические свойства золота. Основные характеристики, параметры драгметалла:
- эмпирическая формула золота – Au;
- кристаллическая решетка – кубическая, тип – гранецентрированная;
- теплопроводность металла – 318 Вт/м*К;
- плотность составляет 19,3 г/см3;
- металл непрозрачный;
- запах отсутствует;
- электронная конфигурация – {Хе} 4f145d106S1;
- температура плавления – 1064,18°С;
- атомная (молярная) масса – 196,966569 а.е.м. (г/моль).
Аурум – мягкий металл. Среди основных свойств золота отмечают и такой параметр, как показатель твердости. Используют разные методы для его определения:
- по Моосу – 2,5;
- по Виккерсу – 2,16 ГПа;
- по Бриннелю – 2,45 ГПа.
Реакция на кислоты
Кроме перечисленных, отмечают и свойства золота, позволяющие оценить его способность взаимодействовать с другими компонентами, веществами. Аурум – условно инертный материал (в чистом виде). Таким он может называться, т. к. существует мало веществ, с которыми Au вступает в реакцию. К ним относятся некоторые кислоты. Благодаря этому металл называют благородным.
Для сравнения большинство других окисляется, теряет свойства. В этом отношении аурум превосходит остальные материалы. Кроме того, селеновая кислота при высоких температурах (+200 градусов) способствует растворению Au.
Драгметалл подвержен воздействию хлорной кислоты (при комнатной температуре), что приводит к образованию оксида хлора и перхлората золота.
Степень окисления и взаимодействие с галогенами
Аурум реагирует на кислород, не только на вещества агрессивного действия. Степень окисления может быть разной, что зависит и от вещества, с которым может произойти предполагаемая химическая реакция.
Кроме того, соединения, которые образовались при этом, имеют свойство восстанавливаться, а другие, наоборот, способствуют полному растворению драгметалла.
Au взаимодействует с галогенами. Причем изменения происходят намного быстрее, чем при соединении с другими веществами. Для сравнения с кислородом аурум не вступает в реакцию напрямую, но подвержен его действию – окисляется. С галогенами же реакция происходит напрямую.
Золото – это смесь или чистое вещество
Au в чистом виде представляет собой вещество. Металл не содержит примесей, но это возможно, только если аурум представлен самородком. При этом не говорят о химическом составе золота, т. к. это однокомпонентный материал. Aurum мягкий и ломкий, когда встречается без добавок. Однако драгметалл может состоять из нескольких компонентов. Это способствует изменению характеристик золота, свойства зависят от типа примесей. У сплава есть главное отличие – металл твердый, пластичный. Но его ценность ниже.
Используемые сплавы с другими металлами
Сплав представляет собой смесь металлов, содержание аурума при этом определяется в процентах. Смесь компонентов может образоваться в естественной среде или при непосредственном участии человека. Сплав больше подходит для работы с драгметаллом. Причем условно он будет обозначаться также – аурум, но фактически это уже другой металл. От состава зависит область применения материала, внешний вид, а также оттенок (красный, белый, желтый, зеленый и др.).
Содержание лигатур и драгметалла определяется ГОСТом.
Стародавняя и современная история золота разнообразна, раскрывает несколько методов добычи Au. Чтобы он смог появиться из земной коры, выполняются разные манипуляции. Из крупных водоемов аурум не добывают – это неоправданно дорого, а результат слабый. Основные источники – поверхностные и более глубокие слои грунта. Чтобы поднять драгметалл с глубины, очистить от примесей, используют несколько основных технологий.
Шлихование (промывка) – древний способ отмывания золотого песка
Такой метод лучший, если необходимо вести поисковые работы, чтобы обнаружить аурум. Основан на опробовании мелких водоемов (речек, ручьев). Частицы драгметалла начинают распространяться вследствие разрушения горных пород, частью которых стали. Этому способствуют мелкие водоемы – речки, ручьи. Аурум выглядит, как блестящие частицы желтого цвета. Это шлих, обозначающий, что здесь есть драгметалл. Такая особенность объясняет, почему Au обнаруживается преимущественно на Урале и других северных регионах России.
Амальгамация с помощью ртути
Метод основан на способности аурума реагировать на воздействие ртути. Чтобы из пустой породы получить драгметалл, нужно браться за процесс основательно. Для этого требуется смачивать жидким металлом aurum, результат будет интересным – образуется амальгама, что позволяет диспергировать Au, а позднее – восстановить его первоначальную форму.
Цианирование – добыча золота из руды
Процесс называется выщелачиванием. Нужно вспомнить, что аурум устойчив к окислению при обычной температуре. Учитывая эти свойства золота, можно получить драгметалл из породы, воздействуя на него растворами цианида. Свободный от примесей металл восстанавливают до первоначальных свойств.
Недостатком метода является возможность получить меньше драгметалла, чем изначально содержала порода. Кроме того, цианид используют для работы с низкокачественной рудой.
Стародавняя история золота не включает в себя применение методов оценки качества драгметалла. Ранее не использовались такие способы. Лишь несколько веков назад начали применять системы определения чистоты аурума. Причем одна сменяла другую. Стали появляться новые методы, их возникновение связано с изменениями в политике и экономике государств.
Каратная система
Более ранняя история золота содержит информацию о применении каратной системы, как самой давней. Она применяется на территории США, Европы. За основу берется 24 карата сплава. Это эталонный показатель качества материала. Слиток чистого металла пробируется, как материал пробы 24 карата. Когда количество драгметалла уменьшается, содержание добавок возрастает. Тогда проба материала будет менее 24 карат.
Метрическая система
Оценивают долю аурума, как количество миллиграммов на 1 грамм чистого металла. Такие манипуляции при определении содержания примесей стали делать в 19-20 веках. На территории Европы метрическая система введена раньше, а в СССР – позднее.
Золотниковая система
Метод использовался с конца 18 вплоть до середины 20 века. При этом был сделан упор на меру – русский фунт, содержащий 96 золотников (эталонное значение). Чем меньше аурума содержит металл, тем ниже проба. Соответственно, обозначение 96 должно читаться, как чистый Au.
Таблица: соответствие проб разных систем
В зависимости от свойств и состава драгметалла определяют не только стоимость готовых изделий, но и правила обращения с ними. Например, чистый металл требует более бережного отношения, т. к. подвержен воздействию механических нагрузок. Украшения для мужчин и женщин могут содержать минимум аурума. При этом проба самая низкая.
Наилучший вариант – драгоценности, которые содержат 50-70% драгметалла. Это могут быть браслеты, серьги, кулоны в виде знака зодиака, обручальные кольца и даже деньги (когда существовала Золотая Орда, и позднее, на территории России была востребована чеканка монет).
Сегодня платежных систем множество, как и способов определения чистоты золота, влияющего на валюту: каратная, метрическая. Чтобы уметь самостоятельно определять пробу, нужно изучить таблицу.
| Метрическая | Каратная | Золотниковая |
|---|---|---|
| 1000/999 | 24 | 96 |
| 958 | 23 | 92 |
| 875 | 21 | 84 |
| 750 | 18 | 72 |
| 583/585 | 14 | 56 |
| 500 | 12 | 48 |
| 375 | 9 | 36 |
Сферы применения золота
Предметы роскоши (как, например, тарелка Роквелла) менее востребованы, чем другие изделия. Чаще возникает необходимость в украшениях, деталях электротехники. Применяют золото, когда создают разные виды покрытий из этого материала.
Основные направления применения драгметалла:
- ювелирная индустрия: производится большое количество украшений, среди них есть и массивные, а также почти прозрачные (ажурные) изделия;
- объект инвестирования: аурум давно определяет международные отношения, влияет и на стоимость валюты, цена же золота постоянно растет, но медленно, поэтому заработать на разнице между стоимостью покупки и продажи возможно только через десятки лет – это инвестиция на перспективу;
- денежный оборот – ранее использовались монеты в качестве денежных знаков, сегодня они не применяются, но аурум продолжает участвовать в денежном обороте, только делает это косвенно;
- промышленность: изготавливают различные детали механизмов, элементы печатных плат и т. д.;
- фармакология: Au входит в состав препаратов некоторых видов;
- стоматология: выполняют протезирование с использованием золота;
- косметология: в состав косметических средств входит коллоидное золото, когда удалось открыть такое свойство аурума, это потрясло мир профессиональной косметики, т. к. драгметалл приносит пользу организму;
- пищевая промышленность: золотые частицы используются в качестве добавки (Е175), но применяется она нечасто.
Определение мировой стоимости золота и его статус на фондовом рынке
Аурум влияет на цену различных валют. На фондовых биржах ежедневно устанавливают стоимость драгметаллов, что позволяет отслеживать малейшие изменения. Однако сильных колебаний никто не ожидает, учитывая, что золото имеет статус безопасного актива, а значит, планируется устойчивый рост цены на Au. Но стоимость все же колеблется, что зависит от внешних факторов, среди них: количество добываемого металла, инфляция, спрос и предложение на аурум разных форм (украшения, слитки, монеты и др.).
Видео: Золото – 79 элемент таблицы Менделеева
Тот, кто взялся за изучение «магических» свойств аурума, может узнать о драгметалле много необычного. Интересные факты о золоте:
- в природе Au распространен слабо, основная часть скрыта глубоко под землей;
- количество золота в литосфере – 4,3·10-7%;
- драгметалл содержит даже морская вода, но его доля еще меньше (в 1 л воды – 4,3·10-9%);
- растения получают из почвы некоторое количество аурума по мере роста;
- основные запасы драгоценного металла сосредоточены на территории России, Канады, ЮАР.
При изучении информации о золотых сплавах на сайтах при выборе продукции нужно понимать, что предлагаются разные материалы. Они могут содержать больше/меньше Au. О разнице должно писаться и на сайтах производителей украшений, прочих ценных изделий из золота, что позволит избежать покупки подделки.
Post Views: 16 166
Новость о первой найденном золотом самородке датируется аж периодом неолита. Тогда горную породу использовали при изготовлении посуды и различных предметов быта. Металл был распространён в Древнем Египте, Риме, Китае и Индии. В те времена золото называли царём всех металлов. Древние люди верили, что материал жёлтого цвета обладает лечебными и магическими свойствами, он был символом солнца. Позже его стали использовать как платёжное средство. Золото подчёркивало высокий статус владельца, но и было опасно: люди были готовы на любые поступки, чтобы завладеть привлекательным и драгоценным материалом.
Первые цивилизации на территории Центральной Европы, Южной Америки и Северной Африки добывали золото ручным способом. Несколько самородков весом в 8−10 г можно было получить только за 2−3 дня. Поскольку минерал не могли очистить от примесей, в тот период он имел низкую пробу. Во время поздней античности стала набирать популярность алхимия. Люди научились превращать недрагоценные вещества в благородные. Хотя алхимия не достигла больших успехов, благодаря ей существуют современные технологии, которые позволяют добыть из руды золото и очистить его от примесей.
Некоторых людей интересует, почему при открытии металла учёные дали такое название химическому элементу. «Золото» родственно обозначениям солнца на разных языках. Наименование элемента Aurum с латыни переводится как «жёлтый». Слово родственно с «Авророй» (Aurora), богиней утренней зари. На славянском языке «жёлтый» звучало как «зёлто», что близко к золоту.
Открытие в природе
В природных условиях золото встречается часто. Оно составляет почти 5% всей литосферы планеты. Высокая цена металла обусловлена его трудоёмкой добычей даже со специальной техникой. Существует много видов горных пород, в составе которых есть мелкие частицы золота, однако оно представлено рассеянной пылью. Из истории известны интересные факты, что люди находили крупные залежи ископаемого просто под пластами земли.
Химический элемент формируется в земной коре под влиянием перепадов температуры. Материал добывают из железных и минеральных руд. В основном металл встречается в виде самородков, но в природе можно встретить его соединения с серебром, висмутом, медью, селеном или сурьмой. Известные природные твёрдые растворы называются:
- электрум (серебристое золото);
- аурокуприд (медистое золото);
- порпецит (палладистое золото).
Есть вторичные месторождения вещества, которые представляют собой результат разрушения первичных соединений. Причины происхождения таких ископаемых могут быть:
- физическими (ветер, вода, колебания температуры);
- химическими (химические реакции);
- биологическими (бактерии и другие микроорганизмы).
Довольно большой объём химического элемента встречается в морской воде, но добывать его оттуда нерентабельно. Россыпь материала похожа на песок, который разносится течением на далёкие расстояния от первичного месторождения. Небольшое количество чистого вещества можно обнаружить даже в обычной проточной воде.
Сегодня драгметалл добывают во многих странах мира:
- Россия;
- Китай;
- Австралия;
- Перу;
- Канада;
- США;
- ЮАР.
Золото обнаружено в Гане, Индонезии и Мексике. Эти страны поставляют золото на мировой рынок металлов. На физической карте он отмечается условным знаком в виде круга с затушёванной левой половиной.
Строение атома и физические свойства
В таблице золото располагается в шестом периоде в подгруппе меди 11 группы. Его обозначение буквами — Au. Элемент имеет порядковый номер — 79. В ядре атома металла находится 79 протонов и 117 нейтронов. На шести энергетических уровнях атома располагаются 79 электронов. Природный элемент существует в виде химически устойчивого изотопа 197Au. Остальные нестабильны и возможны только в условиях ядерного реактора.
Распределение электронов по орбиталям в электронной формуле золота — 1s22s22p63s23p63d104s24p64f145s25p65d106s1. В своих соединениях металл проявляет валентность I. Это обусловлено наличием одного неспаренного электрона. Но для элемента также характерна валентность II.
Золото относится к группе переходных металлов. Абсолютно чистое вещество характеризуется ярко-жёлтым цветом. Если в минерале есть примеси меди, тогда он может обладать красноватым оттенком. Химическому элементу характерна гранецентрированная кубическая кристаллическая решётка.
Основные физические характеристики золота:
- температура плавления — 1064,18 °C;
- температура кипения — 2856 °C;
- атомная масса — 196,96655;
- плотность — 19,3 г/см3;
- молярный объём — 10,2 см3/моль;
- твёрдость по шкале Мооса — 2,5.
Вещество характеризуется пластичностью и гибкостью. Золото — самый мягкий среди всех металлов, оно отлично поддаётся обработке. Изделия из этого вещества высокой пробы возможно погнуть и повредить, поэтому их нужно беречь от любых механических повреждений. При изготовлении столовых приборов производители добавляют в золото дополнительные сплавы, которые повышают прочность предметов. Жидкое вещество летучее и способно испаряться ещё до температуры плавления.
Минерал отличается высокой стойкостью к химическим реакциям и процессам. Это отличный проводник, который быстро транспортирует электрический ток и тепловую энергию. Металл легко полируется, после обработки приобретает мягкий блеск. Тонкая пластина, изготовленная из золота, способна пропускать свет. Поскольку температура вещества падает, его можно применять для тонировки окон.
Химические особенности
Золото имеет несколько степеней окисления: +1, +3, -1. Показатель +5 проявляется с фтором, соединение с которым выступает сильнейшим окислителем.
Поскольку элемент характеризуется относительной инертностью, он обычно не растворяется в кислотах. Поэтому его можно очищать от примесей этими соединениями. Однако есть несколько исключений: золото может растворяться в селеновой и синильной кислотах, цианидах, а также в царской водке.
В естественных условиях металл не окисляется под влиянием кислорода. Это одна из причин, почему он считается драгоценным. При высоких температурах вещество взаимодействует с галогенами (йодом, бромом и хлором).
Наиболее устойчивая — степень окисления +3. С однозарядными анионами золото образует плоско-квадратные комплексы. Степень окисления +1 считается относительно устойчивой. Показатель +2 обычно выражен формально, но при нём в веществах половина металла окислена до +1, а другая — до +3. В ауридах степень окисления Au равна -1.
Золото может реагировать с хлорной кислотой при комнатной температуре с образованием нестойких оксидов хлора, оно взаимодействует с кислородом и иными окислителями при комплексообразователях: растворяясь в цианидах, элемент образует цианоаураты.
Способы получения
Современные технологии позволяют получать благородный металл химическими способами. В 1947 году физики из США смогли преобразовать ртуть в золото. Однако такой путь требует крупных затрат, поэтому он не имеет экономического значения.
Популярные способы получения вещества:
- Промывка. Поскольку металл обладает высокой плотностью, его можно получить в потоке воды, которая смывает примеси с материала. Предварительно добытые ископаемые дробят, а затем промывают. В результате остаётся шлих, который представляет собой золотой песок тяжёлой фракции. Промывка применяется ещё с древних времён для обработки небольших россыпных месторождений. Сегодня при этом методе используются специальные промывочные установки и драги. Во время промывки специалисты следят не только за мелкими, но и за крупными обломками, которые могут оказаться самородками.
- Амальгамация. Этот метод был распространён в Испании в XVI веке. Тогда дроблёную породу сначала увлажняли, затем смешивали со ртутью и дополнительно измельчали на мельницах. После этого получался сплав амальгам, который подвергали промывке для получения золота. Позже дроблёный материал стали пропускать через специальные шлюзы с медными листами, покрытыми тонким слоем ртути. Этот способ применяется только на месторождениях с большим объёмом драгоценного металла. Сегодня он популярен в Африке и Южной Америке.
- Цианирование. При этом методе золото смешивают с цианидами в присутствии кислорода. Полученный измельчённый материал обрабатывают раствором цианида натрия, а затем осаждают нужное вещество цинковой пылью или ионообменными смолами. Сначала такой способ использовался на крупных заводах в специальных чанах для дробления добытых ископаемых. Но с развитием технологий было придумано кучное выщелачивание: на водонепроницаемую площадку насыпают руду и орошают её растворами цианидов. Растворившееся вещество попадает в специальные колонны, в которых осаждается.
Есть метод регенерации. Его осуществляют с помощью раствора щёлочи 10%, который воздействует на растворы солей золота и потом осаждает металл на алюминий из горячего раствора гидроксида. Чтобы извлечь элемент из сульфидных руд, используются многоэтапные технологии с высокой степенью очистки.
Сферы применения
Золото давно используется различными странами в виде монет. Однако в качестве монопольного денежного средства их утвердили только к XIX веку.
Сегодня драгметалл используется во многих сферах жизни общества:
- Ювелирная промышленность. Именно на эту область приходится большой объём добываемой горной породы. Украшения и аксессуары производят не из чистого вещества, а из его сплавов с другими металлами, которые повышают механическую прочность и стойкость изделий. Обычно золото соединяют с серебром и медью. Дополнительными компонентами служат цинк, кобальт, никель или палладий. Драгметалл определяет устойчивость сплава к коррозии, соотношение меди и серебра — оттенок и механические особенности. Важная характеристика таких изделий — проба. Она определяется содержанием золота в них.
- Промышленность. Вещество используется для электрических контактов. Микроэлектроника не обходится без золотых проводников и гальванических покрытий металлом. Обработка оконных стёкол этим материалом позволяет уменьшить потери тепла зимой и предохранить помещения от нагревания ультрафиолетовыми лучами летом. Золотыми припоями смачивают поверхности из разных металлов. Вещество применяется для защиты от коррозии и придания другим материалам дорогого вида.
- Стоматология. Золотые сплавы применяют для производства коронок и зубных протезов, которые не портятся.
- Фармакология. Вещество часто служит дополнительным компонентом в лекарствах от туберкулёза и ревматоидных артритов. Радиоактивный изотоп, который обозначается 198Au, применяется для лечения злокачественных опухолей. Перед использованием препаратов необходимо убедиться в том, что у пациента нет негативных реакций на золото.
- Пищевая промышленность. Элементом в качестве пищевой добавки E175 декорируют различные блюда.
Во все времена золото служило важным элементом финансовой системы. Этот металл не подвержен коррозии, поэтому ему стараются найти применение в различных областях. Периодически роль металла снижалась в качестве международной валюты, однако банки в любых странах хранят его как самый важный источник ликвидности.
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
золото
Внешний вид:
желт. кубические металл
Кристаллические модификации, цвет растворов и паров:
Кусковое имеет желтый отраженный цвет, тонкая фольга на просвет синяя или зеленая, пары имеют зеленовато-желтый цвет. Коллоидные растворы имеют различную окраску в зависимости от степени дисперсности (например, при попадании соединений золота на кожу образуется коллоид фиолетового цвета).
Брутто-формула (система Хилла): Au
Формула в виде текста: Au
Молекулярная масса (в а.е.м.): 196,97
Температура плавления (в °C): 1063,4
Температура кипения (в °C): 2880
Растворимость (в г/100 г или характеристика):
вода: не растворим
ртуть: 0,13 (18°C)
этанол: не растворим
Природные и антропогенные источники:
Содержание золота в земной коре 0,000 000 5%. Встречается в природе в основном в самородном виде (крупнейший самородок весил 112 кг). Известны минералы в основном теллуридной природы: калаверит, сильванит, креинерит, петцит, ауростибит. Среднее содержание золота эксплуатируемых сейчас месторождений 0,001%.
Содержание растворенного золота в воде океанов 0,000 000 000 5%. Содержится в зернах, листях и стеблях кукурузы.
Плотность:
19,3 (20°C, г/см3)
Давление паров (в мм.рт.ст.):
0,01 (1403°C)
0,1 (1574°C)
10 (2055°C)
100 (2412°C)
Поверхностное натяжение (в мН/м):
1120 (1200°C)
Удельная теплоемкость при постоянном давлении (в Дж/г·K):
0,132 (0-100°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (т)
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (т)
Стандартная энтропия образования S (298 К, Дж/моль·K):
47,4 (т)
Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
25,4 (т)
Энтальпия плавления ΔHпл (кДж/моль):
12,55
Энтальпия кипения ΔHкип (кДж/моль):
348,5
Применение:
Является основой денежной системы большинства из стран. В электротехнической промышленности. Для создания предметов роскоши. Для создания атмосферостойких электрических контактов. Для создания микросхем. Как защитное покрытие в стоматологии, химической промышленности.
Дополнительная информация:
Имеет очень высокие ковкость, тягучесть, электро- и теплопроводность. Хорошо паяется и сваривается. Практически полностью отражает инфракрасные лучи. В природе имеет только один изотоп Au-197. Твердость по Моосу 2,5.
С ртутью образует амальгаму содержащую интерметаллические соединения (AuHg2, Au3Hg)и суспензию захваченных крупинок золота. Не растворимо в кислотах (неорганических и органических) в отсутствии окислителей, растворимо в растворах цианидов в присутствии кислорода, царской водке, горячей безводной селеновой кислоте. Мелкодисперсное золото растворимо в растворе трииодида калия за счет образования дииодоаурата (I) калия. Легко растворяется в водном растворе хлора («хлорной воде») или брома. Лучшим растворителем является насыщенная хлором соляная кислота. При 450 С 1 объем золота растворяет до 48 объемов кислорода. Растворяется в жидком теллуре с образованием теллуридов. Растворяется в концентрированной серной кислоте в присутствии ортоиодной кислоты, азотной кислоты или диоксида марганца. Хорошим растворителем золота является водный раствор тиомочевины в присутствии хлорида или сульфата железа (III). Практически все процессы растворения связаны с образованием комплексных соединений золота.
С парами брома реагирует при комнатной температуре с образованием моно- и трибромида, а выше 60 С — монобромида, с иодом — при 60-110 С с образованием моноиодида, с хлором — выше 200 С с образованием трихлорида, а около 300 С — монохлорида, со фтором — выше 300 С с образованием трифторида. Не реагирует с водородом, азотом, углеродом, кислородом, серой и селеном. При восстановлении золота оно часто не выпадает в осадок, а образует коллоидные растворы различного цвета, зависящего от размера частиц, с отрицательным зарядом частиц (золи золота).
Сплавы: Сплав золота (75%), серебра (20%) и индия (5%) называется зеленое золото и используется для изготовления ювелирных изделий. Сплав золота и платины (47:1) имеет белый цвет. Сплав 78% золота и 22% алюминия имеет рубиново-красный цвет. Сплав 75% золота, 20% палладия и 5% серебра имеет белый цвет («белое золото»). Сплав 75% золота и 25% серебра имеет зеленый цвет, сплав 80% золота с 20% никеля имеет белый цвет.
- «Металлургия благородных металлов» М.:Металлургия, 1987 стр. 13-36
- «Неорганические синтезы» сб.1 М.: ИИЛ, 1951 стр. 10
- «Физические величины» под ред. Григорьева И.С., Мейлихова Е.З., М.:Энергоатомиздат 1991 стр. 1189
- Гурвич Я.А. «Справочник молодого аппаратчика-химика» М.:Химия, 1991 стр. 50
- Девяткин В.В., Ляхова Ю.М. «Химия для любознательных, или о чем не узнаешь на уроке» Ярославль:Академия Холдинг, 2000 стр. 32, 41-42
- Некрасов Б.В. «Основы общей химии» т.2 М.:Химия, 1973 стр. 245, 248-250, 254-256
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 64
- Степин Б.Д., Цветков А.А. «Неорганическая химия» М.:Высшая школа 1994 стр. 398-400
Источники информации:
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Еще по теме:
- ЗОЛОТО — химическая энциклопедия



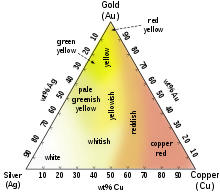



![{displaystyle {ce {2 Au + 3 F2 ->[t] 2 AuF3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ff81168773c670f0d20dad637eb11c293eab2ea8)
![{displaystyle {ce {2 Au + 3 Cl2 ->[t] 2 AuCl3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ebb268ed66673aa0145c1c0df0cc4e2190677a0)
![{displaystyle {ce {2 Au + 2 Br2 ->[t] AuBr3 + AuBr}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e53e90a38d7b2135e56e55c38295b794004fbf80)
![{displaystyle {ce {2 Au + I2 ->[t] 2 AuI}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3328739b5441258750c0ddcc4ac0bc47ab9316e7)
![{displaystyle {ce {2Au+6H2SeO4->[200^{circ }C]Au2(SeO4)3+3H2SeO3+3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/738625602324243a1020930e137fd42fa35538cb)
![{displaystyle {ce {Au+4HCl+HNO3->H[AuCl4]{}+NOuparrow +2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3ede74140b1c7f7a0126dc1c91c0658df37c1767)