Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества
распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем
лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K+ (катион) + A— (анион)
NaCl ⇄ Na+ + Cl—

Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы
и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4,
H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:

Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы.
Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:

Для средних солей диссоциация чаще всего происходит в одну ступень:
Na3PO4 ⇄ 3Na+ + PO43-
Из одной молекулы ортофосфата натрия образовалось 4 иона.
K2SO4 ⇄ 2K+ + SO42-
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности,
вещества делятся на электролиты и неэлектролиты.

Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический
ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.

Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят
электрический ток.

Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми
наиболее часто пользуемся. Примеры молекулярных уравнений:

Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то,
что сократить нельзя.

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na+ и Cl—. В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na+ и Cl— вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na+ + Cl–
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H+ + Cl—.
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
α=Nпродисс/Nисх, где:
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α<1):
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na+ и PO43–:
Na3PO4 → 3Na+ +PO43-
NH4Cr(SO4)2 → NH4+ + Cr3+ + 2SO42–
Диссоциация слабых электролитов: многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
H2CO3 ↔ H+ + HCO3–
HCO3– ↔ H+ + CO32–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH–
Mg(OH)+ ⇄ Mg2+ + OH–
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K+ + HCO3– (α=1)
HCO3– ⇄ H+ + CO32– (α < 1)
Mg(OH)Cl ⇄ MgOH+ + Cl– (α=1)
MgOH+ ⇄ Mg2+ + OH– (α<< 1)
Степень диссоциации слабых электролитов намного меньше 1: α<<1.
Основные положения теории электролитической диссоциации, таким образом:
1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K+ + S2–, при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba2+ + 2ClO3–, опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4++ NO3–, при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe3+ + 3NO3–, при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
Ответ г).
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Электролитическая диссоциация
Материалы портала onx.distant.ru
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные) . Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциаты образуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К + , Cl — , а также возможно образование ионных пар (К + Cl — ), ионных тройников (K2Cl + , KCl2 — ) и ионных квадруполей (K2Cl2, KCl3 2- , K3Cl 2+ ).
- Комплексные соединения (как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4] 2+ , [Fe(CN)6] 3+ , [Cr(H2O)3Cl2] + .
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t, о С |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H + + Cl —
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na + + OH —
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na + + HSO3 —
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3 — → H + + SO3 2-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH + + Cl —
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH + → Mg 2+ + OH —
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6] 3- → Fe 3+ + 6CN —
Константа диссоциации
При растворении слабого электролита К А в растворе установится равновесие:
КА ↔ К + + А —
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации :
Kд = [К + ] · [А — ] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н + больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10 — 4 , а К(HCN) = 4,9·10 — 10 .
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α 2· с)/(1-α) (3)
Для практических расчетов при условии, что α
Кд = α 2· с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT 0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
Следовательно, концентрации ионов К + и РО4 3- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН — (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10 — 5 .
Решение. Уравнение диссоциации электролита:
Концентрации ионов: [NH4 + ] = α С ; [OH — ] = α С , где С – исходная концентрация NH 3 ·H 2 О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Кд ≈ α 2 С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH 3 ·H 2 О . Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √( Кд / С) = √(1,76× 10 — 5 / 0,03 ) = 0,024 или 2,4 %
[OH — ] = αС, откуда [OH — ] = 2,4·10 — 2 ·0,03 = 7,2·10 -4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО — + Н + .
α = [Н + ] / Сисх(CH3CОOH)
откуда [Н + ] = 9,4·10 — 2 ·0,002 = 1,88·10 -4 М.
Kд = [Н + ] 2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2 С .
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10 — 4 . Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд = α 2 С , откуда получаем С исх (HNO 2 ) = 4,6·10 — 4 /(5·10 — 2 ) 2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н + и СООН — в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н + | СООН — |
| ΔGT 0 , кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT 0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT 0 /RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10 — 4 .
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
3. Определите концентрацию ионов NH4 + в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10 — 8 . Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н + в этом растворе.
0,002М; 1× 10 — 5 М.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH 3·H 2О, чтобы степень диссоциации NH 3·H 2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10 — 5 .
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10 — 4 .
Электролитическая диссоциация: решение задач
Теоретический материал приведен на страницах:
Освежим в памяти основные моменты, которые необходимы при решении задач.
Степень диссоциации (α) — отношение кол-ва молекул, которые распались на ионы (N’), к общему кол-ву растворенных молекул (N):
- α=0 — диссоциация отсутствует;
- α=0-3% — слабые электролиты — слабые кислоты (H2SO3, H2S, H2SiO3), слабые основания;
- α=3%-30% — средние электролиты;
- α=30%-100% — сильные электролиты — соли, сильные кислоты (HCl, HBr, HNO3, H2SO4(разб.)), некоторые основания (LiOH, KOH, NaOH);
- α=100% — полная диссоциация.
Степень диссоциации зависит от концентрации раствора.
Константа диссоциации электролита (K) — количественная характеристика диссоциации — отношение произведений концентрации ионов, образованных при диссоциации, к концентрации исходных частиц. Для электролита АВ, который диссоциирует по уравнению АВ↔A — +B + :
Константра диссоциации не зависит от концентрации веществ и может колебаться в очень ширком диапазоне — от 10 -16 до 10 15 .
Степень и константа диссоциации связаны между собой соотношением, называемым Законом разведения Оствальда:
K = ([A — ][B + ]):[AB] = C(α 2 :(1-α))
Для слабых электролитов:
Диссоциация воды и её константа диссоциации:
H2O ↔ H + +OH —
K = ([OH — ][H + ]):[H2O]
Поскольку вода является очень слабым электролитом, то концентрация [H2O] является практически неизменной, поэтому, остаётся постоянной и константа диссоциации воды (ионное произведение воды):
Kω = [OH — ][H + ] = 10 -14 (при 25°C)
Для чистой воды:
[OH — ]=[H + ] = √10 -14 = 10 -7 моль/л
На практике пользуются водородным показателем pH=-lg[H + ]:
- pH=7 — нейтральная среда;
- pH 7 — щелочная среда.
Диссоциация кислот и оснований
Константа диссоциации одноосновных кислот (Ka-кислотный тип диссоциации; А — -кислотный остаток):
Многоосновные кислоты диссоциируют в несколько стадий, у каждой из которых своя константа диссоциации.
Константа диссоциации оснований обозначается Kb.
Диссоциация малорастворимых веществ
Константа диссоциации малорастворимых веществ называется произведением растворимости (ПР).
AgClтв=Ag + +Cl —
K = ([Аg + ][Cl — ]):[AgClтв]
ПР(AgCl) = [Аg + ][Cl — ] = const
При наличии в растворе нескольких электролитов они диссоциируют в сторону образования: 1) осадков; 2) газов; 3) слабых электролитов.
Взаимодействие солей с водой с образованием кислой и основной соли называется гидролизом.
Примеры решения задач
Пример 1 . Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона водорода (H + ) с гидроксид-ионом (OH — ).
- ион водорода реагирует с гидроксид-ионом с образованием молекулы воды (реакция нейтрализации):
- ионы водорода образуются при диссоциации сильных кислот (HCl);
- гидроксид-ионы образуются при диссоциации сильных оснований (NaOH);
Пример 2 . Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона водорода с карбонат-ионом.
- карбонат-ионы реагируют с ионами водорода с образованием гидрокарбонат-ионов (реакция протекает при недостатке ионов водорода):
- второй вариант данной реакции — образование неустойчивой угольной кислоты, распадающейся на воду и оксид углерода (протекает при избытке ионов водорода):
- Молекулярные уравнения реакций:
Пример 3 . Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона серебра с гидроксид-ионом.
- ион серебра реагирует с гидроксид-ионом с образованием неустойчивого соединения гидроксида серебра, распадающегося на воду и оксид серебра:
- ионы серебра образуются при диссоциации растворимых солей серебра (AgNO3);
- гидроксид-ионы образуются при диссоциации сильных оснований (NaOH);
Пример 4 . При взаимодействии каких растворов получится карбонат кальция (CaCO3)?
Из таблицы растворимости видно, что карбонат кальция нерастворим в воде.
- Сокращенное ионное уравнение для получения CaCO3 будет иметь следующий вид:
- Для решения задачи подойдет любое растворимое соединение кальция, которое будет диссоциировать с образованием ионов Ca 2+ , например, хлорид или нитрат кальция — CaCl2 или Ca(NO3)2;
- В качестве донора ионов CO3 2- сойдет любой растворимый в воде карбонат, например, Na2CO3 или K2CO3;
- Один из вариантов молекулярного уравнения:
Пример 5 . Растворы каких солей нужны для получения:
Пример 6 . Какие вещества образуются при взаимодействии растворов сульфата натрия (Na2SO4) и хлорида бария (BaCl2)?
- Из таблицы растворимости видно, что обе соли растворимы в воде:
- При слиянии растворов образуются катионы натрия и бария и анионы хлора и оксида серы. Из таблицы растворимости видно, что нерастворимую в воде соль даст сочетание Ba 2+ и SO4 2- :
- Уравнение реакции будет иметь вид:
Пример 7 . Какая соль выпадет в осадок при взаимодействии нитрата серебра (AgNO3) и хлорида кальция (CaCl2)? Написать уравнение реакции.
Пример 8 . Каким образом можно очистить поваренную соль (NaCl) от сульфата натрия (Na2SO4)?
Идея решения задачи заключается в добавлении в раствор поваренной соли и сульфата натрия вещества, способного распадаться на ионы, которые свяжут ионы оксида серы в нерастворимую соль, высвободив тем самым ионы натрия.
Роль связывающего вещества выполнит хлорид кальция CaCl2.
После того, как CaSO4↓ выпадет в осадок, полученный раствор необходимо будет отфильтровать, после чего в фильтрате будет присутствовать чистая поваренная соль.
Пример 9 . Написать молекулярное и ионное уравнение реакции хлорида алюминия с нитратом серебра.
- Молекулярное уравнение:
- Полное ионное уравнение:
- Сокращенное ионное уравнение:
Пример 10 . Рассчитать концентрацию ионов, образующихся при смешении 1 литра 0,25М раствора BaCl2 и 1 литра 0,5М раствора Na2SO4, после выпадения BaSO4 в осадок.
- Молекулярное уравнение реакции:
- Сокращенное ионное уравнение:
- Рассчитаем исходные кол-ва ионов:
- (Ba 2+ ) в обменной реакции присутствует в недостатке, поэтому, в реакцию вступает не 0,5, а только 0,25 SO4 2- ;
- Объем полученного раствора 1+1=2 литра;
- Рассчитаем молярные концентрации ионов:
Пример 11 . Рассчитать pH водного раствора 0,1М HCl; 0,1M NaOH.
- HCl — сильная кислота, диссоциирует полностью, уравнение диссоциации:
- NaOH — сильное основание, диссоциирует полностью, уравнение диссоциации:
Пример 12 . Рассчитать концентрацию ионов водорода в растворе аммиака с концентрацией 1,5 моль/л (K=1,7·10 -5 ).
- Формула равновесия, установленного в водном растворе аммиака:
- Обозначим через x равновесную концентрацию [OH — ]; тогда [NH4 + ]=x; [NH3]=1,5-x:
Пример 13 . Какое кол-во осадка образуется при смешении 250 мл растворов нитрита лития (концентрация 0,3 моль/л) и фторида натрия (0,2 моль/л), если произведение растворимости фторида лития ПР(LiF)=1,5·10 -3 .
- Уравнение реакции:
- Рассчитаем исходные кол-ва ионов:
- Объем раствора равен 0,25+0,25=0,5 л
- Если обозначить через x моль кол-во выпавшего осадка LiF, тогда произведение концентрации ионов в растворе будет равно:
- Масса выпавшего осадка:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
источники:
http://chemege.ru/el-dissociaciya/
http://prosto-o-slognom.ru/chimia_primery/007-elektroliticheskaya_dissotsiatsiya.html
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Урок №8. Диссоциация кислот, оснований и солей
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + )
Многоосновные кислоты диссоциируют ступенчато:
Н 3 РО 4 ↔ Н + + Н 2 РО — 4 (первая ступень) – дигидроортофосфат ион
Н 2 РО — 4 ↔ Н + + НРO 2- 4 (вторая ступень) – гидроортофосфат ион
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей.
Диссоциация оснований
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH — )
Щёлочи – это основания, растворимые в воде (основания щелочных и щелочноземельных металлов) : LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН) 2 , Sr(ОН) 2 , Ва(ОН) 2 , Rа(ОН) 2 , а также NН 4 ОН
Примеры уравнений диссоциации щелочей:
NH 4 OH ↔ NH + 4 + OH —
Многокислотные основания диссоциируют ступенчато:
Ba(ОН) 2 → Bа(ОН) + + OH — (первая ступень)
Ba(OH) + ↔ Ba 2+ +OH — (вторая ступень)
Диссоциация амфотерных оснований (амфолитов)
Амфолиты — это электролиты, которые при диссоциации одновременно образуют катионы водорода (H + ) и гидроксид-ионы (OH — )
Диссоциацию амфотерного гидроксида цинка Zn(ОН) 2 можно выразить уравнением:
2ОН — + Zn 2+ + 2Н 2 О ↔ Zn(ОН) 2 + 2Н 2 О ↔ [Zn(ОН) 4 ] 2- + 2Н +
Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH + 4 ) и анионы кислотных остатков.
Диссоциация средних солей
Na 3 PO 4 →3Na + + PO 3- 4
Кислые и основные соли диссоциируют ступенчато.
Диссоциация кислых солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
KHSO 4 → K + + HSO — 4
HSO — 4 ↔ H + + SO 2- 4
Диссоциация основных солей
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
MgOHCl → MgOH + + Cl —
MgOH + ↔ Mg 2+ + OH —
ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ
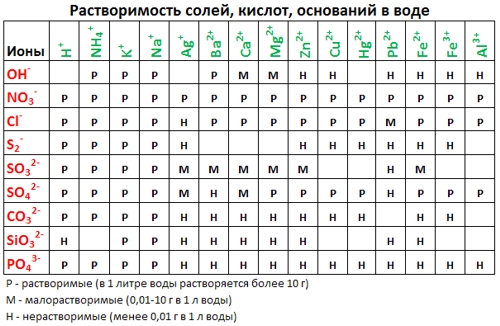
Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: HF, Mg(OH) 2 , CaCl 2 , Zn(NO 3 ) 2 , Ba(OH) 2 , K 2 SO 4 , H 2 SiO 3 , FeI 3 , NiCl 2 , H 3 PO 4 , Ca(OH) 2 , Na 2 CO 3 , Na 3 PO 4 , HNO 3 , KOH, Ba(OH) 2 , H 2 SO 3 , Ca(NO 3 ) 2 , Ca 3 (PO 4 ) 2 , H 2 S, NaOH, HBr
Диссоциация кислот, оснований, амфотерных гидроксидов и солей в водных растворах
Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н + . Составим уравнение электролитической диссоциации сильных кислот: а) одноосновной азотной кислоты HNО3 и б) двухосновной серной кислоты H2SO4:
Число ступеней диссоциации зависит от основности слабой кислоты Нх(Ас), где х — основность кислоты.
Пример: Составим уравнения электролитической диссоциации слабой двухосновной угольной кислоты Н2СО3.
Первая ступень диссоциации (отщепление одного иона водорода Н + ):
Константа диссоциации по первой ступени:
Вторая ступень диссоциации (отщепление иона водорода Н + от сложного иона НСО3 — ):
Растворы кислот имеют некоторые общие свойства, которые, согласно теории электролитической диссоциации, объясняются присутствием в их растворах гидратированных ионов водорода Н + (Н3О + ).
Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН — .
Составим уравнение электролитической диссоциации однокислотного основания гидроксида калия КОН:
Сильное двухкислотное основание Ca(OH)2 диссоциирует так:
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у, где у — кислотность основания.
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Fe(OH)2.
Первая ступень диссоциации (отщепляется один гидроксид-ион ОН — ):
Вторая ступень диссоциации (отщепляется гидроксид-ион ОН — от сложного катиона FeOH + ):
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН — .
Каждая ступень диссоциации слабых многоосновных кислот и слабых многокислотных оснований характеризуется определенной константой диссоциации: K1, K2, K3, причем K1 > K2 > K3. Это объясняется тем, что энергия, которая необходима для отрыва иона Н + или ОН — от нейтральной молекулы кислоты или основания, минимальна. При диссоциации по следующей ступени энергия увеличивается, потому что отрыв ионов происходит от противоположно заряженных частиц.
Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями. Теория электролитической диссоциации объясняет двойственные свойства амфотерных гидроксидов.
Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н + и гидроксид-анионы ОН — , т. е. диссоциируют по типу кислоты и по типу основания.
К амфотерным гидроксидам относятся Ве(ОН)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 и другие. Амфотерным электролитом является также вода Н2O.
В амфотерных гидроксидах диссоциация по типу кислот и по типу оснований происходит потому, что прочность химических связей между атомами металла и кислорода (Ме—О) и между атомами кислорода и водорода (О—Н) почти одинаковая. Поэтому в водном растворе эти связи разрываются одновременно, и амфотерные гидроксиды при диссоциации образуют катионы Н + и анионы ОН — .
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета ее ступенчатого характера:
Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Составим уравнения электролитической диссоциации нормальных солей: а) карбоната калия K2CO3, б) сульфата алюминия Al2(SO4)3:
Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Составим уравнения электролитической диссоциации кислой соли гидрокарбоната натрия NaHCО3.
Сложный анион НСО3 — (гидрокарбонат-ион) частично диссоциирует по уравнению:
Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы состоящие из атомов металла и гидроксогрупп ОН — .
Составим уравнение электролитической диссоциации основной соли Fe(OH)2Cl — дигидроксохлорида железа (III):
Сложный катион частично диссоциирует по уравнениям:
Для обеих ступеней диссоциации Fe(OH)2 + .
источники:
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/9-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%B2%D1%82%D0%BE%D1%80%D0%BE%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-8-%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D1%8F-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82-%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B9-%D0%B8-%D1%81%D0%BE%D0%BB%D0%B5%D0%B9
http://al-himik.ru/dissociacija-kislot-osnovanij-amfoternyh-gidroksidov-i-solej-v-vodnyh-rastvorah/
Электролитическая диссоциация
Электролитическая диссоциация – распад электролитов в водных растворах на ионы.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД), С.А. Аррениус:
- Электролиты в водных растворах диссоциируют на ионы: положительные (катионы) и отрицательные (анионы). Перешедшие в раствор ионы окружены молекулами воды – гидратированы.
- Сумма зарядов положительных ионов равна сумме зарядов отрицательных ионов (раствор в целом электронейтрален)
- Процесс электролитической диссоциации обратимый. Наряду с диссоциацией происходит обратный процесс – ассоциация ионов.
Процесс диссоциации записывают в виде уравнений (уравнений электролитической диссоциации):
KCl = K+ + Cl—; Al2(SO4)3 = 2Al3+ + 3SO42-; H3PO4 ↔ H+ + H2PO4—
СИЛЬНЫЕ И СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Сила электролита определяется степенью диссоциации ά. На степень диссоциации влияют: виды связей в веществе, природа растворителя, концентрация раствора (с уменьшением концентрации ά увеличивается), температура ( с ростом t ά увеличивается, т.к. диссоциация — процесс эндотермический).
Сильные электролиты диссоциированы практически нацело. В растворе нет молекул, есть только ионы.
сильные кислоты (не все кислоты!)- HNO3— азотная; HCl— соляная; H2SO4-серная; HBr- бромоводородная; HI- иодоводородная
сильные основания (все щелочи) – LiOH — гидроксид лития; NaOH — гидроксид натрия; KOH — гидроксид калия; Ca(OH)2 – гидроксид кальция; Ba(OH)2 – гидроксид бария
все растворимые соли
Неперечисленные вещества являются слабыми или средней силы электролитами или неэлектролитами.
Н2О – очень слабый электролит.
Кислоты, основания и соли в свете ТЭД
Кислоты – это электролиты, диссоциирующие в растворах с образованием катионов водорода
HNO3 = Н+ + NO3— H2SO4 = 2Н+ + SO42- сероводородная кислота Н2S ↔ Н+ + НS—
Знак обратимости ↔ используется в уравнениях диссоциации
слабых и средней силы электролитов
Основания – это электролиты, диссоциирующие в растворах с образованием гидроксид — ионов (ОН—)
KOH = K+ + OH— Ba(OH)2 = Ba2+ + 2OH—
Соли – это электролиты, диссоциирующие в растворах с образованием катионов металлов и анионов кислотных остатков
К3РО4 = 3K+ + PO42- Al2(SO4)3 = 2Al3+ + 3SO42-
Формулы и заряды катионов металлов и анионов кислотных остатков есть в
таблице растворимости кислот, оснований, солей !
Итак.
1.Электролиты в водных растворах диссоциируют:
- кислота = катионы водорода + анион кислотного остатка HCl = H+ + Cl—
- основание = катион металла и гидроксид-анионы NaOH = Na+ + OH—
- соль = катионы металла + анионы кислотного остатка КCl = К+ + Cl—
2. Индекс в формуле вещества становится коэффициентом перед формулой иона в уравнении диссоциации
Na2CO3 = 2Na+ + CO32- FeCl3 = Fe3+ 3Cl—
ИОННЫЕ РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Реакции, протекающие с участием растворов электролитов, являются реакциями между ионами. Их принято записывать с помощью ионных уравнений.
Правила составления ионных уравнений:
- Напишите молекулярное уравнение (не забудьте про коэффициенты). По таблице растворимости определите растворимость всех веществ и запишите над формулами
Р Р Н Р
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
- Перепишите это уравнение, записывая сильные электролиты как сумму соответствующих ионов, а слабые электролиты, нерастворимые и газообразные вещества – в молекулярной форме. Получите полное ионное уравнение
2Na+ + SO42- + Ba2+ + 2Cl— = BaSO4↓ + 2Na+ + 2Cl—
- «Сократите» одинаковые ионы (выделены курсивом) в левой и правой части уравнения и запишите сокращенное ионно-молекулярное уравнение, отражающее суть процесса (показывает участвующие в реакции частицы и продукты реакции)
Ba2+ + SO42- = BaSO4↓
Реакции в растворах могут протекать: 1)необратимо; 2) обратимо; 3) практически не идут
Реакции идут до конца (необратимо), если концентрация
ионов в растворе уменьшается за счет связывания их c образованием:
А) нерастворимых и малорастворимых веществ
p p н p
KCl + AgNO3 = AgCl↓ + KCl
K+ + Cl— + Ag+ + NO3— = AgCl↓ + K+ + NO3—
Ag+ + Cl— = AgCl↓
p p н р
2H3PO4 + 3BaCl2 = Ba3(PO4)2↓ + 6HCl (H3PO4 – не сильный электролит, H3PO4↔Н+ + H2PO4—.
Иногда H3PO4 записывают в недиссоциированном виде)
Вариант 1. 2H3PO4 + 3Ba2+ + 6Cl— = Ba3(PO4)2↓ + 6H+ + 6Cl—
2H3PO4 + 3Ba2+ = Ba3(PO4)2↓ + 6H+
Вариант 2. 2H+ + 2H2PO4— + 3Ba2+ + 6Cl— = Ba3(PO4)2↓ + 6H+ + 6Cl—
2H2PO4— + 3Ba2+ = Ba3(PO4)2↓ + 4H+
В) газов
р р р
K2S + 2HCl = 2KCl + H2S↑ (↑ — газ)
2K+ + S2- + 2H+ + 2Cl— = 2K+ + 2Cl— + H2S↑
2H+ + S2- = H2S↑
Газ получается также при образовании нестойких: угольной кислоты H2CO3 = H2O + CO2↑
сернистой кислоты H2SO3 = H2O + SO2↑
гидроксида аммония NH4OH = H2O + NH3↑
например:
p p p
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
2Na+ + CO32- + 2H+ + 2Cl— = 2Na+ + 2Cl— + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
В) слабых электролитов (обычно воды):
р р p
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Ba2+ + 2OH— + 2H+ + 2Cl— = Ba2+ + 2Cl— + 2H2O
2H+ + 2OH— = 2H2O
упростим коэффициенты H+ + OH— = H2O
Пример реакции, которая не идет до конца:
p p p p
2NaCl + Ba(NO3)2 = BaCl2 + 2NaNO3
2Na+ +2Cl— + Ba2+ + 2NO3— = Ba2+ + 2Cl— + 2Na+ + 2NO3—
Все ионы «сокращаются» — нет ионов, связывающихся и образующих продукты реакции.