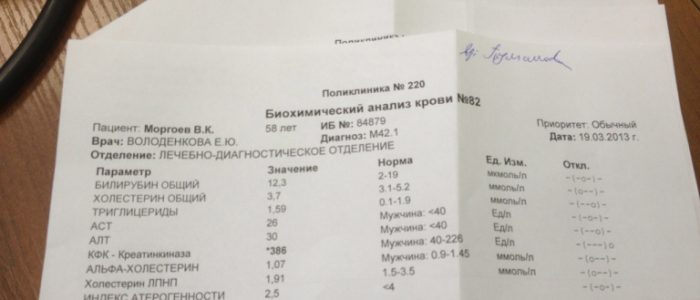
Биохимический анализ крови — достаточно подробное исследование, которое позволяет выявить многие заболевания. Поскольку проблемы с сердцем и инсульты все больше молодеют, врачи рекомендуют исследовать кровь на уровень липопротеидов регулярно, особенно с возрастом.
Не каждый пациент способен расшифровать полученные на руки результаты. Ведь мало кто знает, какими под какими буквами и аббревиатурами скрываются липопротеиды. Рассказываем, как обозначен холестерин в анализе крови.
Холестерин в анализе крови
В простейшем исследовании крови на биохимию подсчитывается лишь суммарный показатель холестерола. Чтобы отдельно подсчитать соотношение липопротеидов высокой и низкой плотности (хороший и вредный холестерин), необходимо отдельно делать липидограмму.

«Полезный холестерин» очищает сосуды от холестериновых бляшек, препятствует образованию тромбов. «Вредный холестерин» — это липопротеиды с низким показателем плотности. Они остаются на стенках сосудов и провоцируют возникновение бляшек, ведущих к сужению канала, а затем к различным сердечным патологиям, вплоть до инфаркта.
Внимание! Суммарная плотность липопротеидов обоих видов обозначается как холестерол. Но для здоровья важно соотношение двух данных веществ в крови человека.
Показатели нормы
Общая сумма содержания липопротеидов имеет свои показатели нормы и меняется с возрастом. У младенцев это значение не должно превышать 3,3 ммоль/л. У остальных людей:
- до 12 месяцев — 1,81-4,53 ммоль/л;
- до 12 лет — 3,1–5,18 ммоль/л;
- 13–17 лет — 3,11–5,44 ммоль/л;
- взрослые — до 5,2 ммоль/л.
Внимание! Расшифровкой полученных данных должен заниматься специалист, который подскажет, в норме ли уровень холестерина, и что делать, если параметры вещества превышают допустимый показатель.
Как записывают холестерин?
Специалисты в области медицины фиксируют все обозначения на латыни. Иногда встречаются буквенные записи на русском языке – ЛПВП или ЛПНП. Первое — полезное вещество, а второе — вредное.
На латыни обозначения выглядят по-другому:
- Суммарный показатель — Chol (сholesterol), TC (тотал cholesterol).
- HDL (high density lipoprotein) — вещество высокого уровня плотности, полезное вещество, ЛПВП.
- LDL — вещество низкого уровня плотности, вредное вещество, в русском обозначении ЛПНП.
- TG – производные глицерина.
- IA — важный показатель антерогенности (уточняет, как соотносятся в крови ЛПВП и ЛПНП).
На каком именно языке, на русском или на латинском, проставлено обозначение, не столь важно. Зачастую это зависит от лаборатории, где проводится анализ.
Как подготовиться к анализу?
Чтобы показатели были максимально правдивы, необходимо качественно подготовиться к исследованию. Все подробности объясняет лечащий врач, но лучше их знать. Перед сдачей крови надо:
- за 8 часов отказаться от пищи;
- воздержаться от курения в течение трех часов;
- успокоиться и не подвергаться воздействию стрессов;
- в кабинет войти с максимально ровным дыханием;
- за стуки до сдачи анализа прекратить прием жирной и соленой пищи.
Существует несколько заболеваний, при которых нужно обязательно сдавать анализ на холестерин несколько раз в год. К ним относятся:
- сахарный диабет;
- патологии сердца и сосудов;
- ожирение;
- гипертония.
Внимание! Женщинам и мужчинам старше 45 лет сдавать анализ крови на chol следует хотя бы раз в год, чтобы предотвратить появление сердечно-сосудистых заболеваний или распознать их на ранней стадии.
Реклама и СМИ уверяют, что холестерол — это злейший враг для людей. Он приводит к заболеванию сердца и нарушению проходимости сосудов. Диетологи советуют рационы питания из продуктов, содержание жиров в которых, снижено. Людей из группы риска сердечно-сосудистых заболеваний заставляют регулярно сдавать анализ на холестерин. Все это правда, но только отчасти. Кроме очевидного вреда и риска для жизни человека, он крайне необходим организму в определенных дозах.
В крови холестерин играет большую роль в налаживании обменных процессов. В норме это вещество только помогает жизнедеятельности внутренних органов. К опасным для здоровья последствиям приводит превышение нормы содержания его у взрослых. Сдавать анализ крови на холестерин действительно нужно, чтобы определить его уровень в текущий момент. Это очень важный показатель в биохимическом анализе крови.
Из чего состоит холестерол
Несмотря на то, что название вещества пишется на латыни, название «холестерин» произошло из греческого языка, от слова «chol». Обозначает оно «желчь». Дальше добавилось еще одно греческое слово «stereo», которое можно перевести как «твердый». Таким образом переводится холестерин как «твердая желчь». Впервые медицинское исследование обнаружило липиды именно в твердом виде, в камнях желчного пузыря.

Анализ холестерина показывает, в каких количествах он содержится в крови человека. Что такое холестерин? Это органическое вещество, которое содержится в каждой клетке нашего организма. Благодаря ему, оболочки клеток приобретают плотность.
Chol в биохимическом анализе крови относят к жирам. Почти 80% необходимого для жизнедеятельности холестерина наш организм производит сам, в крови норма этого вещества зависит от пола и возраста пациента. Генератором этого вещества является наша печень. Остальные 20% поступают вместе с пищей.
Как обозначается холестерин в анализе крови? Единицы измерения холестерина — это количество миллиграмм вещества на децилитр, что обозначается как мг/дл. В крови вещество редко присутствует в чистом виде. Обычно, с помощью биохимии крови, определяют соединения холестерина с другими веществами.
Эти соединения делятся на ЛПНП и ЛПВП. Расшифровать аббревиатуры можно так:
- ЛПНП — липопротеины низкой плотности
- ЛПВП — липопротеины высокой плотности
Если происходит дисбаланс этих соединений, или отклонения от нормы содержания холестерина в крови, могут возникать заболевания различной тяжести.
Дисбаланс биохимических показателей может провоцировать развитие сторонних заболеваний, которые не связаны напрямую с уровнем липидов.
Большая часть липидов содержится в печени, мозге и мышечной ткани. Холестерин циркулирует по организму вместе с кровью по сердечно-сосудистой системе.
Как влияет на здоровье холестерол
В первую очередь от него зависит клеточное строение. Без этого строительного компонента, мембраны клеток не будут иметь достаточный уровень плотности. Во-вторых, это необходимый компонент для выработки самых важных гормонов. От его уровня зависит гормональный фон тестостерона, кортизона и эстрогена.
Для мозга холестерин выступает в качестве транспорта антиоксидантов. Нормальный уровень его в крови необходим для процесса усвоения жиров. Только превышение этого уровня пагубно отражается на здоровье человека. Избежать этого можно, если сдать анализы на холестерин.
Чем же опасен этот компонент для человека
В 90-е годы считалось, что содержание любого количества липидов в крови — это негативный фактор, с которым нужно бороться. Исследования холестерина в крови показывали страшную статистику. Больше половины смертельных случаев сердечно-сосудистых заболеваний происходили из-за его высокого содержания.
Дальше медицинские исследования определили норму необходимую, для деятельности мозга, без вреда для здоровья других органов. Оказалось, что в нашем организме присутствуют два вида этого жироподобного вещества — один называется «плохой», второй «хороший» холестерин.
Аббревиатура в бланке может писаться латинским буквами.
Дисбаланс липидов может привести к следующим заболеваниям:
- Атеросклероз.
- Гипертония.
- Ишемия сердца.
- Инфаркт миокарда.
- Инсульт.
Это крайне серьезные заболевания, имеющие высокий процент смертности. При диагностике состояния организма пациента очень важно получить развернутый анализ содержания и соотношения липидов.
Для чего нужно сдавать анализ
Расшифровка анализа крови на холестерин необходима для выявления заболеваний на начальной стадии. Все патологии, к которым приводит дисбаланс липидов, легче поддаются лечению именно на ранних сроках, когда ситуация еще не запущена. Это помогает снизить риск смертельного исхода в разы.
Все пациенты, у которых имеются предпосылки к развитию сердечно-сосудистых патологий сдают общий анализ крови. Лабораторные исследования проводят в несколько этапов и сверяют результаты по таблице. Расшифровка у взрослых и детей должна проводиться врачом. Показатели холестерина делятся на три группы:
- Общий холестерин. Это расширенный показатель, который отображает общий уровень содержания всех соединений липидов. Норма его не более 5 ммоль/л
- ЛПВП. Это «хороший» холестерин, который жизненно необходим организму для нормального обмена веществ. Такие соединения липидов вырабатываются в нашем организме естественным образом. Его содержание в общем анализе не должно превышать 2 ммоль/л.
- ЛПНП. Еще эта группа может называться «плохой» холестерин. Его содержание зависит от рациона нашего питания. Нормальным считается его полное отсутствие, или показатель не выше 3 ммоль/л.
Если у пациента выявлено наличие сахарного диабета, кровь на холестерин лучше сдавать регулярно, на протяжении всего срока лечения. Биохимический анализ крови в данном случае является самой эффективной диагностикой развития этого заболевания.
Норма холестерин зависит от пола и возраста пациента. Основные коридоры показателей общего холестерина указаны в таблице:
| Возраст | Средние нормы |
|---|---|
| Новорожденные | не выше 3,5 ммоль/л |
| Дети в возрасте до 1 года | от 1,81 до 4,53 ммоль/л |
| Дети в возрасте до 12 лет | от 3,11 до 5,18 ммоль/л |
| Подростки в возрасте 13-17 лет | от 3,11 до 5,44 ммоль/л |
| Взрослые мужчины и женщины | 3,63–8,03 ммоль/л |
Если показатель анализа общего холестерина находится выше или ниже границы нормы, то необходимо делать расширенный анализ и сверять данные анализа на ЛПВП и ЛПНП. Обозначение холестерина в анализе крови могут различаться в зависимости от лаборатории и применяемой методики. Расшифровка анализа в крови на холестерин норма которого рассчитывается индивидуально, должна проводиться лечащим врачом.
Как правильно сдать анализ
Для того, чтобы избежать погрешности в лабораторных исследованиях, очень важно соблюдать ряд правил, прежде чем сдать анализ крови на холестерин. Малейшее отклонение на погрешность может быть причиной постановки неправильного диагноза.
Анализ не требует специфического оборудования, поэтому сдать анализ на общий холестерин можно в любом медицинском центре. Государственные медицинские учреждения, вне зависимости от направленности, делают забор крови бесплатно, в рамках общей диагностики состояния организма. Определение уровня холестерина входит в список мероприятий профилактической диспансеризации населения.
При анализе крови на холестерин и расшифровке важно учесть и общее состояние организма пациента. Результаты анализа могут быть показателем заболевания только в комплексе с другими ярко выраженными признаками, присущими этому заболеванию.
Очень часто требуется повторная сдача анализа через один-два месяца.
Для исследования используют простые методы, поэтому анализ на общий холестерин бывает готов не более, чем через сутки. Для лабораторного определения холестерина используют методики:
- Прямые биохимические исследования. Этот метод основан на реакции Либермана-Бурхарда. Эти методики дают наиболее точный результат, несмотря на дешевизну анализа. Но реактивы, которые задействованы в этом анализе, обладают побочным действием, вызывая коррозию. Их очень неудобно хранить. Поэтому эта методика не используется в крупных исследовательских центрах.
- Прямые биохимические исследования в основном представлены методом Абеля. Имеют небольшой процент погрешности, по сравнению с прямой методикой.
- Ферментативные исследования. Такими методиками пользуются около 95% всех исследовательских лабораторий. Это точные анализы, не имеющие побочных эффектов.
- Хроматографические исследования. В основном используются при отсутствии возможности получить качественную пробу крови. Крайне точная и дорогостоящая методика.
Перед анализом необходимо полностью ограничить прием пищи, не менее чем за 7-8 часов. Кровь из вены правильно сдавать только на голодны желудок. Еда может полностью изменить результат анализа, как в большую, так и в меньшую сторону, и если вы сдадите кровь после еды, у вас могут быть совершенно неверные результаты. Целесообразным будет исключение из рациона тяжелых и жирных продуктов за несколько дней до обследования.
Содержание
- 1 Что это за тест на холестерин?
- 2 Подготовка к выполнению
- 3 Как проводится?
- 4 Как обозначается холестерин в результатах?
- 5 Расшифровка показателей
Пациенту сложно разобраться в медицинских аббревиатурах. Обозначение холестерина в анализе крови государственных больниц и лабораторий является комбинацией заглавных букв медицинских терминов. В частных же клиниках используют англоязычный аналог. Расшифровка анализа не составит труда, если знать нормы каждого показателя. Важно предоставить пациенту консультацию по правильной подготовке к сдаче крови. Это обеспечит адекватные результаты и более быструю постановку диагноза.
Что это за тест на холестерин?
В общем анализе крови обнаружить холестериновые молекулы невозможно. Для их идентификации используется биохимия. Она выявляет «плохой» холестерин, который обозначают заглавными буквами его биохимических характеристик.
Анализ показан людям, у которых подозревают атеросклеротические нарушения в сосудистых стенках. Последние могут проявляться следующей клинической симптоматикой:
- Скачки давления. Они отмечаются при измерении тонометром и регистрации показателей в специальном дневнике. Если систолическое и диастолическое артериальное давление регулярно повышается, речь идет о гипертонической болезни на фоне атеросклероза.
- Головокружение, парестезии и дисфункция органов чувств. Симптомы появляются, когда атеросклеротический процесс достигает крупных и мелких сосудов центральной или периферической нервной системы.
- Одышка. На фоне повышенных цифр артериального давления возникает «легочное» сердце. Оно характеризуется увеличением левого желудочка — его дилатацией. У пациента появляется дыхательная недостаточность.
- Цианоз носогубного треугольника. К нему часто присоединяется синюшность дистальных фаланг пальцев верхних и нижних конечностей. Это свидетельствует о слабой оксигенации этих участков тела.
- Контурирование капилляров, вен и артерий под поверхностью кожи. Часто при этом наблюдается их пульсация.
- Ухудшение мнестических функций пациента. К таковым принадлежат способность мыслить, запоминать новые события и вспоминать старые.
Вернуться к оглавлению
Подготовка к выполнению
Забор биологического материала выполняет медсестра в лабораторных условиях. От пациента требуется только специфическая подготовка. За сутки до сдачи анализа больной обязан перестать употреблять в пищу жирные и жареные продукты, еду с повышенным содержанием консервантов, стабилизаторов, красителей и усилителей вкуса. В день посещения лаборатории пациент не должен завтракать. Позволяется только выпить воды без газа. Человек не должен перегружать себя физической и эмоциональной активностью. Все это может сказаться на его гормональном фоне и общем гомеостазе организма. Игнорирование правил подготовки влечет за собой ложные результаты и необходимость повторного обследования.
Вернуться к оглавлению
Как проводится?
Медицинское исследование крови на холестерин осуществляют в специальной лаборатории при стерильных условиях. Для того, чтобы набрать полный вакутейнер биологического материала, медсестра накладывает на руку пациента жгутик и просит больного сделать этой конечностью движения, будто он сжимает эспандер. После этого жгут распускают и выполняют пункцию вены. Набрав нужное количество кровяной массы, вакуумные контейнеры запечатывают и отправляют на следующий этап. В лабораторных условиях в гематологическом материале специалисты пытаются обнаружить липопротеиды высокой, низкой и очень низкой плотности, холестериновые молекулы и триглицериды.
Вернуться к оглавлению
Как обозначается холестерин в результатах?
Для правильной расшифровки необходимо знать, как пишется каждый показатель. И если в биохимическом анализе общий холестерин обозначен словом «липиды», то для его фракций всегда пишут аббревиатуры. Такое сокращение позволяет докторам автоматически расшифровать название нужного показателя. Обозначение холестерина в биохимическом анализе крови — это аббревиатура от стандартных медицинских терминов или таковых на латыни, что представлено в таблице:
| Обозначение показателя | Расшифровка |
|---|---|
| HDL (high-density lipoprotein) или ЛПВП | «Хороший» холестерин высокой плотности |
| Имеет высокодифференцированные молекулы | |
| Принимает участие в пищеварительных процессах и не вредит организму | |
| VLDL (very-low-density lipoprotein) или ЛПОНП | Липопротеиды очень низкой плотности |
| Является «плохой» молекулой, поскольку не способен метаболизироваться в кровеносном русле | |
| Откладывается в сосудистых стенках, образуя закупорки | |
| LDL (low-density lipoprotein) или ЛПНП | Липопротеиды низкой плотности |
| Эта фракция играет наиболее важную роль в атеросклеротическом процессе | |
| ИА — индекс атерогенности | Коэффициент обозначает соотношение всех описанных выше фракций между собой |
| Является субъективным и требует уточнения других показателей | |
| TG — триглицериды | Их уровень в норме не должен превышать 1,7 ммоль/литр |
| Эти молекулярные структуры способны откладываться в интиме эндотелиальной выстилки сосудистых стенок, образуя бляшки и увеличивая окклюзии капилляров, артерий и вен |
Вернуться к оглавлению
Расшифровка показателей
Существуют и возрастные нормы концентрации холестериновых молекул. К примеру, у новорожденных нормальным значением считается 3,5 ммоль/л, а у детей подросткового возраста этот показатель возрастает до 5 ммоль/литр.
Такие колебания обусловлены ростом организма, о чем упоминалось в научной публикации в журнале «Атеросклероз и дислипидемии». Расшифровка у взрослых чаще дает погрешности, поскольку содержание в их крови холестериновых молекул, липопротеидов разных плотностей и триглицеридов зависит от способа жизни, гормональных особенностей и возрастной категории. Например, у женщин ЛПНП и ЛПОНП способны расти в период менструации, беременности и кормления грудью. Нормальным же показателем для них считается 3,5, в то время как для представителей мужского пола — 4,8 ммоль/л.
Содержание
- Показания
- Холестерин в крови
- Липидограмма и развернутая биохимия
- Референсные значения у детей
- Взрослые нормы Cholesterin
- Итоги
Содержание общего холестерина изучают по сыворотке венозной крови при проведении биохимического исследования. Полную расшифровку анализа на холестерин, его фракции и оценку риска атеросклероза дает липидный профиль пациента (липидограмма).
Показания
Биохимический анализ крови назначают при обращении к врачу с жалобами на боли и недомогания, для контроля лечения и оценки результатов, в рамках плановых проверок (профосмотр, диспансеризация, ВВК, перинатальный скрининг и т.д.). Кровь на биохимию проверяют при поступлении на стационарное лечение.
Липидограмма проводится по персональным показаниям:
- гиперхолестеринемия (повышенный уровень холестерина), выявленная ранее;
- гипертоническая болезнь;
- постинфарктный постинсультный период.
Кровь на расширенный липидный профиль регулярно сдают пациенты с хроническими болезнями сердечно-сосудистой, эндокринной, гепатобилиарной системы. Контроль холестерина рекомендован:
- женщинам в предклимактерический период и во время менопаузы;
- мужчинам в возрасте 40+;
- людям с гиподинамическим образом жизни и никотиновой зависимостью.
Биохимия является обязательным исследованием для детей с наследственными патологиями.
Холестерин в крови
Жиросодержащий спирт холестерол (химическое название холестерина) локализуется в эластичной клеточной мембране, исполняя роль защитника клеток от внешней среды. Он участвует в важнейших биохимических процессах, поддерживающих жизнеспособность организма:
- производство желчных кислот и гормонов (половых и стероидных);
- сообщение между собой нейронов головного и спинного мозга;
- усвоение жирорастворимых витаминов А, Д, Е.
Эндогенный холестерол синтезируют клетки печени. Он составляет до 80% от общего количества. Остальное организм получает из продуктов животного происхождения.
Холестериновый обмен
Обменные процессы обеспечивают липопротеины высокой, низкой и очень низкой плотности (ЛПВП, ЛПНП И ЛПОНП). В их структуру входят триглицериды, высшие жирные кислоты, белки, холестерин, фосфолипиды. Плотность определяется количественной корреляцией белков и липидов (жиров). Чем меньше белковая часть липопротеинов и больше жировая, тем ниже плотность.
В биохимическом исследовании показатели общего холестерина складываются из значений липопротеинов и триглицеридов. ЛПНП условно называют «плохой» холестерин, поскольку именно низкоплотные липопротеины оседают на внутренней части артериальных стенок, образуя бляшки – причины атеросклероза сосудов. ЛПВП («хороший» холестерин) освобождают сосуды от избытка свободного и «плохого» холестерола.
Липидограмма и развернутая биохимия
Для полного определения липидного статуса (профиля) в лаборатории изучают и липиды различных фракций. Целью анализа является оценка жирового обмена в организме. В клинико-лабораторной практике все параметры исследования обозначаются латинскими буквами.
Параметры расширенного анализа
| Показатель | Определение, функции | Русская аббревиатура | Обозначение на латыни |
| Общий холестерин | Совокупность липидных фракций | ОХ | Cho (Cholesterin) |
| Липопротеины низкой и очень низкой плотности | Переносят молекулы холестерола из кишечника и печени в клетки (для обеспечения их функций) | ЛПНП и ЛПОНП | LDL и VLDL |
| Высокоплотные липопротеины | Транспортируют излишки низкоплотных липопротеинов и свободный холестерин в обратном направлении (для катаболизма в печени и выведения из организма) | ЛПВП | HDL |
| Тригрицериды | Жировой запас организма, расходуемый в перерывах между поступлением и выработкой липидов (для восполнения энергии) | ТГ | TRIG или TG |
| Коэффициент атерогенности (иначе, индекс) | Показывает риск развития атеросклероза сосудов, инсульта и ИБС (ишемической болезни сердца) | КА | IA |
В бланках можно встретить аббревиатуру ТС – так обозначается холестерин в анализе крови в некоторых лабораториях. Обозначения ОХ, ТС, Cho равнозначны. Единица измерения для общего холестерола, ЛПНП, ЛПОНП, ЛПВП – ммоль/л или количество миллимолей липида, растворенного в 1 литре крови. Коэффициент атерогенности измеряется в единицах. Его рассчитывают по специальной формуле.
Дополнительными параметрами липидограммы исследования являются:
- апопротеины – белки, входящие в состав липопротеинов и определяющие, каким клеткам предназначены ЛПНП и ЛПВП;
- хиломикроны (ХМ) – особый вид липопротеинов, формирующихся в кишечнике и наделенных функцией перемещения экзогенных жиров (триглицеридов и холестерина) в клетки и ткани организма.
Содержание апопротеинов, триглицеридов, холестерола и других жиров в липопротеинах и хиломикронах в процентах (%)
Дисбаланс разноплотных липопротеинов называется дислипидемия. Чаще всего такое нарушение обусловлено увеличением концентрации ЛПНП на фоне снижения показателей ЛПВП. На составе крови дислипидемия отражается гиперхолестеринемией. В липидограмме указывают все параметры с конкретными цифрами. Обычная биохимия дает только результаты ОХ.
Референсные значения у детей
Нормы холестерина градируются в зависимости от возраста. Принятые значения для детей ниже, чем для взрослых пациентов, поскольку в детском организме:
- окончательно не сформирована половая и репродуктивная система;
- отличается скорость метаболизма жира и сахара;
- отличается процесс переработки и усвоения пищи;
- нестабилен гормональный фон.
Пропорционально росту и развитию ребенка увеличивается количество эндогенного и экзогенного холестерола. Соответственно, изменяются нормы его содержания в крови.
Нормальные детские показатели
| Возраст | До 30 дней | До года | До 12 лет | До 16 лет |
| Ммоль/л | 1,6 – 3 | 1,8 – 3,7 | 3,7 – 4,5 | 3,8 – 5,0 |
Взрослые нормы Cholesterin
Референсные значения ОХ для мужчин и женщин фертильного возраста идентичны. Нижняя граница нормы составляет 3,2 ммоль/л, верхняя граница – 5,2 ммоль/л. Гиперхолестеринемией считаются результаты, превышающие 6,7 ммоль/л.
Основная опасность повышенной концентрации холестерола в крови – развитие атеросклероза коронарных артерий сердца, сосудов нижних конечностей, головного мозга, почек. Атеросклеротические изменения сосудов необратимы. При утрате контроля заболевание приводит к инфаркту, ишемическому инсульту, почечной недостаточности, сухой гангрене ног.
Показатели Cho менее 3,0 ммоль/л означают гипохолестеринемию. При таком нарушении липидного обмена возникает риск:
- разрушения клеточных мембран;
- гиповитаминоза витамина D;
- дисфункций половой и репродуктивной системы;
- сбоя в работе вегетативной нервной системы.
Дефицит Cholesterin провоцирует геморрагический инсульт. Для беременных женщин последствием гипохолестеринемии становятся выкидыш и преждевременные роды. Незначительное возрастное изменение концентрации HDL (в среднем, на 2 ммоль/л) не является патологией. Это связано с угасанием половой активности, замедлением обменных процессов, общим старением организма.
Различия по гендерному признаку
Нормы липопротеинов классифицируют по гендерной принадлежности. Это объясняется:
- разницей в составе, производстве и расходе половых гормонов;
- природной спецификой организма женщины запасаться жиром для сохранения потенциальной беременности.
Женские и мужские показатели триглицеридов и липопротеинов
| Параметры | TRIG | LDL | HDL | VLDL | ||||
| Пол | муж. | жен. | муж. | жен. | муж. | жен. | муж. | жен. |
| Норма в ммоль/л | 0,41-1,8 | 2,25-4,82 | 1,92-4,51 | 0,7-1,73 | 0,86-2,28 | 0,26-1,04 |
Для перинатального периода приняты отдельные показатели. Холестерин становится базовым липидом для образования и развития плаценты. Кроме того, при изменении гормонального статуса в усиленном режиме синтезируется прогестерон – половой гормон, оберегающий будущего ребенка. Для его выработки необходим эндогенный холестерол. Значения ОХ и его фракций возрастают со второго триместра беременности.
Нормальные значения для будущих мам
Волна гормональных изменений во время менопаузы также отражается на концентрации холестерина. Предклимактерический и климактерический период характеризуется постепенным угнетением (с последующей остановкой) выработки полового гормона эстрадиола. Его заменяет эстрон, синтезирующийся из липидов, поэтому повышается уровень ОХ.
Показатели для женщин в менопаузу
Индекс (коэффициент) атерогенности
Символ IA можно встретить только в бланке липидограммы. Вычисление индекса атерогенности в рамках стандартной биохимии крови не производится. Для липидного профиля используются формулы:
- IA= (LDL + VLDL) / HDL;
- IA= (Cho – HDL) / HDL.
Индекс атерогенности отражает степень развития (риска развития) атеросклеротических изменений сосудов. Расшифровать полученные значения КА можно следующим образом:
| Значение | Результат анализа | Предварительный диагноз |
| 2-2,5 | Норма | Правильный обмен липидов |
| 3-4 | Повышенный | Угроза атеросклероза |
| >4 | Высокий | Атеросклероз, риск инсульта, инфаркта |
Заниженный КА не имеет диагностической ценности.
Итоги
Показатели холестерина, липопротеинов и триглицеридов в крови – это маркер процессов жирового обмена и угрозы развития серьезных заболеваний. В бланках анализа параметры исследования обозначаются на латинском языке:
- Cho (Cholesterin) – концентрация общего холестерина;
- LDL и VLDL – низкоплотные и очень низкоплотные липопротеины (ЛПНП и ЛПНОП);
- HDL – высокоплотные липопротеины (ЛПВП);
- TRIG или TG – триглицериды.
Знак IA означает индекс атерогенности, отражающий опасность атеросклеротической патологии сосудов.
холестерин общий
-
1
общий холестеринУниверсальный англо-русский словарь > общий холестерин
-
2
общий холестерин, ОХУниверсальный русско-английский словарь > общий холестерин, ОХ
-
3
общий холестеринУниверсальный русско-немецкий словарь > общий холестерин
-
4
общий холестеринРусско-испанский медицинский словарь > общий холестерин
-
5
CTDiccionario médico español-ruso > CT
-
6
total cholesterol (TC)English-Russian dictionary of medicine > total cholesterol (TC)
-
7
cholesterol totalУниверсальный англо-русский словарь > cholesterol total
-
8
total cholesterolУниверсальный англо-русский словарь > total cholesterol
-
9
ОХСУниверсальный русско-английский словарь > ОХС
-
10
GesamtcholesterinУниверсальный немецко-русский словарь > Gesamtcholesterin
-
11
colesterol totalИспанско-русский универсальный словарь > colesterol total
-
12
ОХмежд.
1) ay, ah; ay de mí
2) oh
* * *
межд.
1) ay, ah; ay de mí
2) oh
* * *
v
Diccionario universal ruso-español > ОХ
См. также в других словарях:
-
холестерин общий — суммарное содержание в сыворотке крови свободного и этерифицированного холестерина … Большой медицинский словарь
-
ХОЛЕСТЕРИН — (холестерол), жирорастворимое вещество, присутствующее во всех тканях животного организма. Функции холестерина весьма разнообразны. Он входит в состав клеточных мембран, является частью растворимых липопротеиновых комплексов, циркулирующих в… … Энциклопедия Кольера
-
Липиды — I Липиды (греч. lipos жир + eidos вид) класс жиров и жироподобных веществ (липоидов), различающихся по химическому составу, структуре и выполняемым в организме функциям, но сходных по физико химическим свойствам. Все Л. нерастворимы в воде, но… … Медицинская энциклопедия
-
Кровь — жидкая ткань, циркулирующая в кровеносной системе человека и животных; обеспечивает жизнедеятельность клеток и тканей и выполнение ими различных физиологических функций. Одна из основных функций К. транспорт газов (O2 от органов… … Большая советская энциклопедия
-
ОБЛИТЕРАЦИЯ — (лат. obliteratio уничтожение), термин, употребляемый для обозначений закрытия, уничтожения той или иной полости или просвета посредством разрастания^ ткани, идущего со стороны стенок данного полостного образования. Указанное разрастание чаще… … Большая медицинская энциклопедия
-
ЖЕЛЧНОКАМЕННАЯ БОЛЕЗНЬ — ЖЕЛЧНОКАМЕННАЯ БОЛЕЗНЬ. Содержание: Исторические данные………….171 Состав и структура желчных камнзй……172 Этиология и патогенез Ж. б. . ………175 Симптоматология и течение………..181 Желчная колика……………..183 Последствия и … Большая медицинская энциклопедия
-
Биохимический анализ крови — Биохимический анализ крови это лабораторный метод исследования, использующийся в медицине, который отражает функциональное состояние органов и систем организма человека. Он позволяет определить функцию печени, почек, активный воспалительный … Википедия
-
КРОВЬ — КРОВЬ, жидкость, заполняющая артерии, вены и капиляры организма и состоящая из прозрачной бледножелтоват. цвета плаз мы и взвешенных в ней форменных элементов: красных кровяных телец, или эритроцитов, белых, или лейкоцитов, и кровяных бляшек, или … Большая медицинская энциклопедия
-
Трайкор — Действующее вещество ›› Фенофибрат* (Fenofibrate*) Латинское название Tricor АТХ: ›› C10AB05 Фенофибрат Фармакологическая группа: Фибраты Нозологическая классификация (МКБ 10) ›› E78.0 Чистая гиперхолестеринемия ›› E78.1 Чистая гиперглицеридемия… … Словарь медицинских препаратов
-
МОЧА — (урина, urina), жидкость, отде ляемая почками и выделяемая из организ ма наружу через систему мочевыводящих путей. СМ. удаляются из организма почти все азотистые продукты обмена веществ (за исключением небольших количеств, поступающих в пот и в… … Большая медицинская энциклопедия
-
ГОЛОВНОЙ МОЗГ — ГОЛОВНОЙ МОЗГ. Содержание: Методы изучения головного мозга ….. . . 485 Филогенетическое и онтогенетическое развитие головного мозга…………. 489 Bee головного мозга…………..502 Анатомия головного мозга Макроскопическое и… … Большая медицинская энциклопедия

|
|

|
|
|
|

|
|
| Names | |
|---|---|
| IUPAC name
Cholest-5-en-3β-ol |
|
| Preferred IUPAC name
(1R,3aS,3bS,7S,9aR,9bS,11aR)-9a,11a-Dimethyl-1-[(2R)-6-methylheptan-2-yl]-2,3,3a,3b,4,6,7,8,9,9a,9b,10,11,11a-tetradecahydro-1H-cyclopenta[a]phenanthren-7-ol |
|
| Other names
Cholesterin, Cholesteryl alcohol[1] |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.321 |
|
IUPHAR/BPS |
|
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C27H46O |
| Molar mass | 386.65 g/mol |
| Appearance | white crystalline powder[2] |
| Density | 1.052 g/cm3 |
| Melting point | 148 to 150 °C (298 to 302 °F; 421 to 423 K)[2] |
| Boiling point | 360 °C (680 °F; 633 K) (decomposes) |
|
Solubility in water |
0.095 mg/L (30 °C)[1] |
| Solubility | soluble in acetone, benzene, chloroform, ethanol, ether, hexane, isopropyl myristate, methanol |
|
Magnetic susceptibility (χ) |
-284.2·10−6 cm3/mol |
| Hazards | |
| Flash point | 209.3 ±12.4 °C |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Cholesterol is any of a class of certain organic molecules called lipids. It is a sterol (or modified steroid),[3] a type of lipid.[1] Cholesterol is biosynthesized by all animal cells and is an essential structural component of animal cell membranes. When chemically isolated, it is a yellowish crystalline solid.
Cholesterol also serves as a precursor for the biosynthesis of steroid hormones, bile acid[4] and vitamin D. Cholesterol is the principal sterol synthesized by all animals. In vertebrates, hepatic cells typically produce the greatest amounts. It is absent among prokaryotes (bacteria and archaea), although there are some exceptions, such as Mycoplasma, which require cholesterol for growth.[5]
François Poulletier de la Salle first identified cholesterol in solid form in gallstones in 1769. However, it was not until 1815 that chemist Michel Eugène Chevreul named the compound «cholesterine».[6][7]
Etymology[edit]
The word «cholesterol» comes from the Ancient Greek chole- (bile) and stereos (solid), followed by the chemical suffix -ol for an alcohol.
Physiology[edit]
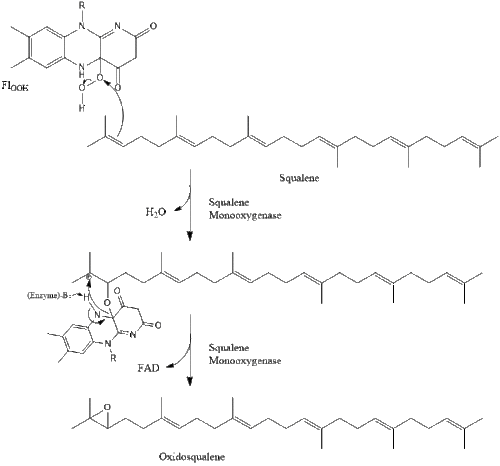
Cholesterol is essential for all animal life, with each cell capable of synthesizing it by way of a complex 37-step process. This begins with the mevalonate or HMG-CoA reductase pathway, the target of statin drugs, which encompasses the first 18 steps. This is followed by 19 additional steps to convert the resulting lanosterol into cholesterol.
A human male weighing 68 kg (150 lb) normally synthesizes about 1 gram (1,000 mg) of cholesterol per day, and his body contains about 35 g, mostly contained within the cell membranes. Typical daily cholesterol dietary intake for a man in the United States is 307 mg.[8]
Most ingested cholesterol is esterified, which causes it to be poorly absorbed by the gut. The body also compensates for absorption of ingested cholesterol by reducing its own cholesterol synthesis.[9] For these reasons, cholesterol in food, seven to ten hours after ingestion, has little, if any effect on concentrations of cholesterol in the blood.[10] However, during the first seven hours after ingestion of cholesterol, as absorbed fats are being distributed around the body within extracellular water by the various lipoproteins (which transport all fats in the water outside cells), the concentrations increase.[11]
Plants make cholesterol in very small amounts.[12] In larger quantities they produce phytosterols, chemically similar substances which can compete with cholesterol for reabsorption in the intestinal tract, thus potentially reducing cholesterol reabsorption.[13] When intestinal lining cells absorb phytosterols, in place of cholesterol, they usually excrete the phytosterol molecules back into the GI tract, an important protective mechanism. The intake of naturally occurring phytosterols, which encompass plant sterols and stanols, ranges between ≈200–300 mg/day depending on eating habits.[14] Specially designed vegetarian experimental diets have been produced yielding upwards of 700 mg/day.[15]
Function[edit]
Membranes[edit]
Cholesterol composes about 30% of all animal cell membranes. It is required to build and maintain membranes and modulates membrane fluidity over the range of physiological temperatures. The hydroxyl group of each cholesterol molecule interacts with water molecules surrounding the membrane, as do the polar heads of the membrane phospholipids and sphingolipids, while the bulky steroid and the hydrocarbon chain are embedded in the membrane, alongside the nonpolar fatty-acid chain of the other lipids. Through the interaction with the phospholipid fatty-acid chains, cholesterol increases membrane packing, which both alters membrane fluidity[16] and maintains membrane integrity so that animal cells do not need to build cell walls (like plants and most bacteria). The membrane remains stable and durable without being rigid, allowing animal cells to change shape and animals to move.
The structure of the tetracyclic ring of cholesterol contributes to the fluidity of the cell membrane, as the molecule is in a trans conformation making all but the side chain of cholesterol rigid and planar.[17] In this structural role, cholesterol also reduces the permeability of the plasma membrane to neutral solutes,[18] hydrogen ions, and sodium ions.[19]
Substrate presentation[edit]
Cholesterol regulates the biological process of substrate presentation and the enzymes that use substrate presentation as a mechanism of their activation. (PLD2) is a well-defined example of an enzyme activated by substrate presentation.[20] The enzyme is palmitoylated causing the enzyme to traffic to cholesterol dependent lipid domains sometimes called «lipid rafts». The substrate of phospholipase D is phosphatidylcholine (PC) which is unsaturated and is of low abundance in lipid rafts. PC localizes to the disordered region of the cell along with the polyunsaturated lipid phosphatidylinositol 4,5-bisphosphate (PIP2). PLD2 has a PIP2 binding domain. When PIP2 concentration in the membrane increases, PLD2 leaves the cholesterol-dependent domains and binds to PIP2 where it then gains access to its substrate PC and commences catalysis based on substrate presentation.
Substrate presentation; PLD (blue oval) is sequestered into cholesterol-dependent lipid domains (green lipids) by palmitoylation. PLD also binds PIP2(red hexagon) domains (grey shading) located in the disordered region of the cell with phosphatidylcholine (PC). When cholesterol decreases or PIP2 increases in the cell, PLD translocates to PIP2 where it is exposed to and hydrolizes PC to phosphatidic acid (red spherical lipid).
Signaling[edit]
Cholesterol is also implicated in cell signaling processes, assisting in the formation of lipid rafts in the plasma membrane, which brings receptor proteins in close proximity with high concentrations of second messenger molecules.[21] In multiple layers, cholesterol and phospholipids, both electrical insulators, can facilitate speed of transmission of electrical impulses along nerve tissue. For many neuron fibers, a myelin sheath, rich in cholesterol since it is derived from compacted layers of Schwann cell membrane, provides insulation for more efficient conduction of impulses.[22] Demyelination (loss of some of these Schwann cells) is believed to be part of the basis for multiple sclerosis.
Cholesterol binds to and affects the gating of a number of ion channels such as the nicotinic acetylcholine receptor, GABAA receptor, and the inward-rectifier potassium channel.[23] Cholesterol also activates the estrogen-related receptor alpha (ERRα), and may be the endogenous ligand for the receptor.[24][25] The constitutively active nature of the receptor may be explained by the fact that cholesterol is ubiquitous in the body.[25] Inhibition of ERRα signaling by reduction of cholesterol production has been identified as a key mediator of the effects of statins and bisphosphonates on bone, muscle, and macrophages.[24][25] On the basis of these findings, it has been suggested that the ERRα should be de-orphanized and classified as a receptor for cholesterol.[24][25]
Chemical precursor[edit]
Within cells, cholesterol is also a precursor molecule for several biochemical pathways. For example, it is the precursor molecule for the synthesis of vitamin D in the calcium metabolism and all steroid hormones, including the adrenal gland hormones cortisol and aldosterone, as well as the sex hormones progesterone, estrogens, and testosterone, and their derivatives.[4][26]
Epidermis[edit]
The stratum corneum is the outermost layer of the epidermis.[27][28] It is composed of terminally differentiated and enucleated corneocytes that reside within a lipid matrix, like «bricks and mortar.»[27][28] Together with ceramides and free fatty acids, cholesterol forms the lipid mortar, a water-impermeable barrier that prevents evaporative water loss. As a general rule of thumb, the epidermal lipid matrix is composed of an equimolar mixture of ceramides (~50% by weight), cholesterol (~ 25% by weight), and free fatty acids (~15% by weight), with smaller quantities of other lipids also being present.[27][28] Cholesterol sulfate reaches its highest concentration in the granular layer of the epidermis. Steroid sulfate sulfatase then decreases its concentration in the stratum corneum, the outermost layer of the epidermis.[29] The relative abundance of cholesterol sulfate in the epidermis varies across different body sites with the heel of the foot having the lowest concentration.[28]
Metabolism[edit]
Cholesterol is recycled in the body. The liver excretes cholesterol into biliary fluids, which are then stored in the gallbladder, which then excretes them in a non-esterified form (via bile) into the digestive tract. Typically, about 50% of the excreted cholesterol is reabsorbed by the small intestine back into the bloodstream.[30]
Biosynthesis and regulation[edit]
Biosynthesis[edit]
All animal cells (exceptions exist within the invertebrates) manufacture cholesterol, for both membrane structure and other uses, with relative production rates varying by cell type and organ function. About 80% of total daily cholesterol production occurs in the liver and the intestines;[31] other sites of higher synthesis rates include the brain, the adrenal glands, and the reproductive organs.
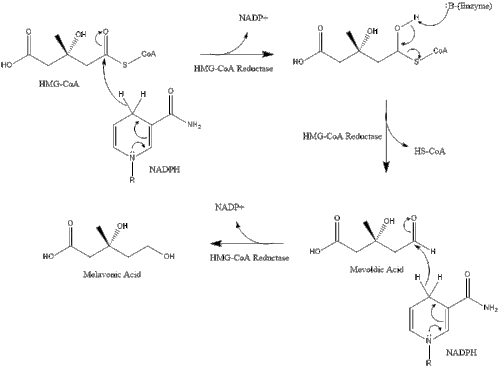
Synthesis within the body starts with the mevalonate pathway where two molecules of acetyl CoA condense to form acetoacetyl-CoA. This is followed by a second condensation between acetyl CoA and acetoacetyl-CoA to form 3-hydroxy-3-methylglutaryl CoA (HMG-CoA).[32]
This molecule is then reduced to mevalonate by the enzyme HMG-CoA reductase. Production of mevalonate is the rate-limiting and irreversible step in cholesterol synthesis and is the site of action for statins (a class of cholesterol-lowering drugs).
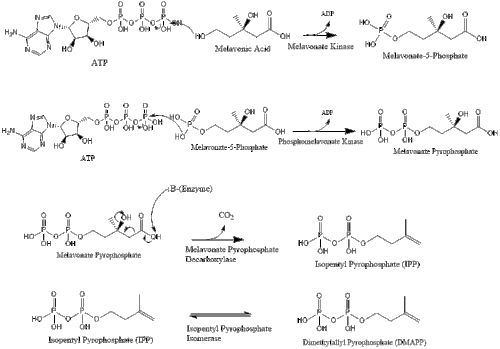
Mevalonate is finally converted to isopentenyl pyrophosphate (IPP) through two phosphorylation steps and one decarboxylation step that requires ATP.
Three molecules of isopentenyl pyrophosphate condense to form farnesyl pyrophosphate through the action of geranyl transferase.
Two molecules of farnesyl pyrophosphate then condense to form squalene by the action of squalene synthase in the endoplasmic reticulum.[32]
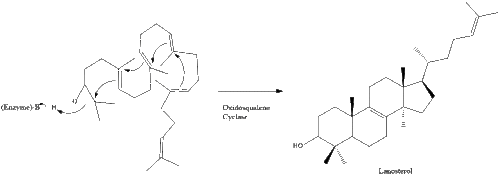
Oxidosqualene cyclase then cyclizes squalene to form lanosterol.
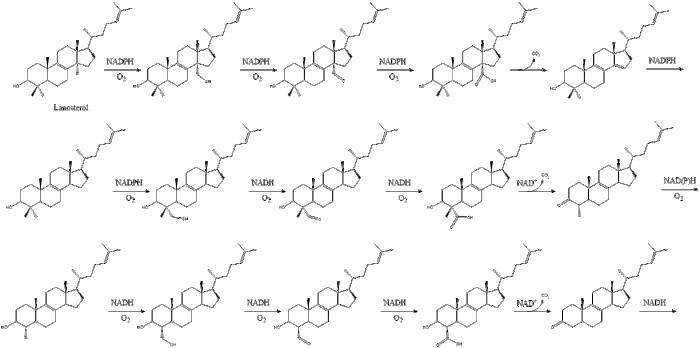
Finally, lanosterol is converted to cholesterol via either of two pathways, the Bloch pathway, or the Kandutsch-Russell pathway.[33][34][35][36][37]
The final 19 steps to cholesterol contain NADPH and oxygen to help oxidize methyl groups for removal of carbons, mutases to move alkene groups, and NADH to help reduce ketones.
Konrad Bloch and Feodor Lynen shared the Nobel Prize in Physiology or Medicine in 1964 for their discoveries concerning some of the mechanisms and methods of regulation of cholesterol and fatty acid metabolism.[38]
Regulation of cholesterol synthesis[edit]
Biosynthesis of cholesterol is directly regulated by the cholesterol levels present, though the homeostatic mechanisms involved are only partly understood. A higher intake of food leads to a net decrease in endogenous production, whereas a lower intake of food has the opposite effect. The main regulatory mechanism is the sensing of intracellular cholesterol in the endoplasmic reticulum by the protein SREBP (sterol regulatory element-binding protein 1 and 2).[39] In the presence of cholesterol, SREBP is bound to two other proteins: SCAP (SREBP cleavage-activating protein) and INSIG-1. When cholesterol levels fall, INSIG-1 dissociates from the SREBP-SCAP complex, which allows the complex to migrate to the Golgi apparatus. Here SREBP is cleaved by S1P and S2P (site-1 protease and site-2 protease), two enzymes that are activated by SCAP when cholesterol levels are low.
The cleaved SREBP then migrates to the nucleus and acts as a transcription factor to bind to the sterol regulatory element (SRE), which stimulates the transcription of many genes. Among these are the low-density lipoprotein (LDL) receptor and HMG-CoA reductase. The LDL receptor scavenges circulating LDL from the bloodstream, whereas HMG-CoA reductase leads to an increase in endogenous production of cholesterol.[40] A large part of this signaling pathway was clarified by Dr. Michael S. Brown and Dr. Joseph L. Goldstein in the 1970s. In 1985, they received the Nobel Prize in Physiology or Medicine for their work. Their subsequent work shows how the SREBP pathway regulates the expression of many genes that control lipid formation and metabolism and body fuel allocation.
Cholesterol synthesis can also be turned off when cholesterol levels are high. HMG-CoA reductase contains both a cytosolic domain (responsible for its catalytic function) and a membrane domain. The membrane domain senses signals for its degradation. Increasing concentrations of cholesterol (and other sterols) cause a change in this domain’s oligomerization state, which makes it more susceptible to destruction by the proteasome. This enzyme’s activity can also be reduced by phosphorylation by an AMP-activated protein kinase. Because this kinase is activated by AMP, which is produced when ATP is hydrolyzed, it follows that cholesterol synthesis is halted when ATP levels are low.[41]
Plasma transport and regulation of absorption[edit]
Lipid logistics: transport of triglycerides and cholesterol in organisms in form of lipoproteins as chylomicrons, VLDL, LDL, IDL, HDL.
As an isolated molecule, cholesterol is only minimally soluble in water, or hydrophilic. Because of this, it dissolves in blood at exceedingly small concentrations. To be transported effectively, cholesterol is instead packaged within lipoproteins, complex discoidal particles with exterior amphiphilic proteins and lipids, whose outward-facing surfaces are water-soluble and inward-facing surfaces are lipid-soluble. This allows it to travel through the blood via emulsification. Unbound cholesterol, being amphipathic, is transported in the monolayer surface of the lipoprotein particle along with phospholipids and proteins. Cholesterol esters bound to fatty acid, on the other hand, are transported within the fatty hydrophobic core of the lipoprotein, along with triglyceride.[42]
There are several types of lipoproteins in the blood. In order of increasing density, they are chylomicrons, very-low-density lipoprotein (VLDL), intermediate-density lipoprotein (IDL), low-density lipoprotein (LDL), and high-density lipoprotein (HDL). Lower protein/lipid ratios make for less dense lipoproteins. Cholesterol within different lipoproteins is identical, although some is carried as its native «free» alcohol form (the cholesterol-OH group facing the water surrounding the particles), while others as fatty acyl esters, known also as cholesterol esters, within the particles.[42]
Lipoprotein particles are organized by complex apolipoproteins, typically 80–100 different proteins per particle, which can be recognized and bound by specific receptors on cell membranes, directing their lipid payload into specific cells and tissues currently ingesting these fat transport particles. These surface receptors serve as unique molecular signatures, which then help determine fat distribution delivery throughout the body.[42]
Chylomicrons, the least dense cholesterol transport molecules, contain apolipoprotein B-48, apolipoprotein C, and apolipoprotein E (the principal cholesterol carrier in the brain[43]) in their shells. Chylomicrons carry fats from the intestine to muscle and other tissues in need of fatty acids for energy or fat production. Unused cholesterol remains in more cholesterol-rich chylomicron remnants, and taken up from here to the bloodstream by the liver.[42]
VLDL molecules are produced by the liver from triacylglycerol and cholesterol which was not used in the synthesis of bile acids. These molecules contain apolipoprotein B100 and apolipoprotein E in their shells, and can be degraded by lipoprotein lipase on the artery wall to IDL. This arterial wall cleavage allows absorption of triacylglycerol and increases the concentration of circulating cholesterol. IDL molecules are then consumed in two processes: half is metabolized by HTGL and taken up by the LDL receptor on the liver cell surfaces, while the other half continues to lose triacylglycerols in the bloodstream until they become cholesterol-laden LDL particles.[42]
LDL particles are the major blood cholesterol carriers. Each one contains approximately 1,500 molecules of cholesterol ester. LDL molecule shells contain just one molecule of apolipoprotein B100, recognized by LDL receptors in peripheral tissues. Upon binding of apolipoprotein B100, many LDL receptors concentrate in clathrin-coated pits. Both LDL and its receptor form vesicles within a cell via endocytosis. These vesicles then fuse with a lysosome, where the lysosomal acid lipase enzyme hydrolyzes the cholesterol esters. The cholesterol can then be used for membrane biosynthesis or esterified and stored within the cell, so as to not interfere with the cell membranes.[42]
LDL receptors are used up during cholesterol absorption, and its synthesis is regulated by SREBP, the same protein that controls the synthesis of cholesterol de novo, according to its presence inside the cell. A cell with abundant cholesterol will have its LDL receptor synthesis blocked, to prevent new cholesterol in LDL molecules from being taken up. Conversely, LDL receptor synthesis proceeds when a cell is deficient in cholesterol.[42]
When this process becomes unregulated, LDL molecules without receptors begin to appear in the blood. These LDL molecules are oxidized and taken up by macrophages, which become engorged and form foam cells. These foam cells often become trapped in the walls of blood vessels and contribute to atherosclerotic plaque formation. Differences in cholesterol homeostasis affect the development of early atherosclerosis (carotid intima-media thickness).[44] These plaques are the main causes of heart attacks, strokes, and other serious medical problems, leading to the association of so-called LDL cholesterol (actually a lipoprotein) with «bad» cholesterol.[41]
HDL particles are thought to transport cholesterol back to the liver, either for excretion or for other tissues that synthesize hormones, in a process known as reverse cholesterol transport (RCT).[45] Large numbers of HDL particles correlates with better health outcomes,[46] whereas low numbers of HDL particles is associated with atheromatous disease progression in the arteries.[47]
Metabolism, recycling and excretion[edit]
Cholesterol is susceptible to oxidation and easily forms oxygenated derivatives called oxysterols. Three different mechanisms can form these: autoxidation, secondary oxidation to lipid peroxidation, and cholesterol-metabolizing enzyme oxidation. A great interest in oxysterols arose when they were shown to exert inhibitory actions on cholesterol biosynthesis.[48] This finding became known as the «oxysterol hypothesis». Additional roles for oxysterols in human physiology include their participation in bile acid biosynthesis, function as transport forms of cholesterol, and regulation of gene transcription.[49]
In biochemical experiments radiolabelled forms of cholesterol, such as tritiated-cholesterol are used. These derivatives undergo degradation upon storage and it is essential to purify cholesterol prior to use. Cholesterol can be purified using small Sephadex LH-20 columns.[50]
Cholesterol is oxidized by the liver into a variety of bile acids.[51] These, in turn, are conjugated with glycine, taurine, glucuronic acid, or sulfate. A mixture of conjugated and nonconjugated bile acids, along with cholesterol itself, is excreted from the liver into the bile. Approximately 95% of the bile acids are reabsorbed from the intestines, and the remainder are lost in the feces.[52] The excretion and reabsorption of bile acids forms the basis of the enterohepatic circulation, which is essential for the digestion and absorption of dietary fats. Under certain circumstances, when more concentrated, as in the gallbladder, cholesterol crystallises and is the major constituent of most gallstones (lecithin and bilirubin gallstones also occur, but less frequently).[53] Every day, up to 1 g of cholesterol enters the colon. This cholesterol originates from the diet, bile, and desquamated intestinal cells, and can be metabolized by the colonic bacteria. Cholesterol is converted mainly into coprostanol, a nonabsorbable sterol that is excreted in the feces.[citation needed]
Although cholesterol is a steroid generally associated with mammals, the human pathogen Mycobacterium tuberculosis is able to completely degrade this molecule and contains a large number of genes that are regulated by its presence.[54] Many of these cholesterol-regulated genes are homologues of fatty acid β-oxidation genes, but have evolved in such a way as to bind large steroid substrates like cholesterol.[55][56]
Dietary sources[edit]
Animal fats are complex mixtures of triglycerides, with lesser amounts of both the phospholipids and cholesterol molecules from which all animal (and human) cell membranes are constructed. Since all animal cells manufacture cholesterol, all animal-based foods contain cholesterol in varying amounts.[57] Major dietary sources of cholesterol include red meat, egg yolks and whole eggs, liver, kidney, giblets, fish oil, and butter.[58] Human breast milk also contains significant quantities of cholesterol.[59]
Plant cells synthesize cholesterol as a precursor for other compounds, such as phytosterols and steroidal glycoalkaloids, with cholesterol remaining in plant foods only in minor amounts or absent.[58][60] Some plant foods, such as avocado, flax seeds and peanuts, contain phytosterols, which compete with cholesterol for absorption in the intestines, and reduce the absorption of both dietary and bile cholesterol.[61] A typical diet contributes on the order of 0.2 gram of phytosterols, which is not enough to have a significant impact on blocking cholesterol absorption. Phytosterols intake can be supplemented through the use of phytosterol-containing functional foods or dietary supplements that are recognized as having potential to reduce levels of LDL-cholesterol.[62]
Medical guidelines and recommendations[edit]
In 2015, the United States Department of Agriculture Dietary Guidelines Advisory Committee (DGAC) recommended that Americans eat as little dietary cholesterol as possible, because most foods that are rich in cholesterol are also high in saturated fat and thereby may increase the risk of cardiovascular disease.[63][64]
A 2013 report by the American Heart Association and the American College of Cardiology recommended focusing on healthy dietary patterns rather than specific cholesterol limits, as they are hard for clinicians and consumers to implement. They recommend the DASH and Mediterranean diet, which are low in cholesterol.[65] A 2017 review by the American Heart Association recommends switching saturated fats for polyunsaturated fats to reduce cardiovascular disease risk.[66]
Some supplemental guidelines have recommended doses of phytosterols in the 1.6–3.0 grams per day range (Health Canada, EFSA, ATP III, FDA). A recent meta-analysis demonstrating a 12% reduction in LDL-cholesterol at a mean dose of 2.1 grams per day.[67] However, the benefits of a diet supplemented with phytosterols have also been questioned.[68]
Clinical significance[edit]
Hypercholesterolemia[edit]
Cholesterolemia and mortality for men and women <50 years and >60 years
According to the lipid hypothesis, elevated levels of cholesterol in the blood lead to atherosclerosis which may increase the risk of heart attack, stroke, and peripheral artery disease. Since higher blood LDL – especially higher LDL concentrations and smaller LDL particle size – contributes to this process more than the cholesterol content of the HDL particles,[69] LDL particles are often termed «bad cholesterol». High concentrations of functional HDL, which can remove cholesterol from cells and atheromas, offer protection and are commonly referred to as «good cholesterol». These balances are mostly genetically determined, but can be changed by body composition, medications, diet,[70] and other factors.[71] A 2007 study demonstrated that blood total cholesterol levels have an exponential effect on cardiovascular and total mortality, with the association more pronounced in younger subjects. Because cardiovascular disease is relatively rare in the younger population, the impact of high cholesterol on health is larger in older people.[72]
Elevated levels of the lipoprotein fractions, LDL, IDL and VLDL, rather than the total cholesterol level, correlate with the extent and progress of atherosclerosis.[73] Conversely, the total cholesterol can be within normal limits, yet be made up primarily of small LDL and small HDL particles, under which conditions atheroma growth rates are high. A post hoc analysis of the IDEAL and the EPIC prospective studies found an association between high levels of HDL cholesterol (adjusted for apolipoprotein A-I and apolipoprotein B) and increased risk of cardiovascular disease, casting doubt on the cardioprotective role of «good cholesterol».[74][75]
About one in 250 individuals can have a genetic mutation for the LDL cholesterol receptor that causes them to have familial hypercholesterolemia.[76] Inherited high cholesterol can also include genetic mutations in the PCSK9 gene and the gene for apolipoprotein B.[77]
Elevated cholesterol levels are treated with a strict diet consisting of low saturated fat, trans fat-free, low cholesterol foods,[78][79] often followed by one of various hypolipidemic agents, such as statins, fibrates, cholesterol absorption inhibitors, monoclonal antibody therapy (PCSK9 inhibitors), nicotinic acid derivatives or bile acid sequestrants.[80] There are several international guidelines on the treatment of hypercholesterolaemia.[81]
Human trials using HMG-CoA reductase inhibitors, known as statins, have repeatedly confirmed that changing lipoprotein transport patterns from unhealthy to healthier patterns significantly lowers cardiovascular disease event rates, even for people with cholesterol values currently considered low for adults.[82] Studies have shown that reducing LDL cholesterol levels by about 38.7 mg/dL with the use of statins can reduce cardiovascular disease and stroke risk by about 21%.[83] Studies have also found that statins reduce atheroma progression.[84] As a result, people with a history of cardiovascular disease may derive benefit from statins irrespective of their cholesterol levels (total cholesterol below 5.0 mmol/L [193 mg/dL]),[85] and in men without cardiovascular disease, there is benefit from lowering abnormally high cholesterol levels («primary prevention»).[86] Primary prevention in women was originally practiced only by extension of the findings in studies on men,[87] since, in women, none of the large statin trials conducted prior to 2007 demonstrated a significant reduction in overall mortality or in cardiovascular endpoints.[88] Meta-analyses have demonstrated significant reductions in all-cause and cardiovascular mortality, without significant heterogeneity by sex.[89]
| Level | Interpretation | |
|---|---|---|
| mg/dL | mmol/L | |
| < 200 | < 5.2 | Desirable level (lower risk) |
| 200–240 | 5.2–6.2 | Borderline high risk |
| > 240 | > 6.2 | High risk |
The 1987 report of National Cholesterol Education Program, Adult Treatment Panels suggests the total blood cholesterol level should be: < 200 mg/dL normal blood cholesterol, 200–239 mg/dL borderline-high, > 240 mg/dL high cholesterol.[90] The American Heart Association provides a similar set of guidelines for total (fasting) blood cholesterol levels and risk for heart disease:[91] Statins are effective in lowering LDL cholesterol and widely used for primary prevention in people at high risk of cardiovascular disease, as well as in secondary prevention for those who have developed cardiovascular disease.[92]
More current testing methods determine LDL («bad») and HDL («good») cholesterol separately, allowing cholesterol analysis to be more nuanced. The desirable LDL level is considered to be less than 100 mg/dL (2.6 mmol/L),[93][94] although a newer upper limit of 70 mg/dL (1.8 mmol/L) can be considered in higher-risk individuals based on some of the above-mentioned trials. A ratio of total cholesterol to HDL—another useful measure—of far less than 5:1 is thought to be healthier.
Reference ranges for blood tests, showing usual, as well as optimal, levels of HDL, LDL, and total cholesterol in mass and molar concentrations, is found in orange color at right, that is, among the blood constituents with the highest concentration.
Total cholesterol is defined as the sum of HDL, LDL, and VLDL. Usually, only the total, HDL, and triglycerides are measured. For cost reasons, the VLDL is usually estimated as one-fifth of the triglycerides and the LDL is estimated using the Friedewald formula (or a variant): estimated LDL = [total cholesterol] − [total HDL] − [estimated VLDL]. Direct LDL measures are used when triglycerides exceed 400 mg/dL. The estimated VLDL and LDL have more error when triglycerides are above 400 mg/dL.[95]
In the Framingham Heart Study, each 10 mg/dL (0.6 mmol/L) increase in total cholesterol levels increased 30-year overall mortality by 5% and CVD mortality by 9%. While subjects over the age of 50 had an 11% increase in overall mortality, and a 14% increase in cardiovascular disease mortality per 1 mg/dL (0.06 mmol/L) year drop in total cholesterol levels. The researchers attributed this phenomenon to reverse causation, whereby the disease itself increases risk of death, as well as changes a myriad of factors, such as weight loss and the inability to eat, which lower serum cholesterol.[96] This effect was also shown in men of all ages and women over 50 in the Vorarlberg Health Monitoring and Promotion Programme. These groups were more likely to die of cancer, liver diseases, and mental diseases with very low total cholesterol, of 186 mg/dL (10.3 mmol/L) and lower. This result indicates the low-cholesterol effect occurs even among younger respondents, contradicting the previous assessment among cohorts of older people that this is a marker for frailty occurring with age.[97]
Hypocholesterolemia[edit]
Abnormally low levels of cholesterol are termed hypocholesterolemia. Research into the causes of this state is relatively limited, but some studies suggest a link with depression, cancer, and cerebral hemorrhage. In general, the low cholesterol levels seem to be a consequence, rather than a cause, of an underlying illness.[72] A genetic defect in cholesterol synthesis causes Smith–Lemli–Opitz syndrome, which is often associated with low plasma cholesterol levels. Hyperthyroidism, or any other endocrine disturbance which causes upregulation of the LDL receptor, may result in hypocholesterolemia.[98]
Cholesterol testing[edit]
The American Heart Association recommends testing cholesterol every 4–6 years for people aged 20 years or older.[99] A separate set of American Heart Association guidelines issued in 2013 indicates that people taking statin medications should have their cholesterol tested 4–12 weeks after their first dose and then every 3–12 months thereafter.[100][101] For men ages 45 to 65 and women ages 55 to 65, a cholesterol test should occur every 1-2 years, and for seniors over age 65, an annual test should be performed.[100]
A blood sample after 12-hours of fasting is taken by a healthcare professional from an arm vein to measure a lipid profile for a) total cholesterol, b) HDL cholesterol, c) LDL cholesterol, and d) triglycerides.[100][102] Results may be expressed as «calculated», indicating a calculation of total cholesterol, HDL, and triglycerides.[102]
Cholesterol is tested to determine for «normal» or «desirable» levels if a person has a total cholesterol of 5.2 mmol/L or less (200 mg/dL), an HDL value of more than 1 mmol/L (40 mg/dL, «the higher, the better»), an LDL value of less than 2.6 mmol/L (100 mg/dL), and a triglycerides level of less than 1.7 mmol/L (150 mg/dL).[100][102] Blood cholesterol in people with lifestyle, aging, or cardiovascular risk factors, such as diabetes mellitus, hypertension, family history of coronary artery disease, or angina, are evaluated at different levels.[100]
Interactive pathway map[edit]
Click on genes, proteins and metabolites below to link to respective articles. [§ 1]
[[File:
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
|alt=Statin Pathway edit]]
- ^ The interactive pathway map can be edited at WikiPathways: «Statin_Pathway_WP430».
Cholesteric liquid crystals[edit]
Some cholesterol derivatives (among other simple cholesteric lipids) are known to generate the liquid crystalline «cholesteric phase». The cholesteric phase is, in fact, a chiral nematic phase, and it changes colour when its temperature changes. This makes cholesterol derivatives useful for indicating temperature in liquid-crystal display thermometers and in temperature-sensitive paints.[citation needed]
Stereoisomers[edit]
Natural cholesterol (top) and ent-cholesterol (bottom)
Cholesterol has 256 stereoisomers that arise from its eight stereocenters, although only two of the stereoisomers are of biochemical significance (nat-cholesterol and ent-cholesterol, for natural and enantiomer, respectively),[103][104] and only one occurs naturally (nat-cholesterol).
Additional images[edit]
-
Cholesterol units conversion
See also[edit]
- Arcus senilis «Cholesterol ring» in the eyes
- Cardiovascular disease
- Cholesterol embolism
- Cholesterol total synthesis
- Familial hypercholesterolemia
- Hypercholesterolemia «High Cholesterol»
- Hypocholesterolemia «Low Cholesterol»
- Janus-faced molecule
- List of cholesterol in foods
- Niemann–Pick disease Type C
- Oxycholesterol
- Remnant cholesterol
References[edit]
- ^ a b c «Cholesterol, 57-88-5». PubChem, National Library of Medicine, US National Institutes of Health. 9 November 2019. Retrieved 14 November 2019.
- ^ a b «Safety (MSDS) data for cholesterol». Archived from the original on 12 July 2007. Retrieved 20 October 2007.
- ^ Cholesterol at the US National Library of Medicine Medical Subject Headings (MeSH)
- ^ a b Hanukoglu I (December 1992). «Steroidogenic enzymes: structure, function, and role in regulation of steroid hormone biosynthesis». The Journal of Steroid Biochemistry and Molecular Biology. 43 (8): 779–804. doi:10.1016/0960-0760(92)90307-5. PMID 22217824. S2CID 112729.
- ^ Razin S, Tully JG (May 1970). «Cholesterol requirement of mycoplasmas». Journal of Bacteriology. 102 (2): 306–10. doi:10.1128/JB.102.2.306-310.1970. PMC 247552. PMID 4911537.
- ^ Chevreul (1816) «Recherches chimiques sur les corps gras, et particulièrement sur leurs combinaisons avec les alcalis. Sixième mémoire. Examen des graisses d’homme, de mouton, de boeuf, de jaguar et d’oie» (Chemical researches on fatty substances, and particularly on their combinations o filippos ine kapios with alkalis. Sixth memoir. Study of human, sheep, beef, jaguar and goose fat), Annales de Chimie et de Physique, 2 : 339–372. From page 346 : «Je nommerai cholesterine, de χολη, bile, et στερεος, solide, la substance cristallisée des calculs biliares humains, … » (I will name cholesterine – from χολη (bile) and στερεος (solid) – the crystalized substance from human gallstones … )
- ^ Olson RE (February 1998). «Discovery of the lipoproteins, their role in fat transport and their significance as risk factors». The Journal of Nutrition. 128 (2 Suppl): 439S–443S. doi:10.1093/jn/128.2.439S. PMID 9478044.
- ^ «National Health and Nutrition Examination Survey» (PDF). United States Center for Disease Control. Retrieved 28 January 2012.
- ^
Lecerf JM, de Lorgeril M (July 2011). «Dietary cholesterol: from physiology to cardiovascular risk». The British Journal of Nutrition. 106 (1): 6–14. doi:10.1017/S0007114511000237. PMID 21385506. - ^ Soliman GA (June 2018). «Dietary Cholesterol and the Lack of Evidence in Cardiovascular Disease». Nutrients. 10 (6): 780. doi:10.3390/nu10060780. PMC 6024687. PMID 29914176.
- ^ Dubois C, Armand M, Mekki N, Portugal H, Pauli AM, Bernard PM, et al. (November 1994). «Effects of increasing amounts of dietary cholesterol on postprandial lipemia and lipoproteins in human subjects». Journal of Lipid Research. 35 (11): 1993–2007. doi:10.1016/S0022-2275(20)39946-6. PMID 7868978.
- ^ Behrman EJ, Gopalan V (2005). Scovell WM (ed.). «Cholesterol and Plants». Journal of Chemical Education. 82 (12): 1791. Bibcode:2005JChEd..82.1791B. doi:10.1021/ed082p1791.
- ^ John S, Sorokin AV, Thompson PD (February 2007). «Phytosterols and vascular disease». Current Opinion in Lipidology. 18 (1): 35–40. doi:10.1097/MOL.0b013e328011e9e3. PMID 17218830. S2CID 29213889.
- ^ Jesch ED, Carr TP (June 2017). «Food Ingredients That Inhibit Cholesterol Absorption». Preventive Nutrition and Food Science. 22 (2): 67–80. doi:10.3746/pnf.2017.22.2.67. PMC 5503415. PMID 28702423.
- ^ Agren JJ, Tvrzicka E, Nenonen MT, Helve T, Hänninen O (February 2001). «Divergent changes in serum sterols during a strict uncooked vegan diet in patients with rheumatoid arthritis». The British Journal of Nutrition. 85 (2): 137–9. doi:10.1079/BJN2000234. PMID 11242480.
- ^ Sadava D, Hillis DM, Heller HC, Berenbaum MR (2011). Life: The Science of Biology 9th Edition. San Francisco: Freeman. pp. 105–114. ISBN 978-1-4292-4646-0.
- ^ Ohvo-Rekilä H, Ramstedt B, Leppimäki P, Slotte JP (January 2002). «Cholesterol interactions with phospholipids in membranes». Progress in Lipid Research. 41 (1): 66–97. doi:10.1016/S0163-7827(01)00020-0. PMID 11694269.
- ^ Yeagle PL (October 1991). «Modulation of membrane function by cholesterol». Biochimie. 73 (10): 1303–10. doi:10.1016/0300-9084(91)90093-G. PMID 1664240.
- ^ Haines TH (July 2001). «Do sterols reduce proton and sodium leaks through lipid bilayers?». Progress in Lipid Research. 40 (4): 299–324. doi:10.1016/S0163-7827(01)00009-1. PMID 11412894.
- ^ Petersen EN, Chung HW, Nayebosadri A, Hansen SB (December 2016). «Kinetic disruption of lipid rafts is a mechanosensor for phospholipase D». Nature Communications. 7: 13873. Bibcode:2016NatCo…713873P. doi:10.1038/ncomms13873. PMC 5171650. PMID 27976674.
- ^ Incardona JP, Eaton S (April 2000). «Cholesterol in signal transduction». Current Opinion in Cell Biology. 12 (2): 193–203. doi:10.1016/S0955-0674(99)00076-9. PMID 10712926.
- ^ Pawlina W, Ross MW (2006). Histology: a text and atlas: with correlated cell and molecular biology. Philadelphia: Lippincott Wiliams & Wilkins. p. 230. ISBN 978-0-7817-5056-1.
- ^ Levitan I, Singh DK, Rosenhouse-Dantsker A (2014). «Cholesterol binding to ion channels». Frontiers in Physiology. 5: 65. doi:10.3389/fphys.2014.00065. PMC 3935357. PMID 24616704.
- ^ a b c Wei W, Schwaid AG, Wang X, Wang X, Chen S, Chu Q, et al. (March 2016). «Ligand Activation of ERRα by Cholesterol Mediates Statin and Bisphosphonate Effects». Cell Metabolism. 23 (3): 479–91. doi:10.1016/j.cmet.2015.12.010. PMC 4785078. PMID 26777690.
- ^ a b c d Nuclear Receptors in Development and Disease. Elsevier Science. 17 May 2017. pp. 88–. ISBN 978-0-12-802196-5.
- ^ Payne AH, Hales DB (December 2004). «Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones». Endocrine Reviews. 25 (6): 947–70. doi:10.1210/er.2003-0030. PMID 15583024.
- ^ a b c Elias, Peter (2006). Skin barrier. New York: Taylor & Francis. ISBN 9780824758158.
- ^ a b c d Merleev, AA; Le, ST; Alexanian, C; Toussi, A; Xie, Y; Marusina, AI; Watkins, SM; Patel, F; Billi, AC; Wiedemann, J; Izumiya, Y; Kumar, A; Uppala, R; Kahlenberg, JM; Liu, FT; Adamopoulos, IE; Wang, EA; Ma, C; Cheng, MY; Xiong, H; Kirane, A; Luxardi, G; Andersen, B; Tsoi, LC; Lebrilla, CB; Gudjonsson, JE; Maverakis, E (22 August 2022). «Biogeographic and disease-specific alterations in epidermal lipid composition and single-cell analysis of acral keratinocytes». JCI Insight. 7 (16). doi:10.1172/jci.insight.159762. PMC 9462509. PMID 35900871.
- ^ Elias, PM; Williams, ML; Maloney, ME; Bonifas, JA; Brown, BE; Grayson, S; Epstein EH, Jr (October 1984). «Stratum corneum lipids in disorders of cornification. Steroid sulfatase and cholesterol sulfate in normal desquamation and the pathogenesis of recessive X-linked ichthyosis». The Journal of Clinical Investigation. 74 (4): 1414–21. doi:10.1172/JCI111552. PMC 425309. PMID 6592175.
- ^ Cohn JS, Kamili A, Wat E, Chung RW, Tandy S (February 2010). «Dietary phospholipids and intestinal cholesterol absorption». Nutrients. 2 (2): 116–27. doi:10.3390/nu2020116. PMC 3257636. PMID 22254012.
- ^ «How it’s made: Cholesterol production in your body». Harvard Health Publishing. Retrieved 18 October 2018.
- ^ a b «Biosynthesis and Regulation of Cholesterol (with Animation)». PharmaXChange.info. 17 September 2013.
- ^ «Cholesterol metabolism (includes both Bloch and Kandutsch-Russell pathways) (Mus musculus) – WikiPathways». www.wikipathways.org. Retrieved 2 February 2021.
- ^ Singh P, Saxena R, Srinivas G, Pande G, Chattopadhyay A (2013). «Cholesterol biosynthesis and homeostasis in regulation of the cell cycle». PLOS ONE. 8 (3): e58833. Bibcode:2013PLoSO…858833S. doi:10.1371/journal.pone.0058833. PMC 3598952. PMID 23554937.
- ^ «Kandutsch-Russell pathway». pubchem.ncbi.nlm.nih.gov. Retrieved 2 February 2021.
- ^ Berg J (2002). Biochemistry. New York: WH Freeman. ISBN 978-0-7167-3051-4.
- ^ Rhodes CM, Stryer L, Tasker R (1995). Biochemistry (4th ed.). San Francisco: W.H. Freeman. pp. 280, 703. ISBN 978-0-7167-2009-6.
- ^ «The Nobel Prize in Physiology or Medicine, 1964». Nobel Prize, Nobel Media.
- ^ Espenshade PJ, Hughes AL (2007). «Regulation of sterol synthesis in eukaryotes». Annual Review of Genetics. 41: 401–27. doi:10.1146/annurev.genet.41.110306.130315. PMID 17666007.
- ^ Brown MS, Goldstein JL (May 1997). «The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor». Cell. 89 (3): 331–40. doi:10.1016/S0092-8674(00)80213-5. PMID 9150132. S2CID 17882616.
- ^ a b Tymoczko JL, Berg T, Stryer L, Berg JM (2002). Biochemistry. San Francisco: W.H. Freeman. pp. 726–727. ISBN 978-0-7167-4955-4.
- ^ a b c d e f g Patton KT, Thibodeau GA (2010). Anatomy and Physiology (7 ed.). Mosby/Elsevier. ISBN 978-9996057762.
- ^ Mahley RW (July 2016). «Apolipoprotein E: from cardiovascular disease to neurodegenerative disorders». Journal of Molecular Medicine. 94 (7): 739–46. doi:10.1007/s00109-016-1427-y. PMC 4921111. PMID 27277824.
- ^ Weingärtner O, Pinsdorf T, Rogacev KS, Blömer L, Grenner Y, Gräber S, et al. (October 2010). Federici M (ed.). «The relationships of markers of cholesterol homeostasis with carotid intima-media thickness». PLOS ONE. 5 (10): e13467. Bibcode:2010PLoSO…513467W. doi:10.1371/journal.pone.0013467. PMC 2956704. PMID 20976107.
- ^ Lewis GF, Rader DJ (June 2005). «New insights into the regulation of HDL metabolism and reverse cholesterol transport». Circulation Research. 96 (12): 1221–1232. doi:10.1161/01.RES.0000170946.56981.5c. PMID 15976321.
- ^ Gordon DJ, Probstfield JL, Garrison RJ, Neaton JD, Castelli WP, Knoke JD, et al. (January 1989). «High-density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies». Circulation. 79 (1): 8–15. doi:10.1161/01.CIR.79.1.8. PMID 2642759.
- ^ Miller NE, Thelle DS, Forde OH, Mjos OD (May 1977). «The Tromsø heart-study. High-density lipoprotein and coronary heart-disease: a prospective case-control study». Lancet. 1 (8019): 965–968. doi:10.1016/s0140-6736(77)92274-7. PMID 67464. S2CID 140204202.
- ^ Kandutsch AA, Chen HW, Heiniger HJ (August 1978). «Biological activity of some oxygenated sterols». Science. 201 (4355): 498–501. Bibcode:1978Sci…201..498K. doi:10.1126/science.663671. PMID 663671.
- ^ Russell DW (December 2000). «Oxysterol biosynthetic enzymes». Biochimica et Biophysica Acta (BBA) — Molecular and Cell Biology of Lipids. 1529 (1–3): 126–35. doi:10.1016/S1388-1981(00)00142-6. PMID 11111082.
- ^ Hanukoglu I, Jefcoate CR (1980). «Pregnenolone separation from cholesterol using Sephadex LH-20 mini-columns». Journal of Chromatography A. 190 (1): 256–262. doi:10.1016/S0021-9673(00)85545-4.
- ^ Javitt NB (December 1994). «Bile acid synthesis from cholesterol: regulatory and auxiliary pathways». FASEB Journal. 8 (15): 1308–11. doi:10.1096/fasebj.8.15.8001744. PMID 8001744. S2CID 20302590.
- ^ Wolkoff AW, Cohen DE (February 2003). «Bile acid regulation of hepatic physiology: I. Hepatocyte transport of bile acids». American Journal of Physiology. Gastrointestinal and Liver Physiology. 284 (2): G175-9. doi:10.1152/ajpgi.00409.2002. PMID 12529265.
- ^
- ^ Wipperman MF, Sampson NS, Thomas ST (2014). «Pathogen roid rage: cholesterol utilization by Mycobacterium tuberculosis». Critical Reviews in Biochemistry and Molecular Biology. 49 (4): 269–93. doi:10.3109/10409238.2014.895700. PMC 4255906. PMID 24611808.
- ^ Thomas ST, Sampson NS (April 2013). «Mycobacterium tuberculosis utilizes a unique heterotetrameric structure for dehydrogenation of the cholesterol side chain». Biochemistry. 52 (17): 2895–904. doi:10.1021/bi4002979. PMC 3726044. PMID 23560677.
- ^ Wipperman MF, Yang M, Thomas ST, Sampson NS (October 2013). «Shrinking the FadE proteome of Mycobacterium tuberculosis: insights into cholesterol metabolism through identification of an α2β2 heterotetrameric acyl coenzyme A dehydrogenase family». Journal of Bacteriology. 195 (19): 4331–41. doi:10.1128/JB.00502-13. PMC 3807453. PMID 23836861.
- ^ Christie WW (2003). Lipid analysis: isolation, separation, identification, and structural analysis of lipids. Ayr, Scotland: Oily Press. ISBN 978-0-9531949-5-7.
- ^ a b «Cholesterol content in foods, rank order per 100 g; In: USDA Food Composition Databases». United States Department of Agriculture. 2019. Retrieved 4 March 2019.[dead link]
- ^ Jensen RG, Hagerty MM, McMahon KE (June 1978). «Lipids of human milk and infant formulas: a review». The American Journal of Clinical Nutrition. 31 (6): 990–1016. doi:10.1093/ajcn/31.6.990. PMID 352132.
- ^ Sonawane PD, Pollier J, Panda S, Szymanski J, Massalha H, Yona M, et al. (December 2016). «Plant cholesterol biosynthetic pathway overlaps with phytosterol metabolism». Nature Plants. 3 (1): 16205. doi:10.1038/nplants.2016.205. PMID 28005066. S2CID 5518449.
- ^ De Smet E, Mensink RP, Plat J (July 2012). «Effects of plant sterols and stanols on intestinal cholesterol metabolism: suggested mechanisms from past to present». Molecular Nutrition & Food Research. 56 (7): 1058–72. doi:10.1002/mnfr.201100722. PMID 22623436.
- ^ European Food Safety Authority, Journal (2010). «Scientific opinion on the substantiation of health claims related to plant sterols and plant stanols and maintenance of normal blood cholesterol concentrations».
- ^ Goldman TR (31 March 2016). «Health Policy Brief: Final 2015-20 Dietary Guidelines for Americans». Health Affairs. doi:10.1377/hpb20160331.683121. Retrieved 7 June 2021.
- ^ Soliman GA (June 2018). «Dietary Cholesterol and the Lack of Evidence in Cardiovascular Disease». Nutrients. 10 (6): 780. doi:10.3390/nu10060780. PMC 6024687. PMID 29914176.
- ^ Carson JA, Lichtenstein AH, Anderson CA, Appel LJ, Kris-Etherton PM, Meyer KA, et al. (January 2020). «Dietary Cholesterol and Cardiovascular Risk: A Science Advisory From the American Heart Association». Circulation. 141 (3): e39–e53. doi:10.1161/CIR.0000000000000743. PMID 31838890.
- ^ Sacks FM, Lichtenstein AH, Wu JH, Appel LJ, Creager MA, Kris-Etherton PM, et al. (July 2017). «Dietary Fats and Cardiovascular Disease: A Presidential Advisory From the American Heart Association». Circulation. 136 (3): e1–e23. doi:10.1161/CIR.0000000000000510. PMID 28620111. S2CID 367602.
- ^ Ras RT, Geleijnse JM, Trautwein EA (July 2014). «LDL-cholesterol-lowering effect of plant sterols and stanols across different dose ranges: a meta-analysis of randomised controlled studies». The British Journal of Nutrition. 112 (2): 214–219. doi:10.1017/S0007114514000750. PMC 4071994. PMID 24780090.
- ^ Weingärtner O, Böhm M, Laufs U (February 2009). «Controversial role of plant sterol esters in the management of hypercholesterolaemia». European Heart Journal. 30 (4): 404–409. doi:10.1093/eurheartj/ehn580. PMC 2642922. PMID 19158117.
- ^ Brunzell JD, Davidson M, Furberg CD, Goldberg RB, Howard BV, Stein JH, Witztum JL (April 2008). «Lipoprotein management in patients with cardiometabolic risk: consensus statement from the American Diabetes Association and the American College of Cardiology Foundation». Diabetes Care. 31 (4): 811–22. doi:10.2337/dc08-9018. PMID 18375431.
- ^ Department of Health (UK), NHS Choices, «More evidence for Mediterranean diet«. 8 March 2011. Access date: 11 Nov 2015
- ^ Durrington P (August 2003). «Dyslipidaemia». Lancet. 362 (9385): 717–31. doi:10.1016/S0140-6736(03)14234-1. PMID 12957096. S2CID 208792416.
- ^ a b Lewington S, Whitlock G, Clarke R, Sherliker P, Emberson J, Halsey J, et al. (December 2007). «Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths». Lancet. 370 (9602): 1829–39. doi:10.1016/S0140-6736(07)61778-4. PMID 18061058. S2CID 54293528.
- ^ «Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) Final Report» (PDF). National Institutes of Health. National Heart, Lung and Blood Institute. 1 September 2002. Retrieved 27 October 2008.
- ^ van der Steeg WA, Holme I, Boekholdt SM, Larsen ML, Lindahl C, Stroes ES, et al. (February 2008). «High-density lipoprotein cholesterol, high-density lipoprotein particle size, and apolipoprotein A-I: significance for cardiovascular risk: the IDEAL and EPIC-Norfolk studies». Journal of the American College of Cardiology. 51 (6): 634–42. doi:10.1016/j.jacc.2007.09.060. PMID 18261682.
- ^ Robinson JG, Wang S, Jacobson TA (November 2012). «Meta-analysis of comparison of effectiveness of lowering apolipoprotein B versus low-density lipoprotein cholesterol and nonhigh-density lipoprotein cholesterol for cardiovascular risk reduction in randomized trials». The American Journal of Cardiology. 110 (10): 1468–76. doi:10.1016/j.amjcard.2012.07.007. PMID 22906895.
- ^ Akioyamen LE, Genest J, Shan SD, Reel RL, Albaum JM, Chu A, Tu JV (September 2017). «Estimating the prevalence of heterozygous familial hypercholesterolaemia: a systematic review and meta-analysis». BMJ Open. 7 (9): e016461. doi:10.1136/bmjopen-2017-016461. PMC 5588988. PMID 28864697.
- ^ «Familial Hypercholesterolemia (FH)». www.heart.org. Retrieved 2 August 2019.
- ^ «How Can I Lower High Cholesterol» (PDF). American Heart Association. Archived from the original (PDF) on 21 December 2015. Retrieved 3 April 2011.
- ^ «Diseases and Conditions. High cholesterol: Olive oil, Foods with added plant sterols or stanols, Other changes to your diet». Mayo Clinic. 2012. Retrieved 11 November 2015.
- ^ National Institute for Health and Clinical Excellence. Clinical guideline 67: Lipid modification. London, 2008.
- ^ Mannu GS, Zaman MJ, Gupta A, Rehman HU, Myint PK (October 2012). «Update on guidelines for management of hypercholesterolemia». Expert Review of Cardiovascular Therapy. 10 (10): 1239–49. doi:10.1586/erc.12.94. PMID 23190064. S2CID 5451203.
- ^ Kizer JR, Madias C, Wilner B, Vaughan CJ, Mushlin AI, Trushin P, et al. (May 2010). «Relation of different measures of low-density lipoprotein cholesterol to risk of coronary artery disease and death in a meta-regression analysis of large-scale trials of statin therapy». The American Journal of Cardiology. 105 (9): 1289–96. doi:10.1016/j.amjcard.2009.12.051. PMC 2917836. PMID 20403481.
- ^ Grundy SM, Stone NJ, Bailey AL, Beam C, Birtcher KK, Blumenthal RS, et al. (June 2019). «2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines». Circulation. 139 (25): e1082–e1143. doi:10.1161/CIR.0000000000000625. PMC 7403606. PMID 30586774.
- ^ Nicholls SJ (August 2008). «Rosuvastatin and progression of atherosclerosis». Expert Review of Cardiovascular Therapy. 6 (7): 925–33. doi:10.1586/14779072.6.7.925. PMID 18666843. S2CID 46419583.
- ^ Heart Protection Study Collaborative Group (July 2002). «MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial». Lancet. 360 (9326): 7–22. doi:10.1016/S0140-6736(02)09327-3. PMID 12114036. S2CID 35836642.
- ^ Shepherd J, Cobbe SM, Ford I, Isles CG, Lorimer AR, MacFarlane PW, et al. (November 1995). «Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group». The New England Journal of Medicine. 333 (20): 1301–7. doi:10.1056/NEJM199511163332001. PMID 7566020.
- ^ Grundy SM (May 2007). «Should women be offered cholesterol lowering drugs to prevent cardiovascular disease? Yes». BMJ. 334 (7601): 982. doi:10.1136/bmj.39202.399942.AD. PMC 1867899. PMID 17494017.
- ^ Kendrick M (May 2007). «Should women be offered cholesterol lowering drugs to prevent cardiovascular disease? No». BMJ. 334 (7601): 983. doi:10.1136/bmj.39202.397488.AD. PMC 1867901. PMID 17494018.
- ^ Brugts JJ, Yetgin T, Hoeks SE, Gotto AM, Shepherd J, Westendorp RG, et al. (June 2009). «The benefits of statins in people without established cardiovascular disease but with cardiovascular risk factors: meta-analysis of randomised controlled trials». BMJ. 338: b2376. doi:10.1136/bmj.b2376. PMC 2714690. PMID 19567909.
- ^ «Report of the National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. The Expert Panel». Archives of Internal Medicine. 148 (1): 36–69. January 1988. doi:10.1001/archinte.148.1.36. PMID 3422148.
- ^ «Cholesterol». American Heart Association. 30 April 2017. Retrieved 22 March 2019.
- ^ Alenghat FJ, Davis AM (February 2019). «Management of Blood Cholesterol». JAMA. 321 (8): 800–801. doi:10.1001/jama.2019.0015. PMC 6679800. PMID 30715135.
- ^ «Getting Your Cholesterol Checked». Centers for Disease Control and Prevention.
- ^ «About cholesterol». American Heart Association. 15 April 2021.
- ^ Warnick GR, Knopp RH, Fitzpatrick V, Branson L (January 1990). «Estimating low-density lipoprotein cholesterol by the Friedewald equation is adequate for classifying patients on the basis of nationally recommended cutpoints». Clinical Chemistry. 36 (1): 15–9. doi:10.1093/clinchem/36.1.15. PMID 2297909.
- ^ Anderson KM, Castelli WP, Levy D (24 April 1987). «Cholesterol and mortality. 30 years of follow-up from the Framingham study». JAMA. 257 (16): 2176–80. doi:10.1001/jama.1987.03390160062027. PMID 3560398.
- ^ Ulmer H, Kelleher C, Diem G, Concin H (2004). «Why Eve is not Adam: prospective follow-up in 149650 women and men of cholesterol and other risk factors related to cardiovascular and all-cause mortality». Journal of Women’s Health. 13 (1): 41–53. doi:10.1089/154099904322836447. PMID 15006277.
- ^ Rizos CV, Elisaf MS, Liberopoulos EN (24 February 2011). «Effects of thyroid dysfunction on lipid profile». The Open Cardiovascular Medicine Journal. 5 (1): 76–84. doi:10.2174/1874192401105010076. PMC 3109527. PMID 21660244.
- ^ «How To Get Your Cholesterol Tested». American Heart Association. Retrieved 10 July 2013.
- ^ a b c d e «Cholesterol test». Mayo Clinic. 15 May 2021. Retrieved 16 March 2022.
- ^ Stone NJ, Robinson J, Goff DC (2013). «Getting a grasp of the Guidelines». American College of Cardiology. Archived from the original on 7 July 2014. Retrieved 2 April 2014.
- ^ a b c «Cholesterol levels». MedlinePlus, National Library of Medicine, US National Institutes of Health. 30 July 2020. Retrieved 16 March 2022.
- ^ Westover EJ, Covey DF, Brockman HL, Brown RE, Pike LJ (December 2003). «Cholesterol depletion results in site-specific increases in epidermal growth factor receptor phosphorylation due to membrane level effects. Studies with cholesterol enantiomers». The Journal of Biological Chemistry. 278 (51): 51125–33. doi:10.1074/jbc.M304332200. PMC 2593805. PMID 14530278.
- ^ Kristiana I, Luu W, Stevenson J, Cartland S, Jessup W, Belani JD, et al. (September 2012). «Cholesterol through the looking glass: ability of its enantiomer also to elicit homeostatic responses». The Journal of Biological Chemistry. 287 (40): 33897–904. doi:10.1074/jbc.M112.360537. PMC 3460484. PMID 22869373.
External links[edit]
Media related to Cholesterol at Wikimedia Commons

|
|

|
|

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Cholest-5-en-3β-ol |
|
| Preferred IUPAC name
(1R,3aS,3bS,7S,9aR,9bS,11aR)-9a,11a-Dimethyl-1-[(2R)-6-methylheptan-2-yl]-2,3,3a,3b,4,6,7,8,9,9a,9b,10,11,11a-tetradecahydro-1H-cyclopenta[a]phenanthren-7-ol |
|
| Other names
Cholesterin, Cholesteryl alcohol[1] |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.321 |
|
IUPHAR/BPS |
|
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C27H46O |
| Molar mass | 386.65 g/mol |
| Appearance | white crystalline powder[2] |
| Density | 1.052 g/cm3 |
| Melting point | 148 to 150 °C (298 to 302 °F; 421 to 423 K)[2] |
| Boiling point | 360 °C (680 °F; 633 K) (decomposes) |
|
Solubility in water |
0.095 mg/L (30 °C)[1] |
| Solubility | soluble in acetone, benzene, chloroform, ethanol, ether, hexane, isopropyl myristate, methanol |
|
Magnetic susceptibility (χ) |
-284.2·10−6 cm3/mol |
| Hazards | |
| Flash point | 209.3 ±12.4 °C |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Cholesterol is any of a class of certain organic molecules called lipids. It is a sterol (or modified steroid),[3] a type of lipid.[1] Cholesterol is biosynthesized by all animal cells and is an essential structural component of animal cell membranes. When chemically isolated, it is a yellowish crystalline solid.
Cholesterol also serves as a precursor for the biosynthesis of steroid hormones, bile acid[4] and vitamin D. Cholesterol is the principal sterol synthesized by all animals. In vertebrates, hepatic cells typically produce the greatest amounts. It is absent among prokaryotes (bacteria and archaea), although there are some exceptions, such as Mycoplasma, which require cholesterol for growth.[5]
François Poulletier de la Salle first identified cholesterol in solid form in gallstones in 1769. However, it was not until 1815 that chemist Michel Eugène Chevreul named the compound «cholesterine».[6][7]
Etymology[edit]
The word «cholesterol» comes from the Ancient Greek chole- (bile) and stereos (solid), followed by the chemical suffix -ol for an alcohol.
Physiology[edit]
Cholesterol is essential for all animal life, with each cell capable of synthesizing it by way of a complex 37-step process. This begins with the mevalonate or HMG-CoA reductase pathway, the target of statin drugs, which encompasses the first 18 steps. This is followed by 19 additional steps to convert the resulting lanosterol into cholesterol.
A human male weighing 68 kg (150 lb) normally synthesizes about 1 gram (1,000 mg) of cholesterol per day, and his body contains about 35 g, mostly contained within the cell membranes. Typical daily cholesterol dietary intake for a man in the United States is 307 mg.[8]
Most ingested cholesterol is esterified, which causes it to be poorly absorbed by the gut. The body also compensates for absorption of ingested cholesterol by reducing its own cholesterol synthesis.[9] For these reasons, cholesterol in food, seven to ten hours after ingestion, has little, if any effect on concentrations of cholesterol in the blood.[10] However, during the first seven hours after ingestion of cholesterol, as absorbed fats are being distributed around the body within extracellular water by the various lipoproteins (which transport all fats in the water outside cells), the concentrations increase.[11]
Plants make cholesterol in very small amounts.[12] In larger quantities they produce phytosterols, chemically similar substances which can compete with cholesterol for reabsorption in the intestinal tract, thus potentially reducing cholesterol reabsorption.[13] When intestinal lining cells absorb phytosterols, in place of cholesterol, they usually excrete the phytosterol molecules back into the GI tract, an important protective mechanism. The intake of naturally occurring phytosterols, which encompass plant sterols and stanols, ranges between ≈200–300 mg/day depending on eating habits.[14] Specially designed vegetarian experimental diets have been produced yielding upwards of 700 mg/day.[15]
Function[edit]
Membranes[edit]
Cholesterol composes about 30% of all animal cell membranes. It is required to build and maintain membranes and modulates membrane fluidity over the range of physiological temperatures. The hydroxyl group of each cholesterol molecule interacts with water molecules surrounding the membrane, as do the polar heads of the membrane phospholipids and sphingolipids, while the bulky steroid and the hydrocarbon chain are embedded in the membrane, alongside the nonpolar fatty-acid chain of the other lipids. Through the interaction with the phospholipid fatty-acid chains, cholesterol increases membrane packing, which both alters membrane fluidity[16] and maintains membrane integrity so that animal cells do not need to build cell walls (like plants and most bacteria). The membrane remains stable and durable without being rigid, allowing animal cells to change shape and animals to move.
The structure of the tetracyclic ring of cholesterol contributes to the fluidity of the cell membrane, as the molecule is in a trans conformation making all but the side chain of cholesterol rigid and planar.[17] In this structural role, cholesterol also reduces the permeability of the plasma membrane to neutral solutes,[18] hydrogen ions, and sodium ions.[19]
Substrate presentation[edit]
Cholesterol regulates the biological process of substrate presentation and the enzymes that use substrate presentation as a mechanism of their activation. (PLD2) is a well-defined example of an enzyme activated by substrate presentation.[20] The enzyme is palmitoylated causing the enzyme to traffic to cholesterol dependent lipid domains sometimes called «lipid rafts». The substrate of phospholipase D is phosphatidylcholine (PC) which is unsaturated and is of low abundance in lipid rafts. PC localizes to the disordered region of the cell along with the polyunsaturated lipid phosphatidylinositol 4,5-bisphosphate (PIP2). PLD2 has a PIP2 binding domain. When PIP2 concentration in the membrane increases, PLD2 leaves the cholesterol-dependent domains and binds to PIP2 where it then gains access to its substrate PC and commences catalysis based on substrate presentation.
Substrate presentation; PLD (blue oval) is sequestered into cholesterol-dependent lipid domains (green lipids) by palmitoylation. PLD also binds PIP2(red hexagon) domains (grey shading) located in the disordered region of the cell with phosphatidylcholine (PC). When cholesterol decreases or PIP2 increases in the cell, PLD translocates to PIP2 where it is exposed to and hydrolizes PC to phosphatidic acid (red spherical lipid).
Signaling[edit]
Cholesterol is also implicated in cell signaling processes, assisting in the formation of lipid rafts in the plasma membrane, which brings receptor proteins in close proximity with high concentrations of second messenger molecules.[21] In multiple layers, cholesterol and phospholipids, both electrical insulators, can facilitate speed of transmission of electrical impulses along nerve tissue. For many neuron fibers, a myelin sheath, rich in cholesterol since it is derived from compacted layers of Schwann cell membrane, provides insulation for more efficient conduction of impulses.[22] Demyelination (loss of some of these Schwann cells) is believed to be part of the basis for multiple sclerosis.
Cholesterol binds to and affects the gating of a number of ion channels such as the nicotinic acetylcholine receptor, GABAA receptor, and the inward-rectifier potassium channel.[23] Cholesterol also activates the estrogen-related receptor alpha (ERRα), and may be the endogenous ligand for the receptor.[24][25] The constitutively active nature of the receptor may be explained by the fact that cholesterol is ubiquitous in the body.[25] Inhibition of ERRα signaling by reduction of cholesterol production has been identified as a key mediator of the effects of statins and bisphosphonates on bone, muscle, and macrophages.[24][25] On the basis of these findings, it has been suggested that the ERRα should be de-orphanized and classified as a receptor for cholesterol.[24][25]
Chemical precursor[edit]
Within cells, cholesterol is also a precursor molecule for several biochemical pathways. For example, it is the precursor molecule for the synthesis of vitamin D in the calcium metabolism and all steroid hormones, including the adrenal gland hormones cortisol and aldosterone, as well as the sex hormones progesterone, estrogens, and testosterone, and their derivatives.[4][26]
Epidermis[edit]
The stratum corneum is the outermost layer of the epidermis.[27][28] It is composed of terminally differentiated and enucleated corneocytes that reside within a lipid matrix, like «bricks and mortar.»[27][28] Together with ceramides and free fatty acids, cholesterol forms the lipid mortar, a water-impermeable barrier that prevents evaporative water loss. As a general rule of thumb, the epidermal lipid matrix is composed of an equimolar mixture of ceramides (~50% by weight), cholesterol (~ 25% by weight), and free fatty acids (~15% by weight), with smaller quantities of other lipids also being present.[27][28] Cholesterol sulfate reaches its highest concentration in the granular layer of the epidermis. Steroid sulfate sulfatase then decreases its concentration in the stratum corneum, the outermost layer of the epidermis.[29] The relative abundance of cholesterol sulfate in the epidermis varies across different body sites with the heel of the foot having the lowest concentration.[28]
Metabolism[edit]
Cholesterol is recycled in the body. The liver excretes cholesterol into biliary fluids, which are then stored in the gallbladder, which then excretes them in a non-esterified form (via bile) into the digestive tract. Typically, about 50% of the excreted cholesterol is reabsorbed by the small intestine back into the bloodstream.[30]
Biosynthesis and regulation[edit]
Biosynthesis[edit]
All animal cells (exceptions exist within the invertebrates) manufacture cholesterol, for both membrane structure and other uses, with relative production rates varying by cell type and organ function. About 80% of total daily cholesterol production occurs in the liver and the intestines;[31] other sites of higher synthesis rates include the brain, the adrenal glands, and the reproductive organs.
Synthesis within the body starts with the mevalonate pathway where two molecules of acetyl CoA condense to form acetoacetyl-CoA. This is followed by a second condensation between acetyl CoA and acetoacetyl-CoA to form 3-hydroxy-3-methylglutaryl CoA (HMG-CoA).[32]
This molecule is then reduced to mevalonate by the enzyme HMG-CoA reductase. Production of mevalonate is the rate-limiting and irreversible step in cholesterol synthesis and is the site of action for statins (a class of cholesterol-lowering drugs).
Mevalonate is finally converted to isopentenyl pyrophosphate (IPP) through two phosphorylation steps and one decarboxylation step that requires ATP.
Three molecules of isopentenyl pyrophosphate condense to form farnesyl pyrophosphate through the action of geranyl transferase.
Two molecules of farnesyl pyrophosphate then condense to form squalene by the action of squalene synthase in the endoplasmic reticulum.[32]
Oxidosqualene cyclase then cyclizes squalene to form lanosterol.
Finally, lanosterol is converted to cholesterol via either of two pathways, the Bloch pathway, or the Kandutsch-Russell pathway.[33][34][35][36][37]
The final 19 steps to cholesterol contain NADPH and oxygen to help oxidize methyl groups for removal of carbons, mutases to move alkene groups, and NADH to help reduce ketones.
Konrad Bloch and Feodor Lynen shared the Nobel Prize in Physiology or Medicine in 1964 for their discoveries concerning some of the mechanisms and methods of regulation of cholesterol and fatty acid metabolism.[38]
Regulation of cholesterol synthesis[edit]
Biosynthesis of cholesterol is directly regulated by the cholesterol levels present, though the homeostatic mechanisms involved are only partly understood. A higher intake of food leads to a net decrease in endogenous production, whereas a lower intake of food has the opposite effect. The main regulatory mechanism is the sensing of intracellular cholesterol in the endoplasmic reticulum by the protein SREBP (sterol regulatory element-binding protein 1 and 2).[39] In the presence of cholesterol, SREBP is bound to two other proteins: SCAP (SREBP cleavage-activating protein) and INSIG-1. When cholesterol levels fall, INSIG-1 dissociates from the SREBP-SCAP complex, which allows the complex to migrate to the Golgi apparatus. Here SREBP is cleaved by S1P and S2P (site-1 protease and site-2 protease), two enzymes that are activated by SCAP when cholesterol levels are low.
The cleaved SREBP then migrates to the nucleus and acts as a transcription factor to bind to the sterol regulatory element (SRE), which stimulates the transcription of many genes. Among these are the low-density lipoprotein (LDL) receptor and HMG-CoA reductase. The LDL receptor scavenges circulating LDL from the bloodstream, whereas HMG-CoA reductase leads to an increase in endogenous production of cholesterol.[40] A large part of this signaling pathway was clarified by Dr. Michael S. Brown and Dr. Joseph L. Goldstein in the 1970s. In 1985, they received the Nobel Prize in Physiology or Medicine for their work. Their subsequent work shows how the SREBP pathway regulates the expression of many genes that control lipid formation and metabolism and body fuel allocation.
Cholesterol synthesis can also be turned off when cholesterol levels are high. HMG-CoA reductase contains both a cytosolic domain (responsible for its catalytic function) and a membrane domain. The membrane domain senses signals for its degradation. Increasing concentrations of cholesterol (and other sterols) cause a change in this domain’s oligomerization state, which makes it more susceptible to destruction by the proteasome. This enzyme’s activity can also be reduced by phosphorylation by an AMP-activated protein kinase. Because this kinase is activated by AMP, which is produced when ATP is hydrolyzed, it follows that cholesterol synthesis is halted when ATP levels are low.[41]
Plasma transport and regulation of absorption[edit]
Lipid logistics: transport of triglycerides and cholesterol in organisms in form of lipoproteins as chylomicrons, VLDL, LDL, IDL, HDL.
As an isolated molecule, cholesterol is only minimally soluble in water, or hydrophilic. Because of this, it dissolves in blood at exceedingly small concentrations. To be transported effectively, cholesterol is instead packaged within lipoproteins, complex discoidal particles with exterior amphiphilic proteins and lipids, whose outward-facing surfaces are water-soluble and inward-facing surfaces are lipid-soluble. This allows it to travel through the blood via emulsification. Unbound cholesterol, being amphipathic, is transported in the monolayer surface of the lipoprotein particle along with phospholipids and proteins. Cholesterol esters bound to fatty acid, on the other hand, are transported within the fatty hydrophobic core of the lipoprotein, along with triglyceride.[42]
There are several types of lipoproteins in the blood. In order of increasing density, they are chylomicrons, very-low-density lipoprotein (VLDL), intermediate-density lipoprotein (IDL), low-density lipoprotein (LDL), and high-density lipoprotein (HDL). Lower protein/lipid ratios make for less dense lipoproteins. Cholesterol within different lipoproteins is identical, although some is carried as its native «free» alcohol form (the cholesterol-OH group facing the water surrounding the particles), while others as fatty acyl esters, known also as cholesterol esters, within the particles.[42]
Lipoprotein particles are organized by complex apolipoproteins, typically 80–100 different proteins per particle, which can be recognized and bound by specific receptors on cell membranes, directing their lipid payload into specific cells and tissues currently ingesting these fat transport particles. These surface receptors serve as unique molecular signatures, which then help determine fat distribution delivery throughout the body.[42]
Chylomicrons, the least dense cholesterol transport molecules, contain apolipoprotein B-48, apolipoprotein C, and apolipoprotein E (the principal cholesterol carrier in the brain[43]) in their shells. Chylomicrons carry fats from the intestine to muscle and other tissues in need of fatty acids for energy or fat production. Unused cholesterol remains in more cholesterol-rich chylomicron remnants, and taken up from here to the bloodstream by the liver.[42]
VLDL molecules are produced by the liver from triacylglycerol and cholesterol which was not used in the synthesis of bile acids. These molecules contain apolipoprotein B100 and apolipoprotein E in their shells, and can be degraded by lipoprotein lipase on the artery wall to IDL. This arterial wall cleavage allows absorption of triacylglycerol and increases the concentration of circulating cholesterol. IDL molecules are then consumed in two processes: half is metabolized by HTGL and taken up by the LDL receptor on the liver cell surfaces, while the other half continues to lose triacylglycerols in the bloodstream until they become cholesterol-laden LDL particles.[42]
LDL particles are the major blood cholesterol carriers. Each one contains approximately 1,500 molecules of cholesterol ester. LDL molecule shells contain just one molecule of apolipoprotein B100, recognized by LDL receptors in peripheral tissues. Upon binding of apolipoprotein B100, many LDL receptors concentrate in clathrin-coated pits. Both LDL and its receptor form vesicles within a cell via endocytosis. These vesicles then fuse with a lysosome, where the lysosomal acid lipase enzyme hydrolyzes the cholesterol esters. The cholesterol can then be used for membrane biosynthesis or esterified and stored within the cell, so as to not interfere with the cell membranes.[42]
LDL receptors are used up during cholesterol absorption, and its synthesis is regulated by SREBP, the same protein that controls the synthesis of cholesterol de novo, according to its presence inside the cell. A cell with abundant cholesterol will have its LDL receptor synthesis blocked, to prevent new cholesterol in LDL molecules from being taken up. Conversely, LDL receptor synthesis proceeds when a cell is deficient in cholesterol.[42]
When this process becomes unregulated, LDL molecules without receptors begin to appear in the blood. These LDL molecules are oxidized and taken up by macrophages, which become engorged and form foam cells. These foam cells often become trapped in the walls of blood vessels and contribute to atherosclerotic plaque formation. Differences in cholesterol homeostasis affect the development of early atherosclerosis (carotid intima-media thickness).[44] These plaques are the main causes of heart attacks, strokes, and other serious medical problems, leading to the association of so-called LDL cholesterol (actually a lipoprotein) with «bad» cholesterol.[41]
HDL particles are thought to transport cholesterol back to the liver, either for excretion or for other tissues that synthesize hormones, in a process known as reverse cholesterol transport (RCT).[45] Large numbers of HDL particles correlates with better health outcomes,[46] whereas low numbers of HDL particles is associated with atheromatous disease progression in the arteries.[47]
Metabolism, recycling and excretion[edit]
Cholesterol is susceptible to oxidation and easily forms oxygenated derivatives called oxysterols. Three different mechanisms can form these: autoxidation, secondary oxidation to lipid peroxidation, and cholesterol-metabolizing enzyme oxidation. A great interest in oxysterols arose when they were shown to exert inhibitory actions on cholesterol biosynthesis.[48] This finding became known as the «oxysterol hypothesis». Additional roles for oxysterols in human physiology include their participation in bile acid biosynthesis, function as transport forms of cholesterol, and regulation of gene transcription.[49]
In biochemical experiments radiolabelled forms of cholesterol, such as tritiated-cholesterol are used. These derivatives undergo degradation upon storage and it is essential to purify cholesterol prior to use. Cholesterol can be purified using small Sephadex LH-20 columns.[50]
Cholesterol is oxidized by the liver into a variety of bile acids.[51] These, in turn, are conjugated with glycine, taurine, glucuronic acid, or sulfate. A mixture of conjugated and nonconjugated bile acids, along with cholesterol itself, is excreted from the liver into the bile. Approximately 95% of the bile acids are reabsorbed from the intestines, and the remainder are lost in the feces.[52] The excretion and reabsorption of bile acids forms the basis of the enterohepatic circulation, which is essential for the digestion and absorption of dietary fats. Under certain circumstances, when more concentrated, as in the gallbladder, cholesterol crystallises and is the major constituent of most gallstones (lecithin and bilirubin gallstones also occur, but less frequently).[53] Every day, up to 1 g of cholesterol enters the colon. This cholesterol originates from the diet, bile, and desquamated intestinal cells, and can be metabolized by the colonic bacteria. Cholesterol is converted mainly into coprostanol, a nonabsorbable sterol that is excreted in the feces.[citation needed]
Although cholesterol is a steroid generally associated with mammals, the human pathogen Mycobacterium tuberculosis is able to completely degrade this molecule and contains a large number of genes that are regulated by its presence.[54] Many of these cholesterol-regulated genes are homologues of fatty acid β-oxidation genes, but have evolved in such a way as to bind large steroid substrates like cholesterol.[55][56]
Dietary sources[edit]
Animal fats are complex mixtures of triglycerides, with lesser amounts of both the phospholipids and cholesterol molecules from which all animal (and human) cell membranes are constructed. Since all animal cells manufacture cholesterol, all animal-based foods contain cholesterol in varying amounts.[57] Major dietary sources of cholesterol include red meat, egg yolks and whole eggs, liver, kidney, giblets, fish oil, and butter.[58] Human breast milk also contains significant quantities of cholesterol.[59]
Plant cells synthesize cholesterol as a precursor for other compounds, such as phytosterols and steroidal glycoalkaloids, with cholesterol remaining in plant foods only in minor amounts or absent.[58][60] Some plant foods, such as avocado, flax seeds and peanuts, contain phytosterols, which compete with cholesterol for absorption in the intestines, and reduce the absorption of both dietary and bile cholesterol.[61] A typical diet contributes on the order of 0.2 gram of phytosterols, which is not enough to have a significant impact on blocking cholesterol absorption. Phytosterols intake can be supplemented through the use of phytosterol-containing functional foods or dietary supplements that are recognized as having potential to reduce levels of LDL-cholesterol.[62]
Medical guidelines and recommendations[edit]
In 2015, the United States Department of Agriculture Dietary Guidelines Advisory Committee (DGAC) recommended that Americans eat as little dietary cholesterol as possible, because most foods that are rich in cholesterol are also high in saturated fat and thereby may increase the risk of cardiovascular disease.[63][64]
A 2013 report by the American Heart Association and the American College of Cardiology recommended focusing on healthy dietary patterns rather than specific cholesterol limits, as they are hard for clinicians and consumers to implement. They recommend the DASH and Mediterranean diet, which are low in cholesterol.[65] A 2017 review by the American Heart Association recommends switching saturated fats for polyunsaturated fats to reduce cardiovascular disease risk.[66]
Some supplemental guidelines have recommended doses of phytosterols in the 1.6–3.0 grams per day range (Health Canada, EFSA, ATP III, FDA). A recent meta-analysis demonstrating a 12% reduction in LDL-cholesterol at a mean dose of 2.1 grams per day.[67] However, the benefits of a diet supplemented with phytosterols have also been questioned.[68]
Clinical significance[edit]
Hypercholesterolemia[edit]
Cholesterolemia and mortality for men and women <50 years and >60 years
According to the lipid hypothesis, elevated levels of cholesterol in the blood lead to atherosclerosis which may increase the risk of heart attack, stroke, and peripheral artery disease. Since higher blood LDL – especially higher LDL concentrations and smaller LDL particle size – contributes to this process more than the cholesterol content of the HDL particles,[69] LDL particles are often termed «bad cholesterol». High concentrations of functional HDL, which can remove cholesterol from cells and atheromas, offer protection and are commonly referred to as «good cholesterol». These balances are mostly genetically determined, but can be changed by body composition, medications, diet,[70] and other factors.[71] A 2007 study demonstrated that blood total cholesterol levels have an exponential effect on cardiovascular and total mortality, with the association more pronounced in younger subjects. Because cardiovascular disease is relatively rare in the younger population, the impact of high cholesterol on health is larger in older people.[72]
Elevated levels of the lipoprotein fractions, LDL, IDL and VLDL, rather than the total cholesterol level, correlate with the extent and progress of atherosclerosis.[73] Conversely, the total cholesterol can be within normal limits, yet be made up primarily of small LDL and small HDL particles, under which conditions atheroma growth rates are high. A post hoc analysis of the IDEAL and the EPIC prospective studies found an association between high levels of HDL cholesterol (adjusted for apolipoprotein A-I and apolipoprotein B) and increased risk of cardiovascular disease, casting doubt on the cardioprotective role of «good cholesterol».[74][75]
About one in 250 individuals can have a genetic mutation for the LDL cholesterol receptor that causes them to have familial hypercholesterolemia.[76] Inherited high cholesterol can also include genetic mutations in the PCSK9 gene and the gene for apolipoprotein B.[77]
Elevated cholesterol levels are treated with a strict diet consisting of low saturated fat, trans fat-free, low cholesterol foods,[78][79] often followed by one of various hypolipidemic agents, such as statins, fibrates, cholesterol absorption inhibitors, monoclonal antibody therapy (PCSK9 inhibitors), nicotinic acid derivatives or bile acid sequestrants.[80] There are several international guidelines on the treatment of hypercholesterolaemia.[81]
Human trials using HMG-CoA reductase inhibitors, known as statins, have repeatedly confirmed that changing lipoprotein transport patterns from unhealthy to healthier patterns significantly lowers cardiovascular disease event rates, even for people with cholesterol values currently considered low for adults.[82] Studies have shown that reducing LDL cholesterol levels by about 38.7 mg/dL with the use of statins can reduce cardiovascular disease and stroke risk by about 21%.[83] Studies have also found that statins reduce atheroma progression.[84] As a result, people with a history of cardiovascular disease may derive benefit from statins irrespective of their cholesterol levels (total cholesterol below 5.0 mmol/L [193 mg/dL]),[85] and in men without cardiovascular disease, there is benefit from lowering abnormally high cholesterol levels («primary prevention»).[86] Primary prevention in women was originally practiced only by extension of the findings in studies on men,[87] since, in women, none of the large statin trials conducted prior to 2007 demonstrated a significant reduction in overall mortality or in cardiovascular endpoints.[88] Meta-analyses have demonstrated significant reductions in all-cause and cardiovascular mortality, without significant heterogeneity by sex.[89]
| Level | Interpretation | |
|---|---|---|
| mg/dL | mmol/L | |
| < 200 | < 5.2 | Desirable level (lower risk) |
| 200–240 | 5.2–6.2 | Borderline high risk |
| > 240 | > 6.2 | High risk |
The 1987 report of National Cholesterol Education Program, Adult Treatment Panels suggests the total blood cholesterol level should be: < 200 mg/dL normal blood cholesterol, 200–239 mg/dL borderline-high, > 240 mg/dL high cholesterol.[90] The American Heart Association provides a similar set of guidelines for total (fasting) blood cholesterol levels and risk for heart disease:[91] Statins are effective in lowering LDL cholesterol and widely used for primary prevention in people at high risk of cardiovascular disease, as well as in secondary prevention for those who have developed cardiovascular disease.[92]
More current testing methods determine LDL («bad») and HDL («good») cholesterol separately, allowing cholesterol analysis to be more nuanced. The desirable LDL level is considered to be less than 100 mg/dL (2.6 mmol/L),[93][94] although a newer upper limit of 70 mg/dL (1.8 mmol/L) can be considered in higher-risk individuals based on some of the above-mentioned trials. A ratio of total cholesterol to HDL—another useful measure—of far less than 5:1 is thought to be healthier.
Reference ranges for blood tests, showing usual, as well as optimal, levels of HDL, LDL, and total cholesterol in mass and molar concentrations, is found in orange color at right, that is, among the blood constituents with the highest concentration.
Total cholesterol is defined as the sum of HDL, LDL, and VLDL. Usually, only the total, HDL, and triglycerides are measured. For cost reasons, the VLDL is usually estimated as one-fifth of the triglycerides and the LDL is estimated using the Friedewald formula (or a variant): estimated LDL = [total cholesterol] − [total HDL] − [estimated VLDL]. Direct LDL measures are used when triglycerides exceed 400 mg/dL. The estimated VLDL and LDL have more error when triglycerides are above 400 mg/dL.[95]
In the Framingham Heart Study, each 10 mg/dL (0.6 mmol/L) increase in total cholesterol levels increased 30-year overall mortality by 5% and CVD mortality by 9%. While subjects over the age of 50 had an 11% increase in overall mortality, and a 14% increase in cardiovascular disease mortality per 1 mg/dL (0.06 mmol/L) year drop in total cholesterol levels. The researchers attributed this phenomenon to reverse causation, whereby the disease itself increases risk of death, as well as changes a myriad of factors, such as weight loss and the inability to eat, which lower serum cholesterol.[96] This effect was also shown in men of all ages and women over 50 in the Vorarlberg Health Monitoring and Promotion Programme. These groups were more likely to die of cancer, liver diseases, and mental diseases with very low total cholesterol, of 186 mg/dL (10.3 mmol/L) and lower. This result indicates the low-cholesterol effect occurs even among younger respondents, contradicting the previous assessment among cohorts of older people that this is a marker for frailty occurring with age.[97]
Hypocholesterolemia[edit]
Abnormally low levels of cholesterol are termed hypocholesterolemia. Research into the causes of this state is relatively limited, but some studies suggest a link with depression, cancer, and cerebral hemorrhage. In general, the low cholesterol levels seem to be a consequence, rather than a cause, of an underlying illness.[72] A genetic defect in cholesterol synthesis causes Smith–Lemli–Opitz syndrome, which is often associated with low plasma cholesterol levels. Hyperthyroidism, or any other endocrine disturbance which causes upregulation of the LDL receptor, may result in hypocholesterolemia.[98]
Cholesterol testing[edit]
The American Heart Association recommends testing cholesterol every 4–6 years for people aged 20 years or older.[99] A separate set of American Heart Association guidelines issued in 2013 indicates that people taking statin medications should have their cholesterol tested 4–12 weeks after their first dose and then every 3–12 months thereafter.[100][101] For men ages 45 to 65 and women ages 55 to 65, a cholesterol test should occur every 1-2 years, and for seniors over age 65, an annual test should be performed.[100]
A blood sample after 12-hours of fasting is taken by a healthcare professional from an arm vein to measure a lipid profile for a) total cholesterol, b) HDL cholesterol, c) LDL cholesterol, and d) triglycerides.[100][102] Results may be expressed as «calculated», indicating a calculation of total cholesterol, HDL, and triglycerides.[102]
Cholesterol is tested to determine for «normal» or «desirable» levels if a person has a total cholesterol of 5.2 mmol/L or less (200 mg/dL), an HDL value of more than 1 mmol/L (40 mg/dL, «the higher, the better»), an LDL value of less than 2.6 mmol/L (100 mg/dL), and a triglycerides level of less than 1.7 mmol/L (150 mg/dL).[100][102] Blood cholesterol in people with lifestyle, aging, or cardiovascular risk factors, such as diabetes mellitus, hypertension, family history of coronary artery disease, or angina, are evaluated at different levels.[100]
Interactive pathway map[edit]
Click on genes, proteins and metabolites below to link to respective articles. [§ 1]
[[File:
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
|alt=Statin Pathway edit]]
- ^ The interactive pathway map can be edited at WikiPathways: «Statin_Pathway_WP430».
Cholesteric liquid crystals[edit]
Some cholesterol derivatives (among other simple cholesteric lipids) are known to generate the liquid crystalline «cholesteric phase». The cholesteric phase is, in fact, a chiral nematic phase, and it changes colour when its temperature changes. This makes cholesterol derivatives useful for indicating temperature in liquid-crystal display thermometers and in temperature-sensitive paints.[citation needed]
Stereoisomers[edit]
Natural cholesterol (top) and ent-cholesterol (bottom)
Cholesterol has 256 stereoisomers that arise from its eight stereocenters, although only two of the stereoisomers are of biochemical significance (nat-cholesterol and ent-cholesterol, for natural and enantiomer, respectively),[103][104] and only one occurs naturally (nat-cholesterol).
Additional images[edit]
-
Cholesterol units conversion
See also[edit]
- Arcus senilis «Cholesterol ring» in the eyes
- Cardiovascular disease
- Cholesterol embolism
- Cholesterol total synthesis
- Familial hypercholesterolemia
- Hypercholesterolemia «High Cholesterol»
- Hypocholesterolemia «Low Cholesterol»
- Janus-faced molecule
- List of cholesterol in foods
- Niemann–Pick disease Type C
- Oxycholesterol
- Remnant cholesterol
References[edit]
- ^ a b c «Cholesterol, 57-88-5». PubChem, National Library of Medicine, US National Institutes of Health. 9 November 2019. Retrieved 14 November 2019.
- ^ a b «Safety (MSDS) data for cholesterol». Archived from the original on 12 July 2007. Retrieved 20 October 2007.
- ^ Cholesterol at the US National Library of Medicine Medical Subject Headings (MeSH)
- ^ a b Hanukoglu I (December 1992). «Steroidogenic enzymes: structure, function, and role in regulation of steroid hormone biosynthesis». The Journal of Steroid Biochemistry and Molecular Biology. 43 (8): 779–804. doi:10.1016/0960-0760(92)90307-5. PMID 22217824. S2CID 112729.
- ^ Razin S, Tully JG (May 1970). «Cholesterol requirement of mycoplasmas». Journal of Bacteriology. 102 (2): 306–10. doi:10.1128/JB.102.2.306-310.1970. PMC 247552. PMID 4911537.
- ^ Chevreul (1816) «Recherches chimiques sur les corps gras, et particulièrement sur leurs combinaisons avec les alcalis. Sixième mémoire. Examen des graisses d’homme, de mouton, de boeuf, de jaguar et d’oie» (Chemical researches on fatty substances, and particularly on their combinations o filippos ine kapios with alkalis. Sixth memoir. Study of human, sheep, beef, jaguar and goose fat), Annales de Chimie et de Physique, 2 : 339–372. From page 346 : «Je nommerai cholesterine, de χολη, bile, et στερεος, solide, la substance cristallisée des calculs biliares humains, … » (I will name cholesterine – from χολη (bile) and στερεος (solid) – the crystalized substance from human gallstones … )
- ^ Olson RE (February 1998). «Discovery of the lipoproteins, their role in fat transport and their significance as risk factors». The Journal of Nutrition. 128 (2 Suppl): 439S–443S. doi:10.1093/jn/128.2.439S. PMID 9478044.
- ^ «National Health and Nutrition Examination Survey» (PDF). United States Center for Disease Control. Retrieved 28 January 2012.
- ^
Lecerf JM, de Lorgeril M (July 2011). «Dietary cholesterol: from physiology to cardiovascular risk». The British Journal of Nutrition. 106 (1): 6–14. doi:10.1017/S0007114511000237. PMID 21385506. - ^ Soliman GA (June 2018). «Dietary Cholesterol and the Lack of Evidence in Cardiovascular Disease». Nutrients. 10 (6): 780. doi:10.3390/nu10060780. PMC 6024687. PMID 29914176.
- ^ Dubois C, Armand M, Mekki N, Portugal H, Pauli AM, Bernard PM, et al. (November 1994). «Effects of increasing amounts of dietary cholesterol on postprandial lipemia and lipoproteins in human subjects». Journal of Lipid Research. 35 (11): 1993–2007. doi:10.1016/S0022-2275(20)39946-6. PMID 7868978.
- ^ Behrman EJ, Gopalan V (2005). Scovell WM (ed.). «Cholesterol and Plants». Journal of Chemical Education. 82 (12): 1791. Bibcode:2005JChEd..82.1791B. doi:10.1021/ed082p1791.
- ^ John S, Sorokin AV, Thompson PD (February 2007). «Phytosterols and vascular disease». Current Opinion in Lipidology. 18 (1): 35–40. doi:10.1097/MOL.0b013e328011e9e3. PMID 17218830. S2CID 29213889.
- ^ Jesch ED, Carr TP (June 2017). «Food Ingredients That Inhibit Cholesterol Absorption». Preventive Nutrition and Food Science. 22 (2): 67–80. doi:10.3746/pnf.2017.22.2.67. PMC 5503415. PMID 28702423.
- ^ Agren JJ, Tvrzicka E, Nenonen MT, Helve T, Hänninen O (February 2001). «Divergent changes in serum sterols during a strict uncooked vegan diet in patients with rheumatoid arthritis». The British Journal of Nutrition. 85 (2): 137–9. doi:10.1079/BJN2000234. PMID 11242480.
- ^ Sadava D, Hillis DM, Heller HC, Berenbaum MR (2011). Life: The Science of Biology 9th Edition. San Francisco: Freeman. pp. 105–114. ISBN 978-1-4292-4646-0.
- ^ Ohvo-Rekilä H, Ramstedt B, Leppimäki P, Slotte JP (January 2002). «Cholesterol interactions with phospholipids in membranes». Progress in Lipid Research. 41 (1): 66–97. doi:10.1016/S0163-7827(01)00020-0. PMID 11694269.
- ^ Yeagle PL (October 1991). «Modulation of membrane function by cholesterol». Biochimie. 73 (10): 1303–10. doi:10.1016/0300-9084(91)90093-G. PMID 1664240.
- ^ Haines TH (July 2001). «Do sterols reduce proton and sodium leaks through lipid bilayers?». Progress in Lipid Research. 40 (4): 299–324. doi:10.1016/S0163-7827(01)00009-1. PMID 11412894.
- ^ Petersen EN, Chung HW, Nayebosadri A, Hansen SB (December 2016). «Kinetic disruption of lipid rafts is a mechanosensor for phospholipase D». Nature Communications. 7: 13873. Bibcode:2016NatCo…713873P. doi:10.1038/ncomms13873. PMC 5171650. PMID 27976674.
- ^ Incardona JP, Eaton S (April 2000). «Cholesterol in signal transduction». Current Opinion in Cell Biology. 12 (2): 193–203. doi:10.1016/S0955-0674(99)00076-9. PMID 10712926.
- ^ Pawlina W, Ross MW (2006). Histology: a text and atlas: with correlated cell and molecular biology. Philadelphia: Lippincott Wiliams & Wilkins. p. 230. ISBN 978-0-7817-5056-1.
- ^ Levitan I, Singh DK, Rosenhouse-Dantsker A (2014). «Cholesterol binding to ion channels». Frontiers in Physiology. 5: 65. doi:10.3389/fphys.2014.00065. PMC 3935357. PMID 24616704.
- ^ a b c Wei W, Schwaid AG, Wang X, Wang X, Chen S, Chu Q, et al. (March 2016). «Ligand Activation of ERRα by Cholesterol Mediates Statin and Bisphosphonate Effects». Cell Metabolism. 23 (3): 479–91. doi:10.1016/j.cmet.2015.12.010. PMC 4785078. PMID 26777690.
- ^ a b c d Nuclear Receptors in Development and Disease. Elsevier Science. 17 May 2017. pp. 88–. ISBN 978-0-12-802196-5.
- ^ Payne AH, Hales DB (December 2004). «Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones». Endocrine Reviews. 25 (6): 947–70. doi:10.1210/er.2003-0030. PMID 15583024.
- ^ a b c Elias, Peter (2006). Skin barrier. New York: Taylor & Francis. ISBN 9780824758158.
- ^ a b c d Merleev, AA; Le, ST; Alexanian, C; Toussi, A; Xie, Y; Marusina, AI; Watkins, SM; Patel, F; Billi, AC; Wiedemann, J; Izumiya, Y; Kumar, A; Uppala, R; Kahlenberg, JM; Liu, FT; Adamopoulos, IE; Wang, EA; Ma, C; Cheng, MY; Xiong, H; Kirane, A; Luxardi, G; Andersen, B; Tsoi, LC; Lebrilla, CB; Gudjonsson, JE; Maverakis, E (22 August 2022). «Biogeographic and disease-specific alterations in epidermal lipid composition and single-cell analysis of acral keratinocytes». JCI Insight. 7 (16). doi:10.1172/jci.insight.159762. PMC 9462509. PMID 35900871.
- ^ Elias, PM; Williams, ML; Maloney, ME; Bonifas, JA; Brown, BE; Grayson, S; Epstein EH, Jr (October 1984). «Stratum corneum lipids in disorders of cornification. Steroid sulfatase and cholesterol sulfate in normal desquamation and the pathogenesis of recessive X-linked ichthyosis». The Journal of Clinical Investigation. 74 (4): 1414–21. doi:10.1172/JCI111552. PMC 425309. PMID 6592175.
- ^ Cohn JS, Kamili A, Wat E, Chung RW, Tandy S (February 2010). «Dietary phospholipids and intestinal cholesterol absorption». Nutrients. 2 (2): 116–27. doi:10.3390/nu2020116. PMC 3257636. PMID 22254012.
- ^ «How it’s made: Cholesterol production in your body». Harvard Health Publishing. Retrieved 18 October 2018.
- ^ a b «Biosynthesis and Regulation of Cholesterol (with Animation)». PharmaXChange.info. 17 September 2013.
- ^ «Cholesterol metabolism (includes both Bloch and Kandutsch-Russell pathways) (Mus musculus) – WikiPathways». www.wikipathways.org. Retrieved 2 February 2021.
- ^ Singh P, Saxena R, Srinivas G, Pande G, Chattopadhyay A (2013). «Cholesterol biosynthesis and homeostasis in regulation of the cell cycle». PLOS ONE. 8 (3): e58833. Bibcode:2013PLoSO…858833S. doi:10.1371/journal.pone.0058833. PMC 3598952. PMID 23554937.
- ^ «Kandutsch-Russell pathway». pubchem.ncbi.nlm.nih.gov. Retrieved 2 February 2021.
- ^ Berg J (2002). Biochemistry. New York: WH Freeman. ISBN 978-0-7167-3051-4.
- ^ Rhodes CM, Stryer L, Tasker R (1995). Biochemistry (4th ed.). San Francisco: W.H. Freeman. pp. 280, 703. ISBN 978-0-7167-2009-6.
- ^ «The Nobel Prize in Physiology or Medicine, 1964». Nobel Prize, Nobel Media.
- ^ Espenshade PJ, Hughes AL (2007). «Regulation of sterol synthesis in eukaryotes». Annual Review of Genetics. 41: 401–27. doi:10.1146/annurev.genet.41.110306.130315. PMID 17666007.
- ^ Brown MS, Goldstein JL (May 1997). «The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor». Cell. 89 (3): 331–40. doi:10.1016/S0092-8674(00)80213-5. PMID 9150132. S2CID 17882616.
- ^ a b Tymoczko JL, Berg T, Stryer L, Berg JM (2002). Biochemistry. San Francisco: W.H. Freeman. pp. 726–727. ISBN 978-0-7167-4955-4.
- ^ a b c d e f g Patton KT, Thibodeau GA (2010). Anatomy and Physiology (7 ed.). Mosby/Elsevier. ISBN 978-9996057762.
- ^ Mahley RW (July 2016). «Apolipoprotein E: from cardiovascular disease to neurodegenerative disorders». Journal of Molecular Medicine. 94 (7): 739–46. doi:10.1007/s00109-016-1427-y. PMC 4921111. PMID 27277824.
- ^ Weingärtner O, Pinsdorf T, Rogacev KS, Blömer L, Grenner Y, Gräber S, et al. (October 2010). Federici M (ed.). «The relationships of markers of cholesterol homeostasis with carotid intima-media thickness». PLOS ONE. 5 (10): e13467. Bibcode:2010PLoSO…513467W. doi:10.1371/journal.pone.0013467. PMC 2956704. PMID 20976107.
- ^ Lewis GF, Rader DJ (June 2005). «New insights into the regulation of HDL metabolism and reverse cholesterol transport». Circulation Research. 96 (12): 1221–1232. doi:10.1161/01.RES.0000170946.56981.5c. PMID 15976321.
- ^ Gordon DJ, Probstfield JL, Garrison RJ, Neaton JD, Castelli WP, Knoke JD, et al. (January 1989). «High-density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies». Circulation. 79 (1): 8–15. doi:10.1161/01.CIR.79.1.8. PMID 2642759.
- ^ Miller NE, Thelle DS, Forde OH, Mjos OD (May 1977). «The Tromsø heart-study. High-density lipoprotein and coronary heart-disease: a prospective case-control study». Lancet. 1 (8019): 965–968. doi:10.1016/s0140-6736(77)92274-7. PMID 67464. S2CID 140204202.
- ^ Kandutsch AA, Chen HW, Heiniger HJ (August 1978). «Biological activity of some oxygenated sterols». Science. 201 (4355): 498–501. Bibcode:1978Sci…201..498K. doi:10.1126/science.663671. PMID 663671.
- ^ Russell DW (December 2000). «Oxysterol biosynthetic enzymes». Biochimica et Biophysica Acta (BBA) — Molecular and Cell Biology of Lipids. 1529 (1–3): 126–35. doi:10.1016/S1388-1981(00)00142-6. PMID 11111082.
- ^ Hanukoglu I, Jefcoate CR (1980). «Pregnenolone separation from cholesterol using Sephadex LH-20 mini-columns». Journal of Chromatography A. 190 (1): 256–262. doi:10.1016/S0021-9673(00)85545-4.
- ^ Javitt NB (December 1994). «Bile acid synthesis from cholesterol: regulatory and auxiliary pathways». FASEB Journal. 8 (15): 1308–11. doi:10.1096/fasebj.8.15.8001744. PMID 8001744. S2CID 20302590.
- ^ Wolkoff AW, Cohen DE (February 2003). «Bile acid regulation of hepatic physiology: I. Hepatocyte transport of bile acids». American Journal of Physiology. Gastrointestinal and Liver Physiology. 284 (2): G175-9. doi:10.1152/ajpgi.00409.2002. PMID 12529265.
- ^
- ^ Wipperman MF, Sampson NS, Thomas ST (2014). «Pathogen roid rage: cholesterol utilization by Mycobacterium tuberculosis». Critical Reviews in Biochemistry and Molecular Biology. 49 (4): 269–93. doi:10.3109/10409238.2014.895700. PMC 4255906. PMID 24611808.
- ^ Thomas ST, Sampson NS (April 2013). «Mycobacterium tuberculosis utilizes a unique heterotetrameric structure for dehydrogenation of the cholesterol side chain». Biochemistry. 52 (17): 2895–904. doi:10.1021/bi4002979. PMC 3726044. PMID 23560677.
- ^ Wipperman MF, Yang M, Thomas ST, Sampson NS (October 2013). «Shrinking the FadE proteome of Mycobacterium tuberculosis: insights into cholesterol metabolism through identification of an α2β2 heterotetrameric acyl coenzyme A dehydrogenase family». Journal of Bacteriology. 195 (19): 4331–41. doi:10.1128/JB.00502-13. PMC 3807453. PMID 23836861.
- ^ Christie WW (2003). Lipid analysis: isolation, separation, identification, and structural analysis of lipids. Ayr, Scotland: Oily Press. ISBN 978-0-9531949-5-7.
- ^ a b «Cholesterol content in foods, rank order per 100 g; In: USDA Food Composition Databases». United States Department of Agriculture. 2019. Retrieved 4 March 2019.[dead link]
- ^ Jensen RG, Hagerty MM, McMahon KE (June 1978). «Lipids of human milk and infant formulas: a review». The American Journal of Clinical Nutrition. 31 (6): 990–1016. doi:10.1093/ajcn/31.6.990. PMID 352132.
- ^ Sonawane PD, Pollier J, Panda S, Szymanski J, Massalha H, Yona M, et al. (December 2016). «Plant cholesterol biosynthetic pathway overlaps with phytosterol metabolism». Nature Plants. 3 (1): 16205. doi:10.1038/nplants.2016.205. PMID 28005066. S2CID 5518449.
- ^ De Smet E, Mensink RP, Plat J (July 2012). «Effects of plant sterols and stanols on intestinal cholesterol metabolism: suggested mechanisms from past to present». Molecular Nutrition & Food Research. 56 (7): 1058–72. doi:10.1002/mnfr.201100722. PMID 22623436.
- ^ European Food Safety Authority, Journal (2010). «Scientific opinion on the substantiation of health claims related to plant sterols and plant stanols and maintenance of normal blood cholesterol concentrations».
- ^ Goldman TR (31 March 2016). «Health Policy Brief: Final 2015-20 Dietary Guidelines for Americans». Health Affairs. doi:10.1377/hpb20160331.683121. Retrieved 7 June 2021.
- ^ Soliman GA (June 2018). «Dietary Cholesterol and the Lack of Evidence in Cardiovascular Disease». Nutrients. 10 (6): 780. doi:10.3390/nu10060780. PMC 6024687. PMID 29914176.
- ^ Carson JA, Lichtenstein AH, Anderson CA, Appel LJ, Kris-Etherton PM, Meyer KA, et al. (January 2020). «Dietary Cholesterol and Cardiovascular Risk: A Science Advisory From the American Heart Association». Circulation. 141 (3): e39–e53. doi:10.1161/CIR.0000000000000743. PMID 31838890.
- ^ Sacks FM, Lichtenstein AH, Wu JH, Appel LJ, Creager MA, Kris-Etherton PM, et al. (July 2017). «Dietary Fats and Cardiovascular Disease: A Presidential Advisory From the American Heart Association». Circulation. 136 (3): e1–e23. doi:10.1161/CIR.0000000000000510. PMID 28620111. S2CID 367602.
- ^ Ras RT, Geleijnse JM, Trautwein EA (July 2014). «LDL-cholesterol-lowering effect of plant sterols and stanols across different dose ranges: a meta-analysis of randomised controlled studies». The British Journal of Nutrition. 112 (2): 214–219. doi:10.1017/S0007114514000750. PMC 4071994. PMID 24780090.
- ^ Weingärtner O, Böhm M, Laufs U (February 2009). «Controversial role of plant sterol esters in the management of hypercholesterolaemia». European Heart Journal. 30 (4): 404–409. doi:10.1093/eurheartj/ehn580. PMC 2642922. PMID 19158117.
- ^ Brunzell JD, Davidson M, Furberg CD, Goldberg RB, Howard BV, Stein JH, Witztum JL (April 2008). «Lipoprotein management in patients with cardiometabolic risk: consensus statement from the American Diabetes Association and the American College of Cardiology Foundation». Diabetes Care. 31 (4): 811–22. doi:10.2337/dc08-9018. PMID 18375431.
- ^ Department of Health (UK), NHS Choices, «More evidence for Mediterranean diet«. 8 March 2011. Access date: 11 Nov 2015
- ^ Durrington P (August 2003). «Dyslipidaemia». Lancet. 362 (9385): 717–31. doi:10.1016/S0140-6736(03)14234-1. PMID 12957096. S2CID 208792416.
- ^ a b Lewington S, Whitlock G, Clarke R, Sherliker P, Emberson J, Halsey J, et al. (December 2007). «Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths». Lancet. 370 (9602): 1829–39. doi:10.1016/S0140-6736(07)61778-4. PMID 18061058. S2CID 54293528.
- ^ «Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) Final Report» (PDF). National Institutes of Health. National Heart, Lung and Blood Institute. 1 September 2002. Retrieved 27 October 2008.
- ^ van der Steeg WA, Holme I, Boekholdt SM, Larsen ML, Lindahl C, Stroes ES, et al. (February 2008). «High-density lipoprotein cholesterol, high-density lipoprotein particle size, and apolipoprotein A-I: significance for cardiovascular risk: the IDEAL and EPIC-Norfolk studies». Journal of the American College of Cardiology. 51 (6): 634–42. doi:10.1016/j.jacc.2007.09.060. PMID 18261682.
- ^ Robinson JG, Wang S, Jacobson TA (November 2012). «Meta-analysis of comparison of effectiveness of lowering apolipoprotein B versus low-density lipoprotein cholesterol and nonhigh-density lipoprotein cholesterol for cardiovascular risk reduction in randomized trials». The American Journal of Cardiology. 110 (10): 1468–76. doi:10.1016/j.amjcard.2012.07.007. PMID 22906895.
- ^ Akioyamen LE, Genest J, Shan SD, Reel RL, Albaum JM, Chu A, Tu JV (September 2017). «Estimating the prevalence of heterozygous familial hypercholesterolaemia: a systematic review and meta-analysis». BMJ Open. 7 (9): e016461. doi:10.1136/bmjopen-2017-016461. PMC 5588988. PMID 28864697.
- ^ «Familial Hypercholesterolemia (FH)». www.heart.org. Retrieved 2 August 2019.
- ^ «How Can I Lower High Cholesterol» (PDF). American Heart Association. Archived from the original (PDF) on 21 December 2015. Retrieved 3 April 2011.
- ^ «Diseases and Conditions. High cholesterol: Olive oil, Foods with added plant sterols or stanols, Other changes to your diet». Mayo Clinic. 2012. Retrieved 11 November 2015.
- ^ National Institute for Health and Clinical Excellence. Clinical guideline 67: Lipid modification. London, 2008.
- ^ Mannu GS, Zaman MJ, Gupta A, Rehman HU, Myint PK (October 2012). «Update on guidelines for management of hypercholesterolemia». Expert Review of Cardiovascular Therapy. 10 (10): 1239–49. doi:10.1586/erc.12.94. PMID 23190064. S2CID 5451203.
- ^ Kizer JR, Madias C, Wilner B, Vaughan CJ, Mushlin AI, Trushin P, et al. (May 2010). «Relation of different measures of low-density lipoprotein cholesterol to risk of coronary artery disease and death in a meta-regression analysis of large-scale trials of statin therapy». The American Journal of Cardiology. 105 (9): 1289–96. doi:10.1016/j.amjcard.2009.12.051. PMC 2917836. PMID 20403481.
- ^ Grundy SM, Stone NJ, Bailey AL, Beam C, Birtcher KK, Blumenthal RS, et al. (June 2019). «2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines». Circulation. 139 (25): e1082–e1143. doi:10.1161/CIR.0000000000000625. PMC 7403606. PMID 30586774.
- ^ Nicholls SJ (August 2008). «Rosuvastatin and progression of atherosclerosis». Expert Review of Cardiovascular Therapy. 6 (7): 925–33. doi:10.1586/14779072.6.7.925. PMID 18666843. S2CID 46419583.
- ^ Heart Protection Study Collaborative Group (July 2002). «MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial». Lancet. 360 (9326): 7–22. doi:10.1016/S0140-6736(02)09327-3. PMID 12114036. S2CID 35836642.
- ^ Shepherd J, Cobbe SM, Ford I, Isles CG, Lorimer AR, MacFarlane PW, et al. (November 1995). «Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group». The New England Journal of Medicine. 333 (20): 1301–7. doi:10.1056/NEJM199511163332001. PMID 7566020.
- ^ Grundy SM (May 2007). «Should women be offered cholesterol lowering drugs to prevent cardiovascular disease? Yes». BMJ. 334 (7601): 982. doi:10.1136/bmj.39202.399942.AD. PMC 1867899. PMID 17494017.
- ^ Kendrick M (May 2007). «Should women be offered cholesterol lowering drugs to prevent cardiovascular disease? No». BMJ. 334 (7601): 983. doi:10.1136/bmj.39202.397488.AD. PMC 1867901. PMID 17494018.
- ^ Brugts JJ, Yetgin T, Hoeks SE, Gotto AM, Shepherd J, Westendorp RG, et al. (June 2009). «The benefits of statins in people without established cardiovascular disease but with cardiovascular risk factors: meta-analysis of randomised controlled trials». BMJ. 338: b2376. doi:10.1136/bmj.b2376. PMC 2714690. PMID 19567909.
- ^ «Report of the National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. The Expert Panel». Archives of Internal Medicine. 148 (1): 36–69. January 1988. doi:10.1001/archinte.148.1.36. PMID 3422148.
- ^ «Cholesterol». American Heart Association. 30 April 2017. Retrieved 22 March 2019.
- ^ Alenghat FJ, Davis AM (February 2019). «Management of Blood Cholesterol». JAMA. 321 (8): 800–801. doi:10.1001/jama.2019.0015. PMC 6679800. PMID 30715135.
- ^ «Getting Your Cholesterol Checked». Centers for Disease Control and Prevention.
- ^ «About cholesterol». American Heart Association. 15 April 2021.
- ^ Warnick GR, Knopp RH, Fitzpatrick V, Branson L (January 1990). «Estimating low-density lipoprotein cholesterol by the Friedewald equation is adequate for classifying patients on the basis of nationally recommended cutpoints». Clinical Chemistry. 36 (1): 15–9. doi:10.1093/clinchem/36.1.15. PMID 2297909.
- ^ Anderson KM, Castelli WP, Levy D (24 April 1987). «Cholesterol and mortality. 30 years of follow-up from the Framingham study». JAMA. 257 (16): 2176–80. doi:10.1001/jama.1987.03390160062027. PMID 3560398.
- ^ Ulmer H, Kelleher C, Diem G, Concin H (2004). «Why Eve is not Adam: prospective follow-up in 149650 women and men of cholesterol and other risk factors related to cardiovascular and all-cause mortality». Journal of Women’s Health. 13 (1): 41–53. doi:10.1089/154099904322836447. PMID 15006277.
- ^ Rizos CV, Elisaf MS, Liberopoulos EN (24 February 2011). «Effects of thyroid dysfunction on lipid profile». The Open Cardiovascular Medicine Journal. 5 (1): 76–84. doi:10.2174/1874192401105010076. PMC 3109527. PMID 21660244.
- ^ «How To Get Your Cholesterol Tested». American Heart Association. Retrieved 10 July 2013.
- ^ a b c d e «Cholesterol test». Mayo Clinic. 15 May 2021. Retrieved 16 March 2022.
- ^ Stone NJ, Robinson J, Goff DC (2013). «Getting a grasp of the Guidelines». American College of Cardiology. Archived from the original on 7 July 2014. Retrieved 2 April 2014.
- ^ a b c «Cholesterol levels». MedlinePlus, National Library of Medicine, US National Institutes of Health. 30 July 2020. Retrieved 16 March 2022.
- ^ Westover EJ, Covey DF, Brockman HL, Brown RE, Pike LJ (December 2003). «Cholesterol depletion results in site-specific increases in epidermal growth factor receptor phosphorylation due to membrane level effects. Studies with cholesterol enantiomers». The Journal of Biological Chemistry. 278 (51): 51125–33. doi:10.1074/jbc.M304332200. PMC 2593805. PMID 14530278.
- ^ Kristiana I, Luu W, Stevenson J, Cartland S, Jessup W, Belani JD, et al. (September 2012). «Cholesterol through the looking glass: ability of its enantiomer also to elicit homeostatic responses». The Journal of Biological Chemistry. 287 (40): 33897–904. doi:10.1074/jbc.M112.360537. PMC 3460484. PMID 22869373.
External links[edit]
Media related to Cholesterol at Wikimedia Commons
В настоящее время большинство показателей выполняют на автоматических гематологических анализаторах, которые в состоянии одновременно определять от 5 до 24 параметров. Из них основными являются: количество эритроцитов, средний объём эритроцита, количество лейкоцитов, концентрация гемоглобина, гематокрит, средняя концентрация гемоглобина в эритроците, среднее содержание гемоглобина в эритроците, полуширина распределения эритроцитов по размерам, количество тромбоцитов, средний объём тромбоцита.
Расшифровка анализов крови и мочи латинскими буквами — Семейная клиника ОПОРА г. Екатеринбург
ОКА (общий клинический анализ) крови — клинико-гематологический метод оценки состава главной биожидкости организма, целью которого является определение возможных нарушений. Исследование состава крови в лабораторных условиях проводится под микроскопом (микроскопия «вручную») и на гематологических автоматических анализаторах.
Итоговые данные автоподсчета компьютер фиксирует и отправляет на печать. В бланке исследования указывается расшифровка общего анализа крови латинскими буквами (аббревиатурой от полного наименования показателя).
Микроскопия ручным подсчетом занимает больше времени, но считается более точной. Оптимально информативный вариант оценки — автоматический анализ, дополненный вычислением лейкограммы специалистом лаборатории.
Назначение и информативность общего анализа крови
ОКА назначают:
- по симптоматическим жалобам для выявления нарушений состава крови;
- для контроля терапии диагностированного заболевания;
- в рамках профосмотра, диспансеризации, перинатального скрининга, военно-врачебной комиссии;
- при госпитализации и перед выпиской из стационара (санатория).
Для детей анализ является обязательным при прохождении медицинской комиссии для оформления в дошкольное или образовательное учреждение. Врач легко читает бланк анализа с обозначением параметров на латинском и английском языке и по результатам исследования может оценить общее состояние организма, а также обнаружить наличие:
- воспалений;
- анемии;
- инфекционных процессов, спровоцированных вирусами, бактериями, простейшими паразитами и гельминтами;
- коагуляционных нарушений (проблем со скоростью свертывания крови).
Несоответствие некоторых показателей нормам позволяет предположить активность раковых клеток.
Обозначение и определение основных показателей ОКА
Все исследуемые в ходе анализа параметры биожидкости находятся в тесной взаимосвязи и зависимости друг от друга. Условно можно разбить корреляционные показатели на три группы.
Забор крови на ОКА производится натощак
Гемоглобин и эритроциты
90% двухкомпонентного железосодержащего белка (гемоглобина) содержится в красных кровяных клетках — эритроцитах. Их совместные усилия обеспечивают насыщение крови кислородом и дыхательную функцию организма. Для полной картины в лаборатории оценивают не только концентрацию гемоглобина и количество красных клеток, но и сопутствующие параметры:
- гематокрит — определяет степень насыщенности кровотока красными клетками;
- скорость оседания эритроцитов — отражает быстроту деления крови на жидкую плазму и клеточную часть, а также соотношение белков в биожидкости;
- ретикулоциты — несозревшие предшественники красных клеток.
Дополнительными параметрами являются эритроцитарные индексы. Их вычисляют для оценки средних величин.
Таблица обозначений и показателей, соответствующих лабораторным нормам
| Аббревиатура в выданном пациенту бланке результатов | Исследуемый параметр | Референсы | |
| Для взрослых | Для детей | ||
| НВ измеряется в г/л | гемоглобин (hemoglobin) | муж. 140-160, жен. 120-150 | 120-130 г/л |
| RBC считают количество клеток в 1 л крови, умноженное на 10 в 12 степени — 10^12/л | эритроциты или красные кровяные тельца (red blood cells) | муж. 3,9-5,6; жен. 3,5-5,2 | 4,0-4,5 |
| HCT | гематокрит (hematocrit) | муж. 40-50%, жен. 37-47% | 33-41% |
| СОЭ или ESR величина измерения — мм/ч | скорость оседания эритроцитов (erythrocyte sedimentation rate) | муж. 2-15, жен. 3-20 | 4-12 |
| RET | ретикулоциты (reticulocytes) | 2-10 % (от эритроцитарной массы) | |
| эритроцитарные индексы или средние величины | |||
| MCV | объема эритроцитов | 78-98 фл (фемтолитров) | |
| MCH | содержания гемоглобина в одной клетке | 28 — 32 пг | |
| MCHC | концентрации гемоглобина в общем количестве эритроцитов | 30 — 37 г/л |
Тромбоциты
Кровяные клетки в форме пластинок, которые отвечают за нормальную коагуляцию (свертываемость крови), а также защищают эпителиальный (внутренний слой) сосудистых стенок. В клиническом анализе крови определяют количество тромбоцитов, процент тромбоцитарных пластинок по отношению к общему объему крови и тромбоцитарные индексы.
Обозначения и показатели нормы
| Аббревиатура, указанная в бланке итоговых результатов | Тромбоцитарные параметры | Референсы | |
| взрослые | дети | ||
| РСТ | тромбокрит (platelet crit) | 0,15-0,4 | |
| PLT (10^9/л) | тромбоциты или пластинки (platelets) | муж. 180-320 жен. 150-400 | 160-375 |
| Индексы | |||
| MPV | средние величины объема кровяной пластинки (mean platelet volume) | 7-10 фл | |
| PDW | распределение тромбоцитов по объему крови | 11,5-14,5 % |
Лейкоцитарные клетки
Лейкоциты — несколько групп белых кровяных клеток, обладающих охранной функцией фагоцитоза (захвата и уничтожения болезнетворных микроорганизмов). При активизации условно-патогенной флоры организма или вторжении патогенных бактерий, вирусов, паразитов и грибков лейкоциты мобилизуются, стремясь их ликвидировать.
Лейкоцитарные клетки разделяются на две большие группы, каждая из которых включает подгруппы:
- агранулоциты — лейкоциты, не содержащие азурофильных гранул в цитоплазме (моноциты и лимфоциты);
- гранулоциты — лейкоцитарные клетки с сегментированным ядром и специфическими гранулами в цитоплазме (нейтрофилы — сегментоядерные и палочкоядерные, эозинофилы и базофилы).
При лабораторной оценке учитывают абсолютное количество клеток (в единицах) и относительное количество (в процентах). В бланке анализа чаще всего указывают абсолютное число лейкоцитов в единицах и процентное соотношение отдельных лейкоцитарных групп.
Таблица обозначений и показателей нормы
| Аббр. в итоговом бланке результатов | Исследуемый параметр | Норма содержания | |||
| для взрослых | для детей | ||||
| в единицах | в % | в единицах | в % | ||
| WBC | лейкоциты или белые кровяные тельца (white blood cells) | 4-9 | — | 6-10 | — |
| LYM (LY#) (LY%) | лимфоциты (lymphocyte) | 1,2 — 3,0 | 25-40 | 30-45 | |
| NEUT (NE#) (NE%) | нейтрофилы (neutrophils) палочкоядерные / сегментоядерные | 2-5 / 55-70 | 1-4 / 40-60 | ||
| MON (MO#) (MO%) | моноциты (monocyte) | 0,1-0,7 | 6-8 | 4-6 | |
| EOS (EO#) (EO%) | эозинофилы (eosinophils) | 2-5 | 1-4 | ||
| BAS (BA#) (BA%) | базофилы (basophils) | 1 | 0-1 | ||
| MID (MON+ EOS+BAS) | смесь (моноциты+ базофилы+эозинофилы) | 0,2-0,8 | 5-10 | 5-10 |
Единицы вычисляют чаще всего вручную. Это количество клеток в литре крови (для удобства полученное число умножают на 10 в 9 степени — 10^9/л).
О расшифровке биохимии крови
Наряду с ОКА, востребованным исследованием является биохимический анализ крови. В бланке с результатами исследуемые параметры могут обозначаться как русской, так и латинской аббревиатурой. Оценка биохимического состава плазмы позволяет выявить функциональные сбои в конкретных органах и системах.
Забор крови на биохимию проводят при помощи одноразовых шприцев или вакутейнеров
Белки
Правильная концентрация протеинов (белков) — это достаточное количество строительного материала для новых клеток, нормальные мышечные сокращения, полноценная защита организма от инфекций, своевременное перемещение по кровотоку гормонов, кислот, питательных веществ.
| Наименование | Белок общий | Альбумин | С-реактивный белок | |
| Норма содержания | у взрослых | 64-84 | 33-55 | не более 5 |
| у детей | 60-80 | 32-46 | ||
| Аббревиатура в бланке | Tр | Albu | Crp |
Лабораторное измерение белка производится в г/л.
Углеводы
Сахар в норме означает правильный углеводный обмен и выработку поджелудочной железой нужного количества гормона инсулина.
| Наименование | Глюкоза | |
| Норма концентрации | Взрослые | 3,3-5,5 |
| Дети | ||
| Аббревиатура | Glu |
Измерительная величина — ммоль/л.
Азотистые соединения
Совпадение результатов анализа с референсными значениями отражает полноценное функционирование почечного аппарата.
| Название показателя | Мочевина | Мочевая кислота | |
| Норма | Взрослые | 2,8-7,2 | Муж. — 210-420, жен. — 150-350 |
| Дети | 4,2-7,2 | 120-330 | |
| Аббревиатура | Urea | Uric asid |
Величина измерения — мкмоль/л.
Жиры
Нормальные показатели жиров — признак правильного липидного обмена, здоровых сосудов головного мозга и нижних конечностей, печени, щитовидной железы.
| Наименование | Холестерин общ. | Липопротеины низкой плотности | Липопротеины высокой плотности | Триглицериды | |
| Норма | муж. | 3,2-5,2 | 1,7-4,3 | 0.6-1,8 | 1,7 |
| жен. | 1,8-4,4 | 0,8-1,8 | |||
| Аббревиатура | Chol | ЛПНП | ЛПВП | ТГ |
Лабораторная величина — ммоль/л.
Жирорастворимый пигмент желчи
Соответствие полученных результатов нормативам говорит о хорошей работе органов гепатобилиарной системы.
| Наименование | Билирубин общий | Билирубин неконъюгированный (свободный или непрямой) | Билирубин конъюгированный (связанный или прямой) |
| Норма | 20,5 | 1,7-17,0 | 0,86-5,3 |
| Аббр. | Tbil | Dbil | Idbil |
В условиях лаборатории измеряют в мкмоль/л.
Ферменты
Нормальные показатели ферментов отражают бесперебойные процессы пищеварительных химических реакций, белкового и углеводного обмена, стабильных мышечных сокращений (в том числе сердечной мышцы — миокарда), нормальной работы печени, поджелудочной железы, смежных органов гепатобилиарной системы.
| Название | Норма | Аббр. | |
| взрослые | дети | ||
| Аланинаминотрансфераза | муж. 45 жен. 39 | 29 | Alt, либо АЛТ, АлАТ |
| Аспартатаминотрансфераза | муж. до 31 жен. до 37 | до 30 | Ast или АСТ, АсАТ |
| Креатинфосфокиназа | муж. до 195 жен. до 167 | до 270 | KFK или КФК |
| Щелочная фосфатаза | 20-130 | 100-600 | Alp или ЩФ |
| Амилаза | до 120 | Amyl |
Измерение проводят в медицинских единицах на литр (ЕД/л).
Общий анализ мочи
Результаты лабораторной оценки мочи, прежде всего, информируют о состоянии здоровья мочевыделительной системы. Правильно расшифровать анализ мочи (общий клинический) может только врач, с учетом всех параметров, зависящих друг от друга. По таблице можно только сравнить полученные результаты с нормативными значениями.
Контейнер для ОАМ можно приобрести в любой аптеке
В ходе анализа оценивают физико-химические характеристики, органолептические свойства, осадок мочи, включающий:
- клетки крови;
- неклассифицируемые и классифицируемые элементы (цилиндры);
- посторонние примеси (слизь, бактерии, соли, дрожжевые грибки, клетки эпителия).
В бланке исследования прописаны все анализируемые параметры. Однако в норме некоторые из них в моче присутствовать не должны. Ненайденные элементы обозначают английским «Neg» или русским — «отрицательно».
Физико-химические характеристики
| Наименование показателя | Референсные значения | Аббревиатура для обозначения в бланке |
| кислотность | 4-7 ЕД. | РН |
| белок | Neg или не больше 0,033 г/л | PRO |
| сахар (глюкоза) | ≤ 0,8 ммоль/л | GLU |
| гемоглобин | Neg | НВ |
| кетоновые тела | Neg | КЕТ |
| билирубин | Neg | BIL |
| уробилиноген | 5-10 мг/л | URO |
Осадок мочи
| Элементы | Норма | Аббревиатура для обозначения в бланке |
| эритроциты | муж.-1-2 жен.- ≤ 3 | BLD или RBC |
| лейкоциты | муж.-≤ 3; жен.-≤ 6 | LEU |
| классифицируемые гиалиновые цилиндры | не более 20 | HYAL |
| неклассифицируемые цилиндры (эритроцитарные, зернистые, эпителиальные, восковидные) | Neg | UNCC |
| бактерии | Neg | NIT или BACT |
| дрожжевые грибки | Neg | BYST |
| слизь | незначительно или Neg | MUCS |
| эпителий мочевого пузыря | Neg | VTC |
Органолептика
| Параметр исследования | Норма | Аббревиатура для обозначения в бланке |
| цвет | соломенный | COLOR |
| плотность (удельный вес) | 1.010-1.022 г/л | SG |
| прозрачность | близка к абсолютной | TURB — при наличии мутности |
| запах | нерезкий | — |
| пенистость | отсутствует | — |
Дополнительные обозначения: скопление лейкоцитов (лейкоцитурия) — WBCC, плоский эпителий — SQEP, аскорбиновая кислота — VC.
Итоги
Результаты лабораторных анализов крови и мочи пациент получает на специальном бланке, где параметры исследования обозначают латинской (английской) аббревиатурой. Каждый показатель имеют свою норму содержания в крови или моче.
Правильно расшифровать итоги исследования может только врач, поскольку все параметры находятся в корреляционной зависимости между собой. Пациент может только сравнить свои результаты с референсными значениями. Нормативы, на которые следует ориентироваться, обычно указаны в бланке анализа.
Общий анализ крови: полная расшифровка
Вряд ли найдется кто-то, кто еще ни разу не сдавал кровь из пальца на анализы. Общий анализ крови берут практически при любом заболевании. Так в чем же его диагностическая ценность и какие диагнозы он может подсказать? Разбираем по-порядку.
Ценность исследования
Основные показатели, на которые врач обращает внимание при расшифровке общего анализа крови — это гемоглобин и эритроциты, СОЭ, лейкоциты и лейкоцитарная формула. Остальные скорее являются вспомогательными.
Чаще всего общий анализ крови назначают, чтобы понять, есть ли в организме воспаление и признаки инфекции, и если да, то какого происхождения — вирусного, бактериального или другого.
Также общий анализ крови может помочь установить анемию — малокровие. И если в крови есть ее признаки — назначают дополнительные анализы, чтобы установить причины.
Еще общий анализ крови назначают, если есть подозрение на онкологический процесс, когда есть ряд настораживающих симптомов и нужны зацепки. В этом случае кровь может косвенно подсказать, в каком направлении двигаться дальше.
Другие показания обычно встречаются реже.
Если после этой статьи у вас останутся вопросы — вы можете проконсультироваться с нашими терапевтами онлайн и задать им любые волнующие вас вопросы, предварительно отправив результаты своих анализов в чат.
Аббревиатура
Сейчас на бланках с результатом анализов в основном используют англ. аббревиатуры. Давайте пройдемся по основным показателям и разберем, что они значат.
-
WBC — white blood cells — белые кровяные тельца — Лейкоциты;
- RBC — red blood cells — красные кровяные тельца — Эритроциты;
- HGB — hemoglobin — Гемоглобин;
- HTC — hematocrit — Гематокрит;
- MCV — mean corpuscular volume — Средний объем эритроцитов;
- MCH — mean concentration hemoglobin — Среднее содержание гемоглобина в эритроците;
- MCHC — mean corpuscular hemoglobin concentration — Средняя концентрация гемоглобина в эритроците;
- RDW — red cell distribution — Индекс распределения эритроцитов;
- PLT — platelets — Тромбоциты;
- MPV — mean platelets volume — Средний объем тромбоцитов
- PTC — Thrombocrit — Тромбокрит.
Отдельным блоком идет лейкоцитарная формула
Это более детальная информация о тех самых WBC из предыдущего блока.
Лейкоциты в крови очень разные. Все они в целом отвечают за иммунитет, но каждый отдельный вид за разные направления в иммунной системе: за борьбу с бактериями, вирусами, паразитами, неспецифическими чужеродными частицами. Поэтому врач всегда смотрит сначала на общий показатель лейкоцитов из перечня выше, а затем на лейкоцитарную формулу, чтобы понять, а какое звено иммунитета нарушено.
Обратите внимание, что эти показатели обычно идут в двух измерениях: абсолютных (абс.) и относительных (%).
Абсолютные показывают, сколько штук клеток попало в поле зрения, а относительные — сколько эти клетки составляют от общего числа лейкоцитов. Это может оказаться важной деталью — например, в абсолютных цифрах лимфоциты вроде как в пределах нормы, но на фоне общего снижения всех лейкоцитов — их относительное количество сильно выше нормы. Итак, лейкоцитарная формула.
-
NEU (% и абс.) — Neutrophil -Нейтрофилы;
- LYMP (% и абс.) — Lymphocyte — Лимфоциты;
- MONO (% и абс.) — Monocytes -Моноциты;
- EO (% и абс.)- Eosinophils — Эозинофилы;
- Baso (% и абс.) — Basophil -Базофилы.
Расшифровка
А теперь пройдемся по каждому из этих показателей и разберем, что они значат.
HGB — hemoglobin — Гемоглобин
Гемоглобин — это белок, который переносит по организму кислород и доставляет его в нужные ткани. Если его не хватает — клетки начинают голодать и развивается целая цепочка симптомов: слабость, утомляемость, головокружение, выпадение волос и ломкость ногтей, заеды в уголках губ и другие. Это симптомы анемии.
В молекулу гемоглобина входит железо, а еще в его формировании большую роль играют витамин В12 и фолиевая кислота. Если их не хватает — в организме нарушается синтез гемоглобина и развивается анемия.
Есть еще наследственные формы анемии, но они случаются гораздо реже и заслуживают отдельного разбора.
В норме гемоглобин составляет 120−160 г/л для женщин и 130-170 г/л для мужчин. Нужно понимать, что в каждом конкретном случае нормы зависят от лаборатирии. Поэтому смотреть нужно на референсные значения той лаборатории, в которой вы сдавали анализ.
Повышенные цифры гемоглобина чаще всего случаются из-за сгущения крови, если человек излишне потеет во время жары, или принимает мочегонные. Еще повышенным гемоглобин может быть у скалолазов и людей, которые часто бывают в горах — это компенсаторная реакция на недостаток кислорода. Еще гемоглобин может повышаться из-за заболеваний дыхательной системы — когда легкие плохо работают и организму все время не хватает кислорода. В каждом конкретном случае нужно разбираться отдельно.
Снижение гемоглобина — признак анемии. Следующим шагом нужно разбираться какой.
RBC — red blood cells — Эритроциты
Эритроциты — это красные клетки крови, которые транспортируют гемоглобин и отвечают за обменные процессы тканей и органов. Именно гемоглобин, а точнее — его железо, красит эти клетки в красный.
Нормы для мужчин — 4,2-5,6*10*9/литр. Для женщин — 4-5*10*9/литр. Которые опять-таки зависят от лаборатории.
Повышаться эритроциты могут из-за потери жидкости с потом, рвотой, поносом, когда сгущается кровь. Еще есть заболевание под названием эритремия — редкое заболевание костного мозга, когда вырабатывается слишком много эритроцитов.
Снижении показателей обычно является признаком анемии, чаще железодефицитной, реже — другой.
MCV — mean corpuscular volume — Средний объем эритроцитов
Норма — 80-95 для мужчин и 80-100 для женщин.
Объем эритроцитов уменьшается при железодефицитной анемии. А повышается — при В12 дефицитной, при гепатитах, снижении функции щитовидной железы.
MCH — mean concentration hemoglobin — Среднее содержание гемоглобина в эритроците
Повышается этот показатель редко, а вот снижение — признак анемии или снижения функции щитовидной железы.
MCHC — средняя концентрация гемоглобина в эритроцитах
Повышение значений почти всегда свидетельствует об аппаратной ошибке, а снижение — о железодефицитной анемии.
HTC — hematocrit — Гематокрит
Это процентное соотношение форменных элементов крови к ее общему объему. Показатель помогает врачу дифференцировать, с чем связана анемия: потерей эритроцитов, что говорит о заболевании, или с избыточным разжижением крови.
PLT — platelets — тромбоциты
Это элементы крови, ответственные за формирование тромботического сгустка при кровотечениях. Превышение нормальных значений может свидетельствовать о физическом перенапряжении, анемии, воспалительных процессах, а может говорить о более серьезных проблемах в организме, среди которых онкологические заболевания и болезни крови.
Снижение уровня тромбоцитов в последние годы часто свидетельствует о постоянном приеме антиагрегантов (например, ацетилсалициловой кислоты) с целью профилактики инфаркта миокарда и ишемического инсульта головного мозга.
А значительное их снижение может быть признаком гематологических заболеваний крови, вплоть до лейкозов. У молодых людей — признаками тромбоцитопенической пурпуры и других заболеваний крови. Так же может появляться на фоне приема противоопухолевых и цитостатических препаратов, гипофункции щитовидной железы.
WВС — white blood cells — лейкоциты
Это основные защитники нашего организма, представители клеточного звена иммунитета. Повышение общего количества лейкоцитов чаще всего свидетельствует о наличии воспалительного процесса, преимущественно бактериальной природы. Также может оказаться признаком так называемого физиологического лейкоцитоза (под воздействием боли, холода, физической нагрузки, стресса, во время менструации, загара).
Нормы у мужчин и женщин обычно колеблются от 4,5 до 11,0*10*9/литр.
Снижение лейкоцитов — признак подавления иммунитета. Причиной чаще всего являются перенесенные вирусные инфекции, прием некоторых лекарств (в том числе нестероидных противовоспалительных и сульфаниламидов), похудение. Гораздо реже — иммунодефициты и лейкозы.
Лейкоцитарная формула
NEU — нейтрофилы
Самый большой пул лейкоцитов, составляющий от 50 до 75% всей лейкоцитарной популяции. Это основное звено клеточного иммунитета. Сами нейтрофилы делятся на палочкоядерные (юные формы) и сегментоядерные (зрелые). Повышение уровня нейтрофилов за счёт юных форм называют сдвигом лейкоцитарной формулы влево и характерно для острой бактериальной инфекции. Снижение — может быть признаком вирусной инфекции, а значительное снижение — признаком заболеваний крови.
LYM — лимфоциты
Второй после нейтрофилов пул лейкоцитов. Принято считать, что во время острой бактериальной инфекции число лимфоцитов снижается, а при вирусной инфекции и после неё — повышается.
Значительное снижение лимфоцитов может наблюдаться при ВИЧ-инфекции, при лейкозах, иммунодефицитах. Но это случается крайне редко и как правило сопровождается выраженными симптомами.
EOS — эозинофилы
Редкие представители лейкоцитов. Повышение их количества встречается при аллергических реакциях, в том числе лекарственной аллергии, также является характерным признаком глистной инвазии.
BAS — базофилы
Самая малочисленная популяция лейкоцитов. Их повышение может говорить об аллергии, паразитарном заболевании, хронических инфекциях, воспалительных и онкологических заболеваниях. Иногда временное повышение базофилов не удается объяснить.
MON — моноциты
Самые крупные представители лейкоцитов. Это макрофаги, пожирающие бактерии. Повышение значений чаще всего говорит о наличии инфекции — бактериальной, вирусной, грибковой, протозойной. А также о периоде восстановления после них и о специфических инфекциях — сифилисе, туберкулезе. Кроме того может быть признаком системных заболеваниях — ревматоидный артрит и другие.
CОЭ — скорость оседания эритроцитов
Если набрать кровь в пробирку и оставить на какое-то время — клетки крови начнут падать в осадок. Если через час взять линейку и замерить, сколько миллиметров эритроцитов выпало в осадок — получим скорость оседания эритроцитов.
В норме она составляет от 0 до 15 мм в час у мужчин, и от 0 до 20 мм у женщин.
Может повышаться, если эритроциты чем-то отягощены — например белками, которые активно участвуют в иммунном ответе: в случае воспаления, аллергической реакции, аутоимунных заболеваний — ревматоидный артрит, системная красная волчанка и другие. Может повышаться при онкологических заболеваниях. Бывает и физиологическое повышение, объясняемое беременностью, менструацией или пожилым возрастом.
В любом случае — высокий СОЭ всегда требует дополнительного обследования. Хоть и является неспецифическим показателем и может одновременно говорить о многом, но мало о чем конкретно.
В любом случае по общему анализу крови практически невозможно поставить точный диагноз, поэтому этот анализ является лишь первым шагом в диагностике и некоторым маячком, чтобы понимать, куда идти дальше. Не пытайтесь найти в своем анализе признаки рака или ВИЧ — скорее всего их там нет. Но если вы заметили любые изменения в анализе крови — не откладывайте визит к врачу. Он оценит ваши симптомы, соберет анамнез и расскажет, что делать с этим анализом дальше.
Если после этой статьи у вас все же остались вопросы по результатам анализов — вы можете проконсультироваться нашими терапевтами онлайн и задать любые волнующие вас вопросы, предварительно отправив результаты своих анализов в чат с врачом. Консультации платные, но здоровье того стоит. Для консультации переходите по ссылке.
Анализ крови на холестерин — липидный профиль
Мы привыкли считать холестерин врагом номер один. Но всё оказалось не так просто — жизнь без холестерина невозможна, да и он бывает не только «плохим», но и «хорошим».
Консультация врача
Вы можете получить консультацию необходимого специалиста онлайн в приложении Доктис
Лаборатория
Вы можете пройти комплексное обследование всех основных систем организма
- Триглицериды (TG)
- Общий холестерин (CHOL).
- Холестерин-ЛПВП (HDL)
- Холестерин-ЛПНП (LDL)
- Холестерин-ЛПОНП (VLDL)
- Индекс (коэффициент) атерогенности
Для того, чтобы определить риск развития атеросклероза сосудов, достаточно сдать анализ на общий
холестерин. Если показатель в норме, можно не волноваться. Правда, в случае, если вас ничего не беспокоит,
а за плечами хорошая наследственность по сердечно-сосудистым заболеваниям. Если нет, или показатель
повышен, важно сдать полноценный липидный профиль и выяснить «баланс сил» между различными
фракциями холестерина и своевременно проконсультироваться со специалистом.
Анализ на холестерин: основные показатели
Триглицериды (TG). Норма – 0,41−1,8 ммоль/л
Триглицериды – основное депо жиров в нашем организме, они образуются в печени. В большинстве
случаев повышенный уровень триглицеридов (так называемый хилёз крови) является следствием неправильного питания с избытком
жирной пищи и углеводов, поэтому сдавать анализ нужно не ранее, чем через 9 часов после последнего приёма
пищи. Причиной повышения могут быть первичные (наследственные) гиперлипидемии, и, намного чаще,
вторичные гиперлипидемии, среди которых – неправильное питание, ожирение, нарушение
толерантности к глюкозе и сахарный диабет, гипотиреоз, подагра, заболевания печени, поджелудочной железы и почек.
Также причиной повышения могут быть стресс, злоупотребление алкоголем, и прием некоторых лекарств
(бета-блокаторы, кортикостероиды, диуретики и некоторые другие). Снижение значений фиксируют при недостаточном
питании, гипертиреозе, нарушении всасывания, длительном приеме витамина С.
Общий холестерин (CHOL). Норма – 3,2−5,6 ммоль/л
Важнейший липид, являющийся структурным компонентом всех клеточных мембран, предшественником половых гормонов,
кортикостероидов, желчных кислот и витамина D. До 80% холестерина синтезируется в печени, остальной
поступает в наш организм с пищей. Содержание холестерина в крови в значительной степени зависит
от возраста, так для младенца верхняя граница нормы 5,25 ммоль/л, а для мужчины за 70
– 6,86 ммоль/л. Холестерин переносится с помощью курьеров, называемых липопротеинами,
которых существует три основных вида — высокой плотности, низкой плотности и очень низкой
плотности. Повышение общего холестерина, как и триглицеридов встречается при первичных и вторичных
гиперлипидемиях.
Несмотря на то, что в скрининговых исследования приняты усредненные
границы общего холестерина (5,6 ммоль/л) и его составляющих, в настоящее время врачи используют таблицы
норм в соответствии с полом и возрастом. Поэтому при отклонении показателей, для расшифровки анализа обратитесь к
врачу.
Холестерин-ЛПВП (HDL). Норма – не менее 0,9 ммоль/л
Эта фракция холестерина участвует в транспорте холестерина из периферических тканей в печень. Это
означает, что они забирают холестерин с поверхности сосудов, в том числе ног, сердца, головного мозга, и несут
его в печень. Значит, ЛПВП играет важную антиатерогенную роль, препятствуя образованию холестериновых бляшек и развитию
атеросклероза. И если уровень общего холестерина повышен за счёт холестерина ЛПВП, это считается хорошим
прогностическим фактором, и снижать холестерин не следует. При этом снижение уровня «хорошего»
холестерина ниже 0,90 ммоль/л для мужчин и 1,15 ммоль/л для женщин считается
фактором риска атеросклероза.
Холестерин-ЛПНП (LDL). Норма – 1,71−3,5 ммоль/л
Липопротеиды низкой плотности — основной переносчик холестерина в нашем организме. Именно он разносит
синтезированный в печени жир к органам и тканям. Считается, что уровень холестерина в ЛПНП
значительно больше влияет на развитие атеросклероза, чем уровень общего холестерина. Именно поэтому его стали
называть «плохим» холестерином. В условиях, когда сосудистая стенка скомпрометирована факторами
риска (никотином, высокой концентрацией глюкозы, гомоцистеина, повышением артериального давления), холестерин из
ЛПНП откладывается в ней, формируя атеросклеротическую бляшку. Для людей с факторами риска атеросклероза
(возраст – более 45 лет для мужчин и 55 лет для женщин, случаи ранней смерти от сердечно-сосудистых
заболеваний среди родственников, курение, сахарный диабет, гипертоническая болезнь, ожирение) уровень холестерина
ЛПНП не должен превышать 3,37 ммоль/л, значения от 3,37 до 4,12
ммоль/л расценивают как средний фактор риска развития атеросклероза, а выше 4,14
ммоль/л – как высокий.
Холестерин-ЛПОНП (VLDL). Норма – 0,26−1,04 ммоль/л
Эти липопротеиды синтезируются в печени и тонком кишечнике и служат предшественниками ЛПНП, то есть
также относятся к переносчикам «плохого» холестерина.
Индекс (коэффициент) атерогенности
Это показатель, который можно рассчитать, исходя из результатов липидного профиля.
Нормальным считается показатель в диапазоне от 2,0 до 2,5 единиц. Максимальными значениями
нормы являются 3,2 для женщин и 3,5 для мужчин. Всё, что выше, говорит о значительном
риске развития атеросклероза и требует мер по его снижению, которые могут быть как немедикаментозными
(изменение режима питания, похудение, отказ от курения, борьба с гиподинамией, прием различным БАДов), так
и медикаментозными (прием лекарств из различных групп, главным образом статинов).
При необходимости врач индивидуально подберет Вам лекарственный препарат