| Cirrhosis | |
|---|---|
| Other names | Cirrhosis of the liver, hepatic cirrhosis |
 |
|
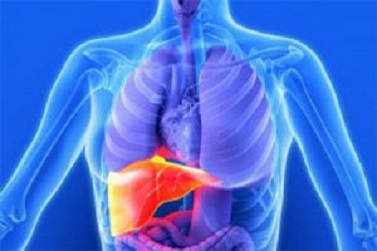
| Cross-section of human liver with cirrhosis | |
| Pronunciation |
|
| Specialty | Gastroenterology, Hepatology |
| Symptoms | Tiredness, itchiness, swelling in the lower legs, jaundice, easily bruising, fluid build-up in the abdomen[1] |
| Complications | Spontaneous bacterial peritonitis, hepatic encephalopathy, dilated veins in the esophagus, liver cancer[1] |
| Usual onset | Over months or years[1] |
| Duration | Long term[1] |
| Causes | Alcoholic liver disease, hepatitis B, hepatitis C, non-alcoholic steatohepatitis |
| Diagnostic method | Blood tests, medical imaging, liver biopsy[2][1] |
| Prevention | Vaccination (such as hepatitis B), avoiding alcohol,[1] losing weight, exercising, low-carbohydrate diet, controlling hypertension and diabetes may help in those with NAFLD or NASH |
| Treatment | Depends on underlying cause[3] |
| Frequency | 2.8 million (2015)[4] |
| Deaths | 1.3 million (2015)[5] |
Cirrhosis, also known as liver cirrhosis or hepatic cirrhosis, and end-stage liver disease, is the impaired liver function caused by the formation of scar tissue known as fibrosis due to damage caused by liver disease.[6] Damage causes tissue repair and subsequent formation of scar tissue, which over time can replace normal functioning tissue, leading to the impaired liver function of cirrhosis.[6][7] The disease typically develops slowly over months or years.[1] Early symptoms may include tiredness, weakness, loss of appetite, unexplained weight loss, nausea and vomiting, and discomfort in the right upper quadrant of the abdomen.[8] As the disease worsens, symptoms may include itchiness, swelling in the lower legs, fluid build-up in the abdomen, jaundice, bruising easily, and the development of spider-like blood vessels in the skin.[8] The fluid build-up in the abdomen may become spontaneously infected.[1] More serious complications include hepatic encephalopathy, bleeding from dilated veins in the esophagus, stomach, or intestines, and liver cancer.[9]
Cirrhosis is most commonly caused by alcoholic liver disease, non-alcoholic steatohepatitis (NASH – the progressive form of non-alcoholic fatty liver disease),[10] heroin abuse,[11] chronic hepatitis B, and chronic hepatitis C.[8][12] Heavy drinking over a number of years can cause alcoholic liver disease.[13] Liver damage has also been attributed to heroin usage over an extended period of time as well.[14] NASH has a number of causes, including obesity, high blood pressure, abnormal levels of cholesterol, type 2 diabetes, and metabolic syndrome.[15] Less common causes of cirrhosis include autoimmune hepatitis, primary biliary cholangitis, and primary sclerosing cholangitis that disrupts bile duct function, genetic disorders such as Wilson’s disease and hereditary hemochromatosis, and chronic heart failure with liver congestion.[8]
Diagnosis is based on blood tests, medical imaging, and liver biopsy.[2][1]
Hepatitis B vaccine can prevent hepatitis B and the development of cirrhosis, but no vaccination against hepatitis C is available.[1] No specific treatment for cirrhosis is known, but many of the underlying causes may be treated by a number of medications that may slow or prevent worsening of the condition.[3] Avoiding alcohol is recommended in all cases.[1] Hepatitis B and C may be treatable with antiviral medications.[1] Autoimmune hepatitis may be treated with steroid medications.[1] Ursodiol may be useful if the disease is due to blockage of the bile duct.[1] Other medications may be useful for complications such as abdominal or leg swelling, hepatic encephalopathy, and dilated esophageal veins.[1] If cirrhosis leads to liver failure, a liver transplant may be an option.[15]
Cirrhosis affected about 2.8 million people and resulted in 1.3 million deaths in 2015.[4][5] Of these deaths, alcohol caused 348,000, hepatitis C caused 326,000, and hepatitis B caused 371,000.[5] In the United States, more men die of cirrhosis than women.[1] The first known description of the condition is by Hippocrates in the fifth century BCE.[16] The term «cirrhosis» was derived in 1819 from the Greek word «kirrhos,» which describes the yellowish color of a diseased liver.[17]
Signs and symptoms[edit]
Person with cirrhosis and associated pain in the right upper region of the abdomen
Cirrhosis can take quite a long time to develop, and symptoms may be slow to emerge.[8] Some early symptoms include tiredness, weakness, loss of appetite, weight loss, and nausea.[8] People may also feel discomfort in the right upper abdomen around the liver.[8]
As cirrhosis progresses, symptoms can include neurological changes.[8] This can consist of cognitive impairments, confusion, memory loss, sleep disorders, and personality changes.[8]
Worsening cirrhosis can cause a build-up of fluid in different parts of the body such as the legs (edema) and abdomen (ascites).[8] Other signs of advancing disease include itchy skin, bruising easily, dark urine, and yellowing of the skin.[8]
Liver dysfunction[edit]
These features are a direct consequence of liver cells not functioning:
- Spider angiomata or spider nevi happen when there is dilatation of vasculature beneath the skin surface.[18] There is a central, red spot with reddish extensions that radiate outward. This creates a visual effect that resembles a spider. It occurs in about one-third of cases.[18] The likely cause is an increase in estrogen.[18] Cirrhosis causes a rise of estrogen due to increased conversion of androgens into estrogen.[19]
- Palmar erythema presents as reddish palms below the thumb and little finger. This is seen in about 23% of cirrhosis cases.[20] This is a result of increased estrogen.[21]
- Gynecomastia, or the increase of breast size in men, is caused by increased estradiol (a potent type of estrogen).[22] This can occur in up to two-thirds of cases.[23]
- Hypogonadism signifies a decreased functionality of the gonads.[24] This can result in impotence, infertility, loss of sexual drive, and testicular atrophy. A swollen scrotum may also be evident.[25]
- Liver size can be enlarged, normal, or shrunken in people with cirrhosis.[26] As the disease progresses, the liver will typically shrink due to the result of scarring.[27]
- Jaundice is the yellowing of the skin. It can additionally cause yellowing of mucous membranes notably of the white of the eyes. This phenomenon is due to increased levels of bilirubin, which may also cause the urine to be dark-colored.[28]
Portal hypertension[edit]
Liver cirrhosis makes it hard for blood to flow in the portal venous system.[29] This resistance creates a backup of blood and increases pressure.[29] This results in portal hypertension. Effects of portal hypertension include:
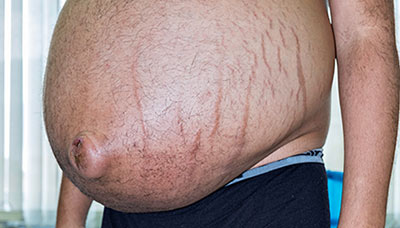
- Ascites is a build-up of fluid in the peritoneal cavity in the abdomen[30]
- An enlarged spleen in 35 to 50% of cases[6]
- Esophageal varices and gastric varices result from collateral circulation in the esophagus and stomach (a process called portacaval anastomosis).[31] When the blood vessels in this circulation become enlarged, they are called varices. Varices are more likely to rupture at this point.[7] Variceal rupture often leads to severe bleeding, which can be fatal.[31]
- Caput medusae are dilated paraumbilical collateral veins due to portal hypertension.[29] Blood from the portal venous system may be forced through the paraumbilical veins and ultimately to the abdominal wall veins. The created pattern resembles the head of Medusa, hence the name.[7]
- Cruveilhier-Baumgarten bruit is bruit in the epigastric region (on examination by stethoscope).[32] It is due to extra connections forming between the portal system and the paraumbilical veins.[33]
Other nonspecific signs[edit]
Some signs that may be present include changes in the nails (such as Muehrcke’s lines, Terry’s nails, and nail clubbing).[34][35] Additional changes may be seen in the hands (Dupuytren’s contracture) as well as the skin/bones (hypertrophic osteoarthropathy).[23]
Advanced disease[edit]
As the disease progresses, complications may develop. In some people, these may be the first signs of the disease.
- Bruising and bleeding can result from decreased production of clotting factors[36]
- Hepatic encephalopathy (HE) occurs when ammonia and related substances build up in the blood.[36] This build-up affects brain function when they are not cleared from the blood by the liver. Symptoms can include unresponsiveness, forgetfulness, trouble concentrating, changes in sleep habits, or psychosis. One classic physical examination finding is asterixis.[23] This is the asynchronous flapping of outstretched, dorsiflexed hands.[23] Fetor hepaticus is a musty breath odor resulting from increased dimethyl sulfide and is a feature of HE.[37]
- Sensitivity to medication can be caused by decreased metabolism of the active compounds
- Acute kidney injury (particularly hepatorenal syndrome) [23]
- Cachexia associated with muscle wasting and weakness [36]
Causes[edit]
Cirrhosis has many possible causes, and more than one cause may be present. History taking is of importance in trying to determine the most likely cause.[2] Globally, 57% of cirrhosis is attributable to either hepatitis B (30%) or hepatitis C (27%).[38][39] Alcohol use disorder is another major cause, accounting for about 20-40% of the cases.[39][23]
Common causes[edit]
- Alcoholic liver disease (ALD, or alcoholic cirrhosis) develops for 10–20% of individuals who drink heavily for a decade or more.[40] Alcohol seems to injure the liver by blocking the normal metabolism of protein, fats, and carbohydrates.[41] This injury happens through the formation of acetaldehyde from alcohol. Acetaldehyde is reactive and leads to the accumulation of other reactive products in the liver.[23] People with ALD may also have concurrent alcoholic hepatitis. Associated symptoms are fever, hepatomegaly, jaundice, and anorexia.[41] AST and ALT blood levels are both elevated, but at less than 300 IU/liter, with an AST:ALT ratio > 2.0, a value rarely seen in other liver diseases.[42] In the United States, 40% of cirrhosis-related deaths are due to alcohol.[23]
- In non-alcoholic fatty liver disease (NAFLD), fat builds up in the liver and eventually causes scar tissue.[43] This type of disorder can be caused by obesity, diabetes, malnutrition, coronary artery disease, and steroids.[43][44] Though similar in signs to alcoholic liver disease, no history of notable alcohol use is found. Blood tests and medical imaging are used to diagnose NAFLD and NASH, and sometimes a liver biopsy is needed.[30]
- Chronic hepatitis C, an infection with the hepatitis C virus, causes inflammation of the liver and a variable grade of damage to the organ.[36] Over several decades, this inflammation and damage can lead to cirrhosis. Among patients with chronic hepatitis C, 20–30% develop cirrhosis.[36][23] Cirrhosis caused by hepatitis C and alcoholic liver disease are the most common reasons for liver transplant.[23] Both hepatitis C and hepatitis B-related cirrhosis can also be attributed with heroin addiction.[45]
- Chronic hepatitis B causes liver inflammation and injury that over several decades can lead to cirrhosis.[36] Hepatitis D is dependent on the presence of hepatitis B and accelerates cirrhosis in co-infection.[36]
Less common causes[edit]
- In primary biliary cholangitis (previously known as primary biliary cirrhosis), the bile ducts become damaged by an autoimmune process.[36] This leads to liver damage.[43] Patients may have no symptoms. While other people could present with fatigue, pruritus, or skin hyperpigmentation.[46] The liver is typically enlarged which is referred to as hepatomegaly.[46] Rises in alkaline phosphatase, cholesterol, and bilirubin levels occur. Patients are usually positive for anti-mitochondrial antibodies.[46]
- Primary sclerosing cholangitis is a disorder of the bile ducts that presents with pruritus, steatorrhea, fat-soluble vitamin deficiencies, and metabolic bone disease. A strong association with inflammatory bowel disease is seen, especially ulcerative colitis.[23]
- Autoimmune hepatitis is caused by an attack of the liver by lymphocytes. This causes inflammation and eventually scarring as well as cirrhosis. Findings include elevations in serum globulins, especially gamma globulins.[23]
- Hereditary hemochromatosis usually presents with skin hyperpigmentation, diabetes mellitus, pseudogout, or cardiomyopathy, All of these are due to signs of iron overload.[23][36] Family history of cirrhosis is common as well.
- Wilson’s disease is an autosomal recessive disorder characterized by low ceruloplasmin in the blood and increased copper of the liver.[43][36] Copper in the urine is also elevated. Patients may also have Kayser-Fleischer rings in the cornea and altered mental status.[47]
- Indian childhood cirrhosis is a form of neonatal cholestasis characterized by deposition of copper in the liver [36][48]
- Alpha-1 antitrypsin deficiency is an autosomal co-dominant disorder of low levels of the enzyme alpha-1 antitrypsin[23]
- Cardiac cirrhosis is due to chronic right-sided heart failure, which leads to liver congestion [23]
- Galactosemia[49]
- Glycogen storage disease type IV[36]
- Cystic fibrosis[23]
- Hepatotoxic drugs or toxins, such as acetaminophen (paracetamol), methotrexate, or amiodarone[36]
Pathophysiology[edit]
The liver plays a vital role in the synthesis of proteins (for example, albumin, clotting factors and complement), detoxification, and storage (for example, of vitamin A and glycogen). In addition, it participates in the metabolism of lipids and carbohydrates.[citation needed]
Cirrhosis is often preceded by hepatitis and fatty liver (steatosis), independent of the cause. If the cause is removed at this stage, the changes are fully reversible.[citation needed]
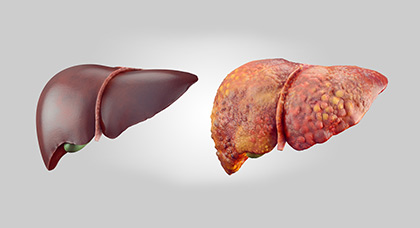
The pathological hallmark of cirrhosis is the development of scar tissue that replaces normal tissue. This scar tissue blocks the portal flow of blood through the organ, raising the blood pressure and disturbing normal function. Research has shown the pivotal role of the stellate cell, that normally stores vitamin A, in the development of cirrhosis. Damage to the liver tissue from inflammation leads to the activation of stellate cells, which increases fibrosis through the production of myofibroblasts, and obstructs hepatic blood flow.[50] In addition, stellate cells secrete TGF beta 1, which leads to a fibrotic response and proliferation of connective tissue. TGF-β1 have been implicated in the process of activating hepatic stellate cells (HSCs) with the magnitude of fibrosis being in proportion to increase in TGF β levels. ACTA2 is associated with TGF β pathway that enhances contractile properties of HSCs leading to fibrosis.[51] Furthermore, it secretes TIMP1 and TIMP2, naturally occurring inhibitors of matrix metalloproteinases, which prevents them from breaking down the fibrotic material in the extracellular matrix.[52][53]
As this cascade of processes continues, fibrous tissue bands (septa) separate hepatocyte nodules, which eventually replace the entire liver architecture, leading to decreased blood flow throughout. The spleen becomes congested, and enlarged, resulting in its retention of platelets, which are needed for normal blood clotting. Portal hypertension is responsible for the most severe complications of cirrhosis.[citation needed]
Diagnosis[edit]
The diagnosis of cirrhosis in an individual is based on multiple factors.[23] Cirrhosis may be suspected from laboratory findings, physical exam, and patient history. Imaging is generally obtained to evaluate the liver.[23] A liver biopsy will confirm the diagnosis; however, is generally not required.[36]
Imaging[edit]
Ultrasound is routinely used in the evaluation of cirrhosis.[36] It may show a small and shrunken liver in advanced disease. On ultrasound, there is increased echogenicity with irregular appearing areas.[54] Other suggestive findings are an enlarged caudate lobe, widening of the fissures and enlargement of the spleen.[55] An enlarged spleen, which normally measures less than 11–12 cm in adults, may suggest underlying portal hypertension.[56] Ultrasound may also screen for hepatocellular carcinoma and portal hypertension.[36] This is done by assessing flow in the hepatic vein.[57] An increased portal vein pulsatility may be seen. However, this may be a sign of elevated right atrial pressure.[58] Portal vein pulsatility are usually measured by an pulsatility indices (PI).[57] A number above a certain values indicates cirrhosis (see table below).
| Index | Calculation | Cutoff |
|---|---|---|
| Average-based | (Max – Min) / Average[57] | 0.5[57] |
| Max-relative | (Max – Min) / Max[59] | 0.5[59][60]–0.54[60] |
Other scans include CT of the abdomen and MRI.[36] A CT scan is non-invasive and may be helpful in the diagnosis.[36] Compared to the ultrasound, CT scans tend to be more expensive. MRI provides excellent evaluation; however, is a high expense.[36]
Cirrhosis is also diagnosable through a variety of new elastography techniques.[61][62] When a liver becomes cirrhotic it will generally become stiffer. Determining the stiffness through imaging can determine the location and severity of disease. Techniques include transient elastography, acoustic radiation force impulse imaging, supersonic shear imaging and magnetic resonance elastography.[63] Transient elastography and magnetic resonance elastography can help identify the stage of fibrosis.[64] Compared to a biopsy, elastography can sample a much larger area and is painless.[65] It shows a reasonable correlation with the severity of cirrhosis.[64] Other modalities have been introduced which are incorporated into ultrasonagraphy systems. These include 2-dimensional shear wave elastography and point shear wave elastography which uses acoustic radiation force impulse imaging.[10]
Rarely are diseases of the bile ducts, such as primary sclerosing cholangitis, causes of cirrhosis.[36] Imaging of the bile ducts, such as ERCP or MRCP (MRI of biliary tract and pancreas) may aid in the diagnosis.[36]
Lab findings[edit]
The best predictors of cirrhosis are ascites, platelet count < 160,000/mm3, spider angiomata, and a Bonacini cirrhosis discriminant score greater than 7 (as the sum of scores for platelet count, ALT/AST ratio and INR as per table).[66]
| Score | Platelet count x109 | ALT/AST ratio | INR |
|---|---|---|---|
| 0 | >340 | >1.7 | <1.1 |
| 1 | 280-340 | 1.2-1.7 | 1.1-1.4 |
| 2 | 220-279 | 0.6-1.19 | >1.4 |
| 3 | 160–219 | <0.6 | … |
| 4 | 100-159 | … | … |
| 5 | 40-99 | … | … |
| 6 | <40 | … | … |
These findings are typical in cirrhosis:
- Thrombocytopenia, typically multifactorial, is due to alcoholic marrow suppression, sepsis, lack of folate, platelet sequestering in the spleen, and decreased thrombopoietin.[42] However, this rarely results in a platelet count < 50 000/mL.[68]
- Aminotransferases AST and ALT are moderately elevated, with AST > ALT. However, normal aminotransferase levels do not preclude cirrhosis.[42]
- Alkaline phosphatase – slightly elevated but less than 2–3 times the upper limit of normal.[citation needed]
- Gamma-glutamyl transferase – correlates with AP levels. Typically much higher in chronic liver disease from alcohol.[68]
- Bilirubin levels are normal when compensated, but may elevate as cirrhosis progresses.[citation needed]
- Albumin levels fall as the synthetic function of the liver declines with worsening cirrhosis since albumin is exclusively synthesized in the liver.
- Prothrombin time increases, since the liver synthesizes clotting factors.
- Globulins increase due to shunting of bacterial antigens away from the liver to lymphoid tissue.
- Serum sodium levels fall(hyponatremia) due to inability to excrete free water resulting from high levels of ADH and aldosterone.
- Leukopenia and neutropenia are due to splenomegaly with splenic margination.[citation needed]
- Coagulation defects occur, as the liver produces most of the coagulation factors, thus coagulopathy correlates with worsening liver disease.
- Glucagon is increased in cirrhosis.[69]
- Vasoactive intestinal peptide is increased as blood is shunted into the intestinal system because of portal hypertension.
- Vasodilators are increased (such as nitric oxide and carbon monoxide) reducing afterload with compensatory increase in cardiac output, mixed venous oxygen saturation.[70]
- Renin is increased (as well as sodium retention in kidneys) secondary to a fall in systemic vascular resistance.[71]
FibroTest is a biomarker for fibrosis that may be used instead of a biopsy.[72]
Other laboratory studies performed in newly diagnosed cirrhosis may include:
- Serology for hepatitis viruses, autoantibodies (ANA, antismooth muscle, antimitochondria, anti-LKM)
- Ferritin[73][74] and transferrin saturation: markers of iron overload as in hemochromatosis, copper and ceruloplasmin: markers of copper overload as in Wilson’s disease
- Immunoglobulin levels (IgG, IgM, IgA) – these immunoglobins are nonspecific, but may help in distinguishing various causes.
- Cholesterol and glucose
- Alpha 1-antitrypsin
Markers of inflammation and immune cell activation are typically elevated in cirrhotic patients, especially in the decompensated disease stage:
- C-reactive protein (CRP)[75]
- Procalcitonin (PCT)[75]
- Presepsin[76]
- soluble CD14[75]
- soluble CD163[77]
- soluble CD206 (mannose receptor)[78]
- soluble TREM-1[79]
A recent study identified15 microbial biomarkers from the gut microbiota.[80] These could potentially be used to discriminate patients with liver cirrhosis from healthy individuals.
Pathology[edit]
The gold standard for diagnosis of cirrhosis is a liver biopsy. This is usually carried out as a fine-needle approach, through the skin (percutaneous), or internal jugular vein (transjugular).[81] Endoscopic ultrasound-guided liver biopsy (EUS), using the percutaneous or transjugular route, has become a good alternative to use.[82][81] EUS can target liver areas that are widely separated,[83] and can deliver bi-lobar biopsies.[82] A biopsy is not necessary if the clinical, laboratory, and radiologic data suggest cirrhosis. Furthermore, a small but significant risk of complications is associated with liver biopsy, and cirrhosis itself predisposes for complications caused by liver biopsy.[84]
Once the biopsy is obtained, a pathologist will study the sample. Cirrhosis is defined by its features on microscopy: (1) the presence of regenerating nodules of hepatocytes and (2) the presence of fibrosis, or the deposition of connective tissue between these nodules. The pattern of fibrosis seen can depend on the underlying insult that led to cirrhosis. Fibrosis can also proliferate even if the underlying process that caused it has resolved or ceased. The fibrosis in cirrhosis can lead to destruction of other normal tissues in the liver: including the sinusoids, the space of Disse, and other vascular structures, which leads to altered resistance to blood flow in the liver, and portal hypertension.[85]
-
No fibrosis, but mild zone 3 steatosis, in which collagen fibres (pink–red, arrow) are confined to portal tracts (P) (Van Gieson’s stain)[86]
-
Histopathology of steatohepatitis with mild fibrosis in the form of fibrous expansion (Van Gieson’s stain)[86]
-
Histopathology of steatohepatitis with moderate fibrosis, with thin fibrous bridges (Van Gieson’s stain)[86]
-
Histopathology of steatohepatitis with established cirrhosis, with thick bands of fibrosis (Van Gieson’s stain)[86]
-
Trichrome stain, showing cirrhosis as a nodular texture surrounded by fibrosis (wherein collagen is stained blue).
As cirrhosis can be caused by many different entities which injure the liver in different ways, cause-specific abnormalities may be seen. For example, in chronic hepatitis B, there is infiltration of the liver parenchyma with lymphocytes.[85] In congestive hepatopathy there are erythrocytes and a greater amount of fibrosis in the tissue surrounding the hepatic veins.[87] In primary biliary cholangitis, there is fibrosis around the bile duct, the presence of granulomas and pooling of bile.[88] Lastly in alcoholic cirrhosis, there is infiltration of the liver with neutrophils.[85]
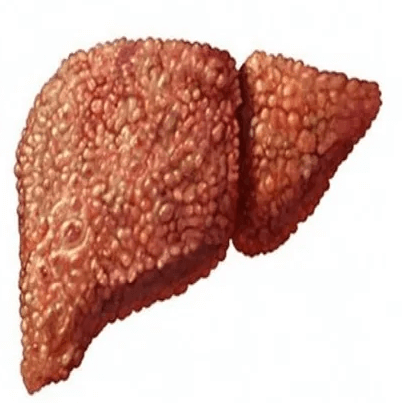
Macroscopically, the liver is initially enlarged, but with the progression of the disease, it becomes smaller. Its surface is irregular, the consistency is firm, and if associated with steatosis the color is yellow. Depending on the size of the nodules, there are three macroscopic types: micronodular, macronodular, and mixed cirrhosis. In the micronodular form (Laennec’s cirrhosis or portal cirrhosis), regenerating nodules are under 3 mm. In macronodular cirrhosis (post-necrotic cirrhosis), the nodules are larger than 3 mm. Mixed cirrhosis consists of nodules of different sizes.[89]
-
Micronodular cirrhosis, with diffuse areas of pallor.
-
Pale macronodules of cirrhosis.
-
Cirrhosis leading to hepatocellular carcinoma
Grading[edit]
The severity of cirrhosis is commonly classified with the Child–Pugh score (also known as the Child–Pugh–Turcotte score).[90] This system was devised in 1964 by Child and Turcotte, and modified in 1973 by Pugh and others.[91] It was first established to determine who would benefit from elective surgery for portal decompression.[90] This scoring system uses multiple lab values including bilirubin, albumin, and INR.[92] The presence of ascites and severity of encephalopathy is also included in the scoring.[92] Patients are classified into class A, B, or C.[92] Class A has a favorable prognosis while class C is at high risk of death.
| Child-Pugh Class | Points | Liver Function | Prognosis | Abdominal surgery post-operative mortality |
|---|---|---|---|---|
| Child-Pugh Class A | 5–6 points | Good liver function | 15–20 years | 10% |
| Child-Pugh Class B | 7–9 points | Moderately impaired liver function | 30% | |
| Child-Pugh Class C | 10–15 points | Advanced liver dysfunction | 1–3 years | 82% |
The Child-Pugh score is a validated predictor of mortality after a major surgery.[90] For example, Child class A patients have a 10% mortality rate and Child class B patients have a 30% mortality rate while Child class C patients have a 70 to 80% mortality rate after abdominal surgery.[90] Elective surgery is usually reserved for those in Child class A patients. There is an increased risk for child class B individuals and they may require medical optimization. Overall, it is not recommended for Child class C patients to undergo elective surgery.[90]
In the past, the Child-Pugh classification was used to determine patients who were candidates for a liver transplant.[90] Child-Pugh class B is usually an indication for evaluation for transplant.[92] However, there were many issues when applying this score to liver transplant eligibility.[90] Thus, the MELD score was created.
The Model for End-Stage Liver Disease (MELD) score was later developed and approved in 2002.[93] It was approved by the United Network for Organ Sharing (UNOS) as a way to determine the allocation of liver transplants to awaiting people in the United States.[94] It is also used as a validated survival predictor of cirrhosis, alcoholic hepatitis, acute liver failure, and acute hepatitis.[95] The variables included bilirubin, INR, creatinine, and dialysis frequency.[95] In 2016, sodium was added to the variables and the score is often referred to as MELD-Na.[96]
MELD-Plus is a further risk score to assess severity of chronic liver disease. It was developed in 2017 as a result of a collaboration between Massachusetts General Hospital and IBM.[97] Nine variables were identified as effective predictors for 90-day mortality after a discharge from a cirrhosis-related hospital admission.[97] The variables include all Model for End-Stage Liver Disease (MELD)’s components, as well as sodium, albumin, total cholesterol, white blood cell count, age, and length of stay.[97]
The hepatic venous pressure gradient (difference in venous pressure between incoming and outgoing blood to the liver) also determines the severity of cirrhosis, although it is hard to measure. A value of 16 mm or more means a greatly increased risk of death.[98][unreliable medical source?]
Prevention[edit]
Key prevention strategies for cirrhosis are population-wide interventions to reduce alcohol intake (through pricing strategies, public health campaigns, and personal counseling), programs to reduce the transmission of viral hepatitis, and screening of relatives of people with hereditary liver diseases.[99]
Little is known about factors affecting cirrhosis risk and progression. However, many studies have provided increasing evidence for the protective effects of coffee consumption against the progression of liver disease. These effects are more noticeable in liver disease that is associated with alcohol use disorder. Coffee has antioxidant and antifibrotic effects. Caffeine may not be the important component; polyphenols may be more important. Drinking two or more cups of coffee a day is associated with improvements in the liver enzymes ALT, AST, and GGT. Even in those with liver disease, coffee consumption can lower fibrosis and cirrhosis.[100]
Treatment[edit]
Generally, liver damage from cirrhosis cannot be reversed, but treatment can stop or delay further progression and reduce complications. A healthy diet is encouraged, as cirrhosis may be an energy-consuming process. A recommended diet consists of high-protein, high-fiber diet plus supplementation with branched-chain amino acids.[101] Close follow-up is often necessary. Antibiotics are prescribed for infections, and various medications can help with itching. Laxatives, such as lactulose, decrease the risk of constipation. Carvedilol increases survival benefit for patients with cirrhosis and portal hypertension.[102]
Alcoholic cirrhosis caused by alcohol use disorder is treated by abstaining from alcohol. Treatment for hepatitis-related cirrhosis involves medications used to treat the different types of hepatitis, such as interferon for viral hepatitis and corticosteroids for autoimmune hepatitis.[citation needed]
Cirrhosis caused by Wilson’s disease is treated by removing the copper which builds up in organs.[2] This is carried out using chelation therapy such as penicillamine. When the cause is an iron overload, iron is removed using a chelation agent such as deferoxamine or by bloodletting.[citation needed]
As of 2021, there are recent studies studying drugs to prevent cirrhosis caused by non-alcoholic fatty liver disease (NAFLD or NASH). A drug called semaglutide was shown to provide greater NASH resolution versus placebo. No improvement in fibrosis was observed.[103] A combination of cilofexor/firsocostat was studied in patients with bridging fibrosis and cirrhosis. It was observed to have led to improvements in NASH activity with a potential antifibrotic effect.[104] Lanifibranor is also shown to prevent worsening fibrosis.[105]
Preventing further liver damage[edit]
Regardless of the underlying cause of cirrhosis, consumption of alcohol and other potentially damaging substances are discouraged. There is no evidence that supports the avoidance or dose reduction of paracetamol in people with compensated cirrhosis; it is thus considered a safe analgesic for said individuals.[106]
Vaccination of susceptible patients should be considered for hepatitis A and hepatitis B.
Treating the cause of cirrhosis prevents further damage; for example, giving oral antivirals such as entecavir and tenofovir where cirrhosis is due to hepatitis B prevents progression of cirrhosis. Similarly, control of weight and diabetes prevents deterioration in cirrhosis due to non-alcoholic fatty liver disease.[107]
Avoid drugs that could further harm the liver. These include several drugs such as anti-depressants, certain antibiotics, and NSAIDs (like ibuprofen).[108] These agents are hepatotoxic as they are metabolized by the liver. If medication that harms the liver is still recommended by your doctor, the dosage can be adjusted.
Lifestyle[edit]
According to a 2018 systematic review based on studies that implemented 8 to 14 week-long exercise programs, there is currently insufficient scientific evidence regarding either the beneficial or harmful effects of physical exercise in people with cirrhosis on all-cause mortality, morbidity (including both serious and non-serious adverse events), health-related quality of life, exercise capacity and anthropomorphic measures.[109] These conclusions were based on low to very low quality research, which imposes the need to develop further research with higher quality, especially to evaluate its effects on clinical outcomes.[citation needed]
Transplantation[edit]
If complications cannot be controlled or when the liver ceases functioning, liver transplantation is necessary. Survival from liver transplantation has been improving over the 1990s, and the five-year survival rate is now around 80%. The survival rate depends largely on the severity of disease and other medical risk factors in the recipient.[110] In the United States, the MELD score is used to prioritize patients for transplantation.[111] Transplantation necessitates the use of immune suppressants (ciclosporin or tacrolimus).
Decompensated cirrhosis[edit]
Manifestations of decompensation in cirrhosis include gastrointestinal bleeding, hepatic encephalopathy, jaundice or ascites. In patients with previously stable cirrhosis, decompensation may occur due to various causes, such as constipation, infection (of any source), increased alcohol intake, medication, bleeding from esophageal varices or dehydration. It may take the form of any of the complications of cirrhosis listed below.
People with decompensated cirrhosis generally require admission to a hospital, with close monitoring of the fluid balance, mental status, and emphasis on adequate nutrition and medical treatment – often with diuretics, antibiotics, laxatives or enemas, thiamine and occasionally steroids, acetylcysteine and pentoxifylline.[112] Administration of saline is avoided, as it would add to the already high total body sodium content that typically occurs in cirrhosis. Life expectancy without liver transplant is low, at most 3 years.
Palliative care[edit]
Palliative care is specialized medical care that focuses on providing patients with relief from the symptoms, pain, and stress of a serious illness, such as cirrhosis. The goal of palliative care is to improve quality of life for both the patient and the patient’s family and it is appropriate at any stage and for any type of cirrhosis.[113]
Especially in the later stages, people with cirrhosis experience significant symptoms such as abdominal swelling, itching, leg edema, and chronic abdominal pain which would be amenable for treatment through palliative care.[114] Because the disease is not curable without a transplant, palliative care can also help with discussions regarding the person’s wishes concerning health care power of attorney, do not resuscitate decisions and life support, and potentially hospice.[114] Despite proven benefit, people with cirrhosis are rarely referred to palliative care.[115]
Immunity[edit]
Cirrhosis is known to cause immune dysfunction in numerous ways. It impedes the immune system from working normally.[citation needed]
Bleeding and blood clot risk[edit]
Cirrhosis can increase the risk of bleeding. The liver produces various proteins in the coagulation cascade (coagulation factors II, VII, IX, X, V, and VI). When damaged, the liver is impaired in its production of these proteins.[116] This will ultimately increase bleeding as clotting factors are diminished. Clotting function is estimated by lab values, mainly platelet count, prothrombin time (PT), and international normalized ratio (INR).
The American Gastroenterological Association (AGA) provided recommendations in 2021 in regards to coagulopathy management of cirrhotic patients in certain scenarios.[116]
- The AGA does not recommend for extensive pre-procedural testing, including repeated measurements of PT/INR or platelet count before patients with stable cirrhosis undergo common gastrointestinal procedures. Nor do they suggest the routine use of blood products, such as platelets, for bleeding prevention.[116] Cirrhosis is stable when there are no changes in baseline abnormalities of coagulation lab values.
- For patients with stable cirrhosis and low platelet count undergoing common low-risk procedures, the AGA does not recommend the routine use of thrombopoietin receptor agonists for bleeding prevention.[116]
- In hospitalized patients who meet standard guidelines for clot prevention, the AGA suggests standard prevention.[116]
- The AGA does not recommend in routine screening for portal vein thrombosis. If there is a portal vein thrombosis, the AGA suggests treatment by anticoagulation.[116]
- In the case of cirrhosis with atrial fibrillation, the AGA recommends using anticoagulation over no anticoagulation.[116]
Complications[edit]
Ascites[edit]
Salt restriction is often necessary, as cirrhosis leads to accumulation of salt (sodium retention). Diuretics may be necessary to suppress ascites. Diuretic options for inpatient treatment include aldosterone antagonists (spironolactone) and loop diuretics. Aldosterone antagonists are preferred for people who can take oral medications and are not in need of an urgent volume reduction. Loop diuretics can be added as additional therapy.[117]
Where salt restriction and the use of diuretics are ineffective then paracentesis may be the preferred option.[118] This procedure requires the insertion of a plastic tube into the peritoneal cavity. Human serum albumin solution is usually given to prevent complications from the rapid volume reduction. In addition to being more rapid than diuretics, 4–5 liters of paracentesis is more successful in comparison to diuretic therapy.[117]
Esophageal and gastric variceal bleeding[edit]
For portal hypertension, nonselective beta blockers such as propranolol or nadolol are commonly used to lower blood pressure over the portal system. In severe complications from portal hypertension, transjugular intrahepatic portosystemic shunting (TIPS) is occasionally indicated to relieve pressure on the portal vein. As this shunting can worsen hepatic encephalopathy, it is reserved for those patients at low risk of encephalopathy. TIPS is generally regarded only as a bridge to liver transplantation[119] or as a palliative measure.[citation needed] Balloon-occluded retrograde transvenous obliteration can be used to treat gastric variceal bleeding.[120]
Gastroscopy (endoscopic examination of the esophagus, stomach, and duodenum) is performed in cases of established cirrhosis. If esophageal varices are found, prophylactic local therapy may be applied such as sclerotherapy or banding, and beta blockers may be used.[121][122][123]
Hepatic encephalopathy[edit]
Hepatic encephalopathy is a potential complication of cirrhosis.[23] It may lead to functional neurological impairment ranging from mild confusion to coma.[23] Goal of treatment is reducing ammonia.[124] This can can achieved by administering lactulose or lactitol to increase potassium.[125] Hydration and nutritional support is also provided.[124] Protein uptake is encouraged.[126] The underlying cause may also need to be identified and treated. Causes include alcohol use, excess protein, gastrointestinal bleeding, infection, constipation, and vomiting/diarrhea.[124] Drugs like benzodiazepines, diuretics, or narcotics can also precipitate hepatic encephalopathy.[124] A low protein diet is recommended with gastrointestinal bleeding.[126] Rifaximin is administered if mental state does not improve in 48 hours.[124] Antibiotic treatment may need to be continued for at least 3 months.[124] The grading or severity of hepatic encephalopathy is determined by mental status.
| Grade | Mental status |
| Grade 1: Mild | Changes in behavior |
| Mild confusion | |
| Slurred speech | |
| Disordered sleep | |
| Grade 2: Moderate | Lethargy |
| Moderate confusion | |
| Grade 3: Severe | Stupor |
| Incoherent | |
| Sleeping but arousable | |
| Grade 4: Coma | Coma/Unresponsive |
Hepatorenal syndrome[edit]
Hepatorenal syndrome is a serious complication of end-stage cirrhosis when kidney damage is also involved.[128]
Spontaneous bacterial peritonitis[edit]
People with ascites due to cirrhosis are at risk of spontaneous bacterial peritonitis.
Portal hypertensive gastropathy[edit]
Portal hypertensive gastropathy refers to changes in the mucosa of the stomach in people with portal hypertension, and is associated with cirrhosis severity.[129]
Infection[edit]
Cirrhosis can cause immune system dysfunction, leading to infection. Signs and symptoms of infection may be nonspecific and are more difficult to recognize (for example, worsening encephalopathy but no fever).[130] Moreover, infections in cirrhosis are major triggers for other complications (ascites, variceal bleading, hepatic enecphalopathy, organ failures, death).[130][77][79]
Hepatocellular carcinoma[edit]
Hepatocellular carcinoma is the most common primary liver cancer, and the most common cause of death in people with cirrhosis.[131] Screening using an MRI scan can detect this cancer and is often carried out for early signs which has been shown to improve outcomes.[2][132]
Epidemiology[edit]
Cirrhosis deaths per million persons in 2012
9-44
45-68
69–88
89–104
105–122
123–152
153–169
170–204
205–282
283–867
Disability-adjusted life year for cirrhosis of the liver per 100,000 inhabitants in 2004.[133]
no data
<50
50-100
100-200
200-300
300-400
400-500
500-600
600-700
700-800
800-900
900–1000
>1000
Each year, approximately one million deaths are due to complications of cirrhosis, making cirrhosis the 11th most common cause of death globally.[134] Cirrhosis and chronic liver disease were the tenth leading cause of death for men and the twelfth for women in the United States in 2001, killing about 27,000 people each year.[135]
The cause of cirrhosis can vary; alcohol and non-alcoholic fatty liver disease are main causes in western and industrialized countries, whereas viral hepatitis is the predominant cause in low and middle-income countries.[134] Cirrhosis is more common in men than in women.[136] The cost of cirrhosis in terms of human suffering, hospital costs, and lost productivity is high.
Globally, age-standardized disability-adjusted life year (DALY) rates have decreased from 1990 to 2017, with the values going from 656.4 years per 100,000 people to 510.7 years per 100,000 people.[137] In males DALY rates have decreased from 903.1 years per 100,000 population in 1990, to 719.3 years per 100,000 population in 2017; in females the DALY rates have decreased from 415.5 years per 100,000 population in 1990, to 307.6 years per 100,000 population in 2017.[137] However, globally the total number of DALYs have increased by 10.9 million from 1990 to 2017, reaching the value of 41.4 million DALYs.[137]
Etymology[edit]
The word «cirrhosis» is a neologism derived from Greek: κίρρωσις; kirrhos κιρρός, meaning «yellowish, tawny» (the orange-yellow colour of the diseased liver) and the suffix -osis, i.e. «condition» in medical terminology.[138][139][140] While the clinical entity was known before, René Laennec gave it this name in an 1819 paper.[17]
See also[edit]
- Liver failure
References[edit]
- ^ a b c d e f g h i j k l m n o p «Cirrhosis». National Institute of Diabetes and Digestive and Kidney Diseases. April 23, 2014. Archived from the original on 9 June 2015. Retrieved 19 May 2015.
- ^ a b c d e Ferri FF (2019). Ferri’s clinical advisor 2019 : 5 books in 1. Philadelphia, PA. pp. 337–339. ISBN 9780323530422.
- ^ a b «Treatment for Cirrhosis | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. Archived from the original on 20 March 2021. Retrieved 6 March 2021.
- ^ a b Vos, Theo; et al. (October 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ a b c Wang H, Naghavi M, Allen C, Barber RM, Bhutta ZA, Carter A, et al. (GBD 2015 Mortality and Causes of Death Collaborators) (October 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1459–1544. doi:10.1016/s0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ^ a b c «Cirrhosis». nhs.uk. 29 June 2020. Archived from the original on 5 October 2017. Retrieved 8 February 2021.
- ^ a b c Dooley JS, Lok AS, Garcia-Tsao G, Pinzani M (8 June 2018). Sherlock’s diseases of the liver and biliary system (13th ed.). Hoboken, NJ. p. 82. ISBN 978-1-119-23756-3. OCLC 1019837000.
- ^ a b c d e f g h i j k «Symptoms & Causes of Cirrhosis | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. Archived from the original on 8 February 2021. Retrieved 8 February 2021.
- ^ «Definition & Facts for Cirrhosis | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. Archived from the original on 2021-03-11. Retrieved 2021-03-10.
- ^ a b Castera L, Friedrich-Rust M, Loomba R (April 2019). «Noninvasive Assessment of Liver Disease in Patients With Nonalcoholic Fatty Liver Disease». Gastroenterology. 156 (5): 1264–1281.e4. doi:10.1053/j.gastro.2018.12.036. PMC 7505052. PMID 30660725.
- ^ Ilić, G.; Karadžić, R.; Kostić-Banović, L.; Stojanović, J.; Antović, A. (February 2010). «Ultrastructural Changes In The Liver Of Intravenous Heroin Addiction». Bosnian Journal of Basic Medical Sciences. Vol. 10, no. 1. Journal of the Association of Basic Medical Sciences. pp. 36–43. PMC 5596609.
- ^ Naghavi M, Wang H, Lozano R, Davis A, Liang X, Zhou M, et al. (GBD 2013 Mortality Causes of Death Collaborators) (January 2015). «Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013». Lancet. 385 (9963): 117–171. doi:10.1016/S0140-6736(14)61682-2. PMC 4340604. PMID 25530442.
- ^ «Alcoholic liver disease». MedlinePlus Medical Encyclopedia. Archived from the original on 2019-05-27. Retrieved 2021-03-10.
- ^ «Heroin and Liver Damage». Banyan Medical Centers. Retrieved August 7, 2022.
- ^ a b «Definition & Facts of NAFLD & NASH | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. Archived from the original on 12 March 2021. Retrieved 9 March 2021.
- ^ Brower ST (2012). Elective general surgery : an evidence-based approach. New York: McGraw-Hill Medical. p. 36. ISBN 9781607951094. Archived from the original on 2017-09-08.
- ^ a b Roguin A (September 2006). «Rene Theophile Hyacinthe Laënnec (1781-1826): the man behind the stethoscope». Clinical Medicine & Research. 4 (3): 230–235. doi:10.3121/cmr.4.3.230. PMC 1570491. PMID 17048358.
- ^ a b c Samant H, Kothadia JP (2022). «Spider Angioma». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 29939595. Retrieved 2022-03-14.
- ^ Kur P, Kolasa-Wołosiuk A, Misiakiewicz-Has K, Wiszniewska B (April 2020). «Sex Hormone-Dependent Physiology and Diseases of Liver». International Journal of Environmental Research and Public Health. 17 (8): E2620. doi:10.3390/ijerph17082620. PMC 7216036. PMID 32290381.
- ^ «Palmar Erythema: Symptoms, Causes, Treatment, and More». Healthline. 2017-07-20. Retrieved 2022-03-16.
- ^ Serrao R, Zirwas M, English JC (2007). «Palmar erythema». American Journal of Clinical Dermatology. 8 (6): 347–56. doi:10.2165/00128071-200708060-00004. PMID 18039017. S2CID 33297418.
- ^ Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dhatariya K, et al. (2000). «Gynecomastia: Etiology, Diagnosis, and Treatment». In Feingold KR, Anawalt B, Boyce A, Chrousos G (eds.). Endotext. South Dartmouth (MA): MDText.com, Inc. PMID 25905330. Retrieved 2022-03-16.
- ^ a b c d e f g h i j k l m n o p q r s t Loscalzo J, Fauci AS, Kasper DL, Hauser SL, Longo DL, Jameson JL (2022). Harrison’s principles of internal medicine (21st ed.). New York. ISBN 978-1-264-26849-8. OCLC 1282172709.[page needed]
- ^ Kim SM, Yalamanchi S, Dobs AS (2017). «Male Hypogonadism and Liver Disease». In Winters SJ, Huhtaniemi IT (eds.). Male Hypogonadism. Cham: Springer International Publishing. pp. 219–234. doi:10.1007/978-3-319-53298-1_11. ISBN 978-3-319-53296-7.
- ^ Qi X, An S, Li H, Guo X (2017-08-24). «Recurrent scrotal edema in liver cirrhosis». AME Medical Journal. 2: 124. doi:10.21037/amj.2017.08.22.
- ^ Plauth M, Schütz ET (September 2002). «Cachexia in liver cirrhosis». International Journal of Cardiology. 85 (1): 83–87. doi:10.1016/s0167-5273(02)00236-x. PMID 12163212.
- ^ Jeffrey G (7 October 2021). «Cirrhosis of the Liver». emedicinehealth. Retrieved 15 March 2022.
- ^ «Jaundice — Hepatic and Biliary Disorders». Merck Manuals Professional Edition. Retrieved 2022-03-16.
- ^ a b c «Portal Hypertension». www.hopkinsmedicine.org. Retrieved 2022-03-16.
- ^ a b «Diagnosis of NAFLD & NASH | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. Archived from the original on 4 March 2021. Retrieved 9 March 2021.
- ^ a b Meseeha M, Attia M (2022). «Esophageal Varices». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 28846255. Retrieved 2022-03-16.
- ^ Masoodi I, Farooq O, Singh R, Ahmad N, Bhat M, Wani A (January 2009). «Courveilhier baumgarten syndrome: a rare syndrome revisited». International Journal of Health Sciences. 3 (1): 97–99. PMC 3068787. PMID 21475517.
- ^ «What is Cruveilhier-baumgarten Syndrome | Medindia». www.medindia.net. Retrieved 2022-03-17.
- ^ Witkowska AB, Jasterzbski TJ, Schwartz RA (2017). «Terry’s Nails: A Sign of Systemic Disease». Indian Journal of Dermatology. 62 (3): 309–311. doi:10.4103/ijd.IJD_98_17 (inactive 31 December 2022). PMC 5448267. PMID 28584375.
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) - ^ Abd El Meged MM (2019-04-01). «Patterns of nail changes in chronic liver diseases». Sohag Medical Journal. 23 (2): 166–170. doi:10.21608/smj.2019.47672. ISSN 1687-8353. S2CID 203813520.
- ^ a b c d e f g h i j k l m n o p q r s t u Friedman L (2018). Handbook of Liver Disease, 4e. Elsevier. ISBN 9780323478748.
- ^ Brennan D. «What Is Fetor Hepaticus?». WebMD. Retrieved 2022-03-17.
- ^ Samji NS, Buggs AM, Roy PK (2021-10-17). Anand BS (ed.). «Viral Hepatitis: Background, Pathophysiology, Etiology». Medscape. WebMD LLC.
- ^ a b Perz JF, Armstrong GL, Farrington LA, Hutin YJ, Bell BP (October 2006). «The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide». Journal of Hepatology. 45 (4): 529–538. doi:10.1016/j.jhep.2006.05.013. PMID 16879891.
- ^ «Cirrhosis of the Liver». American Liver Foundation. Retrieved 2022-03-17.
- ^ a b Stickel F, Datz C, Hampe J, Bataller R (March 2017). «Pathophysiology and Management of Alcoholic Liver Disease: Update 2016». Gut and Liver. 11 (2): 173–188. doi:10.5009/gnl16477. PMC 5347641. PMID 28274107.
- ^ a b c Friedman LS (2014). Current medical diagnosis and treatment 2014. [S.l.]: Mcgraw-Hill. pp. Chapter 16. Liver, Biliary Tract, & Pancreas Disorders. ISBN 978-0071806336.
- ^ a b c d Machado MV, Diehl AM (2018). «Pathogenesis of Nonalcoholic Fatty Liver Disease». In Sanyal AJ, Boyer TD, Terrault NA, Lindor KD (eds.). Zakim and Boyer’s Hepatology. pp. 369–390. doi:10.1016/c2013-0-19055-1. ISBN 9780323375917.
- ^ Golabi P, Paik JM, Arshad T, Younossi Y, Mishra A, Younossi ZM (August 2020). «Mortality of NAFLD According to the Body Composition and Presence of Metabolic Abnormalities». Hepatology Communications. 4 (8): 1136–1148. doi:10.1002/hep4.1534. PMC 7395070. PMID 32766474.
- ^ «Heroin Addiction Health Conditions». Bedrock Recovery Center. Retrieved August 7, 2022.
- ^ a b c «Primary Biliary Cholangitis: Symptoms, Causes, Treatments». Cleveland Clinic. Retrieved 2022-03-17.
- ^ Krause L (2018-09-29). Mena K (ed.). «Wilson’s Disease: Risk Factors, Causes, & Symptoms». Healthline. Retrieved 2022-03-17.
- ^ Coenen IC, Houwen RH (January 2019). «Indian childhood cirrhosis and other disorders of copper handling.». Clinical and Translational Perspectives on Wiloson Disease. Academic Press. pp. 449–453. doi:10.1016/B978-0-12-810532-0.00044-6. ISBN 9780128105320. S2CID 80994882.
- ^ Oiseth S, Jones L, Maza E. «Galactosemia». The Lecturio Medical Concept Library. Retrieved 15 August 2021.
- ^ Hammer GD, McPhee SJ, eds. (2010). Pathophysiology of disease : an introduction to clinical medicine (6th ed.). New York: McGraw-Hill Medical. pp. Chapter 14: Liver Disease. Cirrhosis. ISBN 978-0071621670.
- ^ Hassan S, Shah H, Shawana S (2020). «Dysregulated epidermal growth factor and tumor growth factor-beta receptor signaling through GFAP-ACTA2 protein interaction in liver fibrosis». Pakistan Journal of Medical Sciences. 36 (4): 782–787. doi:10.12669/pjms.36.4.1845. PMC 7260937. PMID 32494274.
- ^ Iredale JP (July 2003). «Cirrhosis: new research provides a basis for rational and targeted treatments». BMJ. 327 (7407): 143–147. doi:10.1136/bmj.327.7407.143. PMC 1126509. PMID 12869458. Archived from the original on 2004-10-29.
- ^ Puche JE, Saiman Y, Friedman SL (October 2013). «Hepatic stellate cells and liver fibrosis». Comprehensive Physiology. 3 (4): 1473–1492. doi:10.1002/cphy.c120035. ISBN 9780470650714. PMID 24265236.
- ^ Wu M, Sharma PG, Grajo JR (September 2020). «The Echogenic Liver: Steatosis and Beyond». Ultrasound Quarterly. 37 (4): 308–314. doi:10.1097/RUQ.0000000000000510. PMID 32956242. S2CID 221842327.
- ^ Yeom SK, Lee CH, Cha SH, Park CM (August 2015). «Prediction of liver cirrhosis, using diagnostic imaging tools». World Journal of Hepatology. 7 (17): 2069–2079. doi:10.4254/wjh.v7.i17.2069. PMC 4539400. PMID 26301049.
- ^ Chapman J, Goyal A, Azevedo AM. Splenomegaly. [Updated 2021 Aug 11]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: [1]
- ^ a b c d Iranpour P, Lall C, Houshyar R, Helmy M, Yang A, Choi JI, et al. (January 2016). «Altered Doppler flow patterns in cirrhosis patients: an overview». Ultrasonography. 35 (1): 3–12. doi:10.14366/usg.15020. PMC 4701371. PMID 26169079.
- ^ Berzigotti A, Seijo S, Reverter E, Bosch J (February 2013). «Assessing portal hypertension in liver diseases». Expert Review of Gastroenterology & Hepatology. 7 (2): 141–155. doi:10.1586/egh.12.83. PMID 23363263. S2CID 31057915.
- ^ a b Goncalvesova E, Varga I, Tavacova M, Lesny P (2013). «Changes of portal vein flow in heart failure patients with liver congestion». European Heart Journal. 34 (suppl 1): P627. doi:10.1093/eurheartj/eht307.P627. ISSN 0195-668X.
- ^ a b Dietrich CF (2009). «Ultrasonography». In Dancygier H (ed.). Clinical Hepatology: Principles and Practice of Hepatobiliary Diseases. Vol. 1. Springer Science & Business Media. p. 367. ISBN 9783540938422. Archived from the original on 2018-11-30.
- ^ «Elastography: MedlinePlus Medical Test». medlineplus.gov. Retrieved 2022-03-21.
- ^ Barr RG, Ferraioli G, Palmeri ML, Goodman ZD, Garcia-Tsao G, Rubin J, et al. (September 2015). «Elastography Assessment of Liver Fibrosis: Society of Radiologists in Ultrasound Consensus Conference Statement». Radiology. 276 (3): 845–861. doi:10.1148/radiol.2015150619. PMID 26079489.
- ^ Srinivasa Babu A, Wells ML, Teytelboym OM, Mackey JE, Miller FH, Yeh BM, et al. (2016-11-01). «Elastography in Chronic Liver Disease: Modalities, Techniques, Limitations, and Future Directions». Radiographics. 36 (7): 1987–2006. doi:10.1148/rg.2016160042. PMC 5584553. PMID 27689833.
- ^ a b Foucher J, Chanteloup E, Vergniol J, Castéra L, Le Bail B, Adhoute X, et al. (March 2006). «Diagnosis of cirrhosis by transient elastography (FibroScan): a prospective study». Gut. 55 (3): 403–408. doi:10.1136/gut.2005.069153. PMC 1856085. PMID 16020491.
- ^ Pavlov CS, Casazza G, Nikolova D, Tsochatzis E, Burroughs AK, Ivashkin VT, Gluud C (January 2015). «Transient elastography for diagnosis of stages of hepatic fibrosis and cirrhosis in people with alcoholic liver disease». The Cochrane Database of Systematic Reviews. 1 (1): CD010542. doi:10.1002/14651858.cd010542.pub2. PMC 7081746. PMID 25612182.
- ^ Udell JA, Wang CS, Tinmouth J, FitzGerald JM, Ayas NT, Simel DL, et al. (February 2012). «Does this patient with liver disease have cirrhosis?». JAMA. 307 (8): 832–842. doi:10.1001/jama.2012.186. PMID 22357834.
- ^ Gudowska M, Gruszewska E, Panasiuk A, Cylwik B, Świderska M, Flisiak R, et al. (February 2016). «Selected Noninvasive Markers in Diagnosing Liver Diseases». Laboratory Medicine. 47 (1): 67–72. doi:10.1093/labmed/lmv015. PMID 26715612.
- ^ a b Maddrey WC, Schiff ER, Sorrell MF, eds. (1999). Schiff’s diseases of the liver (11th ed.). Chichester, West Sussex, UK: John Wiley & Sons. pp. Evaluation of the Liver A: Laboratory Test. ISBN 978-0-470-65468-2.
- ^ Longo DL, Fauci AS, Kasper DL, Hauser SL, Jameson JL, Loscalzo J, eds. (2012). Harrison’s principles of internal medicine (18th ed.). New York: McGraw-Hill. pp. Chapter 308. Cirrhosis and Its Complications. ISBN 9780071748896.
- ^ Slater JS, Esherick DS, Clark ED (2012-12-18). Current practice guidelines in primary care 2013. New York: McGraw-Hill Medical. pp. Chapter 3: Disease Management. ISBN 978-0071797504.
- ^ Van Thiel DH, Gavaler JS, Schade RR (February 1985). «Liver disease and the hypothalamic pituitary gonadal axis». Seminars in Liver Disease. 5 (1): 35–45. doi:10.1055/s-2008-1041756. PMID 3983651.
- ^ Halfon P, Munteanu M, Poynard T (September 2008). «FibroTest-ActiTest as a non-invasive marker of liver fibrosis». Gastroenterologie Clinique et Biologique. 32 (6 Suppl 1): 22–39. doi:10.1016/S0399-8320(08)73991-5. PMID 18973844.
- ^ Tornai D, Antal-Szalmas P, Tornai T, Papp M, Tornai I, Sipeki N, et al. (March 2021). «Abnormal ferritin levels predict development of poor outcomes in cirrhotic outpatients: a cohort study». BMC Gastroenterology. 21 (1): 94. doi:10.1186/s12876-021-01669-w. PMC 7923668. PMID 33653274.
- ^ Maiwall R, Kumar S, Chaudhary AK, Maras J, Wani Z, Kumar C, et al. (July 2014). «Serum ferritin predicts early mortality in patients with decompensated cirrhosis». Journal of Hepatology. 61 (1): 43–50. doi:10.1016/j.jhep.2014.03.027. PMID 24681346.
- ^ a b c Papp M, Vitalis Z, Altorjay I, Tornai I, Udvardy M, Harsfalvi J, et al. (April 2012). «Acute phase proteins in the diagnosis and prediction of cirrhosis associated bacterial infections». Liver International. 32 (4): 603–611. doi:10.1111/j.1478-3231.2011.02689.x. PMID 22145664. S2CID 10326820. Archived from the original on 2021-04-25. Retrieved 2021-04-25.
- ^ Papp M, Tornai T, Vitalis Z, Tornai I, Tornai D, Dinya T, et al. (November 2016). «Presepsin teardown — pitfalls of biomarkers in the diagnosis and prognosis of bacterial infection in cirrhosis». World Journal of Gastroenterology. 22 (41): 9172–9185. doi:10.3748/wjg.v22.i41.9172. PMC 5107598. PMID 27895404.
- ^ a b Tornai T, Vitalis Z, Sipeki N, Dinya T, Tornai D, Antal-Szalmas P, et al. (November 2016). «Macrophage activation marker, soluble CD163, is an independent predictor of short-term mortality in patients with cirrhosis and bacterial infection». Liver International. 36 (11): 1628–1638. doi:10.1111/liv.13133. hdl:2437/223046. PMID 27031405. S2CID 206174528. Archived from the original on 2021-04-25. Retrieved 2021-04-25.
- ^ Laursen TL, Rødgaard-Hansen S, Møller HJ, Mortensen C, Karlsen S, Nielsen DT, et al. (April 2017). «The soluble mannose receptor is released from the liver in cirrhotic patients, but is not associated with bacterial translocation». Liver International. 37 (4): 569–575. doi:10.1111/liv.13262. PMID 27706896. S2CID 46856702.
- ^ a b Tornai D, Vitalis Z, Jonas A, Janka T, Foldi I, Tornai T, et al. (September 2021). «Increased sTREM-1 levels identify cirrhotic patients with bacterial infection and predict their 90-day mortality». Clinics and Research in Hepatology and Gastroenterology. 45 (5): 101579. doi:10.1016/j.clinre.2020.11.009. PMID 33773436.
- ^ Qin N, Yang F, Li A, Prifti E, Chen Y, Shao L, et al. (September 2014). «Alterations of the human gut microbiome in liver cirrhosis». Nature. 513 (7516): 59–64. Bibcode:2014Natur.513…59Q. doi:10.1038/nature13568. PMID 25079328. S2CID 205239766.
- ^ a b McCarty TR, Bazarbashi AN, Njei B, Ryou M, Aslanian HR, Muniraj T (September 2020). «Endoscopic Ultrasound-Guided, Percutaneous, and Transjugular Liver Biopsy: A Comparative Systematic Review and Meta-Analysis». Clinical Endoscopy. 53 (5): 583–593. doi:10.5946/ce.2019.211. PMC 7548145. PMID 33027584.
- ^ a b Mok SR, Diehl DL (January 2019). «The Role of EUS in Liver Biopsy». Current Gastroenterology Reports. 21 (2): 6. doi:10.1007/s11894-019-0675-8. PMID 30706151. S2CID 73440352.
- ^ Diehl DL (April 2019). «Endoscopic Ultrasound-guided Liver Biopsy». Gastrointestinal Endoscopy Clinics of North America. 29 (2): 173–186. doi:10.1016/j.giec.2018.11.002. PMC 6383155. PMID 30846147.
- ^ Grant A, Neuberger J (October 1999). «Guidelines on the use of liver biopsy in clinical practice. British Society of Gastroenterology». Gut. 45 (Suppl 4): IV1–IV11. doi:10.1136/gut.45.2008.iv1. PMC 1766696. PMID 10485854. Archived from the original on 2007-06-30.
The main cause of mortality after percutaneous liver biopsy is intraperitoneal haemorrhage as shown in a retrospective Italian study of 68,000 percutaneous liver biopsies, in which all six patients who died did so from intraperitoneal haemorrhage. Three of these patients had had a laparotomy, and all had either cirrhosis or malignant disease, both of which are risk factors for bleeding.
- ^ a b c Brenner D, Rippe RA (2003). «Pathogenesis of Hepatic Fibrosis». In Yamada (ed.). Textbook of Gastroenterology. Vol. 2 (4th ed.). Lippincott Williams & Wilkins. ISBN 978-0-7817-2861-4.
- ^ a b c d Boyd A, Cain O, Chauhan A, Webb GJ (2020). «Medical liver biopsy: background, indications, procedure and histopathology». Frontline Gastroenterology. 11 (1): 40–47. doi:10.1136/flgastro-2018-101139. ISSN 2041-4137. PMC 6914302. PMID 31885839.
-«This is an open access article distributed in accordance with the Creative Commons Attribution 4.0 Unported (CC BY 4.0) license» - ^ Giallourakis CC, Rosenberg PM, Friedman LS (November 2002). «The liver in heart failure». Clinics in Liver Disease. 6 (4): 947–67, viii–ix. doi:10.1016/S1089-3261(02)00056-9. PMID 12516201.
- ^ Heathcote EJ (November 2003). «Primary biliary cirrhosis: historical perspective». Clinics in Liver Disease. 7 (4): 735–740. doi:10.1016/S1089-3261(03)00098-9. PMID 14594128.
- ^ Bashar S, Savio J (2020). «Hepatic Cirrhosis». StatPearls. StatPearls. PMID 29494026. Archived from the original on 2020-09-03. Retrieved 2019-11-11.
- ^ a b c d e f g h Tsoris A, Marlar CA (2022). «Use Of The Child Pugh Score In Liver Disease». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 31194448. Retrieved 2022-03-23.
- ^ Shakerdge K. «What Are the MELD and Child-Pugh Scores for Liver Disease?». WebMD. Retrieved 2022-03-23.
- ^ a b c d e «Child-Pugh Score for Cirrhosis Mortality». MDCalc. Retrieved 2022-03-23.
- ^ Singal AK, Kamath PS (March 2013). «Model for End-stage Liver Disease». Journal of Clinical and Experimental Hepatology. 3 (1): 50–60. doi:10.1016/j.jceh.2012.11.002. PMC 3940492. PMID 25755471.
- ^ Peng Y, Qi X, Guo X (February 2016). «Child-Pugh Versus MELD Score for the Assessment of Prognosis in Liver Cirrhosis: A Systematic Review and Meta-Analysis of Observational Studies». Medicine. 95 (8): e2877. doi:10.1097/MD.0000000000002877. PMC 4779019. PMID 26937922.
- ^ a b «MELD Score (Model For End-Stage Liver Disease) (12 and older)». MDCalc. Retrieved 2022-03-24.
- ^ «MELDNa/MELD-Na Score for Liver Cirrhosis». MDCalc. Retrieved 2022-03-24.
- ^ a b c Kartoun U, Corey KE, Simon TG, Zheng H, Aggarwal R, Ng K, Shaw SY (2017). «The MELD-Plus: A generalizable prediction risk score in cirrhosis». PLOS ONE. 12 (10): e0186301. Bibcode:2017PLoSO..1286301K. doi:10.1371/journal.pone.0186301. PMC 5656314. PMID 29069090.
- ^ Patch D, Armonis A, Sabin C, Christopoulou K, Greenslade L, McCormick A, et al. (February 1999). «Single portal pressure measurement predicts survival in cirrhotic patients with recent bleeding». Gut. 44 (2): 264–269. doi:10.1136/gut.44.2.264. PMC 1727391. PMID 9895388. Archived from the original on 2008-05-28.
- ^ «Cirrhosis». The Lecturio Medical Concept Library. 28 September 2020. Archived from the original on 9 July 2021. Retrieved 9 July 2021.
- ^ Wadhawan M, Anand AC (March 2016). «Coffee and Liver Disease». Journal of Clinical and Experimental Hepatology. 6 (1): 40–46. doi:10.1016/j.jceh.2016.02.003. PMC 4862107. PMID 27194895.
- ^ Ruiz-Margáin A, Macías-Rodríguez RU, Ríos-Torres SL, Román-Calleja BM, Méndez-Guerrero O, Rodríguez-Córdova P, Torre A (January 2018). «Effect of a high-protein, high-fiber diet plus supplementation with branched-chain amino acids on the nutritional status of patients with cirrhosis». Revista de Gastroenterologia de Mexico. 83 (1): 9–15. doi:10.1016/j.rgmx.2017.02.005. PMID 28408059.
- ^ McDowell HR, Chuah CS, Tripathi D, Stanley AJ, Forrest EH, Hayes PC (February 2021). «Carvedilol is associated with improved survival in patients with cirrhosis: a long-term follow-up study». Alimentary Pharmacology & Therapeutics. 53 (4): 531–539. doi:10.1111/apt.16189 (inactive 31 December 2022). PMID 33296526.
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) - ^ Newsome PN, Buchholtz K, Cusi K, Linder M, Okanoue T, Ratziu V, et al. (March 2021). «A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis». The New England Journal of Medicine. 384 (12): 1113–1124. doi:10.1056/NEJMoa2028395. PMID 33185364. S2CID 226850568.
- ^ Loomba R, Noureddin M, Kowdley KV, Kohli A, Sheikh A, Neff G, et al. (February 2021). «Combination Therapies Including Cilofexor and Firsocostat for Bridging Fibrosis and Cirrhosis Attributable to NASH». Hepatology. 73 (2): 625–643. doi:10.1002/hep.31622. PMID 33169409. S2CID 226295213.
- ^ Francque SM, Bedossa P, Ratziu V, Anstee QM, Bugianesi E, Sanyal AJ, et al. (October 2021). «A Randomized, Controlled Trial of the Pan-PPAR Agonist Lanifibranor in NASH». The New England Journal of Medicine. 385 (17): 1547–1558. doi:10.1056/NEJMoa2036205. hdl:1854/LU-8731444. PMID 34670042. S2CID 239051427.
- ^ Schweighardt AE, Juba KM (December 2018). «A Systematic Review of the Evidence Behind Use of Reduced Doses of Acetaminophen in Chronic Liver Disease». Journal of Pain & Palliative Care Pharmacotherapy. 32 (4): 226–239. doi:10.1080/15360288.2019.1611692. PMID 31206302. S2CID 190535151.
- ^ «Nonalcoholic Fatty Liver Disease». The Lecturio Medical Concept Library. Retrieved 15 August 2021.
- ^ Björnsson ES (February 2016). «Hepatotoxicity by Drugs: The Most Common Implicated Agents». International Journal of Molecular Sciences. 17 (2): 224. doi:10.3390/ijms17020224. PMC 4783956. PMID 26861310.
- ^ Aamann L, Dam G, Rinnov AR, Vilstrup H, Gluud LL, et al. (Cochrane Hepato-Biliary Group) (December 2018). «Physical exercise for people with cirrhosis». The Cochrane Database of Systematic Reviews. 2018 (12): CD012678. doi:10.1002/14651858.CD012678.pub2. PMC 6517144. PMID 30575956.
- ^ «E-medicine liver transplant outlook and survival rates». Emedicinehealth.com. 2009-06-09. Archived from the original on 2009-07-14. Retrieved 2009-09-06.
- ^ Kamath PS, Kim WR (March 2007). «The model for end-stage liver disease (MELD)». Hepatology. 45 (3): 797–805. doi:10.1002/hep.21563. PMID 17326206. S2CID 10440305.
- ^ Chavez-Tapia NC, Barrientos-Gutierrez T, Tellez-Avila FI, Soares-Weiser K, Uribe M (September 2010). «Antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding». The Cochrane Database of Systematic Reviews. 2010 (9): CD002907. doi:10.1002/14651858.CD002907.pub2. PMC 7138054. PMID 20824832.
- ^ Ferrell B, Connor SR, Cordes A, Dahlin CM, Fine PG, Hutton N, et al. (June 2007). «The national agenda for quality palliative care: the National Consensus Project and the National Quality Forum». Journal of Pain and Symptom Management. 33 (6): 737–744. doi:10.1016/j.jpainsymman.2007.02.024. PMID 17531914.
- ^ a b Sanchez W, Talwalkar JA (March 2006). «Palliative care for patients with end-stage liver disease ineligible for liver transplantation». Gastroenterology Clinics of North America. 35 (1): 201–219. doi:10.1016/j.gtc.2005.12.007. PMID 16530121.
- ^ Poonja Z, Brisebois A, van Zanten SV, Tandon P, Meeberg G, Karvellas CJ (April 2014). «Patients with cirrhosis and denied liver transplants rarely receive adequate palliative care or appropriate management». Clinical Gastroenterology and Hepatology. 12 (4): 692–698. doi:10.1016/j.cgh.2013.08.027. PMID 23978345.
- ^ a b c d e f g O’Shea RS, Davitkov P, Ko CW, Rajasekhar A, Su GL, Sultan S, et al. (November 2021). «AGA Clinical Practice Guideline on the Management of Coagulation Disorders in Patients With Cirrhosis». Gastroenterology. 161 (5): 1615–1627.e1. doi:10.1053/j.gastro.2021.08.015. PMID 34579936. S2CID 238202670.
- ^ a b Moore KP, Aithal GP (October 2006). «Guidelines on the management of ascites in cirrhosis». Gut. 55 (Suppl 6): vi1–v12. doi:10.1136/gut.2006.099580. PMC 1860002. PMID 16966752.
- ^ Piano S, Tonon M, Angeli P (February 2018). «Management of ascites and hepatorenal syndrome». Hepatology International. 12 (Suppl 1): 122–134. doi:10.1007/s12072-017-9815-0. PMID 28836115. S2CID 3708859.
- ^ Sellers CM, Nezami N, Schilsky ML, Kim HS (April 2019). «Transjugular intrahepatic portosystemic shunt as a bridge to liver transplant: Current state and future directions». Transplantation Reviews. 33 (2): 64–71. doi:10.1016/j.trre.2018.10.004. PMID 30477811. S2CID 53736623.
- ^ Lee EW, Shahrouki P, Alanis L, Ding P, Kee ST (June 2019). «Management Options for Gastric Variceal Hemorrhage». JAMA Surgery. 154 (6): 540–548. doi:10.1001/jamasurg.2019.0407. PMID 30942880. S2CID 93000660.
- ^ «Gastroscopy – examination of oesophagus and stomach by endoscope». BUPA. December 2006. Archived from the original on 2007-10-06. Retrieved 2007-10-07.
- ^ National Digestive Diseases Information Clearinghouse (November 2004). «Upper Endoscopy». National Institutes of Health. Retrieved 2007-10-07.
- ^ «What is Upper GI Endoscopy?». Patient Center — Procedures. American Gastroenterological Association. Archived from the original on 2007-09-28. Retrieved 2007-10-07.
- ^ a b c d e f Ferenci P (Feb 2022). «Hepatic encephalopathy in adults: Treatment». www.uptodate.com. Retrieved 2022-03-22.
- ^ Patidar KR, Bajaj JS (November 2015). «Covert and Overt Hepatic Encephalopathy: Diagnosis and Management». Clinical Gastroenterology and Hepatology. 13 (12): 2048–2061. doi:10.1016/j.cgh.2015.06.039. PMC 4618040. PMID 26164219.
- ^ a b Merli M, Berzigotti A, Zelber-Sagi S, Dasarathy S, Montagnese S, Genton L, et al. (January 2019). «EASL Clinical Practice Guidelines on nutrition in chronic liver disease». Journal of Hepatology. 70 (1): 172–193. doi:10.1016/j.jhep.2018.06.024. PMC 6657019. PMID 30144956.
- ^ Weissenborn K (February 2019). «Hepatic Encephalopathy: Definition, Clinical Grading and Diagnostic Principles». Drugs. 79 (Suppl 1): 5–9. doi:10.1007/s40265-018-1018-z. PMC 6416238. PMID 30706420.
- ^ Francoz C, Durand F, Kahn JA, Genyk YS, Nadim MK (May 2019). «Hepatorenal Syndrome». Clinical Journal of the American Society of Nephrology. 14 (5): 774–781. doi:10.2215/CJN.12451018. PMC 6500947. PMID 30996046.
- ^ Kim MY, Choi H, Baik SK, Yea CJ, Won CS, Byun JW, et al. (December 2010). «Portal hypertensive gastropathy: correlation with portal hypertension and prognosis in cirrhosis». Digestive Diseases and Sciences. 55 (12): 3561–3567. doi:10.1007/s10620-010-1221-6. PMID 20407828. S2CID 24332780.
- ^ a b Sipeki N, Antal-Szalmas P, Lakatos PL, Papp M (March 2014). «Immune dysfunction in cirrhosis». World Journal of Gastroenterology. 20 (10): 2564–2577. doi:10.3748/wjg.v20.i10.2564. PMC 3949265. PMID 24627592.
- ^ Forner A, Llovet JM, Bruix J (March 2012). «Hepatocellular carcinoma». Lancet. 379 (9822): 1245–1255. doi:10.1016/S0140-6736(11)61347-0. PMID 22353262. S2CID 24927898.
- ^ Singal AG, Pillai A, Tiro J (April 2014). «Early detection, curative treatment, and survival rates for hepatocellular carcinoma surveillance in patients with cirrhosis: a meta-analysis». PLOS Medicine. 11 (4): e1001624. doi:10.1371/journal.pmed.1001624. PMC 3972088. PMID 24691105.
- ^ «WHO Disease and injury country estimates». World Health Organization. 2009. Archived from the original on 2009-11-11. Retrieved Nov 11, 2009.
- ^ a b Asrani SK, Devarbhavi H, Eaton J, Kamath PS (January 2019). «Burden of liver diseases in the world». Journal of Hepatology. 70 (1): 151–171. doi:10.1016/j.jhep.2018.09.014. PMID 30266282. S2CID 52882095.
- ^ Anderson RN, Smith BL (November 2003). «Deaths: leading causes for 2001». National Vital Statistics Reports. 52 (9): 1–85. PMID 14626726.
- ^ Tamparo C (2011). Diseases of the Human Body (5th ed.). Philadelphia, PA: F. A. Davis Company. p. 422. ISBN 978-0-8036-2505-1.
- ^ a b c Sepanlou SG, Safiri S, Bisignano C, Ikuta KS, Merat S, Saberifiroozi M, et al. (GBD 2017 Cirrhosis Collaborators) (March 2020). «The global, regional, and national burden of cirrhosis by cause in 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017». The Lancet. Gastroenterology & Hepatology. 5 (3): 245–266. doi:10.1016/S2468-1253(19)30349-8. PMC 7026710. PMID 31981519.
- ^ κιρρός. Liddell, Henry George; Scott, Robert; A Greek–English Lexicon at the Perseus Project.
- ^ Harper, Douglas. «cirrhosis». Online Etymology Dictionary.
- ^ Harper, Douglas. «-osis». Online Etymology Dictionary.
External links[edit]
- Cirrhosis of the Liver at the National Digestive Diseases Information Clearinghouse (NDDIC). NIH Publication No. 04-1134, December 2003.
- «Cirrhosis». MedlinePlus. U.S. National Library of Medicine.
| Cirrhosis | |
|---|---|
| Other names | Cirrhosis of the liver, hepatic cirrhosis |
 |
|
| Cross-section of human liver with cirrhosis | |
| Pronunciation |
|
| Specialty | Gastroenterology, Hepatology |
| Symptoms | Tiredness, itchiness, swelling in the lower legs, jaundice, easily bruising, fluid build-up in the abdomen[1] |
| Complications | Spontaneous bacterial peritonitis, hepatic encephalopathy, dilated veins in the esophagus, liver cancer[1] |
| Usual onset | Over months or years[1] |
| Duration | Long term[1] |
| Causes | Alcoholic liver disease, hepatitis B, hepatitis C, non-alcoholic steatohepatitis |
| Diagnostic method | Blood tests, medical imaging, liver biopsy[2][1] |
| Prevention | Vaccination (such as hepatitis B), avoiding alcohol,[1] losing weight, exercising, low-carbohydrate diet, controlling hypertension and diabetes may help in those with NAFLD or NASH |
| Treatment | Depends on underlying cause[3] |
| Frequency | 2.8 million (2015)[4] |
| Deaths | 1.3 million (2015)[5] |
Cirrhosis, also known as liver cirrhosis or hepatic cirrhosis, and end-stage liver disease, is the impaired liver function caused by the formation of scar tissue known as fibrosis due to damage caused by liver disease.[6] Damage causes tissue repair and subsequent formation of scar tissue, which over time can replace normal functioning tissue, leading to the impaired liver function of cirrhosis.[6][7] The disease typically develops slowly over months or years.[1] Early symptoms may include tiredness, weakness, loss of appetite, unexplained weight loss, nausea and vomiting, and discomfort in the right upper quadrant of the abdomen.[8] As the disease worsens, symptoms may include itchiness, swelling in the lower legs, fluid build-up in the abdomen, jaundice, bruising easily, and the development of spider-like blood vessels in the skin.[8] The fluid build-up in the abdomen may become spontaneously infected.[1] More serious complications include hepatic encephalopathy, bleeding from dilated veins in the esophagus, stomach, or intestines, and liver cancer.[9]
Cirrhosis is most commonly caused by alcoholic liver disease, non-alcoholic steatohepatitis (NASH – the progressive form of non-alcoholic fatty liver disease),[10] heroin abuse,[11] chronic hepatitis B, and chronic hepatitis C.[8][12] Heavy drinking over a number of years can cause alcoholic liver disease.[13] Liver damage has also been attributed to heroin usage over an extended period of time as well.[14] NASH has a number of causes, including obesity, high blood pressure, abnormal levels of cholesterol, type 2 diabetes, and metabolic syndrome.[15] Less common causes of cirrhosis include autoimmune hepatitis, primary biliary cholangitis, and primary sclerosing cholangitis that disrupts bile duct function, genetic disorders such as Wilson’s disease and hereditary hemochromatosis, and chronic heart failure with liver congestion.[8]
Diagnosis is based on blood tests, medical imaging, and liver biopsy.[2][1]
Hepatitis B vaccine can prevent hepatitis B and the development of cirrhosis, but no vaccination against hepatitis C is available.[1] No specific treatment for cirrhosis is known, but many of the underlying causes may be treated by a number of medications that may slow or prevent worsening of the condition.[3] Avoiding alcohol is recommended in all cases.[1] Hepatitis B and C may be treatable with antiviral medications.[1] Autoimmune hepatitis may be treated with steroid medications.[1] Ursodiol may be useful if the disease is due to blockage of the bile duct.[1] Other medications may be useful for complications such as abdominal or leg swelling, hepatic encephalopathy, and dilated esophageal veins.[1] If cirrhosis leads to liver failure, a liver transplant may be an option.[15]
Cirrhosis affected about 2.8 million people and resulted in 1.3 million deaths in 2015.[4][5] Of these deaths, alcohol caused 348,000, hepatitis C caused 326,000, and hepatitis B caused 371,000.[5] In the United States, more men die of cirrhosis than women.[1] The first known description of the condition is by Hippocrates in the fifth century BCE.[16] The term «cirrhosis» was derived in 1819 from the Greek word «kirrhos,» which describes the yellowish color of a diseased liver.[17]
Signs and symptoms[edit]
Person with cirrhosis and associated pain in the right upper region of the abdomen
Cirrhosis can take quite a long time to develop, and symptoms may be slow to emerge.[8] Some early symptoms include tiredness, weakness, loss of appetite, weight loss, and nausea.[8] People may also feel discomfort in the right upper abdomen around the liver.[8]
As cirrhosis progresses, symptoms can include neurological changes.[8] This can consist of cognitive impairments, confusion, memory loss, sleep disorders, and personality changes.[8]
Worsening cirrhosis can cause a build-up of fluid in different parts of the body such as the legs (edema) and abdomen (ascites).[8] Other signs of advancing disease include itchy skin, bruising easily, dark urine, and yellowing of the skin.[8]
Liver dysfunction[edit]
These features are a direct consequence of liver cells not functioning:
- Spider angiomata or spider nevi happen when there is dilatation of vasculature beneath the skin surface.[18] There is a central, red spot with reddish extensions that radiate outward. This creates a visual effect that resembles a spider. It occurs in about one-third of cases.[18] The likely cause is an increase in estrogen.[18] Cirrhosis causes a rise of estrogen due to increased conversion of androgens into estrogen.[19]
- Palmar erythema presents as reddish palms below the thumb and little finger. This is seen in about 23% of cirrhosis cases.[20] This is a result of increased estrogen.[21]
- Gynecomastia, or the increase of breast size in men, is caused by increased estradiol (a potent type of estrogen).[22] This can occur in up to two-thirds of cases.[23]
- Hypogonadism signifies a decreased functionality of the gonads.[24] This can result in impotence, infertility, loss of sexual drive, and testicular atrophy. A swollen scrotum may also be evident.[25]
- Liver size can be enlarged, normal, or shrunken in people with cirrhosis.[26] As the disease progresses, the liver will typically shrink due to the result of scarring.[27]
- Jaundice is the yellowing of the skin. It can additionally cause yellowing of mucous membranes notably of the white of the eyes. This phenomenon is due to increased levels of bilirubin, which may also cause the urine to be dark-colored.[28]
Portal hypertension[edit]
Liver cirrhosis makes it hard for blood to flow in the portal venous system.[29] This resistance creates a backup of blood and increases pressure.[29] This results in portal hypertension. Effects of portal hypertension include:
- Ascites is a build-up of fluid in the peritoneal cavity in the abdomen[30]
- An enlarged spleen in 35 to 50% of cases[6]
- Esophageal varices and gastric varices result from collateral circulation in the esophagus and stomach (a process called portacaval anastomosis).[31] When the blood vessels in this circulation become enlarged, they are called varices. Varices are more likely to rupture at this point.[7] Variceal rupture often leads to severe bleeding, which can be fatal.[31]
- Caput medusae are dilated paraumbilical collateral veins due to portal hypertension.[29] Blood from the portal venous system may be forced through the paraumbilical veins and ultimately to the abdominal wall veins. The created pattern resembles the head of Medusa, hence the name.[7]
- Cruveilhier-Baumgarten bruit is bruit in the epigastric region (on examination by stethoscope).[32] It is due to extra connections forming between the portal system and the paraumbilical veins.[33]
Other nonspecific signs[edit]
Some signs that may be present include changes in the nails (such as Muehrcke’s lines, Terry’s nails, and nail clubbing).[34][35] Additional changes may be seen in the hands (Dupuytren’s contracture) as well as the skin/bones (hypertrophic osteoarthropathy).[23]
Advanced disease[edit]
As the disease progresses, complications may develop. In some people, these may be the first signs of the disease.
- Bruising and bleeding can result from decreased production of clotting factors[36]
- Hepatic encephalopathy (HE) occurs when ammonia and related substances build up in the blood.[36] This build-up affects brain function when they are not cleared from the blood by the liver. Symptoms can include unresponsiveness, forgetfulness, trouble concentrating, changes in sleep habits, or psychosis. One classic physical examination finding is asterixis.[23] This is the asynchronous flapping of outstretched, dorsiflexed hands.[23] Fetor hepaticus is a musty breath odor resulting from increased dimethyl sulfide and is a feature of HE.[37]
- Sensitivity to medication can be caused by decreased metabolism of the active compounds
- Acute kidney injury (particularly hepatorenal syndrome) [23]
- Cachexia associated with muscle wasting and weakness [36]
Causes[edit]
Cirrhosis has many possible causes, and more than one cause may be present. History taking is of importance in trying to determine the most likely cause.[2] Globally, 57% of cirrhosis is attributable to either hepatitis B (30%) or hepatitis C (27%).[38][39] Alcohol use disorder is another major cause, accounting for about 20-40% of the cases.[39][23]
Common causes[edit]
- Alcoholic liver disease (ALD, or alcoholic cirrhosis) develops for 10–20% of individuals who drink heavily for a decade or more.[40] Alcohol seems to injure the liver by blocking the normal metabolism of protein, fats, and carbohydrates.[41] This injury happens through the formation of acetaldehyde from alcohol. Acetaldehyde is reactive and leads to the accumulation of other reactive products in the liver.[23] People with ALD may also have concurrent alcoholic hepatitis. Associated symptoms are fever, hepatomegaly, jaundice, and anorexia.[41] AST and ALT blood levels are both elevated, but at less than 300 IU/liter, with an AST:ALT ratio > 2.0, a value rarely seen in other liver diseases.[42] In the United States, 40% of cirrhosis-related deaths are due to alcohol.[23]
- In non-alcoholic fatty liver disease (NAFLD), fat builds up in the liver and eventually causes scar tissue.[43] This type of disorder can be caused by obesity, diabetes, malnutrition, coronary artery disease, and steroids.[43][44] Though similar in signs to alcoholic liver disease, no history of notable alcohol use is found. Blood tests and medical imaging are used to diagnose NAFLD and NASH, and sometimes a liver biopsy is needed.[30]
- Chronic hepatitis C, an infection with the hepatitis C virus, causes inflammation of the liver and a variable grade of damage to the organ.[36] Over several decades, this inflammation and damage can lead to cirrhosis. Among patients with chronic hepatitis C, 20–30% develop cirrhosis.[36][23] Cirrhosis caused by hepatitis C and alcoholic liver disease are the most common reasons for liver transplant.[23] Both hepatitis C and hepatitis B-related cirrhosis can also be attributed with heroin addiction.[45]
- Chronic hepatitis B causes liver inflammation and injury that over several decades can lead to cirrhosis.[36] Hepatitis D is dependent on the presence of hepatitis B and accelerates cirrhosis in co-infection.[36]
Less common causes[edit]
- In primary biliary cholangitis (previously known as primary biliary cirrhosis), the bile ducts become damaged by an autoimmune process.[36] This leads to liver damage.[43] Patients may have no symptoms. While other people could present with fatigue, pruritus, or skin hyperpigmentation.[46] The liver is typically enlarged which is referred to as hepatomegaly.[46] Rises in alkaline phosphatase, cholesterol, and bilirubin levels occur. Patients are usually positive for anti-mitochondrial antibodies.[46]
- Primary sclerosing cholangitis is a disorder of the bile ducts that presents with pruritus, steatorrhea, fat-soluble vitamin deficiencies, and metabolic bone disease. A strong association with inflammatory bowel disease is seen, especially ulcerative colitis.[23]
- Autoimmune hepatitis is caused by an attack of the liver by lymphocytes. This causes inflammation and eventually scarring as well as cirrhosis. Findings include elevations in serum globulins, especially gamma globulins.[23]
- Hereditary hemochromatosis usually presents with skin hyperpigmentation, diabetes mellitus, pseudogout, or cardiomyopathy, All of these are due to signs of iron overload.[23][36] Family history of cirrhosis is common as well.
- Wilson’s disease is an autosomal recessive disorder characterized by low ceruloplasmin in the blood and increased copper of the liver.[43][36] Copper in the urine is also elevated. Patients may also have Kayser-Fleischer rings in the cornea and altered mental status.[47]
- Indian childhood cirrhosis is a form of neonatal cholestasis characterized by deposition of copper in the liver [36][48]
- Alpha-1 antitrypsin deficiency is an autosomal co-dominant disorder of low levels of the enzyme alpha-1 antitrypsin[23]
- Cardiac cirrhosis is due to chronic right-sided heart failure, which leads to liver congestion [23]
- Galactosemia[49]
- Glycogen storage disease type IV[36]
- Cystic fibrosis[23]
- Hepatotoxic drugs or toxins, such as acetaminophen (paracetamol), methotrexate, or amiodarone[36]
Pathophysiology[edit]
The liver plays a vital role in the synthesis of proteins (for example, albumin, clotting factors and complement), detoxification, and storage (for example, of vitamin A and glycogen). In addition, it participates in the metabolism of lipids and carbohydrates.[citation needed]
Cirrhosis is often preceded by hepatitis and fatty liver (steatosis), independent of the cause. If the cause is removed at this stage, the changes are fully reversible.[citation needed]
The pathological hallmark of cirrhosis is the development of scar tissue that replaces normal tissue. This scar tissue blocks the portal flow of blood through the organ, raising the blood pressure and disturbing normal function. Research has shown the pivotal role of the stellate cell, that normally stores vitamin A, in the development of cirrhosis. Damage to the liver tissue from inflammation leads to the activation of stellate cells, which increases fibrosis through the production of myofibroblasts, and obstructs hepatic blood flow.[50] In addition, stellate cells secrete TGF beta 1, which leads to a fibrotic response and proliferation of connective tissue. TGF-β1 have been implicated in the process of activating hepatic stellate cells (HSCs) with the magnitude of fibrosis being in proportion to increase in TGF β levels. ACTA2 is associated with TGF β pathway that enhances contractile properties of HSCs leading to fibrosis.[51] Furthermore, it secretes TIMP1 and TIMP2, naturally occurring inhibitors of matrix metalloproteinases, which prevents them from breaking down the fibrotic material in the extracellular matrix.[52][53]
As this cascade of processes continues, fibrous tissue bands (septa) separate hepatocyte nodules, which eventually replace the entire liver architecture, leading to decreased blood flow throughout. The spleen becomes congested, and enlarged, resulting in its retention of platelets, which are needed for normal blood clotting. Portal hypertension is responsible for the most severe complications of cirrhosis.[citation needed]
Diagnosis[edit]
The diagnosis of cirrhosis in an individual is based on multiple factors.[23] Cirrhosis may be suspected from laboratory findings, physical exam, and patient history. Imaging is generally obtained to evaluate the liver.[23] A liver biopsy will confirm the diagnosis; however, is generally not required.[36]
Imaging[edit]
Ultrasound is routinely used in the evaluation of cirrhosis.[36] It may show a small and shrunken liver in advanced disease. On ultrasound, there is increased echogenicity with irregular appearing areas.[54] Other suggestive findings are an enlarged caudate lobe, widening of the fissures and enlargement of the spleen.[55] An enlarged spleen, which normally measures less than 11–12 cm in adults, may suggest underlying portal hypertension.[56] Ultrasound may also screen for hepatocellular carcinoma and portal hypertension.[36] This is done by assessing flow in the hepatic vein.[57] An increased portal vein pulsatility may be seen. However, this may be a sign of elevated right atrial pressure.[58] Portal vein pulsatility are usually measured by an pulsatility indices (PI).[57] A number above a certain values indicates cirrhosis (see table below).
| Index | Calculation | Cutoff |
|---|---|---|
| Average-based | (Max – Min) / Average[57] | 0.5[57] |
| Max-relative | (Max – Min) / Max[59] | 0.5[59][60]–0.54[60] |
Other scans include CT of the abdomen and MRI.[36] A CT scan is non-invasive and may be helpful in the diagnosis.[36] Compared to the ultrasound, CT scans tend to be more expensive. MRI provides excellent evaluation; however, is a high expense.[36]
Cirrhosis is also diagnosable through a variety of new elastography techniques.[61][62] When a liver becomes cirrhotic it will generally become stiffer. Determining the stiffness through imaging can determine the location and severity of disease. Techniques include transient elastography, acoustic radiation force impulse imaging, supersonic shear imaging and magnetic resonance elastography.[63] Transient elastography and magnetic resonance elastography can help identify the stage of fibrosis.[64] Compared to a biopsy, elastography can sample a much larger area and is painless.[65] It shows a reasonable correlation with the severity of cirrhosis.[64] Other modalities have been introduced which are incorporated into ultrasonagraphy systems. These include 2-dimensional shear wave elastography and point shear wave elastography which uses acoustic radiation force impulse imaging.[10]
Rarely are diseases of the bile ducts, such as primary sclerosing cholangitis, causes of cirrhosis.[36] Imaging of the bile ducts, such as ERCP or MRCP (MRI of biliary tract and pancreas) may aid in the diagnosis.[36]
Lab findings[edit]
The best predictors of cirrhosis are ascites, platelet count < 160,000/mm3, spider angiomata, and a Bonacini cirrhosis discriminant score greater than 7 (as the sum of scores for platelet count, ALT/AST ratio and INR as per table).[66]
| Score | Platelet count x109 | ALT/AST ratio | INR |
|---|---|---|---|
| 0 | >340 | >1.7 | <1.1 |
| 1 | 280-340 | 1.2-1.7 | 1.1-1.4 |
| 2 | 220-279 | 0.6-1.19 | >1.4 |
| 3 | 160–219 | <0.6 | … |
| 4 | 100-159 | … | … |
| 5 | 40-99 | … | … |
| 6 | <40 | … | … |
These findings are typical in cirrhosis:
- Thrombocytopenia, typically multifactorial, is due to alcoholic marrow suppression, sepsis, lack of folate, platelet sequestering in the spleen, and decreased thrombopoietin.[42] However, this rarely results in a platelet count < 50 000/mL.[68]
- Aminotransferases AST and ALT are moderately elevated, with AST > ALT. However, normal aminotransferase levels do not preclude cirrhosis.[42]
- Alkaline phosphatase – slightly elevated but less than 2–3 times the upper limit of normal.[citation needed]
- Gamma-glutamyl transferase – correlates with AP levels. Typically much higher in chronic liver disease from alcohol.[68]
- Bilirubin levels are normal when compensated, but may elevate as cirrhosis progresses.[citation needed]
- Albumin levels fall as the synthetic function of the liver declines with worsening cirrhosis since albumin is exclusively synthesized in the liver.
- Prothrombin time increases, since the liver synthesizes clotting factors.
- Globulins increase due to shunting of bacterial antigens away from the liver to lymphoid tissue.
- Serum sodium levels fall(hyponatremia) due to inability to excrete free water resulting from high levels of ADH and aldosterone.
- Leukopenia and neutropenia are due to splenomegaly with splenic margination.[citation needed]
- Coagulation defects occur, as the liver produces most of the coagulation factors, thus coagulopathy correlates with worsening liver disease.
- Glucagon is increased in cirrhosis.[69]
- Vasoactive intestinal peptide is increased as blood is shunted into the intestinal system because of portal hypertension.
- Vasodilators are increased (such as nitric oxide and carbon monoxide) reducing afterload with compensatory increase in cardiac output, mixed venous oxygen saturation.[70]
- Renin is increased (as well as sodium retention in kidneys) secondary to a fall in systemic vascular resistance.[71]
FibroTest is a biomarker for fibrosis that may be used instead of a biopsy.[72]
Other laboratory studies performed in newly diagnosed cirrhosis may include:
- Serology for hepatitis viruses, autoantibodies (ANA, antismooth muscle, antimitochondria, anti-LKM)
- Ferritin[73][74] and transferrin saturation: markers of iron overload as in hemochromatosis, copper and ceruloplasmin: markers of copper overload as in Wilson’s disease
- Immunoglobulin levels (IgG, IgM, IgA) – these immunoglobins are nonspecific, but may help in distinguishing various causes.
- Cholesterol and glucose
- Alpha 1-antitrypsin
Markers of inflammation and immune cell activation are typically elevated in cirrhotic patients, especially in the decompensated disease stage:
- C-reactive protein (CRP)[75]
- Procalcitonin (PCT)[75]
- Presepsin[76]
- soluble CD14[75]
- soluble CD163[77]
- soluble CD206 (mannose receptor)[78]
- soluble TREM-1[79]
A recent study identified15 microbial biomarkers from the gut microbiota.[80] These could potentially be used to discriminate patients with liver cirrhosis from healthy individuals.
Pathology[edit]
The gold standard for diagnosis of cirrhosis is a liver biopsy. This is usually carried out as a fine-needle approach, through the skin (percutaneous), or internal jugular vein (transjugular).[81] Endoscopic ultrasound-guided liver biopsy (EUS), using the percutaneous or transjugular route, has become a good alternative to use.[82][81] EUS can target liver areas that are widely separated,[83] and can deliver bi-lobar biopsies.[82] A biopsy is not necessary if the clinical, laboratory, and radiologic data suggest cirrhosis. Furthermore, a small but significant risk of complications is associated with liver biopsy, and cirrhosis itself predisposes for complications caused by liver biopsy.[84]
Once the biopsy is obtained, a pathologist will study the sample. Cirrhosis is defined by its features on microscopy: (1) the presence of regenerating nodules of hepatocytes and (2) the presence of fibrosis, or the deposition of connective tissue between these nodules. The pattern of fibrosis seen can depend on the underlying insult that led to cirrhosis. Fibrosis can also proliferate even if the underlying process that caused it has resolved or ceased. The fibrosis in cirrhosis can lead to destruction of other normal tissues in the liver: including the sinusoids, the space of Disse, and other vascular structures, which leads to altered resistance to blood flow in the liver, and portal hypertension.[85]
-
No fibrosis, but mild zone 3 steatosis, in which collagen fibres (pink–red, arrow) are confined to portal tracts (P) (Van Gieson’s stain)[86]
-
Histopathology of steatohepatitis with mild fibrosis in the form of fibrous expansion (Van Gieson’s stain)[86]
-
Histopathology of steatohepatitis with moderate fibrosis, with thin fibrous bridges (Van Gieson’s stain)[86]
-
Histopathology of steatohepatitis with established cirrhosis, with thick bands of fibrosis (Van Gieson’s stain)[86]
-
Trichrome stain, showing cirrhosis as a nodular texture surrounded by fibrosis (wherein collagen is stained blue).
As cirrhosis can be caused by many different entities which injure the liver in different ways, cause-specific abnormalities may be seen. For example, in chronic hepatitis B, there is infiltration of the liver parenchyma with lymphocytes.[85] In congestive hepatopathy there are erythrocytes and a greater amount of fibrosis in the tissue surrounding the hepatic veins.[87] In primary biliary cholangitis, there is fibrosis around the bile duct, the presence of granulomas and pooling of bile.[88] Lastly in alcoholic cirrhosis, there is infiltration of the liver with neutrophils.[85]
Macroscopically, the liver is initially enlarged, but with the progression of the disease, it becomes smaller. Its surface is irregular, the consistency is firm, and if associated with steatosis the color is yellow. Depending on the size of the nodules, there are three macroscopic types: micronodular, macronodular, and mixed cirrhosis. In the micronodular form (Laennec’s cirrhosis or portal cirrhosis), regenerating nodules are under 3 mm. In macronodular cirrhosis (post-necrotic cirrhosis), the nodules are larger than 3 mm. Mixed cirrhosis consists of nodules of different sizes.[89]
-
Micronodular cirrhosis, with diffuse areas of pallor.
-
Pale macronodules of cirrhosis.
-
Cirrhosis leading to hepatocellular carcinoma
Grading[edit]
The severity of cirrhosis is commonly classified with the Child–Pugh score (also known as the Child–Pugh–Turcotte score).[90] This system was devised in 1964 by Child and Turcotte, and modified in 1973 by Pugh and others.[91] It was first established to determine who would benefit from elective surgery for portal decompression.[90] This scoring system uses multiple lab values including bilirubin, albumin, and INR.[92] The presence of ascites and severity of encephalopathy is also included in the scoring.[92] Patients are classified into class A, B, or C.[92] Class A has a favorable prognosis while class C is at high risk of death.
| Child-Pugh Class | Points | Liver Function | Prognosis | Abdominal surgery post-operative mortality |
|---|---|---|---|---|
| Child-Pugh Class A | 5–6 points | Good liver function | 15–20 years | 10% |
| Child-Pugh Class B | 7–9 points | Moderately impaired liver function | 30% | |
| Child-Pugh Class C | 10–15 points | Advanced liver dysfunction | 1–3 years | 82% |
The Child-Pugh score is a validated predictor of mortality after a major surgery.[90] For example, Child class A patients have a 10% mortality rate and Child class B patients have a 30% mortality rate while Child class C patients have a 70 to 80% mortality rate after abdominal surgery.[90] Elective surgery is usually reserved for those in Child class A patients. There is an increased risk for child class B individuals and they may require medical optimization. Overall, it is not recommended for Child class C patients to undergo elective surgery.[90]
In the past, the Child-Pugh classification was used to determine patients who were candidates for a liver transplant.[90] Child-Pugh class B is usually an indication for evaluation for transplant.[92] However, there were many issues when applying this score to liver transplant eligibility.[90] Thus, the MELD score was created.
The Model for End-Stage Liver Disease (MELD) score was later developed and approved in 2002.[93] It was approved by the United Network for Organ Sharing (UNOS) as a way to determine the allocation of liver transplants to awaiting people in the United States.[94] It is also used as a validated survival predictor of cirrhosis, alcoholic hepatitis, acute liver failure, and acute hepatitis.[95] The variables included bilirubin, INR, creatinine, and dialysis frequency.[95] In 2016, sodium was added to the variables and the score is often referred to as MELD-Na.[96]
MELD-Plus is a further risk score to assess severity of chronic liver disease. It was developed in 2017 as a result of a collaboration between Massachusetts General Hospital and IBM.[97] Nine variables were identified as effective predictors for 90-day mortality after a discharge from a cirrhosis-related hospital admission.[97] The variables include all Model for End-Stage Liver Disease (MELD)’s components, as well as sodium, albumin, total cholesterol, white blood cell count, age, and length of stay.[97]
The hepatic venous pressure gradient (difference in venous pressure between incoming and outgoing blood to the liver) also determines the severity of cirrhosis, although it is hard to measure. A value of 16 mm or more means a greatly increased risk of death.[98][unreliable medical source?]
Prevention[edit]
Key prevention strategies for cirrhosis are population-wide interventions to reduce alcohol intake (through pricing strategies, public health campaigns, and personal counseling), programs to reduce the transmission of viral hepatitis, and screening of relatives of people with hereditary liver diseases.[99]
Little is known about factors affecting cirrhosis risk and progression. However, many studies have provided increasing evidence for the protective effects of coffee consumption against the progression of liver disease. These effects are more noticeable in liver disease that is associated with alcohol use disorder. Coffee has antioxidant and antifibrotic effects. Caffeine may not be the important component; polyphenols may be more important. Drinking two or more cups of coffee a day is associated with improvements in the liver enzymes ALT, AST, and GGT. Even in those with liver disease, coffee consumption can lower fibrosis and cirrhosis.[100]
Treatment[edit]
Generally, liver damage from cirrhosis cannot be reversed, but treatment can stop or delay further progression and reduce complications. A healthy diet is encouraged, as cirrhosis may be an energy-consuming process. A recommended diet consists of high-protein, high-fiber diet plus supplementation with branched-chain amino acids.[101] Close follow-up is often necessary. Antibiotics are prescribed for infections, and various medications can help with itching. Laxatives, such as lactulose, decrease the risk of constipation. Carvedilol increases survival benefit for patients with cirrhosis and portal hypertension.[102]
Alcoholic cirrhosis caused by alcohol use disorder is treated by abstaining from alcohol. Treatment for hepatitis-related cirrhosis involves medications used to treat the different types of hepatitis, such as interferon for viral hepatitis and corticosteroids for autoimmune hepatitis.[citation needed]
Cirrhosis caused by Wilson’s disease is treated by removing the copper which builds up in organs.[2] This is carried out using chelation therapy such as penicillamine. When the cause is an iron overload, iron is removed using a chelation agent such as deferoxamine or by bloodletting.[citation needed]
As of 2021, there are recent studies studying drugs to prevent cirrhosis caused by non-alcoholic fatty liver disease (NAFLD or NASH). A drug called semaglutide was shown to provide greater NASH resolution versus placebo. No improvement in fibrosis was observed.[103] A combination of cilofexor/firsocostat was studied in patients with bridging fibrosis and cirrhosis. It was observed to have led to improvements in NASH activity with a potential antifibrotic effect.[104] Lanifibranor is also shown to prevent worsening fibrosis.[105]
Preventing further liver damage[edit]
Regardless of the underlying cause of cirrhosis, consumption of alcohol and other potentially damaging substances are discouraged. There is no evidence that supports the avoidance or dose reduction of paracetamol in people with compensated cirrhosis; it is thus considered a safe analgesic for said individuals.[106]
Vaccination of susceptible patients should be considered for hepatitis A and hepatitis B.
Treating the cause of cirrhosis prevents further damage; for example, giving oral antivirals such as entecavir and tenofovir where cirrhosis is due to hepatitis B prevents progression of cirrhosis. Similarly, control of weight and diabetes prevents deterioration in cirrhosis due to non-alcoholic fatty liver disease.[107]
Avoid drugs that could further harm the liver. These include several drugs such as anti-depressants, certain antibiotics, and NSAIDs (like ibuprofen).[108] These agents are hepatotoxic as they are metabolized by the liver. If medication that harms the liver is still recommended by your doctor, the dosage can be adjusted.
Lifestyle[edit]
According to a 2018 systematic review based on studies that implemented 8 to 14 week-long exercise programs, there is currently insufficient scientific evidence regarding either the beneficial or harmful effects of physical exercise in people with cirrhosis on all-cause mortality, morbidity (including both serious and non-serious adverse events), health-related quality of life, exercise capacity and anthropomorphic measures.[109] These conclusions were based on low to very low quality research, which imposes the need to develop further research with higher quality, especially to evaluate its effects on clinical outcomes.[citation needed]
Transplantation[edit]
If complications cannot be controlled or when the liver ceases functioning, liver transplantation is necessary. Survival from liver transplantation has been improving over the 1990s, and the five-year survival rate is now around 80%. The survival rate depends largely on the severity of disease and other medical risk factors in the recipient.[110] In the United States, the MELD score is used to prioritize patients for transplantation.[111] Transplantation necessitates the use of immune suppressants (ciclosporin or tacrolimus).
Decompensated cirrhosis[edit]
Manifestations of decompensation in cirrhosis include gastrointestinal bleeding, hepatic encephalopathy, jaundice or ascites. In patients with previously stable cirrhosis, decompensation may occur due to various causes, such as constipation, infection (of any source), increased alcohol intake, medication, bleeding from esophageal varices or dehydration. It may take the form of any of the complications of cirrhosis listed below.
People with decompensated cirrhosis generally require admission to a hospital, with close monitoring of the fluid balance, mental status, and emphasis on adequate nutrition and medical treatment – often with diuretics, antibiotics, laxatives or enemas, thiamine and occasionally steroids, acetylcysteine and pentoxifylline.[112] Administration of saline is avoided, as it would add to the already high total body sodium content that typically occurs in cirrhosis. Life expectancy without liver transplant is low, at most 3 years.
Palliative care[edit]
Palliative care is specialized medical care that focuses on providing patients with relief from the symptoms, pain, and stress of a serious illness, such as cirrhosis. The goal of palliative care is to improve quality of life for both the patient and the patient’s family and it is appropriate at any stage and for any type of cirrhosis.[113]
Especially in the later stages, people with cirrhosis experience significant symptoms such as abdominal swelling, itching, leg edema, and chronic abdominal pain which would be amenable for treatment through palliative care.[114] Because the disease is not curable without a transplant, palliative care can also help with discussions regarding the person’s wishes concerning health care power of attorney, do not resuscitate decisions and life support, and potentially hospice.[114] Despite proven benefit, people with cirrhosis are rarely referred to palliative care.[115]
Immunity[edit]
Cirrhosis is known to cause immune dysfunction in numerous ways. It impedes the immune system from working normally.[citation needed]
Bleeding and blood clot risk[edit]
Cirrhosis can increase the risk of bleeding. The liver produces various proteins in the coagulation cascade (coagulation factors II, VII, IX, X, V, and VI). When damaged, the liver is impaired in its production of these proteins.[116] This will ultimately increase bleeding as clotting factors are diminished. Clotting function is estimated by lab values, mainly platelet count, prothrombin time (PT), and international normalized ratio (INR).
The American Gastroenterological Association (AGA) provided recommendations in 2021 in regards to coagulopathy management of cirrhotic patients in certain scenarios.[116]
- The AGA does not recommend for extensive pre-procedural testing, including repeated measurements of PT/INR or platelet count before patients with stable cirrhosis undergo common gastrointestinal procedures. Nor do they suggest the routine use of blood products, such as platelets, for bleeding prevention.[116] Cirrhosis is stable when there are no changes in baseline abnormalities of coagulation lab values.
- For patients with stable cirrhosis and low platelet count undergoing common low-risk procedures, the AGA does not recommend the routine use of thrombopoietin receptor agonists for bleeding prevention.[116]
- In hospitalized patients who meet standard guidelines for clot prevention, the AGA suggests standard prevention.[116]
- The AGA does not recommend in routine screening for portal vein thrombosis. If there is a portal vein thrombosis, the AGA suggests treatment by anticoagulation.[116]
- In the case of cirrhosis with atrial fibrillation, the AGA recommends using anticoagulation over no anticoagulation.[116]
Complications[edit]
Ascites[edit]
Salt restriction is often necessary, as cirrhosis leads to accumulation of salt (sodium retention). Diuretics may be necessary to suppress ascites. Diuretic options for inpatient treatment include aldosterone antagonists (spironolactone) and loop diuretics. Aldosterone antagonists are preferred for people who can take oral medications and are not in need of an urgent volume reduction. Loop diuretics can be added as additional therapy.[117]
Where salt restriction and the use of diuretics are ineffective then paracentesis may be the preferred option.[118] This procedure requires the insertion of a plastic tube into the peritoneal cavity. Human serum albumin solution is usually given to prevent complications from the rapid volume reduction. In addition to being more rapid than diuretics, 4–5 liters of paracentesis is more successful in comparison to diuretic therapy.[117]
Esophageal and gastric variceal bleeding[edit]
For portal hypertension, nonselective beta blockers such as propranolol or nadolol are commonly used to lower blood pressure over the portal system. In severe complications from portal hypertension, transjugular intrahepatic portosystemic shunting (TIPS) is occasionally indicated to relieve pressure on the portal vein. As this shunting can worsen hepatic encephalopathy, it is reserved for those patients at low risk of encephalopathy. TIPS is generally regarded only as a bridge to liver transplantation[119] or as a palliative measure.[citation needed] Balloon-occluded retrograde transvenous obliteration can be used to treat gastric variceal bleeding.[120]
Gastroscopy (endoscopic examination of the esophagus, stomach, and duodenum) is performed in cases of established cirrhosis. If esophageal varices are found, prophylactic local therapy may be applied such as sclerotherapy or banding, and beta blockers may be used.[121][122][123]
Hepatic encephalopathy[edit]
Hepatic encephalopathy is a potential complication of cirrhosis.[23] It may lead to functional neurological impairment ranging from mild confusion to coma.[23] Goal of treatment is reducing ammonia.[124] This can can achieved by administering lactulose or lactitol to increase potassium.[125] Hydration and nutritional support is also provided.[124] Protein uptake is encouraged.[126] The underlying cause may also need to be identified and treated. Causes include alcohol use, excess protein, gastrointestinal bleeding, infection, constipation, and vomiting/diarrhea.[124] Drugs like benzodiazepines, diuretics, or narcotics can also precipitate hepatic encephalopathy.[124] A low protein diet is recommended with gastrointestinal bleeding.[126] Rifaximin is administered if mental state does not improve in 48 hours.[124] Antibiotic treatment may need to be continued for at least 3 months.[124] The grading or severity of hepatic encephalopathy is determined by mental status.
| Grade | Mental status |
| Grade 1: Mild | Changes in behavior |
| Mild confusion | |
| Slurred speech | |
| Disordered sleep | |
| Grade 2: Moderate | Lethargy |
| Moderate confusion | |
| Grade 3: Severe | Stupor |
| Incoherent | |
| Sleeping but arousable | |
| Grade 4: Coma | Coma/Unresponsive |
Hepatorenal syndrome[edit]
Hepatorenal syndrome is a serious complication of end-stage cirrhosis when kidney damage is also involved.[128]
Spontaneous bacterial peritonitis[edit]
People with ascites due to cirrhosis are at risk of spontaneous bacterial peritonitis.
Portal hypertensive gastropathy[edit]
Portal hypertensive gastropathy refers to changes in the mucosa of the stomach in people with portal hypertension, and is associated with cirrhosis severity.[129]
Infection[edit]
Cirrhosis can cause immune system dysfunction, leading to infection. Signs and symptoms of infection may be nonspecific and are more difficult to recognize (for example, worsening encephalopathy but no fever).[130] Moreover, infections in cirrhosis are major triggers for other complications (ascites, variceal bleading, hepatic enecphalopathy, organ failures, death).[130][77][79]
Hepatocellular carcinoma[edit]
Hepatocellular carcinoma is the most common primary liver cancer, and the most common cause of death in people with cirrhosis.[131] Screening using an MRI scan can detect this cancer and is often carried out for early signs which has been shown to improve outcomes.[2][132]
Epidemiology[edit]
Cirrhosis deaths per million persons in 2012
9-44
45-68
69–88
89–104
105–122
123–152
153–169
170–204
205–282
283–867
Disability-adjusted life year for cirrhosis of the liver per 100,000 inhabitants in 2004.[133]
no data
<50
50-100
100-200
200-300
300-400
400-500
500-600
600-700
700-800
800-900
900–1000
>1000
Each year, approximately one million deaths are due to complications of cirrhosis, making cirrhosis the 11th most common cause of death globally.[134] Cirrhosis and chronic liver disease were the tenth leading cause of death for men and the twelfth for women in the United States in 2001, killing about 27,000 people each year.[135]
The cause of cirrhosis can vary; alcohol and non-alcoholic fatty liver disease are main causes in western and industrialized countries, whereas viral hepatitis is the predominant cause in low and middle-income countries.[134] Cirrhosis is more common in men than in women.[136] The cost of cirrhosis in terms of human suffering, hospital costs, and lost productivity is high.
Globally, age-standardized disability-adjusted life year (DALY) rates have decreased from 1990 to 2017, with the values going from 656.4 years per 100,000 people to 510.7 years per 100,000 people.[137] In males DALY rates have decreased from 903.1 years per 100,000 population in 1990, to 719.3 years per 100,000 population in 2017; in females the DALY rates have decreased from 415.5 years per 100,000 population in 1990, to 307.6 years per 100,000 population in 2017.[137] However, globally the total number of DALYs have increased by 10.9 million from 1990 to 2017, reaching the value of 41.4 million DALYs.[137]
Etymology[edit]
The word «cirrhosis» is a neologism derived from Greek: κίρρωσις; kirrhos κιρρός, meaning «yellowish, tawny» (the orange-yellow colour of the diseased liver) and the suffix -osis, i.e. «condition» in medical terminology.[138][139][140] While the clinical entity was known before, René Laennec gave it this name in an 1819 paper.[17]
See also[edit]
- Liver failure
References[edit]
- ^ a b c d e f g h i j k l m n o p «Cirrhosis». National Institute of Diabetes and Digestive and Kidney Diseases. April 23, 2014. Archived from the original on 9 June 2015. Retrieved 19 May 2015.
- ^ a b c d e Ferri FF (2019). Ferri’s clinical advisor 2019 : 5 books in 1. Philadelphia, PA. pp. 337–339. ISBN 9780323530422.
- ^ a b «Treatment for Cirrhosis | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. Archived from the original on 20 March 2021. Retrieved 6 March 2021.
- ^ a b Vos, Theo; et al. (October 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ a b c Wang H, Naghavi M, Allen C, Barber RM, Bhutta ZA, Carter A, et al. (GBD 2015 Mortality and Causes of Death Collaborators) (October 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1459–1544. doi:10.1016/s0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ^ a b c «Cirrhosis». nhs.uk. 29 June 2020. Archived from the original on 5 October 2017. Retrieved 8 February 2021.
- ^ a b c Dooley JS, Lok AS, Garcia-Tsao G, Pinzani M (8 June 2018). Sherlock’s diseases of the liver and biliary system (13th ed.). Hoboken, NJ. p. 82. ISBN 978-1-119-23756-3. OCLC 1019837000.
- ^ a b c d e f g h i j k «Symptoms & Causes of Cirrhosis | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. Archived from the original on 8 February 2021. Retrieved 8 February 2021.
- ^ «Definition & Facts for Cirrhosis | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. Archived from the original on 2021-03-11. Retrieved 2021-03-10.
- ^ a b Castera L, Friedrich-Rust M, Loomba R (April 2019). «Noninvasive Assessment of Liver Disease in Patients With Nonalcoholic Fatty Liver Disease». Gastroenterology. 156 (5): 1264–1281.e4. doi:10.1053/j.gastro.2018.12.036. PMC 7505052. PMID 30660725.
- ^ Ilić, G.; Karadžić, R.; Kostić-Banović, L.; Stojanović, J.; Antović, A. (February 2010). «Ultrastructural Changes In The Liver Of Intravenous Heroin Addiction». Bosnian Journal of Basic Medical Sciences. Vol. 10, no. 1. Journal of the Association of Basic Medical Sciences. pp. 36–43. PMC 5596609.
- ^ Naghavi M, Wang H, Lozano R, Davis A, Liang X, Zhou M, et al. (GBD 2013 Mortality Causes of Death Collaborators) (January 2015). «Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013». Lancet. 385 (9963): 117–171. doi:10.1016/S0140-6736(14)61682-2. PMC 4340604. PMID 25530442.
- ^ «Alcoholic liver disease». MedlinePlus Medical Encyclopedia. Archived from the original on 2019-05-27. Retrieved 2021-03-10.
- ^ «Heroin and Liver Damage». Banyan Medical Centers. Retrieved August 7, 2022.
- ^ a b «Definition & Facts of NAFLD & NASH | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. Archived from the original on 12 March 2021. Retrieved 9 March 2021.
- ^ Brower ST (2012). Elective general surgery : an evidence-based approach. New York: McGraw-Hill Medical. p. 36. ISBN 9781607951094. Archived from the original on 2017-09-08.
- ^ a b Roguin A (September 2006). «Rene Theophile Hyacinthe Laënnec (1781-1826): the man behind the stethoscope». Clinical Medicine & Research. 4 (3): 230–235. doi:10.3121/cmr.4.3.230. PMC 1570491. PMID 17048358.
- ^ a b c Samant H, Kothadia JP (2022). «Spider Angioma». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 29939595. Retrieved 2022-03-14.
- ^ Kur P, Kolasa-Wołosiuk A, Misiakiewicz-Has K, Wiszniewska B (April 2020). «Sex Hormone-Dependent Physiology and Diseases of Liver». International Journal of Environmental Research and Public Health. 17 (8): E2620. doi:10.3390/ijerph17082620. PMC 7216036. PMID 32290381.
- ^ «Palmar Erythema: Symptoms, Causes, Treatment, and More». Healthline. 2017-07-20. Retrieved 2022-03-16.
- ^ Serrao R, Zirwas M, English JC (2007). «Palmar erythema». American Journal of Clinical Dermatology. 8 (6): 347–56. doi:10.2165/00128071-200708060-00004. PMID 18039017. S2CID 33297418.
- ^ Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dhatariya K, et al. (2000). «Gynecomastia: Etiology, Diagnosis, and Treatment». In Feingold KR, Anawalt B, Boyce A, Chrousos G (eds.). Endotext. South Dartmouth (MA): MDText.com, Inc. PMID 25905330. Retrieved 2022-03-16.
- ^ a b c d e f g h i j k l m n o p q r s t Loscalzo J, Fauci AS, Kasper DL, Hauser SL, Longo DL, Jameson JL (2022). Harrison’s principles of internal medicine (21st ed.). New York. ISBN 978-1-264-26849-8. OCLC 1282172709.[page needed]
- ^ Kim SM, Yalamanchi S, Dobs AS (2017). «Male Hypogonadism and Liver Disease». In Winters SJ, Huhtaniemi IT (eds.). Male Hypogonadism. Cham: Springer International Publishing. pp. 219–234. doi:10.1007/978-3-319-53298-1_11. ISBN 978-3-319-53296-7.
- ^ Qi X, An S, Li H, Guo X (2017-08-24). «Recurrent scrotal edema in liver cirrhosis». AME Medical Journal. 2: 124. doi:10.21037/amj.2017.08.22.
- ^ Plauth M, Schütz ET (September 2002). «Cachexia in liver cirrhosis». International Journal of Cardiology. 85 (1): 83–87. doi:10.1016/s0167-5273(02)00236-x. PMID 12163212.
- ^ Jeffrey G (7 October 2021). «Cirrhosis of the Liver». emedicinehealth. Retrieved 15 March 2022.
- ^ «Jaundice — Hepatic and Biliary Disorders». Merck Manuals Professional Edition. Retrieved 2022-03-16.
- ^ a b c «Portal Hypertension». www.hopkinsmedicine.org. Retrieved 2022-03-16.
- ^ a b «Diagnosis of NAFLD & NASH | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. Archived from the original on 4 March 2021. Retrieved 9 March 2021.
- ^ a b Meseeha M, Attia M (2022). «Esophageal Varices». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 28846255. Retrieved 2022-03-16.
- ^ Masoodi I, Farooq O, Singh R, Ahmad N, Bhat M, Wani A (January 2009). «Courveilhier baumgarten syndrome: a rare syndrome revisited». International Journal of Health Sciences. 3 (1): 97–99. PMC 3068787. PMID 21475517.
- ^ «What is Cruveilhier-baumgarten Syndrome | Medindia». www.medindia.net. Retrieved 2022-03-17.
- ^ Witkowska AB, Jasterzbski TJ, Schwartz RA (2017). «Terry’s Nails: A Sign of Systemic Disease». Indian Journal of Dermatology. 62 (3): 309–311. doi:10.4103/ijd.IJD_98_17 (inactive 31 December 2022). PMC 5448267. PMID 28584375.
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) - ^ Abd El Meged MM (2019-04-01). «Patterns of nail changes in chronic liver diseases». Sohag Medical Journal. 23 (2): 166–170. doi:10.21608/smj.2019.47672. ISSN 1687-8353. S2CID 203813520.
- ^ a b c d e f g h i j k l m n o p q r s t u Friedman L (2018). Handbook of Liver Disease, 4e. Elsevier. ISBN 9780323478748.
- ^ Brennan D. «What Is Fetor Hepaticus?». WebMD. Retrieved 2022-03-17.
- ^ Samji NS, Buggs AM, Roy PK (2021-10-17). Anand BS (ed.). «Viral Hepatitis: Background, Pathophysiology, Etiology». Medscape. WebMD LLC.
- ^ a b Perz JF, Armstrong GL, Farrington LA, Hutin YJ, Bell BP (October 2006). «The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide». Journal of Hepatology. 45 (4): 529–538. doi:10.1016/j.jhep.2006.05.013. PMID 16879891.
- ^ «Cirrhosis of the Liver». American Liver Foundation. Retrieved 2022-03-17.
- ^ a b Stickel F, Datz C, Hampe J, Bataller R (March 2017). «Pathophysiology and Management of Alcoholic Liver Disease: Update 2016». Gut and Liver. 11 (2): 173–188. doi:10.5009/gnl16477. PMC 5347641. PMID 28274107.
- ^ a b c Friedman LS (2014). Current medical diagnosis and treatment 2014. [S.l.]: Mcgraw-Hill. pp. Chapter 16. Liver, Biliary Tract, & Pancreas Disorders. ISBN 978-0071806336.
- ^ a b c d Machado MV, Diehl AM (2018). «Pathogenesis of Nonalcoholic Fatty Liver Disease». In Sanyal AJ, Boyer TD, Terrault NA, Lindor KD (eds.). Zakim and Boyer’s Hepatology. pp. 369–390. doi:10.1016/c2013-0-19055-1. ISBN 9780323375917.
- ^ Golabi P, Paik JM, Arshad T, Younossi Y, Mishra A, Younossi ZM (August 2020). «Mortality of NAFLD According to the Body Composition and Presence of Metabolic Abnormalities». Hepatology Communications. 4 (8): 1136–1148. doi:10.1002/hep4.1534. PMC 7395070. PMID 32766474.
- ^ «Heroin Addiction Health Conditions». Bedrock Recovery Center. Retrieved August 7, 2022.
- ^ a b c «Primary Biliary Cholangitis: Symptoms, Causes, Treatments». Cleveland Clinic. Retrieved 2022-03-17.
- ^ Krause L (2018-09-29). Mena K (ed.). «Wilson’s Disease: Risk Factors, Causes, & Symptoms». Healthline. Retrieved 2022-03-17.
- ^ Coenen IC, Houwen RH (January 2019). «Indian childhood cirrhosis and other disorders of copper handling.». Clinical and Translational Perspectives on Wiloson Disease. Academic Press. pp. 449–453. doi:10.1016/B978-0-12-810532-0.00044-6. ISBN 9780128105320. S2CID 80994882.
- ^ Oiseth S, Jones L, Maza E. «Galactosemia». The Lecturio Medical Concept Library. Retrieved 15 August 2021.
- ^ Hammer GD, McPhee SJ, eds. (2010). Pathophysiology of disease : an introduction to clinical medicine (6th ed.). New York: McGraw-Hill Medical. pp. Chapter 14: Liver Disease. Cirrhosis. ISBN 978-0071621670.
- ^ Hassan S, Shah H, Shawana S (2020). «Dysregulated epidermal growth factor and tumor growth factor-beta receptor signaling through GFAP-ACTA2 protein interaction in liver fibrosis». Pakistan Journal of Medical Sciences. 36 (4): 782–787. doi:10.12669/pjms.36.4.1845. PMC 7260937. PMID 32494274.
- ^ Iredale JP (July 2003). «Cirrhosis: new research provides a basis for rational and targeted treatments». BMJ. 327 (7407): 143–147. doi:10.1136/bmj.327.7407.143. PMC 1126509. PMID 12869458. Archived from the original on 2004-10-29.
- ^ Puche JE, Saiman Y, Friedman SL (October 2013). «Hepatic stellate cells and liver fibrosis». Comprehensive Physiology. 3 (4): 1473–1492. doi:10.1002/cphy.c120035. ISBN 9780470650714. PMID 24265236.
- ^ Wu M, Sharma PG, Grajo JR (September 2020). «The Echogenic Liver: Steatosis and Beyond». Ultrasound Quarterly. 37 (4): 308–314. doi:10.1097/RUQ.0000000000000510. PMID 32956242. S2CID 221842327.
- ^ Yeom SK, Lee CH, Cha SH, Park CM (August 2015). «Prediction of liver cirrhosis, using diagnostic imaging tools». World Journal of Hepatology. 7 (17): 2069–2079. doi:10.4254/wjh.v7.i17.2069. PMC 4539400. PMID 26301049.
- ^ Chapman J, Goyal A, Azevedo AM. Splenomegaly. [Updated 2021 Aug 11]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: [1]
- ^ a b c d Iranpour P, Lall C, Houshyar R, Helmy M, Yang A, Choi JI, et al. (January 2016). «Altered Doppler flow patterns in cirrhosis patients: an overview». Ultrasonography. 35 (1): 3–12. doi:10.14366/usg.15020. PMC 4701371. PMID 26169079.
- ^ Berzigotti A, Seijo S, Reverter E, Bosch J (February 2013). «Assessing portal hypertension in liver diseases». Expert Review of Gastroenterology & Hepatology. 7 (2): 141–155. doi:10.1586/egh.12.83. PMID 23363263. S2CID 31057915.
- ^ a b Goncalvesova E, Varga I, Tavacova M, Lesny P (2013). «Changes of portal vein flow in heart failure patients with liver congestion». European Heart Journal. 34 (suppl 1): P627. doi:10.1093/eurheartj/eht307.P627. ISSN 0195-668X.
- ^ a b Dietrich CF (2009). «Ultrasonography». In Dancygier H (ed.). Clinical Hepatology: Principles and Practice of Hepatobiliary Diseases. Vol. 1. Springer Science & Business Media. p. 367. ISBN 9783540938422. Archived from the original on 2018-11-30.
- ^ «Elastography: MedlinePlus Medical Test». medlineplus.gov. Retrieved 2022-03-21.
- ^ Barr RG, Ferraioli G, Palmeri ML, Goodman ZD, Garcia-Tsao G, Rubin J, et al. (September 2015). «Elastography Assessment of Liver Fibrosis: Society of Radiologists in Ultrasound Consensus Conference Statement». Radiology. 276 (3): 845–861. doi:10.1148/radiol.2015150619. PMID 26079489.
- ^ Srinivasa Babu A, Wells ML, Teytelboym OM, Mackey JE, Miller FH, Yeh BM, et al. (2016-11-01). «Elastography in Chronic Liver Disease: Modalities, Techniques, Limitations, and Future Directions». Radiographics. 36 (7): 1987–2006. doi:10.1148/rg.2016160042. PMC 5584553. PMID 27689833.
- ^ a b Foucher J, Chanteloup E, Vergniol J, Castéra L, Le Bail B, Adhoute X, et al. (March 2006). «Diagnosis of cirrhosis by transient elastography (FibroScan): a prospective study». Gut. 55 (3): 403–408. doi:10.1136/gut.2005.069153. PMC 1856085. PMID 16020491.
- ^ Pavlov CS, Casazza G, Nikolova D, Tsochatzis E, Burroughs AK, Ivashkin VT, Gluud C (January 2015). «Transient elastography for diagnosis of stages of hepatic fibrosis and cirrhosis in people with alcoholic liver disease». The Cochrane Database of Systematic Reviews. 1 (1): CD010542. doi:10.1002/14651858.cd010542.pub2. PMC 7081746. PMID 25612182.
- ^ Udell JA, Wang CS, Tinmouth J, FitzGerald JM, Ayas NT, Simel DL, et al. (February 2012). «Does this patient with liver disease have cirrhosis?». JAMA. 307 (8): 832–842. doi:10.1001/jama.2012.186. PMID 22357834.
- ^ Gudowska M, Gruszewska E, Panasiuk A, Cylwik B, Świderska M, Flisiak R, et al. (February 2016). «Selected Noninvasive Markers in Diagnosing Liver Diseases». Laboratory Medicine. 47 (1): 67–72. doi:10.1093/labmed/lmv015. PMID 26715612.
- ^ a b Maddrey WC, Schiff ER, Sorrell MF, eds. (1999). Schiff’s diseases of the liver (11th ed.). Chichester, West Sussex, UK: John Wiley & Sons. pp. Evaluation of the Liver A: Laboratory Test. ISBN 978-0-470-65468-2.
- ^ Longo DL, Fauci AS, Kasper DL, Hauser SL, Jameson JL, Loscalzo J, eds. (2012). Harrison’s principles of internal medicine (18th ed.). New York: McGraw-Hill. pp. Chapter 308. Cirrhosis and Its Complications. ISBN 9780071748896.
- ^ Slater JS, Esherick DS, Clark ED (2012-12-18). Current practice guidelines in primary care 2013. New York: McGraw-Hill Medical. pp. Chapter 3: Disease Management. ISBN 978-0071797504.
- ^ Van Thiel DH, Gavaler JS, Schade RR (February 1985). «Liver disease and the hypothalamic pituitary gonadal axis». Seminars in Liver Disease. 5 (1): 35–45. doi:10.1055/s-2008-1041756. PMID 3983651.
- ^ Halfon P, Munteanu M, Poynard T (September 2008). «FibroTest-ActiTest as a non-invasive marker of liver fibrosis». Gastroenterologie Clinique et Biologique. 32 (6 Suppl 1): 22–39. doi:10.1016/S0399-8320(08)73991-5. PMID 18973844.
- ^ Tornai D, Antal-Szalmas P, Tornai T, Papp M, Tornai I, Sipeki N, et al. (March 2021). «Abnormal ferritin levels predict development of poor outcomes in cirrhotic outpatients: a cohort study». BMC Gastroenterology. 21 (1): 94. doi:10.1186/s12876-021-01669-w. PMC 7923668. PMID 33653274.
- ^ Maiwall R, Kumar S, Chaudhary AK, Maras J, Wani Z, Kumar C, et al. (July 2014). «Serum ferritin predicts early mortality in patients with decompensated cirrhosis». Journal of Hepatology. 61 (1): 43–50. doi:10.1016/j.jhep.2014.03.027. PMID 24681346.
- ^ a b c Papp M, Vitalis Z, Altorjay I, Tornai I, Udvardy M, Harsfalvi J, et al. (April 2012). «Acute phase proteins in the diagnosis and prediction of cirrhosis associated bacterial infections». Liver International. 32 (4): 603–611. doi:10.1111/j.1478-3231.2011.02689.x. PMID 22145664. S2CID 10326820. Archived from the original on 2021-04-25. Retrieved 2021-04-25.
- ^ Papp M, Tornai T, Vitalis Z, Tornai I, Tornai D, Dinya T, et al. (November 2016). «Presepsin teardown — pitfalls of biomarkers in the diagnosis and prognosis of bacterial infection in cirrhosis». World Journal of Gastroenterology. 22 (41): 9172–9185. doi:10.3748/wjg.v22.i41.9172. PMC 5107598. PMID 27895404.
- ^ a b Tornai T, Vitalis Z, Sipeki N, Dinya T, Tornai D, Antal-Szalmas P, et al. (November 2016). «Macrophage activation marker, soluble CD163, is an independent predictor of short-term mortality in patients with cirrhosis and bacterial infection». Liver International. 36 (11): 1628–1638. doi:10.1111/liv.13133. hdl:2437/223046. PMID 27031405. S2CID 206174528. Archived from the original on 2021-04-25. Retrieved 2021-04-25.
- ^ Laursen TL, Rødgaard-Hansen S, Møller HJ, Mortensen C, Karlsen S, Nielsen DT, et al. (April 2017). «The soluble mannose receptor is released from the liver in cirrhotic patients, but is not associated with bacterial translocation». Liver International. 37 (4): 569–575. doi:10.1111/liv.13262. PMID 27706896. S2CID 46856702.
- ^ a b Tornai D, Vitalis Z, Jonas A, Janka T, Foldi I, Tornai T, et al. (September 2021). «Increased sTREM-1 levels identify cirrhotic patients with bacterial infection and predict their 90-day mortality». Clinics and Research in Hepatology and Gastroenterology. 45 (5): 101579. doi:10.1016/j.clinre.2020.11.009. PMID 33773436.
- ^ Qin N, Yang F, Li A, Prifti E, Chen Y, Shao L, et al. (September 2014). «Alterations of the human gut microbiome in liver cirrhosis». Nature. 513 (7516): 59–64. Bibcode:2014Natur.513…59Q. doi:10.1038/nature13568. PMID 25079328. S2CID 205239766.
- ^ a b McCarty TR, Bazarbashi AN, Njei B, Ryou M, Aslanian HR, Muniraj T (September 2020). «Endoscopic Ultrasound-Guided, Percutaneous, and Transjugular Liver Biopsy: A Comparative Systematic Review and Meta-Analysis». Clinical Endoscopy. 53 (5): 583–593. doi:10.5946/ce.2019.211. PMC 7548145. PMID 33027584.
- ^ a b Mok SR, Diehl DL (January 2019). «The Role of EUS in Liver Biopsy». Current Gastroenterology Reports. 21 (2): 6. doi:10.1007/s11894-019-0675-8. PMID 30706151. S2CID 73440352.
- ^ Diehl DL (April 2019). «Endoscopic Ultrasound-guided Liver Biopsy». Gastrointestinal Endoscopy Clinics of North America. 29 (2): 173–186. doi:10.1016/j.giec.2018.11.002. PMC 6383155. PMID 30846147.
- ^ Grant A, Neuberger J (October 1999). «Guidelines on the use of liver biopsy in clinical practice. British Society of Gastroenterology». Gut. 45 (Suppl 4): IV1–IV11. doi:10.1136/gut.45.2008.iv1. PMC 1766696. PMID 10485854. Archived from the original on 2007-06-30.
The main cause of mortality after percutaneous liver biopsy is intraperitoneal haemorrhage as shown in a retrospective Italian study of 68,000 percutaneous liver biopsies, in which all six patients who died did so from intraperitoneal haemorrhage. Three of these patients had had a laparotomy, and all had either cirrhosis or malignant disease, both of which are risk factors for bleeding.
- ^ a b c Brenner D, Rippe RA (2003). «Pathogenesis of Hepatic Fibrosis». In Yamada (ed.). Textbook of Gastroenterology. Vol. 2 (4th ed.). Lippincott Williams & Wilkins. ISBN 978-0-7817-2861-4.
- ^ a b c d Boyd A, Cain O, Chauhan A, Webb GJ (2020). «Medical liver biopsy: background, indications, procedure and histopathology». Frontline Gastroenterology. 11 (1): 40–47. doi:10.1136/flgastro-2018-101139. ISSN 2041-4137. PMC 6914302. PMID 31885839.
-«This is an open access article distributed in accordance with the Creative Commons Attribution 4.0 Unported (CC BY 4.0) license» - ^ Giallourakis CC, Rosenberg PM, Friedman LS (November 2002). «The liver in heart failure». Clinics in Liver Disease. 6 (4): 947–67, viii–ix. doi:10.1016/S1089-3261(02)00056-9. PMID 12516201.
- ^ Heathcote EJ (November 2003). «Primary biliary cirrhosis: historical perspective». Clinics in Liver Disease. 7 (4): 735–740. doi:10.1016/S1089-3261(03)00098-9. PMID 14594128.
- ^ Bashar S, Savio J (2020). «Hepatic Cirrhosis». StatPearls. StatPearls. PMID 29494026. Archived from the original on 2020-09-03. Retrieved 2019-11-11.
- ^ a b c d e f g h Tsoris A, Marlar CA (2022). «Use Of The Child Pugh Score In Liver Disease». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 31194448. Retrieved 2022-03-23.
- ^ Shakerdge K. «What Are the MELD and Child-Pugh Scores for Liver Disease?». WebMD. Retrieved 2022-03-23.
- ^ a b c d e «Child-Pugh Score for Cirrhosis Mortality». MDCalc. Retrieved 2022-03-23.
- ^ Singal AK, Kamath PS (March 2013). «Model for End-stage Liver Disease». Journal of Clinical and Experimental Hepatology. 3 (1): 50–60. doi:10.1016/j.jceh.2012.11.002. PMC 3940492. PMID 25755471.
- ^ Peng Y, Qi X, Guo X (February 2016). «Child-Pugh Versus MELD Score for the Assessment of Prognosis in Liver Cirrhosis: A Systematic Review and Meta-Analysis of Observational Studies». Medicine. 95 (8): e2877. doi:10.1097/MD.0000000000002877. PMC 4779019. PMID 26937922.
- ^ a b «MELD Score (Model For End-Stage Liver Disease) (12 and older)». MDCalc. Retrieved 2022-03-24.
- ^ «MELDNa/MELD-Na Score for Liver Cirrhosis». MDCalc. Retrieved 2022-03-24.
- ^ a b c Kartoun U, Corey KE, Simon TG, Zheng H, Aggarwal R, Ng K, Shaw SY (2017). «The MELD-Plus: A generalizable prediction risk score in cirrhosis». PLOS ONE. 12 (10): e0186301. Bibcode:2017PLoSO..1286301K. doi:10.1371/journal.pone.0186301. PMC 5656314. PMID 29069090.
- ^ Patch D, Armonis A, Sabin C, Christopoulou K, Greenslade L, McCormick A, et al. (February 1999). «Single portal pressure measurement predicts survival in cirrhotic patients with recent bleeding». Gut. 44 (2): 264–269. doi:10.1136/gut.44.2.264. PMC 1727391. PMID 9895388. Archived from the original on 2008-05-28.
- ^ «Cirrhosis». The Lecturio Medical Concept Library. 28 September 2020. Archived from the original on 9 July 2021. Retrieved 9 July 2021.
- ^ Wadhawan M, Anand AC (March 2016). «Coffee and Liver Disease». Journal of Clinical and Experimental Hepatology. 6 (1): 40–46. doi:10.1016/j.jceh.2016.02.003. PMC 4862107. PMID 27194895.
- ^ Ruiz-Margáin A, Macías-Rodríguez RU, Ríos-Torres SL, Román-Calleja BM, Méndez-Guerrero O, Rodríguez-Córdova P, Torre A (January 2018). «Effect of a high-protein, high-fiber diet plus supplementation with branched-chain amino acids on the nutritional status of patients with cirrhosis». Revista de Gastroenterologia de Mexico. 83 (1): 9–15. doi:10.1016/j.rgmx.2017.02.005. PMID 28408059.
- ^ McDowell HR, Chuah CS, Tripathi D, Stanley AJ, Forrest EH, Hayes PC (February 2021). «Carvedilol is associated with improved survival in patients with cirrhosis: a long-term follow-up study». Alimentary Pharmacology & Therapeutics. 53 (4): 531–539. doi:10.1111/apt.16189 (inactive 31 December 2022). PMID 33296526.
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) - ^ Newsome PN, Buchholtz K, Cusi K, Linder M, Okanoue T, Ratziu V, et al. (March 2021). «A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis». The New England Journal of Medicine. 384 (12): 1113–1124. doi:10.1056/NEJMoa2028395. PMID 33185364. S2CID 226850568.
- ^ Loomba R, Noureddin M, Kowdley KV, Kohli A, Sheikh A, Neff G, et al. (February 2021). «Combination Therapies Including Cilofexor and Firsocostat for Bridging Fibrosis and Cirrhosis Attributable to NASH». Hepatology. 73 (2): 625–643. doi:10.1002/hep.31622. PMID 33169409. S2CID 226295213.
- ^ Francque SM, Bedossa P, Ratziu V, Anstee QM, Bugianesi E, Sanyal AJ, et al. (October 2021). «A Randomized, Controlled Trial of the Pan-PPAR Agonist Lanifibranor in NASH». The New England Journal of Medicine. 385 (17): 1547–1558. doi:10.1056/NEJMoa2036205. hdl:1854/LU-8731444. PMID 34670042. S2CID 239051427.
- ^ Schweighardt AE, Juba KM (December 2018). «A Systematic Review of the Evidence Behind Use of Reduced Doses of Acetaminophen in Chronic Liver Disease». Journal of Pain & Palliative Care Pharmacotherapy. 32 (4): 226–239. doi:10.1080/15360288.2019.1611692. PMID 31206302. S2CID 190535151.
- ^ «Nonalcoholic Fatty Liver Disease». The Lecturio Medical Concept Library. Retrieved 15 August 2021.
- ^ Björnsson ES (February 2016). «Hepatotoxicity by Drugs: The Most Common Implicated Agents». International Journal of Molecular Sciences. 17 (2): 224. doi:10.3390/ijms17020224. PMC 4783956. PMID 26861310.
- ^ Aamann L, Dam G, Rinnov AR, Vilstrup H, Gluud LL, et al. (Cochrane Hepato-Biliary Group) (December 2018). «Physical exercise for people with cirrhosis». The Cochrane Database of Systematic Reviews. 2018 (12): CD012678. doi:10.1002/14651858.CD012678.pub2. PMC 6517144. PMID 30575956.
- ^ «E-medicine liver transplant outlook and survival rates». Emedicinehealth.com. 2009-06-09. Archived from the original on 2009-07-14. Retrieved 2009-09-06.
- ^ Kamath PS, Kim WR (March 2007). «The model for end-stage liver disease (MELD)». Hepatology. 45 (3): 797–805. doi:10.1002/hep.21563. PMID 17326206. S2CID 10440305.
- ^ Chavez-Tapia NC, Barrientos-Gutierrez T, Tellez-Avila FI, Soares-Weiser K, Uribe M (September 2010). «Antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding». The Cochrane Database of Systematic Reviews. 2010 (9): CD002907. doi:10.1002/14651858.CD002907.pub2. PMC 7138054. PMID 20824832.
- ^ Ferrell B, Connor SR, Cordes A, Dahlin CM, Fine PG, Hutton N, et al. (June 2007). «The national agenda for quality palliative care: the National Consensus Project and the National Quality Forum». Journal of Pain and Symptom Management. 33 (6): 737–744. doi:10.1016/j.jpainsymman.2007.02.024. PMID 17531914.
- ^ a b Sanchez W, Talwalkar JA (March 2006). «Palliative care for patients with end-stage liver disease ineligible for liver transplantation». Gastroenterology Clinics of North America. 35 (1): 201–219. doi:10.1016/j.gtc.2005.12.007. PMID 16530121.
- ^ Poonja Z, Brisebois A, van Zanten SV, Tandon P, Meeberg G, Karvellas CJ (April 2014). «Patients with cirrhosis and denied liver transplants rarely receive adequate palliative care or appropriate management». Clinical Gastroenterology and Hepatology. 12 (4): 692–698. doi:10.1016/j.cgh.2013.08.027. PMID 23978345.
- ^ a b c d e f g O’Shea RS, Davitkov P, Ko CW, Rajasekhar A, Su GL, Sultan S, et al. (November 2021). «AGA Clinical Practice Guideline on the Management of Coagulation Disorders in Patients With Cirrhosis». Gastroenterology. 161 (5): 1615–1627.e1. doi:10.1053/j.gastro.2021.08.015. PMID 34579936. S2CID 238202670.
- ^ a b Moore KP, Aithal GP (October 2006). «Guidelines on the management of ascites in cirrhosis». Gut. 55 (Suppl 6): vi1–v12. doi:10.1136/gut.2006.099580. PMC 1860002. PMID 16966752.
- ^ Piano S, Tonon M, Angeli P (February 2018). «Management of ascites and hepatorenal syndrome». Hepatology International. 12 (Suppl 1): 122–134. doi:10.1007/s12072-017-9815-0. PMID 28836115. S2CID 3708859.
- ^ Sellers CM, Nezami N, Schilsky ML, Kim HS (April 2019). «Transjugular intrahepatic portosystemic shunt as a bridge to liver transplant: Current state and future directions». Transplantation Reviews. 33 (2): 64–71. doi:10.1016/j.trre.2018.10.004. PMID 30477811. S2CID 53736623.
- ^ Lee EW, Shahrouki P, Alanis L, Ding P, Kee ST (June 2019). «Management Options for Gastric Variceal Hemorrhage». JAMA Surgery. 154 (6): 540–548. doi:10.1001/jamasurg.2019.0407. PMID 30942880. S2CID 93000660.
- ^ «Gastroscopy – examination of oesophagus and stomach by endoscope». BUPA. December 2006. Archived from the original on 2007-10-06. Retrieved 2007-10-07.
- ^ National Digestive Diseases Information Clearinghouse (November 2004). «Upper Endoscopy». National Institutes of Health. Retrieved 2007-10-07.
- ^ «What is Upper GI Endoscopy?». Patient Center — Procedures. American Gastroenterological Association. Archived from the original on 2007-09-28. Retrieved 2007-10-07.
- ^ a b c d e f Ferenci P (Feb 2022). «Hepatic encephalopathy in adults: Treatment». www.uptodate.com. Retrieved 2022-03-22.
- ^ Patidar KR, Bajaj JS (November 2015). «Covert and Overt Hepatic Encephalopathy: Diagnosis and Management». Clinical Gastroenterology and Hepatology. 13 (12): 2048–2061. doi:10.1016/j.cgh.2015.06.039. PMC 4618040. PMID 26164219.
- ^ a b Merli M, Berzigotti A, Zelber-Sagi S, Dasarathy S, Montagnese S, Genton L, et al. (January 2019). «EASL Clinical Practice Guidelines on nutrition in chronic liver disease». Journal of Hepatology. 70 (1): 172–193. doi:10.1016/j.jhep.2018.06.024. PMC 6657019. PMID 30144956.
- ^ Weissenborn K (February 2019). «Hepatic Encephalopathy: Definition, Clinical Grading and Diagnostic Principles». Drugs. 79 (Suppl 1): 5–9. doi:10.1007/s40265-018-1018-z. PMC 6416238. PMID 30706420.
- ^ Francoz C, Durand F, Kahn JA, Genyk YS, Nadim MK (May 2019). «Hepatorenal Syndrome». Clinical Journal of the American Society of Nephrology. 14 (5): 774–781. doi:10.2215/CJN.12451018. PMC 6500947. PMID 30996046.
- ^ Kim MY, Choi H, Baik SK, Yea CJ, Won CS, Byun JW, et al. (December 2010). «Portal hypertensive gastropathy: correlation with portal hypertension and prognosis in cirrhosis». Digestive Diseases and Sciences. 55 (12): 3561–3567. doi:10.1007/s10620-010-1221-6. PMID 20407828. S2CID 24332780.
- ^ a b Sipeki N, Antal-Szalmas P, Lakatos PL, Papp M (March 2014). «Immune dysfunction in cirrhosis». World Journal of Gastroenterology. 20 (10): 2564–2577. doi:10.3748/wjg.v20.i10.2564. PMC 3949265. PMID 24627592.
- ^ Forner A, Llovet JM, Bruix J (March 2012). «Hepatocellular carcinoma». Lancet. 379 (9822): 1245–1255. doi:10.1016/S0140-6736(11)61347-0. PMID 22353262. S2CID 24927898.
- ^ Singal AG, Pillai A, Tiro J (April 2014). «Early detection, curative treatment, and survival rates for hepatocellular carcinoma surveillance in patients with cirrhosis: a meta-analysis». PLOS Medicine. 11 (4): e1001624. doi:10.1371/journal.pmed.1001624. PMC 3972088. PMID 24691105.
- ^ «WHO Disease and injury country estimates». World Health Organization. 2009. Archived from the original on 2009-11-11. Retrieved Nov 11, 2009.
- ^ a b Asrani SK, Devarbhavi H, Eaton J, Kamath PS (January 2019). «Burden of liver diseases in the world». Journal of Hepatology. 70 (1): 151–171. doi:10.1016/j.jhep.2018.09.014. PMID 30266282. S2CID 52882095.
- ^ Anderson RN, Smith BL (November 2003). «Deaths: leading causes for 2001». National Vital Statistics Reports. 52 (9): 1–85. PMID 14626726.
- ^ Tamparo C (2011). Diseases of the Human Body (5th ed.). Philadelphia, PA: F. A. Davis Company. p. 422. ISBN 978-0-8036-2505-1.
- ^ a b c Sepanlou SG, Safiri S, Bisignano C, Ikuta KS, Merat S, Saberifiroozi M, et al. (GBD 2017 Cirrhosis Collaborators) (March 2020). «The global, regional, and national burden of cirrhosis by cause in 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017». The Lancet. Gastroenterology & Hepatology. 5 (3): 245–266. doi:10.1016/S2468-1253(19)30349-8. PMC 7026710. PMID 31981519.
- ^ κιρρός. Liddell, Henry George; Scott, Robert; A Greek–English Lexicon at the Perseus Project.
- ^ Harper, Douglas. «cirrhosis». Online Etymology Dictionary.
- ^ Harper, Douglas. «-osis». Online Etymology Dictionary.
External links[edit]
- Cirrhosis of the Liver at the National Digestive Diseases Information Clearinghouse (NDDIC). NIH Publication No. 04-1134, December 2003.
- «Cirrhosis». MedlinePlus. U.S. National Library of Medicine.
Цирроз печени

Признаки цирроза печени, симптомы и способы лечения
Цирроз печени – хроническое заболевание, сопровождающееся структурными изменениями печени с образованием рубцовых тканей, сморщиванием органа и уменьшением ее функциональности.
Он может развиться на фоне длительного и систематического злоупотребления алкоголем, вирусного гепатита с последующим переходом его в хроническую форму, либо вследствие нарушений аутоиммунного характера, обструкции внепеченочных желчных протоков, холангита.
Науке известны случаи, когда к данному заболеванию приводила затяжная сердечная недостаточность, паразитарные поражения печени, гемохроматоз и т.д.
Что это такое?
Цирроз печени — хроническое заболевание печени, сопровождающееся необратимым замещением паренхиматозной ткани печени фиброзной соединительной тканью, или стромой. Печень с циррозом увеличена или уменьшена в размерах, необычно плотная, бугристая, шероховатая. Смерть наступает в зависимости от различного рода случаев в течение двух–четырёх лет с сильными болями и мучениями пациента в терминальной стадии болезни.
Немного исторических данных
Еще с Древних времен, печень считали таким же важным органом, как сердце. По представлениям жителей Мессопотамии, в печени вырабатывается кровь и живет душа. Еще Гиппократ описывал связь между болезнями печени и желтухой, а также асцитом. Он утверждал, что желтуха и твердая печень – плохое сочетание признаков. Это было первое суждение о циррозе печени и его симптомах.
Цирроз печени и причины его возникновения были описаны в 1793 году Мэтью Бэйлли в трактате «морбидная анатомия». В своей работе он четко связал употребление алкогольных напитков с возникновением симптомов цирроза печени. По его мнению, болели чаще мужчины среднего и старшего возраста. Англичане окрестили цирроз печени «джиновой чумой» или «джиновой печенью».
Термин цирроз происходит от греческого «kirrhos», что означает желтый цвет и принадлежит Рене Теофилу Гиацинту Лаэннеку – французскому врачу и анатому. Над изучением цирроза печени трудились и трудятся до нашего времени много ученых. Вирхов, Кюне, Боткин, Татаринов, Абеллов и другие предложили много теорий о том, что такое цирроз печени, его симптомы, причины, методы диагностики и лечения.
Причины развития цирроза
Среди основных причин, приводящих к развитию болезни, выделяют:
- Вирусный гепатит, который по разным оценкам приводит к формированию патологии печени в 10-24% случаев. Болезнью заканчиваются такие разновидности гепатитов, как В, С, D и недавно обнаруженный гепатит G;
- Различные заболевания желчных путей, среди которых внепеченочная обструкция, желчнокаменная болезнь и первичный склерозирующий холангит;
- Нарушения в работе иммунной системы. К развитию цирроза приводят многие аутоиммунные болезни;
- Портальная гипертензия;
- Венозный застой в печени или синдром Бадда-Киари;
- Отравления химическими веществами, оказывающими токсическое влияние на организм. Среди таких веществ особо губительны для печени промышленные яды, соли тяжелых металлов, афлатоксины и грибные яды;
- Болезни, передающиеся по наследству, в частности, генетически обусловленные нарушения обмена веществ (аномалии накопления гликогена, болезнь Вильсона-Коновалова, дефицит а1-антитрипсина и галактозо-1-фосфат-уридилтрансферазы);
- Длительный приём лекарственных препаратов, среди которых Ипразид, анаболические стероидные средства, Изониазид, андрогены, Метилдофа, Индерал, Метотрексат и некоторые другие;
- Прием больших доз алкоголя на протяжении 10 лет и более. Зависимости от конкретного вида напитка нет, основополагающий фактор – присутствие в нем этилового спирта и его регулярное поступление в организм;
- Редкая болезнь Рандю-Ослера также может стать причиной цирроза.
Кроме того, отдельно стоит сказать о криптогенном циррозе, причины которого остаются невыясненными. Он имеет место в пределах от 12 до 40% случаев. Провоцирующими факторами формирования рубцовой ткани могут стать систематическое недоедание, инфекционные болезни, сифилис (бывает причиной цирроза у новорожденных). Существенно повышает риск развития болезни комбинированное влияние этиологических факторов, например, сочетание гепатита и алкоголизма.
Классификация
Современная классификация рассматриваемого заболевания основывается на учете этиологических, морфогенетических и морфологических критериев, а также критериев клинико-функциональных. Исходя из причин, на фоне воздействия которых развился цирроз печени, определяют следующие его варианты:
- билиарный цирроз (первичный, вторичный) (холестаз, холангит);
- циркуляторный цирроз (возникший на фоне венозного хронического застоя);
- обменно-алиментарный цирроз (недостаток витаминов, белков, циррозы накопления, возникающие в результате наследственных обменных нарушений);
- инфекционный (вирусный) цирроз (гепатиты, инфекции желчных путей, заболевания печени паразитарного масштаба);
- токсический цирроз, цирроз токсико-аллергический (пищевые и промышленные яды, медпрепараты, аллергены, алкоголь);
- криптогенный цирроз.
В зависимости от клинико-функциональных характеристик, цирроз печени характеризуется рядом следующих особенностей:
- уровень печеночно-клеточной недостаточности;
- общий характер течения заболевания (прогрессирующий, стабильный или регрессирующий);
- степень актуальной для заболевания портальной гипертензии (кровотечения, асцит);
- общая активность процесса течения заболевания (активный цирроз, цирроз умеренно активный, а также неактивный цирроз).
Портальный цирроз печени
Самая распространенная форма заболевания, которая характеризуется поражением печеночных тканей и гибелью гепатоцитов. Изменения происходят из-за неправильного питания и злоупотребления алкогольными напитками. В 20% портальный цирроз печени может вызвать болезнь Боткина. Сначала пациент жалуется на нарушения со стороны пищеварительного тракта. Затем развиваются внешние признаки болезни: пожелтение кожных покровов, появление на лице сосудистых звездочек. Последняя стадия характеризуется развитием асцита (брюшной водянки).
Билиарный цирроз
Это особая форма заболевания, развивающаяся вследствие длительного холестаза или поражения желчных путей. Билиарный цирроз является аутоиммунной патологией, которая длительно протекает безо всякой симптоматики. Болеют им в основном женщины 40-60 лет. Первичная степень болезни часто сочетается с сахарным диабетом, красной волчанкой, дерматомиозитом, ревматоидным артритом и лекарственной аллергией.
Первые признаки
Среди ранних симптомов, указывающих на цирроз, можно отметить следующие:
- Во рту появляется чувство горечи и сухость, особенно часто в утренние часы;
- Больной несколько теряет в весе, становится раздражительным, быстрее утомляется;
- Человека могут беспокоить периодические расстройства стула, усиленный метеоризм;
- Периодически возникающие боли с локализацией в правом подреберье. Они имеют тенденцию к нарастанию после усиленных физических нагрузок или после принятия жирной и жареной пищи, алкогольных напитков;
- Некоторые формы болезни, например, постнекротический цирроз, проявляют себя в виде желтухи уже на ранних этапах развития.
В некоторых случаях болезнь заявляет о себе остро и ранние признаки отсутствуют.
Симптомы цирроза
Для цирроза характерны общие симптомы: слабость, пониженная трудоспособность, неприятные ощущения в животе, диспепсические расстройства, повышение температуры тела, боли в суставах, также отмечаются метеоризм, боль и чувство тяжести в верхней половине живота, похудение, астения. При осмотре выявляется увеличение печени, уплотнение и деформация её поверхности, заострение края. Сначала отмечается равномерное умеренное увеличение обеих долей печени, позднее как правило преобладает увеличение левой доли. Портальная гипертензия проявляется умеренным увеличением селезенки.
Развёрнутая клиническая картина проявляется синдромами печёночно-клеточной недостаточности и портальной гипертензии. Имеют место вздутие живота, плохая переносимость жирной пищи и алкоголя, тошнота, рвота, диарея, чувство тяжести или боль в животе (преимущественно в правом подреберье). В 70 % случаев обнаруживается гепатомегалия, печень уплотнена, край заострён. У 30 % больных при пальпации выявляется узловатая поверхность печени. Спленомегалия у 50 % больных.
Субфебрильная температура, возможно, связана с прохождением через печень кишечных бактериальных пирогенов, которые она не в состоянии обезвредить. Лихорадка резистентна к антибиотикам и проходит только при улучшении функции печени. Также могут быть внешние признаки — пальмарная или плантарная эритема, сосудистые звёздочки, скудный волосяной покров в подмышечной области и на лобке, белые ногти, гинекомастия у мужчин вследствие гиперэстрогенемии. В ряде случаев пальцы приобретают вид «барабанных палочек».
В терминальной стадии болезни в 25 % случаев отмечается уменьшение размеров печени. Также возникают желтуха, асцит, периферические отёки из-за гипергидратации (прежде всего отёки ног), внешние венозные коллатерали (варикозно-расширенные вены пищевода, желудка, кишечника). Кровотечение из вен часто заканчивается летальным исходом. Реже возникают геморроидальные кровотечения, они менее интенсивны.
Последствия
Цирроз печени, в принципе, в одиночку, не вызывает смерть, смертельно опасны его осложнения в стадии декомпенсации. Среди них:
- Асцит при циррозе — это скопление жидкости в брюшной полости. Назначают диету с ограничением белка (до 0,5 грамм на кг массы тела) и соли, мочегонные препараты, внутривенное введение альбумина (белковый препарат). При необходимости прибегают к парацентезу – удалению избытка жидкости из брюшной полости.
- Спонтанный бактериальный перитонит — воспаление брюшины, за счет инфицирования жидкости в брюшной полости (асцита). У больных повышается температура до 40 градусов, озноб, появляется интенсивная боль в животе. Назначают длительно антибиотики широкого спектра действия. Лечение проводят в отделение интенсивной терапии.
- Печеночная энцефалопатия. Проявляется от незначительных неврологических нарушений (головная боль, повышенная утомляемость, заторможенность) до тяжелой комы. Так как она связана с накоплением в крови продуктов белкового обмена (аммиака) – ограничивают, или исключают из рациона белок, назначают пребиотик – лактулозу. Она обладает слабительным действием и способностью связывать и уменьшать образования аммиака в кишечнике. При выраженных неврологических нарушениях лечения проводят в отделении интенсивной терапии.
- Гепаторенальный синдром – развитие острой почечной недостаточности у больных с циррозом печени. Прекращают применение мочегонных препаратов, назначают внутривенное введение альбумина. Лечение проводят в отделение интенсивной терапии.
- Острое варикозное кровотечение. Возникает из варикозно расширенных вен пищевода и желудка. У больного нарастает слабость, падает артериальное давление, учащается пульс, появляется рвота с примесью крови (цвета кофейной гущи). Лечение проводят в отделение интенсивной терапии, при неэффективности, применяют хирургическое методы лечения. Для остановки кровотечения применяют внутривенное введение октропида (для снижения давления в кровотоке брюшных сосудов), эндоскопическое лечение (перевязка варикозно расширенных узлов, склеротерапия). Осторожно проводят переливание растворов и компонентов крови, для поддержания необходимого уровня гемоглобина.
- Развитие гепатоцеллюлярной карциномы – злокачественного новообразования печени.
Кардинальное лечение гепатоцеллюлярной карциномы и декомпенсированного цирроза печени – пересадка печени. Замена печени пациента печенью донора.
Цирроз печени на последней стадии: фото людей
На фото ниже показано, как проявляется заболевание у человека.
Асцит при циррозе печени — осложнение
Отеки нижних конечностей у пациентки с циррозом печени при хроническом гепатите
Диагностика
Определение диагноза цирроз печени проходит в несколько этапов. Сам диагноз ставится на основании данных инструментальных исследований:
- Магнитно-резонансная или компьютерная томография – наиболее точный метод диагностики.
- Биопсия – метод гистологического исследования материала, взятого из печени, который позволяет установить вид цирроза крупно- или мелкоузловой и причину развития заболевания.
- УЗИ – в качестве скрининга. Позволяет установить только предварительный диагноз, однако является незаменимым при постановке диагноза асцит и портальная гипертензия.
Если при постановке диагноза гистологическое исследование не позволило определить причину развития заболевания, продолжают ее поиск. Для этого выполняют анализ крови на предмет наличия:
- антимитохондриальных антител;
- РНК вируса гепатита С и ДНК вируса гепатита В при помощи ПЦР-метода;
- альфа-фетопротеина – для того, чтобы исключить рак крови;
- уровня меди и церрулоплазмина;
- уровень иммуноглобулинов А и G, уровня Т-лимфоцитов.
На следующем этапе определяется степень повреждения организма вследствие поражения печени. Для этого используют:
- сцинтиграфия печени – радионуклидное исследование для определения работающих клеток печени;
- биохимический анализ крови для определения таких показателей, как уровень натрия и калия, коагулограмма, холестерин, щелочная фосфатаза, билирубин общий и фракционный, АСТ, АЛТ, липидограмма, протеинограмма;
- степень поражения почек – креатинин, мочевина.
Отсутствие или наличие осложнений:
- УЗИ для исключения асцита;
- исключение внутренних кровотечений в пищеварительном тракте путем исследования кала на наличие в нем скрытой крови;
- ФЭГДС – для исключения варикозных расширений вен желудка и пищевода;
- ректороманоскопия для исключения варикозных расширений вен в прямой кишке.
Печень при циррозе прощупывается через переднюю стенку брюшины. При пальпации ощутима бугристость и плотность органа, однако это возможно только на стадии декомпенсации.
При ультразвуковом исследовании четко определяются очаги фиброза в органе, при этом они классифицируются на мелкие – меньше 3 мм, и крупные – свыше 3 мм. При алкогольной природе цирроза развиваются изначально мелкие узлы, биопсия определяет специфические изменения в клетках печени и жировой гепатоз. На более поздних стадиях заболевания узлы укрупняются, становятся смешанными, жировой гепатоз исчезает. Первичный билиарный цирроз отличается увеличением печени с сохранением структуры желчевыводящих путей. При вторичном билиарном циррозе печень увеличивается за счет препятствий в желчных протоках.
Стадии цирроза печени
Течение заболевания, как правило, характеризуется собственной продолжительностью, при этом выделяют следующие основные его стадии:
- Стадия компенсации. Характеризуется отсутствием симптоматики цирроза, что объясняется усиленнием работы сохранившихся печеночных клеток.
- Стадия субкомпенсации. На данном этапе отмечаются первые признаки цирроза печени (в виде слабости и дискомфорта области правого подреберья, снижения аппетита и похудения). Выполнение функций, присущих работе печени, происходит в неполном объеме, что происходит по причине постепенного утрачивания ресурсов сохранившихся клеток.
- Стадия декомпенсации. Здесь уже речь идет о печеночной недостаточности, проявляемой выраженными состояниями (желтуха, портальная гипертензия, кома).
Как лечить цирроз печени?
Вообще, лечение цирроза печени подбирается в строго индивидуальном порядке – терапевтическая тактика зависит от стадии развития болезни, вида патологии, общего состояния здоровья больного, сопутствующих заболеваний. Но существуют и общие принципы назначения лечения.
К таковым относятся:
- Компенсированная стадия цирроза печени всегда начинается с устранения причины патологии – печень в этом случае еще способна функционировать в обычном режиме.
- Больному нужно придерживаться строгой диеты – даже небольшое нарушение может стать толчком к прогрессированию цирроза печени.
- Нельзя при рассматриваемом заболевании проводить физиопроцедуры, лечение теплом. Исключаются и физические нагрузки.
- Если болезнь находится на стадии декомпенсации, то пациент помещается в лечебное учреждение. Дело в том, что при таком течении болезни риск развития тяжелых осложнений очень высок и только медицинские работники смогут своевременно обратить внимание даже на незначительное ухудшение состояния, предотвратить развитие осложнений, которые приводят к смерти больного.
- Чаще всего при лечении назначают гепатопротекторы, бета-адреноблокаторы, препараты натрия и урсодезоксихолевой кислоты.
Общие советы больным циррозом печени:
- Отдыхайте, как только почувствуете усталость.
- Для улучшения пищеварения больным назначают полиферментные препараты.
- Не поднимайте тяжести (это может спровоцировать желудочно-кишечное кровотечение)
- Ежедневно измеряйте вес тела, объем живота на уровне пупка (увеличение в объеме живота и веса тела говорит о задержке жидкости);
- При задержке жидкости в организме (отеки, асцит) необходимо ограничить прием поваренной соли до 0,5г в сутки, жидкости — до 1000-1500мл в сутки.
- Для контроля степени поражения нервной системы рекомендуется использовать простой тест с почерком: каждый день записывайте короткую фразу, например, «Доброе утро» в специальную тетрадь. Показывайте свою тетрадь родственникам — при изменении почерка обратитесь к лечащему врачу.
- Ежедневно считайте баланс жидкости за сутки (диурез): подсчитывать объем всей принимаемой внутрь жидкости (чай, кофе, вода, суп, фрукты и т.д.) и подсчитывать всю жидкость, выделяемую при мочеиспускании. Количество выделяемой жидкости должно быть примерно на 200-300 мл больше, чем количество принятой жидкости.
- Добивайтесь частоты стула 1-2 раза в день. Больным циррозом печени для нормализации работы кишечника и состава кишечной флоры в пользу «полезных» бактерий рекомендуется принимать лактулозу (дюфалак). Дюфалак назначают в той дозе, которая вызывает мягкий, полуоформленный стул 1-2 раза в день. Доза колеблется от 1-3 чайных ложек до 1-3 столовых ложек в сутки, подбирается индивидуально. У препарата нет противопоказаний, его можно принимать даже маленьким детям и беременным женщинам.
Лечение патологических проявлений и осложнений при циррозе подразумевают под собой:
- Уменьшение асцита консервативными (мочегонные препараты по схеме) и хирургическими (выведение жидкости через дренажи) методами.
- Лечение энцефалопатии (ноотропы, сорбенты).
- Снятие проявлений портальной гипертензии — от применения неселективных бета-адреноблокаторов (пропранолол, надолол) до перевязки расширенных вен во время операции.
- Превентивная антибиотикотерапия для профилактики инфекционных осложнений при планируемых посещениях дантиста, перед инструментальными манипуляциями.
- Лечение диспепсии с помощью коррекции питания и применения ферментных препаратов без желчных кислот (панкреатин). Возможно в таких случаях и применение эубиотиков — бактисубтил, энтерол, бифидумбактерин и лактобактерин.
- Для снятия кожного зуда испорльзуют антигистаминные вещества, а также препараты, содержащие урсодеоксихолевую кислоту.
- Назначение андрогенов мужчинам с выраженными проявлениями гипогонадизма и коррекция гормонального фона женщин для профилактики дисфункциональных маточных кровотечений – под контролем эндокринолога.
- Показано применение препаратов, содержащих цинк для профилактики судорог при обычной мышечной нагрузке и в комплексе лечения печеночной недостаточности, для снижения гипераммониемии.
- Профилактика остеопороза у больных с хроническим холестазом и при первичном билиарном циррозе, при наличии аутоиммунного гепатита с приёмом кортикостероидов. Для этого дополнительно вводится кальций в комплексе с витамином Д.
- Хирургическая коррекция портальной гипертензии для профилактики желудочно-кишечных кровотечений, включает в себя наложение сосудистых анастомозов (мезентерикокавальный и спленоренальный) а так же склеротерапию имеющихся расширенных вен.
- При наличии одиночных очагов перерождения в гепатоцеллюлярную карциному и тяжести течения заболевания класса А, больным показано операционное удаление пораженных сегментов печени. При клиническом классе болезни В и С и массивном поражении, в ожидании проведения трансплантации, назначают противоопухолевое лечение для воспрепятствия прогрессии. Для этого используют как воздействие токов и температур (чрескожная радиочастотная термальная абляция), так и химиотерапию путем прицельного введения масляных растворов цитостатиков в сосуды, питающие соответствующие сегменты печени (хемоэмболизация).
Лечение такого развившегося грозного смертельного осложнения как острого массивного кровотечения из вен пищевода включает в себя:
- Местное применение зонда Блэкмора, с помощью которого раздувающаяся в просвете пищевода воздушная манжетка, сдавливает расширенные кровоточащие вены.
- Прицельное обкалывание стенки пищевода склерозирующими веществами.
- Кровезаместительная терапия.
К сожалению, это состояние и становится основной причиной смерти больных циррозом печени.
Диета при циррозе печени
Соблюдение диеты при циррозе печени предусматривает, прежде всего, отказ от пищи, в которой имеет место высокое содержание белка. Ведь у больных циррозом печени переваривание белковой пищи нарушается, и в итоге интенсивность процессов гниения в кишечнике возрастает. Диета при циррозе печени предусматривает периодическое проведение разгрузочных дней, во время которых больной вообще не употребляет пищи, содержащей белок. Кроме того, немаловажным моментом является ограничение употребления вместе с основной едой поваренной соли.
Диета при циррозе печени предусматривает исключение всех продуктов, в которых содержится питьевая сода и пекарный порошок. Нельзя употреблять солений, бекона, ветчины, морепродуктов, солонины, консервов, колбасы, соусов с солью, сыров, мороженого. Чтобы улучшить вкус продуктов, можно использовать вместо соли специи, лимонный сок.
Диета при циррозе печени допускает употребление небольшого количества диетического мяса – кролика, телятины, домашней птицы. Один раз в день можно съедать одно яйцо.
Прогноз болезни
Цирроз печени неизлечим, только если не проведена пересадка печени. С помощью вышеуказанных препаратов можно только поддерживать более или менее достойное качество жизни.
Сколько живут люди с циррозом печени, зависит от причины заболевания, стадии, на которой он был обнаружен и осложнений, которые успели появиться на момент начала лечения:
- при развитии асцита живут 3-5 лет;
- если развивается желудочно-кишечное кровотечение в первый раз, переживет его от 1/3 до половины людей;
- если развилась печеночная кома, это означает практически 100% летальность.
Есть также шкала, которая позволяет прогнозировать ожидаемую продолжительность жизни. Она учитывает результаты анализов и степень энцефалопатии:
| Параметр | Баллы | ||
| 1 | 2 | 3 | |
| Асцит | Нет | Живот мягкий, уходит под действие мочегонных | Живот напряжен, его объем плохо уменьшается при приеме мочегонных |
| Изменение личности, памяти, сонливости | Нет | Легкая степень | Сильно выражена |
| Билирубин общий | Меньше 34 мкмоль/л | 31-51 мкмоль/л | Больше 51 мкмоль/л |
| Альбумин | 3,5 г/л и более | 2,8-3,5 г/л | Менее 2,8 г/л |
| Протромбиновый индекс | Более 60% | 40-60% | Менее 40% |
| Сумма баллов | 5-6 | 7-9 | 10-15 |
| Сколько живут | 15-20 лет | Надо пересаживать печень, но послеоперационная летальность – 30% | 1-3 года. Если провести трансплантацию на этой стадии, вероятность умереть после операции 82 из 100 |
Профилактика
Цирроз печени – это довольно длительный процесс, который поддается остановке и лечению. Основной залог успеха – вовремя направиться к врачу. Тем не менее, это одно из тех заболеваний, которого можно легко избежать, придерживаясь определенных профилактических мер, в числе которых:
- вакцинация от гепатита В в детском возрасте;
- рациональное и правильное питание;
- недопущение голодования и переедания;
- отказ от алкоголя и курения, чтобы исключить алкогольный цирроз и токсическое поражение печени;
- ежегодное ультразвуковое и эндоскопическое обследование;
- своевременное обращение к врачу за медицинской помощью;
- адекватный прием витаминно-минеральных комплексов;
- жесткое пресечение и лечение наркомании.
Также помогут избежать развития цирроза профилактические меры по предупреждению вирусного гепатита.
Цирроз и фиброз печени
Версия: Клинические рекомендации РФ 2021 (Россия)
Категории МКБ:
Алкогольный цирроз печени (K70.3), Гепаторенальный синдром (K76.7), Печеночная недостаточность, не классифицированная в других рубриках (K72), Токсическое поражение печени с фиброзом и циррозом печени (K71.7), Фиброз и цирроз печени (K74)
Разделы медицины:
Гастроэнтерология
Общая информация
Краткое описание
Разработчик клинической рекомендации
-
Российское общество по изучению печени
-
Российская Гастроэнтерологическая Ассоциация
Одобрено Научно-практическим Советом Минздрава РФ
Клинические рекомендации Цирроз и фиброз печени
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: K70.3, K71.7, K74.0-K74.6,K72, K76.7
Год утверждения (частота пересмотра): 2021
Возрастная категория: Взрослые
Год окончания действия: 2023
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Цирроз печени (ЦП)– это диффузный процесс, характеризующийся фиброзом и трансформацией нормальной структуры печени с образованием узлов. ЦП представляет собой финальную стадию большинства хронических диффузных заболеваний печени. Естественное течение ЦП характеризуется бессимптомной стадией (компенсированный ЦП), которая сменяется стадией повышения давления в портальной системе и ухудшением функции печени, что приводит к появлению клинической картины в виде осложнений цирроза печени (стадия декомпенсации). В стадии компенсации у пациентов, как правило, хорошее качество жизни, и заболевание может протекать скрыто в течение нескольких лет. Стадия декомпенсации проявляется развитием выраженных клинических симптомов, к наиболее важным относятся следующие:
-
Асцит (с инфицированием или без инфицирования асцитической жидкости)
-
Кровотечение из варикозных вен пищевода и желудка (ВВПиЖ)
-
Печеночная энцефалопатия (ПЭ)
-
Дисфункция/острое повреждение почек (ОПП) и гепаторенальный синдром (ГРС)
-
Легочные осложнения (печеночный гидроторакс, гепатопульмональный синдром (ГПС), портопульмональная гипертензия (ППГ))
-
Цирротическая кардиомиопатия и вторичная надпочечниковая недостаточность
-
Инфекционные осложнения (спонтанный бактериальный перитонит (СБП), мочевая инфекция, пневмония, инфекции мягких тканей и бактериемия) [1].
Асцит — патологическое накопление жидкости в брюшной полости, встречается более чем у 50 % больных с 10-летней историей заболевания печени и значительно ухудшает прогноз жизни пациентов с ЦП. В течение первого года от момента появления асцита выживает от 45 до 82 % больных, в течение пяти лет – менее 50 % [2].
Кровотечение из ВВПиЖ — критическое состояние, которое возникает при натяжении и разрыве стенки ВВПиЖ из-за повышения давления в портальной системе [19, 20, 23].
Портальная гипертензия – это клинический симптомокомплекс, который гемодинамически проявляется патологическим повышением портального градиента давления, что сопровождается формированием порто-системных коллатералей, через которые происходит сброс крови из портальной вены в обход печени [1, 3, 23].
Печеночная энцефалопатия (ПЭ) — комплекс потенциально обратимых нервно-психических нарушений, возникающих в результате печеночной недостаточности и/или портосистемного шунтирования крови [1, 2, 68].
Острое повреждение почек (ОПП) и гепаторенальный синдром (ГРС) – потенциально обратимое нарушение почечной функции, вызванное системным воспалением и/или вазоконстрикцией (в отсутствие других причин) и не отвечающее на адекватную заместительную терапию [3, 4, 61].
Гипонатриемия разведения – снижение уровня натрия сыворотки крови ниже 130 ммоль/л. Встречается в среднем у трети госпитализированных больных ЦП и асцитом.
Спонтанный бактериальный перитонит (СПБ) — инфицирование асцитической жидкости в отсутствии какого-либо очевидного источника инфекции [3, 5].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической клаcсификации болезней и проблем, связанных со здоровьем
K70.3 — алкогольный цирроз печени
K71.7 — токсическое поражение печени с фиброзом и циррозом печени
Фиброз и цирроз печени (K74)
K74.0 Фиброз печени
K74.1 Склероз печени
K74.2 Фиброз печени в сочетании со склерозом печени
K74.3 Первичный билиарный цирроз
K74.4 Вторичный билиарный цирроз
K74.5 Билиарный цирроз неуточненный
K74.6 Другой и неуточненный цирроз печени
К76.6 Портальная гипертензия
Осложнения цирроза печени
К72 Печёночная недостаточность, не классифицированная в других рубриках (в т.ч. печёночная энцефалопатия/кома)
К76.7 Гепаторенальный синдром
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
По морфологическим признакам ЦП классифицируют:
а) макронодулярный (крупноузловой) – нерегулярно расположенные крупные узлы до 5 см в диаметре, разделенные различной ширины тяжами соединительной ткани
б) микронодулярный (мелкоузловой) – регулярно расположенные мелкие узлы 1-3 мм в диаметре, разделенные сетью рубцовой ткани
в) микро-макронодулярный (смешанный)
Чаще всего для оценки тяжести состояния больных с ЦП применяется классификация по Child-Turcotte-Pugh (Таблица 1) – Приложение Г.
Другая оценочная шкала – MELD (Model for End-stage Liver Disease) была разработана в 2002 г. для определения очередности трансплантации печени в листе ожидания (Приложение Г).
Ещё более точным методом оценки тяжести состояния больного циррозом печени и его очередности в листе ожидания пересадки печени является модификация этой шкалы — MELDNa, где наряду с вышеуказанными показателями, учитывается сывороточный уровень натрия. Учитывая то, что пациенты с терминальной стадией хронического заболевания печени представляют крайне нестабильную категорию больных, с частыми декомпенсациями основного процесса и развитием тяжелых осложнений, возникает необходимость регулярного пересчета MELD (таблица 2)[1, 2].
Таблица 2. Необходимый режим повторной оценки MELD
Классификация асцита
В практической работе очень удобна классификация, предложенная Международным клубом по изучению асцита (International Ascitic Club (IAC)), которая включает 3 степени в зависимости от его выраженности [1, 2, 3]:
1 степень — жидкость в брюшной полости определяется только при ультразвуковом исследовании.
2 степень проявляется симметричным увеличением живота.
3 степень представляет собой напряженный асцит.
Если правильное назначение мочегонных препаратов не приводит к уменьшению асцита, то его называют резистентным, что встречается в 10 % случаев среди больных с ЦП и асцитом. Выживаемость таких пациентов в течение 1 года не превышает 50%. Диагностические критерии резистентного асцита:
1. Длительность лечения: интенсивная терапия мочегонными препаратами (максимальные дозировки: антагонисты альдостерона 400 мг/сут, фуросемид** 160 мг/сут) в течение 1 недели при соблюдении диеты с содержанием соли до 5,2 г/сут;
2. Отсутствие ответа на лечение: снижение массы тела менее 0,8 кг каждые 4 дня;
3. Ранний рецидив асцита: возврат асцита 2-3 степени в течение 4 недель от начала лечения;
4. Осложнения, связанные с приемом диуретических препаратов:
-
портосистемная энцефалопатия, развившаяся в отсутствие других провоцирующих факторов,
-
почечная недостаточность вследствие диуретической терапии: повышение уровня сывороточного креатинина на 100% со значением > 2 мг/дл у пациентов, которые ответили на лечение диуретиками,
-
гипонатриемия – понижение уровня сывороточного Na более, чем на 10 ммоль/л до уровня менее 130 ммоль/л (ряд авторов указывают пороговое значение 135 ммоль/л),
-
гипокалиемия – снижение уровня сывороточного К менее 3,5 ммоль/л,
-
гиперкалиемия – повышение уровня сывороточного К более 5,5 ммоль/л [1, 2].
Портальная гипертензия может развиваться при различных патологических процессах, сопровождающихся нарушением кровотока в системе воротной вены. В соответствии с анатомическим расположением препятствия кровотоку форма портальной гипертензии может быть классифицирована как подпеченочная (с вовлечением селезеночной, брыжеечной или воротной вен), внутрипеченочная (заболевания печени) и надпеченочная (заболевания, приводящие к нарушению венозного оттока от печени) [23, 51].
Классификация портальной гипертензии по уровню портального блока:
-
Тромбоз/сужение печеночных вен и обструкция нижней полой вены (синдром Бадда-Киари, инвазия опухолью, мембрана в просвете нижней полой вены);
-
Заболевания сердечно-сосудистой системы (констриктивный перикардит, выраженная трикуспидальная регургитация).
-
Болезнь Рандю-Ослера;
- Врожденный фиброз печени;
- Тромбоз ветвей портальной вены (тяжелый бактериальный холангит, злокачественные новообразования);
- Первичный склерозирующий холангит;
- Гранулематозы (шистосоматоз, саркоидоз, туберкулез);
- Хронический вирусный гепатит;
- Первичный билиарный цирроз;
-
Миелопролиферативные заболевания;
- Нодулярная регенераторная гиперплазия;
- Идиопатическая (нецирротическая) портальная гипертензия/портосинусоидальная болезнь;
- Болезнь Вильсона;
- Гемохроматоз;
- Поликистоз;
- Амилоидоз;
- Воздействие токсичных веществ (медь, мышьяк, 6-меркаптопурин).
-
Все случаи ЦП;
-
Острый алкогольный гепатит;
-
Тяжелый вирусный гепатит;
-
Острая жировая печень беременных;
-
Интоксикация витамином А;
-
Системный мастоцитоз;
-
Печеночная пурпура;
-
Цитотоксичные лекарства.
-
Веноооклюзионная болезнь;
-
Алкогольный центролобулярный гиалиновый склероз;
-
Тромбоз воротной вены и кавернозная трансформация воротной вены;
-
Тромбоз селезеночной вены;
-
Висцеральная артериовенозная фистула;
-
Идиопатическая тропическая спленомегалия;
Классификация ВВ по степени выраженности:
-
I степень – диаметр вен 2-3 мм;
-
II степень – диаметр вен 3-5 мм;
-
III степень – диаметр вен >5 мм [51-53].
Классификация варикозных венпо локализации:
-
I тип — гастроэзофагеальные ВВПиЖ с распространением на кардиальный и субкардиальный отделы малой кривизны желудка;
-
II тип — гастроэзофагеальные ВВПиЖ от эзофагокардиального перехода по большой кривизне по направлению к дну желудка;
-
III тип — изолированные ВВ желудка без ВВ пищевода – варикозная трансформация вен фундального отдела желудка;
-
IV тип — эктопические узлы тела, антрального отдела желудка, двенадцатиперстной кишки [51-53].
Классификация васкулопатии:
-
легкая — небольшие участки розового цвета, окруженные белым контуром;
-
средняя — плоские красные пятна в центре розовой ареолы;
-
тяжелая — сочетание с точечными кровоизлияниями [52,53].
Таблица 3. Классификация степени кровопотери при кровотечении из ВВ
Классификация ПЭ
ПЭ характеризуется широким спектром проявлений, начиная от клинически бессимптомных форм (минимальная ПЭ) до коматозного состояния. Ключевым маркером ПЭ является изменение уровня и содержания сознания. Согласно существующей классификации, ПЭ подразделяют в зависимости от типа, длительности и клинических характеристик. Минимальную ПЭ рассматривают как отдельную форму.
Выделяют несколько типов ПЭ в зависимости от причин, которые привели к ее развитию:
• тип А, который возникает при острой печеночной недостаточности,
• тип В, обусловленный портосистемным шунтированием в отсутствие хронической печеночной недостаточности,
• тип С, наиболее распространенный, обусловленный ЦП [54].
По тяжести клинических проявлений ПЭ делится на две формы: скрытая (минимальная ПЭ и ПЭ 1 степени) и явная ПЭ. Минимальная ПЭ (ранее носившая название латентной ПЭ) характеризуется отсутствием субъективной и объективной клинической симптоматики. Своевременное распознавание этой формы важно по двум следующим причинам:
1) частота минимальной ПЭ достигает 32-85 % вне зависимости от этиологии заболевания печени;
2) минимальная ПЭ опасна неадекватной реакцией пациента в экстремальных условиях, например, при вождении автомобиля, что сопряжено с повышенным риском создания аварийных ситуаций [54, 64].
Стадирование ПЭ проводится согласно критериям West-Haven, что представлено в таблице 4. Определение стадии ПЭ входит в систему оценки тяжести цирроза по классификации Чайлд-Пью и необходимо для оценки жизненного прогноза пациента. Необходимо помнить, что после появления клинически выраженной ПЭ в течение 1 года выживает 42% больных, а в течение 3 лет — всего 23% [1, 2, 54, 55].
Таблица 4. Стадии ПЭ.
По времени развития ПЭ можно разделить на следующие формы:
— эпизодическая ПЭ, для которой характерны интермиттирующие нейропсихические нарушения;
— фульминантная (молниеносная) ПЭ, которая характеризуется быстро нарастающими клиническими проявлениями в условиях фульминантной печеночной недостаточности (как правило, при воздействии гепатотоксичных факторов);
— персистирующая ПЭ, наблюдающаяся преимущественно у больных с выраженными портосистемными коллатералями, в том числе созданными в результате хирургического вмешательства. У пациентов с такой формой ПЭ помимо типичной психоневрологической симптоматики, наблюдаются постепенно проявляющиеся симптомы миелопатии: атаксия, хореоатетоз, параплегия. Эти нарушения обычно необратимы и ведут к церебральной атрофии и деменции;
— рецидивирующая ПЭ, при которой рецидивы клинических проявлений происходят с интервалом в 6 месяцев или чаще.
В соответствии с наличием провоцирующих факторов ПЭ подразделяется на
-
спонтанную ПЭ, которая развивается в отсутствие какого-либо доказанного гепатотоксичного фактора и
-
спровоцированную ПЭ. В этом случае следует указать провоцирующие факторы. Триггерные факторы ПЭ представлены в таблице 5.
Таблица 5. Триггерные факторы ПЭ
* следует помнить, что дефицит белка в рационе пациентов с ЦП также нежелателен, так как провоцирует прогрессирование саркопении, наоборот, нарастание энцефалопатии и тем самым ухудшает прогноз пациентов. Оптимальным считается поступление 1,2-1,5 г белка на 1 кг веса в сутки [1,2,68,190].
Классификация инфекционных осложнений цирроза печени:
1. По времени возникновения выделяют:
-
Внебольничную инфекцию (community-acquired) – диагноз установлен в первые 48-72 часа от момента поступления пациента без его госпитализации в предшествующие 6 месяцев (30% госпитализированных больных). Чаще представлена СБП и мочевой инфекцией;
-
Связанную с оказанием медицинской помощи (healthcare-associated) – диагноз установлен в первые 48-72 часа от момента поступления у больного, имевшего не менее 2 дней госпитализации в предшествующие 6 месяцев (30% госпитализированных больных). Также чаще представлена СБП и мочевой инфекцией;
-
Нозокомиальную инфекцию – диагноз установлен после 48-72 часов от момента поступления больного (40% госпитализированных больных). Преимущественно проявляется в виде мочевой и Cl.difficile-ассоциированной инфекции [3, 11, 56].
2. По ответу на терапию выделяют бактерии со следующими видами антибиотикорезистентности:
-
Бактерии с широкой лекарственной устойчивостью (ExtremelyDrugResistant) –резистентность к одному и более препарату в двух и менее антимикробных категориях;
-
Бактерии с множественной лекарственной устойчивостью (MultiDrugResistance (MDR)) – это приобретенная резистентность микроорганизма к одному и более препарату в трех и более антимикробных категориях. Факторы риска — наличие инфекции, вызванной MDR-штаммами в течение предыдущих 6 месяцев, применение бета-лактамных антибактериальных препаратов (пенициллины) и других бета-лактамных антибактериальных препаратов в течение предыдущих 3 месяцев, длительный профилактический прием фторхинолонов;
-
Бактерии с полирезистентностью – устойчивость ко всем антимикробным препаратам во всех категориях;
-
Энтеробактерии, продуцирующие бета-лактамазы расширенного спектра действия (ESBL producing Enterobacteriaceae)
-
Ванкомицин-резистентные энтерококки [32, 56, 57].
Инфицирование асцитической жидкости (см. Таблицу 6) подразделяется на собственно СБП, при котором обязательно обнаружение нейтрофилов более 250 в 1 мм3 независимо от результата посева асцитической жидкости; бактериальный асцит, при котором количество нейтрофилов менее 250 в 1 мм3, но имеется положительный посев асцитической жидкости [1, 2, 3, 31, 48]. Вторичный бактериальный перитонит может быть заподозрен при получении полимикробной культуры посева асцитической жидкости в сочетании с нейтрофилами асцитической жидкости ≥ 250 в 1 мм3[59]. Этот вариант инфицирования асцитической жидкости возникает в случае перфорации кишки, таким пациентам требуется срочное проведение рентгенологического или КТ-исследования и, при необходимости, хирургическое вмешательство. Полимикробный бактериальный асцит — ятрогенное состояние, вызванное повреждением кишечника во время выполнения парацентеза. Результат посева положительный, но полимикробный бактериальный асцит обычно не вызывает увеличения содержания нейтрофилов и разрешается самостоятельно. Спонтанная бактериальная эмпиема плевры возникает у пациентов с гидротораксом в отсутствие пневмонии. Диагноз устанавливается при высевании микрофлоры и количестве нейтрофилов ≥ 250 в 1 мм3 в плевральной жидкости, либо при негативном результате посева и количестве нейтрофилов ≥ 500 в 1 мм3. Дальнейшая тактика ведения этой группы пациентов такая же как при СБП[59, 60]
Таблица 6. Классификация инфицированных асцитов (по GinesP.)
Классификация нарушений функции почек
ОПП — повышение уровня сывороточного креатинина на ≥ 0,3 мг/дл (≥26,4 ммоль/л) менее чем за 48 часов или повышение уровня сывороточного креатинина на ≥ 50% (в 1,5 раза выше исходного уровня) менее, чем за семь дней.
Острая почечная недостаточность — снижение скорости клубочковой фильтрации (СКФ) ниже 60 мл/мин/1,73 м2 за период менее 3х месяцев или снижение СКФ на ≥35% за период менее 3х месяцев или повышение уровня сывороточного креатинина на 50% за последние три месяца.
Хроническая болезнь почек – снижение СКФ <60 мл/мин/1,73 м2, рассчитанное по формуле MDRD-6, в течение ≥3-х месяцев.
Острое повреждение почек на фоне хронического — ОПП у пациента с ЦП и признаками хронической болезни почек[61].
1A – увеличение креатинина ≥0,3 мг/дл (26,5 мкмоль/л) в пределах 1,5 мг/дл (133 мкмоль/л) по сравнению с исходным
1B – то же, но ≥1,5 мг/дл (133 мкмоль/л)
2 — увеличение креатинина в 2 — 3 раза по сравнению с исходным
3 – увеличение уровня креатинина в 3 раза и более исходного, либо на ≥4,0 мг/дл (353,6) и более, либо начало заместительной почечной терапии.
1. Преренальное ОПП – самая частая причина ОПП у госпитализированных пациентов с декомпенсированным ЦП (68% всех случаев). Основная причина это гиповолемия на фоне острого желудочно-кишечного кровотечения, другой кровопотери, рвоты, диареи, передозировки мочегонных препаратов.
2. Постренальное ОПП встречается очень редко у пациентов с ЦП (<1% всех вариантов ОПП)
3. Ренальное ОПП наблюдается в 30% случаев и представлен, согласно новым критериям Консенсуса Международного клуба по изучению асцита (InternationalAsciticClub – IAC) (адаптация KDIGO), двумя вариантами:
— острый канальцевый некроз (на фоне применения нефротоксичных препаратов, нестероидных противовоспалительных препаратов (НПВП), йодсодержащего контрастного препарата при компьютерной томографии, токсичного воздействия желчных кислот и др.)
— ГРС с критериями ОПП (ГРС по типу ОПП) [61-63].
Этиология и патогенез
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Причинами развития ЦП являются вирусные гепатиты (В, С, D) алкоголь, метаболические нарушения (неалкогольный стеатогеатит, наследственный гемохроматоз, болезнь Вильсона, недостаточность α1-антитрипсина, муковисцидоз, галактоземия, гликогенозы, наследственная тирозинемия, наследственная непереносимость фруктозы, наследственная геморрагическая телеангиоэктазия, абеталипопротеинемия, порфирия), заболевания желчных путей (внепеченочная обструкция желчных путей, внутрипеченочная обструкция желчных путей: первичный билиарный холангит, первичный склерозирующий холангит, холангиопатия у детей), нарушение венозного оттока из печени: синдром Бадда-Киари, веноокклюзионная болезнь, тяжелая правожелудочковая недостаточность, лекарства, токсины, химикаты, обладающие гепатотоксическим эффектом, имунные нарушения: аутоиммунный гепатит, болезнь «трансплантант против хозяина», другие редкие причины: сифилис, шистосоматоз, саркоидоз, гипервитаминоз А, криптогенный ЦП.
Формирование ЦП происходит в ответ на повреждение печеночной паренхимы и характеризуется избыточным отложением экстрацеллюлярного матрикса в результате увеличения синтеза его компонентов и уменьшения скорости их разрушения. Развитие фиброза сопровождается накоплением и отложением коллагена I, III, IV типов, ламинина, фибронектина, гликозамингликанов, протеогликанов, эластина и т. д. в пространстве Диссе, что приводит к образованию соединительнотканной мембраны в стенке внутридольковых венозных капилляров
Нарушение процессов обмена между кровью, поступающей через систему воротной вены, и гепатоцитами приводит к развитию гипоксии и вовлечению последних в процесс фиброгенеза. В результате активного сокращения пресинусоидальных звездчатых клеток и расширения пространства Диссе, заполненных коллагеновыми волокнами, возникает блок току крови, поступающей по системе воротной вены, повышается давление в воротной вене, формируется синдром портальной гипертензии и включаются портокавальные шунты. При дальнейшем прогрессировании перечисленных изменений со временем происходит перестройка архитектоники печеночной ткани и развивается ЦП[6-9, 20].
Прогноз жизни пациентов с ЦП во многом зависит от развития его осложнений, представленных выше [10].
На стадии декомпенсации цирроз печени представляет собой системное заболевание с полиорганной недостаточностью [10], пациенты становятся крайне восприимчивы к развитию бактериальных осложнений в результате иммунной дисфункции, обусловленной нарушением как иннатной, так и адаптивной иммунной системы. Инфекционные осложнения, в свою очередь, утяжеляют течение ЦП, значительно повышают риск острой печеночной недостаточности на фоне хронической и сопровождаются высокой смертностью [11].
Десятилетиями клинические проявления декомпенсации ЦП рассматривались как следствие гемодинамических нарушений, гипердинамического типа кровообращения, связанного с периферической артериальной вазодилатацией, возникающей преимущественно по спланхническому типу. Подобная вазодилатация ставит под угрозу эффективное кровообращение, приводя к периферической органной гипоперфузии, с обязательным вовлечением почек. В свою очередь, снижение эффективного кровообращения запускает активацию вазоконстрикторных механизмов (например, РААС, симпатическая нервная система и секреция вазопрессина) и задержку натрия и воды [12].
Клинически это проявляется развитием асцита, нарушением функции почек, гепатопульмонального синдрома, цирротической кардиомиопатии. Тем не менее, несмотря на убедительность концепции артериальной вазодилатации как основной причины развития осложнений ЦП, накапливающиеся данные позволяют рассматривать естественное течение ЦП с его осложнениями и в контексте теории ЦП как хронического системного воспаления, что подтверждается, в первую очередь, повышением уровня циркулирующих провоспалительных цитокинов и хемокинов. [13]. Это обусловлено попаданием в системный кровоток бактерий и их продуктов, называемых патоген-ассоциированные молекулярные паттерны (PAMPs), в результате патологической бактериальной транслокации из кишечника [14].
К бактериальной транслокации приводит нарушение синтеза белков плотных межклеточных контактов, локального иммунного ответа и собственно состава кишечного микробиома: непатогеннные строгие анаэробы замещаются на условно патогенные факультативные анаэробы, происходит экспансия микроорганизмов из толстой кишки в тонкую. Последнее состояние называется синдромом избыточного бактериального роста в тонкой кишке (СИБР). Увеличение количества факультативных анаэробов в тонкой кишке при СИБР предрасполагает к их проникновению во внутреннюю среду организма (в стенку кишечника, мезентериальные лимфатические узлы, портальный и системный кровоток). Данный феномен получил название бактериальной транслокации. При ЦП наблюдается постоянное попадание PAMPs в системный кровоток и связывание их рецепторами иннатных иммунных клеток, что приводит к высвобождению провоспалительных молекул. Так как факультативные анаэробы, в отличие от строгих анаэробов, способны выживать в оксигенированных тканях, при снижении барьерной функции кишечника, наблюдаемой при ЦП, эти микроорганизмы могут проникать в асцитическую жидкость. Это влечет за собой развитие СБП. При ЦП снижается и барьерная функция печени, что приводит к тому, что факультативные анаэробы могут проникнуть и в системный кровоток, вызвав развитие септицемии или септикопиемии[15].
В основе развития ПЭ лежит поражение печени с выраженным снижением ее детоксицирующей функции и портосистемное шунтирование крови, когда в системный кровоток и далее в головной мозг попадает кровь, содержащая большое количество аммиака и других токсических продуктов кишечного происхождения. Также существенную роль играет уменьшение степени связывания и выведения аммиака скелетными мышцами (снижение активности глутаминсинтетазы) у больных ЦП с саркопенией [16].
Основной причиной асцита (в 80% случаев) являются хронические заболевания печени. Кроме цирроза, другими причинами могут быть острый алкогольный гепатит, синдром Бадда – Киари, гепатоцеллюлярная карцинома и канцероматоз брюшины, острый панкреатит. В патогенезе асцита основную роль играют портальная гипертензия и нарушение катаболизма гормонов и других биологически активных веществ в печени, изменения гемодинамики (увеличение сердечного выброса, снижение системного сосудистого сопротивления, снижение АД, повышение почечного сосудистого сопротивления), водно-электролитный дисбаланс (задержка натрия и воды) [17].
Кровотечение из ВВПиЖ –критическое состояние, возникающее при натяжении и разрыве стенки ВВ из-за повышения давления в портальной системе. При этом определяющим фактором в развитии кровотечения становится разница между давлением в воротной и нижней полой вене — портальный градиент давления. В норме он составляет 1-5 мм рт ст. Портальная гипертензия приводит к образованию портосистемных коллатералей, через которые часть кровотока из воротной вены шунтируется в системный кровоток в обход печени [18]. Клинически значимой портальная гипертензия становится при повышении портального градиента давления >10 мм. рт. ст. [19]. В настоящее время методика в РФ в большинстве центров недоступна.
В развитых странах около 90% случаев портальной гипертензии обусловлено ЦП. В развивающихся странах, кроме цирроза, частой причиной служит поражение мелких ветвей воротной вены при шистосомозе. Нецирротическая портальная гипертензия (вследствие воздействия других патогенетических факторов) составляет от 10 до 20% из всех случаев развития данного синдрома [20].
Варикозные кровотечения представляют грозное осложнение ЦП, второе по частоте после асцита, приводящее к декомпенсации заболевания и ассоциированное с высокой смертностью. Риск кровотечения из ВВПиЖ определяется степенью выраженности ВВ и наличием пятен васкулопатии при ЭГДС. Васкуло- и гастропатия – это совокупность макроскопических проявлений, наблюдаемых в слизистой оболочке пищевода и желудка при портальной гипертензии, связанных с эктазией и дилятацией сосудов слизистого и подслизистого слоев без значительных воспалительных изменений [21-23].
Нарушение функции почек у пациентов с асцитом ассоциированно с высокой смертностью, а в ряде случаев сохраняется даже после успешной трансплантации печени. Длительное время считалось, что ГРС представляет собой функциональное нарушение почечной функции, вызванное вазоконстрикцией, которая возникает у пациентов с продвинутой стадией заболевания печени, а также у пациентов с острой печеночной недостаточностью или тяжелым алкогольным гепатитом. Накапливающиеся данные подвергают сомнению такое определение ГРС, а также классификацию ГРС на тип 1 и тип 2. Во-первых, в патогенезе ГРС задействованы как гемодинамические, так и воспалительные изменения. Во-вторых, отсутствие повреждения паренхимы почек не было доказано нефробиопсией [24]. Отсутствие существенной протеинурии и/или гематурии еще не исключает почечное повреждение, в частности канальцевые (например, острый канальцевый некроз) или интерстициальные изменения. Рутинное исследование маркеров в крови и/или моче, позволяющих дифференцировать тип ОПП, в РФ вне научных целей недоступно. В отличие от предыдущей классификации почечного повреждения новая градация основывается не на уровне креатинина, а на динамике этого показателя за определенные отрезки времени, потому быстрый прирост креатинина может соответствовать критериям ОПП даже в рамках нормальных значений показателя. В настоящее время принято обозначать тип 1 ГРС как ГРС с критериями ОПП(ГРС по типу ОПП), а тип 2 ГРС включает повреждение почек, соответствующее критериям ГРС, но не критериям ОПП [25].
Критерии ГРС по типу ОПП
:
-
Наличие ЦП и асцита
-
Отсутствие положительной динамики креатинина после отмены диуретической терапии и введения жидкости с альбумином человека** в течение 2-х суток
-
Отсутствие шока, сепсиса, препаратов с нефротоксичностью
-
Исключены паренхиматозные заболевания почек (протеинурия >500 мг/сутки, микрогематурия >50 эритроцитов в поле зрения и/или изменения почек при УЗИ)
Согласно современным представлениям, ГРС развивается не только в результате почечной гипоперфузии на фоне спланхнической артериальной вазодилатации и снижения сердечного выброса, но также в результате повышения уровня циркулирующих в крови провоспалительных цитокинов и хемокиновкак следствие бактериальной транслокации [26, 27]. Кроме того, тяжелый холестаз может также ухудшать функцию почек за счет усугубления системного воспаления и канальцевого повреждения, обусловленного действием желчных кислот– билиарная нефропатия [28].
Гипонатриемия разведения встречается в среднем у трети (30 – 35 %) внутригоспитальных больных с ЦП и асцитом, ассоциирована с высокой смертностью, с развитием неврологических осложнений и с низкой выживаемостью после трансплантации печени. У пациентов с ЦП могут развиваться как гиперволемическая, так и гиповолемическая гипонатриемия. Чаще развивается гиперволемическая гипонатриемия, характеризующаяся увеличением объема внеклеточной жидкости, появлением асцита и периферических отеков. Она может возникать спонтанно, или в результате введения большого объема гипотонических растворов, или на фоне осложнений ЦП, сопровождающихся резким ухудшением эффективного кровообращения. Часто предрасполагающими факторами к развитию дилюционной гипонатриемии считаются прием нестероидных противовоспалительных препаратов и выполнение объемного парацентеза без последующего введения плазмозамещающих растворов [29]. В отличие от гиперволемической, гиповолемическая гипонатриемия развивается при уменьшении объема циркулирующей плазмы вследствие передозировки диуретических препаратов у больных без асцита и отеков.
К числу характерных инфекционных осложнений ЦП относится инфицированный асцит (СБП), выявляемый, по данным разных авторов, у 7–31% больных с асцитом. В случае поздней диагностики и отсроченного лечения смертность от СБП может превышать 90%. Большинство эпизодов инфицирования асцитической жидкости вызывается кишечными бактериями. В 70% возбудителями бактериального асцита служат грамотрицательные бактерии — Escherichia coli и Klebsiella spp, 10–20% составляют грамположительные кокки (Streptococcus pneumoniae), часто встречается Candida albicans. Анаэробную флору высевают у 3–4% пациентов. Описаны случаи, вызванныеListeria monocitogenes, а также микобактериями туберкулеза и грибами Cryptococcus neoformans. Развитие СБП всегда инициируется попаданием микроорганизмов в асцитическую жидкость. Бактерии проникают в брюшную полость двумя путями – транслокационным и гематогенным. В настоящее время большее значение придается пассажу микроорганизмов из кишечника, хотя патогенез возникновения СБП до конца не ясен. В патогенезе СБП существенную роль играет СИБР, часто встречающийся у больных ЦП. Этому может способствовать употребление алкоголя больными алкогольным циррозом, снижение секреции соляной кислоты из-за назначения антисекреторных препаратов, уменьшение секреции желчных кислот и увеличение времени кишечного пассажа [11,30-32].
Риск бактериальных инфекций при ЦП обусловлен многими факторами, включающими нарушение функции печени, портосистемное шунтирование, СИБР в кишечнике и генетическую предрасположенность [27].В основе последнего фактора лежит носительство мутаций в гене nucleotide-binding oligomerization domain containing 2(NOD2). NOD2 экспрессируется в эпителиальных клетках, а также в антигенпрезентирующих клетках, например, незрелых дендритных клетках, и в других мононуклеарах. NOD2-ассоциированные мутации могут вести к недостаточной активации NFkB, далее к недостаточной элиминации транслоцирующихся бактерий и усилением бактериальной транслокации через множественные вторичные эффекты. Доказано, что СБП значительно чаще (р=0,008) развивается у носителей мутаций NOD2 (OR — 3.06) [33].
Хорошо изучена связь хронических заболеваний печени с дыхательными нарушениями и гипоксией. Основные легочные осложнения, возникающие у пациентов с хроническим заболеванием печени, — печеночный гидроторакс, гепатопульмональный синдром и портопульмональная гипертензия.
Печеночный гидроторакс (портоплевральный синдром) представляет собой скопление транссудата в плевральных полостях у пациентов с декомпенсированным ЦП в отсутствие заболевания сердца, легочной патологии или заболевания легких. Асцитическая жидкость поступает из брюшной полости в плевральные полости (преимущественно справа) через расширенные поры в диафрагме в результате повышения внутрибрюшного давления и отрицательного внутригрудного давления на вдохе. Печеночный гидроторакс может приводить к тяжелой дыхательной недостаточности и может осложняться спонтанной бактериальной эмпиемой. Прогноз пациентов с портоплевральным синдромом плохой, их средняя выживаемость составляет около 8-12 месяцев [34].
Гепатопульмональный синдром (ГПС) определяют как нарушение легочной оксигенации, вызванное дилатацией сосудов легких и, реже, плевральными и внутрилегочными артериовенозными шунтами в рамках портальной гипертензии. ГПС чаще диагностируют у пациентов с ЦП и портальной гипертензией, иногда он возникает у пациентов с внепеченочной формой портальной гипертензии в отсутствие ЦП и даже у пациентов с острым гепатитом [35-37]. В основе ГПС лежат два механизма: а)дилатация прекапилляров/капилляров легких, уменьшение времени контакта крови с альвеолами (ускорение кровотока); б) формирование артериовенозных соединений и анатомического шунта, что приводит к недостаточной оксигенации крови.
-
Печеночная недостаточность
-
Портальная гипертензия как внутрипеченочная, так и внепеченочная
-
Гипоксемия (PaO2 < 80 мм.рт.ст. при дыхании воздухом, O2 21%)
-
Повышенный альвеолярно-артериальный градиент кислорода (P(A-a)O2 > 15 мм.рт.ст.)
-
Подтверждение внутрилегочных шунтов с помощью эхокардиографии с контрастным усилением (появление микропузырьков воздуха в левых камерах сердца в течение трех – шести сердечных циклов указывает на дилатацию легочных сосудов)
Портопульмональная гипертензия (ППГ)– может быть диагностирована у пациента с портальной гипертензией (в т.ч. нецирротической) в отсутствие других причин для повышения давления в легочных сосудах, в частности, тромбоэмболии легочной артерии, хронического заболевания легких, хронической сердечной недостаточности. Согласно современной классификации легочной гипертензии, ППГ относится к 1 группе. Встречается у 2-5% пациентов с портальной гипертензией, выше в группе пациентов, включенных в лист ожидания ортотопической трансплантации печени – до 8,5%. ППГ ассоциирована с плохим исходом после трансплантации печени – смертность пациентов с систолическим давлением в легочной артерии (СДЛА)> 35 мм.рт.ст. достигает 35%. Для диагностики используются результаты эхокардиографического исследования и кататеризации правых отделов сердца[38]. Диагностические критерии ППГ:
-
наличие клинически значимой портальной гипертензии,
-
среднее давление в легочной артерии > 25 мм.рт.ст. в покое,
-
среднее давление заклинивания легочных капилляров <15 мм.рт.ст.
Подходы к лечению такие же, как и для лечения легочной артериальной гипертензии [39].
Эпидемиология
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
По данным ВОЗ на долю смертности от ЦП приходится до 1,8% случаев в европейских странах, что составляет 170 000 человек в год. Самыми распространенными причинами формирования ЦП являются хронический вирусный гепатит С и алкогольная болезнь печени. Ежегодно от причин, связанных с употреблением алкоголя, умирает 2,5 миллиона человек, среди которых 320 000 — люди в возрасте от 15 до 29 лет. С 2001 г. в стране ежегодно регистрируется более 40 тысяч впервые выявленных случаев ХГС, а доля гепатита С в структуре хронических вирусных гепатитов составляет более 60%. Заболеваемость хроническим гепатитом С в 2016 году в РФ составила 5800000 человек [40].
Вклад в смертность от ЦП любой этиологии вносят его осложнения. ВВПиЖ выявляются у 30-40% больных с компенсированным и у 60% с декомпенсированным ЦП на момент диагностики ЦП, из них у каждого четвертого возникает кровотечение [1, 2, 3].
По данным отчета Европейской ассоциации по изучению печени около 40% трансплантаций печени в Европе проводится по поводу ЦП вирусной этиологии, 33% — алкогольной и еще 5% — вследствие сочетания этих этиологических факторов, при этом процентное соотношение может варьировать в зависимости от страны [2].
Самое частое осложнение ЦП- асцит, приводит к снижению работоспособности пациента, снижению социальной адаптации, часто ведет к госпитализации, к постоянной медикаментозной поддержке. Асцит часто служит причиной развития других осложнений, таких как СБП, рестриктивная дыхательная недостаточность и абдоминальные грыжи. Появление асцита значительно ухудшает прогноз жизни пациентов с ЦП. В течение первого года от момента появления асцита выживает от 45 до 82 % больных, в течение пяти лет – менее 50 % [2].
Заболеваемость и распространенность ПЭ связаны с тяжестью сопутствующей печеночной недостаточности и портосистемного шунта [41, 42]. У пациентов с ЦП явная ПЭ, равно как и кровотечение из ВВПиЖ или асцит, является индикатором стадии декомпенсации заболевания [43].
Распространенность явной ПЭ на момент постановки диагноза ЦП в целом составляет 10 – 14 % [43, 44], 16– 21 % среди пациентов с декомпенсированным ЦП и 10 – 50 % у пациентов с трансюгулярным внутрипеченочным портосистемным шунтом (TIPS) [45]. Кумулятивные данные демонстрируют, что явная ПЭ будет зафиксирована у 30 – 40 % пациентов с ЦП на том или ином этапе лечения. Минимальная ПЭ встречается у 20 – 80 % пациентов с ЦП [46, 47].
Риск СБП повышен у всех пациентов с ЦП и асцитом. Распространенность СБП у амбулаторных пациентов составляет 1,5-3,5%, а у госпитализированных пациентов – 10% [48]. При этом половина случаев СБП приходится на только что госпитализированных пациентов, другая половина развивается у пациентов во время госпитализации [49].
К другим инфекционным осложнениям ЦП относятся инфекции мочевыделительной системы, пневмония, инфекции кожи и мягких тканей, бактериемия. Они представляют собой гетерогенную группу по клиническому течению и прогнозу. Их частота составляет 25-30% среди госпитализированных пациентов с ЦП[3, 5 14, 15,]. Развитие инфекционных осложнений у пациентов с ЦП ассоциировано с повышением смертности в течение месяца на 30% и в течение 12 месяцев на 63%[14, 50].
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Компенсированный ЦП в 30-40% случаев протекает бессимптомно или с некоторыми неспецифическими жалобами: общая слабость, снижение или потеря аппетита, снижение массы тела и мышечной массы, ощущение тяжести в верхней половине живота. Декомпенсированный ЦП характеризуется наличием одного или нескольких клинических признаков: желтуха, увеличение живота в объеме/асцит, отеки нижних конечностей, желудочно-кишечное кровотечение (ЖКК) из ВВПиЖ, прямой кишки, геморрагический синдром (кровоточивость из десен при чистке зубов или носовые кровотечения, спонтанное появление петехий и экхимозов и др.), инверсия сна (бессонница ночью и сонливость в дневные часы). При напряженном асците и/или гидротораксе может появиться одышка при нагрузках, а также кашель в положении лежа. У женщин детородного возраста одним из первых клинических проявлений цирроза печени могут быть нарушения менструального цикла, вплоть до аменореи, а у мужчин – эректильная дисфункция и снижение либидо. Боли в суставах могут быть предвестниками вирусного гепатита, аутоиммунного гепатита, первичного склерозирующего холангита. Кожный зуд – частый признак внутри- и внепеченочного холестаза, в частности при первичном билиарном холангите и первичном склерозирующем холангите.
При сборе анамнеза у пациентов с ЦП, необходимо активно расспрашивать о переливании крови (особенно до 1990 г.), внутривенном введении лекарств или наркотиков, пирсинге, татуировках, особенностях половой жизни, контактах с пациентами с вирусными гепатитами, профессиональных вредностях, характере потребления алкогольных напитков, недавней инсоляции, приеме лекарственных препаратов и биологически активных добавок, семейном анамнезе. Необходимо выявлять наличие сопутствующих и сочетанных заболеваний, которые так или иначе могут быть ассоциированы с повреждением печени: сахарный диабет, экзогенно-конституциональное ожирение, артериальная гипертензия, гиперлипидемия, (факторы риска жировой болезни печени). Следует уточнить наличие аутоиммунных заболеваний (аутоиммунный тиреоидит, воспалительные заболевания кишечника, витилиго, синдром Шегрена и суставной синдром), которые часто сочетаются с заболеванием печени аутоиммунной природы -первичный билиарный холангит, первичный склерозирующий холангит, аутоиммунный гепатит. Наличие в анамнезе операции на желчевыводящих путях или предшествующая билиарная обструкция могут помочь в установлении диагноза вторичного билиарного цирроза. Курение – доказанный фактор риска прогрессирования вирусного и алкогольного ЦП[1, 2].
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза: Диагноз цирроза печени устанавливается на основании клинических, лабораторно-инструментальных и морфологических признаков внтурипеченочной портальной гипертензии.
Характерные для пациентов с ЦП жалобы и данные анамнеза указаны в подразделе 1.6
2.2 Физикальное обследование
При общем осмотре у пациентов с ЦП можно отметить пониженное питание за счет уменьшения мышечной массы, сухость кожи, геморрагические проявления. Признаками печеночной недостаточности служат отеки (гипоальбуминемия); сосудистые звездочки на коже лица, груди и спины, пальмарная эритема, гинекомастия (нарушение метаболизма эстрогенов в печени); желтушность кожи и склер (нарушение связывания билирубина в гепатоцитах с глюкуроновой кислотой и нарушение экскреции связанного билирубина в желчь). Признаками портальной гипертензии являются асцит, спленомегалия, венозные коллатерали на передней брюшной стенке («голова медузы»). Часто у пациентов с декомпенсированным ЦП можно обнаружить проявления гипердинамического кровообращения — тахикардию в покое и гипотонию [15]. Для пациентов с холестатическими заболеваниями печени (первичный билиарный холангит, реже — первичный склерозирующий холангит) характерны гиперпигментация и выраженная сухость кожи, следы расчесов, холестериновые бляшки на веках и коже (ксантелазмы и ксантомы). Лежащий в основе многих осложнений ЦП синдром избыточного бактериального роста в кишечнике и бактериальная транслокация могут проявляться клинически такими симптомами как субфебрильная температура (без очевидного источника инфекции), вздутие живота, ослабление кишечной перистальтики (преходящий парез кишечника), неустойчивый стул [1, 14].
При наличии асцита над местом скопления свободной жидкости в брюшной полости (более 1,5 л свободной жидкости) перкуторно можно определить тупой звук вместо тимпанита. При напряженном асците пальпация внутренних органов затруднена, при этом печень и селезенка могут баллотировать (cимптомы флуктуации и «плавающей льдинки»). Диагностическая точность притупления перкуторного звука для диагностики асцита составляет 57,1%, симптома флуктуации – 20% [1, 2, 68 ].
Гидроторакс можно диагностировать при наличии одышки в покое и при нагрузке и при следующих физикальных находках: асимметрия/отставание одной половины грудной клетки при дыхании, притупление перкуторного звук, ослабление/отсутствие голосового дрожания и бронхофонии, отсутсвие дыхательных шумов. Диагностическая точность физикальных методов составляет примерно 60% (при большом выпоте достигает 88%) [1, 67,68]
Проявления ПЭ разнообразны и зависят от ее стадии, согласно критериям West-Haven (см. таблицу 4 выше)[1, 2, 54, 55].
С целью оценки состояния сознания больного с ПЭ, в том числе в динамике на фоне терапии, может также применяться шкала комы Глазго (Таблица 
Диагноз ПЭ устанавливают на основании клинических симптомов и клинико- лабораторных признаков нарушения функции печени. Необходимо оценить сознание, поведение, интеллект, неврологический статус (тремор, изменение почерка, психометрические тесты)[1, 2, 54,55].
Латентное течение заболевания печени делает дифференциальный диагноз ПЭ достаточно сложным. Как правило, у таких пациентов, несмотря на отсутствие симптомов очагового поражения центральной нервной системы, необоснованно предполагается нарушение мозгового кровообращения или психическое заболевание. При развернутых стадиях ПЭ могут выявляться рефлексы подошвенного разгибания или повышение глубоких сухожильных рефлексов, но при этом очаговая симптоматика анатомически непостоянна. Особенно опасно ошибочное применение в этих случаях диуретических и психотропных средств. Клинические признаки ПЭ неспецифичны и их практически невозможно отличить от других метаболических нарушений (уремия, гиперкапния, гипокалиемия) и поражения собственно центральной нервной системы.
К клиническим проявлениям минимальной ПЭ относятся:
-
Нарушение зрительного восприятия;
-
Снижение внимания и памяти;
-
Замедление процесса мышления;
-
Нарушение концентрации внимания;
-
Снижение работоспособности;
-
Снижение быстроты реакции;
-
Раздражительность.
Спонтанный бактериальный перитонит у пациентов с ЦП. Клиническая картина СБП включает боль в животе различной интенсивности, без четкой локализации, болезненность при пальпации живота, лихорадку и нарастание ПЭ без видимых провоцирующих факторов. У 8-10 % пациентов определяется положительный симптом раздражения брюшины. Ригидность брюшных мышц редко встречается при напряженном асците. Лихорадка отмечается у 50 % больных с СБП и может быть связана с септическим шоком, нередко имеется повышение температуры тела только до субфебрильных цифр. У 10-15 % пациентов возникают рвота, диарея, признаки пареза кишечника. У ряда больных заболевание манифестирует признаками септического шока с выраженной гипотензией, тахикардией, олигурией. Вместе с тем у 10-33 % больных начальная симптоматика отсутствует и заболевание выявляют случайно при исследовании асцитической жидкости. Это может быть связано с тем, что обычно у таких больных преобладает клиника ПЭ, что затушевывает другую симптоматику [3, 48,49, 64,83].
Гепаторенальный синдром. Специфических клинических симптомов ГРС нет. Клинические признаки определяются сочетанием симптомов острой почечной недостаточности с прогрессирующей печеночной недостаточностью и портальной гипертензией. К почечным клиническим признакам ГРС относятся олиго-/анурия [1, 2, 3].
Дилюционная гипонатриемия. У больных ЦП дилюционная гипонатриемия как правило развивается в течение нескольких дней – недель, хотя возможны и острые состояния. У большинства пациентов уровень натрия сыворотки крови колеблется от 125 до 130 ммоль/л, однако у части больных этот показатель может снижаться до 110-125 ммоль/л. Клинически гипонатриемия проявляется тошнотой, рвотой, апатией, анорексией, летаргией, судорогами, дезориентацией, головной болью. Неврологические симптомы, возникшие при этом состоянии, бывают трудно отличимы от проявлений ПЭ [48].
Портальная гипертензия. При осмотре больного можно выявить расширенные вены передней брюшной стенки, расходящиеся от пупка (голова медузы). Однако, чаще видны одна или несколько подкожных вен в эпигастральной области. Иногда в околопупочной зоне можно выслушать сосудистые венозные шумы. Увеличение селезенки – один из наиболее важных диагностических признаков портальной гипертензии. Плотная печень свидетельствует в пользу ЦП, мягкая – за внепеченочный портальный блок. Наличие асцита при ЦП подразумевает наличие портальной гипертензии и/или развитие печеночной недостаточности с гипоальбуминемией (гипоонкотические отёки). Аноректальные ВВ необходимо дифференцировать с геморроем, не имеющим отношения к портальной гипертензии. У больного с заболеванием печени о развитии портальной гипертензии свидетельствуют ВВПиЖ [1, 2, 23, 66].
Кровотечения из ВВПиЖ при ЦП, как правило, массивные и поэтому их клинические проявления достаточно яркие и складываются из общих симптомов, свойственных любой кровопотере (резкая слабость, головокружение, потеря сознания, выраженная бледность кожных покровов, частый пульс слабого наполнения и напряжения, снижение артериального давления и т. д.), и симптомов, характерных для кровотечения в просвет желудочно-кишечного тракта: рвота свежей или, реже — видоизмененной кровью («кофейная гуща») и черный дегтеобразный стул (мелена). Оценка центрального венозного давления, дефицита объема циркулирующей крови, диуреза, измерение артериального давления и подсчет частоты сердечных сокращений, а также лабораторные показатели позволяют получить очень важные объективные данные о степени тяжести кровотечения (классификация степени кровотечения).
К проявлениям ГПС при ЦП относятся одышка, центральный цианоз, изменения фаланг пальцев по типу «барабанные палочки», телеангиэктазии ногтевого ложа. Одышка у пациентов с ГПС появляется в вертикальном положении и носит название платипноэ. Также в вертикальном положении у них снижается сатурация кислорода, что принято называть ортодеоксией [37,66].
2.3 Лабораторные диагностические исследования
Рекомендовано проведение общего (клинического) анализа крови пациентам с ЦП для оценки уровня гемоглобина, тромбоцитов, лейкоцитов [1, 2, 3, 67, 68, 164-168].
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 4)
Комментарии: Чаще всего у пациентов отмечается цитопения (в большей степени – тромбоцитопения различной степени тяжести). Возможно наличие двухростковой цитопении (лейко- и тромбоцитопении), что отражает синдром гиперспленизма (секвестрационной и/или иммунной цитопении). В случае впервые выявленной тромбоцитопении обязательно проведение ручного подсчета форменных элементов крови (дифференциальный диагноз с агрегацией тромбоцитов). У пациентов с алкогольным циррозом печени спленомегалия и гиперспленизм могут быть выражены минимально или отсутствовать вовсе, что не исключает стадию цирроза. Возможно наличие анемии различной природы и выраженности – вклад могут вносить оккультные кровотечения при портальной гастро- и колопатии, дефицит витаминов (фолиевой кислоты и В12 при алкоголизации), постгеморрагическая анемия (после варикозных кровотечений), а также анемия хронических заболеваний.
-
Рекомендовано проведение анализа крови биохимического общетерапевтического, включая такие показатели как общий белок, альбумин, общий билирубин, прямой билирубин, креатинин, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, гаммаглутаминтранспептидаза, глюкоза, пациентам с ЦП для оценки некровоспалительной активности, холестаза, функции печени, почек [1, 2, 67, 68, 166, 169-172].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
Комментарии: Повышение активности аминотрансфераз по мере прогрессирования хронического заболевания печени теряет клиническое значение – при ЦП активность аспартатаминотрансферазы чаще выше активности аланинаминотрансферазы; сочетание высокой активности аспартатаминотрансферазы и гаммаглутаминтранспептидазы (+макроцитоз/гиперхромная анемия) могут указывать на алкоголизацию, при этом специфичность гаммаглутаминтранспептидазы составляет олоко 60% и может отражать метаболические нарушения (коррелирует с избыточной массой тела). Обязательно исследование уровня альбумина (прогностический маркер и ключевой показатель белоксинтетической недостаточности). В рамках печеночной недостаточности отмечается изолированное снижение уровня альбумина при нормальном/пограничном уровне общего белка. Высокий уровень белка может наблюдаться при активном аутоиммунном процессе (аутоиммунном циррозе печени), а также отражать патологическую секрецию – в таких случаях показано дополнительное обследование у врача-гематолога. Снижение уровня креатинина отражает дефицит мышечной ткани (саркопению) и является неблагоприятным прогностическим маркером. Помимо трансфузий раствора альбумина человека** таким пациентам показано назначение соответствующей высокобелковой диеты и/или энтерального питания для коррекции нутритивного статуса.
-
Рекомендовано выполнение коагулограммы (ориентировочного исследования системы гемостаза), включая определение таких показателей как МНО, протромбиновый индекс%, фибриноген, протромбин, протромбиновое (тромбопластиновое) время, Д-димер, антитромбин III в крови пациентам с ЦП для оценки коагуляционного статуса, функции печени [1, 2, 3 67, 68, 166,170,173-175].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
Комментарии: В рамках печеночной недостаточности отмечается снижение синтеза всех плазменных факторов коагуляции – как про- так и антикоагулянтов. В большей степени при использовании стандартных тестов выявляют признаки гипокоагуляции: повышение МНО, снижение протромбинового индекса, уровня фибриногена. В ряде случаев показано исследование уровня D-димера (исключение активного тромбообразования и эффективности антикоагулянтной терапии), активированного частичного тромбопластинового времени (контроль эффективности терапии низкомолекулярными гепаринами), антитромбина III (при дефиците фактора эффект низкомолекулярных гепаринов может быть неполным или отсутствовать вовсе);
-
Рекомендовано исследование общего (клинического) анализа мочи пациентам с ЦП для исключения мочевой инфекции, а также пациентам с ЦП с повышением уровня креатинина для исключения протеинурии, цилиндрурии как признака самостоятельного заболевания почек [1, 2, 3,61, 67, 68,176].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
Комментарии: Изменения мочевого осадка и/или протеинурия в случае острого повреждения почек позволяют исключить гепаторенальный синдром и указывают на наличие самостоятельного заболевания почек или инфекции. Следует помнить, что даже латентная мочевая инфекция может провоцировать печеночную энцефалопатию и острую печеночную недостаточность на фоне хронической (и декомпенсацию ЦП в целом).
-
Рекомендовано исследование маркеров вирусных гепатитов(антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение суммарных антител классов M и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита C (Hepatitis C virus) в крови, определение антител к вирусу гепатита D (Hepatitis D virus) в крови); исследование электрофореза белков, иммуноглобулинов крови, ферритина, процента насыщения трансферрина железом, церулоплазмина в качестве скрининговых показателей пациентам с ЦП для уточнения этиологии заболевания (в случае, если причина ЦП неизвестна) [1, 2, 3, 67,68].
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 5)
-
Рекомендовано пациентам с ЦП с лихорадкой, с признаками системного воспалительного ответа (Systemic inflammatory response syndrome, SIRS) исследовать уровень С-реактивного белка и прокальцитонина для оценки вероятности развития бактериальной инфекции (вероятность высокая при уровне >0,5 нг/мл) [12, 15,182].
Уровень убедительности рекомендаций В (Уровень достоверности доказательств 1)
Комментарий: Диагностическая точность обоих показателей для выявления инфекции сопоставима. В большинстве случаев достаточно исследовать только уровень СРБ [15].
-
Пациентам с ЦП и подозрением на инфекционное осложнение рекомендовано микробиологическое (культуральное) исследование крови на стерильность, микробиологическое исследование мочи для уточнения инфекционного процесса, исключения бактериальной инфекции [68, 202, 203].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
-
Пациентам с ЦП с нарушениями стула, с лихорадкой, а также пациентам с ЦП, неоднократно госпитализированным, получавшим антибактериальные препараты, рекомендовано иммунохроматографическое экспресс-исследование кала на токсины A и B клостридий (Clostridium difficile) для исключения инфекции Clostridium difficile.[204].
Уровень убедительности рекомендаций В (Уровень достоверности доказательств 3)
Лабораторное исследование асцитической жидкости
-
Рекомендовано проведение диагностического лапароцентеза с последующим исследованием асцитической жидкости всем пациентам с ЦП и асцитом при поступлении для исключения СБП, а также с целью выявления причины возникновения или прогрессирования асцита [1, 2, 3, 23, 69-74]. Также диагностический лапароцентез рекомендован пациентам с желудочно-кишечным кровотечением, признаками шока, с лихорадкой и другими критериями SIRS, при ухудшении функции печени и/или почек, при ПЭ[49, 75]. В некоторых случаях СБП может протекать бессимптомно, особенно у амбулаторных пациентов [49].
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 5)
Комментарии: Асцитическая жидкость направляется на микроскопическое исследование перитонеальной (асцитической) жидкости, а также производится бактериологическое исследование перитонеальной жидкости на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы. Обычно асцитическая жидкость прозрачна и имеет соломенный цвет, примесь крови наблюдается при злокачественном процессе в брюшной полости либо малом тазу, недавно проведенном парацентезе или выполнении инвазивных процедур. Электролитный состав асцитической жидкости аналогичен другим внеклеточным жидкостям.
-
Рекомендовано подсчитывать количество нейтрофилов в асцитической жидкости и производить бактериологическое исследование перитонеальной жидкости на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы пациентам с ЦП, с асцитом и признаками шока, с лихорадкой и другими критериями SIRS, при ухудшении функции печени и/или почек, при ПЭ с целью выявления СБП [1, 2,3, 49, 75,177,178]
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
Комментарии: Содержание нейтрофилов > 250 клеток/мм3 (0,25 х 109/л) является критерием СБП при отсутствии перфораций или воспаления органов брюшной полости [1, 2, 3,49, 67,68, 75]. Для бактериологического исследования перитонеальной жидкости на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы, полученную асцитическую жидкость следует немедленно поместить во флаконы с питательной средой и отправить в лабораторию. В многочисленных исследованиях установлено, что немедленный посев асцитической жидкости на гемокультуру позволяет идентифицировать микроорганизм в 72-90% случаев СБП.
-
Рекомендовано определять уровень общего белка и альбумина в асцитической жидкости, полученной при лапароцентезе, пациентам с ЦП с асцитом, с целью выявления пациентов с высоким риском развития СБП[1, 2, 3, 71, 72,179]
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
Комментарии: Уровень общего белка асцитической жидкости<1,5 г/дл рассматривается неблагоприятным фактором риска развития СБП, несмотря на то, что есть противоречивые данные [1, 2, 71, 72].
-
Рекомендовано рассчитывать сывороточно-асцитический альбуминовый градиент (СААГ) в случаях, когда причина асцита не ясна и при подозрении на другие причины асцита[1, 2, 3, 67,68, 69]
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Комментарии: СААГ рассчитывается по следующей формуле:
СААГ = альбумин сыворотки крови – альбумин асцитической жидкости
Значения СААГ 1,1 г/дл и больше в 80 % случаев свидетельствуют в пользу портальной гипертензии как причины развития асцита (таблица 9) [72, 73].
Дифференциальный диагноз причин развития асцита в зависимости от уровня СААГ (по RimolaA. [49]).
-
Рекомендовано пациентам с ЦП и асцитом исследовать в асцитической жидкости, полученной при лапароцентезе, содержание эритроцитов для исключения геморрагического асцита[1, 2, 3, 67,68].
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 5)
Комментарии: в асцитической жидкости при ЦП обычно количество эритроцитов не превышает 1 тыс. клеток/мм3. Геморрагический асцит (> 50 тыс. клеток/мм3) определяется у 2% пациентов с циррозом, из которых треть больных имеют гепатоцеллюлярный рак. У половины пациентов с геморрагическим асцитом причину его установить не удается.
-
Рекомендовано пациентам с ЦП с асцитом также определение в асцитической жидкости концентрации глюкозы, амилазы, лактатдегидрогеназы, триглицеридов для уточнения этиологии асцита[1, 2, 3, 67,68].
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 5)
-
Рекомендовано пациентам с ЦП и асцитом проводить цитологическое исследование асцитической жидкости для исключения опухолевого генеза асцита [3, 67,68, 73].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 2)
Лабораторное исследование плевральной жидкости
-
Рекомендовано проведение диагностического торакоцентеза пациентам с ЦП с гидротораксом с целью оценки характера плевральной жидкости и исключения ее инфицирования [1, 2, 34].
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 4)
Комментарии: Диагноз печеночного гидроторакса требует исключения сердечной недостаточности и легочной патологии. С помощью диагностического торакоцентеза можно подтвердить инфицирование плевральной жидкости (критерии аналогичные инфицированию асцитической жидкости), оценить содержание белка в плевральной жидкости (при неосложненном печеночном гидротораксе содержание белка низкое, градиент между содержанием альбумина в сыворотке и плевральной жидкости больше 1,1 г/дл) [1, 2, 34,68].
2.4 Инструментальные диагностические исследования
-
Рекомендовано проведение ультразвукового исследования органов брюшной полости(комплексное)пациентам с ЦП с целью определения размеров и ультразвуковых характеристик печени, диагностики портальной гипертензии (обнаружение асцита, измерение диаметра воротной и селезеночной вен, размеров селезенки), исключения очаговых образований печени, при возможности использовать ультразвуковую доплерографию для оценки проходимости печеночных и воротных вен, с целью обнаружения тромбоза сосудов портальной системы [1, 12, 67,68,180].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 2)
Комментарии: При проведении ультразвукового исследования признаками портальной гипертензии служат расширение воротной вены до 13 мм и более, снижение в ней скорости кровотока либо ретроградный кровоток, появление портокавальных коллатералей (параумбиликальная вена, варикозные расширения селезеночной вены и др.), спленомегалия.
-
Рекомендовано проведение эзофагогастродуоденоскопии (ЭГДС) пациентам с ЦП с целью оценки размера вен пищевода и желудка и исключения пятен васкулопатии как стигм высокого риска кровотечения [23, 68,76,77].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
-
Рекомендовано проведение ЭГДС в максимально короткие сроки (желательно в течение первых 12 часов) пациентам с ЦП и варикозным кровотечением с целью уточнения причины кровотечения и эндоскопического лечения[1, 2, 23, 76].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств -5)
Комментарии: ЭГДС проводится при поступлении пациента для определения генеза кровотечения, подтверждения варикозного характера кровотечения, локализации варикозной трансформации и исключения других источников кровотечения (язвенная болезнь желудка или 12-перстной кишки, опухолевые поражения желудка, синдром Меллори-Вейсса, эрозивно-геморрагический гастрит и др.).
-
Пациентам с компенсированным ЦП с отсутствием ВВПиЖ на скрининге, но с сохраняющимся этиологическим фактором заболевания печени, рекомендовано проведение ЭГДС ежегодно для выявления ВВПиЖ [1,77,78,79,181]
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
-
Пациентам с декомпенсацией ЦП рекомендовано проведение внеочередной ЭГДС для оценки риска кровотечения из ВВПиЖ [23, 75-78,181].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
-
Косвенно оценить риск кровотечения из ВВПиЖ можно с помощью эластометрии печени. У пациентов с плотностью печени <20 кПа и уровнем тромбоцитов более 150 тыс риск выраженных ВВ пищевода очень низкий. Таким пациентам можно не проводить ЭГДС на скрининге[2, 76,79].
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 4)
При наличии показаний и отсутствии противопоказаний (не всем пациентам с ЦП):
-
Рекомендовано проведение компьютерной томографии брюшной полости с внутривенным контрастированием (в отсутствии противопоказаний для введения контраста) пациентам с ЦП с подозрением на тромбоз в венах портальной системы или с очаговыми изменениями печени на ультразвуковом исследовании с целью исключения тромбоза и уточнения генеза очагов [1, 2, 67, 180]
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 2)
-
Рекомендовано проведение магнитно-резонансной томографии брюшной полости с внутривенным контрастированием гепатоспецифичным контрастным агентом (в отсутствии противопоказаний для введения контраста) пациентам с ЦП с очаговыми изменениями печени на ультразвуковом исследовании (при невозможности проведения компьютерной томографии или сохраняющихся сомнениях о генезе очагов после ее проведения) с целью определения этиологии образований печени. [67,180]
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 2)
Комментарии: При наличии клинических и лабораторных признаков холестаза применяют магнитно-резонансную холангиопанкреатографию для исключения билиарной гипертензии той или иной причины и/или изменений желчных протоков, характерных для первичного склерозирующего холангита.
2.5 Иные диагностические исследования
-
Пациентам с ЦП рекомендовано применять психометрические тесты: связи чисел, число-буква, линии, почерка, арифметический, пересказа и др. с целью диагностики скрытой ПЭ [16,67, 68, 80, 81].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
Комментарии: при выполнении теста связи чисел пациент соединяет линией цифры от 1 до 25, напечатанные вразброс на листе бумаги (Приложение Г). Оценкой теста служит время, затраченное пациентом на его выполнение, включая время необходимое для исправления ошибок. Чувствительность психометрических тестов в выявлении ПЭ составляет 70-80%. Явная ПЭ диагностируется по критериям West-Haven (см. таблицу 4) [1, 68, 80,82,].
-
Рекомендовано пациентам с ЦП проводить психометрические тесты для выявления инфекционных осложнений, которые могут проявляться лишь усугублением ПЭ [12, 15].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
-
Пациентам с ЦП рекомендована оценка признаков SIRS для исключения возможности инфекционного осложнения и уточнения жизненного прогноза[205].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
Комментарии: Критерии SIRS:
-
Температура тела ≥ 8 °C (фебрильная температура) или ≤ 36 °C (гипотермия);
-
Частота сердечных сокращений ≥ 90/мин(тахикардия);
-
Тахипноэ: частота дыхания ≥ 20/мин или гипервентиляция с содержанием диоксида углерода в крови ≤ 32 мм рт ст;
-
Лейкоцитоз (≥ 12000/мл) или лейкопения (≤ 4000/мл) или смещение лейкоцитарной формулы влево.
Диагностика бактериальных осложнений ЦП зачастую представляет сложности в связи со стертой клинической картиной заболевания
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Консервативное лечение
Цели лечения:
— лечение основного заболевания, приведшего к циррозу печени;
— компенсация ЦП
— устранение осложнений
3.1.1 Лечение пациентов с ЦП и асцитом
ЦП и асцит первой степени по IAC
В соответствии с рекомендациями Международного клуба по изучению асцита (IAC), пациенты с первой степенью асцита не нуждаются в лечении и/или назначении диеты с ограничением соли [1, 2, 83].
ЦП и асцит второй степени по IAC (умеренный асцит)
-
Рекомендована диета с ограничением поступающего с пищей натрия пациентам с ЦП и с умеренным, неосложненным асцитом для достижения отрицательного водного баланса [1, 2, 68,83].
Уровень убедительности рекомендаций В (Уровень достоверности доказательств 2)
Комментарии: Ограничение поступления натрия с пищей может привести к разрешению асцита у 10% пациентов, особенно у пациентов с впервые возникшим асцитом. Ограничение поступления натрия с пищей (80–120 ммоль/день или 4,6-6,9 г поваренной соли в день), в т.ч. за счет употребления полуфабрикатов, выпечки и консервов (содержат соли натрия) [1, 2, 67, 68].
-
Рекомендовано в дополнение к бессолевой диете назначать калийсберегающий диуретик, антагонист альдостерона — (спиронолактон** в начальной дозировке 100 мг/сутки пациентам с ЦП и впервые возникшим умеренным асцитом [1, 2, 84,85,183].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 2)
Комментарии: Так как вторичный гиперальдостеронизм играет ключевую роль в задержке натрия почками у пациентов с циррозом печени, диуретитки с антиминералокортикоидным действием (спиронолактон**)составляют основу лечения асцита.
-
Рекомендовано пошагово увеличивать дозу спиронолактона**(конкурентный калийсберегающий диуретик)до максимальной дозы 400 мг (не более 1 недели) в день пациентам с ЦП и умеренным асцитом при отсутствии ответа на более низкую дозу. В случае отсутствия эффекта от приёма максимальной дозы в течение одной недели констатируют наличие резистентного асцита и меняют терапевтический подход [1, 2, 67,68,86,183].
Уровень убедительности рекомендаций А(Уровень достоверности доказательств 2)
Комментарии: Дозу спиронолактона** увеличивают на 100 мг каждые 72 часа. Критерий эффективности проводимой терапии: уменьшение массы тела не менее, чем на 2 кг в неделю.
-
Рекомендовано добавлять к лечению «петлевые» диуретики (сульфонамиды)–фуросемид**или торасемид – в нарастающих дозах (по 40 или 5 мг соответственно) пациентам с ЦП с умеренным асцитом при неэффективности монотерапии спиронолактоном** или при развитии гиперкалиемии с целью достижения отрицательного водного баланса [1, 2,68,86,183-185].
Уровень убедительности рекомендаций В(Уровень достоверности доказательств 2)
Комментарии: Пациентам назначается комбинированная терапия: спиронолактон** (+ фуросемид**/торасемид. Начальная доза фуросемида** (40 мг в сутки) постепенно увеличивается на 40 мг каждые 7 дней до максимальной дозы 160 мг/сутки, доза торасемида – 5 мг до максимальной суточной дозы 30 мг [1, 2, 68,86 ].
-
Рекомендовано рассмотреть вопрос замены фуросемида** (эффект фуросемида** может быть неудовлетворительным у пациентов с гипоальбуминемией) на торасемид пациентам с ЦП со слабым ответом на фуросемид** для достижения отрицательного водного баланса [1, 2, 68, 184-185]
Уровень убедительности рекомендаций В (Уровень достоверности доказательств 2)
-
Рекомендовано дозу диуретиков подбирать таким образом, чтобы максимальное уменьшение массы тела для пациентов с ЦП и с асцитом без периферических отеков составляло 0,5 кг в день, а для пациентов с асцитом и периферическими отеками – 1 кг в день [1, 2,68 ].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Комментарии: Пациентам с ЦП и разрешающимся асцитом дозу диуретиков снижают до минимальной эффективной дозы во избежание развития побочных эффектов мочегонной терапии.
-
Рекомендовано проводить тщательное мониторирование состояния (уровень сознания и уровень электролитов сыворотки крови) пациентам, получающим мочегонную терапию, для профилактики развития энцефалопатии и электролитных нарушений[1, 2, 68].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Снижение концентрации сывороточного натрия менее 125 ммоль/л, прогрессирующая почечная недостаточность, углубление печеночной энцефалопатии и развитие судорог служат показанием для срочной отмены диуретиков. При снижении уровня сывороточного калия менее 3,0 ммоль/л пациенту следует отменить фуросемид**; при повышении уровня калия выше 6 ммоль/л – отменить спиронолактон**.У мужчин применение высоких доз спиронолактона** приводит к развитию гинекомастии и эректильной дисфункции. Максимальные дозы диуретиков не рекомендуется применять дольше 1 недели[1, 2,68].
ЦП и асцит третей степени по IAC (напряженный асцит)
-
Рекомендовано пациентам с ЦП и напряженным асцитом выполнять лечебный объемный парацентез для облегчения их состояния и уменьшения одышки [1, 2,68,186,187].
Уровень убедительности рекомендаций В(Уровень достоверности доказательств 2)
Комментарии: Процедура парацентеза безопасна, эффективна и имеет меньше побочных эффектов, чем диуретическая терапия. Парацентез проводится в стерильных условиях. Процедура ассоциирована с очень низким риском местных осложнений (преимущественно кровотечение) даже у пациентов с МНО>1,5 и уровнем тромбоцитов <50000/л. Поэтому профилактические трансфузии свежезамороженной плазмы не требуются. Объемный парацентез не проводится при синдроме диссеминированного внутрисосудистого свертывания, при инфекциях мягких тканей в месте предполагаемой пункции, при выраженном парезе кишечника.
-
Рекомендовано пациентам с ЦП и напряженным асцитом после проведения парацентеза назначать альбумин человека** из расчета 8 г на каждый удаленный литр асцитической жидкости в целях профилактики циркуляторных расстройств [1, 2,68,186,187].
Уровень убедительности рекомендаций В(Уровень достоверности доказательств 2)
Комментарии: Удаление большого объема асцитической жидкости потенциально ассоциировано с последующим снижением эффективного объема крови – циркуляторная дисфункция. Клинически она проявляется повреждением почек, дилюционной гипонатриемией, печеночной энцефалопатией и снижением выживаемости этих больных. Не рекомендуется удалять более 15(20) литров асцитической жидкости за один раз. Недопустима быстрая эвакуация асцитической жидкости с использованием троакара. Чтобы предотвратить развитие осложнений после парацентеза, необходимо возмещать недостающий объем. Следует назначать только 20%-й раствор альбумина человека**. Назначение плазмозамещающих растворов (декстран**) не рекомендуется. В день проведения процедуры диуретики отменяют[1, 2,68].
-
Рекомендовано пациентам после проведения объемного парацентеза и возмещения объема альбумином человека** назначать диуретики в сочетании с бессолевой диетой для профилактики рецидива асцита [1, 2,68].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарий: Следует помнить, что трансфузия 500 и более миллилитров 20%-го раствора альбумина человека** (за одно введение) может привести к развитию респираторного дистресс-синдрома [1,68].
Алгоритм ведения пациента с асцитом представлен на рисунке 1 в Приложении Б.
Лечение ЦП с резистентным асцитом
-
Рекомендовано у пациентов с ЦП и рецидивирующим асцитом без системных осложнений ЦП (кровотечение или бактериальные осложнения) оценивать приверженность к диуретической терапии с целью своевременной диагностики резистентного асцита [1, 2,68].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Критерии резистентного асцита представлены в разделе 1.5. Нередко асцит ошибочно расценивается как резистентный. Причинами неэффективности диуретической терапии может быть несоблюдение пациентом гипонатриемической диеты, прием нестероидных противовоспалительных препаратов (НПВП), что приводит к задержке жидкости, назначение низких доз диуретиков, низкий уровень альбумина (актуально для фуросемида**, эффективность которого реализуется при связывании с молекулой альбумина) [68,87].
-
Рекомендовано пациентов с резистентным асцитом рассматривать как кандидатов для трансплантации печени с целью улучшения их жизненного прогноза [2,87].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
Комментарии: Рефрактерный асцит служит независимым прогностическим фактором снижения выживаемости пациентов с ЦП. Радикальный метод лечения ЦП, осложненного резистентным (рефрактерным) асцитом — трансплантация печени.
-
Рекомендовано проведение повторных парацентезов в сочетании с внутривенными трансфузиями альбумина человека** (из расчета 8 г на литр удаленной асцитической жидкости) пациентам с резистентным асцитом, находящимся в листе ожидания трансплантации печени, с целью улучшения их качества жизни[1, 2,68].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
-
Рекомендовано назначение #рифаксимина пациентам с ЦП и рефрактерным асцитом для улучшения выживаемости [2,88].
Уровень убедительности рекомендаций В (Уровень достоверности доказательств 4)
Комментарий: Назначение #рифаксимина в дозе200 мг 4 раза в сутки длительностью не менее 2-х недель пациентам с рефрактерным асцитом продемонстрировало повышение 6-месячной выживаемости[88].
-
Рекомендовано назначение профилактической антибиотикотерапии (СБП – см. соответствующую главу) и постановка в лист ожидания ортотопической трансплантации печени пациентам с ЦП и резистентным асцитом с признаками присоединения повреждения почек (ОПП или ГРС)с целью улучшения жизненного прогноза [25,89].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
-
Рекомендовано рассматривать вопрос о наложении TIPS (трансъюгулярного внутрипеченочного портосистемного шунта) пациентам с ЦП и резистентным асцитом как временное вмешательство в период ожидания трансплантации печени с целью улучшения их качества жизни [90-92].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 1)
3.1.2 Лечение цирроза печени с кровотечениями из варикозных вен пищевода и желудка.
-
Рекомендован перевод или госпитализация пациентов с ЦП и острым кровотечением в отделение интенсивной терапии и реанимации для мониторирования витальных функций [1, 2,93].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Кровотечение как из ВВ, так и неварикозное кровотечение у пациентов с декомпенсированным ЦП сопряжено с высоким риском осложнений и смертности. Ургентную медикаментозную терапию необходимо начинать, не дожидаясь подтверждения кровотечения при ЭГДС. Лечебная тактика основывается на оценке клинического состояния больного, тяжести течения заболевания и степени кровопотери, совместной курацией специалистов: врачей-хирургов, врачей-анестезиологов-реаниматологов, врачей-эндоскопистов или врачей-гастроэнтерологов, а также специалистов смежных диагностических служб.
-
Рекомендовано незамедлительное восполнение ОЦК пациентам с ЦП и кровотечением с целью восстановления гемодинамики [94].
Уровень убедительности рекомендаций В(Уровень достоверности доказательств 2)
-
Рекомендовано применение плазмозамещающих препаратов и белковых фракций плазмы (кровезаменителией и препаратов плазмы крови)(коллоидных) и/или растворов, влияющих на водно-электролитный баланс (кристаллоидных растворов) пациентам с ЦП с варикозным кровотечением с целью восполнения ОЦК и улучшения функции почек [2,22, 23, 93,94].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
-
Рекомендовано избегать назначения гидроксиэтилкрахмала** пациентам с ЦП и варикозным кровотечением с целью восполнения ОЦК [2,93,196].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
-
Рекомендовано проводить трансфузии препаратов крови пациентам с ЦП и варикозным кровотечением для достижения целевого уровня гемоглобина 7–9 г/дл [2,23, 94].
Уровень убедительности рекомендаций В(Уровень достоверности доказательств 2)
-
Рекомендовано назначать антибиотики пациентам с ЦП и варикозным кровотечением с целью снижения риска инфекционных осложнений и улучшения выживаемости [1, 2, 23, 68,96,97 ].
Уровень убедительности рекомендаций В(Уровень достоверности доказательств 2)
Комментарии: Антибиотикопрофилактику необходимо начинать незамедлительно при возникновении варикозного кровотечения и продолжать в течение семи дней. #Цефтриаксон** в дозе 1г. в сутки является препаратом первой линии для пациентов с декомпенсированным ЦП, пациентов, уже получающих антибактериальные препараты, производные хинолона (фторхинолоны), а также в стационарах с высокой частотой фторхинолон-устойчивых бактериальных штаммов. В остальных случаях применяются фторхинолоны (#норфлоксацин 400 мг дважды в день) [2,23,96-98].
-
Рекомендовано назначение #терлипрессина**, #октреотида**, которые обладают вазоконстрикторным действием, при варикозном кровотечении пациентам с ЦП еще до проведения эндоскопии с целью уменьшения объема кровопотери при эндоскопии и снижения смертности[2,23,76].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Назначение #терлипрессина** и #октреотида**до проведения ЭГДС позволяет уменьшить активность кровопотери во время эндоскопического вмешательства и облегчить проведение эндоскопического лечения, тем самым улучшив прогноз этих пациентов.#Терлипрессин** и #октреотид**вызывают спланхническую вазоконстрикцию и, соответственно, уменьшают объем портальной крови, тем самым снижают риск раннего повторного кровотечения. #Терлипрессин** — синтетический аналог гормона задней доли гипофиза вазопрессина (антидиуретический гормон). Этот препарат непосредственно воздействуют на гладкомышечные клетки сосудов. Механизм действия синтетического аналога соматостатина–#октреотида** связан с подавлением активности эндогенных вазодилататоров (в частности, глюкагона). Рекомендуемая доза #терлипрессина**–внутривенно 2 мг каждые 4 часа в течение 48 часов, затем 1 мг каждые 4 часа. Рекомендуемая доза #октреотида** — болюсно 50 мкг/час, затем путем длительной инфузии 50 мкг/час. Продолжительность терапии вазоактивными препаратами – 5 дней. [2,23,76].
-
Рекомендовано введение эритромицина в дозе 250 мг внутривенно за 30-120 минут до ЭГДС пациентам с варикозным кровотечением при отсутствии противопоказаний (удлинение QT) с целью облегчения эндоскопического лечения [199].
Уровень убедительности рекомендаций В (Уровень достоверности доказательств 1)
-
При подтверждении у пациентов с ЦП продолжающегося кровотечения из изолированных ВВ пищевода и вен желудка 1 типа (до 8-10 мм в диаметре) рекомендовано предпринять попытку лигирования источника кровотечения при условии его удовлетворительной визуализации c целью повышения выживаемости [1, 2, 23, 93 ].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Проведение эндоскопического лигирования имеет ряд преимуществ перед склеротерапией: считается более эффективным, имеет меньше осложнений и улучшает выживаемость.
-
Рекомендована комбинация терлипрессина** или октреотида**и эндоскопического лигирования пациентам с ЦП и кровотечением из вен пищевода с целью его остановки [1, 2, 23,76,99].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 1)
Комментарии: Комбинация двух методов лечения наиболее эффективна, так как позволяет достичь местного гемостатического эффекта при эндоскопическом лечении и снизить портальное давление назначением терлипрессина** и октреотида**.
-
При невозможности лигирования источника кровотечения рекомендована установка зонда-обтуратора и продолжение интенсивной консервативной терапии с возмещением кровопотери, применением терлипрессина** и октреотида**пациентам с ЦП и неконтролируемым массивным варикозным кровотечением из вен пищевода с целью его временной остановки [2,23].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Баллонная тампонада должна использоваться только при продолжающемся массивном кровотечении как временная мера в течение максимально 24 часов с периодическим распусканием пищеводной (через каждые 2-3 часа) и желудочной (через каждые 4-6 часов) манжеток для предотвращения образований пролежней на слизистой. Из-за высокого риска аспирационной пневмонии у пациентов в коме или с энцефалопатией баллонную тампонаду рекомендуется предварять оротрахеальной интубацией. Последующая повторная ЭГДС производится через 12-24 часа в условиях остановленного кровотечения. Выбор дальнейшей тактики в отношении окончательного гемостаза строится на основе оценки тяжести состояния пациента, течения заболевания и данных дополнительных лабораторного и инструментального методов исследований (ЭГДС, Ультразвуковое исследование органов брюшной полости (комплексное) с допплерографией, компьютерная томография брюшной полости, эхокардиография и другие).
-
Рекомендовано наложение TIPSс покрытием в течение первых 24-72 часов от начала пищеводного кровотечения определенным пациентам с высоким риском повторного кровотечения (например, декомпенсированный ЦП с количеством баллов >12 по шкале Child-Pugh) (Приложение Г)с целью его профилактики [2,100].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 2)
-
При компенсированном течении заболевания и стабильном состоянии пациента рекомендовано рассмотреть альтернативные варианты окончательного гемостаза, кроме операции TIPS. При отсутствии стент-графта возможна установка непокрыто гостента Даниша для профилактики кровотечения [2,23,90, 100 ].
Уровень убедительности рекомендаций А(Уровень достоверности доказательств 1)
Комментарии: Рандомизированные контролируемые исследования показали, что раннее наложение TIPS с покрытием пациентам с высоким риском повторного кровотечения в течение 72 часов (в идеале в течение менее 24 часов) позволяет лучше контролировать кровотечение и улучшает выживаемость. В настоящее время данный метод лечения может быть рекомендован пациентам с ЦП класса С по шкале Child-Pugh с количеством баллов < 14. Однако критерии отбора пациентов остаются неоднозначными, требуются дополнительные исследования. В России TIPS применяется при упорных рецидивирующих кровотечениях и невозможности проведения эффективного эндоскопического гемостаза и оперативного лечения.
-
Рекомендовано наложение TIPS как резервного метода лечения пациентам с ЦП и не купируемым варикозным кровотечением или рецидивом кровотечения, несмотря на применение всех других методов лечения, для остановки кровотечения [2,23,100,188
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
Комментарии: Почти у 10-15% варикозное кровотечение продолжается или возникает повторно, несмотря на применение вазоактивных препаратов, эндоскопического лигирования и назначение профилактических антибиотиков[1, 2, 19, 23,68]. В таком случае рекомендуется наложение TIPS [2,23].
При рецидивном кровотечении из ВВ пищевода и невозможности выполнения операции TIPS по различным причинам с целью временной остановки рекомендуется проведение баллонной тампонады или выполнение гемостаза путем установки стента Даниша(здесь и далее — стент для экстренной остановки кровотечений из варикозно расширенных вен пищевода) [2,19, 23,68].
-
Пациентам с ЦП при рецидиве кровотечения из вен желудка и отсутствии анатомических возможностей выполнения операции TIPS (тромбоз воротной вены и ее внутрипеченочных разветвлений) рекомендована полостная операция. При сохранной печеночной функции и стабильном состоянии больного (ЦП класс А по Child-Pugh) рекомендовано выполнение шунтирующей операции для остановки кровотечения [2,23].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
-
При отсутствии топографо-анатомических условий для наложения порто-кавального сосудистого анастомоза в группах больных с субкомпенсированным течением заболевания (ЦП класс В по Child-Pugh) рекомендовано выполнение прямых вмешательств на варикозных венах желудка (операция Пациора)для остановки кровотечения [2,23].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
-
Рекомендовано использование стента Даниша пациентам с ЦП при рецидивах кровотечения из изолированных ВВ пищевода после неэффективного эндоскопического гемостаза или в связи с высокими рисками эндоскопического лигирования с целью временной остановки кровотечения при декомпенсации заболевания для последующей подготовки к выполнению операции TIPS [2,23,101,102].
Уровень убедительности рекомендаций В (Уровень достоверности доказательств 2)
-
Рекомендовано использование стента Даниша с покрытием пациентам с массивным кровотечением из вен пищевода как альтернатива баллонной тампонаде с целью снижения частоты осложнений [19, 23,101,102].
Уровень убедительности рекомендаций В (Уровень достоверности доказательств 2)
-
Рекомендовано назначение не всасываемых дисахаридов, а именно осмотических слабительных средств (лактулоза**) пациентам с ЦП и варикозным кровотечением с целью профилактики развития энцефалопатии [1, 2, 19, 23,68,76].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Комментарии: Водный раствор осмотических слабительных средств вводится через установленный с целью гемостаза зонд Блекмора после промывания желудка до «чистых вод». При остановленном кровотечении рекомендуется продолжить пероральное введение осмотических слабительных средств **.
-
Рекомендовано избегать назначения бета-адреноблокаторов в комбинации с вазодилататорами для лечения заболеваний сердца(органические нитраты) пациентам с ЦП и варикозным кровотечением с целью его остановки[1, 2, 19, 20, 23].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
-
Применение органических нитратов может быть рекомендовано пациентам с ЦП при стабильной гемодинамике и наличии угрозы рецидива кровотечения при условии введения их через инфузомат с обязательным титрованием темпа введения под контролем центрального венозного давления и артериального давления с целью его остановки [19, 23,189].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
-
Рекомендовано пациентам с ЦП с острым кровотечением из вен желудка проводить аналогичное лечение как при кровотечении из вен пищевода с целью его остановки[1, 2, 19, 23].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Комментарии: Варикозные вены желудка обнаруживают примерно у 20% пациентов с ЦП. Варикозные вены I типа (распространяются с кардиального отдела на малую кривизну) встречаются чаще всего. Ведение пациентов с ЦП с кровотечением из этих вен аналогично ведению пациентов с кровотечением из вен пищевода. Кровотечение из варикозных вен II типа встречается реже, однако кровотечение из них, как правило, массивнее, тяжелее контролируется, чаще рецидивирует и ассоциировано с высокой смертностью (до 45%) [1, 2, 23]. Эти вены чаще обнаруживают у пациентов с абдоминальным тромбозом. В целом доказательная база по ведению пациентов с ЦП с кровотечением из вен желудка выглядит менее убедительно, чем по ведению пациентов с ЦП с пищеводным кровотечением.
-
При умеренной выраженности варикозных вен желудка I типа (ориентировочно до 8-10 мм) возможно выполнение комбинированного лигирования нейловыми петлями[19, 23]. Недопустимо для лигирования вен желудка использование латексных колец[19].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
-
При компенсированном течении заболевания, осложненном кровотечением из варикозных гастроэзофагеальных вен II типа, рекомендована шунтирующая операция [19, 23]
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Алгоритм лечения пациентов с ЦП с острым варикозным кровотечением представлен на рисунке 2 в приложении Б.
3.1.3 Лечение печеночной энцефалопатии
-
Рекомендовано пациентам с ЦП с признаками ПЭ выявление и устранение факторов, ее провоцирующих с целью более быстрого купирования ПЭ[1, 2, 56,103,104 ].
Уровень убедительности рекомендаций С, уровень достоверности доказательств 5.
Комментарии: Устранение провоцирующих факторов ПЭ (остановка кровотечения, коррекция гиповолемии, поддержание кислотно-щелочного и электролитного баланса, ликвидация инфекции и т.д) является основной задачей, поскольку позволяет в 90% случаев ее купировать [1, 2, 81,103-106 ].
Медикаментозная терапия включает применение лактулозы**, орнитина (способствуют связыванию аммиака) и антибактериальных препаратов (для подавления аммониепродуцирующей флоры).
-
Рекомендовано применение лактулозы** пациентам с явной ПЭ для уменьшения уровня аммиака в системном кровотоке и коррекции кишечного дисбиоза [1,2,68,107].
Уровень убедительности рекомендаций В, уровень достоверности доказательств 1.
Комментарии: Сироп #лактулозы** принимают в индивидуальной дозе(как правило, это 15-30 мл каждые 12 ч) до появления по крайней мере 2-3 дефекаций мягким или неоформленным стулом на протяжении суток. В дальнейшем доза препарата подбирается индивидуально для поддержания 2- или 3-кратного опорожнения кишечника в течение суток. Затем дозировка препарата должна постепенно снижаться. Прием чрезмерно высоких доз лактулозы** может привести к таким осложнениям, как аспирация, дегидратация, гипернатриемия, раздражение перианальных кожных покровов, а в некоторых случаях – даже к усугублению ПЭ [1, 2,68,81].
-
Рекомендовано применение #рифаксимина в суточной дозе 1200 мг в качестве терапии ПЭ любой стадии у пациентов с компенсированным и декомпенсированным ЦП для снижения уровня аммиака в крови, улучшения психического статуса, уменьшения выраженности астериксиса, снижения стадии энцефалопатии [2,105-108 ]
Уровень убедительности рекомендаций А, уровень достоверности доказательств 1.
Комментарии: #Рифаксимин имеет широкий спектр антибактериальной активности, воздействуя на большинство грамположительных и грамотрицательных как аэробных, так и анаэробных бактерий. Препарат практически не всасывается в желудочно–кишечном тракте (при пероральном приеме натощак в крови обнаруживается не более 0,4% от принятой дозы). Доказано Положительное действие #рифаксимина как на уровень аммония в крови, так и динамику клинических проявлений ПЭ в условиях монотерапии, в комбинации с лактулозой**, при непереносимости лактулозы**, а также для профилактики ПЭ после порто системного шунтирования. Международное исследование в группе пациентов с двумя рецидивами явной ПЭ, направленное на изучение возможности по поддержанию ремиссии, показало превосходство #рифаксамина в сравнении с плацебо (на фоне приема лактулозы** в 91 % случаев) [1, 2,105-108,110 ].
-
Рекомендовано применение Орнитина пациентам с компенсированным и декомпенсированным ЦП с ПЭ любой стадии с целью снижения уровня аммиака и улучшения психического статуса.[106,109-111
Уровень убедительности рекомендаций А, уровень достоверности доказательств 1.
Комментарии: Принимая во внимание патогенез развития ПЭ, обосновано применение орнитина для ее лечения. Орнитин и аспартат играют основную роль в превращении аммиака в мочевину. Орнитин включается в цикл мочевины в качестве субстрата и служит стимулятором для одного из основных ферментов в цикле мочевины; аспартат также включается в цикл превращения аммиака и служит субстратом для синтеза глутамина. Таким образом, прием орнитина усиливает метаболизм аммиака, что способствует уменьшению клинических проявлений ПЭ. В течение последних 10 лет проведено несколько рандомизированных исследований, показавших высокую эффективность и безопасность применения орнитина в лечении ПЭ [1, 2, 109-111].
Орнитин выпускается как в виде раствора для внутривенной инфузии, так и в форме гранулята для перорального приема. Стандартная схема применения предусматривает внутривенное капельное введение до 40 г (обычно достаточно 20-30 г) препарата в течение 7-14 дней с последующим переходом на пероральный прием 9-18 г в сутки[1,111, 115]. Для достижения более быстрого и стойкого результата возможна комбинация внутривенного и перорального способа применения. Комбинированная терапия орнитина с лактулозой** способствует элиминации аммиака как из кишечника, так и из крови, что обусловливает суммацию лечебных эффектов[110]. Следует помнить, что применение данного препарата должно быть ограничено при наличии патологии почек, протекающей с явлениями почечной недостаточности с повышенным уровнем креатинина.
-
Рекомендовано пациентам с ЦП и ПЭ ежедневное потребление пищи калорийностью 35-40 ккал/кг идеальной массы тела (около 1800-2500 ккал/сут) для обеспечения достаточной энергетической ценности пищи [1,2,68,190]
Уровень убедительности рекомендаций С, уровень достоверности доказательств 5.
Комментарии: Белок в рационе больного ПЭ должен быть представлен преимущественно протеинами растительного происхождения и лактальбумином ввиду их лучшей переносимости. Калорийность пищи обеспечивается адекватным поступлением жиров и углеводов. Углеводы способствуют уменьшению концентрации аммиака и триптофана в плазме, однако следует помнить, что пациентам с циррозом свойственно развитие нарушения толерантности к глюкозе, что иногда требует назначения инсулина. Применение фруктозы, сорбитола и ксилитола нецелесообразно вследствие повышенного риска лактат-ацидоза. Учитывая способность пищевых волокон стимулировать рост бифидо- и лактобактерий, снижать проницаемость кишечной стенки, адсорбировать токсические субстанции, возможно их использование для уменьшения степени бактериальной транслокации у пациентов с ЦП, осложненном асцитом и, соответственно, профилактики СБП. Пища пациента с ЦП должна также содержать адекватные количества витаминов и микроэлементов. При нарушении всасывания витаминов показано их парентеральное введение.
-
Рекомендовано пациентам с ЦП и ПЭ ежедневное потребление белка от 1,2 до 1,5 г/кгс целью снижения выраженности гипераммониеми и профилактики ПЭ[1, 2,68,190].
Уровень убедительности рекомендаций С, уровень достоверности доказательств 5.
Комментарии: для предотвращения процессов катаболизма количество поступающего белка должно быть не менее 60 г/сут (на 2 – 3 стадиях ПЭ). После ликвидации признаков ПЭ суточное количество белка должно быть увеличено до 80-100 г/сут (1,2-1,5 г/кг). Необходимо учитывать, что у каждого пациента с циррозом свой порог переносимости пищевого белка, и при белковой интолерантности его дефицит нужно восполнять парентеральными инфузиями.
-
Рекомендовано пациентам с ЦП и ПЭ равномерно распределять в течение дня прием небольших порций пищи или жидких пищевых добавок, делать перекус перед сном для профилактики ночного катаболизма эндогенных белков и повышения азотсодержащих соединений в крови [2,68,190].
Уровень убедительности рекомендаций С, уровень достоверности доказательств 5.
-
Рекомендовано пациентом с ЦП и ПЭ лечебное питание(аминокислоты, включая комбинации с полипептидами, аминокислоты для парентерального питания (аминокислот с разветвленной боковой цепью) для уменьшения белкового катаболизма в печени и мышцах и улучшения обменных процессов в головном мозге, нормализации аминокислотного состава крови [67,68,191].
Уровень убедительности рекомендаций В, уровень достоверности доказательств 2.
Комментарии: Рекомендуемая дозировка – 0,3 г/кг/сут [1,68].
3.1.4 Лечение цирроза печени с гипонатриемией разведения
-
Пациентам с ЦП и гиповолемической гипонатриемией рекомендовано устранение причины гипонатриемии и введение растворов электролитов (0,9% изотонический раствор натрия хлорида**) для исключения преренальной азотемии и установления диагноза ГРС [1, 2,68].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
-
Пациентам с ЦП и гиперволемической гипонатриемией рекомендовано ограничение объема жидкости до 1 литра в день и отмена диуретиков для предотвращения дальнейшего падения уровня натрия [1, 2,68].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
-
Пациентам с ЦП и гиперволемической гипонатриемией во избежание перегрузки объемом и усугубления отчено-асцитического синдрома применение растворов, влияющих на водно-электролитный баланс (электролиты, гипертонические растворы)рекомендовано только при развитии жизнеугрожающих осложнений[2, 30,68].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 4)
Комментарии: Введение растворов, влияющих на водно-электролитный баланс(гипертонический раствор) пациентам с декомпенсированным ЦП показано только в случаях тяжелой гипонатриемии, сопровождающейся сердечно-легочными осложнениями, судорогами, угнетением сознания [1, 2,68]. Назначение альбумина человека**не показало достаточной эффективности у пациентов с ЦП и гипонатриемией [1, 2, 30,67,68].
3.1.5 Лечение цирроза печени, осложненного инфицированным асцитом
-
Рекомендовано назначать эмпирическую внутривенную антибиотикотерапию незамедлительно после диагностики инфицирования асцитической жидкости. [1, 2, 3,49,68 ].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
-
Рекомендовано у пациентов с ЦП и признаками инфицирования асцитической жидкости оценивать условия возникновения инфекции, профиль бактериальной резистентности в данном ЛПУ и тяжесть инфекционного осложнения с целью выбора эмпирической антибиотикотерапии [1, 2, 3]
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 5)
Комментарии: Пациенты с декомпенсированным ЦП крайне восприимчивы к развитию инфекций, вызванных микроорганизмами с множественной лекарственной устойчивостью, так как эти пациенты нуждаются в повторных госпитализациях, часто подвергаются инвазивным процедурам, принимают разные группы антибиотиков в качестве профилактики и с терапевтической целью [1, 2, 3,68].Развитие бактериальной резистентности увеличивает риск смертности от инфицированного асцита в 4 раза [3, 56].
-
Рекомендовано применение антибактериальных препаратов системного действия из группы других бета-лактамных антибактериальных препаратов(цефалоспорины 3-го поколения) в качестве препарата первой линии лечения пациентов с ЦП с внебольничной инфекцией асцитической жидкости при низком риске бактериальной резистентности [1, 2, 3].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Комментарии: препаратом выбора служит цефотаксим** (другие бета-лактамные антибактериальные препараты: цефалоспорины 3-гопоколения), который назначается в суточной дозе 4 г в течение 5-7 дней (эффективен в 77-98% случаев). В зависимости от эпидемических данных возможен подбор эмпирической терапии[1,2,3, 112 ].
-
Рекомендовано применение пиперациллин+тазобактама или антибиотика из группы других бета-лактамных антибактериальных препаратов (карбапенемы) в качестве препарата первой линии лечения пациентов с внебольничным инфицирование асцитической жидкости при высоком риске бактериальной резистентности [1, 2, 3].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Инфекции, ассоциированные с оказанием медицинской помощи, и нозокомиальные инфекции часто связаны с развитием бактериальной резистентности.
-
Пациентам с циррозом печени и инфицированным асцитом, связанным с оказанием медицинской помощи, и нозокомиальной инфекцией рекомендовано назначение пиперациллин+тазобактама, если имеются данные о низкой частоте мультирезистентных штаммов; рекомендовано назначение других бета-лактамных антибактериальных препаратов -карбапенемов, если имеются данные о высокой распространенности энтеробактерий — продуцентов бета-лактамаз расширенного спектра действия(ESBL). Рекомендовано применение других бета-лактамных антибактериальных препаратов (карбапенемов) в комбинации с антибиотиками гликопептидной структуры или даптомицином** или #линезолидом**в стандартных дозах согласно инструкции в случае высокой распространенности грамположительных бактерий с множественной лекарственной устойчивостью [1,2,32,56,113]. #Линезолид** вводится в дозе 600 мг внутривенно каждые 12 часов [201].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
-
Пациентам со спонтанной бактериальной эмпиемой рекомендовано применение аналогичного алгоритма подбора антибактериальной терапии [3,60].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Алгоритм подбора эмпирической антибактериальной терапии при инфицировании асцитической жидкости, при спонтанной бактериальной эмпиеме представлен на рисунке 3 в Приложении Б.
-
Рекомендовано у пациентов с ЦП и инфицированным асцитом оценивать эффективность антибиотикотерапии посредством повторного лапароцентеза с исследованием асцитической жидкости через два дня от начала лечения с целью оценки ее эффективности и коррекции терапии. [1, 2,3,49,68].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Эффективность антибиотикотерапии определяют по исчезновению клинической симптоматики и уменьшению количества нейтрофилов асцитической жидкости более чем на 25% через 48 часов от начала лечения. Если уменьшения количества нейтрофилов не наблюдается, то высока вероятность развития инфекции, вызванной бактериями, устойчивыми к антибактериальной терапии [1, 2, 3,113]. Заменять антибиотик следует с учетом чувствительности выделенного микроорганизма. Также в случае неэффективности лечения необходимо помнить о возможности развития вторичного перитонита. Наиболее важным негативным предиктором выживаемости при СБП служит развитие почечной недостаточности во время инфекции. Международное общество по изучению асцита рекомендует повторить исследование асцитической жидкости через 2 дня.
-
Рекомендовано выполнение трансфузий #альбумина человека** пациентам с инфицированном асцитом и ЦП с целью профилактики развития ГРС и снижения смертности [11, 2, 3,113-115 ].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 2)
Комментарии: СБП может провоцировать усугубление дисциркуляторных нарушений с развитием тяжелого нарушения функции печени, печеночной энцефалопатии и ГРС 1 типа, что, несмотря на разрешение инфекции, сопряжено с повышением смертности до 20% за период госпитализации [3,114].Добавление к антибактериальной терапии #альбумина человека** в дозе 1,5 г/кг массы тела (но не более 100 г сухого вещества) в день постановки диагноза инфицированного асцита и 1 г/кг на 3-й день позволяет снизить развитие ГРС 1 типа (с 30 % до 10 %) и смертность (с 29% до 10%) по сравнению с антибактериальной терапией без введения альбумина человека**. Наиболее эффективной данная схема лечения СБП показала себя в группах пациентов с уровнем сывороточного креатинина более 1 мг/дл и билирубина более 4 мг/дл [1, 2,3, 68,114,115 ].
3.1.6 Лечение цирроза печени с другими инфекционными осложнениями
-
Рекомендовано незамедлительное назначение эмпирической антибактериальной терапии пациентам с ЦП с подозрением на инфекционное осложнение с целью снижения внутрибольничной смертности [1, 3,116 ].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 2)
Комментарии: Самые частые инфекционные осложнения у пациентов с ЦП – мочевая инфекция, инфицированный асцит, пневмония, бактериемия. Быстрое начало эмпирической антибактериальной терапии снижает внутрибольничную смертность этих пациентов до 6% по сравнению со стандартной терапией (25%) [1, 2, 3,116 ].
-
Рекомендовано с целью подбора эмпирической антибиотикотерапии пациентам с ЦП основываться на условиях возникновения инфекции (внебольничная или связанная с оказанием медицинской помощи или нозокомиальная), профиле бактериальной резистентности в данном ЛПУ, типе инфекционного осложнения и его тяжести[1, 2, 3,117 ].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: С целью оптимизации эмпирической антибиотикотерапии крайне важно определять время и условия возникновения инфекционного осложнения. Показано, что смертность при развитии нозокомиальной инфекции намного выше (25-48%), чем при развитии внебольничной инфекции (7-21%).
Рекомендации по подбору эмпирической антибактериальной терапии и инфекционными осложнениями представлены в соответствующих рекомендациях[1, 2, 3, 117 ].
«Классические» схемы антибактериальной терапии не всегда возможно применять при ЦП, посколько ряд антибактериальных препаратов обладают или гепатотоксическим потенциалом (например, Амоксициллин+[Клавулановая кислота]**) или не так эффективны по сравнению с общей популяцией, особенно в случае нозокомиальной инфекции. В основе этого лежит общий сниженный иммунный статус у пациентов с ЦП, лейкопения (в рамках гиперспленического синдрома), гиперпродукция провоспалительных цитокинов, дефектные свойства молекулы альбумина, системное воспаление и др.
3.1.7 Лечение цирроза печени с гепаторенальным синдромом с критериями острого повреждения почек (ОПП-ГРС)
-
Рекомендован поиск и устранение этиологического фактора ОПП-ГРС у пациентов с ЦП с целью улучшения функции почек[1, 2, 3, 61,68 ]
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Необходима отмена нефротоксичных препаратов, диуретиков, нестериодных противовоспалительных и противоревматических препаратов [1, 2, 3, 25, 61,68 ], бета-адреноблокаторов [1, 2, 20], лечение бактериальной инфекции.
-
Рекомендовано восполнение ОЦК при гиповолемии пациентам с ЦП и ОПП-ГРС с целью улучшения функции почек [3,117 ].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Пациентам с диареей или интенсивным диурезом показана терапия растворами, влияющими на водно-электролитный баланс (кристаллоидные растворы). Пациентам с острым желудочно-кишечным кровотечением необходимы трансфузии эритроцитарной массы для поддержания гемоглобина на уровне 70-90 г/л[94 ].
-
Рекомендовано выполнение лечебного лапароцентеза в сочетании с введением #альбумина человека** пациентам с ЦП, осложненным ОПП-ГРС и напряженным асцитом с целью улучшения функции почек [1, 2,3,68,126 ].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
-
Рекомендовано назначение 20% раствора альбумина человека** из расчета 1 г/кг массы тела в сутки (не более 100 г альбумина человека** в день) в течение двух дней пациентам с ОПП >1A стадии, при наличии инфекции или без очевидной причины ОПП-ГРС [1, 2, 3,68,118 ].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
-
Рекомендовано введение терлипрессина** и альбумина человека** всем пациентам с ЦП, осложненным ОПП-ГРС, с целью уменьшения спланхнической артериальной вазодилатации и улучшения почечной перфузии [1, 2, 3, 61,68 ].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
-
Рекомендовано пациентам с ЦП, осложненным ОПП-ГРС, с целью повышения краткосрочной выживаемости вводить терлипрессин** внутривенно болюсно или внутривенно непрерывно в комбинации с альбумином человека**[1, 2, 3,68,89,119-123].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 1)
Комментарии: Терлипрессин**, аналог вазопрессина, – самый частый вазоконстриктор, действие которого изучалось у пациентов с ОПП-ГРС. Клинический ответ (полный или частичный) на введение терлипрессина составляет 45-76% по данным различных исследователей [2,23,119-124]. В двух метаанализах было показано, что комбинация терлипрессина и альбумина человека не только улучшает почечную функцию, но и повышает краткосрочную выживаемость этих пациентов [2,119,120,122,124 ].#Терлипрессин можно вводить внутривенно болюсно, начинаясдозы0,5 — 1 мг каждые 4-6 часов, с увеличением дозы до 2 мг каждые 4-6 часов в случае неадекватного снижения уровня сывороточного креатинина (<25%)[2,120,121,124, 206]. Предпочтительнее введение препарата через инфузомат непрерывно, начиная с дозы 2 мг в день. По эффективности такой путь введения препарата аналогичен болюсному введению, а по профилю безопасности лучше, учитывая необходимость введения меньшей дозы [123].Добавление к терапии терлипрессином** #альбумина человека** считается более эффективным, чем монотерапия вазоконстрикторами. Это можно объяснить тем, что, увеличивая эффективный объем кровообращения, #альбумин человека**препятствует снижению сердечного выброса, связанного с ГРС, а также с действием терлипрессина [2,26,125]. Кроме того, #альбумин человека оказывает антиоксидантное и противовоспалительное действие [2,126 ].
-
Рекомендовано пациентам с ЦП, осложненным ОПП-ГРС, введение 20% раствора #альбумина человека**в дозе 20-40 г/день под контролем центрального венозного давления с целью предотвращения гиперволемии [1,2, 21, 23,120, 147].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Комментарии: Лечение альбумином человека** необходимо продолжать до достижения полного клинического ответа (уровень сывороточного креатинина <1,5 мг/дл) или максимально в течение 14 дней в случае частичного ответа (снижение сывороточного креатинина ≥50%, но сохранение его на уровне более 1,5 мг/дл) или в случае отсутствия эффективности [1, 2, 3].
-
#Норэпинефрин**в комбинации с #альбумином человека** рекомендуется применять как терапию второй линии в качестве альтернативы терлипрессину** у пациентов с ЦП, осложненным ОПП-ГРС. Тем не менее, к данной терапии следует относиться с осторожностью – данных исследований на эту тему недостаточно[21, 23,127-130]
Уровень убедительности рекомендаций В(Уровень достоверности доказательств 2)
Комментарии: Показано, что влияние внутривенного болюсного введения #норэпинефрина** в дозе 0,5 – 3 мг/час[129,130 ] на снижение среднего артериального давления, уменьшение повреждения почек и повышение выживаемости пациентов с ЦП с ОПП-ГРС в течение месяца аналогично введению терлипрессина**. Однако число пациентов, леченных #норэпинефрином**, недостаточно, чтобы убедительно рекомендовать его данной группе пациентов. Кроме того, в отличие от терлипрессина**, для введения #норэпинефрина**необходим центральный венозный доступ, а в некоторых странах – перевод пациента в отделение интенсивной терапии.
-
Рекомендован тщательный мониторинг состояния, включая оценку электрокардиограммы, пациентам, получающим терлипрессин** или #норэпинефрин**, во избежание сердечно-сосудистых осложнений, таких как гиперволемия и ишемия миокарда[21, 23,127-130].
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 5)
Комментарии: Самые частые побочные эффекты при внутривенном болюсном введении терлипрессина** (45-46%) – гиперволемия, ишемия миокарда, а также диарея, боль в животе. Частота отмены препарата из-за осложнений, преимущественно сердечно-сосудистых, составляет около 20% [21, 23].
-
Рекомендован повторный курс лечения пациентамcЦП с рецидивом ОПП-ГРС[3, 131].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Комментарии: Рецидив ОПП-ГРС после успешной предшествующей терапии может достигать 20%. Обычно повторный курс терлипрессина** и #альбумина человека** приводит к полному разрешению ОПП-ГРС, однако в некоторых случаях может потребоваться длительное применение данных препаратов.
-
Пациентам с ЦП, осложненном ГРС, не соответствующим критериям ОПП (известный ранее как ГРС 2 типа), также рекомендовано введение #терлипрессина** и #альбумина человека** в большинстве случаев. #Терлипрессин** можно вводить внутривенно болюсно в дозе 1 мг каждые 4 часа, с увеличением дозы до 2 мг каждые 4 каждые 4 часа в случае неадекватного снижения уровня сывороточного креатинина (<25%) Однако, принимая во внимание высокую частоту рецидива повреждения почек у этих пациентов, данные о влиянии этой комбинации на долгосрочную выживаемость, особенно среди пациентов, ожидающих трансплантацию печени, противоречивы. По этой причине не рекомендовано назначать #терлипрессин** и #альбумин человека** пациентам с рецидивирующим ГРС без критериев ОПП, находящимся в листе ожидания пересадки печени [2, 3,132,133].
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 4)
3.1.8 Лечение цирроза печени с лёгочными осложнениями
-
Рекомендовано назначение диуретиков пациентам с ЦП с печеночным гидротораксом с целью уменьшения объема плевральной жидкости [1, 2,68,134].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
-
Рекомендовано проведение лечебного торакоцентеза пациентам с ЦП с печеночным гидротораксом, не отвечающим на диуретики, с целью уменьшения дыхательной недостаточности [1, 2,34,134].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
Комментарии: Лечебный торакоцентез необходим для облегчения одышки. Однако его эффективность при рефрактерном печеночном гидротораксе ограничена, требуется проведение неоднократного торакоцентеза, что увеличивает риск осложнений, таких как пневмоторакс, инфицирование плевральной жидкости и мягких тканей, кровотечение.
-
Рекомендована длительная кислородотерапия пациентам с ЦП и ГПС с тяжелой гипоксемией с целью уменьшения дыхательной недостаточности [2,36,68,135].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Комментарии: В настоящее время нет убедительных данных об эффективности применения того или иного средства в лечении ГПС, что во многом обусловлено отсутствием больших рандомизированных исследований. Результаты некоторых неконтролируемых исследований показали неэффективность таких препаратов как бета-адреноблокаторы, ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства (ингибиторы циклооксигеназы), системные глюкокортикостероиды, циклофосфамид [1, 2,34,36,135 ]. Предполагалось, что наложение TIPS должно уменьшить портальное давление у пациентов с ГПС, однако полученные данные не продемонстировали достоверно значимую эффективность этого метода лечения [136,137 ]. Кроме того, TIPS может усугубить легочную вазодилатацию посредством усиления гиперкинетического типа кровообращения. Поэтому длительная оксигенотерапия остается единственным консервативным методом лечения, который может быть рекомендован пациентам с тяжелой дыхательной недостаточностью, обусловленной ГПС. Необходимо, однако, оценить такие аспекты этого лечения как эффективность, стоимость, приверженность терапии.
3.2 Хирургическое лечение
-
Рекомендовано проведение TIPSпациентам с резистентным асцитом в случае частых и неэффективных больше объемных лапароцентезов с целью улучшения выживаемости и контроля над асцитом.[2, 3, 21, 23,90-92]
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 1)
Комментарии: (Transjugular intrahepatic portosystemic shunt, TIPS) — малоинвазивная хирургическая операция, проводимая под контролем рентгеноскопии. TIPS включает в себя ряд эндоваскулярных процедур в определенной последовательности: после пункции яремной вены с помощью сосудистых стентов (голометаллических или стент-графтов) формируется внутрипеченочное соустье между крупными печеночными венами и ветвями воротной вены. В результате использования TIPS сохраняется гепатопетальный кровоток и осуществляется отчетливая портальная декомпрессия. Успех процедуры во многом зависит от квалификации оперирующего врача-хирурга и учёта им индивидуальных анатомических особенностей пациента [1, 2, 21, 23].
-
Рекомендовано проведение TIPS пациентам с рецидивирующим клинически выраженным печеночным гидротораксом с целью предотвращения накопления жидкости в плевральных полостях и с целью подготовки к проведению трансплантации печени [20, 22,137].
Уровень убедительности рекомендаций В(Уровень достоверности доказательств 2)
-
Рекомендовано использование для TIPS стент-графтов, покрытых политетрафторэтиленом, размером 8 мм с целью снижения частоты развития ПЭ (до 18%) [21, 23,137-139].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 2)
Комментарии: Основным осложнением после наложения TIPS является развитие печеночной энцефалопатии (до 50% пациентов) [139 ]. Существенно снизить частоту развития ПЭ (до 18%) позволяет использование для TIPS стент-графтов, покрытых политетрафторэтиленом, размером 8 мм [19,139].
-
Не рекомендовано проводить TIPS пациентам с тяжелой печеночной недостаточностью, сопутствующей инфекцией, нарастающей почечной недостаточностью, тяжелой сопутствующей патологией других органов и систем [23,140,141].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
Комментарии: тяжелая печеночная недостаточность характеризуется повышением уровня общего билирубина более 3 мг/дл, МНО более 2, нарастанием печеночной энцефалопатии выше 2 стадии.
-
Не рекомендуется проводить TIPS пациентам с ЦП и тромбоцитопенией ниже 75х109 /л, с тяжелой систолической иди диастолической дисфункцией, с легочной гипертензией [140,141].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
-
Рекомендовано проведение TIPS пациентам с риском кровотечения из ВВПиЖ в случае наличия противопоказаний к назначению неселективных бета-адреноблокаторов или резистентности к ним [19, 21, 23].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
-
Рекомендовано проведение TIPS пациентам с ЦП и продолжающимся кровотечением из ВВПиЖ, которые не отвечают на терапию терлипрессином** и октреотидом**и эндоскопическое лигирование [19, 21, 23].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Комментарии: У 10-15% пациентов невозможно остановить кровотечение из ВВПиЖ назначением вазоактивных препаратов и эндоскопическим лигированием или у них развивается повторное кровотечение, несмотря на применение вышеуказанных средств. TIPS может применяться у этих пациентов как резервный метод лечения [19, 23].
3.2.1 Трансплантация печени
На современном этапе отмечается тенденция к более раннему определению показаний к операции, так как, учитывая нехватку доноров и длинные листы ожидания, раннее, и вместе с тем обоснованное, включение пациента с ЦП в лист ожидания дает ему возможность дольше находиться в поле зрения трансплантолога, что увеличивает шансы больного на операцию. Вместе с тем, суммируя данные нескольких исследований, проведенных американским обществом трансплантологов и американским обществом по изучению болезней печени, было достигнуто соглашение, о том, что только больные с имеющимися на данный момент показаниями для трансплантации должны включаться в лист ожидания. Больные с расчетом на необходимость такой терапии в будущем включаться в лист ожидания не должны. Наличие необратимого заболевания печени с прогнозом жизни менее 12 мес., отсутствие других методов лечения, или наличие хронического заболевания печени, значительно снижающего качество жизни и трудоспособность пациента, а также прогрессирующее заболевание печени с ожидаемой продолжительностью жизни меньшей, чем в случае трансплантации печени, являются показаниями для ее пересадки. Данный радикальный метод лечения показан практически всем больным с терминальной стадией заболеваний печени, осложненных кровотечением из ВВПиЖ, развитием асцита, ГРС, энцефалопатией, СБП. Дополнительными показаниями к пересадке печени являются выраженная утомляемость, невозможность вести нормальный образ жизни, выраженное похудание и упорный кожный зуд. Больные с циррозом, которые перенесли пищеводное или желудочное кровотечение как следствие портальной гипертензии и/или хотя бы один эпизод СБП, соответствуют минимальным критериям включения в лист ожидания независимо от класса ЦП по Чайлд-Пью. Следует подчеркнуть, что наличие у пациентов с ЦП и ВВПиЖ и имеющееся в анамнезе кровотечение из них, рассматривается большинством авторов, как настоятельное показание к выполнению трансплантации печени, несмотря на удовлетворительную ее функцию. Таким образом, основным принципом определения показаний для ортотопической трансплантации печени является прогнозирование того, что выживаемость больного после трансплантации превысит его продолжительность жизни без нее [1, 2, 3,68].
Основные противопоказания для трансплантации печени:
-
Внепечёночные злокачественные заболевания
-
Метастатические поражения
-
Активная ВИЧ инфекция
-
Тяжёлые сопутствующие заболевания, не коррегирующиеся трансплантацией
-
Активный алкоголизм, наркомания
-
Внепеченочный сепсис
-
Тяжелые заболевания сердечно-сосудистой системы
-
Психологическая и социальная несостоятельность больного
-
Рекомендовано рассмотреть вопрос о возможности трансплантации печени пациентам с ЦП и рефрактерным асцитом [87,142 ].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
Комментарии: Рефрактерный асцит ассоциирован с плохим жизненным прогнозом (средняя выживаемость около 6 месяцев), поэтому необходимо направить пациента в центр трансплантации печени.
-
Рекомендовано проведение трансплантации печени пациентам с ГРС независимо от ответа на медикаментозное лечение с целью улучшения их выживаемости [1, 2,3,68].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств -5)
-
Рекомендовано проведение трансплантации печени пациентам с рефрактерным печеночным гидротораксомс целью улучшения их выживаемости[2,143,144 ].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
Комментарии: При отсутствии противопоказаний трансплантация печени представляет собой лучший способ лечения пациентов с рефрактерным печеночным гидротораксом. Само по себе наличие гидроторакса не сказывается на исходе операции.
-
Рекомендовано рассмотрение вопроса о трансплантации печени пациентам с ГПС с PaO2 <60 мм. рт. ст.с целью улучшения их выживаемости [145,146 ].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 4)
Комментарии: Единственным на сегодняшний день рекомендованным методом лечения ГПС является пересадка печени. Трансплантация печени приводит к полному разрешению ГПС или значительному улучшению дыхательной недостаточности у более чем 85% пациентов с тяжелой гипоксемией.
-
Рекомендовано регулярное (каждые 6 месяцев) исследование газов артериальной крови пациентам с ЦП с целью установления очередности к трансплантации печени [146,192 ].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
Комментарии: В связи с тем, что тяжелая гипоксемия (PaO2 <45–50 мм.рт.ст.) ассоциирована с повышением смертности после трансплантации печени, необходимо регулярно оценивать газовый состав крови пациентам с ЦП, чтобы определить очередность выполнения данного метода лечения [146 ].
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Дополнительная информация отсутствует.
Медицинская реабилитация
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Медицинская реабилитация больных циррозом в стадии компенсации подразумевает под собой раннее выявление признаков начинающейся декомпенсации цирроза печени, присоединения новых осложнений, определение показателей нутритивной недостаточности.
-
Рекомендовано пациентам с ЦП проводить восстановительное лечение в амбулаторных условиях и оно должно включать прекращение приема алкоголя, исключение воздействия гепатотоксичных веществ, исключения приема лекарственных средств без назначения врача, умеренную физическую активность с ограничением выраженных физических нагрузок, прогулки на свежем воздухе, энтеральное и парентеральное питание растворами белков при снижении синтетической функции печени, коррекцию билиарной и первичной/вторичной панкреатической недостаточности, ограничение приема натрия с пищей (включая минеральные воды с высоким содержанием натрия) у пациентов с асцитом [207, 208].
Уровень убедительности рекомендаций В (Уровень достоверности доказательств 3)
Общие принципы питания больных циррозом печени без ее недостаточности: полноценное, сбалансированное, ограничение тугоплавких жиров (30% жиров должны быть растительного происхождения), азотистых экстрактивных веществ и холестерина [1, 2, 67, 68].
Госпитализация
6. Организация оказания медицинской помощи
Показания к госпитализации: желтуха, клинически выраженная энцефалопатия (2 стадии и выше), впервые возникший или медикаментозно неконтролируемый/напряжённый асцит, отёчный синдром, подозрение на кровотечение, появление/усиление астенического синдрома, олигурия/анурия, подозрение на развитие инфекционного осложнения, появление/усиление одышки, клинические признаки поражения почек (олиго-/анурия). Госпитализация при ЦП может быть плановой и экстренной, в терапевтический или хирургический блок, в отделение интенсивной терапии и реанимации.
Показания к выписке пациента: Уменьшение выраженности клинических симптомов и улучшение качества жизни, отсутствие необходимости хирургического лечения, необходимости проведения интенсивной терапии, стабилизация функции жизненно важных органов: сердечно-сосудистая (гемодинамика) и дыхательная система, почки, ЦНС.
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Очень важен амбулаторный этап ведения пациента, именно от него зависит частота осложнений ЦП, риск его быстрой декомпенсации и повторных госпитализаций [147 . Альбумин человека** играет принципиальную роль в этом процессе.
-
Рекомендовано длительное применение 20% раствора альбумина человека** в амбулаторных условиях пациентам с декомпенсированным ЦП для контроля над асцитом, снижающее частоту инфекционных осложнений, эпизодов энцефалопатии у пациентов с ЦП. Режим введения 20% раствора #альбумина человека**: 20% раствор #альбумина человека** в дозе 40 г 2 раза в неделю в течение первых 2 недель после выписки пациента из стационара или компенсации функции печени/портальной гипертензии в амбулаторных условиях, затем 40 г 1 раз в неделю продолжительностью до 18 месяцев [75,148 ].
Уровень убедительности рекомендаций В(Уровень достоверности доказательств 2)
Комментарии: В 2018 г были опубликованы результаты многоцентрового рандомизированного открытого в параллельных группах исследования Answer (human Albumin for the treatmeNt of aScites in patients With hEpatic cirrhosis – Применение альбумина человека**для лечения асцита у пациентов с циррозом печени), организованного в Италии в условиях реальной клинической практики. Пациенты, получавшие терапию антагонистами альдостерона (≥200 мг/сут) и фуросемидом** (≥25 мг/сут), были рандомизированы в две группы: те, кто получал стандартную медикаментозную терапию и стандартную терапию в комбинации с раствором #альбумина человека** в дозе 40 г 2 раза в неделю в течение 2 недель, затем 40 г 1 раз в неделю продолжительностью в общей сложности до 18 месяцев. Авторы показали, что такая комбинация способствовала контролю над асцитом, приводила к уменьшению частоты повторных госпитализаций, уменьшению летальности, улучшению качества жизни, увеличению периода общей выживаемости [75,148].
5.1 Профилактика инфицирования асцитической жидкости
Ввиду того, что большинство эпизодов инфицированного асцита возникают в результате транслокации грамотрицательных бактерий из кишечника, идеальным препаратом выбора для профилактики СБП должен стать безопасный, доступный антибиотик, эффективный в отношении этих микроорганизмов и сохраняющий полезную анаэробную флору (селективная кишечная деконтаминация) [3,75,149]. Учитывая высокую стоимость и неизбежный риск развития резистентных штаммов, профилактика антибактериальными препаратами должна проводиться только пациентам, относящимся к группам риска: пациенты с желудочно-кишечным кровотечением, пациенты с низким содержанием белка в асцитической жидкости без предшествующего эпизода СБП (первичная профилактика) и пациенты с повторными эпизодами СБП (вторичная профилактика) [1, 2, 20, 68,75,149-152 ].
-
Рекомендовано назначение невсасывающегося кишечного антибактериального препарата #рифаксимина в соответствии с инструкцией пациентам с ЦП для первичной и вторичной профилактики инфицированного асцита[75, 200].
Уровень убедительности рекомендаций A (Уровень достоверности доказательств 1)
Комментарий: Согласно мета-анализу имеющихся исследований, назначение рифаксимина в суточной дозе 1200 мг или 1100 мг в течение 6-12 месяцев показало эффективность рифаксимина для профилактики инфицированного асцита при ЦП [75, 200]. Помимо снижения риска инфицирования асцитической жидкости у пациентов с ЦП применение #рифаксимина сопровождалось увеличением общей выживаемости, при этом частота развития Clostridium difficile ассоциированной диареи не превышает таковую для пациентов, получающих лактулозу**.
-
Рекомендовано назначение антибактериальных препаратов, производных хинолона (фторхинолоны:, #норфлоксацин, #ципрофлоксацин**) в качестве альтернативной терапии пациентам с ЦП с прогрессирующей печеночной недостаточностью и низким содержанием белка в асцитической жидкости с целью первичной профилактики СБП [3,150, 151].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 1)
Комментарии: Назначение #норфлоксацина (400 мг/день) или #ципрофлоксацина (500 мг/день) в течение 3 — 12 месяцев (в зависимости от клинического состояния пациента и разрешения асцита) значительно улучшает трехмесячную выживаемость пациентов с низким содержанием белка в асцитической жидкости (<15 г/л) с прогрессирующей печеночной недостаточностью (сумма баллов по шкале Child-Pugh ≥9 и уровень сывороточного билирубина ≥3 мг/дл) или с нарушением функции почек (уровень сывороточного креатинина ≥ 1,2 мг/дл, азота мочевины ≥25 мг/дл или сывороточная концентрация натрия ≤130 ммоль/л) по сравнению с пациентами, получающими плацебо (94% vs. 62%; p = 0,03) [2, 3, 163]. Согласно данным мета-анализа всех исследований эффективности антибактериальных препаратов, производных хинолона (фторхинолонов) в качестве профилактики СБП у пациентов с ЦП, преимущество длительного их применения в отношении выживаемости особенно заметно в первые три месяца (94% vs. 62%, p = 0,003), но снижается со временем и не прослеживается после 12 месяцев наблюдения (RR 0,65; 95% CI; 0,41–1,02). [1, 2,3,68,150].
-
Рекомендовано отменить терапию норфлоксацином пациентам с ЦП при улучшении функции печени и разрешении асцита с целью профилактики развития резистентных к терапии штаммов[1, 2, 3].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
-
Рекомендовано назначение #норфлоксацина (400 мг/день перорально) пациентам с ЦП с разрешившимся эпизодом СБП с целью вторичной профилактики СБП [1, 2, 3, 193].
Уровень убедительности рекомендаций А(Уровень достоверности доказательств 2)
Комментарии: После эпизода СБП вероятность возврата инфекции в течение года составляет около 70%. [3, 31]. Назначение норфлоксацина снижает вероятность развития повторного эпизода СБП с 68% до 20% [3,151,152].До сих пор неясно, нужно ли продолжать профилактику норфлоксацином пожизненно или до проведения операции трансплантации печени или до стойкого улучшения функции печени.
-
Рекомендована постановка в лист ожидания трансплантации печени пациентам с ЦП, перенесшим эпизод СБП, с целью повышения их выживаемости [2, 3,75].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
Комментарии: Данная рекомендация основывается на данных о низкой выживаемости пациентов с ЦП, перенесшими эпизод СБП (30-50% в течение года и 25-30% в течение двух лет). [2,3,75]
-
Рекомендовано ограничивать применение ингибиторов протонногонасоса пациентам с ЦП с целью профилактики развития СБП [153 ].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 4)
Комментарии: Очень часто ингибиторы протонногонасосаприменяются необоснованно у пациентов с ЦП. Показано, что их длительное применение существенно повышает риск развития СБП и ПЭ, особенно у пациентов с асцитом. Портальная гастропатия не служит показанием для назначения ингибиторов протоновогонасоса, препараты выбора – неселективные бета-адреноблокаторы [2, 19, 21, 23].0
5.2 Профилактика варикозных кровотечений
-
Рекомендовано всем пациентам с ЦП с «симптомами угрозы» (наличие пятен васкулопатии, ЦП класс С по шкале Child-Pugh, ВВ пищевода и желудкаII и III степени независимо от тяжести ЦП по шкале Child-Pugh) проводить первичную профилактику кровотечения из вен пищевода и желудка [19, 21, 23].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
-
Рекомендовано пациентам с ЦП и ВРВП пищевода и желудка I степени с пятнами васкулопатии и пациентам с декомпенсированным ЦП (класс С по шкале Child-Pugh) назначение бета-адреноблокаторов с целью профилактики кровотечения [19, 21, 23].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Влияние бета-адреноблокаторов (#пропранолол**)) и альфа- и бета-адреноблокатора #карведилола**, на портальную гипертензию опосредуется за счет двух механизмов: а) снижение сердечного выброса и спланхнического кровотока через блокаду бета-рецепторов и б) спланхническая вазоконстрикция, приводящая к снижению портального давления, за счет блокады альфа-1-адренорецепторов. Препараты целесообразно назначать в дозе, снижающей частоту пульса в покое на 25%, либо, при исходно низком пульсе, до 55 ударов в минуту. Дозы #пропранолола** могут варьировать от 20 мг/сут внутрь (начальная) до 320 мг/сут (максимальная), и подбирается индивидуально. При достижении целевых дозировок неселективных бета-адреноблокаторов градиент портального давления снижается <10 мм рт ст, что уменьшает риск кровотечения. Тем не менее, целевые гемодинамические изменения отмечаются только у 46% пациентов, получающих неселективные бета-адреноблокаторы [19, 21, 23,154-156, 197].
Перспективной альтернативой неселективным адреноблокаторам становится #карведилол** (неселективный бета-адреноблокатор с существенной анти-альфа1–адренергической активностью). Дозу карведилола необходимо титровать. Начинать необходимо с суточной дозы 6,25 мг, максимальная доза – 25 мг в день. Назначение #карведилола** ассоциировано с более существенным снижением портального давления по сравнению с традиционными неселективными бета-адреноблокаторами [2, 156, 198].
-
Рекомендовано пациентам с ЦП и ВРВПII и III степени и желудка назначать неселективные бета-адреноблокаторы или эндоскопическое лигирование ВВ с целью профилактики кровотечения [20].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
-
Рекомендовано пациентам с ЦП и ВРВПII и III степени и желудка с целью выбора метода профилактики кровотечения (неселективные бета-адреноблокаторы или эндоскопическое лигирование ВВ) ориентироваться на локальный опыт и ресурсы, выбор пациента и ожидаемые побочные эффекты [1, 2, 19, 23,156,157].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: При выборе метода профилактики предпочтение обычно отдается неселективным бета-адреноблокаторам по той причине, что помимо снижения давления в портальной системе они также обладают другими благоприятными эффектами, такими как снижение кишечной проницаемости, бактериальной транслокации и системного воспаления [19, 23, 158-160 ].
-
Рекомендовано избегать высоких доз неселективных бета-адреноблокаторов при лечении пациентов с ЦП и напряженным или рефрактерным асцитом[1, 2, 23,160].
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 5)
Комментарии: Неселективные бета-адреноблокаторы с осторожностью применяются у пациентов с ЦП и напряженным или рефрактерным асцитом. В основе этого положения лежат данные, полученные при изучении прогноза пациентов с рефрактерным асцитом, получавших неселективные бета-адреноблокаторы [173 ]. Было выявлено снижение их выживаемости и повышение риска дисциркуляторной дисфункции после проведения лапароцентеза. Считается, что неселективные бета-алренобокаторы усугубляют системную артериальную гипотензию и истощение резервов сердечной мышцы на фоне прогрессирующего гипердинамического типа кровообращения, которое свойственно пациентам с терминальной стадией заболевания печени. В результате развиваются многочисленные осложнения, такие как ГРС.
-
Не рекомендовано назначать карведилол** пациентам с ЦП и напряженным или рефрактерным асцитом с повышенным риском кровотечения из ВРВП и желудка[21, 23].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
-
Рекомендовано временно отменить неселективные бета-адреноблокаторы пациентам с ЦП и прогрессирующей гипотонией (систолическое артериальное давление < 90 мм.рт.ст.), а также при развитии интеркуррентного события (например, кровотечение, сепсис, СБП или ОПП) [2, 21, 23].
Уровень убедительности рекомендаций C(Уровень достоверности доказательств 5)
-
Рекомендовано проведение эндоскопического лигирования вен пищевода пациентам с ЦП и непереносимостью неселективных бета-адреноблокаторов или при наличии противопоказаний к их назначению с целью профилактики кровотечения из ВРВП и желудка [2, 19, 23].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Несмотря на то, что эндоскопическое лигирование ВРВП и желудка сопряжено с меньшим числом системных побочных эффектов, оно чаще, чем применение неселективных бета-адреноблокаторов, приводит к потенциально жизнеугрожающим осложнениям, таким как образование язв и кровотечение из них [19, 23,161]. Кроме того, эндоскопическое лигирование не влияет на портальную гипертензию. Поэтому эндоскопическое лигирование применяют обычно при непереносимости неселективных бета-адреноблокаторов и при наличии противопоказаний к их назначению.
-
Рекомендовано назначение неселективных бета-адреноблокаторов в комбинации с эндоскопическим лигированием пациентам с ЦП и состоявшимся кровотечением из ВРВП и желудка с целью снижения риска повторного кровотечения [19, 23,161].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 1)
Комментарии: Вторичная профилактика варикозных кровотечений должна начинаться как можно скорее, так как первый эпизод желудочно-кишечного кровотечения у больных ЦП в 60% случаев сопровождается его рецидивом. Рекомендуется комбинация двух методов профилактики повторного кровотечения — неселективные бета-адреноблокаторы и эндоскопическое лигирование, так как данная тактика лучше влияет на выживаемость этих пациентов по сравнению с монотерапией [23,161].
-
Рекомендовано проведение TIPS пациентам с ЦП, не отвечающим на терапию неселективными бета-адреноблокаторами, при отсутствии абсолютных противопоказаний, с целью профилактики кровотечения из ВРВП и желудка[19, 23,162].
Уровень убедительности рекомендаций А (Уровень достоверности доказательств 2)
-
Рекомендовано пациентам с ЦП с целью первичной профилактики кровотечения из гастроэзофагеальных вен типа II или изолированных вен желудка типа I назначать неселективные бета-адреноблокаторы с целью профилактики кровотечения из ВРВП и желудка[19, 23].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств 5)
Комментарии: Последний BAVENO Консенсус решил, что общепринятой считается рекомендация по применению неселективных бета-адреноблокаторов для профилактики кровотечения из кардиофундальных вен[23].
-
Рекомендовано при ведении пациентов с ЦП и гастроэзофагеальными венами типа I применять аналогичный алгоритм первичной профилактики кровотечения как при наличии ВВ пищевода [2, 19, 21, 23].
Уровень убедительности рекомендаций С(Уровень достоверности доказательств 5)
5.3 Профилактика печеночной энцефалопатии
-
Пациентам со скрытой(минимальной или 1 стадии) или явной печеночной энцефалопатией рекомендован прием #рифаксимина для поддержания ремиссии и снижения риска госпитализации, связанной с ПЭ [75,82,88].
Уровень убедительности рекомендаций В, уровень достоверности доказательств 3.
Комментарии: Применение #рифаксимина в дозе 1100 или 1200 мг/сут в течение6 месяцев снижает риск рецидива ПЭ на 58 % (р ˂ 0,0001) и риск госпитализации, связанной с рецидивом ПЭ, на 50 % (p ˂ 0,013) по сравнению с плацебо. Применение рифаксимина сопровождается снижением риска осложнений цирроза печени и увеличением общей выживаемости у пациентов с печеночной энцефалопатией [75 ].
-
Для профилактики ПЭ рекомендован прием орнитина в дозе 18 г в сутки[163 ].
Уровень убедительности рекомендаций А, уровень достоверности доказательств 2.
Комментарии: В двойном слепом плацебо-контролируемом исследовании у 150 пациентов с циррозом печени показан положительный эффект орнитина для профилактики вторичной ПЭ. На фоне назначения орнитина на 6 месяцев по сравнению с плацебо в достоверно меньшем числе случаев развивалась ПЭ; также было отмечено, что временной интервал до развития симптомов ПЭ был значительно длиннее, улучшались параметры психометрических тестов и снижался уровень аммиака в крови[163 ].
Информация
Источники и литература
-
Клинические рекомендации Российской гастроэнтерологической ассоциации
- Клинические рекомендации Российской гастроэнтерологической ассоциации — Ивашкин В.Т., Маевская М.В., Павлов Ч.С., Федосьина Е.А., Бессонова Е.Н., Пирогова И.Ю., Гарбузенко Д.В. Клинические рекомендации Российского общества по изучению печени и Российской гастроэнтерологической ассоциации по лечению осложнений цирроза печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016;26(4):71-102
EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis //J hepatol. – 2018. – Т. 69. – №. 2. – С. 406-460.
EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol.- 2010;53:397–417
Angeli P, Garcia-Tsao G, Nadim MK, Parikh RC. News in pathophysiology, definition and classification of hepatorenal syndrome: A step beyond the International Club of Ascites (ICA) consensus document. J Hepatol 2019, Vol. 71(4): P811-22
Fasolato S, Angeli P, Dallagnese L, et al. Renal failure and bacterial infections in patients with cirrhosis: epidemiology and clinical features. Hepatology 2007;45:223–229.
Guo J, Friedman SL. Hepatic fibrogenesis. Semin Liver Dis 2007; 27: 413-426
Das SK, Vasudevan DM. Genesis of hepatic fibrosis and its biochemical markers. Scand J Clin Lab Invest 2008; 68: 260-269
Ramachandran P, Iredale JP. Reversibility of liver fibrosis. Ann Hepatol 2009; 8: 283-291
Hernandez-Gea V, Friedman SL. Pathogenesis of liver fibrosis. Annu Rev Pathol 2011; 6: 425-456
Bernardi M, Moreau R, Angeli P, Schnabl B, Arroyo V. Mechanisms of decompensation and organ failure in cirrhosis: From peripheral arterial vasodilation to systemic inflammation hypothesis. JHepatol 2015;63:1272–84
Jalan R, Fernandez J, Wiest R, Schnabl B, Moreau R, Angeli P, et al. Bacterial infections in cirrhosis: a position statement based on the EASL Special Conference. J Hepatol 2013;60:1310–1324
Масленников Р.В., Татаркина М.А., Маевская М.В., Павлов Ч.С., Жаркова М.С., Ивашкин В.Т. Влияние синдрома избыточного бактериального роста и системного воспаления на абдоминальную гемодинамику у больных циррозом печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017;27(4):52-61
Claria J, Stauber RE, Coenraad MJ, Moreau R, Jalan R, Pavesi M, et al. Systemic inflammation in decompensated cirrhosis: Characterization and role in acute-on-chronic liver failure. Hepatology 2016;64:1249–1264
Жаркова М.С. Бактериальная транслокация в патогенезе инфекционных осложнений у больных циррозом печени: автореферат диссертации на соискание ученой степени кандидата медицинских наук. ГБОУ ВПО Первый МГМУ им. И.М. Сеченова, Москва, 2012 г.
Масленников Р.В., Дрига А.А., Ивашкин К.В., Жаркова М.С., Маевская М.В., Павлов Ч.С., Арсланян М.Г., Мусина Н.Б., Березина Е.Н., Ивашкин В.Т. Роль синдрома избыточного бактериального роста и системного воспаления в патогенезе гемодинамических изменений у больных циррозом печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017;27(3):45-56
Ивашкин В.Т., Надинская М.Ю., Буеверов А.О. Печеночная энцефалопатия и методы ее метаболической коррекции. Болезни органов пищеварения 2001;1:25-27
Juan AO, Elizabeth CV. Afferent mechanisms of sodium retention in cirrhosis and hepatorenal syndrome. Kidn Intern, 2010. – Vol. 77(8): PP 669-80.
Ripoll C, Groszmann R, Garcia-Tsao G, Grace N, Burroughs A, Planas R, et al. Hepatic venous pressure gradient predicts clinical decompensation in patients with compensated cirrhosis. Gastroenterology 2007;133: 481–88.
Национальные клинические рекомендации Минздрава России по лечению кровотечений из варикозно расширенных вен пищевода и желудка. Затевахин И.И., Ивашкин В.Т., Киценко Е.А., Павлов Ч.С., Шерцингер А.Г., Чжао А.В., Маевская М.В., Верткин А.Л., Жигалова С.Б., Огурцов П.П., Бунова С.С., Королев М.П., Котив Б.Н., Дзидзава И.И., Анисимов А.Ю., Прудков М.И., Хоронько Ю.В., Назыров Ф.Г., Девятов А.В., Манукьян Г.В., Лебезев В.М., Цициашвили М.Ш., Монахов Д.В. Медицинская газета. 2015; (71-74).
Bosch J, Groszmann RJ, Shah VH. Evolution in the understanding of the pathophysiological basis of portal hypertension: How changes in paradigm are leading to successful new treatments. JHepatol 2015;62:S121–S130
De Franchis R. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol2010; 53: 762-768
D’Amico G, De Franchis R. Upper digestive bleeding in cirrhosis. Posttherapeutic outcome and prognostic indicators. Hepatology 2003;38:599–612
De Franchis RBaveno VI faculty. Expanding consensus in portal hypertension: report of the BAVENO VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. JHepatol 2015;63:743–52
Trawale JM, Paradis V, Rautou PE, Francoz C, Escolano S, Sallee M, et al. The spectrum of renal lesions in patients with cirrhosis: a clinicopathological study. LiverInt 2010;30:725–32
Angeli P, Gines P, Wong F, Bernardi M, Boyer TD, Gerbes A, et al. Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the International Club of Ascites. J Hepatol 2015;62:968–74
Krag A, Bendtsen F, Henriksen JH, Moller S. Low cardiac output predicts development of hepatorenal syndrome and survival in patients with cirrhosis and ascites. Gut 2010;59:105–110
Wiest R, Lawson M, Geuking M. Pathological bacterial translocation in liver cirrhosis. JHepatol 2014;60:197–209
Van Slambrouck CM, Salem F, Meehan SM, Chang A. Bile cast nephropathy is a common pathologic finding fo kidney injury associated with severe liver dysfunction. KidneyInt 2013;84:192–197
Biggins SW, Rodriguez HJ, Bacchetti P, Bass NM, Roberts JP, Terrault NA. Serum sodium predicts mortality in patients listed for liver transplantation. Hepatology 2005;41:32–39.
Porcel A, Diaz F, Rendon P, Macias M, Martin-Herrera L, Giron-Gonzalez JA. Dilutional hyponatremia in patients with cirrhosis and ascites. Arch Intern Med 2002;162:323–328;
Piano S, Fasolato S, Salinas F, Romano A, Tonon M, Morando F, et al. The empirical antibiotic treatment of nosocomial spontaneous bacterial peritonitis: Results of a randomized, controlled clinical trial. Hepatology 2016;63:1299–1309.
S. Piano, A. Brocca, S. Mareso, P. Angeli. Infections complicating cirrhosis. Liver Int, 2018,- 38:PP 126-33
Appenrodt B, Grunhage F, Gentemann MG, Thyssen L, Sauerbruch T, Lammert F. Nucleotide-binding oligomerization domain containing 2 (NOD2) variants are genetic risk factors for death and spontaneous bacterial peritonitis in liver cirrhosis. Hepatology 2010;51: 1327–33
Badillo R, Rockey DC. Hepatic hydrothorax. Clinical features, management, and outcomes in 77 patients and review of the literature. Medicine 2014;93:135–142.;
Garbuzenko DV, Arefyev NO. Hepatic hydrothorax: An update and review of the literature. World J Hepatol 2017:1197–1204
Rodriguez-Roisin R, Krowka MJ, Herve P, Fallon MB. ERS task force pulmonary-hepatic vascular disorders (PHD) scientific committee. Pulmonary-hepatic vascular disorders (PHD). Eur Respir J 2004;24: 861–880
Machicao VI, Balakrishnan M, Fallon MB. Pulmonary complications in chronic liver disease. Hepatology 2014;59:1627–1637.;
Saleemi S. Portopulmonary hypertension. Ann Thorac Med. 2010 Jan-Mar; 5(1): 5–9.
Kaymakoglu S, Kahraman T, Kudat H, Demir K, Cakaloglu Y, Adalet I, et al. Hepatopulmonary syndrome in noncirrhotic portal hypertensive patients. Dig Dis Sci 2003;48:556–560
Mukomolov S. Hepatitis C in the Russian Federation: сhallenges and future directions / S. Mukomolov, G. Trifonova, I. Levakova, D. Bolsun, E. Krivanogova // Hepatic medicine: evidence and research. – 2016. – Vol. 8. – P. 51–60
Bajaj JS, Schubert CM, Heuman DM, Wade JB, Gibson DP, Topaz A, et al. Persistence of cognitive impairment after resolution of overt hepatic encephalopathy. Gastroenterology 2010;138:2332-2340.
Riggio O, Ridola L, Pasquale C, Nardelli S, Pentassuglio I, Moscucci F, et al. Evidence of persistent cognitive impairment after resolution of overt hepatic encephalopathy. Clin Gastroenterol Hepatol 2011;9:181-183.
Zipprich A, Garcia-Tsao G, Rogowski S, Fleig WE, Seufferlein T, Dollinger MM. Prognostic indicators of survival in patients with compensated and decompensated cirrhosis. Liver Int. 2012 Oct;32(9):1407-14.
Romero-Gomez M, Boza F, Garcia-Valdecasas MS, et al. Subclinical hepatic encephalopathy predicts the development of overt hepatic encephalopathy. Am J Gastroenterol 2001;96:2718-2723.
Simonetti RG, Perricone G, Robbins HL, Battula NR, Weickert MO, Sutton R, Khan S. Portosystemic shunts versus endoscopic intervention with or without medical treatment for prevention of rebleeding in people with cirrhosis. Cochrane Database of Systematic Reviews 2020, Issue 10. Art. No.: CD000553.
Sharma P, Sharma BC, Puri V, Sarin SK. Critical flicker frequency: diagnostic tool for minimal hepatic encephalopathy. J Hepatol 2007;47:67-73.;
Bajaj JS. Management options for minimal hepatic encephalopathy. Expert Rev Gastroenterol Hepatol 2008;2:785-90.
Evans LT, Kim WR, Poterucha JJ, Kamath PS. Spontaneous bacterial peritonitis in asymptomatic outpatients with cirrhotic ascites. Hepatology 2003;37:897–901
Rimola A, Garcia-Tsao G, Navasa M, Piddock LJ, Planas R, Bernard B, et al. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. International Ascites Club. J Hepatol 2000;32:142–153.
Arvaniti V, D’Amico G, Fede G, Manousou P, Tsochatzis E, Pleguezuelo M, et al. Infections in patients with cirrhosis increase mortality fourfold and should be used in determining prognosis. Gastroenterology 2010;139:1256.
Шерцингер А.Г. Патогенез, диагностика, профилактика и лечение кровотечений из варикозных вен пищевода и желудка у больных портальной гипертензией: Автореф. дис. …докт. мед. наук. – М. –1986. –310 с.
Жигалова С.Б. Эндоскопические технологии в лечении и профилактике кровотечений из варикозно расширенных вен пищевода и желудка у больных с портальной гипертензией. Автореф. дис. … докт. мед. наук. — М. – 2011. 46 с
Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W. Prevention and management of gastroesophagealvarices and variceal hemorrhage in cirrhosis. Hepatology 2007; 46, 7: 922-938.
Павлов Ч.С., Дамулин И.В., Ивашкин В.Т. Печеночная энцефалопатия: патогенез, клиника, диагностика, терапия. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016;26(1):44-53.
Patidar KR, Bajaj JS. Covert and overt hepatic encephalopathy: diagnosis and management. Clin Gastroenterol Hepatol. 2015 Nov. 13(12):2048-61
Fernandez J, Acevedo J, Castro M, Garcia O, de Lope CR, Roca D, et al.; Prevalence and risk factors of infections by multiresistant bacteria in cirrhosis: a prospective study. Hepatology 2012;55:1551–1561.
Magiorakos AP, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG, et al. Multidrug-resistant, extensively drug-resistant and pandrugresistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect 2012;18:268–281
Gines P., Arroyo V., Rodes J., Schrier R.W. Ascites and renal disfunction in liver disease. Blackwell publishing, 2005
Soriano G, Castellote J, Alvarez C, Girbau A, Gordillo J, Baliellas C, et al. Secondary bacterial peritonitis in cirrhosis: a retrospective study of clinical and analytical characteristics, diagnosis and management. J Hepatol 2010;52:39–44
Chen CH, Shih CM, Chou JW, Liu YH, Hang LW, Hsia TC, et al. Outcome predictors of cirrhotic patients with spontaneous bacterial empyema. Liver Int 2011;31:417–24
Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. NephronClinPract 2012;120:c179–c184.
Moreau R, Lebrec D. Diagnosis and treatment of acute renal failure in patients with cirrhosis. Best Pract Res Clin Gastroenterol 2007;21:111–123.
Moreau R, Lebrec D. Acute renal failure in patients with cirrhosis: perspectives in the age of MELD. Hepatology 2003;37:233–43.
Луньков В.Д., Маевская М.В., Цветаева Е.К., Мендез А.Г., Жаркова М.С., Ткаченко П.Е., Ивашкин В.Т. Отношение нейтрофилов к лимфоцитам как предиктор неблагоприятного исхода у пациентов с декомпенсированным циррозом печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2019;29(1):47-61.
Cordoba J, Garcia-Martinez R, Simon-Talero M. Hyponatremic and hepatic encephalopathies: similarities, differences and coexistence.Metab Brain Dis 2010;25:73–80
Bloom S., Kemp W., Lubel J. Portal hypertension: pathophysiology, diagnosis and management. Intern Med J. 2015 Jan;45(1):16-26
Болезни печени и желчевыводящих путей, под ред. В. Т. Ивашкина- 2-е изд., Москва, ООО «Издательский дом «М-Вести», 2005 – 536 с.
Федосьина Е.А., Маевская М.В., Галимова С.Ф.; под ред. Ивашкина В.Т. Лечение осложнений цирроза печени: методические рекомендации для врачей. Российская гастроэнтеролог. Ассоц., РОПИП. – М.: 4ТЕ Арт, 2009.- 60с
Lin-Lin H, Harry HX, Sen-Lin Z. Ascitic Fluid Analysis in the Differential Diagnosis of Ascites: Focus on Cirrhotic Ascites. J Clin Transl Hepatol, 2014. – Vol.2: 58–64
Moore KP, Wong F, Gines P, Bernardi M, Ochs A, Salerno F, et al. The management of ascites in cirrhosis: report on the consensus conference of the International Ascites Club. Hepatology 2003;38:258–66,
Bruns T, Lutz P, Stallmach A. Nischalke HD Low ascitic fluid protein does not indicate an increased risk for spontaneous bacterial peritonitis in current cohorts. J Hepatol 2015;63:527–528.
Runyon BA, Montano AA, Akriviadis EA, Antillon MR, Irving MA, McHutchison JG. The serum-ascites albumin gradient is superior to the exudate-transudate concept in the differential diagnosis of ascites. Ann Intern Med 1992;117:215–220
Gerbes AL, Jüngst D, Xie YN, Permanetter W, Paumgartner G. Ascitic fluid analysis for the differentiation of malignancy-related and nonmalignant ascites. Proposal of a diagnostic sequence. Cancer 1991;68:1808–14.
McGibbon A, Chen GI, Peltekian KM, van Zanten SV. An evidence-based manual for abdominal paracentesis. Dig Dis Sci. 2007 Dec;52(12):3307-15
Kimer N, Gluud LL, Morris RW, Morgan MY. Rifaximin for the prevention and treatment of hepatic encephalopathy: A systematic review with meta-analyses of randomised controlled trials. J Clin Exp Hepatol 2017; 7: S78-S79 [DOI: 10.1016/j.jceh.2017.01.105]
Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W. Practice Guidelines Committee of the American Association for the Study of Liver DiseasesPractice Parameters Committee of the American College of Gastroenterology. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology 2007;46:922–38.
Merli M, Nicolini G, Angeloni S, Rinaldi V, De Santis A, Merkel C, et al. Incidence and natural history of small esophageal varices in cirrhotic patients. J Hepatol 2003;38:266–272
Kibrit J, Khan R, Jung BH, Koppe S. Clinical Assessment and Management of Portal Hypertension. Semin Intervent Radiol. 2018, Aug; 35(3): 153-59
Люсина Е.О. Клиническое применение эластометрии в оценке жизненного прогноза и риска развития осложнений у больных с циррозом печени вирусной (HCV) и алкогольной этиологии. Автореф. дис. …канд. мед. наук. – М. – 2017. 25с.
Weissenborn K, Ennen JC, Schomerus H, Ruckert N, Hecker H. Neuropsychological characterization of hepatic encephalopathy. J Hepatol 2001;34:768-773.
- Клинические рекомендации Российской гастроэнтерологической ассоциации — Ивашкин В.Т., Маевская М.В., Павлов Ч.С., Федосьина Е.А., Бессонова Е.Н., Пирогова И.Ю., Гарбузенко Д.В. Клинические рекомендации Российского общества по изучению печени и Российской гастроэнтерологической ассоциации по лечению осложнений цирроза печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016;26(4):71-102
Информация
ВВ – варикозные вены
ВВПи Ж – варикозные вены пищевода и желудка
ГПС -гепатопульмональный синдром
ГРС — гепаторенальный синдром
ОПП — острое повреждение почек
ППГ — портопульмональная гипертензия
ПЭ — печеночная энцефалопатия
СААГ — сывороточно-асцитический альбуминовый градиент
СИБР — синдромом избыточного бактериального роста в тонкой кишке
СБП — спонтанный бактериальный перитонит
СКФ —скорость клубочковой фильтрации
ЦП – цирроз печени
ЭГДС – эзофагогастродуоденоскопия
IAC – Международный Клуб по Изучению Асцита
MELD — Model for End-stage Liver Disease
NOD2 — nucleotide-binding oligomerization domain containing 2
SIRS – systemic imflammatory response syndrome (синдром системного воспалительного ответа)
TIPS — transjugular intrahepatic portosystemic shunt (трансюгулярный внутрипеченочный портосистемный шунт)
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Ивашкин Владимир Трофимович – доктор медицинских наук, профессор, академик РАН, лауреат премии Правительства РФ в области науки и техники в 2007 г., в области образования – в 2013 г., Заслуженный врач РФ, Заслуженный деятель науки РФ, Президент Российской гастроэнтерологической ассоциации и Российского общества по изучению печени. Конфликт интересов отсутствует.
Маевская Марина Викторовна — доктор медицинских наук, профессор, лауреат премии Правительства РФ в области науки и техники в 2017 г., вице-президент Российского общества по изучению печени. Конфликт интересов отсутствует.
Жаркова Мария Сергеевна — кандидат медицинских наук, лауреат премии Правительства РФ в области науки и техники в 2017 г., член Российского общества по изучению печени. Конфликт интересов отсутствует.
Жигалова Светлана Борисовна – доктор медицинских наук, лауреат премии Правительства РФ в области науки и техники в 2009 г., лауреат премии г. Москвы в области медицины в 2004г., член Ассоциации гепатопанкреатобилиарных хирургов стран СНГ, Российского общества хирургов, Российского общества эндоскопистов. Конфликт интересов отсутствует.
Киценко Евгений Александрович – доктор медицинских наук, профессор, член Ассоциации гепатопанкреатобилиарных хирургов стран СНГ, Российского общества хирургов. Конфликт интересов отсутствует.
Манукьян Гарик Ваганович – доктор медицинских наук, профессор, член Ассоциации гепатопанкреатобилиарных хирургов стран СНГ, Российского общества хирургов. Конфликт интересов отсутствует.
Тихонов Игорь Николаевич — член Российского общества по изучению печени. Конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Предлагаемые рекомендации имеют своей целью довести до практических врачей современные представления об этиологии и патогенезе ЦП, познакомить с применяющимся в настоящее время алгоритмами оценки тяжести заболевания, прогноза и лечения.
Целевая аудитория данных клинических рекомендации:
1. Врачи-гастроэнтерологи
2. Врачи общей практики (семейные врачи)
3. Врачи-терапевты
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица 2. Уровни достоверности доказательств с указанием использованной классификации уровней достоверности доказательств (УДД)
Таблица 3. Уровни убедительности рекомендаций (УУР) с указанием классификации уровней убедительности рекомендаций
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
-
Приказ Министерства здравоохранения и социального развития Российской Федерации от 02.06.2010 № 415н “Об утверждении Порядка оказания медицинской помощи населению при заболеваниях гастроэнтерологического профиля”
-
Приказ Министерства здравоохранения Российской Федерации от 10 мая 2017 г. N 203н «Об утверждении критериев оценки качества медицинской помощи».
-
Приказ Министерства здравоохранения Российской Федерации от 26 мая 2006 года N 404 “Об утверждении стандарта медицинской помощи больным с алкогольным, первичным, вторичным и неуточненным билиарным, другими неуточненными циррозами печени»
Приложение Б. Алгоритмы действий врача
Рисунок 1. Лечебный алгоритм при ЦП с асцитом.
* максимальное уменьшение массы тела для пациентов без периферических отеков -0.5 кг в день, с периферическими отеками – 1 кг в день (риск почечной недостаточности и гипонатриемии!);
** спиронолактон и петлевые диуретики обладают функциональным антагонизмом – рекомендуется назначать препараты с разницей в 3 ч
Рисунок2. Алгоритм лечения ЦП с острым кровотечением из варикозных вен пищевода и желудка
Рисунок 3. Алгоритм ведения пациентов с ЦП с инфекционными осложнениями
Приложение В. Информация для пациента
Уважаемый пациент! Цирроз печени развивается при формировании соединительной ткани в печени в результате различных хронических заболеваний, включая действие алкоголя, вирусные гепатиты, аутоиммунные заболевания печени, более редкие наследственные заболевания печени. По мере прогрессирования заболевания печень с трудом выполняет основные свои функции, что приводит к развитию таких осложнений как желтуха, асцит (накопление жидкости в брюшной полости) и отеки, печеночная энцефалопатия (нарушение ориентации, заторможенность, сонливость). При наличии расширенных вен пищевода и желудка может развиться кровотечение, которое проявляется резкой слабостью, тошнотой, рвотой желудочным содержимым по типу «кофейной гущи». В случае своевременной диагностики цирроза печени и лечения основного фактора, который привел к циррозу, можно избежать этих жизнеугрожающих осложнений, а в некоторых случаях даже обратить процесс вспять. Вам необходимо находиться под постоянным контролем врача, который определит перечень необходимых исследований и их периодичность, назначит необходимую терапию.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Классификация степени тяжести ЦП по Чайлд-Тюркотт-Пью (Child-Turcotte-Pugh) [194]
Название на русском языке: Классификация степени тяжести цирроза печени по Чайлд-Тюркотт-Пью (Child-Turcotte-Pugh)
Источник: Durand F., Valla D. Assessment of the prognosis of cirrhosis: Child–Pugh versus MELD //Journal of hepatology. – 2005. – Т. 42. – №. 1. – С. S100-S107.
Назначение: При выборе лечебной тактики у больных с ЦП необходимо оценить функциональное состояние печени. Шкала применяется для оценки тяжести состояния больных ЦП.
Содержание (шаблон):
Ключ (интерпретация): 5 – 6 баллов: класс А (хорошо компенсированная функция печения); выживаемость в течение года – 100% 7 – 9 баллов: класс В (выраженные нарушения функции печени); выживаемость в течение года – 80% 10 – 15 баллов: класс С (декомпенсация заболевания и функции печени); выживаемость в течение года – 45%.
При сумме баллов менее 5 средняя продолжительность жизни пациентов составляет 6,4 года, а при сумме 12 и более — 2 месяца.
Приложение Г2. Индекс 1. Индекс MELD (Model for End-Stage Liver Disease)
Название на русском языке: Модель для оценки терминальной стадии заболеваний печени
Источник: Durand F., Valla D. Assessment of the prognosis of cirrhosis: Child–Pugh versus MELD //Journal of hepatology. – 2005. – Т. 42. – №. 1. – С. S100-S107.
Тип: индекс Назначение: данная числовая шкала принята для определения очередности трансплантации печени в листе ожидания (в связи с ограниченным количеством донорских органов).
Содержание: MELD = 9,57Ln (уровень креатинина) + 3,78Ln (уровень общего билирубина) + 11,2(МНО) +6,43. MELD калькулятор (источник — https://www.mayoclinic.org/medical-professionals/transplant-medicine/calculators/meld-model/itt-20434705), где Ln – натуральный логарифм, МНО- международное нормализованное отношение
Применяются следующие правила расчета: минимальное значение для любой из трех переменных – 1 мг/дл, максимальный возможный уровень креатинина – 4 мг/дл, максимальное значение для индекса MELD – 40. Неблагоприятый жизненный прогноз ассоциирован со значением МELD > 18.
Ключ (интерпретация): Чем выше значение индекса, тем тяжелее протекает заболевание печени. При использовании классификации MELD было выявлено, что она обладает большой достоверностью при прогнозировании летального исхода в течение трех месяцев у пациентов с декомпенсированным ЦП. Так, при MELD >35 баллов летальный исход прогнозируется в 80% случаев, при MELD от 20 до 34 баллов — в 10-60%, при MELD < 8 баллов — пациент является амбулаторным и требует активного наблюдения. Также используется для оценки тяжести алкогольного гепатита (>21 балла — тяжелый).
Приложение Г3. Шкала комы Глазго [195]
Название на русском языке: Шкала комы Глазго
Источник: Sternbach G. L. The Glasgow coma scale //The Journal of emergency medicine. – 2000. – Т. 19. – №. 1. – С. 67-71.
Назначение: для оценки состояния пациентов с тяжелыми нарушениями сознания, шкала позволяет получить картину неврологических нарушений.
Содержание (шаблон): Шкала состоит из трёх тестов, оценивающих реакцию открывания глаз, речевые и двигательные реакции.
Ключ (интерпретация): Сумма баллов определяет сознание пациента от ясного (15 баллов) до атонической комы (3 балла).
Приложение Г4. Тест связи чисел [80]
Название на русском языке: тест связи чисел
Источник: Моисеева Е. О. Современные клинические и инструментальные методы диагностики печеночной энцефалопатии //Вестник Смоленской государственной медицинской академии. – 2010. – №. 1.
Назначение: для определения стадии ПЭ у пациентов с ЦП, в том числе латентной ПЭ, которая клинически не проявляется и характеризуется снижением быстроты познавательной деятельности и точности тонкой моторики; для оценки динамики психометрических тестов в процессе лечения.
Содержание:
Ключ (интерпретация):
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Оглавление:
- Что такое цирроз печени?
- Причины, вызывающие цирроз печени
- Проявления, характерные для цирроза печени
- Осложнения цирроза печени
- Инфекционные осложнения цирроза печени
- Цироз печени. Прогноз
- Профилактика
- Лечение
- Что можете сделать Вы?
Что такое цирроз печени?
Цирроз печени – многофакторное прогрессирующее заболевание печени, характеризующееся значительным уменьшением количества функционирующих гепатоцитов – клеток печени, нарастающим фиброзом (замещением соединительной тканью), перестройкой нормальной структуры печени и развитием в последующем печёночной недостаточности и портальной гипертензии. Вследствие гибели печеночных клеток под действием различных повреждающих факторов нормальная ткань печени замещается фиброзной с формированием узлов и перестройкой всей структуры печени. Нарушение структуры печени приводит к нарушению всех ее функций.
В экономически развитых странах цирроз входит в число шести основных причин смерти пациентов от 35 до 60 лет, составляя 14-30 случаев на 100 тыс. населения. От цирроза печени ежегодно в мире умирает около 300 тысяч человек, причём за последние 10 лет частота увеличилась на 12%. Бессимптомное течение цирроза имеет место у 12% больных, страдающих хроническим алкоголизмом.
Чаще наблюдается у мужчин: соотношение мужчин и женщин составляет в среднем 3:1. Заболевание может развиться во всех возрастных группах, но чаще после 40 лет.
Причины, вызывающие цирроз печени
- Вирусный гепатит (В, С, дельта, G). Наиболее циррозогенны вирусы С и дельта, причём вирус гепатита С называют «ласковым убийцей», т. к. он приводит к циррозу печени в 97% случаев, при этом длительно заболевание не имеет никаких клинических проявлений;
- Аутоиммунный гепатит (когда организм воспринимает свои собственные клетки как чужеродные);
- Злоупотребление алкоголем, заболевание развивается через 10-15 лет от начала употребления (60 грамм/сутки для мужчин, 20 г/сутки для женщин);
- Метаболические нарушения (гемохроматоз, болезнь Вильсона – Коновалова, недостаточность альфа-1-антитрипсина и др.);
- Химические токсические вещества и медикаменты;
- Гепатотоксические лекарственные препараты;
- Болезни желчевыводящих путей — обструкция (закупорка) внепечёночных и внутрипечёночных желчных путей. Цирроз печени развивается через 3-18 месяцев после нарушения проходимости желчного протока;
- Длительный венозный застой печени (констриктивный перикардит, венооклюзионная болезнь, сердечная недостаточность).
К сожалению, нередко причину, вызвавшую цирроз, выявить невозможно, в таком случае его называют криптогенным циррозом (т.е. с неизвестной причиной).
Проявления, характерные для цирроза печени
Признаки цирроза не зависят от того, какая причина его вызвала, но определяются стадией заболевания.
На начальной стадии цирроза (по международной классификации это класс А) еще нет осложнений заболевания.
Именно в это время очень важно устранить причину заболевания, что позволит сохранить оставшуюся здоровую ткань печени и вести нормальный образ жизни. Дело в том, что печень обладает очень большими возможностями регенерации (восстановления), а здоровые клетки могут работать за себя и своих пострадавших товарищей.
Увеличение в объеме живота, появление изменений со стороны сознания и поведения, кровоточивость десен, носовые кровотечения говорят об осложнениях заболевания (по международной классификации это классы В и С).
Жалобы, предъявляемые больными циррозом печени: повышенная утомляемость, похудание, различные нарушения сознания и поведения (снижение концентрации внимания, сонливость днем, нарушение ночного сна и т.д.), снижение аппетита и дискомфорт в животе (вздутие, ощущение быстрого насыщения во время еды), желтуха (окрашивание кожи, склер в желтый цвет), посветление или обесцвечивание кала, потемнение мочи, боли в животе, отечность голеней и (или) увеличение размеров живота за счет свободной жидкости в брюшной полости (асцит), кровотечения: носовые, желудочно-кишечные, из десен, геморроидальные, а также подкожные кровоизлияния, частые бактериальные инфекции (дыхательных путей и др.), снижение полового влечения, у мужчин — нередко гинекомастия (увеличение молочных желез).
Наряду с увеличением или уменьшением размеров печени характерно ее уплотнение, сопутствующая спленомегалия (увеличение селезенки), симптомы портальной гипертензии, желтухи. Нередка тупая или ноющая боль в области печени, усиливающаяся после погрешностей в диете и физической работы; диспепсические явления (тошнота, рвота, понос), кожный зуд, обусловленный задержкой выделения и накоплением в тканях желчных кислот.
При осмотре больного выявляются характерные для цирроза «печеночные знаки»: сосудистые телеангиэктазии («звездочки», «паучки») на коже верхней половины туловища, эритема ладоней – покраснение ладоней («печеночные ладони»), «лаковый язык» малинового цвета, «печеночный язык».
Осложнения цирроза печени
Печеночная энцефалопатия.
Печеночная энцефалопатия — обратимое повреждение головного мозга токсическими продуктами, которые не обезвреживаются печенью в результате ее повреждения.
Для печеночной энцефалопатии характерны различные нарушения сознания, интеллекта, поведения, нервно-мышечные расстройства.
Печеночная энцефалопатия бывает скрытой (незаметной для пациента и окружающих), и тогда ее может выявить лишь врач при проведении специальных тестов.
Крайняя степень печеночной энцефалопатии — кома (бессознательное состояние), в ее основе лежит острая или хроническая печеночная недостаточность.
Кровотечение из желудочно-кишечного тракта вследствие портальной гипертензии.
При циррозе печени нарушается прохождение крови, идущей с нижней половины туловища, через печень, поэтому кровь находит «обходные» пути – через сосуды передней брюшной стенки, вены пищевода, геморроидальные вены (вены прямой кишки). При прогрессировании цирроза печени в определенный момент наступает декомпенсация и начинаются кровотечения из расширенных вен. Каждый больной циррозом печени должен знать, что желудочно-кишечное кровотечение проявляется рвотой, которая выглядит как «кофейная гуща» и стулом, который выглядит как «малиновое желе»; появляется или резко усиливается слабость вплоть до потери сознания. Возможно кровотечение из геморроидальных вен прямой кишки.
Также характерным симптомом является «голова медузы» — перенаполнение вен передней брюшной стенки.
Инфекционные осложнения цирроза печени
Больные циррозом печени более подвержены бактериальным и вирусным инфекциям, чем здоровые люди. Чаще всего у таких пациентов встречаются инфекции дыхательных путей и мочевой системы. Иногда бывает так, что температура тела может подняться без определенной причины. Это связано с повышенной всасываемостью их кишечника «вредных» (токсических) микроорганизмов. Такое состояние называется эндотоксемией.
Цироз печени. Прогноз
Сформировавшийся цирроз печени является необратимым состоянием, но лечение причины, вызвавшей цирроз, правильный образ жизни, успешное воздействие на активность процесса могут способствовать тому, что цирроз печени долгое время остается компенсированным.
Профилактика
Устранение или ограничение действия причины, приводящей к циррозу печени (снижение употребления алкоголя, вакцинация от гепатита В), своевременное распознавание и лечение хронического гепатита и жировой дистрофии печени.
Лечение
Что может сделать Ваш врач?
Цирроз печени — не смертельное заболевание, его нужно и можно эффективно лечить.
Наблюдение и лечение больных циррозом печени должно проводиться только в специализированных лечебных учреждениях.
По возможности устраняют причину заболевания, например при алкогольном циррозе печени исключают алкоголь, при вирусном циррозе назначают противовирусное лечение.
Выбор оптимальной схемы лечения для конкретного пациента может сделать только врач.
При неэффективности консервативного (медикаментозного) лечения больные включаются в лист ожидания для пересадки печени.
Что можете сделать Вы?
Успех в лечении больного циррозом печени может быть достигнут только в случае строгого выполнения советов врача.
Цирроз печени
- О заболевании
- Классификация
- Причины цирроза печени
- Симптомы заболевания
- Диагностика
- Лечение цирроза печени
- Профилактика
- Реабилитация
- Вопросы и ответы
- Мнение эксперта
- Врачи
Цирроз печени (ЦП) – хроническое заболевание, характеризующееся образованием патологических узлов, заменой здоровых клеток и тканей фиброзными структурами, из-за чего орган постепенно видоизменяется и не может выполнять свои функции. По мере развития болезни нарастает печеночная недостаточность, что в итоге может привести к летальному исходу.
О заболевании
ЦП даже в развитых странах входит в шестерку самых опасных летальных заболеваний: до 12% мужчин и женщин после 40 лет попадают в больницы с признаками цирроза печени, при этом примерно в 10% от общего числа диагностированных случаев клинические симптомы у пациентов отсутствуют.
Классификация
Специалисты в классификации выделяют несколько стадий развития цирроза печени, каждая из которых сопровождается своими характерными симптомами.
-
На первом этапе благодаря высоким регенерирующим свойства органа отмирающие клетки быстро восполняются новыми, поэтому какие-либо клинические признаки отсутствуют, а в лабораторных анализах нарушения не выявляются.
-
Вторая степень цирроза печени характеризуется более серьезными изменениями тканей, формированием первых узлов, что сопровождается более явными симптомами: пациент начинает терять в весе, чувствует себя утомленным даже после длительного отдыха.
-
На третьем этапе наблюдается выраженный фиброз, отмирающие клетки не восполняются новыми, здоровые ткани замещаются соединительными структурами, появляются участки рубцеваний. Внешне это отражается в значительном ухудшении самочувствия, снижении аппетита, дистрофии, дискомфортом и болями в правом подреберье, а также другими малоприятными симптомами.
-
Четвертая, терминальная, стадия цирроза характеризуется уменьшением печени, возникновением стойкой желтухи, расстройствами стула, отеками, внутрижелудочными кровотечениями.
Также врачи-гепатологи выделяют следующие виды цирроза печени:
-
биллиарный;
-
токсический (он же токсико-аллергический);
-
инфекционный;
-
циркуляторный (застойный);
-
обменно-алиментарный.
В основе формирования каждого из этих видов ЦП лежат конкретные причины (инфекции, алкогольные интоксикации, токсические поражения и т.д.), а в случае, когда этиологию установить не удалось, специалисты говорят о криптогенном циррозе.
Причины цирроза печени
Наиболее распространенным фактором, предрасполагающим к развитию заболевания, остается злоупотребление алкогольной продукцией, особенно у мужского населения. Тем не менее, цирроз печени у женщин, сопряженный с алкогольным поражением органа, протекает тяжелее и быстрее, чем аналогичный вид патологии у мужчин. Также патологии более подвержены люди, страдающие другими системными заболеваниями, эндокринными нарушениями, и пациенты, вынужденные длительное время принимать сильные системные лекарственные препараты.
Другими возможными причинами цирроза печени могут стать:
-
паразитарные и глистные инвазии;
-
застой крови в сосудах, питающих печень и близлежащие структуры;
-
портальная гипертензия – повышение кровяного давления в воротной вене из-за закупорки или повреждения кровеносных магистралей;
-
тяжелая форма сердечной недостаточности;
-
аутоиммунные нарушения;
-
инфекционные заболевания (сифилис, бруцеллез и т.д.);
-
вирусные гепатиты;
-
ожирение, особенно при недостаточной двигательной активности;
-
врожденное нарушение обмена веществ;
-
заболевания протоков, отводящих желчь;
-
травмы органа;
-
острые отравления организма, например, ядовитыми грибами или ягодами, химическими веществами, в том числе и при вдыхании опасных веществ.
Специалисты уверены, что немаловажную роль в развитии цирроза печени играет наследственный фактор: случаи выявления болезни у людей, чьи близкие родственники страдали от ЦП, намного выше, чем у пациентов, не имеющих генетической предрасположенности.
Симптомы заболевания
Основными общими признаками цирроза печени являются:
-
дискомфорт в животе;
-
потеря массы тела;
- снижение работоспособности;
-
ускоренное утомление;
-
расстройства стула, диспепсия;
-
снижение аппетита;
-
болезненность в суставах;
-
повышение температуры до субфебрильных значений;
-
почти постоянное ощущение слабости, усталости;
-
тошнота;
-
боль и дискомфорт в правом подреберье;
-
сосудистые звездочки на теле;
-
участки покраснения на ладонях и стопах;
У мужчин на фоне ЦП нередко наблюдается гинекомастия – патологическое увеличение молочных желез.
Во многом симптомы зависят от стадии патологии: по мере развития цирроза печени дискомфорт, боли усиливаются, появляются дополнительные сигналы в виде:
-
пожелтения кожных покровов;
-
кожного зуда;
-
увеличения объема живота;
-
отечности нижних конечностей;
-
одутловатости лица и шеи;
-
выпадения волос на лобке и в подмышечных впадинах.
На поздних стадиях развития ЦП у пациента на ногтях появляются белесые пятна, может развиться асцит – состояние, при котором в брюшной полости скапливается жидкость, а также развиться внутрижелудочное кровотечение из варикозно-расширенных вен органов ЖКТ. На последних этапах заболевания печень значительно уменьшается в размерах и перестает выполнять свои функции, из-за чего больной может оказаться в коме на грани жизни и смерти.
Получить консультацию
Если у Вас наблюдаются подобные симптомы, советуем записаться на прием к врачу. Своевременная консультация предупредит негативные последствия для вашего здоровья.
Узнать подробности о заболевании, цены на лечение и записаться на консультацию к специалисту Вы можете по телефону:

Почему «СМ-Клиника»?
1
Лечение проводится в соответствии с клиническими рекомендациями
2
Комплексная оценка характера заболевания и прогноза лечения
3
Современное диагностическое оборудование и собственная лаборатория
4
Высокий уровень сервиса и взвешенная ценовая политика
Диагностика
Первым этапом становится тщательный сбор анамнеза: врачу необходимо знать максимально подробно об образе жизни пациента, перенесенных и имеющихся хронических заболеваниях, семейной истории болезней, принимаемых препаратах и т.д.
В рамках первичной диагностики также проводится ручная пальпация, в ходе которой специалист может нащупать края увеличенной печени, выполняется оценка видимых клинических признаков и жалоб пациента.
Далее в зависимости от состояния больного назначается комплекс обследований, в число которых могут входить:
-
стандартные биохимические анализы крови на уровень билирубина, белка, ферритина, сывороточного железа и т.д., а также на скрытые инфекции;
-
общеклинические анализы крови, позволяющие выявить анемию, определить количество лейкоцитов и тромбоцитов;
-
тестирования на вирусные гепатиты;
-
общий анализ мочи;
-
ультразвуковое исследование печени и органов брюшной полости;
-
электрокардиография;
-
эндоскопическое исследование желудочно-кишечного тракта;
-
эластография печени;
-
тест на наличие когнитивных нарушений;
-
КТ или МРТ в зависимости от показаний и возможных ограничений;
-
биопсия печени.
При наличии у пациента врожденных или хронических патологий список необходимых диагностических процедур может быть расширен, а к консультациям могут быть привлечены специалисты других направлений (эндокринологи, кардиологи, инфекционисты и др.).
Мнение эксперта
Ежегодно от цирроза печени умирают люди, и главная ошибка пациентов и их родственников – промедление, надежда, что неприятные симптомы пройдут сами и лечения не потребуется. Очень важно при первых признаках возможного поражения печени, желудка и других жизненно важных органов сразу обращаться за помощью медиков.
При таком поражении печени изменения необратимы, болезнь по праву считается очень тяжелой и неизлечимой, однако при своевременной и грамотной медицинской помощи можно значительно купировать симптомы патологии, улучшить качество жизни и продлить ее на долгие годы. Более того, современные возможности медицины позволяют провести трансплантацию органа, что многократно повышает шансы на долгую и счастливую жизнь.
Лечение цирроза печени
Тактика терапии основывается на возрасте и особенностях здоровья пациента, стадии ЦП, выраженности клинической картины и других индивидуальных параметрах конкретного человека. В целом лечение цирроза печени предусматривает:
-
устранение первопричины болезни (инфекции, токсического поражения, аллергена и т.д.);
-
купирование симптоматики;
-
замедление патологических и дегенеративных процессов;
-
предупреждение осложнений;
-
коррекцию образа жизни.
Терапия должна быть всеобъемлющей и комплексной. В качестве медикаментозной помощи в зависимости от степени и причины поражения органа используются:
-
сорбенты;
-
витамины;
-
интерфероны;
-
противовоспалительные препараты;
-
гормональные средства;
-
гепатопротекторы;
-
иммуносупрессивные препараты;
-
мочегонные средства.
Тактику лекарственной поддержки, объем и тип необходимых препаратов подбирает только лечащий врач. В отношении ЦП не может идти речь о каком-либо самолечении или применении средств народной медицины.
Большую роль в лечении цирроза печени на любых стадиях играет диета: правильное, сбалансированное питание и отказ от потенциально вредных ингредиентов помогают сдержать развитие болезни и улучшить общее самочувствие пациента. В рамках диета крайне желательно:
-
отказаться от любого вида алкоголя и тонизирующих энергетических напитков;
-
максимально снизить потребление соли и приправ;
-
исключить из рациона жирную, богатую белком пищу и продукты, тяжелые для печени (грибы, жирные соусы);
-
контролировать ежедневное количество воды и других напитков, не допуская чрезмерного потребления жидкостей.
В случае, если состояние настолько запущено, что медикаменты в сочетании с симптоматической помощью и диетой не оказывают какого-либо нужного эффекта, пациенту требуется хирургическое лечение в специализированных стационарах, где есть возможность пересадки органа.
Профилактика
Для снижения риска развития ЦП специалисты настоятельно рекомендуют:
-
нормировать употребление алкоголя, а еще лучше – полностью отказаться от горячительных напитков любой крепости;
-
не увлекаться приемом лекарственных средств без надобности или прямого указания лечащего врача (особенно это положение касается высоких доз обезболивающих препаратов, гормонов, антибиотиков);
-
своевременно лечить инфекционные заболевания;
-
прививаться от гепатита и проводить плановую ревакцинацию согласно национальному графику прививок;
-
следить за питанием, придерживаясь здорового рациона;
-
предупреждать гиподинамию;
-
контролировать массу тела, не допуская ожирения;
-
с осторожностью относиться к потенциально опасным продуктам питания и не есть незнакомые ингредиенты;
-
работая с вредными веществами, предпринимать все необходимые меры по обеспечению личной безопасности.
Также желательно регулярно проходить профилактические осмотры, сдавать рекомендуемые анализы и следить за здоровьем в целом.
Реабилитация
Прогноз зависит от причины развития цирроза печени, стадии заболевания, общего состояния здоровья пациента и ряда других индивидуальных факторов. При своевременном выявлении шанс на предупреждение стремительного прогрессирования ЦП велик, однако полностью остановить болезнь в любом случае не удастся. После пересадки процент выживаемости близится к 80%.
Узнать больше о причинах, проявлениях и лечении цирроза печени можно на личной консультации у специалистов центра «СМ-Клиника». Современное оборудование, научно обоснованные методы диагностики помогают нам проводить все необходимые обследования в кратчайшие сроки. Прием ведут опытные врачи-гепатологи. Записаться на консультацию можно по телефону, онлайн и лично, обратившись в регистратуру центра.
Вопросы и ответы
Диагностика, дифференциальная диагностика и лечение болезней органов пищеварения. / А.С. Белоусов, В.Д. Водолагин, В.П. Жаков. — М.: Медицина, 2002.
Клинические рекомендации «Цирроз и фиброз печени». Разраб.: Российское общество по изучению печени, Российская Гастроэнтерологическая Ассоциация. – 2021.
>
Заболевания по направлению Гастроэнтеролог
Заболевания по направлению Гепатолог
Цирроз печени
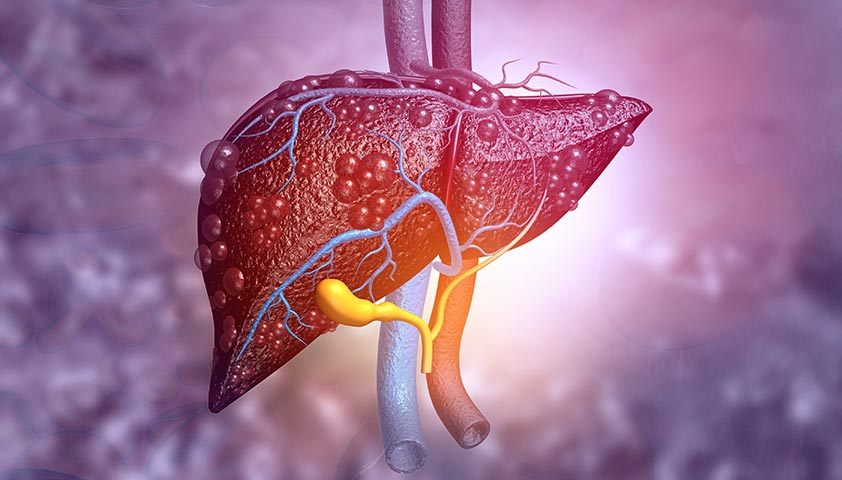
Изменение структуры печёночной ткани, конечная стадия многих серьёзных заболеваний печени. При циррозе здоровая ткань заменяется нефункциональной и орган не может работать как следует.
СОДЕРЖАНИЕ
Признаки и симптомы цирроза печени
Стадии развития и осложнения цирроза
Диагностика цирроза печени
Что такое цирроз печени
Цирроз печени — это состояние, при котором изменяется нормальная структура органа: здоровая ткань замещается нефункциональной рубцовой. Кроме этого, в печени образуются узлы.
В Международной статистической классификации болезней и проблем, связанных со здоровьем, десятого пересмотра (МКБ-10) выделяют следующие разновидности цирроза печени:
- K70.3 — алкогольный цирроз печени;
- K71.7 — токсическое поражение печени с фиброзом и циррозом;
- K74 — фиброз и цирроз печени: K74.0 — фиброз печени, K74.1 — склероз печени, K74.2 — фиброз печени в сочетании со склерозом печени, K74.3 — первичный билиарный цирроз, K74.4 — вторичный билиарный цирроз, K74.5 — билиарный цирроз неуточнённый, K74.6 — другой и неуточнённый цирроз печени;
- К76.6 — портальная гипертензия;
- осложнения цирроза печени: К72 — печёночная недостаточность, не классифицированная в других рубриках (в том числе печёночная энцефалопатия / кома), К76.7 — гепаторенальный синдром.
Причины цирроза печени
Заразиться циррозом нельзя, но если человек заболел вирусным гепатитом В, С или D, то цирроз может развиться как осложнение вирусной инфекции.
Цирроз возникает, если печень долгое время подвергалась воздействию разрушающих факторов. Это может быть, например, систематическое злоупотребление алкоголем.
Другие причины развития цирроза печени:
- нарушения обмена веществ (например, неалкогольный стеатогепатит, наследственный гемохроматоз, болезнь Вильсона — Коновалова и другие);
- заболевания жёлчных путей (например, внепечёночная обструкция жёлчных путей);
- нарушение венозного оттока из печени;
- лекарства и химикаты, токсичные для печени;
- иммунные нарушения (например, аутоиммунный гепатит);
- иные причины (сифилис, шистосомоз, саркоидоз, гипервитаминоз А).
В некоторых случаях может развиться криптогенный цирроз печени, то есть цирроз, причину которого выяснить невозможно.
Признаки и симптомы цирроза печени
Цирроз долгое время может не проявляться. У трети пациентов симптомы отсутствуют до тех пор, пока болезнь не вызовет таких нарушений в организме, которые уже невозможно скомпенсировать за счёт усиленной работы других органов и систем.
В начале заболевания симптомы, как правило, неспецифичны и похожи на признаки других патологий.
Основные ранние симптомы цирроза:
- утомляемость,
- слабость.
Затем могут появиться более выраженные признаки болезни.
Симптомы поражения печени, одинаковые для мужчин и женщин:
- потеря мышечной массы;
- пальмарная эритема («печёночные ладони») — равномерное интенсивное покраснение обеих ладоней;
- желтуха — пожелтение кожи и белков глаз;
- увеличение околоушных желёз;
- контрактура Дюпюитрена — укорочение сухожилий ладоней, из-за чего пальцы деформируются и утрачивают способность полностью разгибаться;
- сосудистые звёздочки;
- «голова медузы» — перенаполнение вен передней брюшной стенки;
- выпадение волос на голове, лице, в подмышечных впадинах и на лобке;
- периферическая нейропатия — поражение периферических нервов (за пределами головного и спинного мозга).
Специфические симптомы у мужчин;
- гинекомастия — увеличение груди;
- тестикулярная атрофия — уменьшение яичек с одновременным снижением выработки семенной жидкости и тестостерона.
Специфический симптом у женщин — нарушение цикла, в том числе полное отсутствие менструаций.
В то же время стоит помнить, что перечисленные симптомы встречаются не только при циррозе, но и при других заболеваниях печени.
Если у пациента развились осложнения цирроза, они могут сопровождаться некоторыми симптомами.
Симптомы при осложнениях цирроза:
- увеличение размеров живота при асците;
- дискомфорт в животе, лихорадка при спонтанном бактериальном перитоните;
- боль или отёк голеней при тромбоэмболии;
- ногти в виде часовых стёкол при гепатопульмональном синдроме;
- спутанность сознания, летаргия при печёночной энцефалопатии;
- выраженная одышка, диспепсия, лихорадка при гепатопульмональном синдроме, портопульмональной гипертензии;
- затруднённое мочеиспускание или полное отсутствие мочи при гепаторенальном синдроме;
- желудочно-кишечные кровотечения при варикозе вен пищевода и прямой кишки.
Признаки цирроза печени: «голова медузы» — перенаполнение вен передней брюшной стенки, асцит — скопление жидкости в брюшной полости
Особенности цирроза печени у детей
Цирроз печени у детей встречается очень редко.
Причинами, провоцирующими развитие цирроза у детей, обычно выступают другие серьёзные болезни.
Болезни, провоцирующие развитие цирроза печени у детей:
- вирусные гепатиты,
- аутоиммунное поражение печени,
- лёгочная гипертензия,
- хроническая сердечная недостаточность,
- синдром Бадда — Киари,
- наследственный гемохроматоз — нарушение обмена железа,
- болезнь Вильсона — Коновалова.
Поскольку цирроз печени у детей чаще всего сопутствует основному тяжёлому заболеванию, прогноз обычно неблагоприятный. Единственное, что может помочь в таком случае, — это пересадка печени.
Течение болезни
Цирроз развивается в ответ на повреждение паренхимы — основной ткани органа, которая позволяет печени выполнять её функции.
Пытаясь восстановиться, печень затягивает место повреждения нефункциональной, то есть не участвующей в работе органа, рубцовой тканью — так возникает фиброз. Чтобы компенсировать частичную утрату функциональности, здоровая ткань печени разрастается и образует узлы. Со временем структура органа меняется на фиброзно-узловую и возникает цирроз.
Слева — здоровая печень, справа — покрытая рубцами
Конечно, такие серьёзные повреждения развиваются медленно. Поэтому врачи называют цирроз конечной стадией других хронических заболеваний органа.
Виды цирроза печени
Существует несколько классификаций цирроза печени по разным признакам.
Формы цирроза печени по происхождению:
- билиарный — аутоиммунное поражение печени, при котором здоровая ткань органа заменяется рубцовой;
- алкогольный;
- токсический (из-за воздействия лекарств, добавок, ядов и других веществ);
- вирусный (следствие вирусных гепатитов В, С или D);
- генетический (связан с нарушениями обмена веществ из-за тяжёлых наследственных заболеваний);
- кардиальный (развивается как последствие лёгочной гипертензии и хронической сердечной недостаточности);
- криптогенный (с неизвестной причиной).
Формы цирроза печени по структуре органа:
- макронодулярный (крупноузловой): крупные узлы диаметром до 5 см расположены неравномерно и разделены полосами соединительной ткани различной ширины;
- микронодулярный (мелкоузловой): мелкие узлы диаметром около 1–3 мм расположены в определённой последовательности и разделены сетью рубцовой ткани;
- микро- и макронодулярный (смешанный);
- неполный септальный: полноценных узлов нет, однако ткань печени пересекают септы (перегородки), некоторые из них неполные.
В трансплантологии, чтобы оценить тяжесть состояния пациентов с циррозом печени и оценить перспективы пересадки органа, врачи используют ещё несколько специализированных классификаций:
- классификация по Чайлду — Тюркотту — Пью (Child — Turcotte — Pugh);
- шкала MELD (Model for End-stage Liver Disease) и её модификация MELDNa.
Они представляют собой опросники, где характеристики состояния пациента можно оценить в баллах.
Так, по шкале Чайлда — Тюркотта — Пью болезнь можно разделить на три класса: класс А (компенсированный) — 5–6 баллов, класс В (субкомпенсированный) — 7–9 баллов и класс С (декомпенсированный) — 10 баллов и более.
Итоговая оценка в баллах помогает врачу спрогнозировать течение болезни и исход операции по пересадке печени.
Стадии развития и осложнения цирроза
Чтобы снабжать кровью образовавшиеся при циррозе узлы, появляется обширная сеть новых сосудов. За счёт этого в печень поступает больший, чем обычно, объём крови. В результате возрастает давление в воротной вене — крупном сосуде, который собирает кровь от желудка, селезёнки, кишечника и поджелудочной железы в печень. Так развивается портальная гипертензия — одно из наиболее частых и серьёзных осложнений при циррозе. Она, в свою очередь, может спровоцировать другие опасные состояния.
Последствия портальной гипертензии при циррозе:
- желудочно-кишечное кровотечение;
- асцит — скопление жидкости в брюшной полости;
- острое повреждение почек (гепаторенальный, или печёночно-почечный, синдром);
- лёгочная гипертензия — повышение давления в лёгочной артерии;
- гепатопульмональный синдром — недостаточное насыщение крови кислородом;
- сердечная недостаточность.
Также осложнениями цирроза печени могут стать печёночная энцефалопатия (обратимый синдром, сопровождающийся перепадами настроения, спутанностью сознания, сонливостью, дезориентацией и в тяжёлых случаях комой) и нарушения свёртываемости крови.
Если у пациента с циррозом печени развился асцит, осложнить его может заражение асцитической жидкости бактериями и развитие спонтанного бактериального перитонита (воспаления брюшины).
Также при циррозе печени осложнением может стать гепатоцеллюлярная карцинома — злокачественная опухоль.
Прогноз
Спрогнозировать, как будет протекать цирроз печени, зачастую очень трудно.
Факторы, влияющие на исход болезни:
- причины развития цирроза,
- тяжесть течения болезни,
- наличие осложнений,
- общее состояние здоровья пациента,
- эффективность терапии.
Если пациенты с циррозом печени продолжают употреблять алкоголь, то прогноз становится неблагоприятным.
Диагностика цирроза печени
Диагностикой и лечением цирроза печени занимаются гастроэнтерологи и гепатологи.
Чтобы диагностировать болезнь, врач осматривает пациента, назначает лабораторные и инструментальные исследования.
Физический осмотр
При циррозе печени часто мышцы становятся слабыми, кожа — сухой, появляются отёки, сосудистые звёздочки, желтеет кожа и белки глаз, краснеют ладони, у мужчин — увеличивается грудь, при асците значительно возрастает объём живота. По этим признакам врач может заподозрить болезнь печени.
Также на приёме врач собирает анамнез, проверяет неврологические реакции пациента, пальпирует живот, чтобы оценить состояние органов брюшной полости.
Лабораторные исследования
Чтобы оценить состояние пациента, назначают общий (клинический) анализ крови.
3.9.1. Вен. кровь (+220 ₽) 
Вен. кровь (+220 ₽) 1 день

Для проверки функций печени и почек рекомендуется биохимический анализ.
28.339. Вен. кровь (+220 ₽) 
Вен. кровь (+220 ₽) 1 день

Чтобы оценить свёртываемость крови и функции печени, показана проведение коагулограммы.
28.256. Вен. кровь (+220 ₽) 
Вен. кровь (+220 ₽) 1 день

Чтобы исключить инфекцию мочевыводящих путей, пациентам с циррозом печени рекомендуется сдать общий анализ мочи.
Если причина, по которой возник цирроз печени, не установлена, целесообразно сдать анализы на маркеры вирусных гепатитов.
20.21. Вен. кровь (+220 ₽) 
Вен. кровь (+220 ₽) 1 день

20.22. Вен. кровь (+220 ₽) 
Вен. кровь (+220 ₽) 1 день

20.38. Вен. кровь (+220 ₽) 
Вен. кровь (+220 ₽) 8 дней

Инструментальные исследования
Чтобы определить размер и ультразвуковые характеристики печени, а также диагностировать портальную гипертензию, используют ультразвуковое исследование органов брюшной полости.
Для оценки размера вен пищевода, желудка и риска желудочно-кишечных кровотечений рекомендуется провести эзофагогастродуоденоскопии (ЭГДС).
Если есть подозрение на тромбоз в венах портальной системы или предполагаются очаговые изменения печени, показано проведение компьютерной томографии брюшной полости с внутривенным контрастированием.
Лечение цирроза печени
Терапия при циррозе направлена на лечение основного заболевания, поддержку организма и устранение осложнений. Например, при алкогольном циррозе необходимо полностью исключить употребление алкоголя, а при циррозе, вызванном вирусными гепатитами, применять назначенные врачом противовирусные препараты.
Чтобы улучшить состояние пациента с циррозом, отменяют приём лекарств, токсичных для печени. Если у человека с циррозом наблюдается варикозное расширение вен пищевода и желудка, для профилактики кровотечений назначают специальные препараты.
Если же у пациента терминальная стадия цирроза или развилась гепатоцеллюлярная карцинома, решается вопрос о возможности пересадки печени или другого хирургического лечения.
Диета при циррозе печени
При циррозе печени необходимо полностью исключить употребление алкоголя, а также не принимать лекарства, если они не назначены врачом. Пациентам нужно полноценно питаться и получать белковые растворы, если функция печени снижена. При этом нужно ограничить употребление животных жиров (30% жиров должны быть растительного происхождения), азотистых экстрактивных веществ (содержатся в свинине, баранине и некоторых других видах мяса) и холестерина.
Если у пациента с циррозом нет энцефалопатии, не нужно исключать белковую пищу — её употребление помогает избежать саркопении (потери мышечной массы).
Если цирроз печени сопровождается асцитом, важно ограничить употребление соли или перейти на бессолевую диету.
Частые вопросы
Продолжительность жизни пациента с циррозом печени зависит от тяжести заболевания, длительности его течения, наличия сопутствующих болезней, а также от того, удалось ли в процессе лечения устранить фактор, из-за которого происходило повреждение печени.
Полностью вылечить цирроз печени можно только при трансплантации органа. В других случаях при циррозе организуют поддерживающую терапию, чтобы улучшить состояние пациента, а также лечат основное заболевание, которое и привело к циррозу.
В МКБ-10 для различных разновидностей болезни и её осложнений используется несколько кодов: K70.3 — алкогольный цирроз печени; K71.7 — токсическое поражение печени с фиброзом и циррозом; K74 — фиброз и цирроз печени: K74.0 — фиброз печени, K74.1 — склероз печени, K74.2 — фиброз печени в сочетании со склерозом печени, K74.3 — первичный билиарный цирроз, K74.4 — вторичный билиарный цирроз, K74.5 — билиарный цирроз неуточненный, K74.6 — другой и неуточненный цирроз печени; К76.6 — портальная гипертензия; К72 — печёночная недостаточность, не классифицированная в других рубриках (в том числе печёночная энцефалопатия / кома), К76.7 — гепаторенальный синдром.
Информацию проверил
врач-эксперт
Информацию проверил врач-эксперт
Екатерина Кашух
Врач-гастроэнтеролог, кандидат медицинских наук
Оцените статью:
Полезная статья? Поделитесь в социальных сетях:
ВАЖНО
Информация из данного раздела не может служить достаточным основанием для постановки диагноза или назначения лечения. Решение об этом должен принимать врач на основании всех имеющихся у него данных.
К началу страницы
Цирроз печени – хроническая болезнь, обусловленная патологической заменой паренхиматозной ткани, из которой в норме состоит структура печени, фиброзной соединительной или стромой. Результат – нарушение кровообращения в органе и ухудшение его функционирования, приводящий к сбоям в работе всего организма.
Статистические данные
Цирроз – одна из распространенных причин смертности в возрасте 30-60 лет. От этого заболевания в мире каждый год умирает порядка 300 тысяч человек, что составляет 14-30 случаев на 100 тысяч смертей.
С каждым годом частота летальных исходов стремительно растет, за последнее десятилетие смертность возросла на 12%. Бессимптомно заболевание протекает у 12% людей, имеющих алкогольную зависимость. Примерно в 20% случаев о том, что человек страдал от данного заболевания, удается узнать лишь после его гибели.
У мужчин цирроз встречается в три раза чаще, чем у женщин, в большинстве случаев после 40 лет (хотя развиться может вы любом возрасте).
Как проявляется цирроз: первые признаки
Не всегда удается вовремя обнаружить признаки заболевания, ведь зачастую цирроз протекает незаметно. Но к ранним симптомам относятся:
- Временные боли в области правого подреберья, усиливающиеся при выполнении физических нагрузок. Также боль в этом участке тела может возникать после приема жареной или жирной пищи, алкогольных напитков.
- Часто, особенно по утрам, во рту появляется горький привкус.
- Повышенное газообразование, периодическая диарея.
- Снижение массы тела.
- Носовые кровотечения.
- Раздражительность и быстрая утомляемость.
В большинстве случаев цирроз протекает остро, поэтому не всегда удается диагностировать его на ранних стадиях.
Прогрессирование заболевания и новые признаки
С постепенным развитием болезни могут добавляться и следующие симптомы (основные):
- Боли в правом подреберье нарастают, принимают характер колики. Могут сопровождаться чувством тяжести, нарастать (если дополнительно наблюдается гипокинетическая дискенизия).
- У больного наблюдается рвота и тошнота. В рвотных массах иногда заметна кровь, что свидетельствует о кровотечении из пищевода или вен желудка.
- Наблюдается кожный зуд, обусловленный переизбытком в крови желчных кислот.
- Стремительное снижение массы тела может приводить к истощению. Наблюдается общее снижение тонуса мышц, они атрофируются.
- Нарушения нервной системы: ухудшается память, наблюдается апатия и бессонница.
- Тремор конечностей, болезненная припухлость суставов.
- Увеличение селезенки.
- Рост молочных желез у мужчин, импотенция. Цирроз печени симптомы у женщин – это также уменьшение вторичных половых признаков: сбои менструального цикла или его полное отсутствие. У мужчин, как и у женщин, наблюдается выпадение волос в подмышечных впадинах и в лобковой зоне.
От стадии заболевания зависит степень выраженности тех или иных симптомов.
Внешние характерные признаки цирроза печени
По мере развития заболевания у больного начинают происходить заметные изменения внешности:
- Кожа приобретает желтый оттенок, начинает шелушиться. Выраженная желтуха говорит о том, что болезнь находится в последней стадии. Изначально желтый оттенок приобретают склеры глаз, слизистая ротовой полости, стопы и ладони, а уже после этого – все тело.
- Появляются ксантелазмы (их еще называют «холестериновыми бляшками») в области верхних век.
- Утолщаются в верхней части пальцы, вокруг ногтей краснеет кожа.
- Расширяются вены на животе. Среди поздних осложнений болезни стоит отметить асцит – патологическое скопление в брюшине большого количества жидкости.
- Появляются ангиомы (сосудистые опухоли) по краям носа и в уголках глаз.
- Язык становиться яркого цвета, отекает.
- Верхняя часть туловища может быть покрыта сосудистыми звездочками, количество которых во время острой формы болезни увеличивается.
- На лице выделяются скулы, набухают слюнные железы. Расширенные капилляры придают лицу красный цвет.
Многие из перечисленных признаков появляются только на поздних и самых тяжелых стадиях цирроза.
Почему возникает цирроз: причины
Возникновение цирроза может быть обусловлено многими причинами: иными заболеваниями печени и других органов, длительным приемом некоторых лекарств или алкоголя.
Более 80% случаев заболевания циррозом обусловлены вирусным гепатитом (преимущественно С и В) и алкоголизмом.
Причины, вызывающие болезнь, следующие:
- Аутоиммунный гепатит. Это своеобразный сбой в работе иммунной системы, когда организм начинает вырабатывать повреждающие и разрушающие печень вещества.
- «Метаболические» гепатиты (врожденные формы цирроза). Болезнь возникает на фоне некоторых генетических патологий (болезни Вильсона-Коновалова, гемохроматоза, галактоземии, тирозиноза и пр.).
- Продолжительный холестаз, когда нарушается нормальные отток желчи вследствие плохой проходимости желчных путей (их закупорки).
- Паразитарные болезни печени.
- Некоторые заболевания других внутренних органов: тромбоз воротной вены, хроническая сердечная недостаточность и пр.
- Чрезмерное потребление алкоголя. Развивается заболевание через 10 и более лет постоянного употребления спиртных напитков.
Часто (примерно в 20% случаев) установить точную причину болезни не удается. Тогда цирроз называют криптогенным.
Риск развития заболевания существенно повышает комбинированное влияние сразу нескольких факторов, например, алкоголизма в сочетании с вирусом гепатита.
Диагностика болезни: основные методы
Диагностикой данного заболевания может заниматься врач-гастроэнтеролог или гепатолог. После проведенной консультации специалист может направить пациента на:
- проведение биохимического анализа крови;
- анализ крови на вирусный гепатит;
- коагулограмму;
- УЗИ органов брюшной полости, УЗИ печени;
- гастроскопию: для исследования вен пищевода и оценки риска кровотечений.
Среди дополнительных диагностических мероприятий стоит упомянуть:
- биопсию печени;
- КТ (компьютерная томография) для оценки изменений органа;
- сцинтиграфию органа для оценки работы его различных отделов.
Опытный специалист может заподозрить цирроз только по одному биохимическому анализу крови: его показатели изменяются по определенной схеме. Так, количество билирубина в крови определяется в избыточном количестве, повышаются показатели трансаминаз, щелочной фосфатазы, глобулинов и специфических печеночных ферментов. При этом показатели холестерина, протромбина и мочевины падают.
Какие существуют виды болезни
Цирроз печени может быть нескольких видов, которые разнятся между собой по течению (симптоматике) и прогнозу.
- Алкогольный. Данный тип цирроза возникает у людей, длительное время потребляющих спиртосодержащие напитки в большом количестве. В большинстве случаев сопутствует уже имеющемуся алкогольному гепатиту. Особенность данного типа заболевания – эффективное лечение при полном отказе от употребления алкоголя.
- Первичный билиарный. Этот тип заболевания связан с плохим оттоком желчи и воспалением желчных протоков. Проявляется такой цирроз желтизной и зудом кожных покровов, повышенной температурой тела.
- Аутоиммунный. Развивается вследствие нарушения иммунной системы человека: иммунитет воспринимает клетки собственной печени как чужеродные и борется с ними. В результате происходит замещение погибших клеток соединительной тканью, что дает ход развитию цирроза.
Аутоиммунная форма — одна из тяжелейших для лечения.
[media=https://youtu.be/_hi926Vf3Kk?t=16s]
Стадии заболевания: степень тяжести
Для каждой стадии болезни характерны отличительные симптомы. Также стадия определят общее состояние человека и необходимую терапию.
| Стадия | Первая (компенсированная) | Вторая (субкомпенсированная) | Третья (терминальная) | Четвертая |
| Особенности | Начальная стадия характеризуется практически бессимптомным течением. Если удается выявить болезнь в этот период, то результативная терапия возможна при помощи лекарственных средств. Человек может чувствовать себя абсолютно здоровым (допустимы редкие боли в правом боку), но изменения уже видны при биохимическом анализе крови. | Данная стадия характеризуется выраженным снижением функционирования органа. В этот период наблюдаются первые признаки болезни: снижение работоспособности и ухудшение общего самочувствия, тошнота и рвота. При грамотно подобранном лечении, возможно перевести больного из второй стадии в первую. | Для данной стадии характерно быстрое нарастание симптомов болезни, дальнейшее развитие печеночной недостаточности. Шансы на улучшение самочувствия есть, но они малы. Больной человек должен находиться в стационаре: наблюдается нарушение обмена веществ, часто развивается асцит. | Последняя стадия болезни имеет весьма неблагоприятный прогноз: без пересадки печени нельзя остановить прогрессирование цирроза — все заканчивается смертью. Боли настолько выражены, что человеку приходится постоянно принимать сильные обезболивающие препараты. |
Причиной летального исхода могут тать очень серьезные осложнения цирроза, среди которых: рак печени, перитонит, пневмония, печеночная кома.
Есть ли шансы вылечить заболевание: терапия цирроза
Без пересадки донорского органа полностью избавиться от цирроза на сегодняшний день невозможно. Однако если заболевание было выявлено на ранней стадии своего возникновения, то возможно остановить его прогрессирование при верно подобранной терапии лекарственными средствами. Если болезнь находится на поздних этапах, то можно попытаться отсрочить или предотвратить развитие серьезных осложнений.
Терапия подбирается строго индивидуально, с учетом клинических проявлений болезни и ее стадии.
Лечение основывается на:
- Устранении причина, поспособствовавшей развитию патологии. В случаях, если болезнь находится в компенсированной стадии.
- Избавлении от алкогольной зависимости.
- Строгой диете, с полным воздержанием от алкоголя и вредных продуктов, оптимальным содержанием в рационе белков и углеводов.
- Ограничении физических нагрузок.
- Индивидуально подобранной медикаментозной терапии.
Не рекомендуется при циррозе лечение теплом. Также без консультации врача нельзя пользоваться средствами народной медицины.
Последствия цирроза и прогноз
Сколько живут с диагнозом «цирроз печени»? Ответ – болезнь может иметь различный прогноз. Так, если человек пересматривает образ своей жизни и придерживается установленной схемы лечении, то на первый стадиях (когда сохранены функциональные возможности гепацидов) выживаемость более 7 лет составляет свыше 50%.
При субкомпенсированной стадии заболевания средняя продолжительность жизни – 5 лет, на более поздних стадиях – не более 40% людей живут 3 года. В большинстве случаев человек погибает от развивающихся осложнений, несовместимых с жизнью.
В некоторых случаях правильная терапия позволяет компенсировать заболевание на довольно долгий срок (до 20 и более лет) и поддерживать функционирование пораженного органа.
Цирроз печени, симптомы у мужчин – сколько живут люди с таким диагнозом, зависит от своевременного выявления болезни и подбора правильной терапии. Даже с развившимся асцитом при медикаментозной терапии можно прожить около 2 лет, но при отказе от лечения только 25-50% от количества больных циррозом людей переживают полгода.

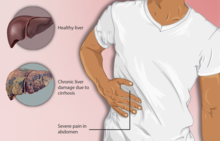
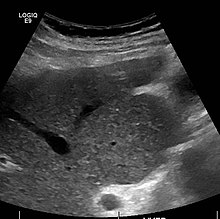


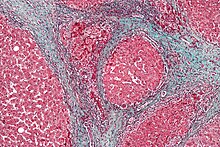
![No fibrosis, but mild zone 3 steatosis, in which collagen fibres (pink–red, arrow) are confined to portal tracts (P) (Van Gieson's stain)[86]](https://upload.wikimedia.org/wikipedia/commons/thumb/2/23/Histopathology_of_mild_zone_3_steatosis_without_fibrosis_%28van_Gieson%29.jpg/120px-Histopathology_of_mild_zone_3_steatosis_without_fibrosis_%28van_Gieson%29.jpg)
![Histopathology of steatohepatitis with mild fibrosis in the form of fibrous expansion (Van Gieson's stain)[86]](https://upload.wikimedia.org/wikipedia/commons/thumb/a/af/Histopathology_of_steatohepatitis_with_mild_fibrosis_in_the_form_of_fibrous_expansion_%28van_Gieson%29.jpg/120px-Histopathology_of_steatohepatitis_with_mild_fibrosis_in_the_form_of_fibrous_expansion_%28van_Gieson%29.jpg)
![Histopathology of steatohepatitis with moderate fibrosis, with thin fibrous bridges (Van Gieson's stain)[86]](https://upload.wikimedia.org/wikipedia/commons/thumb/d/da/Histopathology_of_steatohepatitis_with_moderate_fibrosis%2C_with_thin_fibrous_bridges_%28van_Gieson%29.jpg/120px-Histopathology_of_steatohepatitis_with_moderate_fibrosis%2C_with_thin_fibrous_bridges_%28van_Gieson%29.jpg)
![Histopathology of steatohepatitis with established cirrhosis, with thick bands of fibrosis (Van Gieson's stain)[86]](https://upload.wikimedia.org/wikipedia/commons/thumb/0/0d/Histopathology_of_steatohepatitis_with_established_cirrhosis%2C_with_thick_bands_of_fibrosis_%28van_Gieson%29.jpg/120px-Histopathology_of_steatohepatitis_with_established_cirrhosis%2C_with_thick_bands_of_fibrosis_%28van_Gieson%29.jpg)