«Covid» redirects here. Not to be confused with corvid.
| Coronavirus disease 2019 (COVID-19) |
|
|---|---|
| Other names | COVID, (the) coronavirus |
 |
|
|
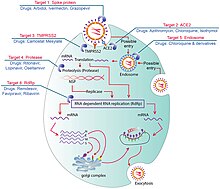
Transmission and life-cycle of SARS-CoV-2 causing COVID-19 |
|
| Pronunciation |
|
| Specialty | Infectious disease |
| Symptoms | Fever, cough, fatigue, shortness of breath, vomiting, loss of taste or smell; some cases asymptomatic[2][3] |
| Complications | Pneumonia, viral sepsis, acute respiratory distress syndrome, kidney failure, cytokine release syndrome, respiratory failure, pulmonary fibrosis, paediatric multisystem inflammatory syndrome, long COVID |
| Usual onset | 2–14 days (typically 5) from infection |
| Duration | 5 days to chronic |
| Causes | Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) |
| Diagnostic method | rRT‑PCR testing, CT scan, Rapid antigen test |
| Prevention | Vaccination,[4] face coverings, quarantine, physical/social distancing, ventilation, hand washing[5] |
| Treatment | Symptomatic and supportive |
| Frequency | 664,338,243[6] confirmed cases |
| Deaths | 6,707,311[6] |
Coronavirus disease 2019 (COVID-19) is a contagious disease caused by a virus, the severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). The first known case was identified in Wuhan, China, in December 2019.[7] The disease quickly spread worldwide, resulting in the COVID-19 pandemic.
The symptoms of COVID‑19 are variable but often include fever,[8] cough, headache,[9] fatigue, breathing difficulties, loss of smell, and loss of taste.[10][11][12] Symptoms may begin one to fourteen days after exposure to the virus. At least a third of people who are infected do not develop noticeable symptoms.[13] Of those who develop symptoms noticeable enough to be classified as patients, most (81%) develop mild to moderate symptoms (up to mild pneumonia), while 14% develop severe symptoms (dyspnea, hypoxia, or more than 50% lung involvement on imaging), and 5% develop critical symptoms (respiratory failure, shock, or multiorgan dysfunction).[14] Older people are at a higher risk of developing severe symptoms. Some people continue to experience a range of effects (long COVID) for months after recovery, and damage to organs has been observed.[15] Multi-year studies are underway to further investigate the long-term effects of the disease.[15]
COVID‑19 transmits when people breathe air contaminated by droplets and small airborne particles containing the virus. The risk of breathing these is highest when people are in close proximity, but they can be inhaled over longer distances, particularly indoors. Transmission can also occur if contaminated fluids are splashed or sprayed in the eyes, nose, or mouth, or, more rarely, via contaminated surfaces. People remain contagious for up to 20 days and can spread the virus even if they do not develop symptoms.[16][17]
Testing methods for COVID-19 to detect the virus’s nucleic acid include real-time reverse transcription polymerase chain reaction (rRT‑PCR),[18][19] transcription-mediated amplification,[18][19][20] and reverse transcription loop-mediated isothermal amplification (RT‑LAMP)[18][19] from a nasopharyngeal swab.[21]
Several COVID-19 vaccines have been approved and distributed in various countries, which have initiated mass vaccination campaigns. Other preventive measures include physical or social distancing, quarantining, ventilation of indoor spaces, use of face masks or coverings in public, covering coughs and sneezes, hand washing, and keeping unwashed hands away from the face. While work is underway to develop drugs that inhibit the virus, the primary treatment is symptomatic. Management involves the treatment of symptoms through supportive care, isolation, and experimental measures.
Nomenclature
During the initial outbreak in Wuhan, the virus and disease were commonly referred to as «coronavirus» and «Wuhan coronavirus»,[22][23][24] with the disease sometimes called «Wuhan pneumonia».[25][26] In the past, many diseases have been named after geographical locations, such as the Spanish flu,[27] Middle East respiratory syndrome, and Zika virus.[28] In January 2020, the World Health Organization (WHO) recommended 2019-nCoV[29] and 2019-nCoV acute respiratory disease[30] as interim names for the virus and disease per 2015 guidance and international guidelines against using geographical locations or groups of people in disease and virus names to prevent social stigma.[31][32][33] The official names COVID‑19 and SARS-CoV-2 were issued by the WHO on 11 February 2020 with COVID-19 being shorthand for «coronavirus disease 2019».[34][35] The WHO additionally uses «the COVID‑19 virus» and «the virus responsible for COVID‑19» in public communications.[34][36]
Signs and symptoms
The symptoms of COVID-19 are variable depending on the type of variant contracted, ranging from mild symptoms to a potentially fatal illness.[37][38] Common symptoms include coughing, fever, loss of smell (anosmia) and taste (ageusia), with less common ones including headaches, nasal congestion and runny nose, muscle pain, sore throat, diarrhea, eye irritation,[39] and toes swelling or turning purple,[40] and in moderate to severe cases, breathing difficulties.[41] People with the COVID-19 infection may have different symptoms, and their symptoms may change over time. Three common clusters of symptoms have been identified: one respiratory symptom cluster with cough, sputum, shortness of breath, and fever; a musculoskeletal symptom cluster with muscle and joint pain, headache, and fatigue; and a cluster of digestive symptoms with abdominal pain, vomiting, and diarrhea.[41] In people without prior ear, nose, or throat disorders, loss of taste combined with loss of smell is associated with COVID-19 and is reported in as many as 88% of symptomatic cases.[42][43][44]
Of people who show symptoms, 81% develop only mild to moderate symptoms (up to mild pneumonia), while 14% develop severe symptoms (dyspnea, hypoxia, or more than 50% lung involvement on imaging) that require hospitalization, and 5% of patients develop critical symptoms (respiratory failure, septic shock, or multiorgan dysfunction) requiring ICU admission.[45] At least a third of the people who are infected with the virus do not develop noticeable symptoms at any point in time.[46][47] These asymptomatic carriers tend not to get tested and can still spread the disease.[47][48][49][50] Other infected people will develop symptoms later (called «pre-symptomatic») or have very mild symptoms and can also spread the virus.[50]
As is common with infections, there is a delay between the moment a person first becomes infected and the appearance of the first symptoms. The median delay for COVID-19 is four to five days[51] possibly being infectious on 1-4 of those days.[52] Most symptomatic people experience symptoms within two to seven days after exposure, and almost all will experience at least one symptom within 12 days.[51][53]
Most people recover from the acute phase of the disease. However, some people—over half of a cohort of home-isolated young adults identified in June, 2021[54][55] continued to experience a range of effects, such as fatigue, for months even after recovery. This is the result of a condition called long COVID, which can be described as a range of persistent symptoms that continue for weeks and/or months at a time.[56] Long-term damage to organs has also been observed after the onset of COVID-19. Multi-year studies are underway to further investigate the potential long-term effects of the disease.[57]
The Omicron variant became dominant in the U.S. in December 2021. Symptoms with the Omicron variant are less severe than they are with other variants.[58]
Cause
COVID‑19 is caused by infection with a strain of coronavirus known as ‘Severe Acute Respiratory Syndrome coronavirus 2’ (SARS-CoV-2).[59]
Transmission
| Transmission of COVID-19 | |
|---|---|
| Other names | Mode of spread of COVID-19 |
 |
|
| Specialty | Infection prevention and control |
| Types | Respiratory droplet, airborne transmission, fomites |
| Prevention | Face coverings, quarantine, physical/social distancing, ventilation, hand washing, vaccination |
COVID-19 is mainly transmitted when people breathe in air contaminated by droplets/aerosols and small airborne particles containing the virus. Infected people exhale those particles as they breathe, talk, cough, sneeze, or sing.[60][61][62][63] Transmission is more likely the more physically close people are. However, infection can occur over longer distances, particularly indoors.[60][64]
Infectivity can begin four to five days before the onset of symptoms,[65] although contact tracing typically begins only two to three days before symptom onset.[66] Infected people can spread the disease even if they are pre-symptomatic or asymptomatic.[66] Most commonly, the peak viral load in upper respiratory tract samples occurs close to the time of symptom onset and declines after the first week after symptoms begin.[66] Current evidence suggests a duration of viral shedding and the period of infectiousness of up to ten days following symptom onset for people with mild to moderate COVID-19, and up to 20 days for persons with severe COVID-19, including immunocompromised people.[67][66]
Infectious particles range in size from aerosols that remain suspended in the air for long periods of time to larger droplets that remain airborne briefly or fall to the ground.[68][69][70][71] Additionally, COVID-19 research has redefined the traditional understanding of how respiratory viruses are transmitted.[71][72] The largest droplets of respiratory fluid do not travel far, but can be inhaled or land on mucous membranes on the eyes, nose, or mouth to infect.[70] Aerosols are highest in concentration when people are in close proximity, which leads to easier viral transmission when people are physically close,[70][71][72] but airborne transmission can occur at longer distances, mainly in locations that are poorly ventilated;[70] in those conditions small particles can remain suspended in the air for minutes to hours.[70]
The number of people generally infected by one infected person varies,[73] but it is estimated that the R0 («R nought» or «R zero») number is around 2.5.[74] The disease often spreads in clusters, where infections can be traced back to an index case or geographical location.[75] Often in these instances, superspreading events occur, where many people are infected by one person.[73]
Virology
Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) is a novel severe acute respiratory syndrome coronavirus. It was first isolated from three people with pneumonia connected to the cluster of acute respiratory illness cases in Wuhan.[76] All structural features of the novel SARS-CoV-2 virus particle occur in related coronaviruses in nature.[77]
Outside the human body, the virus is destroyed by household soap, which bursts its protective bubble.[78]
SARS-CoV-2 is closely related to the original SARS-CoV.[79] It is thought to have an animal (zoonotic) origin. Genetic analysis has revealed that the coronavirus genetically clusters with the genus Betacoronavirus, in subgenus Sarbecovirus (lineage B) together with two bat-derived strains. It is 96% identical at the whole genome level to other bat coronavirus samples (BatCov RaTG13).[80][81][82] The structural proteins of SARS-CoV-2 include membrane glycoprotein (M), envelope protein (E), nucleocapsid protein (N), and the spike protein (S). The M protein of SARS-CoV-2 is about 98% similar to the M protein of bat SARS-CoV, maintains around 98% homology with pangolin SARS-CoV, and has 90% homology with the M protein of SARS-CoV; whereas, the similarity is only around 38% with the M protein of MERS-CoV.[83]
SARS-CoV-2 variants
The many thousands of SARS-CoV-2 variants are grouped into either clades or lineages.[84][85] The WHO, in collaboration with partners, expert networks, national authorities, institutions and researchers, have established nomenclature systems for naming and tracking SARS-CoV-2 genetic lineages by GISAID, Nextstrain and Pango. The expert group convened by the WHO recommended the labelling of variants using letters of the Greek alphabet, for example, Alpha, Beta, Delta, and Gamma, giving the justification that they «will be easier and more practical to discussed by non-scientific audiences.»[86] Nextstrain divides the variants into five clades (19A, 19B, 20A, 20B, and 20C), while GISAID divides them into seven (L, O, V, S, G, GH, and GR).[87] The Pango tool groups variants into lineages, with many circulating lineages being classed under the B.1 lineage.[85][88]
Several notable variants of SARS-CoV-2 emerged throughout 2020.[89][90] Cluster 5 emerged among minks and mink farmers in Denmark.[91] After strict quarantines and a mink euthanasia campaign, the cluster was assessed to no longer be circulating among humans in Denmark as of 1 February 2021.[92]
As of December 2021, there are five dominant variants of SARS-CoV-2 spreading among global populations: the Alpha variant (B.1.1.7, formerly called the UK variant), first found in London and Kent, the Beta variant (B.1.351, formerly called the South Africa variant), the Gamma variant (P.1, formerly called the Brazil variant), the Delta variant (B.1.617.2, formerly called the India variant),[93] and the Omicron variant (B.1.1.529), which had spread to 57 countries as of 7 December.[94][95]
Pathophysiology
The SARS-CoV-2 virus can infect a wide range of cells and systems of the body. COVID‑19 is most known for affecting the upper respiratory tract (sinuses, nose, and throat) and the lower respiratory tract (windpipe and lungs).[96] The lungs are the organs most affected by COVID‑19 because the virus accesses host cells via the receptor for the enzyme angiotensin-converting enzyme 2 (ACE2), which is most abundant on the surface of type II alveolar cells of the lungs.[97] The virus uses a special surface glycoprotein called a «spike» to connect to the ACE2 receptor and enter the host cell.[98]
Respiratory tract
Following viral entry, COVID‑19 infects the ciliated epithelium of the nasopharynx and upper airways.[99]
Nervous system
One common symptom, loss of smell, results from infection of the support cells of the olfactory epithelium, with subsequent damage to the olfactory neurons.[100] The involvement of both the central and peripheral nervous system in COVID‑19 has been reported in many medical publications.[101] It is clear that many people with COVID-19 exhibit neurological or mental health issues. The virus is not detected in the central nervous system (CNS) of the majority of COVID-19 patients with neurological issues. However, SARS-CoV-2 has been detected at low levels in the brains of those who have died from COVID‑19, but these results need to be confirmed.[102] While virus has been detected in cerebrospinal fluid of autopsies, the exact mechanism by which it invades the CNS remains unclear and may first involve invasion of peripheral nerves given the low levels of ACE2 in the brain.[103][104][105] The virus may also enter the bloodstream from the lungs and cross the blood–brain barrier to gain access to the CNS, possibly within an infected white blood cell.[102]
Research conducted when Alpha was the dominant variant has suggested COVID-19 may cause brain damage. It is unknown if such damage is temporary or permanent, and whether Omicron has similar effects.[106][107] Observed individuals infected with COVID-19 (most with mild cases) experienced an additional 0.2% to 2% of brain tissue lost in regions of the brain connected to the sense of smell compared with uninfected individuals, and the overall effect on the brain was equivalent on average to at least one extra year of normal ageing; infected individuals also scored lower on several cognitive tests. All effects were more pronounced among older ages.[108]
Gastrointestinal tract
The virus also affects gastrointestinal organs as ACE2 is abundantly expressed in the glandular cells of gastric, duodenal and rectal epithelium[109] as well as endothelial cells and enterocytes of the small intestine.[110]
Cardiovascular system
The virus can cause acute myocardial injury and chronic damage to the cardiovascular system.[111][112] An acute cardiac injury was found in 12% of infected people admitted to the hospital in Wuhan, China,[113] and is more frequent in severe disease.[114] Rates of cardiovascular symptoms are high, owing to the systemic inflammatory response and immune system disorders during disease progression, but acute myocardial injuries may also be related to ACE2 receptors in the heart.[112] ACE2 receptors are highly expressed in the heart and are involved in heart function.[112][115]
A high incidence of thrombosis and venous thromboembolism occurs in people transferred to intensive care units with COVID‑19 infections, and may be related to poor prognosis.[116] Blood vessel dysfunction and clot formation (as suggested by high D-dimer levels caused by blood clots) may have a significant role in mortality, incidences[spelling?] of clots leading to pulmonary embolisms, and ischaemic events within the brain found as complications leading to death in people infected with COVID‑19.[117] Infection may initiate a chain of vasoconstrictive responses within the body, including pulmonary vasoconstriction – a possible mechanism in which oxygenation decreases during pneumonia.[117] Furthermore, damage of arterioles and capillaries was found in brain tissue samples of people who died from COVID‑19.[118][119]
COVID‑19 may also cause substantial structural changes to blood cells, sometimes persisting for months after hospital discharge.[120] A low level of blood lymphocytes may result from the virus acting through ACE2-related entry into lymphocytes.[121]
Other organs
Another common cause of death is complications related to the kidneys.[117] Early reports show that up to 30% of hospitalised patients both in China and in New York have experienced some injury to their kidneys, including some persons with no previous kidney problems.[122]
Autopsies of people who died of COVID‑19 have found diffuse alveolar damage, and lymphocyte-containing inflammatory infiltrates within the lung.[123]
Immunopathology
Although SARS-CoV-2 has a tropism for ACE2-expressing epithelial cells of the respiratory tract, people with severe COVID‑19 have symptoms of systemic hyperinflammation. Clinical laboratory findings of elevated IL‑2, IL‑7, IL‑6, granulocyte-macrophage colony-stimulating factor (GM‑CSF), interferon gamma-induced protein 10 (IP‑10), monocyte chemoattractant protein 1 (MCP1), macrophage inflammatory protein 1‑alpha (MIP‑1‑alpha), and tumour necrosis factor (TNF‑α) indicative of cytokine release syndrome (CRS) suggest an underlying immunopathology.[113]
Interferon alpha plays a complex, Janus-faced role in the pathogenesis of COVID-19. Although it promotes the elimination of virus-infected cells, it also upregulates the expression of ACE-2, thereby facilitating the SARS-Cov2 virus to enter cells and to replicate.[124][125] A competition of negative feedback loops (via protective effects of interferon alpha) and positive feedback loops (via upregulation of ACE-2) is assumed to determine the fate of patients suffering from COVID-19.[126]
Additionally, people with COVID‑19 and acute respiratory distress syndrome (ARDS) have classical serum biomarkers of CRS, including elevated C-reactive protein (CRP), lactate dehydrogenase (LDH), D-dimer, and ferritin.[127]
Systemic inflammation results in vasodilation, allowing inflammatory lymphocytic and monocytic infiltration of the lung and the heart. In particular, pathogenic GM-CSF-secreting T cells were shown to correlate with the recruitment of inflammatory IL-6-secreting monocytes and severe lung pathology in people with COVID‑19.[128] Lymphocytic infiltrates have also been reported at autopsy.[123]
Viral and host factors
Virus proteins
Multiple viral and host factors affect the pathogenesis of the virus. The S-protein, otherwise known as the spike protein, is the viral component that attaches to the host receptor via the ACE2 receptors. It includes two subunits: S1 and S2. S1 determines the virus-host range and cellular tropism via the receptor-binding domain. S2 mediates the membrane fusion of the virus to its potential cell host via the H1 and HR2, which are heptad repeat regions. Studies have shown that S1 domain induced IgG and IgA antibody levels at a much higher capacity. It is the focus spike proteins expression that are involved in many effective COVID‑19 vaccines.[129]
The M protein is the viral protein responsible for the transmembrane transport of nutrients. It is the cause of the bud release and the formation of the viral envelope.[130] The N and E protein are accessory proteins that interfere with the host’s immune response.[130]
Host factors
Human angiotensin converting enzyme 2 (hACE2) is the host factor that SARS-CoV-2 virus targets causing COVID‑19. Theoretically, the usage of angiotensin receptor blockers (ARB) and ACE inhibitors upregulating ACE2 expression might increase morbidity with COVID‑19, though animal data suggest some potential protective effect of ARB; however no clinical studies have proven susceptibility or outcomes. Until further data is available, guidelines and recommendations for hypertensive patients remain.[131]
The effect of the virus on ACE2 cell surfaces leads to leukocytic infiltration, increased blood vessel permeability, alveolar wall permeability, as well as decreased secretion of lung surfactants. These effects cause the majority of the respiratory symptoms. However, the aggravation of local inflammation causes a cytokine storm eventually leading to a systemic inflammatory response syndrome.[132]
Among healthy adults not exposed to SARS-CoV-2, about 35% have CD4+ T cells that recognise the SARS-CoV-2 S protein (particularly the S2 subunit) and about 50% react to other proteins of the virus, suggesting cross-reactivity from previous common colds caused by other coronaviruses.[133]
It is unknown whether different persons use similar antibody genes in response to COVID‑19.[134]
Host cytokine response
The severity of the inflammation can be attributed to the severity of what is known as the cytokine storm.[135] Levels of interleukin 1B, interferon-gamma, interferon-inducible protein 10, and monocyte chemoattractant protein 1 were all associated with COVID‑19 disease severity. Treatment has been proposed to combat the cytokine storm as it remains to be one of the leading causes of morbidity and mortality in COVID‑19 disease.[136]
A cytokine storm is due to an acute hyperinflammatory response that is responsible for clinical illness in an array of diseases but in COVID‑19, it is related to worse prognosis and increased fatality. The storm causes acute respiratory distress syndrome, blood clotting events such as strokes, myocardial infarction, encephalitis, acute kidney injury, and vasculitis. The production of IL-1, IL-2, IL-6, TNF-alpha, and interferon-gamma, all crucial components of normal immune responses, inadvertently become the causes of a cytokine storm. The cells of the central nervous system, the microglia, neurons, and astrocytes, are also involved in the release of pro-inflammatory cytokines affecting the nervous system, and effects of cytokine storms toward the CNS are not uncommon.[137]
Pregnancy response
There are many unknowns for pregnant women during the COVID-19 pandemic. Given that they are prone to have complications and severe disease infection with other types of coronaviruses, they have been identified as a vulnerable group and advised to take supplementary preventive measures.[138]
Physiological responses to pregnancy can include:
- Immunological: The immunological response to COVID-19, like other viruses, depends on a working immune system. It adapts during pregnancy to allow the development of the foetus whose genetic load is only partially shared with their mother, leading to a different immunological reaction to infections during the course of pregnancy.[138]
- Respiratory: Many factors can make pregnant women more vulnerable to hard respiratory infections. One of them is the total reduction of the lungs’ capacity and inability to clear secretions.[138]
- Coagulation: During pregnancy, there are higher levels of circulating coagulation factors, and the pathogenesis of SARS-CoV-2 infection can be implicated. The thromboembolic events with associated mortality are a risk for pregnant women.[138]
However, from the evidence base, it is difficult to conclude whether pregnant women are at increased risk of grave consequences of this virus.[138]
In addition to the above, other clinical studies have proved that SARS-CoV-2 can affect the period of pregnancy in different ways. On the one hand, there is little evidence of its impact up to 12 weeks gestation. On the other hand, COVID-19 infection may cause increased rates of unfavourable outcomes in the course of the pregnancy. Some examples of these could be foetal growth restriction, preterm birth, and perinatal mortality, which refers to the foetal death past 22 or 28 completed weeks of pregnancy as well as the death among live-born children up to seven completed days of life.[138]
Unvaccinated women in later stages of pregnancy with COVID-19 are more likely than other patients to need very intensive care. Babies born to mothers with COVID-19 are more likely to have breathing problems. Pregnant women are strongly encouraged to get vaccinated.[139]
Diagnosis
COVID‑19 can provisionally be diagnosed on the basis of symptoms and confirmed using reverse transcription polymerase chain reaction (RT-PCR) or other nucleic acid testing of infected secretions.[21][140] Along with laboratory testing, chest CT scans may be helpful to diagnose COVID‑19 in individuals with a high clinical suspicion of infection.[141] Detection of a past infection is possible with serological tests, which detect antibodies produced by the body in response to the infection.[21]
Viral testing
The standard methods of testing for presence of SARS-CoV-2 are nucleic acid tests,[21][142] which detects the presence of viral RNA fragments.[143] As these tests detect RNA but not infectious virus, its «ability to determine duration of infectivity of patients is limited.»[144] The test is typically done on respiratory samples obtained by a nasopharyngeal swab; however, a nasal swab or sputum sample may also be used.[145][146] Results are generally available within hours.[21] The WHO has published several testing protocols for the disease.[147]
Several laboratories and companies have developed serological tests, which detect antibodies produced by the body in response to infection. Several have been evaluated by Public Health England and approved for use in the UK.[148]
The University of Oxford’s CEBM has pointed to mounting evidence[149][150] that «a good proportion of ‘new’ mild cases and people re-testing positives after quarantine or discharge from hospital are not infectious, but are simply clearing harmless virus particles which their immune system has efficiently dealt with» and have called for «an international effort to standardize and periodically calibrate testing»[151] In September 2020, the UK government issued «guidance for procedures to be implemented in laboratories to provide assurance of positive SARS-CoV-2 RNA results during periods of low prevalence, when there is a reduction in the predictive value of positive test results».[152]
Imaging
A CT scan of a person with COVID-19 shows lesions (bright regions) in the lungs
CT scan of rapid progression stage of COVID-19
Chest X-ray showing COVID‑19 pneumonia
Chest CT scans may be helpful to diagnose COVID‑19 in individuals with a high clinical suspicion of infection but are not recommended for routine screening.[141][153] Bilateral multilobar ground-glass opacities with a peripheral, asymmetric, and posterior distribution are common in early infection.[141][154] Subpleural dominance, crazy paving (lobular septal thickening with variable alveolar filling), and consolidation may appear as the disease progresses.[141][155] Characteristic imaging features on chest radiographs and computed tomography (CT) of people who are symptomatic include asymmetric peripheral ground-glass opacities without pleural effusions.[156]
Many groups have created COVID‑19 datasets that include imagery such as the Italian Radiological Society which has compiled an international online database of imaging findings for confirmed cases.[157] Due to overlap with other infections such as adenovirus, imaging without confirmation by rRT-PCR is of limited specificity in identifying COVID‑19.[156] A large study in China compared chest CT results to PCR and demonstrated that though imaging is less specific for the infection, it is faster and more sensitive.[140]
Coding
In late 2019, the WHO assigned emergency ICD-10 disease codes U07.1 for deaths from lab-confirmed SARS-CoV-2 infection and U07.2 for deaths from clinically or epidemiologically diagnosed COVID‑19 without lab-confirmed SARS-CoV-2 infection.[158]
Pathology
The main pathological findings at autopsy are:
- Macroscopy: pericarditis, lung consolidation and pulmonary oedema[123]
- Lung findings:
- minor serous exudation, minor fibrin exudation[123]
- pulmonary oedema, pneumocyte hyperplasia, large atypical pneumocytes, interstitial inflammation with lymphocytic infiltration and multinucleated giant cell formation[123]
- diffuse alveolar damage (DAD) with diffuse alveolar exudates. DAD is the cause of acute respiratory distress syndrome (ARDS) and severe hypoxaemia.[123]
- organisation of exudates in alveolar cavities and pulmonary interstitial fibrosis[123]
- plasmocytosis in BAL[159]
- Blood and vessels: disseminated intravascular coagulation (DIC);[160] leukoerythroblastic reaction,[161] endotheliitis,[162] hemophagocytosis[162]
- Heart: cardiac muscle cell necrosis[162]
- Liver: microvesicular steatosis[123]
- Nose: shedding of olfactory epithelium[100]
- Brain: infarction[162]
- Kidneys: acute tubular damage.[162]
- Spleen: white pulp depletion.[162]
Prevention
Without pandemic containment measures – such as social distancing, vaccination, and face masks – pathogens can spread exponentially.[163] This graphic shows how early adoption of containment measures tends to protect wider swaths of the population.
Preventive measures to reduce the chances of infection include getting vaccinated, staying at home, wearing a mask in public, avoiding crowded places, keeping distance from others, ventilating indoor spaces, managing potential exposure durations,[164] washing hands with soap and water often and for at least twenty seconds, practising good respiratory hygiene, and avoiding touching the eyes, nose, or mouth with unwashed hands.[165][166]
Those diagnosed with COVID‑19 or who believe they may be infected are advised by the CDC to stay home except to get medical care, call ahead before visiting a healthcare provider, wear a face mask before entering the healthcare provider’s office and when in any room or vehicle with another person, cover coughs and sneezes with a tissue, regularly wash hands with soap and water and avoid sharing personal household items.[167][168]
The first COVID‑19 vaccine was granted regulatory approval on 2 December 2020 by the UK medicines regulator MHRA.[169] It was evaluated for emergency use authorization (EUA) status by the US FDA, and in several other countries.[170] Initially, the US National Institutes of Health guidelines do not recommend any medication for prevention of COVID‑19, before or after exposure to the SARS-CoV-2 virus, outside the setting of a clinical trial.[171][172] Without a vaccine, other prophylactic measures, or effective treatments, a key part of managing COVID‑19 is trying to decrease and delay the epidemic peak, known as «flattening the curve».[173] This is done by slowing the infection rate to decrease the risk of health services being overwhelmed, allowing for better treatment of active cases, and delaying additional cases until effective treatments or a vaccine become available.[173][174]
Vaccine
Different vaccine candidate types in development for SARS-CoV-2
A COVID‑19 vaccine is a vaccine intended to provide acquired immunity against severe acute respiratory syndrome coronavirus 2 (SARS‑CoV‑2), the virus that causes coronavirus disease 2019 (COVID‑19).
Prior to the COVID‑19 pandemic, an established body of knowledge existed about the structure and function of coronaviruses causing diseases like severe acute respiratory syndrome (SARS) and Middle East respiratory syndrome (MERS). This knowledge accelerated the development of various vaccine platforms during early 2020.[175] The initial focus of SARS-CoV-2 vaccines was on preventing symptomatic, often severe illness.[176] In January 2020, the SARS-CoV-2 genetic sequence data was shared through GISAID, and by March 2020, the global pharmaceutical industry announced a major commitment to address COVID‑19.[177] In 2020, the first COVID‑19 vaccines were developed and made available to the public through emergency authorizations[178] and conditional approvals.[179][180] Initially, most COVID‑19 vaccines were two-dose vaccines, with the sole exception being the single-dose Janssen COVID-19 vaccine.[178] However, immunity from the vaccines has been found to wane over time, requiring people to get booster doses of the vaccine to maintain protection against COVID‑19.[178]
Face masks and respiratory hygiene
Masks with an exhalation valve. The valves are a weak point that can transmit the viruses outwards.
The WHO and the US CDC recommend individuals wear non-medical face coverings in public settings where there is an increased risk of transmission and where social distancing measures are difficult to maintain.[181][182] This recommendation is meant to reduce the spread of the disease by asymptomatic and pre-symptomatic individuals and is complementary to established preventive measures such as social distancing.[182][183] Face coverings limit the volume and travel distance of expiratory droplets dispersed when talking, breathing, and coughing.[182][183] A face covering without vents or holes will also filter out particles containing the virus from inhaled and exhaled air, reducing the chances of infection.[184] However, if the mask includes an exhalation valve, a wearer that is infected (and possibly asymptomatic) may transmit the virus through the valve. Many countries and local jurisdictions encourage or mandate the use of face masks or cloth face coverings by members of the public to limit the spread of the virus.[185]
Masks are also strongly recommended for those who may have been infected and those taking care of someone who may have the disease.[186] When not wearing a mask, the CDC recommends covering the mouth and nose with a tissue when coughing or sneezing and recommends using the inside of the elbow if no tissue is available. Proper hand hygiene after any cough or sneeze is encouraged. Healthcare professionals interacting directly with people who have COVID‑19 are advised to use respirators at least as protective as NIOSH-certified N95 or equivalent, in addition to other personal protective equipment.[187]
Indoor ventilation and avoiding crowded indoor spaces
The CDC recommends that crowded indoor spaces should be avoided.[188] When indoors, increasing the rate of air change, decreasing recirculation of air and increasing the use of outdoor air can reduce transmission.[188][189] The WHO recommends ventilation and air filtration in public spaces to help clear out infectious aerosols.[190][191][192]
Exhaled respiratory particles can build-up within enclosed spaces with inadequate ventilation. The risk of COVID‑19 infection increases especially in spaces where people engage in physical exertion or raise their voice (e.g., exercising, shouting, singing) as this increases exhalation of respiratory droplets. Prolonged exposure to these conditions, typically more than 15 minutes, leads to higher risk of infection.[188]
Displacement ventilation with large natural inlets can move stale air directly to the exhaust in laminar flow while significantly reducing the concentration of droplets and particles. Passive ventilation reduces energy consumption and maintenance costs but may lack controllability and heat recovery. Displacement ventilation can also be achieved mechanically with higher energy and maintenance costs. The use of large ducts and openings helps to prevent mixing in closed environments. Recirculation and mixing should be avoided because recirculation prevents dilution of harmful particles and redistributes possibly contaminated air, and mixing increases the concentration and range of infectious particles and keeps larger particles in the air.[193]
Hand-washing and hygiene
Thorough hand hygiene after any cough or sneeze is required.[194] The WHO also recommends that individuals wash hands often with soap and water for at least twenty seconds, especially after going to the toilet or when hands are visibly dirty, before eating and after blowing one’s nose.[195] When soap and water are not available, the CDC recommends using an alcohol-based hand sanitiser with at least 60% alcohol.[196] For areas where commercial hand sanitisers are not readily available, the WHO provides two formulations for local production. In these formulations, the antimicrobial activity arises from ethanol or isopropanol. Hydrogen peroxide is used to help eliminate bacterial spores in the alcohol; it is «not an active substance for hand antisepsis.» Glycerol is added as a humectant.[197]
Social distancing (also known as physical distancing) includes infection control actions intended to slow the spread of the disease by minimising close contact between individuals. Methods include quarantines; travel restrictions; and the closing of schools, workplaces, stadiums, theatres, or shopping centres. Individuals may apply social distancing methods by staying at home, limiting travel, avoiding crowded areas, using no-contact greetings, and physically distancing themselves from others.[198] Many governments are mandating or recommending social distancing in regions affected by the outbreak.[199]
Outbreaks have occurred in prisons due to crowding and an inability to enforce adequate social distancing.[200][201] In the United States, the prisoner population is ageing and many of them are at high risk for poor outcomes from COVID‑19 due to high rates of coexisting heart and lung disease, and poor access to high-quality healthcare.[200]
Surface cleaning
After being expelled from the body, coronaviruses can survive on surfaces for hours to days. If a person touches the dirty surface, they may deposit the virus at the eyes, nose, or mouth where it can enter the body and cause infection.[202] Evidence indicates that contact with infected surfaces is not the main driver of COVID‑19,[203][204][205] leading to recommendations for optimised disinfection procedures to avoid issues such as the increase of antimicrobial resistance through the use of inappropriate cleaning products and processes.[206][207] Deep cleaning and other surface sanitation has been criticised as hygiene theatre, giving a false sense of security against something primarily spread through the air.[208][209]
The amount of time that the virus can survive depends significantly on the type of surface, the temperature, and the humidity.[210] Coronaviruses die very quickly when exposed to the UV light in sunlight.[210] Like other enveloped viruses, SARS-CoV-2 survives longest when the temperature is at room temperature or lower, and when the relative humidity is low (<50%).[210]
On many surfaces, including glass, some types of plastic, stainless steel, and skin, the virus can remain infective for several days indoors at room temperature, or even about a week under ideal conditions.[210][211] On some surfaces, including cotton fabric and copper, the virus usually dies after a few hours.[210] The virus dies faster on porous surfaces than on non-porous surfaces due to capillary action within pores and faster aerosol droplet evaporation.[212][205][210] However, of the many surfaces tested, two with the longest survival times are N95 respirator masks and surgical masks, both of which are considered porous surfaces.[210]
The CDC says that in most situations, cleaning surfaces with soap or detergent, not disinfecting, is enough to reduce risk of transmission.[213][214] The CDC recommends that if a COVID‑19 case is suspected or confirmed at a facility such as an office or day care, all areas such as offices, bathrooms, common areas, shared electronic equipment like tablets, touch screens, keyboards, remote controls, and ATMs used by the ill persons should be disinfected.[215] Surfaces may be decontaminated with 62–71 per cent ethanol, 50–100 per cent isopropanol, 0.1 per cent sodium hypochlorite, 0.5 per cent hydrogen peroxide, 0.2–7.5 per cent povidone-iodine, or 50–200 ppm hypochlorous acid. Other solutions, such as benzalkonium chloride and chlorhexidine gluconate, are less effective. Ultraviolet germicidal irradiation may also be used,[190] although popular devices require 5–10 min exposure and may deteriorate some materials over time.[216] A datasheet comprising the authorised substances to disinfection in the food industry (including suspension or surface tested, kind of surface, use dilution, disinfectant and inocuylum volumes) can be seen in the supplementary material of.[206]
Self-isolation
Self-isolation at home has been recommended for those diagnosed with COVID‑19 and those who suspect they have been infected. Health agencies have issued detailed instructions for proper self-isolation.[217] Many governments have mandated or recommended self-quarantine for entire populations. The strongest self-quarantine instructions have been issued to those in high-risk groups.[218] Those who may have been exposed to someone with COVID‑19 and those who have recently travelled to a country or region with the widespread transmission have been advised to self-quarantine for 14 days from the time of last possible exposure.[219]
A 2021 Cochrane rapid review found that based upon low-certainty evidence, international travel-related control measures such as restricting cross-border travel may help to contain the spread of COVID‑19.[220] Additionally, symptom/exposure-based screening measures at borders may miss many positive cases.[220] While test-based border screening measures may be more effective, it could also miss many positive cases if only conducted upon arrival without follow-up. The review concluded that a minimum 10-day quarantine may be beneficial in preventing the spread of COVID‑19 and may be more effective if combined with an additional control measure like border screening.[220]
Treatment
An overview of COVID-19 therapeutics and drugs
Although several medications have been approved in different countries as of April 2022, not all countries have these medications. Patients with mild to moderate symptoms who are in the risk groups can take nirmatrelvir/ritonavir (marketed as Paxlovid) or remdesivir, either of which reduces the risk of serious illness or hospitalization.[221] In the US, the Biden Administration COVID-19 action plan includes the Test to Treat initiative, where people can go to a pharmacy, take a COVID test, and immediately receive free Paxlovid if they test positive.[222]
Highly effective vaccines have reduced mortality related to SARS-CoV-2; however, for those awaiting vaccination, as well as for the estimated millions of immunocompromised persons who are unlikely to respond robustly to vaccination, treatment remains important.[223] The cornerstone of management of COVID-19 has been supportive care, which includes treatment to relieve symptoms, fluid therapy, oxygen support and prone positioning as needed, and medications or devices to support other affected vital organs.[224][225][226]
Most cases of COVID-19 are mild. In these, supportive care includes medication such as paracetamol or NSAIDs to relieve symptoms (fever, body aches, cough), proper intake of fluids, rest, and nasal breathing.[227][228][229][230] Good personal hygiene and a healthy diet are also recommended.[231] As of April 2020 the U.S. Centers for Disease Control and Prevention (CDC) recommended that those who suspect they are carrying the virus isolate themselves at home and wear a face mask.[232]
As of November 2020 use of the glucocorticoid dexamethasone had been strongly recommended in those severe cases treated in hospital with low oxygen levels, to reduce the risk of death.[233][234][235] Noninvasive ventilation and, ultimately, admission to an intensive care unit for mechanical ventilation may be required to support breathing.[236] Extracorporeal membrane oxygenation (ECMO) has been used to address respiratory failure, but its benefits are still under consideration.[237][238] Some of the cases of severe disease course are caused by systemic hyper-inflammation, the so-called cytokine storm.[239]
Prognosis and risk factors
The severity of COVID‑19 varies. The disease may take a mild course with few or no symptoms, resembling other common upper respiratory diseases such as the common cold. In 3–4% of cases (7.4% for those over age 65) symptoms are severe enough to cause hospitalisation.[240] Mild cases typically recover within two weeks, while those with severe or critical diseases may take three to six weeks to recover. Among those who have died, the time from symptom onset to death has ranged from two to eight weeks.[80] The Italian Istituto Superiore di Sanità reported that the median time between the onset of symptoms and death was twelve days, with seven being hospitalised. However, people transferred to an ICU had a median time of ten days between hospitalisation and death.[241] Abnormal sodium levels during hospitalization with COVID-19 are associated with poor prognoses: high sodium with a greater risk of death, and low sodium with an increased chance of needing ventilator support.[242][243] Prolonged prothrombin time and elevated C-reactive protein levels on admission to the hospital are associated with severe course of COVID‑19 and with a transfer to ICU.[244][245]
Some early studies suggest 10% to 20% of people with COVID‑19 will experience symptoms lasting longer than a month.[246][247] A majority of those who were admitted to hospital with severe disease report long-term problems including fatigue and shortness of breath.[248] On 30 October 2020, WHO chief Tedros Adhanom warned that «to a significant number of people, the COVID virus poses a range of serious long-term effects.» He has described the vast spectrum of COVID‑19 symptoms that fluctuate over time as «really concerning». They range from fatigue, a cough and shortness of breath, to inflammation and injury of major organs – including the lungs and heart, and also neurological and psychologic effects. Symptoms often overlap and can affect any system in the body. Infected people have reported cyclical bouts of fatigue, headaches, months of complete exhaustion, mood swings, and other symptoms. Tedros therefore concluded that a strategy of achieving herd immunity by infection, rather than vaccination, is «morally unconscionable and unfeasible».[249]
In terms of hospital readmissions about 9% of 106,000 individuals had to return for hospital treatment within two months of discharge. The average to readmit was eight days since first hospital visit. There are several risk factors that have been identified as being a cause of multiple admissions to a hospital facility. Among these are advanced age (above 65 years of age) and presence of a chronic condition such as diabetes, COPD, heart failure or chronic kidney disease.[250][251]
According to scientific reviews smokers are more likely to require intensive care or die compared to non-smokers.[252][253] Acting on the same ACE2 pulmonary receptors affected by smoking, air pollution has been correlated with the disease.[253] Short term[254] and chronic[255] exposure to air pollution seems to enhance morbidity and mortality from COVID‑19.[256][257][258] Pre-existing heart and lung diseases[259] and also obesity, especially in conjunction with fatty liver disease, contributes to an increased health risk of COVID‑19.[253][260][261][262]
It is also assumed that those that are immunocompromised are at higher risk of getting severely sick from SARS-CoV-2.[263] One research study that looked into the COVID‑19 infections in hospitalised kidney transplant recipients found a mortality rate of 11%.[264]
Men with untreated hypogonadism were 2.4 times more likely than men with eugonadism to be hospitalized if they contracted COVID-19; Hypogonad men treated with testosterone were less likely to be hospitalized for COVID-19 than men who were not treated for hypogonadism.[265]
Genetic risk factors
Genetics plays an important role in the ability to fight off Covid.[266] For instance, those that do not produce detectable type I interferons or produce auto-antibodies against these may get much sicker from COVID‑19.[267][268] Genetic screening is able to detect interferon effector genes.[269] Some genetic variants are risk factors in specific populations. For instance, and allele of the DOCK2 gene (dedicator of cytokinesis 2 gene) is a common risk factor in Asian populations but much less common in Europe. The mutation leads to lower expression of DOCK2 especially in younger patients with severe Covid.[270] In fact, many other genes and genetic variants have been found that determine the outcome of SARS-CoV-2 infections.[271]
Children
While very young children have experienced lower rates of infection, older children have a rate of infection that is similar to the population as a whole.[272][273] Children are likely to have milder symptoms and are at lower risk of severe disease than adults.[274] The CDC reports that in the US roughly a third of hospitalised children were admitted to the ICU,[275] while a European multinational study of hospitalised children from June 2020, found that about 8% of children admitted to a hospital needed intensive care.[276] Four of the 582 children (0.7%) in the European study died, but the actual mortality rate may be «substantially lower» since milder cases that did not seek medical help were not included in the study.[277][278]
Complications
Complications may include pneumonia, acute respiratory distress syndrome (ARDS), multi-organ failure, septic shock, and death.[279][280][281][282] Cardiovascular complications may include heart failure, arrhythmias (including atrial fibrillation), heart inflammation, and thrombosis, particularly venous thromboembolism.[283][284][285][286][287][288] Approximately 20–30% of people who present with COVID‑19 have elevated liver enzymes, reflecting liver injury.[289][172]
Neurologic manifestations include seizure, stroke, encephalitis, and Guillain–Barré syndrome (which includes loss of motor functions).[290][291] Following the infection, children may develop paediatric multisystem inflammatory syndrome, which has symptoms similar to Kawasaki disease, which can be fatal.[292][293] In very rare cases, acute encephalopathy can occur, and it can be considered in those who have been diagnosed with COVID‑19 and have an altered mental status.[294]
In the case of pregnant women, it is important to note that, according to the US Centers for Disease Control and Prevention, pregnant women are at increased risk of becoming seriously ill from COVID‑19.[295] This is because pregnant women with COVID‑19 appear to be more likely to develop respiratory and obstetric complications that can lead to miscarriage, premature delivery and intrauterine growth restriction.[295]
Fungal infections such as aspergillosis, candidiasis, cryptococcosis and mucormycosis have been recorded in patients recovering from COVID‑19.[296][297]
Longer-term effects
Some early studies suggest that 10–20% of people with COVID‑19 will experience symptoms lasting longer than a month.[298][247] A majority of those who were admitted to hospital with severe disease report long-term problems, including fatigue and shortness of breath.[299] About 5–10% of patients admitted to hospital progress to severe or critical disease, including pneumonia and acute respiratory failure.[300]
By a variety of mechanisms, the lungs are the organs most affected in COVID‑19.[301] In people requiring hospital admission, up to 98% of CT scans performed show lung abnormalities after 28 days of illness even if they had clinically improved.[302]
People with advanced age, severe disease, prolonged ICU stays, or who smoke are more likely to have long-lasting effects, including pulmonary fibrosis.[303] Overall, approximately one-third of those investigated after four weeks will have findings of pulmonary fibrosis or reduced lung function as measured by DLCO, even in asymptomatic people, but with the suggestion of continuing improvement with the passing of more time.[301] After severe disease, lung function can take anywhere from three months to a year or more to return to previous levels.[304]
The risks of cognitive deficit, dementia, psychotic disorders, and epilepsy or seizures persists at an increased level two years after infection.[305]
Immunity
The immune response by humans to SARS-CoV-2 virus occurs as a combination of the cell-mediated immunity and antibody production,[306] just as with most other infections.[307] B cells interact with T cells and begin dividing before selection into the plasma cell, partly on the basis of their affinity for antigen.[308] Since SARS-CoV-2 has been in the human population only since December 2019, it remains unknown if the immunity is long-lasting in people who recover from the disease.[309] The presence of neutralising antibodies in blood strongly correlates with protection from infection, but the level of neutralising antibody declines with time. Those with asymptomatic or mild disease had undetectable levels of neutralising antibody two months after infection. In another study, the level of neutralising antibodies fell four-fold one to four months after the onset of symptoms. However, the lack of antibodies in the blood does not mean antibodies will not be rapidly produced upon reexposure to SARS-CoV-2. Memory B cells specific for the spike and nucleocapsid proteins of SARS-CoV-2 last for at least six months after the appearance of symptoms.[309]
As of August 2021, reinfection with COVID‑19 was possible but uncommon. The first case of reinfection was documented in August 2020.[310] A systematic review found 17 cases of confirmed reinfection in medical literature as of May 2021.[310] With the Omicron variant, as of 2022, reinfections have become common, albeit it is unclear how common.[311] COVID-19 reinfections are thought to likely be less severe than primary infections, especially if one was previously infected by the same variant.[311][additional citation(s) needed]
Mortality
Several measures are commonly used to quantify mortality.[312] These numbers vary by region and over time and are influenced by the volume of testing, healthcare system quality, treatment options, time since the initial outbreak, and population characteristics such as age, sex, and overall health.[313]
The mortality rate reflects the number of deaths within a specific demographic group divided by the population of that demographic group. Consequently, the mortality rate reflects the prevalence as well as the severity of the disease within a given population. Mortality rates are highly correlated to age, with relatively low rates for young people and relatively high rates among the elderly.[314][315][316] In fact, one relevant factor of mortality rates is the age structure of the countries’ populations. For example, the case fatality rate for COVID‑19 is lower in India than in the US since India’s younger population represents a larger percentage than in the US.[317]
Case fatality rate
The case fatality rate (CFR) reflects the number of deaths divided by the number of diagnosed cases within a given time interval. Based on Johns Hopkins University statistics, the global death-to-case ratio is 1.01% (6,707,311/664,338,243) as of 9 January 2023.[6] The number varies by region.[318][319]
-
Total confirmed cases over time
-
Total confirmed cases of COVID‑19 per million people[320]
-
Total deaths over time
-
Total confirmed deaths due to COVID‑19 per million people[321]
Infection fatality rate
A key metric in gauging the severity of COVID‑19 is the infection fatality rate (IFR), also referred to as the infection fatality ratio or infection fatality risk.[322][323][324] This metric is calculated by dividing the total number of deaths from the disease by the total number of infected individuals; hence, in contrast to the CFR, the IFR incorporates asymptomatic and undiagnosed infections as well as reported cases.[325]
Estimates
The red line shows the estimate of infection fatality rate (IFR), in percentage terms, as a function of age. The shaded region depicts the 95% confidence interval for that estimate. Markers denotes specific observations used in the meta-analysis.[326]
The same relationship plotted on a log scale
A December 2020 systematic review and meta-analysis estimated that population IFR during the first wave of the pandemic was about 0.5% to 1% in many locations (including France, Netherlands, New Zealand, and Portugal), 1% to 2% in other locations (Australia, England, Lithuania, and Spain), and exceeded 2% in Italy.[326] That study also found that most of these differences in IFR reflected corresponding differences in the age composition of the population and age-specific infection rates; in particular, the metaregression estimate of IFR is very low for children and younger adults (e.g., 0.002% at age 10 and 0.01% at age 25) but increases progressively to 0.4% at age 55, 1.4% at age 65, 4.6% at age 75, and 15% at age 85.[326] These results were also highlighted in a December 2020 report issued by the WHO.[327]
| Age group | IFR |
|---|---|
| 0–34 | 0.004% |
| 35–44 | 0.068% |
| 45–54 | 0.23% |
| 55–64 | 0.75% |
| 65–74 | 2.5% |
| 75–84 | 8.5% |
| 85 + | 28.3% |
An analysis of those IFR rates indicates that COVID‑19 is hazardous not only for the elderly but also for middle-aged adults, for whom the infection fatality rate of COVID-19 is two orders of magnitude greater than the annualised risk of a fatal automobile accident and far more dangerous than seasonal influenza.[326]
Earlier estimates of IFR
At an early stage of the pandemic, the World Health Organization reported estimates of IFR between 0.3% and 1%.[328][329] On 2 July, The WHO’s chief scientist reported that the average IFR estimate presented at a two-day WHO expert forum was about 0.6%.[330][331] In August, the WHO found that studies incorporating data from broad serology testing in Europe showed IFR estimates converging at approximately 0.5–1%.[332] Firm lower limits of IFRs have been established in a number of locations such as New York City and Bergamo in Italy since the IFR cannot be less than the population fatality rate. (After sufficient time however, people can get reinfected).[333] As of 10 July, in New York City, with a population of 8.4 million, 23,377 individuals (18,758 confirmed and 4,619 probable) have died with COVID‑19 (0.3% of the population).[334] Antibody testing in New York City suggested an IFR of ≈0.9%,[335] and ≈1.4%.[336] In Bergamo province, 0.6% of the population has died.[337] In September 2020, the U.S. Centers for Disease Control and Prevention (CDC) reported preliminary estimates of age-specific IFRs for public health planning purposes.[338]
Sex differences
| Percentage of infected people who are hospitalised | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 0–19 | 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | 70–79 | 80+ | Total | |
| Female | 0.1 (0.07–0.2) |
0.5 (0.3–0.8) |
0.9 (0.5–1.5) |
1.3 (0.7–2.1) |
2.6 (1.5–4.2) |
5.1 (2.9–8.3) |
7.8 (4.4–12.8) |
19.3 (10.9–31.6) |
2.6 (1.5–4.3) |
| Male | 0.2 (0.08–0.2) |
0.6 (0.3–0.9) |
1.2 (0.7–1.9) |
1.6 (0.9–2.6) |
3.2 (1.8–5.2) |
6.7 (3.7–10.9) |
11.0 (6.2–17.9) |
37.6 (21.1–61.3) |
3.3 (1.8–5.3) |
| Total | 0.1 (0.08–0.2) |
0.5 (0.3–0.8) |
1.1 (0.6–1.7) |
1.4 (0.8–2.3) |
2.9 (1.6–4.7) |
5.8 (3.3–9.5) |
9.3 (5.2–15.1) |
26.2 (14.8–42.7) |
2.9 (1.7–4.8) |
| Percentage of hospitalised people who go to Intensive Care Unit | |||||||||
| 0–19 | 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | 70–79 | 80+ | Total | |
| Female | 16.7 (14.3–19.3) |
8.7 (7.5–9.9) |
11.9 (10.9–13.0) |
16.6 (15.6–17.7) |
20.7 (19.8–21.6) |
23.1 (22.2–24.0) |
18.7 (18.0–19.5) |
4.2 (4.0–4.5) |
14.3 (13.9–14.7) |
| Male | 26.9 (23.1–31.1) |
14.0 (12.2–16.0) |
19.2 (17.6–20.9) |
26.9 (25.4–28.4) |
33.4 (32.0–34.8) |
37.3 (36.0–38.6) |
30.2 (29.1–31.3) |
6.8 (6.5–7.2) |
23.1 (22.6–23.6) |
| Total | 22.2 (19.1–25.7) |
11.6 (10.1–13.2) |
15.9 (14.5–17.3) |
22.2 (21.0–23.5) |
27.6 (26.5–28.7) |
30.8 (29.8–31.8) |
24.9 (24.1–25.8) |
5.6 (5.3–5.9) |
19.0 (18.7–19.44) |
| Percent of hospitalised people who die | |||||||||
| 0–19 | 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | 70–79 | 80+ | Total | |
| Female | 0.5 (0.2–1.0) |
0.9 (0.5–1.3) |
1.5 (1.2–1.9) |
2.6 (2.3–3.0) |
5.2 (4.8–5.6) |
10.1 (9.5–10.6) |
16.7 (16.0–17.4) |
25.2 (24.4–26.0) |
14.4 (14.0–14.8) |
| Male | 0.7 (0.3–1.5) |
1.3 (0.8–1.9) |
2.2 (1.7–2.7) |
3.8 (3.3–4.4) |
7.6 (7.0–8.2) |
14.8 (14.1–15.6) |
24.6 (23.7–25.6) |
37.1 (36.1–38.2) |
21.2 (20.8–21.7) |
| Total | 0.6 (0.2–1.3) |
1.1 (0.7–1.6) |
1.9 (1.5–2.3) |
3.3 (2.9–3.8) |
6.5 (6.0–7.0) |
12.6 (12.0–13.2) |
21.0 (20.3–21.7) |
31.6 (30.9–32.4) |
18.1 (17.8–18.4) |
| Percent of infected people who die – infection fatality rate (IFR) | |||||||||
| 0–19 | 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | 70–79 | 80+ | Total | |
| Female | 0.001 (<0.001–0.002) |
0.004 (0.002–0.007) |
0.01 (0.007–0.02) |
0.03 (0.02–0.06) |
0.1 (0.08–0.2) |
0.5 (0.3–0.8) |
1.3 (0.7–2.1) |
4.9 (2.7–8.0) |
0.4 (0.2–0.6) |
| Male | 0.001 (<0.001–0.003) |
0.007 (0.003–0.01) |
0.03 (0.02–0.05) |
0.06 (0.03–0.1) |
0.2 (0.1–0.4) |
1.0 (0.6–1.6) |
2.7 (1.5–1.4) |
14.0 (7.9–22.7) |
0.7 (0.4–1.1) |
| Total | 0.001 (<0.001–0.002) |
0.005 (0.003–0.01) |
0.02 (0.01–0.03) |
0.05 (0.03–0.08) |
0.2 (0.1–0.3) |
0.7 (0.4–1.2) |
1.9 (1.1–3.2) |
8.3 (4.7–13.5) |
0.5 (0.3–0.9) |
| Numbers in parentheses are 95% credible intervals for the estimates. |
COVID‑19 case fatality rates are higher among men than women in most countries. However, in a few countries like India, Nepal, Vietnam, and Slovenia the fatality cases are higher in women than men.[317] Globally, men are more likely to be admitted to the ICU and more likely to die.[340][341] One meta-analysis found that globally, men were more likely to get COVID‑19 than women; there were approximately 55 men and 45 women per 100 infections (CI: 51.43–56.58).[342]
The Chinese Center for Disease Control and Prevention reported the death rate was 2.8% for men and 1.7% for women.[343] Later reviews in June 2020 indicated that there is no significant difference in susceptibility or in CFR between genders.[344][345] One review acknowledges the different mortality rates in Chinese men, suggesting that it may be attributable to lifestyle choices such as smoking and drinking alcohol rather than genetic factors.[346] Smoking, which in some countries like China is mainly a male activity, is a habit that contributes to increasing significantly the case fatality rates among men.[317] Sex-based immunological differences, lesser prevalence of smoking in women and men developing co-morbid conditions such as hypertension at a younger age than women could have contributed to the higher mortality in men.[347] In Europe as of February 2020, 57% of the infected people were men and 72% of those died with COVID‑19 were men.[348] As of April 2020, the US government is not tracking sex-related data of COVID‑19 infections.[349] Research has shown that viral illnesses like Ebola, HIV, influenza and SARS affect men and women differently.[349]
Ethnic differences
In the US, a greater proportion of deaths due to COVID‑19 have occurred among African Americans and other minority groups.[350] Structural factors that prevent them from practising social distancing include their concentration in crowded substandard housing and in «essential» occupations such as retail grocery workers, public transit employees, health-care workers and custodial staff. Greater prevalence of lacking health insurance and care of underlying conditions such as diabetes,[351] hypertension, and heart disease also increase their risk of death.[352] Similar issues affect Native American and Latino communities.[350] On the one hand, in the Dominican Republic there is a clear example of both gender and ethnic inequality. In this Latin American territory, there is great inequality and precariousness that especially affects Dominican women, with greater emphasis on those of Haitian descent.[353] According to a US health policy non-profit, 34% of American Indian and Alaska Native People (AIAN) non-elderly adults are at risk of serious illness compared to 21% of white non-elderly adults.[354] The source attributes it to disproportionately high rates of many health conditions that may put them at higher risk as well as living conditions like lack of access to clean water.[355]
Leaders have called for efforts to research and address the disparities.[356] In the UK, a greater proportion of deaths due to COVID‑19 have occurred in those of a Black, Asian, and other ethnic minority background.[357][358][359] More severe impacts upon patients including the relative incidence of the necessity of hospitalisation requirements, and vulnerability to the disease has been associated via DNA analysis to be expressed in genetic variants at chromosomal region 3, features that are associated with European Neanderthal heritage. That structure imposes greater risks that those affected will develop a more severe form of the disease.[360] The findings are from Professor Svante Pääbo and researchers he leads at the Max Planck Institute for Evolutionary Anthropology and the Karolinska Institutet.[360] This admixture of modern human and Neanderthal genes is estimated to have occurred roughly between 50,000 and 60,000 years ago in Southern Europe.[360]
Comorbidities
Biological factors (immune response) and the general behaviour (habits) can strongly determine the consequences of COVID‑19.[317] Most of those who die of COVID‑19 have pre-existing (underlying) conditions, including hypertension, diabetes mellitus,[351] and cardiovascular disease.[361] According to March data from the United States, 89% of those hospitalised had preexisting conditions.[362] The Italian Istituto Superiore di Sanità reported that out of 8.8% of deaths where medical charts were available, 96.1% of people had at least one comorbidity with the average person having 3.4 diseases.[241] According to this report the most common comorbidities are hypertension (66% of deaths), type 2 diabetes (29.8% of deaths), ischaemic heart disease (27.6% of deaths), atrial fibrillation (23.1% of deaths) and chronic renal failure (20.2% of deaths).
Most critical respiratory comorbidities according to the US Centers for Disease Control and Prevention (CDC), are: moderate or severe asthma, pre-existing COPD, pulmonary fibrosis, cystic fibrosis.[363] Evidence stemming from meta-analysis of several smaller research papers also suggests that smoking can be associated with worse outcomes.[364][365] When someone with existing respiratory problems is infected with COVID‑19, they might be at greater risk for severe symptoms.[366] COVID‑19 also poses a greater risk to people who misuse opioids and amphetamines, insofar as their drug use may have caused lung damage.[367]
In August 2020, the CDC issued a caution that tuberculosis (TB) infections could increase the risk of severe illness or death. The WHO recommended that people with respiratory symptoms be screened for both diseases, as testing positive for COVID‑19 could not rule out co-infections. Some projections have estimated that reduced TB detection due to the pandemic could result in 6.3 million additional TB cases and 1.4 million TB-related deaths by 2025.[368]
History
The virus is thought to be of natural animal origin, most likely through spillover infection.[77][369][370] A joint-study conducted in early 2021 by the People’s Republic of China and the World Health Organization indicated that the virus descended from a coronavirus that infects wild bats, and likely spread to humans through an intermediary wildlife host.[371] There are several theories about where the index case originated and investigations into the origin of the pandemic are ongoing.[372] According to articles published in July 2022 in Science, virus transmission into humans occurred through two spillover events in November 2019 and was likely due to live wildlife trade on the Huanan wet market in the city of Wuhan (Hubei, China).[373][374][375] Doubts about the conclusions have mostly centred on the precise site of spillover.[376] Earlier phylogenetics estimated that SARS-CoV-2 arose in October or November 2019.[377][378][379] A phylogenetic algorithm analysis suggested that the virus may have been circulating in Guangdong before Wuhan.[380] U.S intelligence agencies and other scientists have found that the virus may have been unintentionally leaked from a laboratory such as the Wuhan Institute of Virology, but that it was not developed as a biological weapon and is unlikely to have been genetically engineered.[381][382][383][384]
The first confirmed human infections were in Wuhan. A study of the first 41 cases of confirmed COVID‑19, published in January 2020 in The Lancet, reported the earliest date of onset of symptoms as 1 December 2019.[385][386][387] Official publications from the WHO reported the earliest onset of symptoms as 8 December 2019.[388] Human-to-human transmission was confirmed by the WHO and Chinese authorities by 20 January 2020.[389][390] According to official Chinese sources, these were mostly linked to the Huanan Seafood Wholesale Market, which also sold live animals.[391] In May 2020, George Gao, the director of the CDC, said animal samples collected from the seafood market had tested negative for the virus, indicating that the market was the site of an early superspreading event, but that it was not the site of the initial outbreak.[392] Traces of the virus have been found in wastewater samples that were collected in Milan and Turin, Italy, on 18 December 2019.[393]
By December 2019, the spread of infection was almost entirely driven by human-to-human transmission.[343][394] The number of COVID-19 cases in Hubei gradually increased, reaching sixty by 20 December,[395] and at least 266 by 31 December.[396] On 24 December, Wuhan Central Hospital sent a bronchoalveolar lavage fluid (BAL) sample from an unresolved clinical case to sequencing company Vision Medicals. On 27 and 28 December, Vision Medicals informed the Wuhan Central Hospital and the Chinese CDC of the results of the test, showing a new coronavirus.[397] A pneumonia cluster of unknown cause was observed on 26 December and treated by the doctor Zhang Jixian in Hubei Provincial Hospital, who informed the Wuhan Jianghan CDC on 27 December.[398] On 30 December, a test report addressed to Wuhan Central Hospital, from company CapitalBio Medlab, stated an erroneous positive result for SARS, causing a group of doctors at Wuhan Central Hospital to alert their colleagues and relevant hospital authorities of the result. The Wuhan Municipal Health Commission issued a notice to various medical institutions on «the treatment of pneumonia of unknown cause» that same evening.[399] Eight of these doctors, including Li Wenliang (punished on 3 January),[400] were later admonished by the police for spreading false rumours and another, Ai Fen, was reprimanded by her superiors for raising the alarm.[401]
The Wuhan Municipal Health Commission made the first public announcement of a pneumonia outbreak of unknown cause on 31 December, confirming 27 cases[402][403][404] – enough to trigger an investigation.[405]
During the early stages of the outbreak, the number of cases doubled approximately every seven and a half days.[406] In early and mid-January 2020, the virus spread to other Chinese provinces, helped by the Chinese New Year migration and Wuhan being a transport hub and major rail interchange.[80] On 20 January, China reported nearly 140 new cases in one day, including two people in Beijing and one in Shenzhen.[407] Later official data shows 6,174 people had already developed symptoms by then,[343] and more may have been infected.[408] A report in The Lancet on 24 January indicated human transmission, strongly recommended personal protective equipment for health workers, and said testing for the virus was essential due to its «pandemic potential».[113][409] On 30 January, the WHO declared COVID-19 a Public Health Emergency of International Concern.[408] By this time, the outbreak spread by a factor of 100 to 200 times.[410]
Italy had its first confirmed cases on 31 January 2020, two tourists from China.[411] Italy overtook China as the country with the most deaths on 19 March 2020.[412] By 26 March the United States had overtaken China and Italy with the highest number of confirmed cases in the world.[413] Research on coronavirus genomes indicates the majority of COVID-19 cases in New York came from European travellers, rather than directly from China or any other Asian country.[414] Retesting of prior samples found a person in France who had the virus on 27 December 2019,[415][416] and a person in the United States who died from the disease on 6 February 2020.[417]
RT-PCR testing of untreated wastewater samples from Brazil and Italy have suggested detection of SARS-CoV-2 as early as November and December 2019, respectively, but the methods of such sewage studies have not been optimised, many have not been peer-reviewed, details are often missing, and there is a risk of false positives due to contamination or if only one gene target is detected.[418] A September 2020 review journal article said, «The possibility that the COVID‑19 infection had already spread to Europe at the end of last year is now indicated by abundant, even if partially circumstantial, evidence,» including pneumonia case numbers and radiology in France and Italy in November and December.[419]
As of 1 October 2021, Reuters reported that it had estimated the worldwide total number of deaths due to COVID‑19 to have exceeded five million.[420]
Misinformation
After the initial outbreak of COVID‑19, misinformation and disinformation regarding the origin, scale, prevention, treatment, and other aspects of the disease rapidly spread online.[421][422][423]
In September 2020, the US Centers for Disease Control and Prevention (CDC) published preliminary estimates of the risk of death by age groups in the United States, but those estimates were widely misreported and misunderstood.[424][425]
Other species
Humans appear to be capable of spreading the virus to some other animals, a type of disease transmission referred to as zooanthroponosis.
Some pets, especially cats and ferrets, can catch this virus from infected humans.[426][427] Symptoms in cats include respiratory (such as a cough) and digestive symptoms.[426] Cats can spread the virus to other cats, and may be able to spread the virus to humans, but cat-to-human transmission of SARS-CoV-2 has not been proven.[426][428] Compared to cats, dogs are less susceptible to this infection.[428] Behaviours which increase the risk of transmission include kissing, licking, and petting the animal.[428]
The virus does not appear to be able to infect pigs, ducks, or chickens at all.[426] Mice, rats, and rabbits, if they can be infected at all, are unlikely to be involved in spreading the virus.[428]
Tigers and lions in zoos have become infected as a result of contact with infected humans.[428] As expected, monkeys and great ape species such as orangutans can also be infected with the COVID‑19 virus.[428]
Minks, which are in the same family as ferrets, have been infected.[428] Minks may be asymptomatic, and can also spread the virus to humans.[428] Multiple countries have identified infected animals in mink farms.[429] Denmark, a major producer of mink pelts, ordered the slaughter of all minks over fears of viral mutations,[429] following an outbreak referred to as Cluster 5. A vaccine for mink and other animals is being researched.[429]
Research
International research on vaccines and medicines in COVID‑19 is underway by government organisations, academic groups, and industry researchers.[430][431] The CDC has classified it to require a BSL3 grade laboratory.[432] There has been a great deal of COVID‑19 research, involving accelerated research processes and publishing shortcuts to meet the global demand.[433]
As of December 2020, hundreds of clinical trials have been undertaken, with research happening on every continent except Antarctica.[434] As of November 2020, more than 200 possible treatments have been studied in humans.[435]
Transmission and prevention research
Modelling research has been conducted with several objectives, including predictions of the dynamics of transmission,[436] diagnosis and prognosis of infection,[437] estimation of the impact of interventions,[438][439] or allocation of resources.[440] Modelling studies are mostly based on compartmental models in epidemiology,[441] estimating the number of infected people over time under given conditions. Several other types of models have been developed and used during the COVID‑19 including computational fluid dynamics models to study the flow physics of COVID‑19,[442] retrofits of crowd movement models to study occupant exposure,[443] mobility-data based models to investigate transmission,[444] or the use of macroeconomic models to assess the economic impact of the pandemic.[445] Further, conceptual frameworks from crisis management research have been applied to better understand the effects of COVID‑19 on organisations worldwide.[446][447]
Seven possible drug targets in viral replication process and drugs
Repurposed antiviral drugs make up most of the research into COVID‑19 treatments.[448][449] Other candidates in trials include vasodilators, corticosteroids, immune therapies, lipoic acid, bevacizumab, and recombinant angiotensin-converting enzyme 2.[449]
In March 2020, the World Health Organization (WHO) initiated the Solidarity trial to assess the treatment effects of some promising drugs: an experimental drug called remdesivir; anti-malarial drugs chloroquine and hydroxychloroquine; two anti-HIV drugs, lopinavir/ritonavir; and interferon-beta.[450][451] More than 300 active clinical trials are underway as of April 2020.[172]
Research on the antimalarial drugs hydroxychloroquine and chloroquine showed that they were ineffective at best,[452][453] and that they may reduce the antiviral activity of remdesivir.[454] By May 2020, France, Italy, and Belgium had banned the use of hydroxychloroquine as a COVID‑19 treatment.[455]
In June, initial results from the randomised RECOVERY Trial in the United Kingdom showed that dexamethasone reduced mortality by one third for people who are critically ill on ventilators and one fifth for those receiving supplemental oxygen.[456] Because this is a well-tested and widely available treatment, it was welcomed by the WHO, which is in the process of updating treatment guidelines to include dexamethasone and other steroids.[457][458] Based on those preliminary results, dexamethasone treatment has been recommended by the NIH for patients with COVID‑19 who are mechanically ventilated or who require supplemental oxygen but not in patients with COVID‑19 who do not require supplemental oxygen.[459]
In September 2020, the WHO released updated guidance on using corticosteroids for COVID‑19.[460][461] The WHO recommends systemic corticosteroids rather than no systemic corticosteroids for the treatment of people with severe and critical COVID‑19 (strong recommendation, based on moderate certainty evidence).[460] The WHO suggests not to use corticosteroids in the treatment of people with non-severe COVID‑19 (conditional recommendation, based on low certainty evidence).[460] The updated guidance was based on a meta-analysis of clinical trials of critically ill COVID‑19 patients.[462][463]
In September 2020, the European Medicines Agency (EMA) endorsed the use of dexamethasone in adults and adolescents from twelve years of age and weighing at least 40 kilograms (88 lb) who require supplemental oxygen therapy.[464][465] Dexamethasone can be taken by mouth or given as an injection or infusion (drip) into a vein.[464]
In November 2020, the US Food and Drug Administration (FDA) issued an emergency use authorization for the investigational monoclonal antibody therapy bamlanivimab for the treatment of mild-to-moderate COVID‑19.[466] Bamlanivimab is authorised for people with positive results of direct SARS-CoV-2 viral testing who are twelve years of age and older weighing at least 40 kilograms (88 lb), and who are at high risk for progressing to severe COVID‑19 or hospitalisation.[466] This includes those who are 65 years of age or older, or who have chronic medical conditions.[466]
In February 2021, the FDA issued an emergency use authorization (EUA) for bamlanivimab and etesevimab administered together for the treatment of mild to moderate COVID‑19 in people twelve years of age or older weighing at least 40 kilograms (88 lb) who test positive for SARS‑CoV‑2 and who are at high risk for progressing to severe COVID‑19. The authorised use includes treatment for those who are 65 years of age or older or who have certain chronic medical conditions.[467]
In April 2021, the FDA revoked the emergency use authorization (EUA) that allowed for the investigational monoclonal antibody therapy bamlanivimab, when administered alone, to be used for the treatment of mild-to-moderate COVID‑19 in adults and certain paediatric patients.[468]
Cytokine storm
Various therapeutic strategies for targeting cytokine storm
A cytokine storm can be a complication in the later stages of severe COVID‑19. A cytokine storm is a potentially deadly immune reaction where a large amount of pro-inflammatory cytokines and chemokines are released too quickly. A cytokine storm can lead to ARDS and multiple organ failure.[469] Data collected from Jin Yin-tan Hospital in Wuhan, China indicates that patients who had more severe responses to COVID‑19 had greater amounts of pro-inflammatory cytokines and chemokines in their system than patients who had milder responses. These high levels of pro-inflammatory cytokines and chemokines indicate presence of a cytokine storm.[470]
Tocilizumab has been included in treatment guidelines by China’s National Health Commission after a small study was completed.[471][472] It is undergoing a Phase II non-randomised trial at the national level in Italy after showing positive results in people with severe disease.[473][474] Combined with a serum ferritin blood test to identify a cytokine storm (also called cytokine storm syndrome, not to be confused with cytokine release syndrome), it is meant to counter such developments, which are thought to be the cause of death in some affected people.[475] The interleukin-6 receptor (IL-6R) antagonist was approved by the FDA to undergo a Phase III clinical trial assessing its effectiveness on COVID‑19 based on retrospective case studies for the treatment of steroid-refractory cytokine release syndrome induced by a different cause, CAR T cell therapy, in 2017.[476] There is no randomised, controlled evidence that tocilizumab is an efficacious treatment for CRS. Prophylactic tocilizumab has been shown to increase serum IL-6 levels by saturating the IL-6R, driving IL-6 across the blood–brain barrier, and exacerbating neurotoxicity while having no effect on the incidence of CRS.[477]
Lenzilumab, an anti-GM-CSF monoclonal antibody, is protective in murine models for CAR T cell-induced CRS and neurotoxicity and is a viable therapeutic option due to the observed increase of pathogenic GM-CSF secreting T cells in hospitalised patients with COVID‑19.[478]
Passive antibodies
Transferring purified and concentrated antibodies produced by the immune systems of those who have recovered from COVID‑19 to people who need them is being investigated as a non-vaccine method of passive immunisation.[479][480] Viral neutralisation is the anticipated mechanism of action by which passive antibody therapy can mediate defence against SARS-CoV-2. The spike protein of SARS-CoV-2 is the primary target for neutralising antibodies.[481] As of 8 August 2020, eight neutralising antibodies targeting the spike protein of SARS-CoV-2 have entered clinical studies.[482] It has been proposed that selection of broad-neutralising antibodies against SARS-CoV-2 and SARS-CoV might be useful for treating not only COVID‑19 but also future SARS-related CoV infections.[481] Other mechanisms, however, such as antibody-dependant cellular cytotoxicity or phagocytosis, may be possible.[479] Other forms of passive antibody therapy, for example, using manufactured monoclonal antibodies, are in development.[479]
The use of passive antibodies to treat people with active COVID‑19 is also being studied. This involves the production of convalescent serum, which consists of the liquid portion of the blood from people who recovered from the infection and contains antibodies specific to this virus, which is then administered to active patients.[479] This strategy was tried for SARS with inconclusive results.[479] An updated Cochrane review in May 2021 found high certainty evidence that, for the treatment of people with moderate to severe COVID‑19, convalescent plasma did not reduce mortality or bring about symptom improvement.[480] There continues to be uncertainty about the safety of convalescent plasma administration to people with COVID‑19 and differing outcomes measured in different studies limits their use in determining efficacy.[480]
Bioethics
Since the outbreak of the COVID‑19 pandemic, scholars have explored the bioethics, normative economics, and political theories of healthcare policies related to the public health crisis.[483] Academics have pointed to the moral distress of healthcare workers, ethics of distributing scarce healthcare resources such as ventilators,[484] and the global justice of vaccine diplomacies.[citation needed] The socio-economic inequalities between genders,[485] races,[486] groups with disabilities,[487] communities,[488] regions, countries,[489] and continents have also drawn attention in academia and the general public.
Effects on other diseases
The use of social distancing and the wearing of surgical masks and similar precautions against COVID‑19 may have caused a drop in the spread of the common cold and the flu.[490][491]
See also
- Coronavirus diseases, a group of closely related syndromes
- Disease X, a WHO term
- Law of declining virulence – Disproved hypothesis of epidemiologist Theobald Smith
- Theory of virulence – Theory by biologist Paul W. Ewald
References
- ^ «Covid-19». Oxford English Dictionary (Online ed.). Oxford University Press. April 2020. Retrieved 15 April 2020. (Subscription or participating institution membership required.)
- ^ «Symptoms of Coronavirus». U.S. Centers for Disease Control and Prevention (CDC). 13 May 2020. Archived from the original on 17 June 2020. Retrieved 18 June 2020.
- ^ «Q&A on coronaviruses (COVID-19)». World Health Organization (WHO). 17 April 2020. Archived from the original on 14 May 2020. Retrieved 14 May 2020.
- ^ «COVID-19 vaccines». World Health Organization (WHO). Retrieved 3 March 2021.
- ^ Talic S, Shah S, Wild H, Gasevic D, Maharaj A, Ademi Z, et al. (November 2021). «Effectiveness of public health measures in reducing the incidence of covid-19, SARS-CoV-2 transmission, and covid-19 mortality: systematic review and meta-analysis». BMJ (Clinical Research Ed.). 375: e068302. doi:10.1136/bmj-2021-068302. ISSN 1756-1833. PMC 9423125. PMID 34789505. S2CID 244271780.
- ^ a b c «COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU)». ArcGIS. Johns Hopkins University. Retrieved 9 January 2023.
- ^ Page J, Hinshaw D, McKay B (26 February 2021). «In Hunt for Covid-19 Origin, Patient Zero Points to Second Wuhan Market – The man with the first confirmed infection of the new coronavirus told the WHO team that his parents had shopped there». The Wall Street Journal. Retrieved 27 February 2021.
- ^ Islam MA (April 2021). «Prevalence and characteristics of fever in adult and paediatric patients with coronavirus disease 2019 (COVID-19): A systematic review and meta-analysis of 17515 patients». PLOS ONE. 16 (4): e0249788. Bibcode:2021PLoSO..1649788I. doi:10.1371/journal.pone.0249788. PMC 8023501. PMID 33822812.
- ^ Islam MA (November 2020). «Prevalence of Headache in Patients With Coronavirus Disease 2019 (COVID-19): A Systematic Review and Meta-Analysis of 14,275 Patients». Frontiers in Neurology. 11: 562634. doi:10.3389/fneur.2020.562634. PMC 7728918. PMID 33329305.
- ^ Saniasiaya J, Islam MA (April 2021). «Prevalence of Olfactory Dysfunction in Coronavirus Disease 2019 (COVID-19): A Meta-analysis of 27,492 Patients». The Laryngoscope. 131 (4): 865–878. doi:10.1002/lary.29286. ISSN 0023-852X. PMC 7753439. PMID 33219539.
- ^ Saniasiaya J, Islam MA (November 2020). «Prevalence and Characteristics of Taste Disorders in Cases of COVID-19: A Meta-analysis of 29,349 Patients». Otolaryngology–Head and Neck Surgery. 165 (1): 33–42. doi:10.1177/0194599820981018. PMID 33320033. S2CID 229174644.
- ^ Agyeman AA, Chin KL, Landersdorfer CB, Liew D, Ofori-Asenso R (August 2020). «Smell and Taste Dysfunction in Patients With COVID-19: A Systematic Review and Meta-analysis». Mayo Clin. Proc. 95 (8): 1621–1631. doi:10.1016/j.mayocp.2020.05.030. PMC 7275152. PMID 32753137.
- ^ Oran DP, Topol EJ (January 2021). «The Proportion of SARS-CoV-2 Infections That Are Asymptomatic: A Systematic Review». Annals of Internal Medicine. 174 (5): M20-6976. doi:10.7326/M20-6976. PMC 7839426. PMID 33481642.
- ^ «Interim Clinical Guidance for Management of Patients with Confirmed Coronavirus Disease (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 6 April 2020. Archived from the original on 2 March 2020. Retrieved 19 April 2020.
- ^ a b CDC (11 February 2020). «Post-COVID Conditions». U.S. Centers for Disease Control and Prevention (CDC). Retrieved 12 July 2021.
- ^ CDC (11 February 2020). «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). Retrieved 6 December 2020.
- ^ «Clinical Questions about COVID-19: Questions and Answers». U.S. Centers for Disease Control and Prevention (CDC). 17 November 2021. Retrieved 25 January 2022.
- ^ a b c «Overview of Testing for SARS-CoV-2, the virus that causes COVID-19». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 31 July 2022.
- ^ a b c «Nucleic Acid Amplification Tests (NAATs)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 31 July 2022.
- ^ Gorzalski AJ, Tian H, Laverdure C, Morzunov S, Verma SC, VanHooser S, Pandori MW (August 2020). «High-Throughput Transcription-mediated amplification on the Hologic Panther is a highly sensitive method of detection for SARS-CoV-2». Journal of Clinical Virology. 129: 104501. doi:10.1016/j.jcv.2020.104501. PMC 7286273. PMID 32619959.
- ^ a b c d e Li C, Zhao C, Bao J, Tang B, Wang Y, Gu B (November 2020). «Laboratory diagnosis of coronavirus disease-2019 (COVID-19)». Clinica Chimica Acta; International Journal of Clinical Chemistry. 510: 35–46. doi:10.1016/j.cca.2020.06.045. PMC 7329657. PMID 32621814.
- ^ «2nd U.S. Case Of Wuhan Coronavirus Confirmed». NPR. Retrieved 4 April 2020.
- ^ McNeil Jr DG (2 February 2020). «Wuhan Coronavirus Looks Increasingly Like a Pandemic, Experts Say». The New York Times. ISSN 0362-4331. Archived from the original on 2 February 2020. Retrieved 4 April 2020.
- ^ Griffiths J. «Wuhan coronavirus deaths spike again as outbreak shows no signs of slowing». CNN. Retrieved 4 April 2020.
- ^ Jiang S, Xia S, Ying T, Lu L (May 2020). «A novel coronavirus (2019-nCoV) causing pneumonia-associated respiratory syndrome». Cellular & Molecular Immunology. 17 (5): 554. doi:10.1038/s41423-020-0372-4. PMC 7091741. PMID 32024976.
- ^ Chan JF, Yuan S, Kok KH, To KK, Chu H, Yang J, et al. (February 2020). «A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster». Lancet. 395 (10223): 514–523. doi:10.1016/S0140-6736(20)30154-9. PMC 7159286. PMID 31986261.
- ^ Shablovsky S (September 2017). «The legacy of the Spanish flu». Science. 357 (6357): 1245. Bibcode:2017Sci…357.1245S. doi:10.1126/science.aao4093. ISSN 0036-8075. S2CID 44116811.
- ^ «Stop the coronavirus stigma now». Nature. 580 (7802): 165. 7 April 2020. Bibcode:2020Natur.580..165.. doi:10.1038/d41586-020-01009-0. PMID 32265571. S2CID 214809950. Retrieved 16 April 2020.
- ^ «Novel Coronavirus (2019-nCoV) Situation Report – 1» (PDF). World Health Organization (WHO). 21 January 2020.
- ^ «Novel Coronavirus(2019-nCoV) Situation Report – 10» (PDF). World Health Organization (WHO). 30 January 2020.
- ^ «Novel coronavirus named ‘Covid-19’: WHO». Today. Singapore. Archived from the original on 21 March 2020. Retrieved 11 February 2020.
- ^ «The coronavirus spreads racism against – and among – ethnic Chinese». The Economist. 17 February 2020. Archived from the original on 17 February 2020. Retrieved 17 February 2020.
- ^ World Health Organization Best Practices for the Naming of New Human Infectious Diseases (PDF) (Report). World Health Organization (WHO). May 2015. hdl:10665/163636.
- ^ a b «Naming the coronavirus disease (COVID-19) and the virus that causes it». World Health Organization (WHO). Archived from the original on 28 February 2020. Retrieved 13 March 2020.
- ^ «Novel Coronavirus(2019-nCoV) Situation Report – 22» (PDF). WHO. 11 February 2020.
- ^ Gover AR, Harper SB, Langton L (July 2020). «Anti-Asian Hate Crime During the COVID-19 Pandemic: Exploring the Reproduction of Inequality». American Journal of Criminal Justice. 45 (4): 647–667. doi:10.1007/s12103-020-09545-1. PMC 7364747. PMID 32837171.
- ^ «Symptoms of Coronavirus». U.S. Centers for Disease Control and Prevention (CDC). 22 February 2021. Archived from the original on 4 March 2021. Retrieved 4 March 2021.
- ^ Grant MC, Geoghegan L, Arbyn M, Mohammed Z, McGuinness L, Clarke EL, Wade RG (23 June 2020). «The prevalence of symptoms in 24,410 adults infected by the novel coronavirus (SARS-CoV-2; COVID-19): A systematic review and meta-analysis of 148 studies from 9 countries». PLOS ONE. 15 (6): e0234765. Bibcode:2020PLoSO..1534765G. doi:10.1371/journal.pone.0234765. PMC 7310678. PMID 32574165. S2CID 220046286.
- ^ Pardhan S, Vaughan M, Zhang J, Smith L, Chichger H (1 November 2020). «Sore eyes as the most significant ocular symptom experienced by people with COVID-19: a comparison between pre-COVID-19 and during COVID-19 states». BMJ Open Ophthalmology. 5 (1): e000632. doi:10.1136/bmjophth-2020-000632. PMC 7705420. PMID 34192153.
- ^ «COVID toes, rashes: How the coronavirus can affect your skin». www.aad.org. Retrieved 20 March 2022.
- ^ a b «Clinical characteristics of COVID-19». European Centre for Disease Prevention and Control. Retrieved 29 December 2020.
- ^ Paderno A, Mattavelli D, Rampinelli V, Grammatica A, Raffetti E, Tomasoni M, et al. (December 2020). «Olfactory and Gustatory Outcomes in COVID-19: A Prospective Evaluation in Nonhospitalized Subjects». Otolaryngology–Head and Neck Surgery. 163 (6): 1144–1149. doi:10.1177/0194599820939538. PMC 7331108. PMID 32600175.
- ^ Chabot AB, Huntwork MP (September 2021). «Turmeric as a Possible Treatment for COVID-19-Induced Anosmia and Ageusia». Cureus. 13 (9): e17829. doi:10.7759/cureus.17829. PMC 8502749. PMID 34660038.
- ^ Niazkar HR, Zibaee B, Nasimi A, Bahri N (July 2020). «The neurological manifestations of COVID-19: a review article». Neurological Sciences. 41 (7): 1667–1671. doi:10.1007/s10072-020-04486-3. PMC 7262683. PMID 32483687.
- ^ «Interim Clinical Guidance for Management of Patients with Confirmed Coronavirus Disease (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 6 April 2020. Archived from the original on 2 March 2020. Retrieved 19 April 2020.
- ^ Multiple sources:
- Oran DP, Topol EJ (May 2021). «The Proportion of SARS-CoV-2 Infections That Are Asymptomatic : A Systematic Review». Annals of Internal Medicine. 174 (5): 655–662. doi:10.7326/M20-6976. PMC 7839426. PMID 33481642.
- «Transmission of COVID-19». European Centre for Disease Prevention and Control. Retrieved 6 December 2020.
- Nogrady B (November 2020). «What the data say about asymptomatic COVID infections». Nature. 587 (7835): 534–535. Bibcode:2020Natur.587..534N. doi:10.1038/d41586-020-03141-3. PMID 33214725.
- ^ a b Gao Z, Xu Y, Sun C, Wang X, Guo Y, Qiu S, Ma K (February 2021). «A systematic review of asymptomatic infections with COVID-19». Journal of Microbiology, Immunology, and Infection = Wei Mian Yu Gan Ran Za Zhi. 54 (1): 12–16. doi:10.1016/j.jmii.2020.05.001. PMC 7227597. PMID 32425996.
- ^ Oran DP, Topol EJ (September 2020). «Prevalence of Asymptomatic SARS-CoV-2 Infection : A Narrative Review». Annals of Internal Medicine. 173 (5): 362–367. doi:10.7326/M20-3012. PMC 7281624. PMID 32491919.
- ^ Lai CC, Liu YH, Wang CY, Wang YH, Hsueh SC, Yen MY, et al. (June 2020). «Asymptomatic carrier state, acute respiratory disease, and pneumonia due to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2): Facts and myths». Journal of Microbiology, Immunology, and Infection = Wei Mian Yu Gan Ran Za Zhi. 53 (3): 404–412. doi:10.1016/j.jmii.2020.02.012. PMC 7128959. PMID 32173241.
- ^ a b Furukawa NW, Brooks JT, Sobel J (July 2020). «Evidence Supporting Transmission of Severe Acute Respiratory Syndrome Coronavirus 2 While Presymptomatic or Asymptomatic». Emerging Infectious Diseases. 26 (7). doi:10.3201/eid2607.201595. PMC 7323549. PMID 32364890.
- ^ a b Gandhi RT, Lynch JB, Del Rio C (October 2020). «Mild or Moderate Covid-19». The New England Journal of Medicine. 383 (18): 1757–1766. doi:10.1056/NEJMcp2009249. PMID 32329974.
- ^ Byrne AW, McEvoy D, Collins AB, Hunt K, Casey M, Barber A, et al. (August 2020). «Inferred duration of infectious period of SARS-CoV-2: rapid scoping review and analysis of available evidence for asymptomatic and symptomatic COVID-19 cases». BMJ Open. 10 (8): e039856. doi:10.1136/bmjopen-2020-039856. PMC 7409948. PMID 32759252.
- ^ Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC (August 2020). «Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (COVID-19): A Review». JAMA. 324 (8): 782–793. doi:10.1001/jama.2020.12839. PMID 32648899. S2CID 220465311.
- ^ «Half of young adults with COVID-19 had persistent symptoms after 6 months». medicalxpress.com. Retrieved 10 July 2021.
- ^ Blomberg B, Mohn KG, Brokstad KA, Zhou F, Linchausen DW, Hansen BA, et al. (September 2021). «Long COVID in a prospective cohort of home-isolated patients». Nature Medicine. 27 (9): 1607–1613. doi:10.1038/s41591-021-01433-3. PMC 8440190. PMID 34163090. S2CID 235625772.
- ^ CDC (1 September 2022). «Post-COVID Conditions». Centers for Disease Control and Prevention. Retrieved 21 September 2022.
- ^ CDC (11 February 2020). «COVID-19 and Your Health». Centers for Disease Control and Prevention. Retrieved 23 January 2021.
- ^ CDC (29 March 2022). «Omicron Variant: What You Need to Know». Centers for Disease Control and Prevention. Retrieved 15 June 2022.
- ^ Hu B, Guo H, Zhou P, Shi ZL (March 2021). «Characteristics of SARS-CoV-2 and COVID-19». Nature Reviews. Microbiology. 19 (3): 141–154. doi:10.1038/s41579-020-00459-7. PMC 7537588. PMID 33024307.
- ^ a b Wang CC, Prather KA, Sznitman J, Jimenez JL, Lakdawala SS, Tufekci Z, Marr LC (August 2021). «Airborne transmission of respiratory viruses». Science. 373 (6558). Bibcode:2021Sci…373…..W. doi:10.1126/science.abd9149. PMC 8721651. PMID 34446582.
- ^ Greenhalgh T, Jimenez JL, Prather KA, Tufekci Z, Fisman D, Schooley R (May 2021). «Ten scientific reasons in support of airborne transmission of SARS-CoV-2». Lancet. 397 (10285): 1603–1605. doi:10.1016/s0140-6736(21)00869-2. PMC 8049599. PMID 33865497.
- ^ Bourouiba L (13 July 2021). «Fluid Dynamics of Respiratory Infectious Diseases». Annual Review of Biomedical Engineering. 23 (1): 547–577. doi:10.1146/annurev-bioeng-111820-025044. hdl:1721.1/131115. PMID 34255991. S2CID 235823756. Retrieved 7 September 2021.
- ^ Stadnytskyi, Valentyn; Bax, Christina E.; Bax, Adriaan; Anfinrud, Philip (2 June 2020). «The airborne lifetime of small speech droplets and their potential importance in SARS-CoV-2 transmission». Proceedings of the National Academy of Sciences. 117 (22): 11875–11877. doi:10.1073/pnas.2006874117. PMC 7275719. PMID 32404416.
- ^ Miller SL, Nazaroff WW, Jimenez JL, Boerstra A, Buonanno G, Dancer SJ, et al. (March 2021). «Transmission of SARS-CoV-2 by inhalation of respiratory aerosol in the Skagit Valley Chorale superspreading event». Indoor Air. 31 (2): 314–323. doi:10.1111/ina.12751. PMC 7537089. PMID 32979298.
- ^ He, Xi; Lau, Eric H. Y.; Wu, Peng; Deng, Xilong; Wang, Jian; Hao, Xinxin; Lau, Yiu Chung; Wong, Jessica Y.; Guan, Yujuan; Tan, Xinghua; Mo, Xiaoneng; Chen, Yanqing; Liao, Baolin; Chen, Weilie; Hu, Fengyu; Zhang, Qing; Zhong, Mingqiu; Wu, Yanrong; Zhao, Lingzhai; Zhang, Fuchun; Cowling, Benjamin J.; Li, Fang; Leung, Gabriel M. (September 2020). «Author Correction: Temporal dynamics in viral shedding and transmissibility of COVID-19». Nature Medicine. 26 (9): 1491–1493. doi:10.1038/s41591-020-1016-z. PMC 7413015. PMID 32770170. S2CID 221050261.
- ^ a b c d Communicable Diseases Network Australia. «Coronavirus Disease 2019 (COVID-19): CDNA National Guidelines for Public Health Units». 5.1. Communicable Diseases Network Australia/Australian Government Department of Health.
- ^ «Clinical Questions about COVID-19: Questions and Answers». Centers for Disease Control and Prevention. 4 March 2021.
- ^ «Scientific Brief: SARS-CoV-2 Transmission». Centers for Disease Control and Prevention. 7 May 2021. Retrieved 8 May 2021.
- ^ «Coronavirus disease (COVID-19): How is it transmitted?». World Health Organization. 30 April 2021.
- ^ a b c d e • «COVID-19: epidemiology, virology and clinical features». GOV.UK. Retrieved 18 October 2020.
• Communicable Diseases Network Australia. «Coronavirus Disease 2019 (COVID-19) — CDNA Guidelines for Public Health Units». Version 4.4. Australian Government Department of Health. Retrieved 17 May 2021.{{cite web}}: CS1 maint: url-status (link)
• Public Health Agency of Canada (3 November 2020). «COVID-19: Main modes of transmission». aem. Retrieved 18 May 2021.
• «Transmission of COVID-19». European Centre for Disease Prevention and Control. Retrieved 18 May 2021.
• Meyerowitz EA, Richterman A, Gandhi RT, Sax PE (January 2021). «Transmission of SARS-CoV-2: A Review of Viral, Host, and Environmental Factors». Annals of Internal Medicine. 174 (1): 69–79. doi:10.7326/M20-5008. ISSN 0003-4819. PMC 7505025. PMID 32941052. - ^ a b c Tang JW, Marr LC, Li Y, Dancer SJ (April 2021). «Covid-19 has redefined airborne transmission». BMJ. 373: n913. doi:10.1136/bmj.n913. PMID 33853842.
- ^ a b Morawska L, Allen J, Bahnfleth W, Bluyssen PM, Boerstra A, Buonanno G, et al. (May 2021). «A paradigm shift to combat indoor respiratory infection» (PDF). Science. 372 (6543): 689–691. Bibcode:2021Sci…372..689M. doi:10.1126/science.abg2025. PMID 33986171. S2CID 234487289.
- ^ a b Meyerowitz EA, Richterman A, Gandhi RT, Sax PE (January 2021). «Transmission of SARS-CoV-2: A Review of Viral, Host, and Environmental Factors». Annals of Internal Medicine. 174 (1): 69–79. doi:10.7326/M20-5008. ISSN 0003-4819. PMC 7505025. PMID 32941052.
- ^ CDC (11 February 2020). «Healthcare Workers». Centers for Disease Control and Prevention. Retrieved 29 March 2022.
- ^ Liu T, Gong D, Xiao J, Hu J, He G, Rong Z, Ma W (October 2020). «Cluster infections play important roles in the rapid evolution of COVID-19 transmission: A systematic review». International Journal of Infectious Diseases. 99: 374–380. doi:10.1016/j.ijid.2020.07.073. PMC 7405860. PMID 32768702.
- ^ «Outbreak of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2): increased transmission beyond China – fourth update» (PDF). European Centre for Disease Prevention and Control. 14 February 2020. Retrieved 8 March 2020.
- ^ a b Andersen KG, Rambaut A, Lipkin WI, Holmes EC, Garry RF (April 2020). «The proximal origin of SARS-CoV-2». Nature Medicine. 26 (4): 450–452. doi:10.1038/s41591-020-0820-9. PMC 7095063. PMID 32284615.
- ^ Gibbens S (18 March 2020). «Why soap is preferable to bleach in the fight against coronavirus». National Geographic. Archived from the original on 2 April 2020. Retrieved 2 April 2020.
- ^ Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. (February 2020). «A Novel Coronavirus from Patients with Pneumonia in China, 2019». The New England Journal of Medicine. 382 (8): 727–733. doi:10.1056/NEJMoa2001017. PMC 7092803. PMID 31978945.
- ^ a b c Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) (PDF) (Report). World Health Organization (WHO). February 2020. Archived (PDF) from the original on 29 February 2020. Retrieved 21 March 2020.
- ^ «Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19)». World Health Organization (WHO). Retrieved 25 January 2022.
- ^ Rathore JS, Ghosh C (August 2020). «Severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2), a newly emerged pathogen: an overview». Pathogens and Disease. 78 (6). doi:10.1093/femspd/ftaa042. OCLC 823140442. PMC 7499575. PMID 32840560.
- ^ Thomas S (October 2020). «The Structure of the Membrane Protein of SARS-CoV-2 Resembles the Sugar Transporter SemiSWEET». Pathogens & Immunity. 5 (1): 342–363. doi:10.20411/pai.v5i1.377. PMC 7608487. PMID 33154981.
- ^ Koyama T, Platt D, Parida L (July 2020). «Variant analysis of SARS-CoV-2 genomes». Bulletin of the World Health Organization. 98 (7): 495–504. doi:10.2471/BLT.20.253591. PMC 7375210. PMID 32742035.
We detected in total 65776 variants with 5775 distinct variants.
- ^ a b Rambaut A, Holmes EC, O’Toole Á, Hill V, McCrone JT, Ruis C, et al. (November 2020). «A dynamic nomenclature proposal for SARS-CoV-2 lineages to assist genomic epidemiology». Nature Microbiology. 5 (11): 1403–1407. doi:10.1038/s41564-020-0770-5. PMC 7610519. PMID 32669681.
- ^ «Tracking SARS-CoV-2 variants». World Health Organization. 1 July 2021. Retrieved 5 July 2021.
- ^ Alm E, Broberg EK, Connor T, Hodcroft EB, Komissarov AB, Maurer-Stroh S, et al. (August 2020). «Geographical and temporal distribution of SARS-CoV-2 clades in the WHO European Region, January to June 2020». Euro Surveillance. 25 (32). doi:10.2807/1560-7917.ES.2020.25.32.2001410. PMC 7427299. PMID 32794443.
- ^ «PANGO lineages». cov-lineages.org. Archived from the original on 10 May 2021. Retrieved 9 May 2021.
- ^ Lauring AS, Hodcroft EB (February 2021). «Genetic Variants of SARS-CoV-2-What Do They Mean?». JAMA. 325 (6): 529–531. doi:10.1001/jama.2020.27124. PMID 33404586. S2CID 230783233.
- ^ Abdool Karim SS, de Oliveira T (May 2021). «New SARS-CoV-2 Variants – Clinical, Public Health, and Vaccine Implications». The New England Journal of Medicine. Massachusetts Medical Society. 384 (19): 1866–1868. doi:10.1056/nejmc2100362. ISSN 0028-4793. PMC 8008749. PMID 33761203.
- ^ Mallapaty S (November 2020). «COVID mink analysis shows mutations are not dangerous – yet». Nature. 587 (7834): 340–341. Bibcode:2020Natur.587..340M. doi:10.1038/d41586-020-03218-z. PMID 33188367. S2CID 226947606.
- ^ Larsen HD, Fonager J, Lomholt FK, Dalby T, Benedetti G, Kristensen B, et al. (February 2021). «Preliminary report of an outbreak of SARS-CoV-2 in mink and mink farmers associated with community spread, Denmark, June to November 2020». Euro Surveillance. 26 (5): 2100009. doi:10.2807/1560-7917.ES.2021.26.5.210009. PMC 7863232. PMID 33541485.
As at 1 February 2021, we assess that the cluster 5 variant is no longer circulating among humans in Denmark.
- ^ «New COVID-19 Variants». U.S. Centers for Disease Control and Prevention (CDC). 28 June 2021 [First published 11 February 2020]. Retrieved 15 July 2021.
- ^ «COVID-19 Weekly Epidemiological Update Edition 69». World Health Organization (WHO). 7 December 2021.
- ^ «Classification of Omicron (B.1.1.529): SARS-CoV-2 Variant of Concern». World Health Organization (WHO). Retrieved 9 December 2021.
- ^ Harrison AG, Lin T, Wang P (December 2020). «Mechanisms of SARS-CoV-2 Transmission and Pathogenesis». Trends in Immunology. 41 (12): 1100–1115. doi:10.1016/j.it.2020.10.004. PMC 7556779. PMID 33132005.
- ^ Verdecchia P, Cavallini C, Spanevello A, Angeli F (June 2020). «The pivotal link between ACE2 deficiency and SARS-CoV-2 infection». European Journal of Internal Medicine. 76: 14–20. doi:10.1016/j.ejim.2020.04.037. PMC 7167588. PMID 32336612.
- ^ Letko M, Marzi A, Munster V (April 2020). «Functional assessment of cell entry and receptor usage for SARS-CoV-2 and other lineage B betacoronaviruses». Nature Microbiology. 5 (4): 562–569. doi:10.1038/s41564-020-0688-y. PMC 7095430. PMID 32094589.
- ^ Marik PE, Iglesias J, Varon J, Kory P (January 2021). «A scoping review of the pathophysiology of COVID-19». International Journal of Immunopathology and Pharmacology. 35: 20587384211048026. doi:10.1177/20587384211048026. PMC 8477699. PMID 34569339.
- ^ a b Meunier N, Briand L, Jacquin-Piques A, Brondel L, Pénicaud L (June 2020). «COVID 19-Induced Smell and Taste Impairments: Putative Impact on Physiology». Frontiers in Physiology. 11: 625110. doi:10.3389/fphys.2020.625110. PMC 7870487. PMID 33574768.
- ^ Guerrero JI, Barragán LA, Martínez JD, Montoya JP, Peña A, Sobrino FE, et al. (June 2021). «Central and peripheral nervous system involvement by COVID-19: a systematic review of the pathophysiology, clinical manifestations, neuropathology, neuroimaging, electrophysiology, and cerebrospinal fluid findings». BMC Infectious Diseases. 21 (1): 515. doi:10.1186/s12879-021-06185-6. PMC 8170436. PMID 34078305.
- ^ a b Pezzini A, Padovani A (November 2020). «Lifting the mask on neurological manifestations of COVID-19». Nature Reviews. Neurology. 16 (11): 636–644. doi:10.1038/s41582-020-0398-3. PMC 7444680. PMID 32839585.
- ^ Li YC, Bai WZ, Hashikawa T (June 2020). «The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients». Journal of Medical Virology. 92 (6): 552–555. doi:10.1002/jmv.25728. PMC 7228394. PMID 32104915.
- ^ Baig AM, Khaleeq A, Ali U, Syeda H (April 2020). «Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host-Virus Interaction, and Proposed Neurotropic Mechanisms». ACS Chemical Neuroscience. 11 (7): 995–998. doi:10.1021/acschemneuro.0c00122. PMC 7094171. PMID 32167747.
- ^ Yavarpour-Bali H, Ghasemi-Kasman M (September 2020). «Update on neurological manifestations of COVID-19». Life Sciences. 257: 118063. doi:10.1016/j.lfs.2020.118063. PMC 7346808. PMID 32652139.
- ^ Covid can shrink brain and damage its tissue, finds research The Guardian
- ^ Scans reveal how Covid may change the brain BBC
- ^ «Even mild Covid is linked to brain damage months after illness, scans show». NBC News.
- ^ Gu J, Han B, Wang J (May 2020). «COVID-19: Gastrointestinal Manifestations and Potential Fecal-Oral Transmission». Gastroenterology. 158 (6): 1518–1519. doi:10.1053/j.gastro.2020.02.054. PMC 7130192. PMID 32142785.
- ^ Mönkemüller K, Fry L, Rickes S (May 2020). «COVID-19, coronavirus, SARS-CoV-2 and the small bowel». Revista Espanola de Enfermedades Digestivas. 112 (5): 383–388. doi:10.17235/reed.2020.7137/2020. PMID 32343593. S2CID 216645754.
- ^ Almamlouk R, Kashour T, Obeidat S, Bois MC, Maleszewski JJ, Omrani OA, et al. (August 2022). «COVID-19-Associated cardiac pathology at the postmortem evaluation: a collaborative systematic review». Clinical Microbiology and Infection. 28 (8): 1066–1075. doi:10.1016/j.cmi.2022.03.021. PMC 8941843. PMID 35339672.
- ^ a b c Zheng YY, Ma YT, Zhang JY, Xie X (May 2020). «COVID-19 and the cardiovascular system». Nature Reviews. Cardiology. 17 (5): 259–260. doi:10.1038/s41569-020-0360-5. PMC 7095524. PMID 32139904.
- ^ a b c Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. (February 2020). «Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China». Lancet. 395 (10223): 497–506. doi:10.1016/S0140-6736(20)30183-5. PMC 7159299. PMID 31986264.
- ^ «Coronavirus disease 2019 (COVID-19): Myocardial infarction and other coronary artery disease issues». UpToDate. Retrieved 28 September 2020.
- ^ Turner AJ, Hiscox JA, Hooper NM (June 2004). «ACE2: from vasopeptidase to SARS virus receptor». Trends in Pharmacological Sciences. 25 (6): 291–4. doi:10.1016/j.tips.2004.04.001. PMC 7119032. PMID 15165741.
- ^ Abou-Ismail MY, Diamond A, Kapoor S, Arafah Y, Nayak L (October 2020). «The hypercoagulable state in COVID-19: Incidence, pathophysiology, and management». Thrombosis Research. Elsevier BV. 194: 101–115. doi:10.1016/j.thromres.2020.06.029. PMC 7305763. PMID 32788101.
- ^ a b c Wadman M (April 2020). «How does coronavirus kill? Clinicians trace a ferocious rampage through the body, from brain to toes». Science. doi:10.1126/science.abc3208.
- ^ «NIH study uncovers blood vessel damage and inflammation in COVID-19 patients’ brains but no infection». National Institutes of Health (NIH). 30 December 2020. Retrieved 17 January 2021.
- ^ Lee MH, Perl DP, Nair G, Li W, Maric D, Murray H, et al. (February 2021). «Microvascular Injury in the Brains of Patients with Covid-19». The New England Journal of Medicine. 384 (5): 481–483. doi:10.1056/nejmc2033369. PMC 7787217. PMID 33378608.
- ^ Kubánková M, Hohberger B, Hoffmanns J, Fürst J, Herrmann M, Guck J, Kräter M (July 2021). «Physical phenotype of blood cells is altered in COVID-19». Biophysical Journal. 120 (14): 2838–2847. Bibcode:2021BpJ…120.2838K. doi:10.1016/j.bpj.2021.05.025. PMC 8169220. PMID 34087216.
- ^ Gupta A, Madhavan MV, Sehgal K, Nair N, Mahajan S, Sehrawat TS, et al. (July 2020). «Extrapulmonary manifestations of COVID-19». Nature Medicine. 26 (7): 1017–1032. doi:10.1038/s41591-020-0968-3. PMID 32651579. S2CID 220462000.
- ^ «Coronavirus: Kidney Damage Caused by COVID-19». Johns Hopkins Medicine. 14 May 2020. Retrieved 25 January 2022.
- ^ a b c d e f g h Eketunde AO, Mellacheruvu SP, Oreoluwa P (July 2020). «A Review of Postmortem Findings in Patients With COVID-19». Cureus. Cureus, Inc. 12 (7): e9438. doi:10.7759/cureus.9438. PMC 7451084. PMID 32864262. S2CID 221352704.
- ^ Ziegler, CGK; Allon, SJ; Nyquist, SK; Mbano, IM; Miao, VN; Tzouanas, CN; Cao, Y; Yousif, AS; Bals, J; Hauser, BM; Feldman, J; Muus, C; Wadsworth MH, 2nd; Kazer, SW; Hughes, TK; Doran, B; Gatter, GJ; Vukovic, M; Taliaferro, F; Mead, BE; Guo, Z; Wang, JP; Gras, D; Plaisant, M; Ansari, M; Angelidis, I; Adler, H; Sucre, JMS; Taylor, CJ; Lin, B; Waghray, A; Mitsialis, V; Dwyer, DF; Buchheit, KM; Boyce, JA; Barrett, NA; Laidlaw, TM; Carroll, SL; Colonna, L; Tkachev, V; Peterson, CW; Yu, A; Zheng, HB; Gideon, HP; Winchell, CG; Lin, PL; Bingle, CD; Snapper, SB; Kropski, JA; Theis, FJ; Schiller, HB; Zaragosi, LE; Barbry, P; Leslie, A; Kiem, HP; Flynn, JL; Fortune, SM; Berger, B; Finberg, RW; Kean, LS; Garber, M; Schmidt, AG; Lingwood, D; Shalek, AK; Ordovas-Montanes, J; HCA Lung Biological Network. Electronic address, lung-network@humancellatlas.org.; HCA Lung Biological, Network. (28 May 2020). «SARS-CoV-2 Receptor ACE2 Is an Interferon-Stimulated Gene in Human Airway Epithelial Cells and Is Detected in Specific Cell Subsets across Tissues». Cell. 181 (5): 1016–1035.e19. doi:10.1016/j.cell.2020.04.035. PMC 7252096. PMID 32413319.
- ^ Sajuthi, SP; DeFord, P; Li, Y; Jackson, ND; Montgomery, MT; Everman, JL; Rios, CL; Pruesse, E; Nolin, JD; Plender, EG; Wechsler, ME; Mak, ACY; Eng, C; Salazar, S; Medina, V; Wohlford, EM; Huntsman, S; Nickerson, DA; Germer, S; Zody, MC; Abecasis, G; Kang, HM; Rice, KM; Kumar, R; Oh, S; Rodriguez-Santana, J; Burchard, EG; Seibold, MA (12 October 2020). «Type 2 and interferon inflammation regulate SARS-CoV-2 entry factor expression in the airway epithelium». Nature Communications. 11 (1): 5139. Bibcode:2020NatCo..11.5139S. doi:10.1038/s41467-020-18781-2. PMC 7550582. PMID 33046696.
- ^
- ^ Zhang C, Wu Z, Li JW, Zhao H, Wang GQ (May 2020). «Cytokine release syndrome in severe COVID-19: interleukin-6 receptor antagonist tocilizumab may be the key to reduce mortality». International Journal of Antimicrobial Agents. 55 (5): 105954. doi:10.1016/j.ijantimicag.2020.105954. PMC 7118634. PMID 32234467.
- ^ Gómez-Rial J, Rivero-Calle I, Salas A, Martinón-Torres F (2020). «Role of Monocytes/Macrophages in Covid-19 Pathogenesis: Implications for Therapy». Infection and Drug Resistance. 13: 2485–2493. doi:10.2147/IDR.S258639. PMC 7383015. PMID 32801787.
- ^ Dai L, Gao GF (February 2021). «Viral targets for vaccines against COVID-19». Nature Reviews. Immunology. 21 (2): 73–82. doi:10.1038/s41577-020-00480-0. ISSN 1474-1733. PMC 7747004. PMID 33340022.
- ^ a b Boopathi S, Poma AB, Kolandaivel P (April 2020). «Novel 2019 coronavirus structure, mechanism of action, antiviral drug promises and rule out against its treatment». Journal of Biomolecular Structure & Dynamics. 39 (9): 3409–3418. doi:10.1080/07391102.2020.1758788. PMC 7196923. PMID 32306836.
- ^ Kai H, Kai M (July 2020). «Interactions of coronaviruses with ACE2, angiotensin II, and RAS inhibitors-lessons from available evidence and insights into COVID-19». Hypertension Research. 43 (7): 648–654. doi:10.1038/s41440-020-0455-8. PMC 7184165. PMID 32341442.
- ^ Chen HX, Chen ZH, Shen HH (October 2020). «[Structure of SARS-CoV-2 and treatment of COVID-19]». Sheng Li Xue Bao. 72 (5): 617–630. PMID 33106832.
- ^ Jeyanathan M, Afkhami S, Smaill F, Miller MS, Lichty BD, Xing Z (4 September 2020). «Immunological considerations for COVID-19 vaccine strategies». Nature Reviews Immunology. 20 (10): 615–632. doi:10.1038/s41577-020-00434-6. ISSN 1474-1741. PMC 7472682. PMID 32887954.
- ^ Zhang Q, Ju B, Ge J, Chan JF, Cheng L, Wang R, et al. (July 2021). «Potent and protective IGHV3-53/3-66 public antibodies and their shared escape mutant on the spike of SARS-CoV-2». Nature Communications. 12 (1): 4210. Bibcode:2021NatCo..12.4210Z. doi:10.1038/s41467-021-24514-w. PMC 8270942. PMID 34244522. S2CID 235786394.
- ^ Soy M, Keser G, Atagündüz P, Tabak F, Atagündüz I, Kayhan S (July 2020). «Cytokine storm in COVID-19: pathogenesis and overview of anti-inflammatory agents used in treatment». Clinical Rheumatology. 39 (7): 2085–2094. doi:10.1007/s10067-020-05190-5. PMC 7260446. PMID 32474885.
- ^ Quirch M, Lee J, Rehman S (August 2020). «Hazards of the Cytokine Storm and Cytokine-Targeted Therapy in Patients With COVID-19: Review». Journal of Medical Internet Research. 22 (8): e20193. doi:10.2196/20193. PMC 7428145. PMID 32707537.
- ^ Bhaskar S, Sinha A, Banach M, Mittoo S, Weissert R, Kass JS, et al. (2020). «Cytokine Storm in COVID-19-Immunopathological Mechanisms, Clinical Considerations, and Therapeutic Approaches: The REPROGRAM Consortium Position Paper». Frontiers in Immunology. 11: 1648. doi:10.3389/fimmu.2020.01648. PMC 7365905. PMID 32754159.
- ^ a b c d e f Wastnedge EA, Reynolds RM, van Boeckel SR, Stock SJ, Denison FC, Maybin JA, Critchley HO (January 2021). «Pregnancy and COVID-19». Physiological Reviews. 101 (1): 303–318. doi:10.1152/physrev.00024.2020. PMC 7686875. PMID 32969772.
- ^ Campbell D (10 October 2021). «One in six most critically ill NHS Covid patients are unvaccinated pregnant women». The Guardian. Retrieved 25 January 2022.
- ^ a b Ai T, Yang Z, Hou H, Zhan C, Chen C, Lv W, et al. (August 2020). «Correlation of Chest CT and RT-PCR Testing for Coronavirus Disease 2019 (COVID-19) in China: A Report of 1014 Cases». Radiology. 296 (2): E32–E40. doi:10.1148/radiol.2020200642. PMC 7233399. PMID 32101510.
- ^ a b c d Salehi S, Abedi A, Balakrishnan S, Gholamrezanezhad A (July 2020). «Coronavirus Disease 2019 (COVID-19): A Systematic Review of Imaging Findings in 919 Patients». AJR. American Journal of Roentgenology. 215 (1): 87–93. doi:10.2214/AJR.20.23034. PMID 32174129.
- ^ «2019 Novel Coronavirus (2019-nCoV) Situation Summary». U.S. Centers for Disease Control and Prevention (CDC). 30 January 2020. Archived from the original on 26 January 2020. Retrieved 30 January 2020.
- ^ «Coronavirus disease (COVID-19) technical guidance: Laboratory testing for 2019-nCoV in humans». World Health Organization (WHO). Archived from the original on 15 March 2020. Retrieved 14 March 2020.
- ^ Bullard J, Dust K, Funk D, Strong JE, Alexander D, Garnett L, et al. (December 2020). «Predicting Infectious Severe Acute Respiratory Syndrome Coronavirus 2 From Diagnostic Samples». Clinical Infectious Diseases. 71 (10): 2663–2666. doi:10.1093/cid/ciaa638. PMC 7314198. PMID 32442256.
- ^ «Interim Guidelines for Collecting, Handling, and Testing Clinical Specimens from Persons for Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Archived from the original on 4 March 2020. Retrieved 26 March 2020.
- ^ «Real-Time RT-PCR Panel for Detection 2019-nCoV». U.S. Centers for Disease Control and Prevention (CDC). 29 January 2020. Archived from the original on 30 January 2020. Retrieved 1 February 2020.
- ^ «Laboratory testing for 2019 novel coronavirus (2019-nCoV) in suspected human cases». World Health Organization (WHO). Archived from the original on 17 March 2020. Retrieved 13 March 2020.
- ^ «NHS staff will be first to get new coronavirus antibody test, medical chief promises». The Independent. 14 May 2020. Retrieved 14 May 2020.
- ^ Heneghan C, Jefferson T (1 September 2020). «Virological characterization of COVID-19 patients that test re-positive for SARS-CoV-2 by RT-PCR». CEBM. Retrieved 19 September 2020.
- ^ Lu J, Peng J, Xiong Q, Liu Z, Lin H, Tan X, et al. (September 2020). «Clinical, immunological and virological characterization of COVID-19 patients that test re-positive for SARS-CoV-2 by RT-PCR». EBioMedicine. 59: 102960. doi:10.1016/j.ebiom.2020.102960. PMC 7444471. PMID 32853988.
- ^ Spencer E, Jefferson T, Brassey J, Heneghan C (11 September 2020). «When is Covid, Covid?». The Centre for Evidence-Based Medicine. Retrieved 19 September 2020.
- ^ «SARS-CoV-2 RNA testing: assurance of positive results during periods of low prevalence». GOV.UK. Retrieved 19 September 2020.
- ^ «ACR Recommendations for the use of Chest Radiography and Computed Tomography (CT) for Suspected COVID-19 Infection». American College of Radiology. 22 March 2020. Archived from the original on 28 March 2020.
- ^ Pormohammad A, Ghorbani S, Khatami A, Razizadeh MH, Alborzi E, Zarei M, et al. (October 2020). «Comparison of influenza type A and B with COVID-19: A global systematic review and meta-analysis on clinical, laboratory and radiographic findings». Reviews in Medical Virology. 31 (3): e2179. doi:10.1002/rmv.2179. PMC 7646051. PMID 33035373. S2CID 222255245.
- ^ Lee EY, Ng MY, Khong PL (April 2020). «COVID-19 pneumonia: what has CT taught us?». The Lancet. Infectious Diseases. 20 (4): 384–385. doi:10.1016/S1473-3099(20)30134-1. PMC 7128449. PMID 32105641.
- ^ a b Li Y, Xia L (June 2020). «Coronavirus Disease 2019 (COVID-19): Role of Chest CT in Diagnosis and Management». AJR. American Journal of Roentgenology. 214 (6): 1280–1286. doi:10.2214/AJR.20.22954. PMID 32130038. S2CID 212416282.
- ^ «COVID-19 Database». Società Italiana di Radiologia Medica e Interventistica (in Italian). Retrieved 11 March 2020.
- ^ «ICD-10 Version:2019». World Health Organization (WHO). 2019. Archived from the original on 31 March 2020. Retrieved 31 March 2020.
U07.2 – COVID-19, virus not identified – COVID-19 NOS – Use this code when COVID-19 is diagnosed clinically or epidemiologically but laboratory testing is inconclusive or not available. Use additional code, if desired, to identify pneumonia or other manifestations
- ^ Giani M, Seminati D, Lucchini A, Foti G, Pagni F (May 2020). «Exuberant Plasmocytosis in Bronchoalveolar Lavage Specimen of the First Patient Requiring Extracorporeal Membrane Oxygenation for SARS-CoV-2 in Europe». Journal of Thoracic Oncology. 15 (5): e65–e66. doi:10.1016/j.jtho.2020.03.008. PMC 7118681. PMID 32194247.
- ^ Lillicrap D (April 2020). «Disseminated intravascular coagulation in patients with 2019-nCoV pneumonia». Journal of Thrombosis and Haemostasis. 18 (4): 786–787. doi:10.1111/jth.14781. PMC 7166410. PMID 32212240.
- ^ Mitra A, Dwyre DM, Schivo M, Thompson GR, Cohen SH, Ku N, Graff JP (August 2020). «Leukoerythroblastic reaction in a patient with COVID-19 infection». American Journal of Hematology. 95 (8): 999–1000. doi:10.1002/ajh.25793. PMC 7228283. PMID 32212392.
- ^ a b c d e f Satturwar S, Fowkes M, Farver C, Wilson AM, Eccher A, Girolami I, et al. (May 2021). «Postmortem Findings Associated With SARS-CoV-2: Systematic Review and Meta-analysis». The American Journal of Surgical Pathology. 45 (5): 587–603. doi:10.1097/PAS.0000000000001650. PMC 8132567. PMID 33481385. S2CID 231679276.
- ^ Maier BF, Brockmann D (May 2020). «Effective containment explains subexponential growth in recent confirmed COVID-19 cases in China». Science. 368 (6492): 742–746. arXiv:2002.07572. Bibcode:2020Sci…368..742M. doi:10.1126/science.abb4557. PMC 7164388. PMID 32269067. («… initial exponential growth expected for an unconstrained outbreak.»)
- ^ «Viral Load Exposure Factors». ReallyCorrect.com.
- ^ «Recommendation Regarding the Use of Cloth Face Coverings, Especially in Areas of Significant Community-Based Transmission». U.S. Centers for Disease Control and Prevention (CDC). 28 June 2020.
- ^ «Scientific Brief: SARS-CoV-2 and Potential Airborne Transmission». COVID-19 Published Science and Research. U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 30 October 2020.
- ^ Centers for Disease Control and Prevention (5 April 2020). «What to Do if You Are Sick». U.S. Centers for Disease Control and Prevention (CDC). Archived from the original on 14 February 2020. Retrieved 24 April 2020.
- ^ «Coronavirus Disease 2019 (COVID-19) – Prevention & Treatment». U.S. Centers for Disease Control and Prevention (CDC). 10 March 2020. Archived from the original on 11 March 2020. Retrieved 11 March 2020.
- ^ «UK medicines regulator gives approval for first UK COVID-19 vaccine». Medicines and Healthcare Products Regulatory Agency, Government of the UK. 2 December 2020. Retrieved 2 December 2020.
- ^ Mueller B (2 December 2020). «U.K. Approves Pfizer Coronavirus Vaccine, a First in the West». The New York Times. Archived from the original on 2 December 2020. Retrieved 2 December 2020.
- ^ «COVID-19 Treatment Guidelines». nih.gov. National Institutes of Health. Retrieved 21 April 2020.
- ^ a b c Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB (May 2020). «Pharmacologic Treatments for Coronavirus Disease 2019 (COVID-19): A Review». JAMA. 323 (18): 1824–1836. doi:10.1001/jama.2020.6019. PMID 32282022.
- ^ a b Anderson RM, Heesterbeek H, Klinkenberg D, Hollingsworth TD (March 2020). «How will country-based mitigation measures influence the course of the COVID-19 epidemic?». Lancet. 395 (10228): 931–934. doi:10.1016/S0140-6736(20)30567-5. PMC 7158572. PMID 32164834.
A key issue for epidemiologists is helping policy makers decide the main objectives of mitigation – e.g. minimising morbidity and associated mortality, avoiding an epidemic peak that overwhelms health-care services, keeping the effects on the economy within manageable levels, and flattening the epidemic curve to wait for vaccine development and manufacture on scale and antiviral drug therapies.
- ^ Wiles S (14 March 2020). «After ‘Flatten the Curve’, we must now ‘Stop the Spread’. Here’s what that means». The Spinoff. Archived from the original on 26 March 2020. Retrieved 13 March 2020.
- ^ Li YD, Chi WY, Su JH, Ferrall L, Hung CF, Wu TC (December 2020). «Coronavirus vaccine development: from SARS and MERS to COVID-19». Journal of Biomedical Science. 27 (1): 104. doi:10.1186/s12929-020-00695-2. PMC 7749790. PMID 33341119.
- ^ Subbarao K (July 2021). «The success of SARS-CoV-2 vaccines and challenges ahead». Cell Host & Microbe. 29 (7): 1111–1123. doi:10.1016/j.chom.2021.06.016. PMC 8279572. PMID 34265245.
- ^ Padilla TB (24 February 2021). «No one is safe unless everyone is safe». BusinessWorld. Archived from the original on 23 February 2021. Retrieved 24 February 2021.
- ^ a b c Rogers K (11 May 2022). «COVID-19 vaccine». Encyclopædia Britannica. Archived from the original on 12 June 2022. Retrieved 12 June 2022.
- ^ «Swissmedic grants authorisation for the first COVID-19 vaccine in Switzerland» (Press release). Swiss Agency for Therapeutic Products (Swissmedic). 18 December 2020. Archived from the original on 2 May 2021. Retrieved 5 July 2022.
- ^ «EMA recommends first COVID-19 vaccine for authorisation in the EU». European Medicines Agency (EMA) (Press release). 21 December 2020. Archived from the original on 30 January 2021. Retrieved 21 December 2020.
- ^ «Wear masks in public says WHO, in update of COVID-19 advice». Reuters. 5 June 2020. Retrieved 3 July 2020.
- ^ a b c «Recommendation Regarding the Use of Cloth Face Coverings, Especially in Areas of Significant Community-Based Transmission». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 17 April 2020.
- ^ a b «Using face masks in the community – Technical Report» (PDF). ECDC. 8 April 2020.
- ^ «Scientific Brief: Community Use of Cloth Masks to Control the Spread of SARS-CoV-2». U.S. Centers for Disease Control and Prevention (CDC). 10 November 2020.
- ^ Greenhalgh T, Schmid MB, Czypionka T, Bassler D, Gruer L (April 2020). «Face masks for the public during the covid-19 crisis». BMJ. 369: m1435. doi:10.1136/bmj.m1435. PMID 32273267. S2CID 215516381.
- ^ «Caring for Someone Sick at Home». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 3 July 2020.
- ^ «Using Personal Protective Equipment (PPE)». U.S. Centers for Disease Control and Prevention (CDC). 11 June 2020. Retrieved 4 July 2020.
- ^ a b c CDC (11 February 2020). «Scientific Brief: SARS-CoV-2 Transmission». U.S. Centers for Disease Control and Prevention (CDC). Retrieved 10 May 2021.
- ^ «Transmission of COVID-19». European Centre for Disease Prevention and Control. 7 September 2020. Retrieved 14 October 2020.
- ^ a b National Center for Immunization and Respiratory Diseases (NCIRD) (9 July 2020). «COVID-19 Employer Information for Office Buildings». U.S. Centers for Disease Control and Prevention (CDC). Retrieved 9 July 2020.
- ^ WHO’s Science in 5 on COVID-19 — Ventilation — 30 October 2020. World Health Organization (WHO). 30 October 2020. Archived from the original on 25 October 2022. Retrieved 8 December 2022 – via YouTube.
- ^ Somsen GA, van Rijn C, Kooij S, Bem RA, Bonn D (July 2020). «Small droplet aerosols in poorly ventilated spaces and SARS-CoV-2 transmission». The Lancet. Respiratory Medicine. Elsesier. 8 (7): 658–659. doi:10.1016/S2213-2600(20)30245-9. PMC 7255254. PMID 32473123.
- ^ Lipinski T, Ahmad D, Serey N, Jouhara H (1 November 2020). «Review of ventilation strategies to reduce the risk of disease transmission in high occupancy buildings». International Journal of Thermofluids. 7–8: 100045. doi:10.1016/j.ijft.2020.100045. ISSN 2666-2027. S2CID 221642242.
- ^ «Social distancing: what you need to do – Coronavirus (COVID-19)». nhs.uk. 2 June 2020. Retrieved 18 August 2020.
- ^ «Advice for the public on COVID-19 – World Health Organization». World Health Organization (WHO). Retrieved 18 August 2020.
- ^ «COVID-19 and Your Health». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 23 March 2021.
To prevent the spread of germs, including COVID-19, CDC recommends washing hands with soap and water whenever possible because it reduces the amount of many types of germs and chemicals on hands. But if soap and water are not readily available, using a hand sanitizer with at least 60% alcohol can help you avoid getting sick and spreading germs to others.
- ^ «WHO-recommended handrub formulations». WHO Guidelines on Hand Hygiene in Health Care: First Global Patient Safety Challenge Clean Care Is Safer Care. World Health Organization (WHO). 19 March 2009. Retrieved 19 March 2020.
- ^ Nussbaumer-Streit B, Mayr V, Dobrescu AI, Chapman A, Persad E, Klerings I, et al. (September 2020). «Quarantine alone or in combination with other public health measures to control COVID-19: a rapid review». The Cochrane Database of Systematic Reviews. 2020 (9): CD013574. doi:10.1002/14651858.CD013574.pub2. ISSN 1469-493X. PMC 8133397. PMID 33959956.
- ^ Qian M, Jiang J (May 2020). «COVID-19 and social distancing». Zeitschrift für Gesundheitswissenschaften = Journal of Public Health. 30 (1): 259–261. doi:10.1007/s10389-020-01321-z. PMC 7247774. PMID 32837835.
- ^ a b Hawks L, Woolhandler S, McCormick D (August 2020). «COVID-19 in Prisons and Jails in the United States». JAMA Internal Medicine. 180 (8): 1041–1042. doi:10.1001/jamainternmed.2020.1856. PMID 32343355.
- ^ Waldstein D (6 May 2020). «To Fight Virus in Prisons, C.D.C. Suggests More Screenings». The New York Times. Archived from the original on 7 May 2020. Retrieved 14 May 2020.
- ^ «How COVID-19 Spreads». U.S. Centers for Disease Control and Prevention (CDC). 18 September 2020. Archived from the original on 19 September 2020. Retrieved 20 September 2020.
- ^ Goldman E (August 2020). «Exaggerated risk of transmission of COVID-19 by fomites». The Lancet. Infectious Diseases. 20 (8): 892–893. doi:10.1016/S1473-3099(20)30561-2. PMC 7333993. PMID 32628907.
- ^ Weixel N (5 April 2021). «CDC says risk of COVID-19 transmission on surfaces 1 in 10,000». The Hill. Retrieved 19 December 2021.
- ^ a b «Science Brief: SARS-CoV-2 and Surface (Fomite) Transmission for Indoor Community Environments». U.S. Centers for Disease Control and Prevention (CDC). 5 April 2021. Archived from the original on 5 April 2021.
- ^ a b Pedreira A, Taşkın Y, García MR (January 2021). «A Critical Review of Disinfection Processes to Control SARS-CoV-2 Transmission in the Food Industry». Foods. 10 (2): 283. doi:10.3390/foods10020283. PMC 7911259. PMID 33572531. S2CID 231900820.
- ^ Rezasoltani S, Yadegar A, Hatami B, Asadzadeh Aghdaei H, Zali MR (2020). «Antimicrobial Resistance as a Hidden Menace Lurking Behind the COVID-19 Outbreak: The Global Impacts of Too Much Hygiene on AMR». Frontiers in Microbiology. 11: 590683. doi:10.3389/fmicb.2020.590683. PMC 7769770. PMID 33384670.
- ^ Thompson D (8 February 2021). «Hygiene Theater Is Still a Huge Waste of Time». The Atlantic. Retrieved 27 February 2021.
- ^ Thompson D (27 July 2020). «Hygiene Theater Is a Huge Waste of Time». The Atlantic. Retrieved 27 February 2021.
- ^ a b c d e f g Bueckert M, Gupta R, Gupta A, Garg M, Mazumder A (November 2020). «Infectivity of SARS-CoV-2 and Other Coronaviruses on Dry Surfaces: Potential for Indirect Transmission». Materials. 13 (22): 5211. Bibcode:2020Mate…13.5211B. doi:10.3390/ma13225211. PMC 7698891. PMID 33218120.
- ^ Bhardwaj R, Agrawal A (November 2020). «How coronavirus survives for days on surfaces». Physics of Fluids. 32 (11): 111706. Bibcode:2020PhFl…32k1706B. doi:10.1063/5.0033306. PMC 7713872. PMID 33281435.
- ^ Chatterjee S, Murallidharan JS, Agrawal A, Bhardwaj R (February 2021). «Why coronavirus survives longer on impermeable than porous surfaces». Physics of Fluids. 33 (2): 021701. Bibcode:2021PhFl…33b1701C. doi:10.1063/5.0037924. PMC 7978145. PMID 33746485.
- ^ CDC (11 February 2020). «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). Retrieved 12 April 2021.
- ^ Anthes E (8 April 2021). «Has the Era of Overzealous Cleaning Finally Come to an End?». The New York Times. Archived from the original on 28 December 2021. Retrieved 12 April 2021.
- ^ «Interim Recommendations for US Community Facilities with Suspected/Confirmed Coronavirus Disease 2019». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 4 April 2020.
- ^ «Yes, UV phone sanitizers work. That doesn’t mean you need one». The Washington Post. 16 February 2021. Retrieved 29 April 2022.
- ^ Patiño-Lugo DF, Vélez M, Velásquez Salazar P, Vera-Giraldo CY, Vélez V, Marín IC, et al. (June 2020). «Non-pharmaceutical interventions for containment, mitigation and suppression of COVID-19 infection». Colombia Medica. 51 (2): e4266. doi:10.25100/cm.v51i2.4266. PMC 7518730. PMID 33012884.
- ^ «COVID-19 Informational Resources for High-Risk Groups | Keeping Education ACTIVE | Partnership to Fight Chronic Disease». fightchronicdisease.org. Retrieved 31 May 2020.
- ^ «Quarantine and Isolation». U.S. Centers for Disease Control and Prevention (CDC). 29 July 2021. Retrieved 12 August 2021.
- ^ a b c Burns J, Movsisyan A, Stratil JM, Biallas RL, Coenen M, Emmert-Fees KM, et al. (Cochrane Public Health Group) (March 2021). «International travel-related control measures to contain the COVID-19 pandemic: a rapid review». The Cochrane Database of Systematic Reviews. 2021 (3): CD013717. doi:10.1002/14651858.CD013717.pub2. PMC 8406796. PMID 33763851. S2CID 232356197.
- ^ «COVID Treatment Guidelines: Clinical Management Summary». NIH Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. 8 April 2022. Archived from the original on 5 November 2021. Retrieved 19 April 2022.
- ^ Wise, Jeff (17 April 2022). «What Happened to Paxlovid, the COVID Wonder Drug?». Intelligencer. Archived from the original on 19 April 2022. Retrieved 19 April 2022.
- ^ Tao K, Tzou PL, Nouhin J, Bonilla H, Jagannathan P, Shafer RW (July 2021). «SARS-CoV-2 Antiviral Therapy». Clinical Microbiology Reviews. 34 (4): e0010921. doi:10.1128/CMR.00109-21. PMC 8404831. PMID 34319150. S2CID 236472654.
- ^ Fisher D, Heymann D (February 2020). «Q&A: The novel coronavirus outbreak causing COVID-19». BMC Medicine. 18 (1): 57. doi:10.1186/s12916-020-01533-w. PMC 7047369. PMID 32106852.
- ^ Liu K, Fang YY, Deng Y, Liu W, Wang MF, Ma JP, et al. (May 2020). «Clinical characteristics of novel coronavirus cases in tertiary hospitals in Hubei Province». Chinese Medical Journal. 133 (9): 1025–1031. doi:10.1097/CM9.0000000000000744. PMC 7147277. PMID 32044814.
- ^ Wang T, Du Z, Zhu F, Cao Z, An Y, Gao Y, Jiang B (March 2020). «Comorbidities and multi-organ injuries in the treatment of COVID-19». Lancet. Elsevier BV. 395 (10228): e52. doi:10.1016/s0140-6736(20)30558-4. PMC 7270177. PMID 32171074.
- ^ Wang Y, Wang Y, Chen Y, Qin Q (March 2020). «Unique epidemiological and clinical features of the emerging 2019 novel coronavirus pneumonia (COVID-19) implicate special control measures». Journal of Medical Virology. 92 (6): 568–576. doi:10.1002/jmv.25748. PMC 7228347. PMID 32134116.
- ^ «Coronavirus». WebMD. Archived from the original on 1 February 2020. Retrieved 1 February 2020.
- ^ Martel J, Ko YF, Young JD, Ojcius DM (May 2020). «Could nasal breathing help to mitigate the severity of COVID-19». Microbes and Infection. 22 (4–5): 168–171. doi:10.1016/j.micinf.2020.05.002. PMC 7200356. PMID 32387333.
- ^ «Coronavirus recovery: breathing exercises». www.hopkinsmedicine.org. Johns Hopkins Medicine. Archived from the original on 11 October 2020. Retrieved 30 July 2020.
- ^ Wang L, Wang Y, Ye D, Liu Q (March 2020). «Review of the 2019 novel coronavirus (SARS-CoV-2) based on current evidence». International Journal of Antimicrobial Agents. 55 (6): 105948. doi:10.1016/j.ijantimicag.2020.105948. PMC 7156162. PMID 32201353.
- ^ U.S. Centers for Disease Control and Prevention (5 April 2020). «What to Do if You Are Sick». U.S. Centers for Disease Control and Prevention (CDC). Archived from the original on 14 February 2020. Retrieved 24 April 2020.
- ^ «Update to living WHO guideline on drugs for covid-19». BMJ (Clinical Research Ed.). 371: m4475. November 2020. doi:10.1136/bmj.m4475. ISSN 1756-1833. PMID 33214213. S2CID 227059995.
- ^ «Q&A: Dexamethasone and COVID-19». World Health Organization (WHO). Archived from the original on 11 October 2020. Retrieved 11 July 2020.
- ^ «Home». National COVID-19 Clinical Evidence Taskforce. Archived from the original on 11 October 2020. Retrieved 11 July 2020.
- ^ Motseki, Thabiso Patrick (7 June 2022). «COVID-19 Vaccination Guidelines». www.nih.gov. National Institutes of Health. Archived from the original on 19 January 2021. Retrieved 18 January 2021.
- ^ Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. (April 2020). «Clinical Characteristics of Coronavirus Disease 2019 in China». The New England Journal of Medicine. Massachusetts Medical Society. 382 (18): 1708–1720. doi:10.1056/nejmoa2002032. PMC 7092819. PMID 32109013.
- ^ Henry BM (April 2020). «COVID-19, ECMO, and lymphopenia: a word of caution». The Lancet. Respiratory Medicine. Elsevier BV. 8 (4): e24. doi:10.1016/s2213-2600(20)30119-3. PMC 7118650. PMID 32178774.
- ^ Kim JS, Lee JY, Yang JW, Lee KH, Effenberger M, Szpirt W, et al. (2021). «Immunopathogenesis and treatment of cytokine storm in COVID-19». Theranostics. 11 (1): 316–329. doi:10.7150/thno.49713. PMC 7681075. PMID 33391477.
- ^ Doshi P (October 2020). «Will covid-19 vaccines save lives? Current trials aren’t designed to tell us». BMJ. 371: m4037. doi:10.1136/bmj.m4037. PMID 33087398. S2CID 224817161.
- ^ a b Palmieri L, Andrianou X, Barbariol P, Bella A, Bellino S, Benelli E, et al. (22 July 2020). Characteristics of SARS-CoV-2 patients dying in Italy Report based on available data on July 22nd, 2020 (PDF) (Report). Istituto Superiore di Sanità. Retrieved 4 October 2020.
- ^ Tzoulis P, Waung JA, Bagkeris E, Hussein Z, Biddanda A, Cousins J, et al. (May 2021). «Dysnatremia is a Predictor for Morbidity and Mortality in Hospitalized Patients with COVID-19». The Journal of Clinical Endocrinology and Metabolism. 106 (6): 1637–1648. doi:10.1210/clinem/dgab107. PMC 7928894. PMID 33624101.
- ^ Tzoulis P, Grossman AB, Baldeweg SE, Bouloux P, Kaltsas G (September 2021). «MANAGEMENT OF ENDOCRINE DISEASE: Dysnatraemia in COVID-19: prevalence, prognostic impact, pathophysiology, and management». European Journal of Endocrinology. 185 (4): R103–R111. doi:10.1530/EJE-21-0281. PMC 8428074. PMID 34370712.
- ^ Baranovskii DS, Klabukov ID, Krasilnikova OA, Nikogosov DA, Polekhina NV, Baranovskaia DR, et al. (December 1975). «Letter: Acid secretion by gastric mucous membrane». The American Journal of Physiology. 229 (6): 21–25. doi:10.1080/03007995.2020.1853510. PMC 7738209. PMID 33210948. S2CID 227065216.
- ^ Christensen B, Favaloro EJ, Lippi G, Van Cott EM (October 2020). «Hematology Laboratory Abnormalities in Patients with Coronavirus Disease 2019 (COVID-19)». Seminars in Thrombosis and Hemostasis. 46 (7): 845–849. doi:10.1055/s-0040-1715458. PMC 7645834. PMID 32877961.
- ^ «Living with Covid19». NIHR Themed Reviews. National Institute for Health Research. 15 October 2020. doi:10.3310/themedreview_41169.
- ^ a b «How long does COVID-19 last?». UK COVID Symptom Study. 6 June 2020. Retrieved 15 October 2020.
- ^ «Summary of COVID-19 Long Term Health Effects: Emerging evidence and Ongoing Investigation» (PDF). University of Washington. 1 September 2020. Archived from the original (PDF) on 18 December 2020. Retrieved 15 October 2020.
- ^ «Long-term symptoms of COVID-19 ‘really concerning’, says WHO chief». UN News. 30 October 2020. Retrieved 7 March 2021.
- ^ «Coronavirus disease 2019 (COVID-19) – Prognosis». BMJ. Retrieved 15 November 2020.
- ^ Lavery AM, Preston LE, Ko JY, Chevinsky JR, DeSisto CL, Pennington AF, et al. (November 2020). «Characteristics of Hospitalized COVID-19 Patients Discharged and Experiencing Same-Hospital Readmission – United States, March–August 2020». MMWR. Morbidity and Mortality Weekly Report. 69 (45): 1695–1699. doi:10.15585/mmwr.mm6945e2. PMC 7660660. PMID 33180754.
- ^ Vardavas CI, Nikitara K (March 2020). «COVID-19 and smoking: A systematic review of the evidence». Tobacco Induced Diseases. 18: 20. doi:10.18332/tid/119324. PMC 7083240. PMID 32206052.
- ^ a b c Engin AB, Engin ED, Engin A (August 2020). «Two important controversial risk factors in SARS-CoV-2 infection: Obesity and smoking». Environmental Toxicology and Pharmacology. 78: 103411. doi:10.1016/j.etap.2020.103411. PMC 7227557. PMID 32422280.
- ^ Setti L, Passarini F, De Gennaro G, Barbieri P, Licen S, Perrone MG, et al. (September 2020). «Potential role of particulate matter in the spreading of COVID-19 in Northern Italy: first observational study based on initial epidemic diffusion». BMJ Open. 10 (9): e039338. doi:10.1136/bmjopen-2020-039338. PMC 7517216. PMID 32973066.
- ^ Wu X, Nethery RC, Sabath MB, Braun D, Dominici F (November 2020). «Air pollution and COVID-19 mortality in the United States: Strengths and limitations of an ecological regression analysis». Science Advances. 6 (45): eabd4049. Bibcode:2020SciA….6.4049W. doi:10.1126/sciadv.abd4049. PMC 7673673. PMID 33148655.
- ^ Pansini R, Fornacca D (June 2021). «Early Spread of COVID-19 in the Air-Polluted Regions of Eight Severely Affected Countries». Atmosphere. 12 (6): 795. Bibcode:2021Atmos..12..795P. doi:10.3390/atmos12060795.
- ^ Comunian S, Dongo D, Milani C, Palestini P (June 2020). «Air Pollution and Covid-19: The Role of Particulate Matter in the Spread and Increase of Covid-19’s Morbidity and Mortality». International Journal of Environmental Research and Public Health. 17 (12): 4487. doi:10.3390/ijerph17124487. PMC 7345938. PMID 32580440.
- ^ Domingo JL, Marquès M, Rovira J (September 2020). «Influence of airborne transmission of SARS-CoV-2 on COVID-19 pandemic. A review». Environmental Research. 188: 109861. Bibcode:2020ER….188j9861D. doi:10.1016/j.envres.2020.109861. PMC 7309850. PMID 32718835.
- ^ «COVID-19: Who’s at higher risk of serious symptoms?». Mayo Clinic.
- ^ Tamara A, Tahapary DL (July 2020). «Obesity as a predictor for a poor prognosis of COVID-19: A systematic review». Diabetes & Metabolic Syndrome. 14 (4): 655–659. doi:10.1016/j.dsx.2020.05.020. PMC 7217103. PMID 32438328.
- ^ Petrakis D, Margină D, Tsarouhas K, Tekos F, Stan M, Nikitovic D, et al. (July 2020). «Obesity – A risk factor for increased COVID-19, severity and lethality (Review)». Molecular Medicine Reports. 22 (1): 9–19. doi:10.3892/mmr.2020.11127. PMC 7248467. PMID 32377709.
- ^ Roca-Fernández A, Dennis A, Nicholls R, McGonigle J, Kelly M, Banerjee R, et al. (29 March 2021). «Hepatic Steatosis, Rather Than Underlying Obesity, Increases the Risk of Infection and Hospitalization for COVID-19». Frontiers in Medicine. 8: 636637. doi:10.3389/fmed.2021.636637. ISSN 2296-858X. PMC 8039134. PMID 33855033.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020.
- ^ Devresse A, Belkhir L, Vo B, Ghaye B, Scohy A, Kabamba B, et al. (November 2020). «COVID-19 Infection in Kidney Transplant Recipients: A Single-Center Case Series of 22 Cases From Belgium». Kidney Medicine. 2 (4): 459–466. doi:10.1016/j.xkme.2020.06.001. PMC 7295531. PMID 32775986.
- ^ Dhindsa S, Champion C, Deol E, Lui M, Campbell R, Newman J, et al. (September 2022). «Association of Male Hypogonadism With Risk of Hospitalization for COVID-19». JAMA Network Open. 5 (9): e2229747. doi:10.1001/jamanetworkopen.2022.29747. PMC 9440397. PMID 36053534.
- ^ Shelton JF, Shastri AJ, Ye C, Weldon CH, Filshtein-Sonmez T, Coker D, et al. (June 2021). «Trans-ancestry analysis reveals genetic and nongenetic associations with COVID-19 susceptibility and severity». Nature Genetics. 53 (6): 801–808. doi:10.1038/s41588-021-00854-7. PMID 33888907. S2CID 233372385.
- ^ Wallis C. «One in Seven Dire COVID Cases May Result from a Faulty Immune Response». Scientific American.
- ^ Bastard P, Rosen LB, Zhang Q, Michailidis E, Hoffmann HH, Zhang Y, et al. (October 2020). «Autoantibodies against type I IFNs in patients with life-threatening COVID-19». Science. 370 (6515): eabd4585. doi:10.1126/science.abd4585. PMC 7857397. PMID 32972996. S2CID 221914095.
- ^ Fusco DN, Brisac C, John SP, Huang YW, Chin CR, Xie T, et al. (June 2013). «A genetic screen identifies interferon-α effector genes required to suppress hepatitis C virus replication». Gastroenterology. 144 (7): 1438–49, 1449.e1-9. doi:10.1053/j.gastro.2013.02.026. PMC 3665646. PMID 23462180.
- ^ Namkoong H, Edahiro R, Takano T, Nishihara H, Shirai Y, Sonehara K, et al. (September 2022). «DOCK2 is involved in the host genetics and biology of severe COVID-19». Nature. 609 (7928): 754–760. Bibcode:2022Natur.609..754N. doi:10.1038/s41586-022-05163-5. PMC 9492544. PMID 35940203.
- ^ Kousathanas A, Pairo-Castineira E, Rawlik K, Stuckey A, Odhams CA, Walker S, et al. (July 2022). «Whole-genome sequencing reveals host factors underlying critical COVID-19». Nature. 607 (7917): 97–103. doi:10.1038/s41586-022-04576-6. PMC 9259496. PMID 35255492.
- ^ «COVID-19 in children and the role of school settings in transmission – first update». European Centre for Disease Prevention and Control. 23 December 2020. Retrieved 6 April 2021.
- ^ «Estimated Disease Burden of COVID-19». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 6 April 2021.
- ^ Reardon S (2 September 2021). «Why don’t kids tend to get as sick from Covid-19?». Knowable Magazine. doi:10.1146/knowable-090121-1. S2CID 239653475. Retrieved 7 September 2021.
- ^ «Information for Pediatric Healthcare Providers». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 6 April 2021.
- ^ Götzinger F, Santiago-García B, Noguera-Julián A, Lanaspa M, Lancella L, Calò Carducci FI, et al. (September 2020). «COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study». The Lancet. Child & Adolescent Health. 4 (9): 653–661. doi:10.1016/S2352-4642(20)30177-2. PMC 7316447. PMID 32593339.
- ^ Fang L, Karakiulakis G, Roth M (April 2020). «Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection?». The Lancet. Respiratory Medicine. 8 (4): e21. doi:10.1016/S0140-6736(20)30311-1. PMC 7118626. PMID 32171062.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Archived from the original on 2 March 2020. Retrieved 2 March 2020.
- ^ Hui DS, I Azhar E, Madani TA, Ntoumi F, Kock R, Dar O, et al. (February 2020). «The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health – The latest 2019 novel coronavirus outbreak in Wuhan, China». International Journal of Infectious Diseases. 91: 264–266. doi:10.1016/j.ijid.2020.01.009. PMC 7128332. PMID 31953166.
- ^ Murthy S, Gomersall CD, Fowler RA (April 2020). «Care for Critically Ill Patients With COVID-19». JAMA. 323 (15): 1499–1500. doi:10.1001/jama.2020.3633. PMID 32159735.
- ^ Cascella M, Rajnik M, Cuomo A, Dulebohn SC, Di Napoli R (2020). «Features, Evaluation and Treatment Coronavirus (COVID-19)». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 32150360. Retrieved 18 March 2020.
- ^ Heymann DL, Shindo N, et al. (WHO Scientific and Technical Advisory Group for Infectious Hazards) (February 2020). «COVID-19: what is next for public health?». Lancet. 395 (10224): 542–545. doi:10.1016/s0140-6736(20)30374-3. PMC 7138015. PMID 32061313.
- ^ Romiti GF, Corica B, Lip GY, Proietti M (June 2021). «Prevalence and Impact of Atrial Fibrillation in Hospitalized Patients with COVID-19: A Systematic Review and Meta-Analysis». Journal of Clinical Medicine. 10 (11): 2490. doi:10.3390/jcm10112490. PMC 8200114. PMID 34199857.
- ^ Wen W, Zhang H, Zhou M, Cheng Y, Ye L, Chen J, et al. (November 2020). «Arrhythmia in patients with severe coronavirus disease (COVID-19): a meta-analysis». European Review for Medical and Pharmacological Sciences. 24 (21): 11395–11401. doi:10.26355/eurrev_202011_23632. PMID 33215461. S2CID 227077132.
- ^ Long B, Brady WJ, Koyfman A, Gottlieb M (July 2020). «Cardiovascular complications in COVID-19». The American Journal of Emergency Medicine. 38 (7): 1504–1507. doi:10.1016/j.ajem.2020.04.048. PMC 7165109. PMID 32317203.
- ^ Puntmann VO, Carerj ML, Wieters I, Fahim M, Arendt C, Hoffmann J, et al. (November 2020). «Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019 (COVID-19)». JAMA Cardiology. 5 (11): 1265–1273. doi:10.1001/jamacardio.2020.3557. PMC 7385689. PMID 32730619.
- ^ Lindner D, Fitzek A, Bräuninger H, Aleshcheva G, Edler C, Meissner K, et al. (November 2020). «Association of Cardiac Infection With SARS-CoV-2 in Confirmed COVID-19 Autopsy Cases». JAMA Cardiology. 5 (11): 1281–1285. doi:10.1001/jamacardio.2020.3551. PMC 7385672. PMID 32730555.
- ^ Siripanthong B, Nazarian S, Muser D, Deo R, Santangeli P, Khanji MY, et al. (September 2020). «Recognizing COVID-19-related myocarditis: The possible pathophysiology and proposed guideline for diagnosis and management». Heart Rhythm. 17 (9): 1463–1471. doi:10.1016/j.hrthm.2020.05.001. PMC 7199677. PMID 32387246.
- ^ Xu L, Liu J, Lu M, Yang D, Zheng X (May 2020). «Liver injury during highly pathogenic human coronavirus infections». Liver International. 40 (5): 998–1004. doi:10.1111/liv.14435. PMC 7228361. PMID 32170806.
- ^ Carod-Artal FJ (May 2020). «Neurological complications of coronavirus and COVID-19». Revista de Neurología. 70 (9): 311–322. doi:10.33588/rn.7009.2020179. PMID 32329044. S2CID 226200547.
- ^ Toscano G, Palmerini F, Ravaglia S, Ruiz L, Invernizzi P, Cuzzoni MG, et al. (June 2020). «Guillain-Barré Syndrome Associated with SARS-CoV-2». The New England Journal of Medicine. 382 (26): 2574–2576. doi:10.1056/NEJMc2009191. PMC 7182017. PMID 32302082.
- ^ «Multisystem inflammatory syndrome in children and adolescents temporally related to COVID-19». World Health Organization (WHO). 15 May 2020. Retrieved 20 May 2020.
- ^ HAN Archive – 00432. U.S. Centers for Disease Control and Prevention (CDC) (Report). 15 May 2020. Retrieved 20 May 2020.
- ^ Poyiadji N, Shahin G, Noujaim D, Stone M, Patel S, Griffith B (August 2020). «COVID-19-associated Acute Hemorrhagic Necrotizing Encephalopathy: Imaging Features». Radiology. 296 (2): E119–E120. doi:10.1148/radiol.2020201187. PMC 7233386. PMID 32228363.
- ^ a b Córdoba-Vives S, Peñaranda G (April 2020). «COVID-19 y Embarazo». Medical Journal of Costa Rica (in Spanish): 629. Archived from the original on 18 June 2021. Retrieved 14 February 2022.
- ^ Das S, Dhar S (July 2021). «Mucormycosis Following COVID-19 Infections: an Insight». The Indian Journal of Surgery. 84 (3): 585–586. doi:10.1007/s12262-021-03028-1. PMC 8270771. PMID 34276145. S2CID 235782159.
- ^ Baruah C, Devi P, Deka B, Sharma DK (June 2021). «Mucormycosis and Aspergillosis have been Linked to Covid-19-Related Fungal Infections in India». Advancements in Case Studies. 3 (1). doi:10.31031/AICS.2021.03.000555. ISSN 2639-0531. S2CID 244678882 – via ResearchGate.
- ^ «Living with Covid19». NIHR Themed Review. National Institute for Health Research. 15 October 2020. doi:10.3310/themedreview_41169. S2CID 241034526.
- ^ «Summary of COVID-19 Long Term Health Effects: Emerging evidence and Ongoing Investigation» (PDF). University of Washington. 1 September 2020. Retrieved 15 October 2020.
- ^ Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. (February 2020). «Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China». Lancet. 395 (10223): 497–506. doi:10.1016/S0140-6736(20)30183-5. PMC 7159299. PMID 31986264.
- ^ a b Torres-Castro R, Vasconcello-Castillo L, Alsina-Restoy X, Solis-Navarro L, Burgos F, Puppo H, Vilaró J (November 2020). «Respiratory function in patients post-infection by COVID-19: a systematic review and meta-analysis». Pulmonology. Elsevier BV. 27 (4): 328–337. doi:10.1016/j.pulmoe.2020.10.013. PMC 7687368. PMID 33262076. S2CID 227162748.
- ^ Shaw B, Daskareh M, Gholamrezanezhad A (January 2021). «The lingering manifestations of COVID-19 during and after convalescence: update on long-term pulmonary consequences of coronavirus disease 2019 (COVID-19)». La Radiologia Medica. 126 (1): 40–46. doi:10.1007/s11547-020-01295-8. PMC 7529085. PMID 33006087.
- ^ Zhao YM, Shang YM, Song WB, Li QQ, Xie H, Xu QF, et al. (August 2020). «Follow-up study of the pulmonary function and related physiological characteristics of COVID-19 survivors three months after recovery». EClinicalMedicine. 25: 100463. doi:10.1016/j.ijtb.2020.11.003. PMC 7654356. PMID 32838236.
- ^ «COVID-19 Lung Damage». Johns Hopkins Medicine. 28 February 2022. Retrieved 21 May 2022.
- ^ Taquet M, Sillett R, Zhu L, Mendel J, Camplisson I, Dercon Q, Harrison PJ (17 August 2022). «Neurological and psychiatric risk trajectories after SARS-CoV-2 infection: an analysis of 2-year retrospective cohort studies including 1 284 437 patients». The Lancet Psychiatry. 9 (10): 815–827. doi:10.1016/S2215-0366(22)00260-7. ISSN 2215-0366. PMC 9385200. PMID 35987197. S2CID 251626731.
- ^ «Immune responses and correlates of protective immunity against SARS-CoV-2». European Centre for Disease Prevention and Control. 18 May 2021. Retrieved 3 June 2021.
- ^ Vabret N, Britton GJ, Gruber C, Hegde S, Kim J, Kuksin M, et al. (June 2020). «Immunology of COVID-19: Current State of the Science». Immunity. 52 (6): 910–941. doi:10.1016/j.immuni.2020.05.002. PMC 7200337. PMID 32505227.
- ^ Wang Z, Muecksch F, Schaefer-Babajew D, Finkin S, Viant C, Gaebler C, et al. (July 2021). «Naturally enhanced neutralizing breadth against SARS-CoV-2 one year after infection». Nature. 595 (7867): 426–431. Bibcode:2021Natur.595..426W. doi:10.1038/s41586-021-03696-9. PMC 8277577. PMID 34126625.
- ^ a b Cohen JI, Burbelo PD (December 2020). «Reinfection with SARS-CoV-2: Implications for Vaccines». Clinical Infectious Diseases. 73 (11): e4223–e4228. doi:10.1093/cid/ciaa1866. PMC 7799323. PMID 33338197. S2CID 229323810.
- ^ a b Wang J, Kaperak C, Sato T, Sakuraba A (August 2021). «COVID-19 reinfection: a rapid systematic review of case reports and case series». Journal of Investigative Medicine. 69 (6): 1253–1255. doi:10.1136/jim-2021-001853. ISSN 1081-5589. PMID 34006572. S2CID 234773697.
- ^ a b «How soon after catching COVID-19 can you get it again?». ABC News. 2 May 2022. Retrieved 24 June 2022.
- ^ Centers for Disease Control and Prevention (May 2012). «Lesson 3: Measures of Risk Section 3: Mortality Frequency Measures». Principles of Epidemiology in Public Health Practice (Third ed.). U.S. Centers for Disease Control and Prevention (CDC). No. SS1978. Archived from the original on 28 February 2020. Retrieved 28 March 2020.
- ^ Ritchie H, Roser M (25 March 2020). Chivers T (ed.). «What do we know about the risk of dying from COVID-19?». Our World in Data. Archived from the original on 28 March 2020. Retrieved 28 March 2020.
- ^ Castagnoli R, Votto M, Licari A, Brambilla I, Bruno R, Perlini S, et al. (September 2020). «Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Infection in Children and Adolescents: A Systematic Review». JAMA Pediatrics. 174 (9): 882–889. doi:10.1001/jamapediatrics.2020.1467. PMID 32320004.
- ^ Lu X, Zhang L, Du H, Zhang J, Li YY, Qu J, et al. (April 2020). «SARS-CoV-2 Infection in Children». The New England Journal of Medicine. Massachusetts Medical Society. 382 (17): 1663–1665. doi:10.1056/nejmc2005073. PMC 7121177. PMID 32187458.
- ^ Dong Y, Mo X, Hu Y, Qi X, Jiang F, Jiang Z, Tong S (June 2020). «Epidemiology of COVID-19 Among Children in China». Pediatrics. 145 (6): e20200702. doi:10.1542/peds.2020-0702. PMID 32179660. S2CID 219118986.
- ^ a b c d Dehingia N (2021). «Sex differences in COVID-19 case fatality: do we know enough?». The Lancet. Global Health. 9 (1): e14–e15. doi:10.1016/S2214-109X(20)30464-2. PMC 7834645. PMID 33160453.
- ^ Lazzerini M, Putoto G (May 2020). «COVID-19 in Italy: momentous decisions and many uncertainties». The Lancet. Global Health. 8 (5): e641–e642. doi:10.1016/S2214-109X(20)30110-8. PMC 7104294. PMID 32199072.
- ^ Ritchie H, Ortiz-Ospina E, Beltekian D, Mathieu E, Hasell J, MacDonald B, et al. (5 March 2020). «What do we know about the risk of dying from COVID-19?». Our World in Data. Archived from the original on 28 March 2020. Retrieved 28 March 2020.
- ^ «Total confirmed cases of COVID-19 per million people». Our World in Data. Archived from the original on 19 March 2020. Retrieved 21 June 2022.[needs update]
- ^ «Cumulative confirmed COVID-19 deaths per million people». Our World in Data.
- ^ Mallapaty S (June 2020). «How deadly is the coronavirus? Scientists are close to an answer». Nature. 582 (7813): 467–468. Bibcode:2020Natur.582..467M. doi:10.1038/d41586-020-01738-2. PMID 32546810. S2CID 219726496.
- ^ Alwan NA, Burgess RA, Ashworth S, Beale R, Bhadelia N, Bogaert D, et al. (October 2020). «Scientific consensus on the COVID-19 pandemic: we need to act now». Lancet. 396 (10260): e71–e72. doi:10.1016/S0140-6736(20)32153-X. PMC 7557300. PMID 33069277.
- ^ Meyerowitz-Katz G, Merone L (December 2020). «A systematic review and meta-analysis of published research data on COVID-19 infection fatality rates». International Journal of Infectious Diseases. 101: 138–148. doi:10.1016/j.ijid.2020.09.1464. PMC 7524446. PMID 33007452.
- ^ Zhang D, Hu M, Ji Q (October 2020). «Financial markets under the global pandemic of COVID-19». Finance Research Letters. 36: 101528. Bibcode:2020CSFX….500043D. doi:10.1016/j.csfx.2020.100043. PMC 7402242. PMID 32837360.
- ^ a b c d e Levin AT, Hanage WP, Owusu-Boaitey N, Cochran KB, Walsh SP, Meyerowitz-Katz G (December 2020). «Assessing the age specificity of infection fatality rates for COVID-19: systematic review, meta-analysis, and public policy implications». European Journal of Epidemiology. 35 (12): 1123–1138. doi:10.1007/s10654-020-00698-1. PMC 7721859. PMID 33289900.
Text was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ^ World Health Organization (22 December 2020). «Background paper on Covid-19 disease and vaccines: prepared by the Strategic Advisory Group of Experts (SAGE) on immunization working group on COVID-19 vaccines». World Health Organization. hdl:10665/338095.
- ^ «Coronavirus disease 2019 (COVID-19) Situation Report – 30» (PDF). 19 February 2020. Retrieved 3 June 2020.
- ^ «Coronavirus disease 2019 (COVID-19) Situation Report – 31» (PDF). 20 February 2020. Retrieved 23 April 2020.
- ^ McNeil Jr DG (4 July 2020). «The Pandemic’s Big Mystery: How Deadly Is the Coronavirus? – Even with more than 500,000 dead worldwide, scientists are struggling to learn how often the virus kills. Here’s why». The New York Times. Archived from the original on 4 July 2020. Retrieved 6 July 2020.
- ^ «Global Research and Innovation Forum on COVID-19: Virtual Press Conference» (PDF). World Health Organization. 2 July 2020.
- ^ «Estimating mortality from COVID-19». World Health Organization (WHO). Retrieved 21 September 2020.
- ^ Shaffer C (23 October 2021). «Covid-19 still rife in Iran». New Scientist. 252 (3357): 10–11. Bibcode:2021NewSc.252…10S. doi:10.1016/S0262-4079(21)01865-0. ISSN 0262-4079. PMC 8536311. PMID 34720322.
- ^ «COVID-19: Data». City of New York.
- ^ Wilson L (May 2020). «SARS-CoV-2, COVID-19, Infection Fatality Rate (IFR) Implied by the Serology, Antibody, Testing in New York City». SSRN 3590771.
- ^ Yang W, Kandula S, Huynh M, Greene SK, Van Wye G, Li W, et al. (February 2021). «Estimating the infection-fatality risk of SARS-CoV-2 in New York City during the spring 2020 pandemic wave: a model-based analysis». The Lancet. Infectious Diseases. 21 (2): 203–212. doi:10.1016/s1473-3099(20)30769-6. PMC 7572090. PMID 33091374.
- ^ Modi C (21 April 2020). «How deadly is COVID-19? Data Science offers answers from Italy mortality data». Medium. Retrieved 23 April 2020.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 10 September 2020. Retrieved 9 December 2020.
- ^ Salje H, Tran Kiem C, Lefrancq N, Courtejoie N, Bosetti P, Paireau J, et al. (July 2020). «Estimating the burden of SARS-CoV-2 in France». Science. 369 (6500): 208–211. Bibcode:2020Sci…369..208S. doi:10.1126/science.abc3517. PMC 7223792. PMID 32404476.
- ^ McIntosh K (April 2021). «Covid 19 Clinical Features». UpToDate. Retrieved 12 May 2021.
- ^ Peckham H, de Gruijter NM, Raine C, Radziszewska A, Ciurtin C, Wedderburn LR, et al. (December 2020). «Male sex identified by global COVID-19 meta-analysis as a risk factor for death and ITU admission». Nature Communications. 11 (1): 6317. Bibcode:2020NatCo..11.6317P. doi:10.1038/s41467-020-19741-6. PMC 7726563. PMID 33298944.
- ^ Abate BB, Kassie AM, Kassaw MW, Aragie TG, Masresha SA (October 2020). «Sex difference in coronavirus disease (COVID-19): a systematic review and meta-analysis». BMJ Open. 10 (10): e040129. doi:10.1136/bmjopen-2020-040129. PMC 7539579. PMID 33028563.
- ^ a b c The Novel Coronavirus Pneumonia Emergency Response Epidemiology Team (February 2020). «The Epidemiological Characteristics of an Outbreak of 2019 Novel Coronavirus Diseases (COVID-19) – China, 2020». China CDC Weekly. 2 (8): 113–122. doi:10.46234/ccdcw2020.032. PMC 839292. PMID 34594836.
- ^ Hu Y, Sun J, Dai Z, Deng H, Li X, Huang Q, et al. (June 2020). «Prevalence and severity of corona virus disease 2019 (COVID-19): A systematic review and meta-analysis». Journal of Clinical Virology. 127: 104371. doi:10.1016/j.jcv.2020.104371. PMC 7195434. PMID 32315817.
- ^ Fu L, Wang B, Yuan T, Chen X, Ao Y, Fitzpatrick T, et al. (June 2020). «Clinical characteristics of coronavirus disease 2019 (COVID-19) in China: A systematic review and meta-analysis». The Journal of Infection. 80 (6): 656–665. doi:10.1016/j.jinf.2020.03.041. PMC 7151416. PMID 32283155.
- ^ Yuki K, Fujiogi M, Koutsogiannaki S (June 2020). «COVID-19 pathophysiology: A review». Clinical Immunology. 215: 108427. doi:10.1016/j.clim.2020.108427. PMC 7169933. PMID 32325252. S2CID 216028003.
- ^ Rabin RC (20 March 2020). «In Italy, Coronavirus Takes a Higher Toll on Men». The New York Times. Archived from the original on 20 March 2020. Retrieved 7 April 2020.
- ^ «COVID-19 weekly surveillance report». World Health Organization (WHO). Archived from the original on 15 March 2020. Retrieved 7 April 2020.
- ^ a b Gupta AH (3 April 2020). «Does Covid-19 Hit Women and Men Differently? U.S. Isn’t Keeping Track». The New York Times. Archived from the original on 3 April 2020. Retrieved 7 April 2020.
- ^ a b Dorn AV, Cooney RE, Sabin ML (April 2020). «COVID-19 exacerbating inequalities in the US». Lancet. 395 (10232): 1243–1244. doi:10.1016/S0140-6736(20)30893-X. PMC 7162639. PMID 32305087.
- ^ a b Shauly-Aharonov, Michal; Shafrir, Asher; Paltiel, Ora; Calderon-Margalit, Ronit; Safadi, Rifaat; Bicher, Roee; Barenholz-Goultschin, Orit; Stokar, Joshua (22 July 2021). «Both high and low pre-infection glucose levels associated with increased risk for severe COVID-19: New insights from a population-based study». PLOS ONE. 16 (7): e0254847. Bibcode:2021PLoSO..1654847S. doi:10.1371/journal.pone.0254847. ISSN 1932-6203. PMC 8297851. PMID 34293038.
- ^ Adams ML, Katz DL, Grandpre J (August 2020). «Population-Based Estimates of Chronic Conditions Affecting Risk for Complications from Coronavirus Disease, United States». Emerging Infectious Diseases. 26 (8): 1831–1833. doi:10.3201/eid2608.200679. PMC 7392427. PMID 32324118.
- ^ Batthyány K (13 October 2020). «Coronavirus y Desigualdades preexistentes: Género y Cuidados». CLACSO (Consejo Latinoamericano de Ciencias Sociales). Retrieved 22 April 2021.
- ^ «COVID-19 Presents Significant Risks for American Indian and Alaska Native People». 14 May 2020.
- ^ «COVID-19 Presents Significant Risks for American Indian and Alaska Native People». 14 May 2020.
- ^ Laurencin CT, McClinton A (June 2020). «The COVID-19 Pandemic: a Call to Action to Identify and Address Racial and Ethnic Disparities». Journal of Racial and Ethnic Health Disparities. 7 (3): 398–402. doi:10.1007/s40615-020-00756-0. PMC 7166096. PMID 32306369.
- ^ «How coronavirus deaths in the UK compare by race and ethnicity». The Independent. 9 June 2020. Retrieved 10 June 2020.
- ^ «Emerging findings on the impact of COVID-19 on black and minority ethnic people». The Health Foundation. Retrieved 10 June 2020.
- ^ Butcher B, Massey J (9 June 2020). «Why are more BAME people dying from coronavirus?». BBC News. Retrieved 10 June 2020.
- ^ a b c «The ancient Neanderthal hand in severe COVID-19». ScienceDaily. 30 September 2020. Retrieved 13 December 2020.
- ^ «WHO Director-General’s statement on the advice of the IHR Emergency Committee on Novel Coronavirus». World Health Organization (WHO).
- ^ Garg S, Kim L, Whitaker M, O’Halloran A, Cummings C, Holstein R, et al. (April 2020). «Hospitalization Rates and Characteristics of Patients Hospitalized with Laboratory-Confirmed Coronavirus Disease 2019 – COVID-NET, 14 States, March 1–30, 2020». MMWR. Morbidity and Mortality Weekly Report. 69 (15): 458–464. doi:10.15585/mmwr.mm6915e3. PMC 7755063. PMID 32298251.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 19 June 2020.
- ^ Zhao Q, Meng M, Kumar R, Wu Y, Huang J, Lian N, et al. (October 2020). «The impact of COPD and smoking history on the severity of COVID-19: A systemic review and meta-analysis». Journal of Medical Virology. 92 (10): 1915–1921. doi:10.1002/jmv.25889. PMC 7262275. PMID 32293753.
- ^ «Smoking and COVID-19». World Health Organization (WHO). Retrieved 19 June 2020.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 4 May 2020.
- ^ DeRobertis J (3 May 2020). «People who use drugs are more vulnerable to coronavirus. Here’s what clinics are doing to help». The Advocate (Louisiana). Retrieved 4 May 2020.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020.
- ^ Frutos R, Gavotte L, Devaux CA (November 2021). «Understanding the origin of COVID-19 requires to change the paradigm on zoonotic emergence from the spillover to the circulation model». Infection, Genetics and Evolution. 95: 104812. doi:10.1016/j.meegid.2021.104812. PMC 7969828. PMID 33744401.
- ^ Holmes EC, Goldstein SA, Rasmussen AL, Robertson DL, Crits-Christoph A, Wertheim JO, et al. (September 2021). «The origins of SARS-CoV-2: A critical review». Cell. 184 (19): 4848–4856. doi:10.1016/j.cell.2021.08.017. PMC 8373617. PMID 34480864.
- ^ «WHO-convened Global Study of Origins of SARS-CoV-2: China Part». World Health Organization. 30 March 2021. Retrieved 29 July 2022.
- ^ Duarte F (24 February 2020). «As the cases of coronavirus increase in China and around the world, the hunt is on to identify «patient zero»«. BBC News. Retrieved 22 March 2020.
- ^ Pekar JE, Magee P, Parker E, Moshiri N, Izhikevich K, Havens JL, et al. (26 July 2022). «The molecular epidemiology of multiple zoonotic origins of SARS-CoV-2». Science. 377 (6609): 960–966. Bibcode:2022Sci…377..960P. doi:10.1126/science.abp8337. PMC 9348752. PMID 35881005.
- ^ Gill V (26 July 2022). «Covid origin studies say evidence points to Wuhan market».
- ^ Worobey M, Levy JI, Serrano LM, Crits-Christoph A, Pekar JE, Goldstein SA, et al. (July 2022). «The Huanan Seafood Wholesale Market in Wuhan was the early epicenter of the COVID-19 pandemic». Science. 377 (6609): 951–959. Bibcode:2022Sci…377..951W. doi:10.1126/science.abp8715. PMC 9348750. PMID 35881010. S2CID 251067542.
- ^ «Debate deepens over Wuhan wet market’s role in kickstarting the pandemic». National Geographic. 27 July 2022.
- ^ Li X, Zai J, Zhao Q, Nie Q, Li Y, Foley BT, Chaillon A (June 2020). «Evolutionary history, potential intermediate animal host, and cross-species analyses of SARS-CoV-2». Journal of Medical Virology. 92 (6): 602–611. doi:10.1002/jmv.25731. PMC 7228310. PMID 32104911.
- ^ Andersen KG, Rambaut A, Lipkin WI, Holmes EC, Garry RF (April 2020). «The proximal origin of SARS-CoV-2». Nature Medicine. 26 (4): 450–452. doi:10.1038/s41591-020-0820-9. PMC 7095063. PMID 32284615.
- ^ van Dorp L, Acman M, Richard D, Shaw LP, Ford CE, Ormond L, et al. (September 2020). «Emergence of genomic diversity and recurrent mutations in SARS-CoV-2». Infection, Genetics and Evolution. 83: 104351. doi:10.1016/j.meegid.2020.104351. PMC 7199730. PMID 32387564.
- ^ Grose TK (13 May 2020). «Did the Coronavirus Originate Outside of Wuhan?». U.S. News & World Report.
- ^ Wolf ZB (25 May 2021). «Analysis: Why scientists are suddenly more interested in the lab-leak theory of Covid’s origin». CNN. Retrieved 26 May 2021.
- ^ Maxmen A (September 2021). «US COVID origins report: researchers pleased with scientific approach». Nature. 597 (7875): 159–160. Bibcode:2021Natur.597..159M. doi:10.1038/d41586-021-02366-0. PMID 34465917. S2CID 237373547.
- ^ Paun C, Zeller S, Reader R, Leonard B, Scullion G (4 November 2022). «Cross-examining the lab-leak theorists». Politico. Retrieved 21 November 2022.
- ^ Hosenball M, Zengerle P (30 October 2021). «U.S. spy agencies say origins of COVID-19 may never be known». Reuters. Retrieved 21 November 2022.
- ^ Wu YC, Chen CS, Chan YJ (March 2020). «The outbreak of COVID-19: An overview». Journal of the Chinese Medical Association. 83 (3): 217–220. doi:10.1097/JCMA.0000000000000270. PMC 7153464. PMID 32134861.
- ^ Wang C, Horby PW, Hayden FG, Gao GF (February 2020). «A novel coronavirus outbreak of global health concern». Lancet. 395 (10223): 470–473. doi:10.1016/S0140-6736(20)30185-9. PMC 7135038. PMID 31986257.
- ^ Cohen J (January 2020). «Wuhan seafood market may not be source of novel virus spreading globally». Science. doi:10.1126/science.abb0611.
- ^ «Novel Coronavirus – China». World Health Organization (WHO). 12 January 2020. Archived from the original on 14 January 2020.
- ^ Kessler G (17 April 2020). «Trump’s false claim that the WHO said the coronavirus was ‘not communicable’«. The Washington Post. Archived from the original on 17 April 2020. Retrieved 17 April 2020.
- ^ Kuo L (21 January 2020). «China confirms human-to-human transmission of coronavirus». The Guardian. Retrieved 18 April 2020.
- ^ Epidemiology Working Group For Ncip Epidemic Response; Chinese Center for Disease Control Prevention (February 2020). «[The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China]». Zhonghua Liu Xing Bing Xue Za Zhi = Zhonghua Liuxingbingxue Zazhi (in Chinese). 41 (2): 145–151. doi:10.3760/cma.j.issn.0254-6450.2020.02.003. PMID 32064853. S2CID 211133882.
- ^ Areddy JT (26 May 2020). «China Rules Out Animal Market and Lab as Coronavirus Origin». The Wall Street Journal. Retrieved 29 May 2020.
- ^ Kelland K (19 June 2020). «Italy sewage study suggests COVID-19 was there in December 2019». Reuters. Retrieved 23 June 2020.
- ^ Heymann DL, Shindo N (February 2020). «COVID-19: what is next for public health?». Lancet. 395 (10224): 542–545. doi:10.1016/S0140-6736(20)30374-3. PMC 7138015. PMID 32061313.
- ^ Bryner J (14 March 2020). «1st known case of coronavirus traced back to November in China». livescience.com. Retrieved 31 May 2020.
- ^ Canadian Politics (8 April 2020). «The birth of a pandemic: How COVID-19 went from Wuhan to Toronto | National Post». National Post. Retrieved 31 May 2020.
- ^ 高昱 (26 February 2020). «独家 | 新冠病毒基因测序溯源:警报是何时拉响的» [Exclusive | Tracing the New Coronavirus gene sequencing: when did the alarm sound]. Caixin (in Chinese). Archived from the original on 27 February 2020. Retrieved 1 March 2020.
- ^ 路子康. «最早上报疫情的她,怎样发现这种不一样的肺炎». 中国网新闻 (in Chinese (China)). 北京. Archived from the original on 2 March 2020. Retrieved 11 February 2020.
- ^ «Undiagnosed pneumonia – China (HU): RFI». ProMED Mail. ProMED. Retrieved 7 May 2020.
- ^ «‘Hero who told the truth’: Chinese rage over coronavirus death of whistleblower doctor». The Guardian. 7 February 2020.
- ^ Kuo L (11 March 2020). «Coronavirus: Wuhan doctor speaks out against authorities». The Guardian. London.
- ^ «Novel Coronavirus». World Health Organization (WHO). Archived from the original on 2 February 2020. Retrieved 6 February 2020.
- ^ «武汉现不明原因肺炎 官方确认属实:已经做好隔离». Xinhua Net 新華網. 31 December 2019. Retrieved 31 March 2020.
- ^ 武汉市卫健委关于当前我市肺炎疫情的情况通报. WJW.Wuhan.gov.cn (in Chinese). Wuhan Municipal Health Commission. 31 December 2019. Archived from the original on 9 January 2020. Retrieved 8 February 2020.
- ^ «Mystery pneumonia virus probed in China». BBC News. 3 January 2020. Archived from the original on 5 January 2020. Retrieved 29 January 2020.
- ^ Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y, et al. (March 2020). «Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia». The New England Journal of Medicine. 382 (13): 1199–1207. doi:10.1056/NEJMoa2001316. PMC 7121484. PMID 31995857.
- ^ «China confirms sharp rise in cases of SARS-like virus across the country». 20 January 2020. Archived from the original on 20 January 2020. Retrieved 20 January 2020.
- ^ a b «Flattery and foot dragging: China’s influence over the WHO under scrutiny». The Globe and Mail. 25 April 2020.
- ^ Horton R (18 March 2020). «Scientists have been sounding the alarm on coronavirus for months. Why did Britain fail to act?». The Guardian. Retrieved 23 April 2020.
- ^ «China delayed releasing coronavirus info, frustrating WHO». Associated Press. 2 June 2020. Retrieved 3 June 2020.
- ^ «Coronavirus: Primi due casi in Italia» [Coronavirus: First two cases in Italy]. Corriere della sera (in Italian). 31 January 2020. Retrieved 31 January 2020.
- ^ «Coronavirus: Number of COVID-19 deaths in Italy surpasses China as total reaches 3,405». Sky News. Retrieved 7 May 2020.
- ^ McNeil Jr DG (26 March 2020). «The U.S. Now Leads the World in Confirmed Coronavirus Cases». The New York Times. Archived from the original on 26 March 2020. Retrieved 27 March 2020.
- ^ «Studies Show N.Y. Outbreak Originated in Europe». The New York Times. 8 April 2020. Archived from the original on 8 April 2020.
- ^ Irish J (4 May 2020). Lough RM, Graff P (eds.). «After retesting samples, French hospital discovers COVID-19 case from December». Reuters. Retrieved 4 May 2020.
- ^ Deslandes A, Berti V, Tandjaoui-Lambotte Y, Alloui C, Carbonnelle E, Zahar JR, et al. (June 2020). «SARS-CoV-2 was already spreading in France in late December 2019». International Journal of Antimicrobial Agents. 55 (6): 106006. doi:10.1016/j.ijantimicag.2020.106006. PMC 7196402. PMID 32371096.
- ^ «2 died with coronavirus weeks before 1st U.S. virus death». PBS NewsHour. 22 April 2020. Retrieved 23 April 2020.
- ^ Michael-Kordatou I, Karaolia P, Fatta-Kassinos D (October 2020). «Sewage analysis as a tool for the COVID-19 pandemic response and management: the urgent need for optimised protocols for SARS-CoV-2 detection and quantification». Journal of Environmental Chemical Engineering. 8 (5): 104306. doi:10.1016/j.jece.2020.104306. PMC 7384408. PMID 32834990.
- ^ Platto S, Xue T, Carafoli E (September 2020). «COVID19: an announced pandemic». Cell Death & Disease. 11 (9): 799. doi:10.1038/s41419-020-02995-9. PMC 7513903. PMID 32973152.
- ^ Kavya B, Abraham R (3 October 2021). Shumaker L, Wardell J (eds.). «Global COVID-19 deaths hit 5 million as Delta variant sweeps the world». Reuters.com. Reuters.
- ^ «China coronavirus: Misinformation spreads online about origin and scale». BBC News. 30 January 2020. Archived from the original on 4 February 2020. Retrieved 10 February 2020.
- ^ Taylor J (31 January 2020). «Bat soup, dodgy cures and ‘diseasology’: the spread of coronavirus misinformation». The Guardian. Archived from the original on 2 February 2020. Retrieved 3 February 2020.
- ^ «Here’s A Running List Of Disinformation Spreading About The Coronavirus». Buzzfeed News. Archived from the original on 6 February 2020. Retrieved 8 February 2020.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 10 October 2020.
- ^ «Misleading claim circulates online about infection fatality ratio of Covid-19 in the US». Fact Check. 8 October 2020. Retrieved 10 October 2020.
- ^ a b c d Kampf G, Brüggemann Y, Kaba HE, Steinmann J, Pfaender S, Scheithauer S, Steinmann E (December 2020). «Potential sources, modes of transmission and effectiveness of prevention measures against SARS-CoV-2». The Journal of Hospital Infection. 106 (4): 678–697. doi:10.1016/j.jhin.2020.09.022. PMC 7500278. PMID 32956786.
- ^ Shi J, Wen Z, Zhong G, Yang H, Wang C, Huang B, et al. (May 2020). «Susceptibility of ferrets, cats, dogs, and other domesticated animals to SARS-coronavirus 2». Science. 368 (6494): 1016–1020. doi:10.1126/science.abb7015. PMC 7164390. PMID 32269068.
- ^ a b c d e f g h Salajegheh Tazerji S, Magalhães Duarte P, Rahimi P, Shahabinejad F, Dhakal S, Singh Malik Y, et al. (September 2020). «Transmission of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) to animals: an updated review». Journal of Translational Medicine. 18 (1): 358. doi:10.1186/s12967-020-02534-2. PMC 7503431. PMID 32957995.
- ^ a b c Gorman J (22 January 2021). «The Coronavirus Kills Mink, So They Too May Get a Vaccine». The New York Times. ISSN 0362-4331. Archived from the original on 28 December 2021. Retrieved 24 February 2021.
- ^ Dhama K, Sharun K, Tiwari R, Dadar M, Malik YS, Singh KP, Chaicumpa W (June 2020). «COVID-19, an emerging coronavirus infection: advances and prospects in designing and developing vaccines, immunotherapeutics, and therapeutics». Human Vaccines & Immunotherapeutics. 16 (6): 1232–1238. doi:10.1080/21645515.2020.1735227. PMC 7103671. PMID 32186952.
- ^ Zhang L, Liu Y (May 2020). «Potential interventions for novel coronavirus in China: A systematic review». Journal of Medical Virology. 92 (5): 479–490. doi:10.1002/jmv.25707. PMC 7166986. PMID 32052466.
- ^ «Interim Laboratory Biosafety Guidelines for Handling and Processing Specimens Associated with Coronavirus Disease 2019 (COVID-19)». Coronavirus Disease 2019 (COVID-19) Lab Biosafety Guidelines. U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 1 April 2020.
- ^ Aristovnik A, Ravšelj D, Umek L (November 2020). «A Bibliometric Analysis of COVID-19 across Science and Social Science Research Landscape». Sustainability. 12 (21): 9132. doi:10.3390/su12219132.
- ^ Kupferschmidt K (3 December 2020). «First-of-its-kind African trial tests common drugs to prevent severe COVID-19». Science. doi:10.1126/science.abf9987. Retrieved 8 March 2022.
- ^ Reardon S (November 2020). «For COVID Drugs, Months of Frantic Development Lead to Few Outright Successes». Scientific American. Retrieved 10 December 2020.
- ^ Kucharski AJ, Russell TW, Diamond C, Liu Y, Edmunds J, Funk S, Eggo RM (May 2020). «Early dynamics of transmission and control of COVID-19: a mathematical modelling study». The Lancet. Infectious Diseases. 20 (5): 553–558. doi:10.1016/S1473-3099(20)30144-4. PMC 7158569. PMID 32171059.
- ^ «Update to living systematic review on prediction models for diagnosis and prognosis of covid-19». BMJ (Clinical Research Ed.). 372: n236. 3 February 2021. doi:10.1136/bmj.n236. ISSN 1756-1833. PMID 33536183. S2CID 231775762.
- ^ Giordano G, Blanchini F, Bruno R, Colaneri P, Di Filippo A, Di Matteo A, Colaneri M (June 2020). «Modelling the COVID-19 epidemic and implementation of population-wide interventions in Italy». Nature Medicine. 26 (6): 855–860. arXiv:2003.09861. doi:10.1038/s41591-020-0883-7. PMC 7175834. PMID 32322102.
- ^ Prem K, Liu Y, Russell TW, Kucharski AJ, Eggo RM, Davies N, et al. (May 2020). «The effect of control strategies to reduce social mixing on outcomes of the COVID-19 epidemic in Wuhan, China: a modelling study». The Lancet. Public Health. 5 (5): e261–e270. doi:10.1016/S2468-2667(20)30073-6. PMC 7158905. PMID 32220655.
- ^ Emanuel EJ, Persad G, Upshur R, Thome B, Parker M, Glickman A, et al. (May 2020). «Fair Allocation of Scarce Medical Resources in the Time of Covid-19». The New England Journal of Medicine. 382 (21): 2049–2055. doi:10.1056/NEJMsb2005114. PMID 32202722.
- ^ Kermack WO, McKendrick AG (1927). «A contribution to the mathematical theory of epidemics». Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. 115 (772): 700–721. Bibcode:1927RSPSA.115..700K. doi:10.1098/rspa.1927.0118.
- ^ Mittal R, Ni R, Seo JH (2020). «The flow physics of COVID-19». Journal of Fluid Mechanics. 894: –2. arXiv:2004.09354. Bibcode:2020JFM…894F…2M. doi:10.1017/jfm.2020.330.
- ^ Ronchi E, Lovreglio R (October 2020). «EXPOSED: An occupant exposure model for confined spaces to retrofit crowd models during a pandemic». Safety Science. 130: 104834. arXiv:2005.04007. doi:10.1016/j.ssci.2020.104834. PMC 7373681. PMID 32834509.
- ^ Badr HS, Du H, Marshall M, Dong E, Squire MM, Gardner LM (November 2020). «Association between mobility patterns and COVID-19 transmission in the USA: a mathematical modelling study». The Lancet Infectious Diseases. 20 (11): 1247–1254. doi:10.1016/S1473-3099(20)30553-3. PMC 7329287. PMID 32621869.
- ^ McKibbin W, Roshen F (2020). «The global macroeconomic impacts of COVID-19: Seven scenarios» (PDF). CAMA Working Paper. doi:10.2139/ssrn.3547729. S2CID 216307705.
- ^ Bundy J, Pfarrer MD, Short CE, Coombs WT (July 2017). «Crises and crisis management: Integration, interpretation, and research development». Journal of Management. 43 (6): 1661–92. doi:10.1177/0149206316680030. S2CID 152223772.
- ^ Kraus S, Clauss T, Breier M, Gast J, Zardini A, Tiberius V (2020). «The economics of COVID-19: initial empirical evidence on how family firms in five European countries cope with the corona crisis». International Journal of Entrepreneurial Behavior & Research. 26 (5): 1067–1092. doi:10.1108/IJEBR-04-2020-0214. ISSN 1355-2554. S2CID 219144929.
- ^ «COVID-19 treatment and vaccine tracker» (PDF). Milken Institute. 21 April 2020. Retrieved 21 April 2020.
- ^ a b Koch S, Pong W (13 March 2020). «First up for COVID-19: nearly 30 clinical readouts before end of April». BioCentury Inc. Retrieved 1 April 2020.
- ^ Kupferschmidt K, Cohen J (March 2020). «WHO launches global megatrial of the four most promising coronavirus treatments». Science. doi:10.1126/science.abb8497.
- ^ «UN health chief announces global ‘solidarity trial’ to jumpstart search for COVID-19 treatment». UN News. 18 March 2020. Archived from the original on 23 March 2020. Retrieved 23 March 2020.
- ^ «Citing safety concerns, the W.H.O. paused tests of a drug Trump said he had taken». The New York Times. 26 May 2020. Archived from the original on 26 May 2020.
- ^
This article incorporates text from this source, which is in the public domain: «Hydroxychloroquine does not benefit adults hospitalized with COVID-19». National Institutes of Health (NIH) (Press release). 9 November 2020. Retrieved 9 November 2020.
- ^
This article incorporates text from this source, which is in the public domain: «Coronavirus (COVID-19) Update: FDA Warns of Newly Discovered Potential Drug Interaction That May Reduce Effectiveness of a COVID-19 Treatment Authorized for Emergency Use». U.S. Food and Drug Administration (FDA) (Press release). 15 June 2020. Retrieved 15 June 2020.
- ^ «France bans use of hydroxychloroquine, drug touted by Trump, in coronavirus patients». CBS News. 27 May 2020.
- ^ Boseley S (16 June 202). «Recovery trial for Covid-19 treatments: what we know so far». The Guardian. Retrieved 21 June 2020.
- ^ «WHO welcomes preliminary results about dexamethasone use in treating critically ill COVID-19 patients». World Health Organization (WHO) (Press release). 16 June 2020. Retrieved 21 June 2020.
- ^ «Q&A: Dexamethasone and COVID-19». World Health Organization (WHO) (Press release). Retrieved 12 July 2020.
- ^ «Corticosteroids». COVID-19 Treatment Guidelines. National Institutes of Health. Retrieved 12 July 2020.
- ^ a b c World Health Organization (2020). Corticosteroids for COVID-19: living guidance, 2 September 2020 (Report). hdl:10665/334125. WHO/2019-nCoV/Corticosteroids/2020.1.
- ^ «WHO updates clinical care guidance with corticosteroid recommendations». World Health Organization (WHO). Retrieved 25 January 2022.
- ^ Sterne JA, Murthy S, Diaz JV, Slutsky AS, Villar J, Angus DC, et al. (The WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) Working Group) (October 2020). «Association Between Administration of Systemic Corticosteroids and Mortality Among Critically Ill Patients With COVID-19: A Meta-analysis». JAMA. 324 (13): 1330–1341. doi:10.1001/jama.2020.17023. PMC 7489434. PMID 32876694. S2CID 221467783.
- ^ Prescott HC, Rice TW (October 2020). «Corticosteroids in COVID-19 ARDS: Evidence and Hope During the Pandemic». JAMA. 324 (13): 1292–1295. doi:10.1001/jama.2020.16747. PMID 32876693. S2CID 221468015.
- ^ a b «EMA endorses use of dexamethasone in COVID-19 patients on oxygen or mechanical ventilation». European Medicines Agency (EMA) (Press release). 18 September 2020. Retrieved 21 September 2020. Text was copied from this source which is European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ Dexamethasone in hospitalised patients with COVID-19 (PDF) (Report). European Medicines Agency. 17 September 2020.
- ^ a b c
This article incorporates text from this source, which is in the public domain: «Coronavirus (COVID-19) Update: FDA Authorizes Monoclonal Antibody for Treatment of COVID-19». U.S. Food and Drug Administration (FDA) (Press release). 9 November 2020. Retrieved 9 November 2020.
- ^
This article incorporates text from this source, which is in the public domain: «FDA Authorizes Monoclonal Antibodies for Treatment of COVID-19». U.S. Food and Drug Administration (FDA) (Press release). 10 February 2021. Retrieved 9 February 2021.
- ^
This article incorporates text from this source, which is in the public domain: «Coronavirus (COVID-19) Update: FDA Revokes Emergency Use Authorization for Monoclonal Antibody Bamlanivimab». U.S. Food and Drug Administration (FDA) (Press release). 16 April 2021. Retrieved 16 April 2021.
- ^ Li X, Geng M, Peng Y, Meng L, Lu S (April 2020). «Molecular immune pathogenesis and diagnosis of COVID-19». Journal of Pharmaceutical Analysis. 10 (2): 102–108. doi:10.1016/j.jpha.2020.03.001. PMC 7104082. PMID 32282863.
- ^ Zhao Z, Wei Y, Tao C (January 2021). «An enlightening role for cytokine storm in coronavirus infection». Clinical Immunology. 222: 108615. doi:10.1016/j.clim.2020.108615. PMC 7583583. PMID 33203513.
- ^ Liu R, Miller J (3 March 2020). «China approves use of Roche drug in battle against coronavirus complications». Reuters. Archived from the original on 12 March 2020. Retrieved 14 March 2020.
- ^ Xu X, Han M, Li T, Sun W, Wang D, Fu B, et al. (May 2020). «Effective treatment of severe COVID-19 patients with tocilizumab». Proceedings of the National Academy of Sciences of the United States of America. 117 (20): 10970–10975. Bibcode:2020PNAS..11710970X. doi:10.1073/pnas.2005615117. PMC 7245089. PMID 32350134.
- ^ Ovadia D, Agenzia Z. «COVID-19 – Italy launches an independent trial on tocilizumab». Univadis from Medscape. Aptus Health. Retrieved 22 April 2020.
- ^ «Tocilizumab in COVID-19 Pneumonia (TOCIVID-19) (TOCIVID-19)». clinicaltrials.gov. Retrieved 22 April 2020.
- ^ Various sources:
- «How doctors can potentially significantly reduce the number of deaths from Covid-19». Vox. 12 March 2020. Archived from the original on 19 March 2020. Retrieved 14 March 2020.
- Ruan Q, Yang K, Wang W, Jiang L, Song J (May 2020). «Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China». Intensive Care Medicine. 46 (5): 846–848. doi:10.1007/s00134-020-05991-x. PMC 7080116. PMID 32125452.
- Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ (March 2020). «COVID-19: consider cytokine storm syndromes and immunosuppression». Lancet. 395 (10229): 1033–1034. doi:10.1016/S0140-6736(20)30628-0. PMC 7270045. PMID 32192578.
- ^ Slater H (26 March 2020). «FDA Approves Phase III Clinical Trial of Tocilizumab for COVID-19 Pneumonia». cancernetwork.com. Cancer Network. Retrieved 22 April 2020.
- ^ Locke FL, Neelapu SS, Bartlett NL, Lekakis LJ, Jacobson CA, Braunschweig I, et al. (2017). «Preliminary Results of Prophylactic Tocilizumab after Axicabtageneciloleucel (axi-cel; KTE-C19) Treatment for Patients with Refractory, Aggressive Non-Hodgkin Lymphoma (NHL)». Blood. 130 (Supplement 1): 1547. doi:10.1182/blood.V130.Suppl_1.1547.1547. S2CID 155698207.
- ^ Sterner RM, Sakemura R, Cox MJ, Yang N, Khadka RH, Forsman CL, et al. (February 2019). «GM-CSF inhibition reduces cytokine release syndrome and neuroinflammation but enhances CAR T cell function in xenografts». Blood. 133 (7): 697–709. doi:10.1182/blood-2018-10-881722. PMC 6376281. PMID 30463995.
- ^ a b c d e Casadevall A, Pirofski LA (April 2020). «The convalescent sera option for containing COVID-19». The Journal of Clinical Investigation. 130 (4): 1545–1548. doi:10.1172/JCI138003. PMC 7108922. PMID 32167489.
- ^ a b c Piechotta V, Iannizzi C, Chai KL, Valk SJ, Kimber C, Dorando E, et al. (May 2021). «Convalescent plasma or hyperimmune immunoglobulin for people with COVID-19: a living systematic review». The Cochrane Database of Systematic Reviews. 2021 (5): CD013600. doi:10.1002/14651858.CD013600.pub4. PMC 8135693. PMID 34013969.
- ^ a b Ho M (April 2020). «Perspectives on the development of neutralizing antibodies against SARS-CoV-2». Antibody Therapeutics. 3 (2): 109–114. doi:10.1093/abt/tbaa009. PMC 7291920. PMID 32566896.
- ^ Yang L, Liu W, Yu X, Wu M, Reichert JM, Ho M (July 2020). «COVID-19 antibody therapeutics tracker: a global online database of antibody therapeutics for the prevention and treatment of COVID-19». Antibody Therapeutics. 3 (3): 205–212. doi:10.1093/abt/tbaa020. PMC 7454247. PMID 33215063.
- ^ Maccaro A, Piaggio D, Pagliara S, Pecchia L (June 2021). «The role of ethics in science: a systematic literature review from the first wave of COVID-19». Health and Technology. 11 (5): 1063–1071. doi:10.1007/s12553-021-00570-6. ISSN 2190-7188. PMC 8175060. PMID 34104626.
- ^ McGuire AL, Aulisio MP, Davis FD, Erwin C, Harter TD, Jagsi R, et al. (July 2020). «Ethical Challenges Arising in the COVID-19 Pandemic: An Overview from the Association of Bioethics Program Directors (ABPD) Task Force». The American Journal of Bioethics. 20 (7): 15–27. doi:10.1080/15265161.2020.1764138. PMID 32511078. S2CID 219552665.
- ^ Wenham C, Smith J, Morgan R (March 2020). «COVID-19: the gendered impacts of the outbreak». Lancet. 395 (10227): 846–848. doi:10.1016/S0140-6736(20)30526-2. PMC 7124625. PMID 32151325.
- ^ Tolchin B, Hull SC, Kraschel K (October 2020). «Triage and justice in an unjust pandemic: ethical allocation of scarce medical resources in the setting of racial and socioeconomic disparities». Journal of Medical Ethics. 47 (3): 200–202. doi:10.1136/medethics-2020-106457. PMID 33067315. S2CID 223558059.
- ^ Sabatello M, Burke TB, McDonald KE, Appelbaum PS (October 2020). «Disability, Ethics, and Health Care in the COVID-19 Pandemic». American Journal of Public Health. 110 (10): 1523–1527. doi:10.2105/AJPH.2020.305837. PMC 7483109. PMID 32816541.
- ^ Chin T, Kahn R, Li R, Chen JT, Krieger N, Buckee CO, et al. (September 2020). «US-county level variation in intersecting individual, household and community characteristics relevant to COVID-19 and planning an equitable response: a cross-sectional analysis». BMJ Open. 10 (9): e039886. doi:10.1136/bmjopen-2020-039886. PMC 7467554. PMID 32873684.
- ^ Elgar FJ, Stefaniak A, Wohl MJ (October 2020). «The trouble with trust: Time-series analysis of social capital, income inequality, and COVID-19 deaths in 84 countries». Social Science & Medicine. 263: 113365. doi:10.1016/j.socscimed.2020.113365. PMC 7492158. PMID 32981770.
- ^ Uttley H (2 March 2021). «Pandemic sends demand for cold and flu remedies to record low». The Telegraph. Archived from the original on 10 January 2022. Retrieved 28 March 2021.
- ^ «2020–2021 Flu Season Summary». U.S. Centers for Disease Control and Prevention (CDC). 25 October 2021. Retrieved 31 July 2022.
Further reading
- Erola Pairo-Castineira; Sara Clohisey; Lucija Klarić; et al. (11 December 2020). «Genetic mechanisms of critical illness in Covid-19». Nature. doi:10.1038/S41586-020-03065-Y. ISSN 1476-4687. PMID 33307546. Wikidata Q104287299. Scholia Q104287299.
- «Progress report on the coronavirus pandemic». Nature. 584 (7821): 325. 1 August 2020. doi:10.1038/D41586-020-02414-1. ISSN 1476-4687. PMID 32814893. Wikidata Q98568681.
- COVID-19 infection prevention and control measures for primary care, including general practitioner practices, dental clinics and pharmacy settings: first update. European Centre for Disease Prevention and Control (ECDC) (Report). October 2020.
External links
Health agencies
- Coronavirus disease (COVID‑19) Facts by the World Health Organization (WHO)
- Coronavirus 2019 (COVID-19) by the US Centers for Disease Control and Prevention (CDC)
- Coronavirus (COVID‑19) by the UK National Health Service (NHS)
Directories
- Coronavirus Resource Center at the Center for Inquiry
- COVID-19 at Curlie
- COVID‑19 Resource Directory on OpenMD
- COVID‑19 Information on FireMountain.net Archived 13 January 2022 at the Wayback Machine
Medical journals
- Coronavirus Disease 2019 (COVID‑19) by JAMA
- BMJ’s Coronavirus (covid‑19) Hub by the BMJ
- Novel Coronavirus Information Center by Elsevier
- COVID‑19 Resource Centre by The Lancet
- Coronavirus (COVID‑19) Research Highlights by Springer Nature
- Coronavirus (Covid‑19) by The New England Journal of Medicine
- Covid‑19: Novel Coronavirus Archived 24 September 2020 at the Wayback Machine by Wiley Publishing
Treatment guidelines
- «JHMI Clinical Recommendations for Available Pharmacologic Therapies for COVID-19» (PDF). Johns Hopkins Medicine.
- «Bouncing Back From COVID-19: Your Guide to Restoring Movement» (PDF). Johns Hopkins Medicine.
- «Guidelines on the Treatment and Management of Patients with COVID-19». Infectious Diseases Society of America.
- «Coronavirus Disease 2019 (COVID-19) Treatment Guidelines» (PDF). National Institutes of Health.
- World Health Organization (2022). Therapeutics and COVID-19: living guideline, 14 January 2022 (Report). hdl:10665/351006. WHO/2019-nCoV/therapeutics/2022.1.
- NHS England and NHS Improvement. National Guidance for post-COVID syndrome assessment clinics (Report).
«Covid» redirects here. Not to be confused with corvid.
| Coronavirus disease 2019 (COVID-19) |
|
|---|---|
| Other names | COVID, (the) coronavirus |
 |
|
|
Transmission and life-cycle of SARS-CoV-2 causing COVID-19 |
|
| Pronunciation |
|
| Specialty | Infectious disease |
| Symptoms | Fever, cough, fatigue, shortness of breath, vomiting, loss of taste or smell; some cases asymptomatic[2][3] |
| Complications | Pneumonia, viral sepsis, acute respiratory distress syndrome, kidney failure, cytokine release syndrome, respiratory failure, pulmonary fibrosis, paediatric multisystem inflammatory syndrome, long COVID |
| Usual onset | 2–14 days (typically 5) from infection |
| Duration | 5 days to chronic |
| Causes | Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) |
| Diagnostic method | rRT‑PCR testing, CT scan, Rapid antigen test |
| Prevention | Vaccination,[4] face coverings, quarantine, physical/social distancing, ventilation, hand washing[5] |
| Treatment | Symptomatic and supportive |
| Frequency | 664,338,243[6] confirmed cases |
| Deaths | 6,707,311[6] |
Coronavirus disease 2019 (COVID-19) is a contagious disease caused by a virus, the severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). The first known case was identified in Wuhan, China, in December 2019.[7] The disease quickly spread worldwide, resulting in the COVID-19 pandemic.
The symptoms of COVID‑19 are variable but often include fever,[8] cough, headache,[9] fatigue, breathing difficulties, loss of smell, and loss of taste.[10][11][12] Symptoms may begin one to fourteen days after exposure to the virus. At least a third of people who are infected do not develop noticeable symptoms.[13] Of those who develop symptoms noticeable enough to be classified as patients, most (81%) develop mild to moderate symptoms (up to mild pneumonia), while 14% develop severe symptoms (dyspnea, hypoxia, or more than 50% lung involvement on imaging), and 5% develop critical symptoms (respiratory failure, shock, or multiorgan dysfunction).[14] Older people are at a higher risk of developing severe symptoms. Some people continue to experience a range of effects (long COVID) for months after recovery, and damage to organs has been observed.[15] Multi-year studies are underway to further investigate the long-term effects of the disease.[15]
COVID‑19 transmits when people breathe air contaminated by droplets and small airborne particles containing the virus. The risk of breathing these is highest when people are in close proximity, but they can be inhaled over longer distances, particularly indoors. Transmission can also occur if contaminated fluids are splashed or sprayed in the eyes, nose, or mouth, or, more rarely, via contaminated surfaces. People remain contagious for up to 20 days and can spread the virus even if they do not develop symptoms.[16][17]
Testing methods for COVID-19 to detect the virus’s nucleic acid include real-time reverse transcription polymerase chain reaction (rRT‑PCR),[18][19] transcription-mediated amplification,[18][19][20] and reverse transcription loop-mediated isothermal amplification (RT‑LAMP)[18][19] from a nasopharyngeal swab.[21]
Several COVID-19 vaccines have been approved and distributed in various countries, which have initiated mass vaccination campaigns. Other preventive measures include physical or social distancing, quarantining, ventilation of indoor spaces, use of face masks or coverings in public, covering coughs and sneezes, hand washing, and keeping unwashed hands away from the face. While work is underway to develop drugs that inhibit the virus, the primary treatment is symptomatic. Management involves the treatment of symptoms through supportive care, isolation, and experimental measures.
Nomenclature
During the initial outbreak in Wuhan, the virus and disease were commonly referred to as «coronavirus» and «Wuhan coronavirus»,[22][23][24] with the disease sometimes called «Wuhan pneumonia».[25][26] In the past, many diseases have been named after geographical locations, such as the Spanish flu,[27] Middle East respiratory syndrome, and Zika virus.[28] In January 2020, the World Health Organization (WHO) recommended 2019-nCoV[29] and 2019-nCoV acute respiratory disease[30] as interim names for the virus and disease per 2015 guidance and international guidelines against using geographical locations or groups of people in disease and virus names to prevent social stigma.[31][32][33] The official names COVID‑19 and SARS-CoV-2 were issued by the WHO on 11 February 2020 with COVID-19 being shorthand for «coronavirus disease 2019».[34][35] The WHO additionally uses «the COVID‑19 virus» and «the virus responsible for COVID‑19» in public communications.[34][36]
Signs and symptoms
The symptoms of COVID-19 are variable depending on the type of variant contracted, ranging from mild symptoms to a potentially fatal illness.[37][38] Common symptoms include coughing, fever, loss of smell (anosmia) and taste (ageusia), with less common ones including headaches, nasal congestion and runny nose, muscle pain, sore throat, diarrhea, eye irritation,[39] and toes swelling or turning purple,[40] and in moderate to severe cases, breathing difficulties.[41] People with the COVID-19 infection may have different symptoms, and their symptoms may change over time. Three common clusters of symptoms have been identified: one respiratory symptom cluster with cough, sputum, shortness of breath, and fever; a musculoskeletal symptom cluster with muscle and joint pain, headache, and fatigue; and a cluster of digestive symptoms with abdominal pain, vomiting, and diarrhea.[41] In people without prior ear, nose, or throat disorders, loss of taste combined with loss of smell is associated with COVID-19 and is reported in as many as 88% of symptomatic cases.[42][43][44]
Of people who show symptoms, 81% develop only mild to moderate symptoms (up to mild pneumonia), while 14% develop severe symptoms (dyspnea, hypoxia, or more than 50% lung involvement on imaging) that require hospitalization, and 5% of patients develop critical symptoms (respiratory failure, septic shock, or multiorgan dysfunction) requiring ICU admission.[45] At least a third of the people who are infected with the virus do not develop noticeable symptoms at any point in time.[46][47] These asymptomatic carriers tend not to get tested and can still spread the disease.[47][48][49][50] Other infected people will develop symptoms later (called «pre-symptomatic») or have very mild symptoms and can also spread the virus.[50]
As is common with infections, there is a delay between the moment a person first becomes infected and the appearance of the first symptoms. The median delay for COVID-19 is four to five days[51] possibly being infectious on 1-4 of those days.[52] Most symptomatic people experience symptoms within two to seven days after exposure, and almost all will experience at least one symptom within 12 days.[51][53]
Most people recover from the acute phase of the disease. However, some people—over half of a cohort of home-isolated young adults identified in June, 2021[54][55] continued to experience a range of effects, such as fatigue, for months even after recovery. This is the result of a condition called long COVID, which can be described as a range of persistent symptoms that continue for weeks and/or months at a time.[56] Long-term damage to organs has also been observed after the onset of COVID-19. Multi-year studies are underway to further investigate the potential long-term effects of the disease.[57]
The Omicron variant became dominant in the U.S. in December 2021. Symptoms with the Omicron variant are less severe than they are with other variants.[58]
Cause
COVID‑19 is caused by infection with a strain of coronavirus known as ‘Severe Acute Respiratory Syndrome coronavirus 2’ (SARS-CoV-2).[59]
Transmission
| Transmission of COVID-19 | |
|---|---|
| Other names | Mode of spread of COVID-19 |
 |
|
| Specialty | Infection prevention and control |
| Types | Respiratory droplet, airborne transmission, fomites |
| Prevention | Face coverings, quarantine, physical/social distancing, ventilation, hand washing, vaccination |
COVID-19 is mainly transmitted when people breathe in air contaminated by droplets/aerosols and small airborne particles containing the virus. Infected people exhale those particles as they breathe, talk, cough, sneeze, or sing.[60][61][62][63] Transmission is more likely the more physically close people are. However, infection can occur over longer distances, particularly indoors.[60][64]
Infectivity can begin four to five days before the onset of symptoms,[65] although contact tracing typically begins only two to three days before symptom onset.[66] Infected people can spread the disease even if they are pre-symptomatic or asymptomatic.[66] Most commonly, the peak viral load in upper respiratory tract samples occurs close to the time of symptom onset and declines after the first week after symptoms begin.[66] Current evidence suggests a duration of viral shedding and the period of infectiousness of up to ten days following symptom onset for people with mild to moderate COVID-19, and up to 20 days for persons with severe COVID-19, including immunocompromised people.[67][66]
Infectious particles range in size from aerosols that remain suspended in the air for long periods of time to larger droplets that remain airborne briefly or fall to the ground.[68][69][70][71] Additionally, COVID-19 research has redefined the traditional understanding of how respiratory viruses are transmitted.[71][72] The largest droplets of respiratory fluid do not travel far, but can be inhaled or land on mucous membranes on the eyes, nose, or mouth to infect.[70] Aerosols are highest in concentration when people are in close proximity, which leads to easier viral transmission when people are physically close,[70][71][72] but airborne transmission can occur at longer distances, mainly in locations that are poorly ventilated;[70] in those conditions small particles can remain suspended in the air for minutes to hours.[70]
The number of people generally infected by one infected person varies,[73] but it is estimated that the R0 («R nought» or «R zero») number is around 2.5.[74] The disease often spreads in clusters, where infections can be traced back to an index case or geographical location.[75] Often in these instances, superspreading events occur, where many people are infected by one person.[73]
Virology
Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) is a novel severe acute respiratory syndrome coronavirus. It was first isolated from three people with pneumonia connected to the cluster of acute respiratory illness cases in Wuhan.[76] All structural features of the novel SARS-CoV-2 virus particle occur in related coronaviruses in nature.[77]
Outside the human body, the virus is destroyed by household soap, which bursts its protective bubble.[78]
SARS-CoV-2 is closely related to the original SARS-CoV.[79] It is thought to have an animal (zoonotic) origin. Genetic analysis has revealed that the coronavirus genetically clusters with the genus Betacoronavirus, in subgenus Sarbecovirus (lineage B) together with two bat-derived strains. It is 96% identical at the whole genome level to other bat coronavirus samples (BatCov RaTG13).[80][81][82] The structural proteins of SARS-CoV-2 include membrane glycoprotein (M), envelope protein (E), nucleocapsid protein (N), and the spike protein (S). The M protein of SARS-CoV-2 is about 98% similar to the M protein of bat SARS-CoV, maintains around 98% homology with pangolin SARS-CoV, and has 90% homology with the M protein of SARS-CoV; whereas, the similarity is only around 38% with the M protein of MERS-CoV.[83]
SARS-CoV-2 variants
The many thousands of SARS-CoV-2 variants are grouped into either clades or lineages.[84][85] The WHO, in collaboration with partners, expert networks, national authorities, institutions and researchers, have established nomenclature systems for naming and tracking SARS-CoV-2 genetic lineages by GISAID, Nextstrain and Pango. The expert group convened by the WHO recommended the labelling of variants using letters of the Greek alphabet, for example, Alpha, Beta, Delta, and Gamma, giving the justification that they «will be easier and more practical to discussed by non-scientific audiences.»[86] Nextstrain divides the variants into five clades (19A, 19B, 20A, 20B, and 20C), while GISAID divides them into seven (L, O, V, S, G, GH, and GR).[87] The Pango tool groups variants into lineages, with many circulating lineages being classed under the B.1 lineage.[85][88]
Several notable variants of SARS-CoV-2 emerged throughout 2020.[89][90] Cluster 5 emerged among minks and mink farmers in Denmark.[91] After strict quarantines and a mink euthanasia campaign, the cluster was assessed to no longer be circulating among humans in Denmark as of 1 February 2021.[92]
As of December 2021, there are five dominant variants of SARS-CoV-2 spreading among global populations: the Alpha variant (B.1.1.7, formerly called the UK variant), first found in London and Kent, the Beta variant (B.1.351, formerly called the South Africa variant), the Gamma variant (P.1, formerly called the Brazil variant), the Delta variant (B.1.617.2, formerly called the India variant),[93] and the Omicron variant (B.1.1.529), which had spread to 57 countries as of 7 December.[94][95]
Pathophysiology
The SARS-CoV-2 virus can infect a wide range of cells and systems of the body. COVID‑19 is most known for affecting the upper respiratory tract (sinuses, nose, and throat) and the lower respiratory tract (windpipe and lungs).[96] The lungs are the organs most affected by COVID‑19 because the virus accesses host cells via the receptor for the enzyme angiotensin-converting enzyme 2 (ACE2), which is most abundant on the surface of type II alveolar cells of the lungs.[97] The virus uses a special surface glycoprotein called a «spike» to connect to the ACE2 receptor and enter the host cell.[98]
Respiratory tract
Following viral entry, COVID‑19 infects the ciliated epithelium of the nasopharynx and upper airways.[99]
Nervous system
One common symptom, loss of smell, results from infection of the support cells of the olfactory epithelium, with subsequent damage to the olfactory neurons.[100] The involvement of both the central and peripheral nervous system in COVID‑19 has been reported in many medical publications.[101] It is clear that many people with COVID-19 exhibit neurological or mental health issues. The virus is not detected in the central nervous system (CNS) of the majority of COVID-19 patients with neurological issues. However, SARS-CoV-2 has been detected at low levels in the brains of those who have died from COVID‑19, but these results need to be confirmed.[102] While virus has been detected in cerebrospinal fluid of autopsies, the exact mechanism by which it invades the CNS remains unclear and may first involve invasion of peripheral nerves given the low levels of ACE2 in the brain.[103][104][105] The virus may also enter the bloodstream from the lungs and cross the blood–brain barrier to gain access to the CNS, possibly within an infected white blood cell.[102]
Research conducted when Alpha was the dominant variant has suggested COVID-19 may cause brain damage. It is unknown if such damage is temporary or permanent, and whether Omicron has similar effects.[106][107] Observed individuals infected with COVID-19 (most with mild cases) experienced an additional 0.2% to 2% of brain tissue lost in regions of the brain connected to the sense of smell compared with uninfected individuals, and the overall effect on the brain was equivalent on average to at least one extra year of normal ageing; infected individuals also scored lower on several cognitive tests. All effects were more pronounced among older ages.[108]
Gastrointestinal tract
The virus also affects gastrointestinal organs as ACE2 is abundantly expressed in the glandular cells of gastric, duodenal and rectal epithelium[109] as well as endothelial cells and enterocytes of the small intestine.[110]
Cardiovascular system
The virus can cause acute myocardial injury and chronic damage to the cardiovascular system.[111][112] An acute cardiac injury was found in 12% of infected people admitted to the hospital in Wuhan, China,[113] and is more frequent in severe disease.[114] Rates of cardiovascular symptoms are high, owing to the systemic inflammatory response and immune system disorders during disease progression, but acute myocardial injuries may also be related to ACE2 receptors in the heart.[112] ACE2 receptors are highly expressed in the heart and are involved in heart function.[112][115]
A high incidence of thrombosis and venous thromboembolism occurs in people transferred to intensive care units with COVID‑19 infections, and may be related to poor prognosis.[116] Blood vessel dysfunction and clot formation (as suggested by high D-dimer levels caused by blood clots) may have a significant role in mortality, incidences[spelling?] of clots leading to pulmonary embolisms, and ischaemic events within the brain found as complications leading to death in people infected with COVID‑19.[117] Infection may initiate a chain of vasoconstrictive responses within the body, including pulmonary vasoconstriction – a possible mechanism in which oxygenation decreases during pneumonia.[117] Furthermore, damage of arterioles and capillaries was found in brain tissue samples of people who died from COVID‑19.[118][119]
COVID‑19 may also cause substantial structural changes to blood cells, sometimes persisting for months after hospital discharge.[120] A low level of blood lymphocytes may result from the virus acting through ACE2-related entry into lymphocytes.[121]
Other organs
Another common cause of death is complications related to the kidneys.[117] Early reports show that up to 30% of hospitalised patients both in China and in New York have experienced some injury to their kidneys, including some persons with no previous kidney problems.[122]
Autopsies of people who died of COVID‑19 have found diffuse alveolar damage, and lymphocyte-containing inflammatory infiltrates within the lung.[123]
Immunopathology
Although SARS-CoV-2 has a tropism for ACE2-expressing epithelial cells of the respiratory tract, people with severe COVID‑19 have symptoms of systemic hyperinflammation. Clinical laboratory findings of elevated IL‑2, IL‑7, IL‑6, granulocyte-macrophage colony-stimulating factor (GM‑CSF), interferon gamma-induced protein 10 (IP‑10), monocyte chemoattractant protein 1 (MCP1), macrophage inflammatory protein 1‑alpha (MIP‑1‑alpha), and tumour necrosis factor (TNF‑α) indicative of cytokine release syndrome (CRS) suggest an underlying immunopathology.[113]
Interferon alpha plays a complex, Janus-faced role in the pathogenesis of COVID-19. Although it promotes the elimination of virus-infected cells, it also upregulates the expression of ACE-2, thereby facilitating the SARS-Cov2 virus to enter cells and to replicate.[124][125] A competition of negative feedback loops (via protective effects of interferon alpha) and positive feedback loops (via upregulation of ACE-2) is assumed to determine the fate of patients suffering from COVID-19.[126]
Additionally, people with COVID‑19 and acute respiratory distress syndrome (ARDS) have classical serum biomarkers of CRS, including elevated C-reactive protein (CRP), lactate dehydrogenase (LDH), D-dimer, and ferritin.[127]
Systemic inflammation results in vasodilation, allowing inflammatory lymphocytic and monocytic infiltration of the lung and the heart. In particular, pathogenic GM-CSF-secreting T cells were shown to correlate with the recruitment of inflammatory IL-6-secreting monocytes and severe lung pathology in people with COVID‑19.[128] Lymphocytic infiltrates have also been reported at autopsy.[123]
Viral and host factors
Virus proteins
Multiple viral and host factors affect the pathogenesis of the virus. The S-protein, otherwise known as the spike protein, is the viral component that attaches to the host receptor via the ACE2 receptors. It includes two subunits: S1 and S2. S1 determines the virus-host range and cellular tropism via the receptor-binding domain. S2 mediates the membrane fusion of the virus to its potential cell host via the H1 and HR2, which are heptad repeat regions. Studies have shown that S1 domain induced IgG and IgA antibody levels at a much higher capacity. It is the focus spike proteins expression that are involved in many effective COVID‑19 vaccines.[129]
The M protein is the viral protein responsible for the transmembrane transport of nutrients. It is the cause of the bud release and the formation of the viral envelope.[130] The N and E protein are accessory proteins that interfere with the host’s immune response.[130]
Host factors
Human angiotensin converting enzyme 2 (hACE2) is the host factor that SARS-CoV-2 virus targets causing COVID‑19. Theoretically, the usage of angiotensin receptor blockers (ARB) and ACE inhibitors upregulating ACE2 expression might increase morbidity with COVID‑19, though animal data suggest some potential protective effect of ARB; however no clinical studies have proven susceptibility or outcomes. Until further data is available, guidelines and recommendations for hypertensive patients remain.[131]
The effect of the virus on ACE2 cell surfaces leads to leukocytic infiltration, increased blood vessel permeability, alveolar wall permeability, as well as decreased secretion of lung surfactants. These effects cause the majority of the respiratory symptoms. However, the aggravation of local inflammation causes a cytokine storm eventually leading to a systemic inflammatory response syndrome.[132]
Among healthy adults not exposed to SARS-CoV-2, about 35% have CD4+ T cells that recognise the SARS-CoV-2 S protein (particularly the S2 subunit) and about 50% react to other proteins of the virus, suggesting cross-reactivity from previous common colds caused by other coronaviruses.[133]
It is unknown whether different persons use similar antibody genes in response to COVID‑19.[134]
Host cytokine response
The severity of the inflammation can be attributed to the severity of what is known as the cytokine storm.[135] Levels of interleukin 1B, interferon-gamma, interferon-inducible protein 10, and monocyte chemoattractant protein 1 were all associated with COVID‑19 disease severity. Treatment has been proposed to combat the cytokine storm as it remains to be one of the leading causes of morbidity and mortality in COVID‑19 disease.[136]
A cytokine storm is due to an acute hyperinflammatory response that is responsible for clinical illness in an array of diseases but in COVID‑19, it is related to worse prognosis and increased fatality. The storm causes acute respiratory distress syndrome, blood clotting events such as strokes, myocardial infarction, encephalitis, acute kidney injury, and vasculitis. The production of IL-1, IL-2, IL-6, TNF-alpha, and interferon-gamma, all crucial components of normal immune responses, inadvertently become the causes of a cytokine storm. The cells of the central nervous system, the microglia, neurons, and astrocytes, are also involved in the release of pro-inflammatory cytokines affecting the nervous system, and effects of cytokine storms toward the CNS are not uncommon.[137]
Pregnancy response
There are many unknowns for pregnant women during the COVID-19 pandemic. Given that they are prone to have complications and severe disease infection with other types of coronaviruses, they have been identified as a vulnerable group and advised to take supplementary preventive measures.[138]
Physiological responses to pregnancy can include:
- Immunological: The immunological response to COVID-19, like other viruses, depends on a working immune system. It adapts during pregnancy to allow the development of the foetus whose genetic load is only partially shared with their mother, leading to a different immunological reaction to infections during the course of pregnancy.[138]
- Respiratory: Many factors can make pregnant women more vulnerable to hard respiratory infections. One of them is the total reduction of the lungs’ capacity and inability to clear secretions.[138]
- Coagulation: During pregnancy, there are higher levels of circulating coagulation factors, and the pathogenesis of SARS-CoV-2 infection can be implicated. The thromboembolic events with associated mortality are a risk for pregnant women.[138]
However, from the evidence base, it is difficult to conclude whether pregnant women are at increased risk of grave consequences of this virus.[138]
In addition to the above, other clinical studies have proved that SARS-CoV-2 can affect the period of pregnancy in different ways. On the one hand, there is little evidence of its impact up to 12 weeks gestation. On the other hand, COVID-19 infection may cause increased rates of unfavourable outcomes in the course of the pregnancy. Some examples of these could be foetal growth restriction, preterm birth, and perinatal mortality, which refers to the foetal death past 22 or 28 completed weeks of pregnancy as well as the death among live-born children up to seven completed days of life.[138]
Unvaccinated women in later stages of pregnancy with COVID-19 are more likely than other patients to need very intensive care. Babies born to mothers with COVID-19 are more likely to have breathing problems. Pregnant women are strongly encouraged to get vaccinated.[139]
Diagnosis
COVID‑19 can provisionally be diagnosed on the basis of symptoms and confirmed using reverse transcription polymerase chain reaction (RT-PCR) or other nucleic acid testing of infected secretions.[21][140] Along with laboratory testing, chest CT scans may be helpful to diagnose COVID‑19 in individuals with a high clinical suspicion of infection.[141] Detection of a past infection is possible with serological tests, which detect antibodies produced by the body in response to the infection.[21]
Viral testing
The standard methods of testing for presence of SARS-CoV-2 are nucleic acid tests,[21][142] which detects the presence of viral RNA fragments.[143] As these tests detect RNA but not infectious virus, its «ability to determine duration of infectivity of patients is limited.»[144] The test is typically done on respiratory samples obtained by a nasopharyngeal swab; however, a nasal swab or sputum sample may also be used.[145][146] Results are generally available within hours.[21] The WHO has published several testing protocols for the disease.[147]
Several laboratories and companies have developed serological tests, which detect antibodies produced by the body in response to infection. Several have been evaluated by Public Health England and approved for use in the UK.[148]
The University of Oxford’s CEBM has pointed to mounting evidence[149][150] that «a good proportion of ‘new’ mild cases and people re-testing positives after quarantine or discharge from hospital are not infectious, but are simply clearing harmless virus particles which their immune system has efficiently dealt with» and have called for «an international effort to standardize and periodically calibrate testing»[151] In September 2020, the UK government issued «guidance for procedures to be implemented in laboratories to provide assurance of positive SARS-CoV-2 RNA results during periods of low prevalence, when there is a reduction in the predictive value of positive test results».[152]
Imaging
A CT scan of a person with COVID-19 shows lesions (bright regions) in the lungs
CT scan of rapid progression stage of COVID-19
Chest X-ray showing COVID‑19 pneumonia
Chest CT scans may be helpful to diagnose COVID‑19 in individuals with a high clinical suspicion of infection but are not recommended for routine screening.[141][153] Bilateral multilobar ground-glass opacities with a peripheral, asymmetric, and posterior distribution are common in early infection.[141][154] Subpleural dominance, crazy paving (lobular septal thickening with variable alveolar filling), and consolidation may appear as the disease progresses.[141][155] Characteristic imaging features on chest radiographs and computed tomography (CT) of people who are symptomatic include asymmetric peripheral ground-glass opacities without pleural effusions.[156]
Many groups have created COVID‑19 datasets that include imagery such as the Italian Radiological Society which has compiled an international online database of imaging findings for confirmed cases.[157] Due to overlap with other infections such as adenovirus, imaging without confirmation by rRT-PCR is of limited specificity in identifying COVID‑19.[156] A large study in China compared chest CT results to PCR and demonstrated that though imaging is less specific for the infection, it is faster and more sensitive.[140]
Coding
In late 2019, the WHO assigned emergency ICD-10 disease codes U07.1 for deaths from lab-confirmed SARS-CoV-2 infection and U07.2 for deaths from clinically or epidemiologically diagnosed COVID‑19 without lab-confirmed SARS-CoV-2 infection.[158]
Pathology
The main pathological findings at autopsy are:
- Macroscopy: pericarditis, lung consolidation and pulmonary oedema[123]
- Lung findings:
- minor serous exudation, minor fibrin exudation[123]
- pulmonary oedema, pneumocyte hyperplasia, large atypical pneumocytes, interstitial inflammation with lymphocytic infiltration and multinucleated giant cell formation[123]
- diffuse alveolar damage (DAD) with diffuse alveolar exudates. DAD is the cause of acute respiratory distress syndrome (ARDS) and severe hypoxaemia.[123]
- organisation of exudates in alveolar cavities and pulmonary interstitial fibrosis[123]
- plasmocytosis in BAL[159]
- Blood and vessels: disseminated intravascular coagulation (DIC);[160] leukoerythroblastic reaction,[161] endotheliitis,[162] hemophagocytosis[162]
- Heart: cardiac muscle cell necrosis[162]
- Liver: microvesicular steatosis[123]
- Nose: shedding of olfactory epithelium[100]
- Brain: infarction[162]
- Kidneys: acute tubular damage.[162]
- Spleen: white pulp depletion.[162]
Prevention
Without pandemic containment measures – such as social distancing, vaccination, and face masks – pathogens can spread exponentially.[163] This graphic shows how early adoption of containment measures tends to protect wider swaths of the population.
Preventive measures to reduce the chances of infection include getting vaccinated, staying at home, wearing a mask in public, avoiding crowded places, keeping distance from others, ventilating indoor spaces, managing potential exposure durations,[164] washing hands with soap and water often and for at least twenty seconds, practising good respiratory hygiene, and avoiding touching the eyes, nose, or mouth with unwashed hands.[165][166]
Those diagnosed with COVID‑19 or who believe they may be infected are advised by the CDC to stay home except to get medical care, call ahead before visiting a healthcare provider, wear a face mask before entering the healthcare provider’s office and when in any room or vehicle with another person, cover coughs and sneezes with a tissue, regularly wash hands with soap and water and avoid sharing personal household items.[167][168]
The first COVID‑19 vaccine was granted regulatory approval on 2 December 2020 by the UK medicines regulator MHRA.[169] It was evaluated for emergency use authorization (EUA) status by the US FDA, and in several other countries.[170] Initially, the US National Institutes of Health guidelines do not recommend any medication for prevention of COVID‑19, before or after exposure to the SARS-CoV-2 virus, outside the setting of a clinical trial.[171][172] Without a vaccine, other prophylactic measures, or effective treatments, a key part of managing COVID‑19 is trying to decrease and delay the epidemic peak, known as «flattening the curve».[173] This is done by slowing the infection rate to decrease the risk of health services being overwhelmed, allowing for better treatment of active cases, and delaying additional cases until effective treatments or a vaccine become available.[173][174]
Vaccine
Different vaccine candidate types in development for SARS-CoV-2
A COVID‑19 vaccine is a vaccine intended to provide acquired immunity against severe acute respiratory syndrome coronavirus 2 (SARS‑CoV‑2), the virus that causes coronavirus disease 2019 (COVID‑19).
Prior to the COVID‑19 pandemic, an established body of knowledge existed about the structure and function of coronaviruses causing diseases like severe acute respiratory syndrome (SARS) and Middle East respiratory syndrome (MERS). This knowledge accelerated the development of various vaccine platforms during early 2020.[175] The initial focus of SARS-CoV-2 vaccines was on preventing symptomatic, often severe illness.[176] In January 2020, the SARS-CoV-2 genetic sequence data was shared through GISAID, and by March 2020, the global pharmaceutical industry announced a major commitment to address COVID‑19.[177] In 2020, the first COVID‑19 vaccines were developed and made available to the public through emergency authorizations[178] and conditional approvals.[179][180] Initially, most COVID‑19 vaccines were two-dose vaccines, with the sole exception being the single-dose Janssen COVID-19 vaccine.[178] However, immunity from the vaccines has been found to wane over time, requiring people to get booster doses of the vaccine to maintain protection against COVID‑19.[178]
Face masks and respiratory hygiene
Masks with an exhalation valve. The valves are a weak point that can transmit the viruses outwards.
The WHO and the US CDC recommend individuals wear non-medical face coverings in public settings where there is an increased risk of transmission and where social distancing measures are difficult to maintain.[181][182] This recommendation is meant to reduce the spread of the disease by asymptomatic and pre-symptomatic individuals and is complementary to established preventive measures such as social distancing.[182][183] Face coverings limit the volume and travel distance of expiratory droplets dispersed when talking, breathing, and coughing.[182][183] A face covering without vents or holes will also filter out particles containing the virus from inhaled and exhaled air, reducing the chances of infection.[184] However, if the mask includes an exhalation valve, a wearer that is infected (and possibly asymptomatic) may transmit the virus through the valve. Many countries and local jurisdictions encourage or mandate the use of face masks or cloth face coverings by members of the public to limit the spread of the virus.[185]
Masks are also strongly recommended for those who may have been infected and those taking care of someone who may have the disease.[186] When not wearing a mask, the CDC recommends covering the mouth and nose with a tissue when coughing or sneezing and recommends using the inside of the elbow if no tissue is available. Proper hand hygiene after any cough or sneeze is encouraged. Healthcare professionals interacting directly with people who have COVID‑19 are advised to use respirators at least as protective as NIOSH-certified N95 or equivalent, in addition to other personal protective equipment.[187]
Indoor ventilation and avoiding crowded indoor spaces
The CDC recommends that crowded indoor spaces should be avoided.[188] When indoors, increasing the rate of air change, decreasing recirculation of air and increasing the use of outdoor air can reduce transmission.[188][189] The WHO recommends ventilation and air filtration in public spaces to help clear out infectious aerosols.[190][191][192]
Exhaled respiratory particles can build-up within enclosed spaces with inadequate ventilation. The risk of COVID‑19 infection increases especially in spaces where people engage in physical exertion or raise their voice (e.g., exercising, shouting, singing) as this increases exhalation of respiratory droplets. Prolonged exposure to these conditions, typically more than 15 minutes, leads to higher risk of infection.[188]
Displacement ventilation with large natural inlets can move stale air directly to the exhaust in laminar flow while significantly reducing the concentration of droplets and particles. Passive ventilation reduces energy consumption and maintenance costs but may lack controllability and heat recovery. Displacement ventilation can also be achieved mechanically with higher energy and maintenance costs. The use of large ducts and openings helps to prevent mixing in closed environments. Recirculation and mixing should be avoided because recirculation prevents dilution of harmful particles and redistributes possibly contaminated air, and mixing increases the concentration and range of infectious particles and keeps larger particles in the air.[193]
Hand-washing and hygiene
Thorough hand hygiene after any cough or sneeze is required.[194] The WHO also recommends that individuals wash hands often with soap and water for at least twenty seconds, especially after going to the toilet or when hands are visibly dirty, before eating and after blowing one’s nose.[195] When soap and water are not available, the CDC recommends using an alcohol-based hand sanitiser with at least 60% alcohol.[196] For areas where commercial hand sanitisers are not readily available, the WHO provides two formulations for local production. In these formulations, the antimicrobial activity arises from ethanol or isopropanol. Hydrogen peroxide is used to help eliminate bacterial spores in the alcohol; it is «not an active substance for hand antisepsis.» Glycerol is added as a humectant.[197]
Social distancing (also known as physical distancing) includes infection control actions intended to slow the spread of the disease by minimising close contact between individuals. Methods include quarantines; travel restrictions; and the closing of schools, workplaces, stadiums, theatres, or shopping centres. Individuals may apply social distancing methods by staying at home, limiting travel, avoiding crowded areas, using no-contact greetings, and physically distancing themselves from others.[198] Many governments are mandating or recommending social distancing in regions affected by the outbreak.[199]
Outbreaks have occurred in prisons due to crowding and an inability to enforce adequate social distancing.[200][201] In the United States, the prisoner population is ageing and many of them are at high risk for poor outcomes from COVID‑19 due to high rates of coexisting heart and lung disease, and poor access to high-quality healthcare.[200]
Surface cleaning
After being expelled from the body, coronaviruses can survive on surfaces for hours to days. If a person touches the dirty surface, they may deposit the virus at the eyes, nose, or mouth where it can enter the body and cause infection.[202] Evidence indicates that contact with infected surfaces is not the main driver of COVID‑19,[203][204][205] leading to recommendations for optimised disinfection procedures to avoid issues such as the increase of antimicrobial resistance through the use of inappropriate cleaning products and processes.[206][207] Deep cleaning and other surface sanitation has been criticised as hygiene theatre, giving a false sense of security against something primarily spread through the air.[208][209]
The amount of time that the virus can survive depends significantly on the type of surface, the temperature, and the humidity.[210] Coronaviruses die very quickly when exposed to the UV light in sunlight.[210] Like other enveloped viruses, SARS-CoV-2 survives longest when the temperature is at room temperature or lower, and when the relative humidity is low (<50%).[210]
On many surfaces, including glass, some types of plastic, stainless steel, and skin, the virus can remain infective for several days indoors at room temperature, or even about a week under ideal conditions.[210][211] On some surfaces, including cotton fabric and copper, the virus usually dies after a few hours.[210] The virus dies faster on porous surfaces than on non-porous surfaces due to capillary action within pores and faster aerosol droplet evaporation.[212][205][210] However, of the many surfaces tested, two with the longest survival times are N95 respirator masks and surgical masks, both of which are considered porous surfaces.[210]
The CDC says that in most situations, cleaning surfaces with soap or detergent, not disinfecting, is enough to reduce risk of transmission.[213][214] The CDC recommends that if a COVID‑19 case is suspected or confirmed at a facility such as an office or day care, all areas such as offices, bathrooms, common areas, shared electronic equipment like tablets, touch screens, keyboards, remote controls, and ATMs used by the ill persons should be disinfected.[215] Surfaces may be decontaminated with 62–71 per cent ethanol, 50–100 per cent isopropanol, 0.1 per cent sodium hypochlorite, 0.5 per cent hydrogen peroxide, 0.2–7.5 per cent povidone-iodine, or 50–200 ppm hypochlorous acid. Other solutions, such as benzalkonium chloride and chlorhexidine gluconate, are less effective. Ultraviolet germicidal irradiation may also be used,[190] although popular devices require 5–10 min exposure and may deteriorate some materials over time.[216] A datasheet comprising the authorised substances to disinfection in the food industry (including suspension or surface tested, kind of surface, use dilution, disinfectant and inocuylum volumes) can be seen in the supplementary material of.[206]
Self-isolation
Self-isolation at home has been recommended for those diagnosed with COVID‑19 and those who suspect they have been infected. Health agencies have issued detailed instructions for proper self-isolation.[217] Many governments have mandated or recommended self-quarantine for entire populations. The strongest self-quarantine instructions have been issued to those in high-risk groups.[218] Those who may have been exposed to someone with COVID‑19 and those who have recently travelled to a country or region with the widespread transmission have been advised to self-quarantine for 14 days from the time of last possible exposure.[219]
A 2021 Cochrane rapid review found that based upon low-certainty evidence, international travel-related control measures such as restricting cross-border travel may help to contain the spread of COVID‑19.[220] Additionally, symptom/exposure-based screening measures at borders may miss many positive cases.[220] While test-based border screening measures may be more effective, it could also miss many positive cases if only conducted upon arrival without follow-up. The review concluded that a minimum 10-day quarantine may be beneficial in preventing the spread of COVID‑19 and may be more effective if combined with an additional control measure like border screening.[220]
Treatment
An overview of COVID-19 therapeutics and drugs
Although several medications have been approved in different countries as of April 2022, not all countries have these medications. Patients with mild to moderate symptoms who are in the risk groups can take nirmatrelvir/ritonavir (marketed as Paxlovid) or remdesivir, either of which reduces the risk of serious illness or hospitalization.[221] In the US, the Biden Administration COVID-19 action plan includes the Test to Treat initiative, where people can go to a pharmacy, take a COVID test, and immediately receive free Paxlovid if they test positive.[222]
Highly effective vaccines have reduced mortality related to SARS-CoV-2; however, for those awaiting vaccination, as well as for the estimated millions of immunocompromised persons who are unlikely to respond robustly to vaccination, treatment remains important.[223] The cornerstone of management of COVID-19 has been supportive care, which includes treatment to relieve symptoms, fluid therapy, oxygen support and prone positioning as needed, and medications or devices to support other affected vital organs.[224][225][226]
Most cases of COVID-19 are mild. In these, supportive care includes medication such as paracetamol or NSAIDs to relieve symptoms (fever, body aches, cough), proper intake of fluids, rest, and nasal breathing.[227][228][229][230] Good personal hygiene and a healthy diet are also recommended.[231] As of April 2020 the U.S. Centers for Disease Control and Prevention (CDC) recommended that those who suspect they are carrying the virus isolate themselves at home and wear a face mask.[232]
As of November 2020 use of the glucocorticoid dexamethasone had been strongly recommended in those severe cases treated in hospital with low oxygen levels, to reduce the risk of death.[233][234][235] Noninvasive ventilation and, ultimately, admission to an intensive care unit for mechanical ventilation may be required to support breathing.[236] Extracorporeal membrane oxygenation (ECMO) has been used to address respiratory failure, but its benefits are still under consideration.[237][238] Some of the cases of severe disease course are caused by systemic hyper-inflammation, the so-called cytokine storm.[239]
Prognosis and risk factors
The severity of COVID‑19 varies. The disease may take a mild course with few or no symptoms, resembling other common upper respiratory diseases such as the common cold. In 3–4% of cases (7.4% for those over age 65) symptoms are severe enough to cause hospitalisation.[240] Mild cases typically recover within two weeks, while those with severe or critical diseases may take three to six weeks to recover. Among those who have died, the time from symptom onset to death has ranged from two to eight weeks.[80] The Italian Istituto Superiore di Sanità reported that the median time between the onset of symptoms and death was twelve days, with seven being hospitalised. However, people transferred to an ICU had a median time of ten days between hospitalisation and death.[241] Abnormal sodium levels during hospitalization with COVID-19 are associated with poor prognoses: high sodium with a greater risk of death, and low sodium with an increased chance of needing ventilator support.[242][243] Prolonged prothrombin time and elevated C-reactive protein levels on admission to the hospital are associated with severe course of COVID‑19 and with a transfer to ICU.[244][245]
Some early studies suggest 10% to 20% of people with COVID‑19 will experience symptoms lasting longer than a month.[246][247] A majority of those who were admitted to hospital with severe disease report long-term problems including fatigue and shortness of breath.[248] On 30 October 2020, WHO chief Tedros Adhanom warned that «to a significant number of people, the COVID virus poses a range of serious long-term effects.» He has described the vast spectrum of COVID‑19 symptoms that fluctuate over time as «really concerning». They range from fatigue, a cough and shortness of breath, to inflammation and injury of major organs – including the lungs and heart, and also neurological and psychologic effects. Symptoms often overlap and can affect any system in the body. Infected people have reported cyclical bouts of fatigue, headaches, months of complete exhaustion, mood swings, and other symptoms. Tedros therefore concluded that a strategy of achieving herd immunity by infection, rather than vaccination, is «morally unconscionable and unfeasible».[249]
In terms of hospital readmissions about 9% of 106,000 individuals had to return for hospital treatment within two months of discharge. The average to readmit was eight days since first hospital visit. There are several risk factors that have been identified as being a cause of multiple admissions to a hospital facility. Among these are advanced age (above 65 years of age) and presence of a chronic condition such as diabetes, COPD, heart failure or chronic kidney disease.[250][251]
According to scientific reviews smokers are more likely to require intensive care or die compared to non-smokers.[252][253] Acting on the same ACE2 pulmonary receptors affected by smoking, air pollution has been correlated with the disease.[253] Short term[254] and chronic[255] exposure to air pollution seems to enhance morbidity and mortality from COVID‑19.[256][257][258] Pre-existing heart and lung diseases[259] and also obesity, especially in conjunction with fatty liver disease, contributes to an increased health risk of COVID‑19.[253][260][261][262]
It is also assumed that those that are immunocompromised are at higher risk of getting severely sick from SARS-CoV-2.[263] One research study that looked into the COVID‑19 infections in hospitalised kidney transplant recipients found a mortality rate of 11%.[264]
Men with untreated hypogonadism were 2.4 times more likely than men with eugonadism to be hospitalized if they contracted COVID-19; Hypogonad men treated with testosterone were less likely to be hospitalized for COVID-19 than men who were not treated for hypogonadism.[265]
Genetic risk factors
Genetics plays an important role in the ability to fight off Covid.[266] For instance, those that do not produce detectable type I interferons or produce auto-antibodies against these may get much sicker from COVID‑19.[267][268] Genetic screening is able to detect interferon effector genes.[269] Some genetic variants are risk factors in specific populations. For instance, and allele of the DOCK2 gene (dedicator of cytokinesis 2 gene) is a common risk factor in Asian populations but much less common in Europe. The mutation leads to lower expression of DOCK2 especially in younger patients with severe Covid.[270] In fact, many other genes and genetic variants have been found that determine the outcome of SARS-CoV-2 infections.[271]
Children
While very young children have experienced lower rates of infection, older children have a rate of infection that is similar to the population as a whole.[272][273] Children are likely to have milder symptoms and are at lower risk of severe disease than adults.[274] The CDC reports that in the US roughly a third of hospitalised children were admitted to the ICU,[275] while a European multinational study of hospitalised children from June 2020, found that about 8% of children admitted to a hospital needed intensive care.[276] Four of the 582 children (0.7%) in the European study died, but the actual mortality rate may be «substantially lower» since milder cases that did not seek medical help were not included in the study.[277][278]
Complications
Complications may include pneumonia, acute respiratory distress syndrome (ARDS), multi-organ failure, septic shock, and death.[279][280][281][282] Cardiovascular complications may include heart failure, arrhythmias (including atrial fibrillation), heart inflammation, and thrombosis, particularly venous thromboembolism.[283][284][285][286][287][288] Approximately 20–30% of people who present with COVID‑19 have elevated liver enzymes, reflecting liver injury.[289][172]
Neurologic manifestations include seizure, stroke, encephalitis, and Guillain–Barré syndrome (which includes loss of motor functions).[290][291] Following the infection, children may develop paediatric multisystem inflammatory syndrome, which has symptoms similar to Kawasaki disease, which can be fatal.[292][293] In very rare cases, acute encephalopathy can occur, and it can be considered in those who have been diagnosed with COVID‑19 and have an altered mental status.[294]
In the case of pregnant women, it is important to note that, according to the US Centers for Disease Control and Prevention, pregnant women are at increased risk of becoming seriously ill from COVID‑19.[295] This is because pregnant women with COVID‑19 appear to be more likely to develop respiratory and obstetric complications that can lead to miscarriage, premature delivery and intrauterine growth restriction.[295]
Fungal infections such as aspergillosis, candidiasis, cryptococcosis and mucormycosis have been recorded in patients recovering from COVID‑19.[296][297]
Longer-term effects
Some early studies suggest that 10–20% of people with COVID‑19 will experience symptoms lasting longer than a month.[298][247] A majority of those who were admitted to hospital with severe disease report long-term problems, including fatigue and shortness of breath.[299] About 5–10% of patients admitted to hospital progress to severe or critical disease, including pneumonia and acute respiratory failure.[300]
By a variety of mechanisms, the lungs are the organs most affected in COVID‑19.[301] In people requiring hospital admission, up to 98% of CT scans performed show lung abnormalities after 28 days of illness even if they had clinically improved.[302]
People with advanced age, severe disease, prolonged ICU stays, or who smoke are more likely to have long-lasting effects, including pulmonary fibrosis.[303] Overall, approximately one-third of those investigated after four weeks will have findings of pulmonary fibrosis or reduced lung function as measured by DLCO, even in asymptomatic people, but with the suggestion of continuing improvement with the passing of more time.[301] After severe disease, lung function can take anywhere from three months to a year or more to return to previous levels.[304]
The risks of cognitive deficit, dementia, psychotic disorders, and epilepsy or seizures persists at an increased level two years after infection.[305]
Immunity
The immune response by humans to SARS-CoV-2 virus occurs as a combination of the cell-mediated immunity and antibody production,[306] just as with most other infections.[307] B cells interact with T cells and begin dividing before selection into the plasma cell, partly on the basis of their affinity for antigen.[308] Since SARS-CoV-2 has been in the human population only since December 2019, it remains unknown if the immunity is long-lasting in people who recover from the disease.[309] The presence of neutralising antibodies in blood strongly correlates with protection from infection, but the level of neutralising antibody declines with time. Those with asymptomatic or mild disease had undetectable levels of neutralising antibody two months after infection. In another study, the level of neutralising antibodies fell four-fold one to four months after the onset of symptoms. However, the lack of antibodies in the blood does not mean antibodies will not be rapidly produced upon reexposure to SARS-CoV-2. Memory B cells specific for the spike and nucleocapsid proteins of SARS-CoV-2 last for at least six months after the appearance of symptoms.[309]
As of August 2021, reinfection with COVID‑19 was possible but uncommon. The first case of reinfection was documented in August 2020.[310] A systematic review found 17 cases of confirmed reinfection in medical literature as of May 2021.[310] With the Omicron variant, as of 2022, reinfections have become common, albeit it is unclear how common.[311] COVID-19 reinfections are thought to likely be less severe than primary infections, especially if one was previously infected by the same variant.[311][additional citation(s) needed]
Mortality
Several measures are commonly used to quantify mortality.[312] These numbers vary by region and over time and are influenced by the volume of testing, healthcare system quality, treatment options, time since the initial outbreak, and population characteristics such as age, sex, and overall health.[313]
The mortality rate reflects the number of deaths within a specific demographic group divided by the population of that demographic group. Consequently, the mortality rate reflects the prevalence as well as the severity of the disease within a given population. Mortality rates are highly correlated to age, with relatively low rates for young people and relatively high rates among the elderly.[314][315][316] In fact, one relevant factor of mortality rates is the age structure of the countries’ populations. For example, the case fatality rate for COVID‑19 is lower in India than in the US since India’s younger population represents a larger percentage than in the US.[317]
Case fatality rate
The case fatality rate (CFR) reflects the number of deaths divided by the number of diagnosed cases within a given time interval. Based on Johns Hopkins University statistics, the global death-to-case ratio is 1.01% (6,707,311/664,338,243) as of 9 January 2023.[6] The number varies by region.[318][319]
-
Total confirmed cases over time
-
Total confirmed cases of COVID‑19 per million people[320]
-
Total deaths over time
-
Total confirmed deaths due to COVID‑19 per million people[321]
Infection fatality rate
A key metric in gauging the severity of COVID‑19 is the infection fatality rate (IFR), also referred to as the infection fatality ratio or infection fatality risk.[322][323][324] This metric is calculated by dividing the total number of deaths from the disease by the total number of infected individuals; hence, in contrast to the CFR, the IFR incorporates asymptomatic and undiagnosed infections as well as reported cases.[325]
Estimates
The red line shows the estimate of infection fatality rate (IFR), in percentage terms, as a function of age. The shaded region depicts the 95% confidence interval for that estimate. Markers denotes specific observations used in the meta-analysis.[326]
The same relationship plotted on a log scale
A December 2020 systematic review and meta-analysis estimated that population IFR during the first wave of the pandemic was about 0.5% to 1% in many locations (including France, Netherlands, New Zealand, and Portugal), 1% to 2% in other locations (Australia, England, Lithuania, and Spain), and exceeded 2% in Italy.[326] That study also found that most of these differences in IFR reflected corresponding differences in the age composition of the population and age-specific infection rates; in particular, the metaregression estimate of IFR is very low for children and younger adults (e.g., 0.002% at age 10 and 0.01% at age 25) but increases progressively to 0.4% at age 55, 1.4% at age 65, 4.6% at age 75, and 15% at age 85.[326] These results were also highlighted in a December 2020 report issued by the WHO.[327]
| Age group | IFR |
|---|---|
| 0–34 | 0.004% |
| 35–44 | 0.068% |
| 45–54 | 0.23% |
| 55–64 | 0.75% |
| 65–74 | 2.5% |
| 75–84 | 8.5% |
| 85 + | 28.3% |
An analysis of those IFR rates indicates that COVID‑19 is hazardous not only for the elderly but also for middle-aged adults, for whom the infection fatality rate of COVID-19 is two orders of magnitude greater than the annualised risk of a fatal automobile accident and far more dangerous than seasonal influenza.[326]
Earlier estimates of IFR
At an early stage of the pandemic, the World Health Organization reported estimates of IFR between 0.3% and 1%.[328][329] On 2 July, The WHO’s chief scientist reported that the average IFR estimate presented at a two-day WHO expert forum was about 0.6%.[330][331] In August, the WHO found that studies incorporating data from broad serology testing in Europe showed IFR estimates converging at approximately 0.5–1%.[332] Firm lower limits of IFRs have been established in a number of locations such as New York City and Bergamo in Italy since the IFR cannot be less than the population fatality rate. (After sufficient time however, people can get reinfected).[333] As of 10 July, in New York City, with a population of 8.4 million, 23,377 individuals (18,758 confirmed and 4,619 probable) have died with COVID‑19 (0.3% of the population).[334] Antibody testing in New York City suggested an IFR of ≈0.9%,[335] and ≈1.4%.[336] In Bergamo province, 0.6% of the population has died.[337] In September 2020, the U.S. Centers for Disease Control and Prevention (CDC) reported preliminary estimates of age-specific IFRs for public health planning purposes.[338]
Sex differences
| Percentage of infected people who are hospitalised | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 0–19 | 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | 70–79 | 80+ | Total | |
| Female | 0.1 (0.07–0.2) |
0.5 (0.3–0.8) |
0.9 (0.5–1.5) |
1.3 (0.7–2.1) |
2.6 (1.5–4.2) |
5.1 (2.9–8.3) |
7.8 (4.4–12.8) |
19.3 (10.9–31.6) |
2.6 (1.5–4.3) |
| Male | 0.2 (0.08–0.2) |
0.6 (0.3–0.9) |
1.2 (0.7–1.9) |
1.6 (0.9–2.6) |
3.2 (1.8–5.2) |
6.7 (3.7–10.9) |
11.0 (6.2–17.9) |
37.6 (21.1–61.3) |
3.3 (1.8–5.3) |
| Total | 0.1 (0.08–0.2) |
0.5 (0.3–0.8) |
1.1 (0.6–1.7) |
1.4 (0.8–2.3) |
2.9 (1.6–4.7) |
5.8 (3.3–9.5) |
9.3 (5.2–15.1) |
26.2 (14.8–42.7) |
2.9 (1.7–4.8) |
| Percentage of hospitalised people who go to Intensive Care Unit | |||||||||
| 0–19 | 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | 70–79 | 80+ | Total | |
| Female | 16.7 (14.3–19.3) |
8.7 (7.5–9.9) |
11.9 (10.9–13.0) |
16.6 (15.6–17.7) |
20.7 (19.8–21.6) |
23.1 (22.2–24.0) |
18.7 (18.0–19.5) |
4.2 (4.0–4.5) |
14.3 (13.9–14.7) |
| Male | 26.9 (23.1–31.1) |
14.0 (12.2–16.0) |
19.2 (17.6–20.9) |
26.9 (25.4–28.4) |
33.4 (32.0–34.8) |
37.3 (36.0–38.6) |
30.2 (29.1–31.3) |
6.8 (6.5–7.2) |
23.1 (22.6–23.6) |
| Total | 22.2 (19.1–25.7) |
11.6 (10.1–13.2) |
15.9 (14.5–17.3) |
22.2 (21.0–23.5) |
27.6 (26.5–28.7) |
30.8 (29.8–31.8) |
24.9 (24.1–25.8) |
5.6 (5.3–5.9) |
19.0 (18.7–19.44) |
| Percent of hospitalised people who die | |||||||||
| 0–19 | 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | 70–79 | 80+ | Total | |
| Female | 0.5 (0.2–1.0) |
0.9 (0.5–1.3) |
1.5 (1.2–1.9) |
2.6 (2.3–3.0) |
5.2 (4.8–5.6) |
10.1 (9.5–10.6) |
16.7 (16.0–17.4) |
25.2 (24.4–26.0) |
14.4 (14.0–14.8) |
| Male | 0.7 (0.3–1.5) |
1.3 (0.8–1.9) |
2.2 (1.7–2.7) |
3.8 (3.3–4.4) |
7.6 (7.0–8.2) |
14.8 (14.1–15.6) |
24.6 (23.7–25.6) |
37.1 (36.1–38.2) |
21.2 (20.8–21.7) |
| Total | 0.6 (0.2–1.3) |
1.1 (0.7–1.6) |
1.9 (1.5–2.3) |
3.3 (2.9–3.8) |
6.5 (6.0–7.0) |
12.6 (12.0–13.2) |
21.0 (20.3–21.7) |
31.6 (30.9–32.4) |
18.1 (17.8–18.4) |
| Percent of infected people who die – infection fatality rate (IFR) | |||||||||
| 0–19 | 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | 70–79 | 80+ | Total | |
| Female | 0.001 (<0.001–0.002) |
0.004 (0.002–0.007) |
0.01 (0.007–0.02) |
0.03 (0.02–0.06) |
0.1 (0.08–0.2) |
0.5 (0.3–0.8) |
1.3 (0.7–2.1) |
4.9 (2.7–8.0) |
0.4 (0.2–0.6) |
| Male | 0.001 (<0.001–0.003) |
0.007 (0.003–0.01) |
0.03 (0.02–0.05) |
0.06 (0.03–0.1) |
0.2 (0.1–0.4) |
1.0 (0.6–1.6) |
2.7 (1.5–1.4) |
14.0 (7.9–22.7) |
0.7 (0.4–1.1) |
| Total | 0.001 (<0.001–0.002) |
0.005 (0.003–0.01) |
0.02 (0.01–0.03) |
0.05 (0.03–0.08) |
0.2 (0.1–0.3) |
0.7 (0.4–1.2) |
1.9 (1.1–3.2) |
8.3 (4.7–13.5) |
0.5 (0.3–0.9) |
| Numbers in parentheses are 95% credible intervals for the estimates. |
COVID‑19 case fatality rates are higher among men than women in most countries. However, in a few countries like India, Nepal, Vietnam, and Slovenia the fatality cases are higher in women than men.[317] Globally, men are more likely to be admitted to the ICU and more likely to die.[340][341] One meta-analysis found that globally, men were more likely to get COVID‑19 than women; there were approximately 55 men and 45 women per 100 infections (CI: 51.43–56.58).[342]
The Chinese Center for Disease Control and Prevention reported the death rate was 2.8% for men and 1.7% for women.[343] Later reviews in June 2020 indicated that there is no significant difference in susceptibility or in CFR between genders.[344][345] One review acknowledges the different mortality rates in Chinese men, suggesting that it may be attributable to lifestyle choices such as smoking and drinking alcohol rather than genetic factors.[346] Smoking, which in some countries like China is mainly a male activity, is a habit that contributes to increasing significantly the case fatality rates among men.[317] Sex-based immunological differences, lesser prevalence of smoking in women and men developing co-morbid conditions such as hypertension at a younger age than women could have contributed to the higher mortality in men.[347] In Europe as of February 2020, 57% of the infected people were men and 72% of those died with COVID‑19 were men.[348] As of April 2020, the US government is not tracking sex-related data of COVID‑19 infections.[349] Research has shown that viral illnesses like Ebola, HIV, influenza and SARS affect men and women differently.[349]
Ethnic differences
In the US, a greater proportion of deaths due to COVID‑19 have occurred among African Americans and other minority groups.[350] Structural factors that prevent them from practising social distancing include their concentration in crowded substandard housing and in «essential» occupations such as retail grocery workers, public transit employees, health-care workers and custodial staff. Greater prevalence of lacking health insurance and care of underlying conditions such as diabetes,[351] hypertension, and heart disease also increase their risk of death.[352] Similar issues affect Native American and Latino communities.[350] On the one hand, in the Dominican Republic there is a clear example of both gender and ethnic inequality. In this Latin American territory, there is great inequality and precariousness that especially affects Dominican women, with greater emphasis on those of Haitian descent.[353] According to a US health policy non-profit, 34% of American Indian and Alaska Native People (AIAN) non-elderly adults are at risk of serious illness compared to 21% of white non-elderly adults.[354] The source attributes it to disproportionately high rates of many health conditions that may put them at higher risk as well as living conditions like lack of access to clean water.[355]
Leaders have called for efforts to research and address the disparities.[356] In the UK, a greater proportion of deaths due to COVID‑19 have occurred in those of a Black, Asian, and other ethnic minority background.[357][358][359] More severe impacts upon patients including the relative incidence of the necessity of hospitalisation requirements, and vulnerability to the disease has been associated via DNA analysis to be expressed in genetic variants at chromosomal region 3, features that are associated with European Neanderthal heritage. That structure imposes greater risks that those affected will develop a more severe form of the disease.[360] The findings are from Professor Svante Pääbo and researchers he leads at the Max Planck Institute for Evolutionary Anthropology and the Karolinska Institutet.[360] This admixture of modern human and Neanderthal genes is estimated to have occurred roughly between 50,000 and 60,000 years ago in Southern Europe.[360]
Comorbidities
Biological factors (immune response) and the general behaviour (habits) can strongly determine the consequences of COVID‑19.[317] Most of those who die of COVID‑19 have pre-existing (underlying) conditions, including hypertension, diabetes mellitus,[351] and cardiovascular disease.[361] According to March data from the United States, 89% of those hospitalised had preexisting conditions.[362] The Italian Istituto Superiore di Sanità reported that out of 8.8% of deaths where medical charts were available, 96.1% of people had at least one comorbidity with the average person having 3.4 diseases.[241] According to this report the most common comorbidities are hypertension (66% of deaths), type 2 diabetes (29.8% of deaths), ischaemic heart disease (27.6% of deaths), atrial fibrillation (23.1% of deaths) and chronic renal failure (20.2% of deaths).
Most critical respiratory comorbidities according to the US Centers for Disease Control and Prevention (CDC), are: moderate or severe asthma, pre-existing COPD, pulmonary fibrosis, cystic fibrosis.[363] Evidence stemming from meta-analysis of several smaller research papers also suggests that smoking can be associated with worse outcomes.[364][365] When someone with existing respiratory problems is infected with COVID‑19, they might be at greater risk for severe symptoms.[366] COVID‑19 also poses a greater risk to people who misuse opioids and amphetamines, insofar as their drug use may have caused lung damage.[367]
In August 2020, the CDC issued a caution that tuberculosis (TB) infections could increase the risk of severe illness or death. The WHO recommended that people with respiratory symptoms be screened for both diseases, as testing positive for COVID‑19 could not rule out co-infections. Some projections have estimated that reduced TB detection due to the pandemic could result in 6.3 million additional TB cases and 1.4 million TB-related deaths by 2025.[368]
History
The virus is thought to be of natural animal origin, most likely through spillover infection.[77][369][370] A joint-study conducted in early 2021 by the People’s Republic of China and the World Health Organization indicated that the virus descended from a coronavirus that infects wild bats, and likely spread to humans through an intermediary wildlife host.[371] There are several theories about where the index case originated and investigations into the origin of the pandemic are ongoing.[372] According to articles published in July 2022 in Science, virus transmission into humans occurred through two spillover events in November 2019 and was likely due to live wildlife trade on the Huanan wet market in the city of Wuhan (Hubei, China).[373][374][375] Doubts about the conclusions have mostly centred on the precise site of spillover.[376] Earlier phylogenetics estimated that SARS-CoV-2 arose in October or November 2019.[377][378][379] A phylogenetic algorithm analysis suggested that the virus may have been circulating in Guangdong before Wuhan.[380] U.S intelligence agencies and other scientists have found that the virus may have been unintentionally leaked from a laboratory such as the Wuhan Institute of Virology, but that it was not developed as a biological weapon and is unlikely to have been genetically engineered.[381][382][383][384]
The first confirmed human infections were in Wuhan. A study of the first 41 cases of confirmed COVID‑19, published in January 2020 in The Lancet, reported the earliest date of onset of symptoms as 1 December 2019.[385][386][387] Official publications from the WHO reported the earliest onset of symptoms as 8 December 2019.[388] Human-to-human transmission was confirmed by the WHO and Chinese authorities by 20 January 2020.[389][390] According to official Chinese sources, these were mostly linked to the Huanan Seafood Wholesale Market, which also sold live animals.[391] In May 2020, George Gao, the director of the CDC, said animal samples collected from the seafood market had tested negative for the virus, indicating that the market was the site of an early superspreading event, but that it was not the site of the initial outbreak.[392] Traces of the virus have been found in wastewater samples that were collected in Milan and Turin, Italy, on 18 December 2019.[393]
By December 2019, the spread of infection was almost entirely driven by human-to-human transmission.[343][394] The number of COVID-19 cases in Hubei gradually increased, reaching sixty by 20 December,[395] and at least 266 by 31 December.[396] On 24 December, Wuhan Central Hospital sent a bronchoalveolar lavage fluid (BAL) sample from an unresolved clinical case to sequencing company Vision Medicals. On 27 and 28 December, Vision Medicals informed the Wuhan Central Hospital and the Chinese CDC of the results of the test, showing a new coronavirus.[397] A pneumonia cluster of unknown cause was observed on 26 December and treated by the doctor Zhang Jixian in Hubei Provincial Hospital, who informed the Wuhan Jianghan CDC on 27 December.[398] On 30 December, a test report addressed to Wuhan Central Hospital, from company CapitalBio Medlab, stated an erroneous positive result for SARS, causing a group of doctors at Wuhan Central Hospital to alert their colleagues and relevant hospital authorities of the result. The Wuhan Municipal Health Commission issued a notice to various medical institutions on «the treatment of pneumonia of unknown cause» that same evening.[399] Eight of these doctors, including Li Wenliang (punished on 3 January),[400] were later admonished by the police for spreading false rumours and another, Ai Fen, was reprimanded by her superiors for raising the alarm.[401]
The Wuhan Municipal Health Commission made the first public announcement of a pneumonia outbreak of unknown cause on 31 December, confirming 27 cases[402][403][404] – enough to trigger an investigation.[405]
During the early stages of the outbreak, the number of cases doubled approximately every seven and a half days.[406] In early and mid-January 2020, the virus spread to other Chinese provinces, helped by the Chinese New Year migration and Wuhan being a transport hub and major rail interchange.[80] On 20 January, China reported nearly 140 new cases in one day, including two people in Beijing and one in Shenzhen.[407] Later official data shows 6,174 people had already developed symptoms by then,[343] and more may have been infected.[408] A report in The Lancet on 24 January indicated human transmission, strongly recommended personal protective equipment for health workers, and said testing for the virus was essential due to its «pandemic potential».[113][409] On 30 January, the WHO declared COVID-19 a Public Health Emergency of International Concern.[408] By this time, the outbreak spread by a factor of 100 to 200 times.[410]
Italy had its first confirmed cases on 31 January 2020, two tourists from China.[411] Italy overtook China as the country with the most deaths on 19 March 2020.[412] By 26 March the United States had overtaken China and Italy with the highest number of confirmed cases in the world.[413] Research on coronavirus genomes indicates the majority of COVID-19 cases in New York came from European travellers, rather than directly from China or any other Asian country.[414] Retesting of prior samples found a person in France who had the virus on 27 December 2019,[415][416] and a person in the United States who died from the disease on 6 February 2020.[417]
RT-PCR testing of untreated wastewater samples from Brazil and Italy have suggested detection of SARS-CoV-2 as early as November and December 2019, respectively, but the methods of such sewage studies have not been optimised, many have not been peer-reviewed, details are often missing, and there is a risk of false positives due to contamination or if only one gene target is detected.[418] A September 2020 review journal article said, «The possibility that the COVID‑19 infection had already spread to Europe at the end of last year is now indicated by abundant, even if partially circumstantial, evidence,» including pneumonia case numbers and radiology in France and Italy in November and December.[419]
As of 1 October 2021, Reuters reported that it had estimated the worldwide total number of deaths due to COVID‑19 to have exceeded five million.[420]
Misinformation
After the initial outbreak of COVID‑19, misinformation and disinformation regarding the origin, scale, prevention, treatment, and other aspects of the disease rapidly spread online.[421][422][423]
In September 2020, the US Centers for Disease Control and Prevention (CDC) published preliminary estimates of the risk of death by age groups in the United States, but those estimates were widely misreported and misunderstood.[424][425]
Other species
Humans appear to be capable of spreading the virus to some other animals, a type of disease transmission referred to as zooanthroponosis.
Some pets, especially cats and ferrets, can catch this virus from infected humans.[426][427] Symptoms in cats include respiratory (such as a cough) and digestive symptoms.[426] Cats can spread the virus to other cats, and may be able to spread the virus to humans, but cat-to-human transmission of SARS-CoV-2 has not been proven.[426][428] Compared to cats, dogs are less susceptible to this infection.[428] Behaviours which increase the risk of transmission include kissing, licking, and petting the animal.[428]
The virus does not appear to be able to infect pigs, ducks, or chickens at all.[426] Mice, rats, and rabbits, if they can be infected at all, are unlikely to be involved in spreading the virus.[428]
Tigers and lions in zoos have become infected as a result of contact with infected humans.[428] As expected, monkeys and great ape species such as orangutans can also be infected with the COVID‑19 virus.[428]
Minks, which are in the same family as ferrets, have been infected.[428] Minks may be asymptomatic, and can also spread the virus to humans.[428] Multiple countries have identified infected animals in mink farms.[429] Denmark, a major producer of mink pelts, ordered the slaughter of all minks over fears of viral mutations,[429] following an outbreak referred to as Cluster 5. A vaccine for mink and other animals is being researched.[429]
Research
International research on vaccines and medicines in COVID‑19 is underway by government organisations, academic groups, and industry researchers.[430][431] The CDC has classified it to require a BSL3 grade laboratory.[432] There has been a great deal of COVID‑19 research, involving accelerated research processes and publishing shortcuts to meet the global demand.[433]
As of December 2020, hundreds of clinical trials have been undertaken, with research happening on every continent except Antarctica.[434] As of November 2020, more than 200 possible treatments have been studied in humans.[435]
Transmission and prevention research
Modelling research has been conducted with several objectives, including predictions of the dynamics of transmission,[436] diagnosis and prognosis of infection,[437] estimation of the impact of interventions,[438][439] or allocation of resources.[440] Modelling studies are mostly based on compartmental models in epidemiology,[441] estimating the number of infected people over time under given conditions. Several other types of models have been developed and used during the COVID‑19 including computational fluid dynamics models to study the flow physics of COVID‑19,[442] retrofits of crowd movement models to study occupant exposure,[443] mobility-data based models to investigate transmission,[444] or the use of macroeconomic models to assess the economic impact of the pandemic.[445] Further, conceptual frameworks from crisis management research have been applied to better understand the effects of COVID‑19 on organisations worldwide.[446][447]
Seven possible drug targets in viral replication process and drugs
Repurposed antiviral drugs make up most of the research into COVID‑19 treatments.[448][449] Other candidates in trials include vasodilators, corticosteroids, immune therapies, lipoic acid, bevacizumab, and recombinant angiotensin-converting enzyme 2.[449]
In March 2020, the World Health Organization (WHO) initiated the Solidarity trial to assess the treatment effects of some promising drugs: an experimental drug called remdesivir; anti-malarial drugs chloroquine and hydroxychloroquine; two anti-HIV drugs, lopinavir/ritonavir; and interferon-beta.[450][451] More than 300 active clinical trials are underway as of April 2020.[172]
Research on the antimalarial drugs hydroxychloroquine and chloroquine showed that they were ineffective at best,[452][453] and that they may reduce the antiviral activity of remdesivir.[454] By May 2020, France, Italy, and Belgium had banned the use of hydroxychloroquine as a COVID‑19 treatment.[455]
In June, initial results from the randomised RECOVERY Trial in the United Kingdom showed that dexamethasone reduced mortality by one third for people who are critically ill on ventilators and one fifth for those receiving supplemental oxygen.[456] Because this is a well-tested and widely available treatment, it was welcomed by the WHO, which is in the process of updating treatment guidelines to include dexamethasone and other steroids.[457][458] Based on those preliminary results, dexamethasone treatment has been recommended by the NIH for patients with COVID‑19 who are mechanically ventilated or who require supplemental oxygen but not in patients with COVID‑19 who do not require supplemental oxygen.[459]
In September 2020, the WHO released updated guidance on using corticosteroids for COVID‑19.[460][461] The WHO recommends systemic corticosteroids rather than no systemic corticosteroids for the treatment of people with severe and critical COVID‑19 (strong recommendation, based on moderate certainty evidence).[460] The WHO suggests not to use corticosteroids in the treatment of people with non-severe COVID‑19 (conditional recommendation, based on low certainty evidence).[460] The updated guidance was based on a meta-analysis of clinical trials of critically ill COVID‑19 patients.[462][463]
In September 2020, the European Medicines Agency (EMA) endorsed the use of dexamethasone in adults and adolescents from twelve years of age and weighing at least 40 kilograms (88 lb) who require supplemental oxygen therapy.[464][465] Dexamethasone can be taken by mouth or given as an injection or infusion (drip) into a vein.[464]
In November 2020, the US Food and Drug Administration (FDA) issued an emergency use authorization for the investigational monoclonal antibody therapy bamlanivimab for the treatment of mild-to-moderate COVID‑19.[466] Bamlanivimab is authorised for people with positive results of direct SARS-CoV-2 viral testing who are twelve years of age and older weighing at least 40 kilograms (88 lb), and who are at high risk for progressing to severe COVID‑19 or hospitalisation.[466] This includes those who are 65 years of age or older, or who have chronic medical conditions.[466]
In February 2021, the FDA issued an emergency use authorization (EUA) for bamlanivimab and etesevimab administered together for the treatment of mild to moderate COVID‑19 in people twelve years of age or older weighing at least 40 kilograms (88 lb) who test positive for SARS‑CoV‑2 and who are at high risk for progressing to severe COVID‑19. The authorised use includes treatment for those who are 65 years of age or older or who have certain chronic medical conditions.[467]
In April 2021, the FDA revoked the emergency use authorization (EUA) that allowed for the investigational monoclonal antibody therapy bamlanivimab, when administered alone, to be used for the treatment of mild-to-moderate COVID‑19 in adults and certain paediatric patients.[468]
Cytokine storm
Various therapeutic strategies for targeting cytokine storm
A cytokine storm can be a complication in the later stages of severe COVID‑19. A cytokine storm is a potentially deadly immune reaction where a large amount of pro-inflammatory cytokines and chemokines are released too quickly. A cytokine storm can lead to ARDS and multiple organ failure.[469] Data collected from Jin Yin-tan Hospital in Wuhan, China indicates that patients who had more severe responses to COVID‑19 had greater amounts of pro-inflammatory cytokines and chemokines in their system than patients who had milder responses. These high levels of pro-inflammatory cytokines and chemokines indicate presence of a cytokine storm.[470]
Tocilizumab has been included in treatment guidelines by China’s National Health Commission after a small study was completed.[471][472] It is undergoing a Phase II non-randomised trial at the national level in Italy after showing positive results in people with severe disease.[473][474] Combined with a serum ferritin blood test to identify a cytokine storm (also called cytokine storm syndrome, not to be confused with cytokine release syndrome), it is meant to counter such developments, which are thought to be the cause of death in some affected people.[475] The interleukin-6 receptor (IL-6R) antagonist was approved by the FDA to undergo a Phase III clinical trial assessing its effectiveness on COVID‑19 based on retrospective case studies for the treatment of steroid-refractory cytokine release syndrome induced by a different cause, CAR T cell therapy, in 2017.[476] There is no randomised, controlled evidence that tocilizumab is an efficacious treatment for CRS. Prophylactic tocilizumab has been shown to increase serum IL-6 levels by saturating the IL-6R, driving IL-6 across the blood–brain barrier, and exacerbating neurotoxicity while having no effect on the incidence of CRS.[477]
Lenzilumab, an anti-GM-CSF monoclonal antibody, is protective in murine models for CAR T cell-induced CRS and neurotoxicity and is a viable therapeutic option due to the observed increase of pathogenic GM-CSF secreting T cells in hospitalised patients with COVID‑19.[478]
Passive antibodies
Transferring purified and concentrated antibodies produced by the immune systems of those who have recovered from COVID‑19 to people who need them is being investigated as a non-vaccine method of passive immunisation.[479][480] Viral neutralisation is the anticipated mechanism of action by which passive antibody therapy can mediate defence against SARS-CoV-2. The spike protein of SARS-CoV-2 is the primary target for neutralising antibodies.[481] As of 8 August 2020, eight neutralising antibodies targeting the spike protein of SARS-CoV-2 have entered clinical studies.[482] It has been proposed that selection of broad-neutralising antibodies against SARS-CoV-2 and SARS-CoV might be useful for treating not only COVID‑19 but also future SARS-related CoV infections.[481] Other mechanisms, however, such as antibody-dependant cellular cytotoxicity or phagocytosis, may be possible.[479] Other forms of passive antibody therapy, for example, using manufactured monoclonal antibodies, are in development.[479]
The use of passive antibodies to treat people with active COVID‑19 is also being studied. This involves the production of convalescent serum, which consists of the liquid portion of the blood from people who recovered from the infection and contains antibodies specific to this virus, which is then administered to active patients.[479] This strategy was tried for SARS with inconclusive results.[479] An updated Cochrane review in May 2021 found high certainty evidence that, for the treatment of people with moderate to severe COVID‑19, convalescent plasma did not reduce mortality or bring about symptom improvement.[480] There continues to be uncertainty about the safety of convalescent plasma administration to people with COVID‑19 and differing outcomes measured in different studies limits their use in determining efficacy.[480]
Bioethics
Since the outbreak of the COVID‑19 pandemic, scholars have explored the bioethics, normative economics, and political theories of healthcare policies related to the public health crisis.[483] Academics have pointed to the moral distress of healthcare workers, ethics of distributing scarce healthcare resources such as ventilators,[484] and the global justice of vaccine diplomacies.[citation needed] The socio-economic inequalities between genders,[485] races,[486] groups with disabilities,[487] communities,[488] regions, countries,[489] and continents have also drawn attention in academia and the general public.
Effects on other diseases
The use of social distancing and the wearing of surgical masks and similar precautions against COVID‑19 may have caused a drop in the spread of the common cold and the flu.[490][491]
See also
- Coronavirus diseases, a group of closely related syndromes
- Disease X, a WHO term
- Law of declining virulence – Disproved hypothesis of epidemiologist Theobald Smith
- Theory of virulence – Theory by biologist Paul W. Ewald
References
- ^ «Covid-19». Oxford English Dictionary (Online ed.). Oxford University Press. April 2020. Retrieved 15 April 2020. (Subscription or participating institution membership required.)
- ^ «Symptoms of Coronavirus». U.S. Centers for Disease Control and Prevention (CDC). 13 May 2020. Archived from the original on 17 June 2020. Retrieved 18 June 2020.
- ^ «Q&A on coronaviruses (COVID-19)». World Health Organization (WHO). 17 April 2020. Archived from the original on 14 May 2020. Retrieved 14 May 2020.
- ^ «COVID-19 vaccines». World Health Organization (WHO). Retrieved 3 March 2021.
- ^ Talic S, Shah S, Wild H, Gasevic D, Maharaj A, Ademi Z, et al. (November 2021). «Effectiveness of public health measures in reducing the incidence of covid-19, SARS-CoV-2 transmission, and covid-19 mortality: systematic review and meta-analysis». BMJ (Clinical Research Ed.). 375: e068302. doi:10.1136/bmj-2021-068302. ISSN 1756-1833. PMC 9423125. PMID 34789505. S2CID 244271780.
- ^ a b c «COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU)». ArcGIS. Johns Hopkins University. Retrieved 9 January 2023.
- ^ Page J, Hinshaw D, McKay B (26 February 2021). «In Hunt for Covid-19 Origin, Patient Zero Points to Second Wuhan Market – The man with the first confirmed infection of the new coronavirus told the WHO team that his parents had shopped there». The Wall Street Journal. Retrieved 27 February 2021.
- ^ Islam MA (April 2021). «Prevalence and characteristics of fever in adult and paediatric patients with coronavirus disease 2019 (COVID-19): A systematic review and meta-analysis of 17515 patients». PLOS ONE. 16 (4): e0249788. Bibcode:2021PLoSO..1649788I. doi:10.1371/journal.pone.0249788. PMC 8023501. PMID 33822812.
- ^ Islam MA (November 2020). «Prevalence of Headache in Patients With Coronavirus Disease 2019 (COVID-19): A Systematic Review and Meta-Analysis of 14,275 Patients». Frontiers in Neurology. 11: 562634. doi:10.3389/fneur.2020.562634. PMC 7728918. PMID 33329305.
- ^ Saniasiaya J, Islam MA (April 2021). «Prevalence of Olfactory Dysfunction in Coronavirus Disease 2019 (COVID-19): A Meta-analysis of 27,492 Patients». The Laryngoscope. 131 (4): 865–878. doi:10.1002/lary.29286. ISSN 0023-852X. PMC 7753439. PMID 33219539.
- ^ Saniasiaya J, Islam MA (November 2020). «Prevalence and Characteristics of Taste Disorders in Cases of COVID-19: A Meta-analysis of 29,349 Patients». Otolaryngology–Head and Neck Surgery. 165 (1): 33–42. doi:10.1177/0194599820981018. PMID 33320033. S2CID 229174644.
- ^ Agyeman AA, Chin KL, Landersdorfer CB, Liew D, Ofori-Asenso R (August 2020). «Smell and Taste Dysfunction in Patients With COVID-19: A Systematic Review and Meta-analysis». Mayo Clin. Proc. 95 (8): 1621–1631. doi:10.1016/j.mayocp.2020.05.030. PMC 7275152. PMID 32753137.
- ^ Oran DP, Topol EJ (January 2021). «The Proportion of SARS-CoV-2 Infections That Are Asymptomatic: A Systematic Review». Annals of Internal Medicine. 174 (5): M20-6976. doi:10.7326/M20-6976. PMC 7839426. PMID 33481642.
- ^ «Interim Clinical Guidance for Management of Patients with Confirmed Coronavirus Disease (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 6 April 2020. Archived from the original on 2 March 2020. Retrieved 19 April 2020.
- ^ a b CDC (11 February 2020). «Post-COVID Conditions». U.S. Centers for Disease Control and Prevention (CDC). Retrieved 12 July 2021.
- ^ CDC (11 February 2020). «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). Retrieved 6 December 2020.
- ^ «Clinical Questions about COVID-19: Questions and Answers». U.S. Centers for Disease Control and Prevention (CDC). 17 November 2021. Retrieved 25 January 2022.
- ^ a b c «Overview of Testing for SARS-CoV-2, the virus that causes COVID-19». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 31 July 2022.
- ^ a b c «Nucleic Acid Amplification Tests (NAATs)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 31 July 2022.
- ^ Gorzalski AJ, Tian H, Laverdure C, Morzunov S, Verma SC, VanHooser S, Pandori MW (August 2020). «High-Throughput Transcription-mediated amplification on the Hologic Panther is a highly sensitive method of detection for SARS-CoV-2». Journal of Clinical Virology. 129: 104501. doi:10.1016/j.jcv.2020.104501. PMC 7286273. PMID 32619959.
- ^ a b c d e Li C, Zhao C, Bao J, Tang B, Wang Y, Gu B (November 2020). «Laboratory diagnosis of coronavirus disease-2019 (COVID-19)». Clinica Chimica Acta; International Journal of Clinical Chemistry. 510: 35–46. doi:10.1016/j.cca.2020.06.045. PMC 7329657. PMID 32621814.
- ^ «2nd U.S. Case Of Wuhan Coronavirus Confirmed». NPR. Retrieved 4 April 2020.
- ^ McNeil Jr DG (2 February 2020). «Wuhan Coronavirus Looks Increasingly Like a Pandemic, Experts Say». The New York Times. ISSN 0362-4331. Archived from the original on 2 February 2020. Retrieved 4 April 2020.
- ^ Griffiths J. «Wuhan coronavirus deaths spike again as outbreak shows no signs of slowing». CNN. Retrieved 4 April 2020.
- ^ Jiang S, Xia S, Ying T, Lu L (May 2020). «A novel coronavirus (2019-nCoV) causing pneumonia-associated respiratory syndrome». Cellular & Molecular Immunology. 17 (5): 554. doi:10.1038/s41423-020-0372-4. PMC 7091741. PMID 32024976.
- ^ Chan JF, Yuan S, Kok KH, To KK, Chu H, Yang J, et al. (February 2020). «A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster». Lancet. 395 (10223): 514–523. doi:10.1016/S0140-6736(20)30154-9. PMC 7159286. PMID 31986261.
- ^ Shablovsky S (September 2017). «The legacy of the Spanish flu». Science. 357 (6357): 1245. Bibcode:2017Sci…357.1245S. doi:10.1126/science.aao4093. ISSN 0036-8075. S2CID 44116811.
- ^ «Stop the coronavirus stigma now». Nature. 580 (7802): 165. 7 April 2020. Bibcode:2020Natur.580..165.. doi:10.1038/d41586-020-01009-0. PMID 32265571. S2CID 214809950. Retrieved 16 April 2020.
- ^ «Novel Coronavirus (2019-nCoV) Situation Report – 1» (PDF). World Health Organization (WHO). 21 January 2020.
- ^ «Novel Coronavirus(2019-nCoV) Situation Report – 10» (PDF). World Health Organization (WHO). 30 January 2020.
- ^ «Novel coronavirus named ‘Covid-19’: WHO». Today. Singapore. Archived from the original on 21 March 2020. Retrieved 11 February 2020.
- ^ «The coronavirus spreads racism against – and among – ethnic Chinese». The Economist. 17 February 2020. Archived from the original on 17 February 2020. Retrieved 17 February 2020.
- ^ World Health Organization Best Practices for the Naming of New Human Infectious Diseases (PDF) (Report). World Health Organization (WHO). May 2015. hdl:10665/163636.
- ^ a b «Naming the coronavirus disease (COVID-19) and the virus that causes it». World Health Organization (WHO). Archived from the original on 28 February 2020. Retrieved 13 March 2020.
- ^ «Novel Coronavirus(2019-nCoV) Situation Report – 22» (PDF). WHO. 11 February 2020.
- ^ Gover AR, Harper SB, Langton L (July 2020). «Anti-Asian Hate Crime During the COVID-19 Pandemic: Exploring the Reproduction of Inequality». American Journal of Criminal Justice. 45 (4): 647–667. doi:10.1007/s12103-020-09545-1. PMC 7364747. PMID 32837171.
- ^ «Symptoms of Coronavirus». U.S. Centers for Disease Control and Prevention (CDC). 22 February 2021. Archived from the original on 4 March 2021. Retrieved 4 March 2021.
- ^ Grant MC, Geoghegan L, Arbyn M, Mohammed Z, McGuinness L, Clarke EL, Wade RG (23 June 2020). «The prevalence of symptoms in 24,410 adults infected by the novel coronavirus (SARS-CoV-2; COVID-19): A systematic review and meta-analysis of 148 studies from 9 countries». PLOS ONE. 15 (6): e0234765. Bibcode:2020PLoSO..1534765G. doi:10.1371/journal.pone.0234765. PMC 7310678. PMID 32574165. S2CID 220046286.
- ^ Pardhan S, Vaughan M, Zhang J, Smith L, Chichger H (1 November 2020). «Sore eyes as the most significant ocular symptom experienced by people with COVID-19: a comparison between pre-COVID-19 and during COVID-19 states». BMJ Open Ophthalmology. 5 (1): e000632. doi:10.1136/bmjophth-2020-000632. PMC 7705420. PMID 34192153.
- ^ «COVID toes, rashes: How the coronavirus can affect your skin». www.aad.org. Retrieved 20 March 2022.
- ^ a b «Clinical characteristics of COVID-19». European Centre for Disease Prevention and Control. Retrieved 29 December 2020.
- ^ Paderno A, Mattavelli D, Rampinelli V, Grammatica A, Raffetti E, Tomasoni M, et al. (December 2020). «Olfactory and Gustatory Outcomes in COVID-19: A Prospective Evaluation in Nonhospitalized Subjects». Otolaryngology–Head and Neck Surgery. 163 (6): 1144–1149. doi:10.1177/0194599820939538. PMC 7331108. PMID 32600175.
- ^ Chabot AB, Huntwork MP (September 2021). «Turmeric as a Possible Treatment for COVID-19-Induced Anosmia and Ageusia». Cureus. 13 (9): e17829. doi:10.7759/cureus.17829. PMC 8502749. PMID 34660038.
- ^ Niazkar HR, Zibaee B, Nasimi A, Bahri N (July 2020). «The neurological manifestations of COVID-19: a review article». Neurological Sciences. 41 (7): 1667–1671. doi:10.1007/s10072-020-04486-3. PMC 7262683. PMID 32483687.
- ^ «Interim Clinical Guidance for Management of Patients with Confirmed Coronavirus Disease (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 6 April 2020. Archived from the original on 2 March 2020. Retrieved 19 April 2020.
- ^ Multiple sources:
- Oran DP, Topol EJ (May 2021). «The Proportion of SARS-CoV-2 Infections That Are Asymptomatic : A Systematic Review». Annals of Internal Medicine. 174 (5): 655–662. doi:10.7326/M20-6976. PMC 7839426. PMID 33481642.
- «Transmission of COVID-19». European Centre for Disease Prevention and Control. Retrieved 6 December 2020.
- Nogrady B (November 2020). «What the data say about asymptomatic COVID infections». Nature. 587 (7835): 534–535. Bibcode:2020Natur.587..534N. doi:10.1038/d41586-020-03141-3. PMID 33214725.
- ^ a b Gao Z, Xu Y, Sun C, Wang X, Guo Y, Qiu S, Ma K (February 2021). «A systematic review of asymptomatic infections with COVID-19». Journal of Microbiology, Immunology, and Infection = Wei Mian Yu Gan Ran Za Zhi. 54 (1): 12–16. doi:10.1016/j.jmii.2020.05.001. PMC 7227597. PMID 32425996.
- ^ Oran DP, Topol EJ (September 2020). «Prevalence of Asymptomatic SARS-CoV-2 Infection : A Narrative Review». Annals of Internal Medicine. 173 (5): 362–367. doi:10.7326/M20-3012. PMC 7281624. PMID 32491919.
- ^ Lai CC, Liu YH, Wang CY, Wang YH, Hsueh SC, Yen MY, et al. (June 2020). «Asymptomatic carrier state, acute respiratory disease, and pneumonia due to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2): Facts and myths». Journal of Microbiology, Immunology, and Infection = Wei Mian Yu Gan Ran Za Zhi. 53 (3): 404–412. doi:10.1016/j.jmii.2020.02.012. PMC 7128959. PMID 32173241.
- ^ a b Furukawa NW, Brooks JT, Sobel J (July 2020). «Evidence Supporting Transmission of Severe Acute Respiratory Syndrome Coronavirus 2 While Presymptomatic or Asymptomatic». Emerging Infectious Diseases. 26 (7). doi:10.3201/eid2607.201595. PMC 7323549. PMID 32364890.
- ^ a b Gandhi RT, Lynch JB, Del Rio C (October 2020). «Mild or Moderate Covid-19». The New England Journal of Medicine. 383 (18): 1757–1766. doi:10.1056/NEJMcp2009249. PMID 32329974.
- ^ Byrne AW, McEvoy D, Collins AB, Hunt K, Casey M, Barber A, et al. (August 2020). «Inferred duration of infectious period of SARS-CoV-2: rapid scoping review and analysis of available evidence for asymptomatic and symptomatic COVID-19 cases». BMJ Open. 10 (8): e039856. doi:10.1136/bmjopen-2020-039856. PMC 7409948. PMID 32759252.
- ^ Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC (August 2020). «Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (COVID-19): A Review». JAMA. 324 (8): 782–793. doi:10.1001/jama.2020.12839. PMID 32648899. S2CID 220465311.
- ^ «Half of young adults with COVID-19 had persistent symptoms after 6 months». medicalxpress.com. Retrieved 10 July 2021.
- ^ Blomberg B, Mohn KG, Brokstad KA, Zhou F, Linchausen DW, Hansen BA, et al. (September 2021). «Long COVID in a prospective cohort of home-isolated patients». Nature Medicine. 27 (9): 1607–1613. doi:10.1038/s41591-021-01433-3. PMC 8440190. PMID 34163090. S2CID 235625772.
- ^ CDC (1 September 2022). «Post-COVID Conditions». Centers for Disease Control and Prevention. Retrieved 21 September 2022.
- ^ CDC (11 February 2020). «COVID-19 and Your Health». Centers for Disease Control and Prevention. Retrieved 23 January 2021.
- ^ CDC (29 March 2022). «Omicron Variant: What You Need to Know». Centers for Disease Control and Prevention. Retrieved 15 June 2022.
- ^ Hu B, Guo H, Zhou P, Shi ZL (March 2021). «Characteristics of SARS-CoV-2 and COVID-19». Nature Reviews. Microbiology. 19 (3): 141–154. doi:10.1038/s41579-020-00459-7. PMC 7537588. PMID 33024307.
- ^ a b Wang CC, Prather KA, Sznitman J, Jimenez JL, Lakdawala SS, Tufekci Z, Marr LC (August 2021). «Airborne transmission of respiratory viruses». Science. 373 (6558). Bibcode:2021Sci…373…..W. doi:10.1126/science.abd9149. PMC 8721651. PMID 34446582.
- ^ Greenhalgh T, Jimenez JL, Prather KA, Tufekci Z, Fisman D, Schooley R (May 2021). «Ten scientific reasons in support of airborne transmission of SARS-CoV-2». Lancet. 397 (10285): 1603–1605. doi:10.1016/s0140-6736(21)00869-2. PMC 8049599. PMID 33865497.
- ^ Bourouiba L (13 July 2021). «Fluid Dynamics of Respiratory Infectious Diseases». Annual Review of Biomedical Engineering. 23 (1): 547–577. doi:10.1146/annurev-bioeng-111820-025044. hdl:1721.1/131115. PMID 34255991. S2CID 235823756. Retrieved 7 September 2021.
- ^ Stadnytskyi, Valentyn; Bax, Christina E.; Bax, Adriaan; Anfinrud, Philip (2 June 2020). «The airborne lifetime of small speech droplets and their potential importance in SARS-CoV-2 transmission». Proceedings of the National Academy of Sciences. 117 (22): 11875–11877. doi:10.1073/pnas.2006874117. PMC 7275719. PMID 32404416.
- ^ Miller SL, Nazaroff WW, Jimenez JL, Boerstra A, Buonanno G, Dancer SJ, et al. (March 2021). «Transmission of SARS-CoV-2 by inhalation of respiratory aerosol in the Skagit Valley Chorale superspreading event». Indoor Air. 31 (2): 314–323. doi:10.1111/ina.12751. PMC 7537089. PMID 32979298.
- ^ He, Xi; Lau, Eric H. Y.; Wu, Peng; Deng, Xilong; Wang, Jian; Hao, Xinxin; Lau, Yiu Chung; Wong, Jessica Y.; Guan, Yujuan; Tan, Xinghua; Mo, Xiaoneng; Chen, Yanqing; Liao, Baolin; Chen, Weilie; Hu, Fengyu; Zhang, Qing; Zhong, Mingqiu; Wu, Yanrong; Zhao, Lingzhai; Zhang, Fuchun; Cowling, Benjamin J.; Li, Fang; Leung, Gabriel M. (September 2020). «Author Correction: Temporal dynamics in viral shedding and transmissibility of COVID-19». Nature Medicine. 26 (9): 1491–1493. doi:10.1038/s41591-020-1016-z. PMC 7413015. PMID 32770170. S2CID 221050261.
- ^ a b c d Communicable Diseases Network Australia. «Coronavirus Disease 2019 (COVID-19): CDNA National Guidelines for Public Health Units». 5.1. Communicable Diseases Network Australia/Australian Government Department of Health.
- ^ «Clinical Questions about COVID-19: Questions and Answers». Centers for Disease Control and Prevention. 4 March 2021.
- ^ «Scientific Brief: SARS-CoV-2 Transmission». Centers for Disease Control and Prevention. 7 May 2021. Retrieved 8 May 2021.
- ^ «Coronavirus disease (COVID-19): How is it transmitted?». World Health Organization. 30 April 2021.
- ^ a b c d e • «COVID-19: epidemiology, virology and clinical features». GOV.UK. Retrieved 18 October 2020.
• Communicable Diseases Network Australia. «Coronavirus Disease 2019 (COVID-19) — CDNA Guidelines for Public Health Units». Version 4.4. Australian Government Department of Health. Retrieved 17 May 2021.{{cite web}}: CS1 maint: url-status (link)
• Public Health Agency of Canada (3 November 2020). «COVID-19: Main modes of transmission». aem. Retrieved 18 May 2021.
• «Transmission of COVID-19». European Centre for Disease Prevention and Control. Retrieved 18 May 2021.
• Meyerowitz EA, Richterman A, Gandhi RT, Sax PE (January 2021). «Transmission of SARS-CoV-2: A Review of Viral, Host, and Environmental Factors». Annals of Internal Medicine. 174 (1): 69–79. doi:10.7326/M20-5008. ISSN 0003-4819. PMC 7505025. PMID 32941052. - ^ a b c Tang JW, Marr LC, Li Y, Dancer SJ (April 2021). «Covid-19 has redefined airborne transmission». BMJ. 373: n913. doi:10.1136/bmj.n913. PMID 33853842.
- ^ a b Morawska L, Allen J, Bahnfleth W, Bluyssen PM, Boerstra A, Buonanno G, et al. (May 2021). «A paradigm shift to combat indoor respiratory infection» (PDF). Science. 372 (6543): 689–691. Bibcode:2021Sci…372..689M. doi:10.1126/science.abg2025. PMID 33986171. S2CID 234487289.
- ^ a b Meyerowitz EA, Richterman A, Gandhi RT, Sax PE (January 2021). «Transmission of SARS-CoV-2: A Review of Viral, Host, and Environmental Factors». Annals of Internal Medicine. 174 (1): 69–79. doi:10.7326/M20-5008. ISSN 0003-4819. PMC 7505025. PMID 32941052.
- ^ CDC (11 February 2020). «Healthcare Workers». Centers for Disease Control and Prevention. Retrieved 29 March 2022.
- ^ Liu T, Gong D, Xiao J, Hu J, He G, Rong Z, Ma W (October 2020). «Cluster infections play important roles in the rapid evolution of COVID-19 transmission: A systematic review». International Journal of Infectious Diseases. 99: 374–380. doi:10.1016/j.ijid.2020.07.073. PMC 7405860. PMID 32768702.
- ^ «Outbreak of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2): increased transmission beyond China – fourth update» (PDF). European Centre for Disease Prevention and Control. 14 February 2020. Retrieved 8 March 2020.
- ^ a b Andersen KG, Rambaut A, Lipkin WI, Holmes EC, Garry RF (April 2020). «The proximal origin of SARS-CoV-2». Nature Medicine. 26 (4): 450–452. doi:10.1038/s41591-020-0820-9. PMC 7095063. PMID 32284615.
- ^ Gibbens S (18 March 2020). «Why soap is preferable to bleach in the fight against coronavirus». National Geographic. Archived from the original on 2 April 2020. Retrieved 2 April 2020.
- ^ Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. (February 2020). «A Novel Coronavirus from Patients with Pneumonia in China, 2019». The New England Journal of Medicine. 382 (8): 727–733. doi:10.1056/NEJMoa2001017. PMC 7092803. PMID 31978945.
- ^ a b c Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) (PDF) (Report). World Health Organization (WHO). February 2020. Archived (PDF) from the original on 29 February 2020. Retrieved 21 March 2020.
- ^ «Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19)». World Health Organization (WHO). Retrieved 25 January 2022.
- ^ Rathore JS, Ghosh C (August 2020). «Severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2), a newly emerged pathogen: an overview». Pathogens and Disease. 78 (6). doi:10.1093/femspd/ftaa042. OCLC 823140442. PMC 7499575. PMID 32840560.
- ^ Thomas S (October 2020). «The Structure of the Membrane Protein of SARS-CoV-2 Resembles the Sugar Transporter SemiSWEET». Pathogens & Immunity. 5 (1): 342–363. doi:10.20411/pai.v5i1.377. PMC 7608487. PMID 33154981.
- ^ Koyama T, Platt D, Parida L (July 2020). «Variant analysis of SARS-CoV-2 genomes». Bulletin of the World Health Organization. 98 (7): 495–504. doi:10.2471/BLT.20.253591. PMC 7375210. PMID 32742035.
We detected in total 65776 variants with 5775 distinct variants.
- ^ a b Rambaut A, Holmes EC, O’Toole Á, Hill V, McCrone JT, Ruis C, et al. (November 2020). «A dynamic nomenclature proposal for SARS-CoV-2 lineages to assist genomic epidemiology». Nature Microbiology. 5 (11): 1403–1407. doi:10.1038/s41564-020-0770-5. PMC 7610519. PMID 32669681.
- ^ «Tracking SARS-CoV-2 variants». World Health Organization. 1 July 2021. Retrieved 5 July 2021.
- ^ Alm E, Broberg EK, Connor T, Hodcroft EB, Komissarov AB, Maurer-Stroh S, et al. (August 2020). «Geographical and temporal distribution of SARS-CoV-2 clades in the WHO European Region, January to June 2020». Euro Surveillance. 25 (32). doi:10.2807/1560-7917.ES.2020.25.32.2001410. PMC 7427299. PMID 32794443.
- ^ «PANGO lineages». cov-lineages.org. Archived from the original on 10 May 2021. Retrieved 9 May 2021.
- ^ Lauring AS, Hodcroft EB (February 2021). «Genetic Variants of SARS-CoV-2-What Do They Mean?». JAMA. 325 (6): 529–531. doi:10.1001/jama.2020.27124. PMID 33404586. S2CID 230783233.
- ^ Abdool Karim SS, de Oliveira T (May 2021). «New SARS-CoV-2 Variants – Clinical, Public Health, and Vaccine Implications». The New England Journal of Medicine. Massachusetts Medical Society. 384 (19): 1866–1868. doi:10.1056/nejmc2100362. ISSN 0028-4793. PMC 8008749. PMID 33761203.
- ^ Mallapaty S (November 2020). «COVID mink analysis shows mutations are not dangerous – yet». Nature. 587 (7834): 340–341. Bibcode:2020Natur.587..340M. doi:10.1038/d41586-020-03218-z. PMID 33188367. S2CID 226947606.
- ^ Larsen HD, Fonager J, Lomholt FK, Dalby T, Benedetti G, Kristensen B, et al. (February 2021). «Preliminary report of an outbreak of SARS-CoV-2 in mink and mink farmers associated with community spread, Denmark, June to November 2020». Euro Surveillance. 26 (5): 2100009. doi:10.2807/1560-7917.ES.2021.26.5.210009. PMC 7863232. PMID 33541485.
As at 1 February 2021, we assess that the cluster 5 variant is no longer circulating among humans in Denmark.
- ^ «New COVID-19 Variants». U.S. Centers for Disease Control and Prevention (CDC). 28 June 2021 [First published 11 February 2020]. Retrieved 15 July 2021.
- ^ «COVID-19 Weekly Epidemiological Update Edition 69». World Health Organization (WHO). 7 December 2021.
- ^ «Classification of Omicron (B.1.1.529): SARS-CoV-2 Variant of Concern». World Health Organization (WHO). Retrieved 9 December 2021.
- ^ Harrison AG, Lin T, Wang P (December 2020). «Mechanisms of SARS-CoV-2 Transmission and Pathogenesis». Trends in Immunology. 41 (12): 1100–1115. doi:10.1016/j.it.2020.10.004. PMC 7556779. PMID 33132005.
- ^ Verdecchia P, Cavallini C, Spanevello A, Angeli F (June 2020). «The pivotal link between ACE2 deficiency and SARS-CoV-2 infection». European Journal of Internal Medicine. 76: 14–20. doi:10.1016/j.ejim.2020.04.037. PMC 7167588. PMID 32336612.
- ^ Letko M, Marzi A, Munster V (April 2020). «Functional assessment of cell entry and receptor usage for SARS-CoV-2 and other lineage B betacoronaviruses». Nature Microbiology. 5 (4): 562–569. doi:10.1038/s41564-020-0688-y. PMC 7095430. PMID 32094589.
- ^ Marik PE, Iglesias J, Varon J, Kory P (January 2021). «A scoping review of the pathophysiology of COVID-19». International Journal of Immunopathology and Pharmacology. 35: 20587384211048026. doi:10.1177/20587384211048026. PMC 8477699. PMID 34569339.
- ^ a b Meunier N, Briand L, Jacquin-Piques A, Brondel L, Pénicaud L (June 2020). «COVID 19-Induced Smell and Taste Impairments: Putative Impact on Physiology». Frontiers in Physiology. 11: 625110. doi:10.3389/fphys.2020.625110. PMC 7870487. PMID 33574768.
- ^ Guerrero JI, Barragán LA, Martínez JD, Montoya JP, Peña A, Sobrino FE, et al. (June 2021). «Central and peripheral nervous system involvement by COVID-19: a systematic review of the pathophysiology, clinical manifestations, neuropathology, neuroimaging, electrophysiology, and cerebrospinal fluid findings». BMC Infectious Diseases. 21 (1): 515. doi:10.1186/s12879-021-06185-6. PMC 8170436. PMID 34078305.
- ^ a b Pezzini A, Padovani A (November 2020). «Lifting the mask on neurological manifestations of COVID-19». Nature Reviews. Neurology. 16 (11): 636–644. doi:10.1038/s41582-020-0398-3. PMC 7444680. PMID 32839585.
- ^ Li YC, Bai WZ, Hashikawa T (June 2020). «The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients». Journal of Medical Virology. 92 (6): 552–555. doi:10.1002/jmv.25728. PMC 7228394. PMID 32104915.
- ^ Baig AM, Khaleeq A, Ali U, Syeda H (April 2020). «Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host-Virus Interaction, and Proposed Neurotropic Mechanisms». ACS Chemical Neuroscience. 11 (7): 995–998. doi:10.1021/acschemneuro.0c00122. PMC 7094171. PMID 32167747.
- ^ Yavarpour-Bali H, Ghasemi-Kasman M (September 2020). «Update on neurological manifestations of COVID-19». Life Sciences. 257: 118063. doi:10.1016/j.lfs.2020.118063. PMC 7346808. PMID 32652139.
- ^ Covid can shrink brain and damage its tissue, finds research The Guardian
- ^ Scans reveal how Covid may change the brain BBC
- ^ «Even mild Covid is linked to brain damage months after illness, scans show». NBC News.
- ^ Gu J, Han B, Wang J (May 2020). «COVID-19: Gastrointestinal Manifestations and Potential Fecal-Oral Transmission». Gastroenterology. 158 (6): 1518–1519. doi:10.1053/j.gastro.2020.02.054. PMC 7130192. PMID 32142785.
- ^ Mönkemüller K, Fry L, Rickes S (May 2020). «COVID-19, coronavirus, SARS-CoV-2 and the small bowel». Revista Espanola de Enfermedades Digestivas. 112 (5): 383–388. doi:10.17235/reed.2020.7137/2020. PMID 32343593. S2CID 216645754.
- ^ Almamlouk R, Kashour T, Obeidat S, Bois MC, Maleszewski JJ, Omrani OA, et al. (August 2022). «COVID-19-Associated cardiac pathology at the postmortem evaluation: a collaborative systematic review». Clinical Microbiology and Infection. 28 (8): 1066–1075. doi:10.1016/j.cmi.2022.03.021. PMC 8941843. PMID 35339672.
- ^ a b c Zheng YY, Ma YT, Zhang JY, Xie X (May 2020). «COVID-19 and the cardiovascular system». Nature Reviews. Cardiology. 17 (5): 259–260. doi:10.1038/s41569-020-0360-5. PMC 7095524. PMID 32139904.
- ^ a b c Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. (February 2020). «Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China». Lancet. 395 (10223): 497–506. doi:10.1016/S0140-6736(20)30183-5. PMC 7159299. PMID 31986264.
- ^ «Coronavirus disease 2019 (COVID-19): Myocardial infarction and other coronary artery disease issues». UpToDate. Retrieved 28 September 2020.
- ^ Turner AJ, Hiscox JA, Hooper NM (June 2004). «ACE2: from vasopeptidase to SARS virus receptor». Trends in Pharmacological Sciences. 25 (6): 291–4. doi:10.1016/j.tips.2004.04.001. PMC 7119032. PMID 15165741.
- ^ Abou-Ismail MY, Diamond A, Kapoor S, Arafah Y, Nayak L (October 2020). «The hypercoagulable state in COVID-19: Incidence, pathophysiology, and management». Thrombosis Research. Elsevier BV. 194: 101–115. doi:10.1016/j.thromres.2020.06.029. PMC 7305763. PMID 32788101.
- ^ a b c Wadman M (April 2020). «How does coronavirus kill? Clinicians trace a ferocious rampage through the body, from brain to toes». Science. doi:10.1126/science.abc3208.
- ^ «NIH study uncovers blood vessel damage and inflammation in COVID-19 patients’ brains but no infection». National Institutes of Health (NIH). 30 December 2020. Retrieved 17 January 2021.
- ^ Lee MH, Perl DP, Nair G, Li W, Maric D, Murray H, et al. (February 2021). «Microvascular Injury in the Brains of Patients with Covid-19». The New England Journal of Medicine. 384 (5): 481–483. doi:10.1056/nejmc2033369. PMC 7787217. PMID 33378608.
- ^ Kubánková M, Hohberger B, Hoffmanns J, Fürst J, Herrmann M, Guck J, Kräter M (July 2021). «Physical phenotype of blood cells is altered in COVID-19». Biophysical Journal. 120 (14): 2838–2847. Bibcode:2021BpJ…120.2838K. doi:10.1016/j.bpj.2021.05.025. PMC 8169220. PMID 34087216.
- ^ Gupta A, Madhavan MV, Sehgal K, Nair N, Mahajan S, Sehrawat TS, et al. (July 2020). «Extrapulmonary manifestations of COVID-19». Nature Medicine. 26 (7): 1017–1032. doi:10.1038/s41591-020-0968-3. PMID 32651579. S2CID 220462000.
- ^ «Coronavirus: Kidney Damage Caused by COVID-19». Johns Hopkins Medicine. 14 May 2020. Retrieved 25 January 2022.
- ^ a b c d e f g h Eketunde AO, Mellacheruvu SP, Oreoluwa P (July 2020). «A Review of Postmortem Findings in Patients With COVID-19». Cureus. Cureus, Inc. 12 (7): e9438. doi:10.7759/cureus.9438. PMC 7451084. PMID 32864262. S2CID 221352704.
- ^ Ziegler, CGK; Allon, SJ; Nyquist, SK; Mbano, IM; Miao, VN; Tzouanas, CN; Cao, Y; Yousif, AS; Bals, J; Hauser, BM; Feldman, J; Muus, C; Wadsworth MH, 2nd; Kazer, SW; Hughes, TK; Doran, B; Gatter, GJ; Vukovic, M; Taliaferro, F; Mead, BE; Guo, Z; Wang, JP; Gras, D; Plaisant, M; Ansari, M; Angelidis, I; Adler, H; Sucre, JMS; Taylor, CJ; Lin, B; Waghray, A; Mitsialis, V; Dwyer, DF; Buchheit, KM; Boyce, JA; Barrett, NA; Laidlaw, TM; Carroll, SL; Colonna, L; Tkachev, V; Peterson, CW; Yu, A; Zheng, HB; Gideon, HP; Winchell, CG; Lin, PL; Bingle, CD; Snapper, SB; Kropski, JA; Theis, FJ; Schiller, HB; Zaragosi, LE; Barbry, P; Leslie, A; Kiem, HP; Flynn, JL; Fortune, SM; Berger, B; Finberg, RW; Kean, LS; Garber, M; Schmidt, AG; Lingwood, D; Shalek, AK; Ordovas-Montanes, J; HCA Lung Biological Network. Electronic address, lung-network@humancellatlas.org.; HCA Lung Biological, Network. (28 May 2020). «SARS-CoV-2 Receptor ACE2 Is an Interferon-Stimulated Gene in Human Airway Epithelial Cells and Is Detected in Specific Cell Subsets across Tissues». Cell. 181 (5): 1016–1035.e19. doi:10.1016/j.cell.2020.04.035. PMC 7252096. PMID 32413319.
- ^ Sajuthi, SP; DeFord, P; Li, Y; Jackson, ND; Montgomery, MT; Everman, JL; Rios, CL; Pruesse, E; Nolin, JD; Plender, EG; Wechsler, ME; Mak, ACY; Eng, C; Salazar, S; Medina, V; Wohlford, EM; Huntsman, S; Nickerson, DA; Germer, S; Zody, MC; Abecasis, G; Kang, HM; Rice, KM; Kumar, R; Oh, S; Rodriguez-Santana, J; Burchard, EG; Seibold, MA (12 October 2020). «Type 2 and interferon inflammation regulate SARS-CoV-2 entry factor expression in the airway epithelium». Nature Communications. 11 (1): 5139. Bibcode:2020NatCo..11.5139S. doi:10.1038/s41467-020-18781-2. PMC 7550582. PMID 33046696.
- ^
- ^ Zhang C, Wu Z, Li JW, Zhao H, Wang GQ (May 2020). «Cytokine release syndrome in severe COVID-19: interleukin-6 receptor antagonist tocilizumab may be the key to reduce mortality». International Journal of Antimicrobial Agents. 55 (5): 105954. doi:10.1016/j.ijantimicag.2020.105954. PMC 7118634. PMID 32234467.
- ^ Gómez-Rial J, Rivero-Calle I, Salas A, Martinón-Torres F (2020). «Role of Monocytes/Macrophages in Covid-19 Pathogenesis: Implications for Therapy». Infection and Drug Resistance. 13: 2485–2493. doi:10.2147/IDR.S258639. PMC 7383015. PMID 32801787.
- ^ Dai L, Gao GF (February 2021). «Viral targets for vaccines against COVID-19». Nature Reviews. Immunology. 21 (2): 73–82. doi:10.1038/s41577-020-00480-0. ISSN 1474-1733. PMC 7747004. PMID 33340022.
- ^ a b Boopathi S, Poma AB, Kolandaivel P (April 2020). «Novel 2019 coronavirus structure, mechanism of action, antiviral drug promises and rule out against its treatment». Journal of Biomolecular Structure & Dynamics. 39 (9): 3409–3418. doi:10.1080/07391102.2020.1758788. PMC 7196923. PMID 32306836.
- ^ Kai H, Kai M (July 2020). «Interactions of coronaviruses with ACE2, angiotensin II, and RAS inhibitors-lessons from available evidence and insights into COVID-19». Hypertension Research. 43 (7): 648–654. doi:10.1038/s41440-020-0455-8. PMC 7184165. PMID 32341442.
- ^ Chen HX, Chen ZH, Shen HH (October 2020). «[Structure of SARS-CoV-2 and treatment of COVID-19]». Sheng Li Xue Bao. 72 (5): 617–630. PMID 33106832.
- ^ Jeyanathan M, Afkhami S, Smaill F, Miller MS, Lichty BD, Xing Z (4 September 2020). «Immunological considerations for COVID-19 vaccine strategies». Nature Reviews Immunology. 20 (10): 615–632. doi:10.1038/s41577-020-00434-6. ISSN 1474-1741. PMC 7472682. PMID 32887954.
- ^ Zhang Q, Ju B, Ge J, Chan JF, Cheng L, Wang R, et al. (July 2021). «Potent and protective IGHV3-53/3-66 public antibodies and their shared escape mutant on the spike of SARS-CoV-2». Nature Communications. 12 (1): 4210. Bibcode:2021NatCo..12.4210Z. doi:10.1038/s41467-021-24514-w. PMC 8270942. PMID 34244522. S2CID 235786394.
- ^ Soy M, Keser G, Atagündüz P, Tabak F, Atagündüz I, Kayhan S (July 2020). «Cytokine storm in COVID-19: pathogenesis and overview of anti-inflammatory agents used in treatment». Clinical Rheumatology. 39 (7): 2085–2094. doi:10.1007/s10067-020-05190-5. PMC 7260446. PMID 32474885.
- ^ Quirch M, Lee J, Rehman S (August 2020). «Hazards of the Cytokine Storm and Cytokine-Targeted Therapy in Patients With COVID-19: Review». Journal of Medical Internet Research. 22 (8): e20193. doi:10.2196/20193. PMC 7428145. PMID 32707537.
- ^ Bhaskar S, Sinha A, Banach M, Mittoo S, Weissert R, Kass JS, et al. (2020). «Cytokine Storm in COVID-19-Immunopathological Mechanisms, Clinical Considerations, and Therapeutic Approaches: The REPROGRAM Consortium Position Paper». Frontiers in Immunology. 11: 1648. doi:10.3389/fimmu.2020.01648. PMC 7365905. PMID 32754159.
- ^ a b c d e f Wastnedge EA, Reynolds RM, van Boeckel SR, Stock SJ, Denison FC, Maybin JA, Critchley HO (January 2021). «Pregnancy and COVID-19». Physiological Reviews. 101 (1): 303–318. doi:10.1152/physrev.00024.2020. PMC 7686875. PMID 32969772.
- ^ Campbell D (10 October 2021). «One in six most critically ill NHS Covid patients are unvaccinated pregnant women». The Guardian. Retrieved 25 January 2022.
- ^ a b Ai T, Yang Z, Hou H, Zhan C, Chen C, Lv W, et al. (August 2020). «Correlation of Chest CT and RT-PCR Testing for Coronavirus Disease 2019 (COVID-19) in China: A Report of 1014 Cases». Radiology. 296 (2): E32–E40. doi:10.1148/radiol.2020200642. PMC 7233399. PMID 32101510.
- ^ a b c d Salehi S, Abedi A, Balakrishnan S, Gholamrezanezhad A (July 2020). «Coronavirus Disease 2019 (COVID-19): A Systematic Review of Imaging Findings in 919 Patients». AJR. American Journal of Roentgenology. 215 (1): 87–93. doi:10.2214/AJR.20.23034. PMID 32174129.
- ^ «2019 Novel Coronavirus (2019-nCoV) Situation Summary». U.S. Centers for Disease Control and Prevention (CDC). 30 January 2020. Archived from the original on 26 January 2020. Retrieved 30 January 2020.
- ^ «Coronavirus disease (COVID-19) technical guidance: Laboratory testing for 2019-nCoV in humans». World Health Organization (WHO). Archived from the original on 15 March 2020. Retrieved 14 March 2020.
- ^ Bullard J, Dust K, Funk D, Strong JE, Alexander D, Garnett L, et al. (December 2020). «Predicting Infectious Severe Acute Respiratory Syndrome Coronavirus 2 From Diagnostic Samples». Clinical Infectious Diseases. 71 (10): 2663–2666. doi:10.1093/cid/ciaa638. PMC 7314198. PMID 32442256.
- ^ «Interim Guidelines for Collecting, Handling, and Testing Clinical Specimens from Persons for Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Archived from the original on 4 March 2020. Retrieved 26 March 2020.
- ^ «Real-Time RT-PCR Panel for Detection 2019-nCoV». U.S. Centers for Disease Control and Prevention (CDC). 29 January 2020. Archived from the original on 30 January 2020. Retrieved 1 February 2020.
- ^ «Laboratory testing for 2019 novel coronavirus (2019-nCoV) in suspected human cases». World Health Organization (WHO). Archived from the original on 17 March 2020. Retrieved 13 March 2020.
- ^ «NHS staff will be first to get new coronavirus antibody test, medical chief promises». The Independent. 14 May 2020. Retrieved 14 May 2020.
- ^ Heneghan C, Jefferson T (1 September 2020). «Virological characterization of COVID-19 patients that test re-positive for SARS-CoV-2 by RT-PCR». CEBM. Retrieved 19 September 2020.
- ^ Lu J, Peng J, Xiong Q, Liu Z, Lin H, Tan X, et al. (September 2020). «Clinical, immunological and virological characterization of COVID-19 patients that test re-positive for SARS-CoV-2 by RT-PCR». EBioMedicine. 59: 102960. doi:10.1016/j.ebiom.2020.102960. PMC 7444471. PMID 32853988.
- ^ Spencer E, Jefferson T, Brassey J, Heneghan C (11 September 2020). «When is Covid, Covid?». The Centre for Evidence-Based Medicine. Retrieved 19 September 2020.
- ^ «SARS-CoV-2 RNA testing: assurance of positive results during periods of low prevalence». GOV.UK. Retrieved 19 September 2020.
- ^ «ACR Recommendations for the use of Chest Radiography and Computed Tomography (CT) for Suspected COVID-19 Infection». American College of Radiology. 22 March 2020. Archived from the original on 28 March 2020.
- ^ Pormohammad A, Ghorbani S, Khatami A, Razizadeh MH, Alborzi E, Zarei M, et al. (October 2020). «Comparison of influenza type A and B with COVID-19: A global systematic review and meta-analysis on clinical, laboratory and radiographic findings». Reviews in Medical Virology. 31 (3): e2179. doi:10.1002/rmv.2179. PMC 7646051. PMID 33035373. S2CID 222255245.
- ^ Lee EY, Ng MY, Khong PL (April 2020). «COVID-19 pneumonia: what has CT taught us?». The Lancet. Infectious Diseases. 20 (4): 384–385. doi:10.1016/S1473-3099(20)30134-1. PMC 7128449. PMID 32105641.
- ^ a b Li Y, Xia L (June 2020). «Coronavirus Disease 2019 (COVID-19): Role of Chest CT in Diagnosis and Management». AJR. American Journal of Roentgenology. 214 (6): 1280–1286. doi:10.2214/AJR.20.22954. PMID 32130038. S2CID 212416282.
- ^ «COVID-19 Database». Società Italiana di Radiologia Medica e Interventistica (in Italian). Retrieved 11 March 2020.
- ^ «ICD-10 Version:2019». World Health Organization (WHO). 2019. Archived from the original on 31 March 2020. Retrieved 31 March 2020.
U07.2 – COVID-19, virus not identified – COVID-19 NOS – Use this code when COVID-19 is diagnosed clinically or epidemiologically but laboratory testing is inconclusive or not available. Use additional code, if desired, to identify pneumonia or other manifestations
- ^ Giani M, Seminati D, Lucchini A, Foti G, Pagni F (May 2020). «Exuberant Plasmocytosis in Bronchoalveolar Lavage Specimen of the First Patient Requiring Extracorporeal Membrane Oxygenation for SARS-CoV-2 in Europe». Journal of Thoracic Oncology. 15 (5): e65–e66. doi:10.1016/j.jtho.2020.03.008. PMC 7118681. PMID 32194247.
- ^ Lillicrap D (April 2020). «Disseminated intravascular coagulation in patients with 2019-nCoV pneumonia». Journal of Thrombosis and Haemostasis. 18 (4): 786–787. doi:10.1111/jth.14781. PMC 7166410. PMID 32212240.
- ^ Mitra A, Dwyre DM, Schivo M, Thompson GR, Cohen SH, Ku N, Graff JP (August 2020). «Leukoerythroblastic reaction in a patient with COVID-19 infection». American Journal of Hematology. 95 (8): 999–1000. doi:10.1002/ajh.25793. PMC 7228283. PMID 32212392.
- ^ a b c d e f Satturwar S, Fowkes M, Farver C, Wilson AM, Eccher A, Girolami I, et al. (May 2021). «Postmortem Findings Associated With SARS-CoV-2: Systematic Review and Meta-analysis». The American Journal of Surgical Pathology. 45 (5): 587–603. doi:10.1097/PAS.0000000000001650. PMC 8132567. PMID 33481385. S2CID 231679276.
- ^ Maier BF, Brockmann D (May 2020). «Effective containment explains subexponential growth in recent confirmed COVID-19 cases in China». Science. 368 (6492): 742–746. arXiv:2002.07572. Bibcode:2020Sci…368..742M. doi:10.1126/science.abb4557. PMC 7164388. PMID 32269067. («… initial exponential growth expected for an unconstrained outbreak.»)
- ^ «Viral Load Exposure Factors». ReallyCorrect.com.
- ^ «Recommendation Regarding the Use of Cloth Face Coverings, Especially in Areas of Significant Community-Based Transmission». U.S. Centers for Disease Control and Prevention (CDC). 28 June 2020.
- ^ «Scientific Brief: SARS-CoV-2 and Potential Airborne Transmission». COVID-19 Published Science and Research. U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 30 October 2020.
- ^ Centers for Disease Control and Prevention (5 April 2020). «What to Do if You Are Sick». U.S. Centers for Disease Control and Prevention (CDC). Archived from the original on 14 February 2020. Retrieved 24 April 2020.
- ^ «Coronavirus Disease 2019 (COVID-19) – Prevention & Treatment». U.S. Centers for Disease Control and Prevention (CDC). 10 March 2020. Archived from the original on 11 March 2020. Retrieved 11 March 2020.
- ^ «UK medicines regulator gives approval for first UK COVID-19 vaccine». Medicines and Healthcare Products Regulatory Agency, Government of the UK. 2 December 2020. Retrieved 2 December 2020.
- ^ Mueller B (2 December 2020). «U.K. Approves Pfizer Coronavirus Vaccine, a First in the West». The New York Times. Archived from the original on 2 December 2020. Retrieved 2 December 2020.
- ^ «COVID-19 Treatment Guidelines». nih.gov. National Institutes of Health. Retrieved 21 April 2020.
- ^ a b c Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB (May 2020). «Pharmacologic Treatments for Coronavirus Disease 2019 (COVID-19): A Review». JAMA. 323 (18): 1824–1836. doi:10.1001/jama.2020.6019. PMID 32282022.
- ^ a b Anderson RM, Heesterbeek H, Klinkenberg D, Hollingsworth TD (March 2020). «How will country-based mitigation measures influence the course of the COVID-19 epidemic?». Lancet. 395 (10228): 931–934. doi:10.1016/S0140-6736(20)30567-5. PMC 7158572. PMID 32164834.
A key issue for epidemiologists is helping policy makers decide the main objectives of mitigation – e.g. minimising morbidity and associated mortality, avoiding an epidemic peak that overwhelms health-care services, keeping the effects on the economy within manageable levels, and flattening the epidemic curve to wait for vaccine development and manufacture on scale and antiviral drug therapies.
- ^ Wiles S (14 March 2020). «After ‘Flatten the Curve’, we must now ‘Stop the Spread’. Here’s what that means». The Spinoff. Archived from the original on 26 March 2020. Retrieved 13 March 2020.
- ^ Li YD, Chi WY, Su JH, Ferrall L, Hung CF, Wu TC (December 2020). «Coronavirus vaccine development: from SARS and MERS to COVID-19». Journal of Biomedical Science. 27 (1): 104. doi:10.1186/s12929-020-00695-2. PMC 7749790. PMID 33341119.
- ^ Subbarao K (July 2021). «The success of SARS-CoV-2 vaccines and challenges ahead». Cell Host & Microbe. 29 (7): 1111–1123. doi:10.1016/j.chom.2021.06.016. PMC 8279572. PMID 34265245.
- ^ Padilla TB (24 February 2021). «No one is safe unless everyone is safe». BusinessWorld. Archived from the original on 23 February 2021. Retrieved 24 February 2021.
- ^ a b c Rogers K (11 May 2022). «COVID-19 vaccine». Encyclopædia Britannica. Archived from the original on 12 June 2022. Retrieved 12 June 2022.
- ^ «Swissmedic grants authorisation for the first COVID-19 vaccine in Switzerland» (Press release). Swiss Agency for Therapeutic Products (Swissmedic). 18 December 2020. Archived from the original on 2 May 2021. Retrieved 5 July 2022.
- ^ «EMA recommends first COVID-19 vaccine for authorisation in the EU». European Medicines Agency (EMA) (Press release). 21 December 2020. Archived from the original on 30 January 2021. Retrieved 21 December 2020.
- ^ «Wear masks in public says WHO, in update of COVID-19 advice». Reuters. 5 June 2020. Retrieved 3 July 2020.
- ^ a b c «Recommendation Regarding the Use of Cloth Face Coverings, Especially in Areas of Significant Community-Based Transmission». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 17 April 2020.
- ^ a b «Using face masks in the community – Technical Report» (PDF). ECDC. 8 April 2020.
- ^ «Scientific Brief: Community Use of Cloth Masks to Control the Spread of SARS-CoV-2». U.S. Centers for Disease Control and Prevention (CDC). 10 November 2020.
- ^ Greenhalgh T, Schmid MB, Czypionka T, Bassler D, Gruer L (April 2020). «Face masks for the public during the covid-19 crisis». BMJ. 369: m1435. doi:10.1136/bmj.m1435. PMID 32273267. S2CID 215516381.
- ^ «Caring for Someone Sick at Home». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 3 July 2020.
- ^ «Using Personal Protective Equipment (PPE)». U.S. Centers for Disease Control and Prevention (CDC). 11 June 2020. Retrieved 4 July 2020.
- ^ a b c CDC (11 February 2020). «Scientific Brief: SARS-CoV-2 Transmission». U.S. Centers for Disease Control and Prevention (CDC). Retrieved 10 May 2021.
- ^ «Transmission of COVID-19». European Centre for Disease Prevention and Control. 7 September 2020. Retrieved 14 October 2020.
- ^ a b National Center for Immunization and Respiratory Diseases (NCIRD) (9 July 2020). «COVID-19 Employer Information for Office Buildings». U.S. Centers for Disease Control and Prevention (CDC). Retrieved 9 July 2020.
- ^ WHO’s Science in 5 on COVID-19 — Ventilation — 30 October 2020. World Health Organization (WHO). 30 October 2020. Archived from the original on 25 October 2022. Retrieved 8 December 2022 – via YouTube.
- ^ Somsen GA, van Rijn C, Kooij S, Bem RA, Bonn D (July 2020). «Small droplet aerosols in poorly ventilated spaces and SARS-CoV-2 transmission». The Lancet. Respiratory Medicine. Elsesier. 8 (7): 658–659. doi:10.1016/S2213-2600(20)30245-9. PMC 7255254. PMID 32473123.
- ^ Lipinski T, Ahmad D, Serey N, Jouhara H (1 November 2020). «Review of ventilation strategies to reduce the risk of disease transmission in high occupancy buildings». International Journal of Thermofluids. 7–8: 100045. doi:10.1016/j.ijft.2020.100045. ISSN 2666-2027. S2CID 221642242.
- ^ «Social distancing: what you need to do – Coronavirus (COVID-19)». nhs.uk. 2 June 2020. Retrieved 18 August 2020.
- ^ «Advice for the public on COVID-19 – World Health Organization». World Health Organization (WHO). Retrieved 18 August 2020.
- ^ «COVID-19 and Your Health». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 23 March 2021.
To prevent the spread of germs, including COVID-19, CDC recommends washing hands with soap and water whenever possible because it reduces the amount of many types of germs and chemicals on hands. But if soap and water are not readily available, using a hand sanitizer with at least 60% alcohol can help you avoid getting sick and spreading germs to others.
- ^ «WHO-recommended handrub formulations». WHO Guidelines on Hand Hygiene in Health Care: First Global Patient Safety Challenge Clean Care Is Safer Care. World Health Organization (WHO). 19 March 2009. Retrieved 19 March 2020.
- ^ Nussbaumer-Streit B, Mayr V, Dobrescu AI, Chapman A, Persad E, Klerings I, et al. (September 2020). «Quarantine alone or in combination with other public health measures to control COVID-19: a rapid review». The Cochrane Database of Systematic Reviews. 2020 (9): CD013574. doi:10.1002/14651858.CD013574.pub2. ISSN 1469-493X. PMC 8133397. PMID 33959956.
- ^ Qian M, Jiang J (May 2020). «COVID-19 and social distancing». Zeitschrift für Gesundheitswissenschaften = Journal of Public Health. 30 (1): 259–261. doi:10.1007/s10389-020-01321-z. PMC 7247774. PMID 32837835.
- ^ a b Hawks L, Woolhandler S, McCormick D (August 2020). «COVID-19 in Prisons and Jails in the United States». JAMA Internal Medicine. 180 (8): 1041–1042. doi:10.1001/jamainternmed.2020.1856. PMID 32343355.
- ^ Waldstein D (6 May 2020). «To Fight Virus in Prisons, C.D.C. Suggests More Screenings». The New York Times. Archived from the original on 7 May 2020. Retrieved 14 May 2020.
- ^ «How COVID-19 Spreads». U.S. Centers for Disease Control and Prevention (CDC). 18 September 2020. Archived from the original on 19 September 2020. Retrieved 20 September 2020.
- ^ Goldman E (August 2020). «Exaggerated risk of transmission of COVID-19 by fomites». The Lancet. Infectious Diseases. 20 (8): 892–893. doi:10.1016/S1473-3099(20)30561-2. PMC 7333993. PMID 32628907.
- ^ Weixel N (5 April 2021). «CDC says risk of COVID-19 transmission on surfaces 1 in 10,000». The Hill. Retrieved 19 December 2021.
- ^ a b «Science Brief: SARS-CoV-2 and Surface (Fomite) Transmission for Indoor Community Environments». U.S. Centers for Disease Control and Prevention (CDC). 5 April 2021. Archived from the original on 5 April 2021.
- ^ a b Pedreira A, Taşkın Y, García MR (January 2021). «A Critical Review of Disinfection Processes to Control SARS-CoV-2 Transmission in the Food Industry». Foods. 10 (2): 283. doi:10.3390/foods10020283. PMC 7911259. PMID 33572531. S2CID 231900820.
- ^ Rezasoltani S, Yadegar A, Hatami B, Asadzadeh Aghdaei H, Zali MR (2020). «Antimicrobial Resistance as a Hidden Menace Lurking Behind the COVID-19 Outbreak: The Global Impacts of Too Much Hygiene on AMR». Frontiers in Microbiology. 11: 590683. doi:10.3389/fmicb.2020.590683. PMC 7769770. PMID 33384670.
- ^ Thompson D (8 February 2021). «Hygiene Theater Is Still a Huge Waste of Time». The Atlantic. Retrieved 27 February 2021.
- ^ Thompson D (27 July 2020). «Hygiene Theater Is a Huge Waste of Time». The Atlantic. Retrieved 27 February 2021.
- ^ a b c d e f g Bueckert M, Gupta R, Gupta A, Garg M, Mazumder A (November 2020). «Infectivity of SARS-CoV-2 and Other Coronaviruses on Dry Surfaces: Potential for Indirect Transmission». Materials. 13 (22): 5211. Bibcode:2020Mate…13.5211B. doi:10.3390/ma13225211. PMC 7698891. PMID 33218120.
- ^ Bhardwaj R, Agrawal A (November 2020). «How coronavirus survives for days on surfaces». Physics of Fluids. 32 (11): 111706. Bibcode:2020PhFl…32k1706B. doi:10.1063/5.0033306. PMC 7713872. PMID 33281435.
- ^ Chatterjee S, Murallidharan JS, Agrawal A, Bhardwaj R (February 2021). «Why coronavirus survives longer on impermeable than porous surfaces». Physics of Fluids. 33 (2): 021701. Bibcode:2021PhFl…33b1701C. doi:10.1063/5.0037924. PMC 7978145. PMID 33746485.
- ^ CDC (11 February 2020). «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). Retrieved 12 April 2021.
- ^ Anthes E (8 April 2021). «Has the Era of Overzealous Cleaning Finally Come to an End?». The New York Times. Archived from the original on 28 December 2021. Retrieved 12 April 2021.
- ^ «Interim Recommendations for US Community Facilities with Suspected/Confirmed Coronavirus Disease 2019». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 4 April 2020.
- ^ «Yes, UV phone sanitizers work. That doesn’t mean you need one». The Washington Post. 16 February 2021. Retrieved 29 April 2022.
- ^ Patiño-Lugo DF, Vélez M, Velásquez Salazar P, Vera-Giraldo CY, Vélez V, Marín IC, et al. (June 2020). «Non-pharmaceutical interventions for containment, mitigation and suppression of COVID-19 infection». Colombia Medica. 51 (2): e4266. doi:10.25100/cm.v51i2.4266. PMC 7518730. PMID 33012884.
- ^ «COVID-19 Informational Resources for High-Risk Groups | Keeping Education ACTIVE | Partnership to Fight Chronic Disease». fightchronicdisease.org. Retrieved 31 May 2020.
- ^ «Quarantine and Isolation». U.S. Centers for Disease Control and Prevention (CDC). 29 July 2021. Retrieved 12 August 2021.
- ^ a b c Burns J, Movsisyan A, Stratil JM, Biallas RL, Coenen M, Emmert-Fees KM, et al. (Cochrane Public Health Group) (March 2021). «International travel-related control measures to contain the COVID-19 pandemic: a rapid review». The Cochrane Database of Systematic Reviews. 2021 (3): CD013717. doi:10.1002/14651858.CD013717.pub2. PMC 8406796. PMID 33763851. S2CID 232356197.
- ^ «COVID Treatment Guidelines: Clinical Management Summary». NIH Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. 8 April 2022. Archived from the original on 5 November 2021. Retrieved 19 April 2022.
- ^ Wise, Jeff (17 April 2022). «What Happened to Paxlovid, the COVID Wonder Drug?». Intelligencer. Archived from the original on 19 April 2022. Retrieved 19 April 2022.
- ^ Tao K, Tzou PL, Nouhin J, Bonilla H, Jagannathan P, Shafer RW (July 2021). «SARS-CoV-2 Antiviral Therapy». Clinical Microbiology Reviews. 34 (4): e0010921. doi:10.1128/CMR.00109-21. PMC 8404831. PMID 34319150. S2CID 236472654.
- ^ Fisher D, Heymann D (February 2020). «Q&A: The novel coronavirus outbreak causing COVID-19». BMC Medicine. 18 (1): 57. doi:10.1186/s12916-020-01533-w. PMC 7047369. PMID 32106852.
- ^ Liu K, Fang YY, Deng Y, Liu W, Wang MF, Ma JP, et al. (May 2020). «Clinical characteristics of novel coronavirus cases in tertiary hospitals in Hubei Province». Chinese Medical Journal. 133 (9): 1025–1031. doi:10.1097/CM9.0000000000000744. PMC 7147277. PMID 32044814.
- ^ Wang T, Du Z, Zhu F, Cao Z, An Y, Gao Y, Jiang B (March 2020). «Comorbidities and multi-organ injuries in the treatment of COVID-19». Lancet. Elsevier BV. 395 (10228): e52. doi:10.1016/s0140-6736(20)30558-4. PMC 7270177. PMID 32171074.
- ^ Wang Y, Wang Y, Chen Y, Qin Q (March 2020). «Unique epidemiological and clinical features of the emerging 2019 novel coronavirus pneumonia (COVID-19) implicate special control measures». Journal of Medical Virology. 92 (6): 568–576. doi:10.1002/jmv.25748. PMC 7228347. PMID 32134116.
- ^ «Coronavirus». WebMD. Archived from the original on 1 February 2020. Retrieved 1 February 2020.
- ^ Martel J, Ko YF, Young JD, Ojcius DM (May 2020). «Could nasal breathing help to mitigate the severity of COVID-19». Microbes and Infection. 22 (4–5): 168–171. doi:10.1016/j.micinf.2020.05.002. PMC 7200356. PMID 32387333.
- ^ «Coronavirus recovery: breathing exercises». www.hopkinsmedicine.org. Johns Hopkins Medicine. Archived from the original on 11 October 2020. Retrieved 30 July 2020.
- ^ Wang L, Wang Y, Ye D, Liu Q (March 2020). «Review of the 2019 novel coronavirus (SARS-CoV-2) based on current evidence». International Journal of Antimicrobial Agents. 55 (6): 105948. doi:10.1016/j.ijantimicag.2020.105948. PMC 7156162. PMID 32201353.
- ^ U.S. Centers for Disease Control and Prevention (5 April 2020). «What to Do if You Are Sick». U.S. Centers for Disease Control and Prevention (CDC). Archived from the original on 14 February 2020. Retrieved 24 April 2020.
- ^ «Update to living WHO guideline on drugs for covid-19». BMJ (Clinical Research Ed.). 371: m4475. November 2020. doi:10.1136/bmj.m4475. ISSN 1756-1833. PMID 33214213. S2CID 227059995.
- ^ «Q&A: Dexamethasone and COVID-19». World Health Organization (WHO). Archived from the original on 11 October 2020. Retrieved 11 July 2020.
- ^ «Home». National COVID-19 Clinical Evidence Taskforce. Archived from the original on 11 October 2020. Retrieved 11 July 2020.
- ^ Motseki, Thabiso Patrick (7 June 2022). «COVID-19 Vaccination Guidelines». www.nih.gov. National Institutes of Health. Archived from the original on 19 January 2021. Retrieved 18 January 2021.
- ^ Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. (April 2020). «Clinical Characteristics of Coronavirus Disease 2019 in China». The New England Journal of Medicine. Massachusetts Medical Society. 382 (18): 1708–1720. doi:10.1056/nejmoa2002032. PMC 7092819. PMID 32109013.
- ^ Henry BM (April 2020). «COVID-19, ECMO, and lymphopenia: a word of caution». The Lancet. Respiratory Medicine. Elsevier BV. 8 (4): e24. doi:10.1016/s2213-2600(20)30119-3. PMC 7118650. PMID 32178774.
- ^ Kim JS, Lee JY, Yang JW, Lee KH, Effenberger M, Szpirt W, et al. (2021). «Immunopathogenesis and treatment of cytokine storm in COVID-19». Theranostics. 11 (1): 316–329. doi:10.7150/thno.49713. PMC 7681075. PMID 33391477.
- ^ Doshi P (October 2020). «Will covid-19 vaccines save lives? Current trials aren’t designed to tell us». BMJ. 371: m4037. doi:10.1136/bmj.m4037. PMID 33087398. S2CID 224817161.
- ^ a b Palmieri L, Andrianou X, Barbariol P, Bella A, Bellino S, Benelli E, et al. (22 July 2020). Characteristics of SARS-CoV-2 patients dying in Italy Report based on available data on July 22nd, 2020 (PDF) (Report). Istituto Superiore di Sanità. Retrieved 4 October 2020.
- ^ Tzoulis P, Waung JA, Bagkeris E, Hussein Z, Biddanda A, Cousins J, et al. (May 2021). «Dysnatremia is a Predictor for Morbidity and Mortality in Hospitalized Patients with COVID-19». The Journal of Clinical Endocrinology and Metabolism. 106 (6): 1637–1648. doi:10.1210/clinem/dgab107. PMC 7928894. PMID 33624101.
- ^ Tzoulis P, Grossman AB, Baldeweg SE, Bouloux P, Kaltsas G (September 2021). «MANAGEMENT OF ENDOCRINE DISEASE: Dysnatraemia in COVID-19: prevalence, prognostic impact, pathophysiology, and management». European Journal of Endocrinology. 185 (4): R103–R111. doi:10.1530/EJE-21-0281. PMC 8428074. PMID 34370712.
- ^ Baranovskii DS, Klabukov ID, Krasilnikova OA, Nikogosov DA, Polekhina NV, Baranovskaia DR, et al. (December 1975). «Letter: Acid secretion by gastric mucous membrane». The American Journal of Physiology. 229 (6): 21–25. doi:10.1080/03007995.2020.1853510. PMC 7738209. PMID 33210948. S2CID 227065216.
- ^ Christensen B, Favaloro EJ, Lippi G, Van Cott EM (October 2020). «Hematology Laboratory Abnormalities in Patients with Coronavirus Disease 2019 (COVID-19)». Seminars in Thrombosis and Hemostasis. 46 (7): 845–849. doi:10.1055/s-0040-1715458. PMC 7645834. PMID 32877961.
- ^ «Living with Covid19». NIHR Themed Reviews. National Institute for Health Research. 15 October 2020. doi:10.3310/themedreview_41169.
- ^ a b «How long does COVID-19 last?». UK COVID Symptom Study. 6 June 2020. Retrieved 15 October 2020.
- ^ «Summary of COVID-19 Long Term Health Effects: Emerging evidence and Ongoing Investigation» (PDF). University of Washington. 1 September 2020. Archived from the original (PDF) on 18 December 2020. Retrieved 15 October 2020.
- ^ «Long-term symptoms of COVID-19 ‘really concerning’, says WHO chief». UN News. 30 October 2020. Retrieved 7 March 2021.
- ^ «Coronavirus disease 2019 (COVID-19) – Prognosis». BMJ. Retrieved 15 November 2020.
- ^ Lavery AM, Preston LE, Ko JY, Chevinsky JR, DeSisto CL, Pennington AF, et al. (November 2020). «Characteristics of Hospitalized COVID-19 Patients Discharged and Experiencing Same-Hospital Readmission – United States, March–August 2020». MMWR. Morbidity and Mortality Weekly Report. 69 (45): 1695–1699. doi:10.15585/mmwr.mm6945e2. PMC 7660660. PMID 33180754.
- ^ Vardavas CI, Nikitara K (March 2020). «COVID-19 and smoking: A systematic review of the evidence». Tobacco Induced Diseases. 18: 20. doi:10.18332/tid/119324. PMC 7083240. PMID 32206052.
- ^ a b c Engin AB, Engin ED, Engin A (August 2020). «Two important controversial risk factors in SARS-CoV-2 infection: Obesity and smoking». Environmental Toxicology and Pharmacology. 78: 103411. doi:10.1016/j.etap.2020.103411. PMC 7227557. PMID 32422280.
- ^ Setti L, Passarini F, De Gennaro G, Barbieri P, Licen S, Perrone MG, et al. (September 2020). «Potential role of particulate matter in the spreading of COVID-19 in Northern Italy: first observational study based on initial epidemic diffusion». BMJ Open. 10 (9): e039338. doi:10.1136/bmjopen-2020-039338. PMC 7517216. PMID 32973066.
- ^ Wu X, Nethery RC, Sabath MB, Braun D, Dominici F (November 2020). «Air pollution and COVID-19 mortality in the United States: Strengths and limitations of an ecological regression analysis». Science Advances. 6 (45): eabd4049. Bibcode:2020SciA….6.4049W. doi:10.1126/sciadv.abd4049. PMC 7673673. PMID 33148655.
- ^ Pansini R, Fornacca D (June 2021). «Early Spread of COVID-19 in the Air-Polluted Regions of Eight Severely Affected Countries». Atmosphere. 12 (6): 795. Bibcode:2021Atmos..12..795P. doi:10.3390/atmos12060795.
- ^ Comunian S, Dongo D, Milani C, Palestini P (June 2020). «Air Pollution and Covid-19: The Role of Particulate Matter in the Spread and Increase of Covid-19’s Morbidity and Mortality». International Journal of Environmental Research and Public Health. 17 (12): 4487. doi:10.3390/ijerph17124487. PMC 7345938. PMID 32580440.
- ^ Domingo JL, Marquès M, Rovira J (September 2020). «Influence of airborne transmission of SARS-CoV-2 on COVID-19 pandemic. A review». Environmental Research. 188: 109861. Bibcode:2020ER….188j9861D. doi:10.1016/j.envres.2020.109861. PMC 7309850. PMID 32718835.
- ^ «COVID-19: Who’s at higher risk of serious symptoms?». Mayo Clinic.
- ^ Tamara A, Tahapary DL (July 2020). «Obesity as a predictor for a poor prognosis of COVID-19: A systematic review». Diabetes & Metabolic Syndrome. 14 (4): 655–659. doi:10.1016/j.dsx.2020.05.020. PMC 7217103. PMID 32438328.
- ^ Petrakis D, Margină D, Tsarouhas K, Tekos F, Stan M, Nikitovic D, et al. (July 2020). «Obesity – A risk factor for increased COVID-19, severity and lethality (Review)». Molecular Medicine Reports. 22 (1): 9–19. doi:10.3892/mmr.2020.11127. PMC 7248467. PMID 32377709.
- ^ Roca-Fernández A, Dennis A, Nicholls R, McGonigle J, Kelly M, Banerjee R, et al. (29 March 2021). «Hepatic Steatosis, Rather Than Underlying Obesity, Increases the Risk of Infection and Hospitalization for COVID-19». Frontiers in Medicine. 8: 636637. doi:10.3389/fmed.2021.636637. ISSN 2296-858X. PMC 8039134. PMID 33855033.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020.
- ^ Devresse A, Belkhir L, Vo B, Ghaye B, Scohy A, Kabamba B, et al. (November 2020). «COVID-19 Infection in Kidney Transplant Recipients: A Single-Center Case Series of 22 Cases From Belgium». Kidney Medicine. 2 (4): 459–466. doi:10.1016/j.xkme.2020.06.001. PMC 7295531. PMID 32775986.
- ^ Dhindsa S, Champion C, Deol E, Lui M, Campbell R, Newman J, et al. (September 2022). «Association of Male Hypogonadism With Risk of Hospitalization for COVID-19». JAMA Network Open. 5 (9): e2229747. doi:10.1001/jamanetworkopen.2022.29747. PMC 9440397. PMID 36053534.
- ^ Shelton JF, Shastri AJ, Ye C, Weldon CH, Filshtein-Sonmez T, Coker D, et al. (June 2021). «Trans-ancestry analysis reveals genetic and nongenetic associations with COVID-19 susceptibility and severity». Nature Genetics. 53 (6): 801–808. doi:10.1038/s41588-021-00854-7. PMID 33888907. S2CID 233372385.
- ^ Wallis C. «One in Seven Dire COVID Cases May Result from a Faulty Immune Response». Scientific American.
- ^ Bastard P, Rosen LB, Zhang Q, Michailidis E, Hoffmann HH, Zhang Y, et al. (October 2020). «Autoantibodies against type I IFNs in patients with life-threatening COVID-19». Science. 370 (6515): eabd4585. doi:10.1126/science.abd4585. PMC 7857397. PMID 32972996. S2CID 221914095.
- ^ Fusco DN, Brisac C, John SP, Huang YW, Chin CR, Xie T, et al. (June 2013). «A genetic screen identifies interferon-α effector genes required to suppress hepatitis C virus replication». Gastroenterology. 144 (7): 1438–49, 1449.e1-9. doi:10.1053/j.gastro.2013.02.026. PMC 3665646. PMID 23462180.
- ^ Namkoong H, Edahiro R, Takano T, Nishihara H, Shirai Y, Sonehara K, et al. (September 2022). «DOCK2 is involved in the host genetics and biology of severe COVID-19». Nature. 609 (7928): 754–760. Bibcode:2022Natur.609..754N. doi:10.1038/s41586-022-05163-5. PMC 9492544. PMID 35940203.
- ^ Kousathanas A, Pairo-Castineira E, Rawlik K, Stuckey A, Odhams CA, Walker S, et al. (July 2022). «Whole-genome sequencing reveals host factors underlying critical COVID-19». Nature. 607 (7917): 97–103. doi:10.1038/s41586-022-04576-6. PMC 9259496. PMID 35255492.
- ^ «COVID-19 in children and the role of school settings in transmission – first update». European Centre for Disease Prevention and Control. 23 December 2020. Retrieved 6 April 2021.
- ^ «Estimated Disease Burden of COVID-19». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 6 April 2021.
- ^ Reardon S (2 September 2021). «Why don’t kids tend to get as sick from Covid-19?». Knowable Magazine. doi:10.1146/knowable-090121-1. S2CID 239653475. Retrieved 7 September 2021.
- ^ «Information for Pediatric Healthcare Providers». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 6 April 2021.
- ^ Götzinger F, Santiago-García B, Noguera-Julián A, Lanaspa M, Lancella L, Calò Carducci FI, et al. (September 2020). «COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study». The Lancet. Child & Adolescent Health. 4 (9): 653–661. doi:10.1016/S2352-4642(20)30177-2. PMC 7316447. PMID 32593339.
- ^ Fang L, Karakiulakis G, Roth M (April 2020). «Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection?». The Lancet. Respiratory Medicine. 8 (4): e21. doi:10.1016/S0140-6736(20)30311-1. PMC 7118626. PMID 32171062.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Archived from the original on 2 March 2020. Retrieved 2 March 2020.
- ^ Hui DS, I Azhar E, Madani TA, Ntoumi F, Kock R, Dar O, et al. (February 2020). «The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health – The latest 2019 novel coronavirus outbreak in Wuhan, China». International Journal of Infectious Diseases. 91: 264–266. doi:10.1016/j.ijid.2020.01.009. PMC 7128332. PMID 31953166.
- ^ Murthy S, Gomersall CD, Fowler RA (April 2020). «Care for Critically Ill Patients With COVID-19». JAMA. 323 (15): 1499–1500. doi:10.1001/jama.2020.3633. PMID 32159735.
- ^ Cascella M, Rajnik M, Cuomo A, Dulebohn SC, Di Napoli R (2020). «Features, Evaluation and Treatment Coronavirus (COVID-19)». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 32150360. Retrieved 18 March 2020.
- ^ Heymann DL, Shindo N, et al. (WHO Scientific and Technical Advisory Group for Infectious Hazards) (February 2020). «COVID-19: what is next for public health?». Lancet. 395 (10224): 542–545. doi:10.1016/s0140-6736(20)30374-3. PMC 7138015. PMID 32061313.
- ^ Romiti GF, Corica B, Lip GY, Proietti M (June 2021). «Prevalence and Impact of Atrial Fibrillation in Hospitalized Patients with COVID-19: A Systematic Review and Meta-Analysis». Journal of Clinical Medicine. 10 (11): 2490. doi:10.3390/jcm10112490. PMC 8200114. PMID 34199857.
- ^ Wen W, Zhang H, Zhou M, Cheng Y, Ye L, Chen J, et al. (November 2020). «Arrhythmia in patients with severe coronavirus disease (COVID-19): a meta-analysis». European Review for Medical and Pharmacological Sciences. 24 (21): 11395–11401. doi:10.26355/eurrev_202011_23632. PMID 33215461. S2CID 227077132.
- ^ Long B, Brady WJ, Koyfman A, Gottlieb M (July 2020). «Cardiovascular complications in COVID-19». The American Journal of Emergency Medicine. 38 (7): 1504–1507. doi:10.1016/j.ajem.2020.04.048. PMC 7165109. PMID 32317203.
- ^ Puntmann VO, Carerj ML, Wieters I, Fahim M, Arendt C, Hoffmann J, et al. (November 2020). «Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019 (COVID-19)». JAMA Cardiology. 5 (11): 1265–1273. doi:10.1001/jamacardio.2020.3557. PMC 7385689. PMID 32730619.
- ^ Lindner D, Fitzek A, Bräuninger H, Aleshcheva G, Edler C, Meissner K, et al. (November 2020). «Association of Cardiac Infection With SARS-CoV-2 in Confirmed COVID-19 Autopsy Cases». JAMA Cardiology. 5 (11): 1281–1285. doi:10.1001/jamacardio.2020.3551. PMC 7385672. PMID 32730555.
- ^ Siripanthong B, Nazarian S, Muser D, Deo R, Santangeli P, Khanji MY, et al. (September 2020). «Recognizing COVID-19-related myocarditis: The possible pathophysiology and proposed guideline for diagnosis and management». Heart Rhythm. 17 (9): 1463–1471. doi:10.1016/j.hrthm.2020.05.001. PMC 7199677. PMID 32387246.
- ^ Xu L, Liu J, Lu M, Yang D, Zheng X (May 2020). «Liver injury during highly pathogenic human coronavirus infections». Liver International. 40 (5): 998–1004. doi:10.1111/liv.14435. PMC 7228361. PMID 32170806.
- ^ Carod-Artal FJ (May 2020). «Neurological complications of coronavirus and COVID-19». Revista de Neurología. 70 (9): 311–322. doi:10.33588/rn.7009.2020179. PMID 32329044. S2CID 226200547.
- ^ Toscano G, Palmerini F, Ravaglia S, Ruiz L, Invernizzi P, Cuzzoni MG, et al. (June 2020). «Guillain-Barré Syndrome Associated with SARS-CoV-2». The New England Journal of Medicine. 382 (26): 2574–2576. doi:10.1056/NEJMc2009191. PMC 7182017. PMID 32302082.
- ^ «Multisystem inflammatory syndrome in children and adolescents temporally related to COVID-19». World Health Organization (WHO). 15 May 2020. Retrieved 20 May 2020.
- ^ HAN Archive – 00432. U.S. Centers for Disease Control and Prevention (CDC) (Report). 15 May 2020. Retrieved 20 May 2020.
- ^ Poyiadji N, Shahin G, Noujaim D, Stone M, Patel S, Griffith B (August 2020). «COVID-19-associated Acute Hemorrhagic Necrotizing Encephalopathy: Imaging Features». Radiology. 296 (2): E119–E120. doi:10.1148/radiol.2020201187. PMC 7233386. PMID 32228363.
- ^ a b Córdoba-Vives S, Peñaranda G (April 2020). «COVID-19 y Embarazo». Medical Journal of Costa Rica (in Spanish): 629. Archived from the original on 18 June 2021. Retrieved 14 February 2022.
- ^ Das S, Dhar S (July 2021). «Mucormycosis Following COVID-19 Infections: an Insight». The Indian Journal of Surgery. 84 (3): 585–586. doi:10.1007/s12262-021-03028-1. PMC 8270771. PMID 34276145. S2CID 235782159.
- ^ Baruah C, Devi P, Deka B, Sharma DK (June 2021). «Mucormycosis and Aspergillosis have been Linked to Covid-19-Related Fungal Infections in India». Advancements in Case Studies. 3 (1). doi:10.31031/AICS.2021.03.000555. ISSN 2639-0531. S2CID 244678882 – via ResearchGate.
- ^ «Living with Covid19». NIHR Themed Review. National Institute for Health Research. 15 October 2020. doi:10.3310/themedreview_41169. S2CID 241034526.
- ^ «Summary of COVID-19 Long Term Health Effects: Emerging evidence and Ongoing Investigation» (PDF). University of Washington. 1 September 2020. Retrieved 15 October 2020.
- ^ Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. (February 2020). «Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China». Lancet. 395 (10223): 497–506. doi:10.1016/S0140-6736(20)30183-5. PMC 7159299. PMID 31986264.
- ^ a b Torres-Castro R, Vasconcello-Castillo L, Alsina-Restoy X, Solis-Navarro L, Burgos F, Puppo H, Vilaró J (November 2020). «Respiratory function in patients post-infection by COVID-19: a systematic review and meta-analysis». Pulmonology. Elsevier BV. 27 (4): 328–337. doi:10.1016/j.pulmoe.2020.10.013. PMC 7687368. PMID 33262076. S2CID 227162748.
- ^ Shaw B, Daskareh M, Gholamrezanezhad A (January 2021). «The lingering manifestations of COVID-19 during and after convalescence: update on long-term pulmonary consequences of coronavirus disease 2019 (COVID-19)». La Radiologia Medica. 126 (1): 40–46. doi:10.1007/s11547-020-01295-8. PMC 7529085. PMID 33006087.
- ^ Zhao YM, Shang YM, Song WB, Li QQ, Xie H, Xu QF, et al. (August 2020). «Follow-up study of the pulmonary function and related physiological characteristics of COVID-19 survivors three months after recovery». EClinicalMedicine. 25: 100463. doi:10.1016/j.ijtb.2020.11.003. PMC 7654356. PMID 32838236.
- ^ «COVID-19 Lung Damage». Johns Hopkins Medicine. 28 February 2022. Retrieved 21 May 2022.
- ^ Taquet M, Sillett R, Zhu L, Mendel J, Camplisson I, Dercon Q, Harrison PJ (17 August 2022). «Neurological and psychiatric risk trajectories after SARS-CoV-2 infection: an analysis of 2-year retrospective cohort studies including 1 284 437 patients». The Lancet Psychiatry. 9 (10): 815–827. doi:10.1016/S2215-0366(22)00260-7. ISSN 2215-0366. PMC 9385200. PMID 35987197. S2CID 251626731.
- ^ «Immune responses and correlates of protective immunity against SARS-CoV-2». European Centre for Disease Prevention and Control. 18 May 2021. Retrieved 3 June 2021.
- ^ Vabret N, Britton GJ, Gruber C, Hegde S, Kim J, Kuksin M, et al. (June 2020). «Immunology of COVID-19: Current State of the Science». Immunity. 52 (6): 910–941. doi:10.1016/j.immuni.2020.05.002. PMC 7200337. PMID 32505227.
- ^ Wang Z, Muecksch F, Schaefer-Babajew D, Finkin S, Viant C, Gaebler C, et al. (July 2021). «Naturally enhanced neutralizing breadth against SARS-CoV-2 one year after infection». Nature. 595 (7867): 426–431. Bibcode:2021Natur.595..426W. doi:10.1038/s41586-021-03696-9. PMC 8277577. PMID 34126625.
- ^ a b Cohen JI, Burbelo PD (December 2020). «Reinfection with SARS-CoV-2: Implications for Vaccines». Clinical Infectious Diseases. 73 (11): e4223–e4228. doi:10.1093/cid/ciaa1866. PMC 7799323. PMID 33338197. S2CID 229323810.
- ^ a b Wang J, Kaperak C, Sato T, Sakuraba A (August 2021). «COVID-19 reinfection: a rapid systematic review of case reports and case series». Journal of Investigative Medicine. 69 (6): 1253–1255. doi:10.1136/jim-2021-001853. ISSN 1081-5589. PMID 34006572. S2CID 234773697.
- ^ a b «How soon after catching COVID-19 can you get it again?». ABC News. 2 May 2022. Retrieved 24 June 2022.
- ^ Centers for Disease Control and Prevention (May 2012). «Lesson 3: Measures of Risk Section 3: Mortality Frequency Measures». Principles of Epidemiology in Public Health Practice (Third ed.). U.S. Centers for Disease Control and Prevention (CDC). No. SS1978. Archived from the original on 28 February 2020. Retrieved 28 March 2020.
- ^ Ritchie H, Roser M (25 March 2020). Chivers T (ed.). «What do we know about the risk of dying from COVID-19?». Our World in Data. Archived from the original on 28 March 2020. Retrieved 28 March 2020.
- ^ Castagnoli R, Votto M, Licari A, Brambilla I, Bruno R, Perlini S, et al. (September 2020). «Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Infection in Children and Adolescents: A Systematic Review». JAMA Pediatrics. 174 (9): 882–889. doi:10.1001/jamapediatrics.2020.1467. PMID 32320004.
- ^ Lu X, Zhang L, Du H, Zhang J, Li YY, Qu J, et al. (April 2020). «SARS-CoV-2 Infection in Children». The New England Journal of Medicine. Massachusetts Medical Society. 382 (17): 1663–1665. doi:10.1056/nejmc2005073. PMC 7121177. PMID 32187458.
- ^ Dong Y, Mo X, Hu Y, Qi X, Jiang F, Jiang Z, Tong S (June 2020). «Epidemiology of COVID-19 Among Children in China». Pediatrics. 145 (6): e20200702. doi:10.1542/peds.2020-0702. PMID 32179660. S2CID 219118986.
- ^ a b c d Dehingia N (2021). «Sex differences in COVID-19 case fatality: do we know enough?». The Lancet. Global Health. 9 (1): e14–e15. doi:10.1016/S2214-109X(20)30464-2. PMC 7834645. PMID 33160453.
- ^ Lazzerini M, Putoto G (May 2020). «COVID-19 in Italy: momentous decisions and many uncertainties». The Lancet. Global Health. 8 (5): e641–e642. doi:10.1016/S2214-109X(20)30110-8. PMC 7104294. PMID 32199072.
- ^ Ritchie H, Ortiz-Ospina E, Beltekian D, Mathieu E, Hasell J, MacDonald B, et al. (5 March 2020). «What do we know about the risk of dying from COVID-19?». Our World in Data. Archived from the original on 28 March 2020. Retrieved 28 March 2020.
- ^ «Total confirmed cases of COVID-19 per million people». Our World in Data. Archived from the original on 19 March 2020. Retrieved 21 June 2022.[needs update]
- ^ «Cumulative confirmed COVID-19 deaths per million people». Our World in Data.
- ^ Mallapaty S (June 2020). «How deadly is the coronavirus? Scientists are close to an answer». Nature. 582 (7813): 467–468. Bibcode:2020Natur.582..467M. doi:10.1038/d41586-020-01738-2. PMID 32546810. S2CID 219726496.
- ^ Alwan NA, Burgess RA, Ashworth S, Beale R, Bhadelia N, Bogaert D, et al. (October 2020). «Scientific consensus on the COVID-19 pandemic: we need to act now». Lancet. 396 (10260): e71–e72. doi:10.1016/S0140-6736(20)32153-X. PMC 7557300. PMID 33069277.
- ^ Meyerowitz-Katz G, Merone L (December 2020). «A systematic review and meta-analysis of published research data on COVID-19 infection fatality rates». International Journal of Infectious Diseases. 101: 138–148. doi:10.1016/j.ijid.2020.09.1464. PMC 7524446. PMID 33007452.
- ^ Zhang D, Hu M, Ji Q (October 2020). «Financial markets under the global pandemic of COVID-19». Finance Research Letters. 36: 101528. Bibcode:2020CSFX….500043D. doi:10.1016/j.csfx.2020.100043. PMC 7402242. PMID 32837360.
- ^ a b c d e Levin AT, Hanage WP, Owusu-Boaitey N, Cochran KB, Walsh SP, Meyerowitz-Katz G (December 2020). «Assessing the age specificity of infection fatality rates for COVID-19: systematic review, meta-analysis, and public policy implications». European Journal of Epidemiology. 35 (12): 1123–1138. doi:10.1007/s10654-020-00698-1. PMC 7721859. PMID 33289900.
Text was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ^ World Health Organization (22 December 2020). «Background paper on Covid-19 disease and vaccines: prepared by the Strategic Advisory Group of Experts (SAGE) on immunization working group on COVID-19 vaccines». World Health Organization. hdl:10665/338095.
- ^ «Coronavirus disease 2019 (COVID-19) Situation Report – 30» (PDF). 19 February 2020. Retrieved 3 June 2020.
- ^ «Coronavirus disease 2019 (COVID-19) Situation Report – 31» (PDF). 20 February 2020. Retrieved 23 April 2020.
- ^ McNeil Jr DG (4 July 2020). «The Pandemic’s Big Mystery: How Deadly Is the Coronavirus? – Even with more than 500,000 dead worldwide, scientists are struggling to learn how often the virus kills. Here’s why». The New York Times. Archived from the original on 4 July 2020. Retrieved 6 July 2020.
- ^ «Global Research and Innovation Forum on COVID-19: Virtual Press Conference» (PDF). World Health Organization. 2 July 2020.
- ^ «Estimating mortality from COVID-19». World Health Organization (WHO). Retrieved 21 September 2020.
- ^ Shaffer C (23 October 2021). «Covid-19 still rife in Iran». New Scientist. 252 (3357): 10–11. Bibcode:2021NewSc.252…10S. doi:10.1016/S0262-4079(21)01865-0. ISSN 0262-4079. PMC 8536311. PMID 34720322.
- ^ «COVID-19: Data». City of New York.
- ^ Wilson L (May 2020). «SARS-CoV-2, COVID-19, Infection Fatality Rate (IFR) Implied by the Serology, Antibody, Testing in New York City». SSRN 3590771.
- ^ Yang W, Kandula S, Huynh M, Greene SK, Van Wye G, Li W, et al. (February 2021). «Estimating the infection-fatality risk of SARS-CoV-2 in New York City during the spring 2020 pandemic wave: a model-based analysis». The Lancet. Infectious Diseases. 21 (2): 203–212. doi:10.1016/s1473-3099(20)30769-6. PMC 7572090. PMID 33091374.
- ^ Modi C (21 April 2020). «How deadly is COVID-19? Data Science offers answers from Italy mortality data». Medium. Retrieved 23 April 2020.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 10 September 2020. Retrieved 9 December 2020.
- ^ Salje H, Tran Kiem C, Lefrancq N, Courtejoie N, Bosetti P, Paireau J, et al. (July 2020). «Estimating the burden of SARS-CoV-2 in France». Science. 369 (6500): 208–211. Bibcode:2020Sci…369..208S. doi:10.1126/science.abc3517. PMC 7223792. PMID 32404476.
- ^ McIntosh K (April 2021). «Covid 19 Clinical Features». UpToDate. Retrieved 12 May 2021.
- ^ Peckham H, de Gruijter NM, Raine C, Radziszewska A, Ciurtin C, Wedderburn LR, et al. (December 2020). «Male sex identified by global COVID-19 meta-analysis as a risk factor for death and ITU admission». Nature Communications. 11 (1): 6317. Bibcode:2020NatCo..11.6317P. doi:10.1038/s41467-020-19741-6. PMC 7726563. PMID 33298944.
- ^ Abate BB, Kassie AM, Kassaw MW, Aragie TG, Masresha SA (October 2020). «Sex difference in coronavirus disease (COVID-19): a systematic review and meta-analysis». BMJ Open. 10 (10): e040129. doi:10.1136/bmjopen-2020-040129. PMC 7539579. PMID 33028563.
- ^ a b c The Novel Coronavirus Pneumonia Emergency Response Epidemiology Team (February 2020). «The Epidemiological Characteristics of an Outbreak of 2019 Novel Coronavirus Diseases (COVID-19) – China, 2020». China CDC Weekly. 2 (8): 113–122. doi:10.46234/ccdcw2020.032. PMC 839292. PMID 34594836.
- ^ Hu Y, Sun J, Dai Z, Deng H, Li X, Huang Q, et al. (June 2020). «Prevalence and severity of corona virus disease 2019 (COVID-19): A systematic review and meta-analysis». Journal of Clinical Virology. 127: 104371. doi:10.1016/j.jcv.2020.104371. PMC 7195434. PMID 32315817.
- ^ Fu L, Wang B, Yuan T, Chen X, Ao Y, Fitzpatrick T, et al. (June 2020). «Clinical characteristics of coronavirus disease 2019 (COVID-19) in China: A systematic review and meta-analysis». The Journal of Infection. 80 (6): 656–665. doi:10.1016/j.jinf.2020.03.041. PMC 7151416. PMID 32283155.
- ^ Yuki K, Fujiogi M, Koutsogiannaki S (June 2020). «COVID-19 pathophysiology: A review». Clinical Immunology. 215: 108427. doi:10.1016/j.clim.2020.108427. PMC 7169933. PMID 32325252. S2CID 216028003.
- ^ Rabin RC (20 March 2020). «In Italy, Coronavirus Takes a Higher Toll on Men». The New York Times. Archived from the original on 20 March 2020. Retrieved 7 April 2020.
- ^ «COVID-19 weekly surveillance report». World Health Organization (WHO). Archived from the original on 15 March 2020. Retrieved 7 April 2020.
- ^ a b Gupta AH (3 April 2020). «Does Covid-19 Hit Women and Men Differently? U.S. Isn’t Keeping Track». The New York Times. Archived from the original on 3 April 2020. Retrieved 7 April 2020.
- ^ a b Dorn AV, Cooney RE, Sabin ML (April 2020). «COVID-19 exacerbating inequalities in the US». Lancet. 395 (10232): 1243–1244. doi:10.1016/S0140-6736(20)30893-X. PMC 7162639. PMID 32305087.
- ^ a b Shauly-Aharonov, Michal; Shafrir, Asher; Paltiel, Ora; Calderon-Margalit, Ronit; Safadi, Rifaat; Bicher, Roee; Barenholz-Goultschin, Orit; Stokar, Joshua (22 July 2021). «Both high and low pre-infection glucose levels associated with increased risk for severe COVID-19: New insights from a population-based study». PLOS ONE. 16 (7): e0254847. Bibcode:2021PLoSO..1654847S. doi:10.1371/journal.pone.0254847. ISSN 1932-6203. PMC 8297851. PMID 34293038.
- ^ Adams ML, Katz DL, Grandpre J (August 2020). «Population-Based Estimates of Chronic Conditions Affecting Risk for Complications from Coronavirus Disease, United States». Emerging Infectious Diseases. 26 (8): 1831–1833. doi:10.3201/eid2608.200679. PMC 7392427. PMID 32324118.
- ^ Batthyány K (13 October 2020). «Coronavirus y Desigualdades preexistentes: Género y Cuidados». CLACSO (Consejo Latinoamericano de Ciencias Sociales). Retrieved 22 April 2021.
- ^ «COVID-19 Presents Significant Risks for American Indian and Alaska Native People». 14 May 2020.
- ^ «COVID-19 Presents Significant Risks for American Indian and Alaska Native People». 14 May 2020.
- ^ Laurencin CT, McClinton A (June 2020). «The COVID-19 Pandemic: a Call to Action to Identify and Address Racial and Ethnic Disparities». Journal of Racial and Ethnic Health Disparities. 7 (3): 398–402. doi:10.1007/s40615-020-00756-0. PMC 7166096. PMID 32306369.
- ^ «How coronavirus deaths in the UK compare by race and ethnicity». The Independent. 9 June 2020. Retrieved 10 June 2020.
- ^ «Emerging findings on the impact of COVID-19 on black and minority ethnic people». The Health Foundation. Retrieved 10 June 2020.
- ^ Butcher B, Massey J (9 June 2020). «Why are more BAME people dying from coronavirus?». BBC News. Retrieved 10 June 2020.
- ^ a b c «The ancient Neanderthal hand in severe COVID-19». ScienceDaily. 30 September 2020. Retrieved 13 December 2020.
- ^ «WHO Director-General’s statement on the advice of the IHR Emergency Committee on Novel Coronavirus». World Health Organization (WHO).
- ^ Garg S, Kim L, Whitaker M, O’Halloran A, Cummings C, Holstein R, et al. (April 2020). «Hospitalization Rates and Characteristics of Patients Hospitalized with Laboratory-Confirmed Coronavirus Disease 2019 – COVID-NET, 14 States, March 1–30, 2020». MMWR. Morbidity and Mortality Weekly Report. 69 (15): 458–464. doi:10.15585/mmwr.mm6915e3. PMC 7755063. PMID 32298251.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 19 June 2020.
- ^ Zhao Q, Meng M, Kumar R, Wu Y, Huang J, Lian N, et al. (October 2020). «The impact of COPD and smoking history on the severity of COVID-19: A systemic review and meta-analysis». Journal of Medical Virology. 92 (10): 1915–1921. doi:10.1002/jmv.25889. PMC 7262275. PMID 32293753.
- ^ «Smoking and COVID-19». World Health Organization (WHO). Retrieved 19 June 2020.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 4 May 2020.
- ^ DeRobertis J (3 May 2020). «People who use drugs are more vulnerable to coronavirus. Here’s what clinics are doing to help». The Advocate (Louisiana). Retrieved 4 May 2020.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020.
- ^ Frutos R, Gavotte L, Devaux CA (November 2021). «Understanding the origin of COVID-19 requires to change the paradigm on zoonotic emergence from the spillover to the circulation model». Infection, Genetics and Evolution. 95: 104812. doi:10.1016/j.meegid.2021.104812. PMC 7969828. PMID 33744401.
- ^ Holmes EC, Goldstein SA, Rasmussen AL, Robertson DL, Crits-Christoph A, Wertheim JO, et al. (September 2021). «The origins of SARS-CoV-2: A critical review». Cell. 184 (19): 4848–4856. doi:10.1016/j.cell.2021.08.017. PMC 8373617. PMID 34480864.
- ^ «WHO-convened Global Study of Origins of SARS-CoV-2: China Part». World Health Organization. 30 March 2021. Retrieved 29 July 2022.
- ^ Duarte F (24 February 2020). «As the cases of coronavirus increase in China and around the world, the hunt is on to identify «patient zero»«. BBC News. Retrieved 22 March 2020.
- ^ Pekar JE, Magee P, Parker E, Moshiri N, Izhikevich K, Havens JL, et al. (26 July 2022). «The molecular epidemiology of multiple zoonotic origins of SARS-CoV-2». Science. 377 (6609): 960–966. Bibcode:2022Sci…377..960P. doi:10.1126/science.abp8337. PMC 9348752. PMID 35881005.
- ^ Gill V (26 July 2022). «Covid origin studies say evidence points to Wuhan market».
- ^ Worobey M, Levy JI, Serrano LM, Crits-Christoph A, Pekar JE, Goldstein SA, et al. (July 2022). «The Huanan Seafood Wholesale Market in Wuhan was the early epicenter of the COVID-19 pandemic». Science. 377 (6609): 951–959. Bibcode:2022Sci…377..951W. doi:10.1126/science.abp8715. PMC 9348750. PMID 35881010. S2CID 251067542.
- ^ «Debate deepens over Wuhan wet market’s role in kickstarting the pandemic». National Geographic. 27 July 2022.
- ^ Li X, Zai J, Zhao Q, Nie Q, Li Y, Foley BT, Chaillon A (June 2020). «Evolutionary history, potential intermediate animal host, and cross-species analyses of SARS-CoV-2». Journal of Medical Virology. 92 (6): 602–611. doi:10.1002/jmv.25731. PMC 7228310. PMID 32104911.
- ^ Andersen KG, Rambaut A, Lipkin WI, Holmes EC, Garry RF (April 2020). «The proximal origin of SARS-CoV-2». Nature Medicine. 26 (4): 450–452. doi:10.1038/s41591-020-0820-9. PMC 7095063. PMID 32284615.
- ^ van Dorp L, Acman M, Richard D, Shaw LP, Ford CE, Ormond L, et al. (September 2020). «Emergence of genomic diversity and recurrent mutations in SARS-CoV-2». Infection, Genetics and Evolution. 83: 104351. doi:10.1016/j.meegid.2020.104351. PMC 7199730. PMID 32387564.
- ^ Grose TK (13 May 2020). «Did the Coronavirus Originate Outside of Wuhan?». U.S. News & World Report.
- ^ Wolf ZB (25 May 2021). «Analysis: Why scientists are suddenly more interested in the lab-leak theory of Covid’s origin». CNN. Retrieved 26 May 2021.
- ^ Maxmen A (September 2021). «US COVID origins report: researchers pleased with scientific approach». Nature. 597 (7875): 159–160. Bibcode:2021Natur.597..159M. doi:10.1038/d41586-021-02366-0. PMID 34465917. S2CID 237373547.
- ^ Paun C, Zeller S, Reader R, Leonard B, Scullion G (4 November 2022). «Cross-examining the lab-leak theorists». Politico. Retrieved 21 November 2022.
- ^ Hosenball M, Zengerle P (30 October 2021). «U.S. spy agencies say origins of COVID-19 may never be known». Reuters. Retrieved 21 November 2022.
- ^ Wu YC, Chen CS, Chan YJ (March 2020). «The outbreak of COVID-19: An overview». Journal of the Chinese Medical Association. 83 (3): 217–220. doi:10.1097/JCMA.0000000000000270. PMC 7153464. PMID 32134861.
- ^ Wang C, Horby PW, Hayden FG, Gao GF (February 2020). «A novel coronavirus outbreak of global health concern». Lancet. 395 (10223): 470–473. doi:10.1016/S0140-6736(20)30185-9. PMC 7135038. PMID 31986257.
- ^ Cohen J (January 2020). «Wuhan seafood market may not be source of novel virus spreading globally». Science. doi:10.1126/science.abb0611.
- ^ «Novel Coronavirus – China». World Health Organization (WHO). 12 January 2020. Archived from the original on 14 January 2020.
- ^ Kessler G (17 April 2020). «Trump’s false claim that the WHO said the coronavirus was ‘not communicable’«. The Washington Post. Archived from the original on 17 April 2020. Retrieved 17 April 2020.
- ^ Kuo L (21 January 2020). «China confirms human-to-human transmission of coronavirus». The Guardian. Retrieved 18 April 2020.
- ^ Epidemiology Working Group For Ncip Epidemic Response; Chinese Center for Disease Control Prevention (February 2020). «[The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China]». Zhonghua Liu Xing Bing Xue Za Zhi = Zhonghua Liuxingbingxue Zazhi (in Chinese). 41 (2): 145–151. doi:10.3760/cma.j.issn.0254-6450.2020.02.003. PMID 32064853. S2CID 211133882.
- ^ Areddy JT (26 May 2020). «China Rules Out Animal Market and Lab as Coronavirus Origin». The Wall Street Journal. Retrieved 29 May 2020.
- ^ Kelland K (19 June 2020). «Italy sewage study suggests COVID-19 was there in December 2019». Reuters. Retrieved 23 June 2020.
- ^ Heymann DL, Shindo N (February 2020). «COVID-19: what is next for public health?». Lancet. 395 (10224): 542–545. doi:10.1016/S0140-6736(20)30374-3. PMC 7138015. PMID 32061313.
- ^ Bryner J (14 March 2020). «1st known case of coronavirus traced back to November in China». livescience.com. Retrieved 31 May 2020.
- ^ Canadian Politics (8 April 2020). «The birth of a pandemic: How COVID-19 went from Wuhan to Toronto | National Post». National Post. Retrieved 31 May 2020.
- ^ 高昱 (26 February 2020). «独家 | 新冠病毒基因测序溯源:警报是何时拉响的» [Exclusive | Tracing the New Coronavirus gene sequencing: when did the alarm sound]. Caixin (in Chinese). Archived from the original on 27 February 2020. Retrieved 1 March 2020.
- ^ 路子康. «最早上报疫情的她,怎样发现这种不一样的肺炎». 中国网新闻 (in Chinese (China)). 北京. Archived from the original on 2 March 2020. Retrieved 11 February 2020.
- ^ «Undiagnosed pneumonia – China (HU): RFI». ProMED Mail. ProMED. Retrieved 7 May 2020.
- ^ «‘Hero who told the truth’: Chinese rage over coronavirus death of whistleblower doctor». The Guardian. 7 February 2020.
- ^ Kuo L (11 March 2020). «Coronavirus: Wuhan doctor speaks out against authorities». The Guardian. London.
- ^ «Novel Coronavirus». World Health Organization (WHO). Archived from the original on 2 February 2020. Retrieved 6 February 2020.
- ^ «武汉现不明原因肺炎 官方确认属实:已经做好隔离». Xinhua Net 新華網. 31 December 2019. Retrieved 31 March 2020.
- ^ 武汉市卫健委关于当前我市肺炎疫情的情况通报. WJW.Wuhan.gov.cn (in Chinese). Wuhan Municipal Health Commission. 31 December 2019. Archived from the original on 9 January 2020. Retrieved 8 February 2020.
- ^ «Mystery pneumonia virus probed in China». BBC News. 3 January 2020. Archived from the original on 5 January 2020. Retrieved 29 January 2020.
- ^ Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y, et al. (March 2020). «Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia». The New England Journal of Medicine. 382 (13): 1199–1207. doi:10.1056/NEJMoa2001316. PMC 7121484. PMID 31995857.
- ^ «China confirms sharp rise in cases of SARS-like virus across the country». 20 January 2020. Archived from the original on 20 January 2020. Retrieved 20 January 2020.
- ^ a b «Flattery and foot dragging: China’s influence over the WHO under scrutiny». The Globe and Mail. 25 April 2020.
- ^ Horton R (18 March 2020). «Scientists have been sounding the alarm on coronavirus for months. Why did Britain fail to act?». The Guardian. Retrieved 23 April 2020.
- ^ «China delayed releasing coronavirus info, frustrating WHO». Associated Press. 2 June 2020. Retrieved 3 June 2020.
- ^ «Coronavirus: Primi due casi in Italia» [Coronavirus: First two cases in Italy]. Corriere della sera (in Italian). 31 January 2020. Retrieved 31 January 2020.
- ^ «Coronavirus: Number of COVID-19 deaths in Italy surpasses China as total reaches 3,405». Sky News. Retrieved 7 May 2020.
- ^ McNeil Jr DG (26 March 2020). «The U.S. Now Leads the World in Confirmed Coronavirus Cases». The New York Times. Archived from the original on 26 March 2020. Retrieved 27 March 2020.
- ^ «Studies Show N.Y. Outbreak Originated in Europe». The New York Times. 8 April 2020. Archived from the original on 8 April 2020.
- ^ Irish J (4 May 2020). Lough RM, Graff P (eds.). «After retesting samples, French hospital discovers COVID-19 case from December». Reuters. Retrieved 4 May 2020.
- ^ Deslandes A, Berti V, Tandjaoui-Lambotte Y, Alloui C, Carbonnelle E, Zahar JR, et al. (June 2020). «SARS-CoV-2 was already spreading in France in late December 2019». International Journal of Antimicrobial Agents. 55 (6): 106006. doi:10.1016/j.ijantimicag.2020.106006. PMC 7196402. PMID 32371096.
- ^ «2 died with coronavirus weeks before 1st U.S. virus death». PBS NewsHour. 22 April 2020. Retrieved 23 April 2020.
- ^ Michael-Kordatou I, Karaolia P, Fatta-Kassinos D (October 2020). «Sewage analysis as a tool for the COVID-19 pandemic response and management: the urgent need for optimised protocols for SARS-CoV-2 detection and quantification». Journal of Environmental Chemical Engineering. 8 (5): 104306. doi:10.1016/j.jece.2020.104306. PMC 7384408. PMID 32834990.
- ^ Platto S, Xue T, Carafoli E (September 2020). «COVID19: an announced pandemic». Cell Death & Disease. 11 (9): 799. doi:10.1038/s41419-020-02995-9. PMC 7513903. PMID 32973152.
- ^ Kavya B, Abraham R (3 October 2021). Shumaker L, Wardell J (eds.). «Global COVID-19 deaths hit 5 million as Delta variant sweeps the world». Reuters.com. Reuters.
- ^ «China coronavirus: Misinformation spreads online about origin and scale». BBC News. 30 January 2020. Archived from the original on 4 February 2020. Retrieved 10 February 2020.
- ^ Taylor J (31 January 2020). «Bat soup, dodgy cures and ‘diseasology’: the spread of coronavirus misinformation». The Guardian. Archived from the original on 2 February 2020. Retrieved 3 February 2020.
- ^ «Here’s A Running List Of Disinformation Spreading About The Coronavirus». Buzzfeed News. Archived from the original on 6 February 2020. Retrieved 8 February 2020.
- ^ «Coronavirus Disease 2019 (COVID-19)». U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 10 October 2020.
- ^ «Misleading claim circulates online about infection fatality ratio of Covid-19 in the US». Fact Check. 8 October 2020. Retrieved 10 October 2020.
- ^ a b c d Kampf G, Brüggemann Y, Kaba HE, Steinmann J, Pfaender S, Scheithauer S, Steinmann E (December 2020). «Potential sources, modes of transmission and effectiveness of prevention measures against SARS-CoV-2». The Journal of Hospital Infection. 106 (4): 678–697. doi:10.1016/j.jhin.2020.09.022. PMC 7500278. PMID 32956786.
- ^ Shi J, Wen Z, Zhong G, Yang H, Wang C, Huang B, et al. (May 2020). «Susceptibility of ferrets, cats, dogs, and other domesticated animals to SARS-coronavirus 2». Science. 368 (6494): 1016–1020. doi:10.1126/science.abb7015. PMC 7164390. PMID 32269068.
- ^ a b c d e f g h Salajegheh Tazerji S, Magalhães Duarte P, Rahimi P, Shahabinejad F, Dhakal S, Singh Malik Y, et al. (September 2020). «Transmission of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) to animals: an updated review». Journal of Translational Medicine. 18 (1): 358. doi:10.1186/s12967-020-02534-2. PMC 7503431. PMID 32957995.
- ^ a b c Gorman J (22 January 2021). «The Coronavirus Kills Mink, So They Too May Get a Vaccine». The New York Times. ISSN 0362-4331. Archived from the original on 28 December 2021. Retrieved 24 February 2021.
- ^ Dhama K, Sharun K, Tiwari R, Dadar M, Malik YS, Singh KP, Chaicumpa W (June 2020). «COVID-19, an emerging coronavirus infection: advances and prospects in designing and developing vaccines, immunotherapeutics, and therapeutics». Human Vaccines & Immunotherapeutics. 16 (6): 1232–1238. doi:10.1080/21645515.2020.1735227. PMC 7103671. PMID 32186952.
- ^ Zhang L, Liu Y (May 2020). «Potential interventions for novel coronavirus in China: A systematic review». Journal of Medical Virology. 92 (5): 479–490. doi:10.1002/jmv.25707. PMC 7166986. PMID 32052466.
- ^ «Interim Laboratory Biosafety Guidelines for Handling and Processing Specimens Associated with Coronavirus Disease 2019 (COVID-19)». Coronavirus Disease 2019 (COVID-19) Lab Biosafety Guidelines. U.S. Centers for Disease Control and Prevention (CDC). 11 February 2020. Retrieved 1 April 2020.
- ^ Aristovnik A, Ravšelj D, Umek L (November 2020). «A Bibliometric Analysis of COVID-19 across Science and Social Science Research Landscape». Sustainability. 12 (21): 9132. doi:10.3390/su12219132.
- ^ Kupferschmidt K (3 December 2020). «First-of-its-kind African trial tests common drugs to prevent severe COVID-19». Science. doi:10.1126/science.abf9987. Retrieved 8 March 2022.
- ^ Reardon S (November 2020). «For COVID Drugs, Months of Frantic Development Lead to Few Outright Successes». Scientific American. Retrieved 10 December 2020.
- ^ Kucharski AJ, Russell TW, Diamond C, Liu Y, Edmunds J, Funk S, Eggo RM (May 2020). «Early dynamics of transmission and control of COVID-19: a mathematical modelling study». The Lancet. Infectious Diseases. 20 (5): 553–558. doi:10.1016/S1473-3099(20)30144-4. PMC 7158569. PMID 32171059.
- ^ «Update to living systematic review on prediction models for diagnosis and prognosis of covid-19». BMJ (Clinical Research Ed.). 372: n236. 3 February 2021. doi:10.1136/bmj.n236. ISSN 1756-1833. PMID 33536183. S2CID 231775762.
- ^ Giordano G, Blanchini F, Bruno R, Colaneri P, Di Filippo A, Di Matteo A, Colaneri M (June 2020). «Modelling the COVID-19 epidemic and implementation of population-wide interventions in Italy». Nature Medicine. 26 (6): 855–860. arXiv:2003.09861. doi:10.1038/s41591-020-0883-7. PMC 7175834. PMID 32322102.
- ^ Prem K, Liu Y, Russell TW, Kucharski AJ, Eggo RM, Davies N, et al. (May 2020). «The effect of control strategies to reduce social mixing on outcomes of the COVID-19 epidemic in Wuhan, China: a modelling study». The Lancet. Public Health. 5 (5): e261–e270. doi:10.1016/S2468-2667(20)30073-6. PMC 7158905. PMID 32220655.
- ^ Emanuel EJ, Persad G, Upshur R, Thome B, Parker M, Glickman A, et al. (May 2020). «Fair Allocation of Scarce Medical Resources in the Time of Covid-19». The New England Journal of Medicine. 382 (21): 2049–2055. doi:10.1056/NEJMsb2005114. PMID 32202722.
- ^ Kermack WO, McKendrick AG (1927). «A contribution to the mathematical theory of epidemics». Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. 115 (772): 700–721. Bibcode:1927RSPSA.115..700K. doi:10.1098/rspa.1927.0118.
- ^ Mittal R, Ni R, Seo JH (2020). «The flow physics of COVID-19». Journal of Fluid Mechanics. 894: –2. arXiv:2004.09354. Bibcode:2020JFM…894F…2M. doi:10.1017/jfm.2020.330.
- ^ Ronchi E, Lovreglio R (October 2020). «EXPOSED: An occupant exposure model for confined spaces to retrofit crowd models during a pandemic». Safety Science. 130: 104834. arXiv:2005.04007. doi:10.1016/j.ssci.2020.104834. PMC 7373681. PMID 32834509.
- ^ Badr HS, Du H, Marshall M, Dong E, Squire MM, Gardner LM (November 2020). «Association between mobility patterns and COVID-19 transmission in the USA: a mathematical modelling study». The Lancet Infectious Diseases. 20 (11): 1247–1254. doi:10.1016/S1473-3099(20)30553-3. PMC 7329287. PMID 32621869.
- ^ McKibbin W, Roshen F (2020). «The global macroeconomic impacts of COVID-19: Seven scenarios» (PDF). CAMA Working Paper. doi:10.2139/ssrn.3547729. S2CID 216307705.
- ^ Bundy J, Pfarrer MD, Short CE, Coombs WT (July 2017). «Crises and crisis management: Integration, interpretation, and research development». Journal of Management. 43 (6): 1661–92. doi:10.1177/0149206316680030. S2CID 152223772.
- ^ Kraus S, Clauss T, Breier M, Gast J, Zardini A, Tiberius V (2020). «The economics of COVID-19: initial empirical evidence on how family firms in five European countries cope with the corona crisis». International Journal of Entrepreneurial Behavior & Research. 26 (5): 1067–1092. doi:10.1108/IJEBR-04-2020-0214. ISSN 1355-2554. S2CID 219144929.
- ^ «COVID-19 treatment and vaccine tracker» (PDF). Milken Institute. 21 April 2020. Retrieved 21 April 2020.
- ^ a b Koch S, Pong W (13 March 2020). «First up for COVID-19: nearly 30 clinical readouts before end of April». BioCentury Inc. Retrieved 1 April 2020.
- ^ Kupferschmidt K, Cohen J (March 2020). «WHO launches global megatrial of the four most promising coronavirus treatments». Science. doi:10.1126/science.abb8497.
- ^ «UN health chief announces global ‘solidarity trial’ to jumpstart search for COVID-19 treatment». UN News. 18 March 2020. Archived from the original on 23 March 2020. Retrieved 23 March 2020.
- ^ «Citing safety concerns, the W.H.O. paused tests of a drug Trump said he had taken». The New York Times. 26 May 2020. Archived from the original on 26 May 2020.
- ^
This article incorporates text from this source, which is in the public domain: «Hydroxychloroquine does not benefit adults hospitalized with COVID-19». National Institutes of Health (NIH) (Press release). 9 November 2020. Retrieved 9 November 2020.
- ^
This article incorporates text from this source, which is in the public domain: «Coronavirus (COVID-19) Update: FDA Warns of Newly Discovered Potential Drug Interaction That May Reduce Effectiveness of a COVID-19 Treatment Authorized for Emergency Use». U.S. Food and Drug Administration (FDA) (Press release). 15 June 2020. Retrieved 15 June 2020.
- ^ «France bans use of hydroxychloroquine, drug touted by Trump, in coronavirus patients». CBS News. 27 May 2020.
- ^ Boseley S (16 June 202). «Recovery trial for Covid-19 treatments: what we know so far». The Guardian. Retrieved 21 June 2020.
- ^ «WHO welcomes preliminary results about dexamethasone use in treating critically ill COVID-19 patients». World Health Organization (WHO) (Press release). 16 June 2020. Retrieved 21 June 2020.
- ^ «Q&A: Dexamethasone and COVID-19». World Health Organization (WHO) (Press release). Retrieved 12 July 2020.
- ^ «Corticosteroids». COVID-19 Treatment Guidelines. National Institutes of Health. Retrieved 12 July 2020.
- ^ a b c World Health Organization (2020). Corticosteroids for COVID-19: living guidance, 2 September 2020 (Report). hdl:10665/334125. WHO/2019-nCoV/Corticosteroids/2020.1.
- ^ «WHO updates clinical care guidance with corticosteroid recommendations». World Health Organization (WHO). Retrieved 25 January 2022.
- ^ Sterne JA, Murthy S, Diaz JV, Slutsky AS, Villar J, Angus DC, et al. (The WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) Working Group) (October 2020). «Association Between Administration of Systemic Corticosteroids and Mortality Among Critically Ill Patients With COVID-19: A Meta-analysis». JAMA. 324 (13): 1330–1341. doi:10.1001/jama.2020.17023. PMC 7489434. PMID 32876694. S2CID 221467783.
- ^ Prescott HC, Rice TW (October 2020). «Corticosteroids in COVID-19 ARDS: Evidence and Hope During the Pandemic». JAMA. 324 (13): 1292–1295. doi:10.1001/jama.2020.16747. PMID 32876693. S2CID 221468015.
- ^ a b «EMA endorses use of dexamethasone in COVID-19 patients on oxygen or mechanical ventilation». European Medicines Agency (EMA) (Press release). 18 September 2020. Retrieved 21 September 2020. Text was copied from this source which is European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ Dexamethasone in hospitalised patients with COVID-19 (PDF) (Report). European Medicines Agency. 17 September 2020.
- ^ a b c
This article incorporates text from this source, which is in the public domain: «Coronavirus (COVID-19) Update: FDA Authorizes Monoclonal Antibody for Treatment of COVID-19». U.S. Food and Drug Administration (FDA) (Press release). 9 November 2020. Retrieved 9 November 2020.
- ^
This article incorporates text from this source, which is in the public domain: «FDA Authorizes Monoclonal Antibodies for Treatment of COVID-19». U.S. Food and Drug Administration (FDA) (Press release). 10 February 2021. Retrieved 9 February 2021.
- ^
This article incorporates text from this source, which is in the public domain: «Coronavirus (COVID-19) Update: FDA Revokes Emergency Use Authorization for Monoclonal Antibody Bamlanivimab». U.S. Food and Drug Administration (FDA) (Press release). 16 April 2021. Retrieved 16 April 2021.
- ^ Li X, Geng M, Peng Y, Meng L, Lu S (April 2020). «Molecular immune pathogenesis and diagnosis of COVID-19». Journal of Pharmaceutical Analysis. 10 (2): 102–108. doi:10.1016/j.jpha.2020.03.001. PMC 7104082. PMID 32282863.
- ^ Zhao Z, Wei Y, Tao C (January 2021). «An enlightening role for cytokine storm in coronavirus infection». Clinical Immunology. 222: 108615. doi:10.1016/j.clim.2020.108615. PMC 7583583. PMID 33203513.
- ^ Liu R, Miller J (3 March 2020). «China approves use of Roche drug in battle against coronavirus complications». Reuters. Archived from the original on 12 March 2020. Retrieved 14 March 2020.
- ^ Xu X, Han M, Li T, Sun W, Wang D, Fu B, et al. (May 2020). «Effective treatment of severe COVID-19 patients with tocilizumab». Proceedings of the National Academy of Sciences of the United States of America. 117 (20): 10970–10975. Bibcode:2020PNAS..11710970X. doi:10.1073/pnas.2005615117. PMC 7245089. PMID 32350134.
- ^ Ovadia D, Agenzia Z. «COVID-19 – Italy launches an independent trial on tocilizumab». Univadis from Medscape. Aptus Health. Retrieved 22 April 2020.
- ^ «Tocilizumab in COVID-19 Pneumonia (TOCIVID-19) (TOCIVID-19)». clinicaltrials.gov. Retrieved 22 April 2020.
- ^ Various sources:
- «How doctors can potentially significantly reduce the number of deaths from Covid-19». Vox. 12 March 2020. Archived from the original on 19 March 2020. Retrieved 14 March 2020.
- Ruan Q, Yang K, Wang W, Jiang L, Song J (May 2020). «Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China». Intensive Care Medicine. 46 (5): 846–848. doi:10.1007/s00134-020-05991-x. PMC 7080116. PMID 32125452.
- Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ (March 2020). «COVID-19: consider cytokine storm syndromes and immunosuppression». Lancet. 395 (10229): 1033–1034. doi:10.1016/S0140-6736(20)30628-0. PMC 7270045. PMID 32192578.
- ^ Slater H (26 March 2020). «FDA Approves Phase III Clinical Trial of Tocilizumab for COVID-19 Pneumonia». cancernetwork.com. Cancer Network. Retrieved 22 April 2020.
- ^ Locke FL, Neelapu SS, Bartlett NL, Lekakis LJ, Jacobson CA, Braunschweig I, et al. (2017). «Preliminary Results of Prophylactic Tocilizumab after Axicabtageneciloleucel (axi-cel; KTE-C19) Treatment for Patients with Refractory, Aggressive Non-Hodgkin Lymphoma (NHL)». Blood. 130 (Supplement 1): 1547. doi:10.1182/blood.V130.Suppl_1.1547.1547. S2CID 155698207.
- ^ Sterner RM, Sakemura R, Cox MJ, Yang N, Khadka RH, Forsman CL, et al. (February 2019). «GM-CSF inhibition reduces cytokine release syndrome and neuroinflammation but enhances CAR T cell function in xenografts». Blood. 133 (7): 697–709. doi:10.1182/blood-2018-10-881722. PMC 6376281. PMID 30463995.
- ^ a b c d e Casadevall A, Pirofski LA (April 2020). «The convalescent sera option for containing COVID-19». The Journal of Clinical Investigation. 130 (4): 1545–1548. doi:10.1172/JCI138003. PMC 7108922. PMID 32167489.
- ^ a b c Piechotta V, Iannizzi C, Chai KL, Valk SJ, Kimber C, Dorando E, et al. (May 2021). «Convalescent plasma or hyperimmune immunoglobulin for people with COVID-19: a living systematic review». The Cochrane Database of Systematic Reviews. 2021 (5): CD013600. doi:10.1002/14651858.CD013600.pub4. PMC 8135693. PMID 34013969.
- ^ a b Ho M (April 2020). «Perspectives on the development of neutralizing antibodies against SARS-CoV-2». Antibody Therapeutics. 3 (2): 109–114. doi:10.1093/abt/tbaa009. PMC 7291920. PMID 32566896.
- ^ Yang L, Liu W, Yu X, Wu M, Reichert JM, Ho M (July 2020). «COVID-19 antibody therapeutics tracker: a global online database of antibody therapeutics for the prevention and treatment of COVID-19». Antibody Therapeutics. 3 (3): 205–212. doi:10.1093/abt/tbaa020. PMC 7454247. PMID 33215063.
- ^ Maccaro A, Piaggio D, Pagliara S, Pecchia L (June 2021). «The role of ethics in science: a systematic literature review from the first wave of COVID-19». Health and Technology. 11 (5): 1063–1071. doi:10.1007/s12553-021-00570-6. ISSN 2190-7188. PMC 8175060. PMID 34104626.
- ^ McGuire AL, Aulisio MP, Davis FD, Erwin C, Harter TD, Jagsi R, et al. (July 2020). «Ethical Challenges Arising in the COVID-19 Pandemic: An Overview from the Association of Bioethics Program Directors (ABPD) Task Force». The American Journal of Bioethics. 20 (7): 15–27. doi:10.1080/15265161.2020.1764138. PMID 32511078. S2CID 219552665.
- ^ Wenham C, Smith J, Morgan R (March 2020). «COVID-19: the gendered impacts of the outbreak». Lancet. 395 (10227): 846–848. doi:10.1016/S0140-6736(20)30526-2. PMC 7124625. PMID 32151325.
- ^ Tolchin B, Hull SC, Kraschel K (October 2020). «Triage and justice in an unjust pandemic: ethical allocation of scarce medical resources in the setting of racial and socioeconomic disparities». Journal of Medical Ethics. 47 (3): 200–202. doi:10.1136/medethics-2020-106457. PMID 33067315. S2CID 223558059.
- ^ Sabatello M, Burke TB, McDonald KE, Appelbaum PS (October 2020). «Disability, Ethics, and Health Care in the COVID-19 Pandemic». American Journal of Public Health. 110 (10): 1523–1527. doi:10.2105/AJPH.2020.305837. PMC 7483109. PMID 32816541.
- ^ Chin T, Kahn R, Li R, Chen JT, Krieger N, Buckee CO, et al. (September 2020). «US-county level variation in intersecting individual, household and community characteristics relevant to COVID-19 and planning an equitable response: a cross-sectional analysis». BMJ Open. 10 (9): e039886. doi:10.1136/bmjopen-2020-039886. PMC 7467554. PMID 32873684.
- ^ Elgar FJ, Stefaniak A, Wohl MJ (October 2020). «The trouble with trust: Time-series analysis of social capital, income inequality, and COVID-19 deaths in 84 countries». Social Science & Medicine. 263: 113365. doi:10.1016/j.socscimed.2020.113365. PMC 7492158. PMID 32981770.
- ^ Uttley H (2 March 2021). «Pandemic sends demand for cold and flu remedies to record low». The Telegraph. Archived from the original on 10 January 2022. Retrieved 28 March 2021.
- ^ «2020–2021 Flu Season Summary». U.S. Centers for Disease Control and Prevention (CDC). 25 October 2021. Retrieved 31 July 2022.
Further reading
- Erola Pairo-Castineira; Sara Clohisey; Lucija Klarić; et al. (11 December 2020). «Genetic mechanisms of critical illness in Covid-19». Nature. doi:10.1038/S41586-020-03065-Y. ISSN 1476-4687. PMID 33307546. Wikidata Q104287299. Scholia Q104287299.
- «Progress report on the coronavirus pandemic». Nature. 584 (7821): 325. 1 August 2020. doi:10.1038/D41586-020-02414-1. ISSN 1476-4687. PMID 32814893. Wikidata Q98568681.
- COVID-19 infection prevention and control measures for primary care, including general practitioner practices, dental clinics and pharmacy settings: first update. European Centre for Disease Prevention and Control (ECDC) (Report). October 2020.
External links
Health agencies
- Coronavirus disease (COVID‑19) Facts by the World Health Organization (WHO)
- Coronavirus 2019 (COVID-19) by the US Centers for Disease Control and Prevention (CDC)
- Coronavirus (COVID‑19) by the UK National Health Service (NHS)
Directories
- Coronavirus Resource Center at the Center for Inquiry
- COVID-19 at Curlie
- COVID‑19 Resource Directory on OpenMD
- COVID‑19 Information on FireMountain.net Archived 13 January 2022 at the Wayback Machine
Medical journals
- Coronavirus Disease 2019 (COVID‑19) by JAMA
- BMJ’s Coronavirus (covid‑19) Hub by the BMJ
- Novel Coronavirus Information Center by Elsevier
- COVID‑19 Resource Centre by The Lancet
- Coronavirus (COVID‑19) Research Highlights by Springer Nature
- Coronavirus (Covid‑19) by The New England Journal of Medicine
- Covid‑19: Novel Coronavirus Archived 24 September 2020 at the Wayback Machine by Wiley Publishing
Treatment guidelines
- «JHMI Clinical Recommendations for Available Pharmacologic Therapies for COVID-19» (PDF). Johns Hopkins Medicine.
- «Bouncing Back From COVID-19: Your Guide to Restoring Movement» (PDF). Johns Hopkins Medicine.
- «Guidelines on the Treatment and Management of Patients with COVID-19». Infectious Diseases Society of America.
- «Coronavirus Disease 2019 (COVID-19) Treatment Guidelines» (PDF). National Institutes of Health.
- World Health Organization (2022). Therapeutics and COVID-19: living guideline, 14 January 2022 (Report). hdl:10665/351006. WHO/2019-nCoV/therapeutics/2022.1.
- NHS England and NHS Improvement. National Guidance for post-COVID syndrome assessment clinics (Report).
Как правильно писать коронавирусную инфекцию, что такое карантикулы и прочие производственные слова о пандемии – в новом материале «Шпаргалок «Петербургского дневника»
– Ты сегодня в школу идешь?
– Нет, у меня карантикулы. Пойду зумить, – так может выглядеть диалог в обычной петербургской семье во время пандемии. Коронавирус подарил нам огромное количество неологизмов – дистант, ковидиот и даже… ковидаст. «Петербургский дневник» узнал значение новых слов, а также проверил, можно ли писать КОВИД, а не COVID.
СЛОВАРЬ МОЛЧИТ
Русский орфографический словарь под редакцией Владимира Лопатина зафиксировал в 2015 году правильное написание слова «коронавирус» – через «о» и без дефиса. Правда, что делать с COVID, пока непонятно: аббревиатуру, а также производное от нее «ковидный» словарь пока не фиксирует.
Профессор кафедры журналистики и медиакоммуникаций СЗИУ РАНХиГС, доктор филологических наук Олеся Глущенко советует обращаться к официальным документам – если слова нет в словаре, правильное написание подскажут законы и постановления правительства.
«Выражения, связанные с COVID, для языка пока новые. А раз они новые, то они в слабой степени регулируются письменными нормами, – объясняет читателям «ПД» Олеся Глущенко. – Как в нормативных документах употребляется, так и считается правильным. Например, в законах Санкт-Петербурга используется такое составное наименование – «новая коронавирусная инфекция» (COVID-19). Это обозначение самое правильное, такое наименование мы встретим в официальных документах».
В различных документах более низкого уровня можно встретить и другие варианты.
«Например, выражение «коронавирусная инфекция» или просто «коронавирус». Получается, что эти три выражения можно употреблять как синонимы. Но приоритет определяется уровнем документа», – говорит эксперт.
В деловой устной коммуникации можно встретить «заразу» как синоним коронавируса. «Например, в интервью президента COVID обозначается как «COVID-инфекция», «коронавирусная инфекция» и экспрессивный контекстуальный синоним «зараза» и «коварная зараза».
По словам эксперта, слово уже вошло в язык и обросло системными связями, то есть подарило новые слова. «Пока это происходит в разговорной речи. В профессиональном жаргоне врачей мы слышим «коронавирусники», «антикоронавирусные меры» и прочие вещи».
Можем ли мы писать «КОВИД» и «КОВИД-19»? «В начале коронавирусных мер, в марте, были следующие рекомендации: соблюдать латинскую графику – COVID-19. Если и писать в русской графике, то прописными буквами – КОВИД-19», – рассказала Олеся Глущенко.
ЗУМИТЬ И КОВИДСТВОВАТЬ
Благодаря онлайн-обучению во время пандемии язык обогатился неологизмами. Например, если занятия проходят через онлайн-платформу Zoom, значит, школьник или студент пошел зумить, то есть учиться. «Я слышала слово «ковидствует», которое означает «без основания уходить на дистант». У него есть уже и производные, например, «ковидничать». Я слышала его в таком контексте: «Пойдешь на пары?», а студент отвечает: «Нет, буду ковидничать».
Кстати, когда студент работает онлайн в Zoom или Microsoft Teams, он следит за речью, поэтому вся экспрессивная речь выходит за официальное поле. Из новенького в молодежном жаргоне появились производные от этих платформ. Например, Moodle и «мудлить» или Zoom и «зумить», – отметила в беседе с «ПД» доктор филологических наук.
«Однозначного ответа, как писать, пока нет. В словарях это еще не отражено, – рассказала «Петербургскому дневнику» учительница русского языка Татьяна Гартман, известная в Сети как блогер «Училка». – Поскольку слово уже прочно вошло в русский язык, мне кажется, что вполне нормально, если мы начнем писать его русскими буквами, не переходя на латиницу. Просто КОВИД и все».
Во время пандемии учительница-блогер даже начала вести «коронавирусный словарик». «Мое любимое слово – «карантикулы»! Оно распространено у школьников. Мне это слово очень понравилось, поскольку сейчас как раз у нас в Нижнем Новгороде идут карантикулы.
Карантикулы – это не каникулы, которые должны идти по обычному школьному расписанию, а те, что появились в связи с пандемией. Таких слов довольно много, поскольку язык очень быстро реагирует на такие процессы, особенно когда речь идет о животрепещущей теме, которая касается всех и каждого. У меня есть целый список таких слов. Например, появилось слово «дистант». «Дистанционка» – слово просторечное, разговорное, поэтому в некоторых документах можно встретить «дистант» как обозначение дистанционного образования. Zoom-вечеринка и онлайн-вечеринка. Есть и шуточные: ковидор – это коридор в больнице, где расположились люди, заболевшие COVID-19 и которым не хватило места в палатах. Карантини – алкогольный напиток, ковидарий – специально построенная больница для работы с коронавирусными больными. Ковидаст – человек, воспользовавшийся пандемией для личного обогащения. Ководоворс – это развод или разрыв отношений из-за невозможности долго жить вместе в одной квартире».
КАК ДОКТОР ПРОПИСАЛ
Врач и писатель Максим Осипов «прописал» читателям «Петербургского дневника» писать COVID, хотя сам он с таким наименованием не до конца согласен.
«COVID – это изначально неправильно, правильно было бы писать КОВИЗ или коронавирусное заболевание. Но поскольку это уже вошло в язык, никакой КОВИЗ не сработает. В начале пандемии, когда переводил памятки, я сам писал КОВИЗ-19, но сейчас перешел на COVID. Такое бывает. В конце концов, мы пишем НАТО, а расшифровывается это как «северо-американский атлантический блок». Думаю, ничего уже с этим не сделать и надо оставить COVID, можно даже русскими буквами – КОВИД, потому что норма меняется. В свое время Даниил Хармс говорил, что сажал бы в тюрьму людей за то, что они говорят «метро» вместо «метрополитен». Теперь метро – слово совершенно естественное», – считает Максим Осипов.
А вот любимых слов, связанных с коронавирусом, в личном словаре доктора нет. «Человек я довольно консервативный, и новые слова с трудом входят в мой обиход. Может быть, COVID-диссиденты – так в Сети называют людей, отрицающих существование коронавируса».
По мнению писателя, пандемия подарила авторам новый виток творчества, который только набирает обороты. «Я сам написал несколько коротких историй, которые называются «Письма счастья-2020». Они опубликованы в журнале «Знамя» в июне этого года. Так что я сам откликнулся на это», – рассказал «Петербургскому дневнику» Максим Осипов.
КОРОНАВИРУС В РУКАХ НАРОДНЫХ УМЕЛЬЦЕВ
«Лучше бы этого слова и вовсе не было, – сокрушается в беседе с «Петербургским дневником» писатель Илья Бояшов. – Как правильно писать? С большой буквы русскими буквами – Ковид-19. По крайней мере, так считаю я. Дождемся словарей, они разъяснят».
Кстати, слова, связанные с коронавирусом, Бояшов в принципе не любит. «Вы знаете, все эти новые словечки для меня нелюбимые, честно вам признаюсь. Фаворитов я точно не найду. Меня вообще удивляет количество иностранных слов в русской речи. Например, «лайк», «лайкнул» и «лайканул». Я не сомневаюсь: народные умельцы придумают что-нибудь еще. Живой язык впитывает новые слова», – уверен писатель.
ВОДОЛАЗКИН В «КОРОННОМ НОМЕРЕ»
Писатель и литературовед Евгений Водолазкин советует читателям «ПД» определиться самостоятельно, как им лучше писать COVID. По его словам, аббревиатура в скором времени «русифицируется» окончательно.
«К этому процессу надо подходить в его развитии. Наиболее правильная форма, на мой взгляд, писать латиницей. Это можно сказать, безупречный вариант. Но если учитывать, что все попадающие к нам обозначения рано или поздно русифицируются, можно переходить на русское написание, криминалом это не будет», – считает Евгений Водолазкин.
Также он поделился с «ПД» забавным словосочетанием, появившимся в пандемию.
«Я публиковался в одном журнале, редактор которого посвятил отдельный выпуск пандемии коронавируса и назвал этот выпуск «коронный номер». Кстати, уже начали выходить рассказы и романы о пандемии. В частности, свою пьесу «Сестра четырех» я написал еще в апреле, когда пандемия только начиналась. Я думаю, коронавирус становится очень важной темой для литературы, поскольку событие это беспрецедентное, и я убежден, что литература и искусство на него откликнутся».
Объявлены официальные наименования вируса, вызывающего заболевание COVID‑19 (ранее известный как «новый коронавирус 2019 г.»), и соответствующего заболевания. Официальные наименования:
Заболевание
коронавирусная инфекция
(COVID-19)
Вирус
коронавирус тяжелого острого респираторного синдрома‑2
(SARS-CoV-2)
Почему заболевание и вирус по-разному называются?
Нередко наименования вирусов и вызываемых ими заболеваний не совпадают. Например, вирус ВИЧ вызывает СПИД. Людям часто бывает известно наименование заболевания, например, «корь», а не соответствующего вируса (rubeola).
Присвоение названий вирусам и заболеваниям происходит различным образом и для различных целей.
Наименования вирусов основаны на их генетической структуре, что упрощает разработку диагностических тестов, вакцин и лекарственных препаратов. Эту работу проводят вирусологи и другие представители научной общественности, поэтому наименования вирусам присваивает Международный комитет по таксономии вирусов (ICTV).
Наименования заболеваний требуются для того, чтобы давать характеристику различным аспектам профилактики, распространения, передачи, тяжести течения, а также лечения заболеваний. Задачей ВОЗ является обеспечение готовности и реагирования на заболевания человека, в связи с чем ВОЗ указывает официальные наименования заболеваний в Международной классификации болезней (МКБ).
Одиннадцатого февраля 2020 г. Международный комитет по таксономии вирусов присвоил новому вирусу наименование SARS-CoV-2 (коронавирус тяжелого острого респираторного синдрома‑2). Данное название выбрано по причине того, что этот вирус имеет генетическое родство с возбудителем вспышки ТОРС в 2003 г. Это разные вирусы, хотя они и связаны генетически.
Согласно рекомендациям, разработанным ранее совместно со Всемирной организацией по охране здоровья животных (МЭБ), а также Продовольственной и сельскохозяйственной организацией Объединенных Наций (ФАО), 11 февраля 2020 г. ВОЗ объявила о присвоении данному заболеванию названия «COVID‑19».
- Выступление Генерального директора ВОЗ на пресс-брифинге 11 февраля 2020 г.
- Доклад ВОЗ о текущем положении дел, 11 февраля 2020 г. – на английском языке
Работа по присвоению названий вирусу и заболеванию проходила на фоне тесного сотрудничества ВОЗ и Международного комитета по таксономии вирусов.
Каким наименованием этого вируса пользуется ВОЗ?
С точки зрения информирования о рисках использование наименования «ТОРС» может повлечь за собой неоправданные последствия в смысле создания тревожных настроений в некоторых группах населения, в особенности, в Азии, регионе, больше всего пострадавшем от вспышки ТОРС в 2003 г.
По этой и другим причинам ВОЗ приняла решение в публичной сфере называть вирус «вирусом, вызывающим COVID‑19» или «коронавирусной инфекцией COVID‑19». Ни одно из этих наименований не заменяет официального названия вируса, присвоенного Международным комитетом по таксономии вирусов.
Во избежание несогласованности за исключением необходимых случаев в материалы, опубликованные до момента присвоения вирусу официального названия, изменений вноситься не будет.
Дополнительная информация:
- Как присваивают названия инфекционным болезням? – на английском языке
- Подробнее о коронавирусной инфекции COVID-2019
- Пресс брифинги ВОЗ по COVID-2019 – на английском языке
- Международная классификация болезней – на английском языке
- Международный комитет по таксономии вирусов – на английском языке
Утратил силу — Архив
Версия: Клинические рекомендации РФ 2018-2020 (Россия)
Категории МКБ:
Другие уточненные вирусные болезни (B33.8), Изоляция (Z29.0), Контакт с больным и возможность заражения другими инфекционными болезнями (Z20.8), Коронавирус COVID-19, вирус идентифицирован (U07.1), Коронавирус COVID-19, вирус не идентифицирован (U07.2), Коронавирусная инфекция неуточненная (B34.2), Наблюдение при подозрении на другие болезни или состояния (Z03.8), Носительство возбудителя другой инфекционной болезни (Z22.8), Специальное скрининговое обследование с целью выявления других вирусных болезней (Z11.5)
Разделы медицины:
Инфекционные болезни у детей, Инфекционные и паразитарные болезни
Общая информация
Краткое описание
Утверждаю
Заместитель Министра здравоохранения
Российской Федерации
Е.Г. КАМКИН
ВРЕМЕННЫЕ МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПРОФИЛАКТИКА, ДИАГНОСТИКА И ЛЕЧЕНИЕ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ (COVID-19)
ВЕРСИЯ 6 (28.04.2020)
ВВЕДЕНИЕ
В конце 2019 года в Китайской Народной Республике (КНР) произошла вспышка новой коронавирусной инфекции с эпицентром в городе Ухань (провинция Хубэй), возбудителю которой было дано временное название 2019-nCoV.
Всемирная организация здравоохранения (ВОЗ) 11 февраля 2020 г. присвоила официальное название инфекции, вызванной новым коронавирусом, — COVID-19 («Coronavirus disease 2019»). Международный комитет по таксономии вирусов 11 февраля 2020 г. присвоил официальное название возбудителю инфекции — SARS-CoV-2.
Появление COVID-19 поставило перед специалистами здравоохранения задачи, связанные с быстрой диагностикой и оказанием медицинской помощи больным. В настоящее время сведения об эпидемиологии, клинических особенностях, профилактике и лечении этого заболевания ограничены. Известно, что наиболее распространенным клиническим проявлением нового варианта коронавирусной инфекции является двусторонняя пневмония, у 3 — 4% пациентов зарегистрировано развитие острого респираторного дистресс-синдрома (ОРДС).
Рекомендации, представленные в документе, в значительной степени базируются на материалах по диагностике, профилактике и лечению COVID-19, опубликованных специалистами ВОЗ, китайского, американского и европейского центров по контролю за заболеваемостью, анализе отечественных и зарубежных научных публикаций, нормативно-правовых документах Минздрава России и Роспотребнадзора.
Методические рекомендации предназначены для руководителей медицинских организаций и их структурных подразделений, врачей-терапевтов, врачей общей практики, врачей-инфекционистов, врачей-педиатров, врачей-акушеров-гинекологов, врачей-реаниматологов отделений интенсивной терапии инфекционных стационаров, врачей скорой медицинской помощи, а также иных специалистов, работающих в сфере организации оказания медицинской помощи пациентам с COVID-19.
Этиология и патогенез
ЭТИОЛОГИЯ, ПАТОГЕНЕЗ И ПАТОМОРФОЛОГИЯ
Коронавирусы (Coronaviridae) — это большое семейство РНК-содержащих вирусов, способных инфицировать человека и некоторых животных. У людей коронавирусы могут вызвать целый ряд заболеваний — от легких форм острой респираторной инфекции до тяжелого острого респираторного синдрома (ТОРС). В настоящее время известно о циркуляции среди населения четырех коронавирусов (HCoV-229E, -OC43, -NL63 и -HKU1), которые круглогодично присутствуют в структуре ОРВИ, и, как правило, вызывают поражение верхних дыхательных путей легкой и средней степени тяжести.
По результатам серологического и филогенетического анализа коронавирусы разделяются на четыре рода: Alphacoronavirus, Betacoronavirus, Gammacoronavirus и Deltacoronavirus. Естественными хозяевами большинства из известных в настоящее время коронавирусов являются млекопитающие.
До 2002 г. коронавирусы рассматривались в качестве агентов, вызывающих нетяжелые заболевания верхних дыхательных путей (с крайне редкими летальными исходами). В конце 2002 г. появился коронавирус (SARS-CoV), возбудитель атипичной пневмонии, который вызывал ТОРС у людей. Данный вирус относится к роду Betacoronavirus. Природным резервуаром SARS-CoV служат летучие мыши, промежуточные хозяева — верблюды и гималайские циветты. Всего за период эпидемии в 37 странах по миру было зарегистрировано более 8000 случаев, из них 774 со смертельным исходом. С 2004 г. новых случаев атипичной пневмонии, вызванной SARSCoV, не зарегистрировано.
В 2012 г. мир столкнулся с новым коронавирусом MERS (MERS-CoV), возбудителем ближневосточного респираторного синдрома, также принадлежащим к роду Betacoronavirus. Основным природным резервуаром коронавирусов MERS-CoV являются одногорбые верблюды (дромадеры). С 2012 г. по 31 января 2020 г. зарегистрировано 2519 случаев коронавирусной инфекции, вызванной вирусом MERS-CoV, из которых 866 закончились летальным исходом. Все случаи заболевания географически ассоциированы с Аравийским полуостровом (82% случаев зарегистрированы в Саудовской Аравии). В настоящий момент MERS-CoV продолжает циркулировать и вызывать новые случаи заболевания.
Новый коронавирус SARS-CoV-2 представляет собой одноцепочечный РНК-содержащий вирус, относится к семейству Coronaviridae, относится к линии Beta-CoV B. Вирус отнесен ко II группе патогенности, как и некоторые другие представители этого семейства (вирус SARS-CoV, MERS-CoV).
Коронавирус SARS-CoV-2 предположительно является рекомбинантным вирусом между коронавирусом летучих мышей и неизвестным по происхождению коронавирусом. Генетическая последовательность SARSCoV-2 сходна с последовательностью SARS-CoV по меньшей мере на 79%.
Входные ворота возбудителя — эпителий верхних дыхательных путей и эпителиоциты желудка и кишечника. Начальным этапом заражения является проникновение SARS-CoV-2 в клетки-мишени, имеющие рецепторы ангиотензинпревращающего фермента II типа (ACE2). Рецепторы ACE2 представлены на клетках дыхательного тракта, почек, пищевода, мочевого пузыря, подвздошной кишки, сердца, ЦНС. Однако основной и быстро достижимой мишенью являются альвеолярные клетки II типа (AT2) легких, что определяет развитие пневмонии. Также обсуждается роль CD147 в инвазии клеток SARS-CoV-2.
Установлено, что диссеминация SARS-CoV-2 из системного кровотока или через пластинку решетчатой кости (Lamina cribrosa) может привести к поражению головного мозга. Изменение обоняния (гипосмия) у больного на ранней стадии заболевания может свидетельствовать как о поражении ЦНС, так и об отеке слизистой оболочки носоглотки.
Многие аспекты патогенеза коронавирусной инфекции нуждаются в дальнейшем комплексном изучении.
Эпидемиология
ЭПИДЕМИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА
С декабря 2019 г. по март 2020 г. наиболее широкое распространение SARS-CoV-2 получил на территории КНР, в которой подтвержденные случаи заболевания были зарегистрированы во всех административных образованиях. Наибольшее количество заболевших выявлено в Юго-Восточной части КНР с эпицентром в провинции Хубэй (84% от общего числа случаев в КНР).
С конца января 2020 г. во многих странах мира стали регистрироваться случаи заболевания COVID-19, преимущественно связанные с поездками в КНР. В конце февраля 2020 г. резко осложнилась эпидемиологическая обстановка по COVID-19 в Южной Корее, Иране и Италии, что в последующем привело к значительному росту числа случаев заболевания в других странах мира, связанных с поездками в эти страны. ВОЗ объявила 11 марта 2020 г. о начале пандемии COVID-19.
Основным источником инфекции является больной человек, в том числе находящийся в инкубационном периоде заболевания.
Передача инфекции осуществляется воздушно-капельным, воздушно-пылевым и контактным путями. Ведущим путем передачи SARS-CoV-2 является воздушно-капельный, который реализуется при кашле, чихании и разговоре на близком (менее 2 метров) расстоянии. Контактный путь передачи осуществляется во время рукопожатий и других видах непосредственного контакта с инфицированным человеком, а также через пищевые продукты, поверхности и предметы, контаминированные вирусом. Известно, что при комнатной температуре SARS-CoV-2 способен сохранять жизнеспособность на различных объектах окружающей среды в течение 3 суток.
По имеющимся научным данным возможен фекально-оральный механизм передачи вируса. РНК SARS-CoV-2 обнаруживалась при исследовании образцов фекалий больных. Нуклеокапсидный белок COVID-19 был обнаружен в цитоплазме эпителиальных клеток слюнных желез, желудка, двенадцатиперстной кишки и прямой кишки, мочевыводящих путей. Установлена роль COVID-19 как инфекции, связанной с оказанием медицинской помощи.
SARS-CoV-2 включен в перечень заболеваний, представляющих опасность для окружающих (постановление Правительства Российской Федерации от 31 января 2020 г. N 66).
Стандартное определение случая заболевания COVID-19
Подозрительный на COVID-19 случай
Клинические проявления острой респираторной инфекции (температура тела выше 37,5 °C и один или более из следующих признаков: кашель — сухой или со скудной мокротой, одышка, ощущение заложенности в грудной клетке, насыщение крови кислородом по данным пульсоксиметрии (SpO2) 95%, боль в горле, насморк и другие катаральные симптомы, слабость, головная боль, аносмия, диарея) при отсутствии других известных причин, которые объясняют клиническую картину вне зависимости от эпидемиологического анамнеза.
Вероятный (клинически подтвержденный) случай COVID-19
1. Клинические проявления острой респираторной инфекции (температура тела выше 37,5 °C и один или более признаков: кашель, сухой или со скудной мокротой, одышка, ощущение заложенности в грудной клетке, насыщение крови кислородом по данным пульсоксиметрии (SpO2) 95%, боль в горле, насморк и другие катаральные симптомы, слабость, головная боль, аносмия, диарея) при наличии хотя бы одного из эпидемиологических признаков:
— возвращение из зарубежной поездки за 14 дней до появления симптомов;
— наличие тесных контактов за последние 14 дней с лицом, находящимся под наблюдением по COVID-19, который в последующем заболел;
— наличие тесных контактов за последние 14 дней с лицом, у которого лабораторно подтвержден диагноз COVID-19;
— работа с лицами, у которых выявлен подозрительный или подтвержденный случай заболевания COVID-19.
2. Наличие клинических проявлений, указанных в п. 1, в сочетании с характерными изменениями в легких по данным компьютерной томографии или обзорной рентгенографии органов грудной клетки (см. Приложение 1 настоящих рекомендаций) вне зависимости от результатов однократного лабораторного исследования на наличие РНК SARS-CoV-2 и эпидемиологического анамнеза.
3. Наличие клинических проявлений (указаны в п. 1), в сочетании с характерными изменениями в легких по данным лучевых исследований (указаны в п. 2) при невозможности проведения лабораторного исследования на наличие РНК SARS-CoV-2.
Подтвержденный случай COVID-19
Положительный результат лабораторного исследования на наличие РНК SARS-CoV-2 с применением методов амплификации нуклеиновых кислот вне зависимости от клинических проявлений.
Другие случаи, требующие обследования на COVID-19.
При обращении в медицинские учреждения пациентов без признаков поражения дыхательной системы при наличии следующих данных эпидемиологического анамнеза:
— возвращение из зарубежной поездки за 14 дней до обращения;
— наличие тесных контактов за последние 14 дней с лицами, находящимися под наблюдением по инфекции, вызванной новым коронавирусом SARS-CoV-2, которые в последующем заболели;
— наличие тесных контактов за последние 14 дней с лицами, у которых лабораторно подтвержден диагноз COVID-19;
— работа с лицами, у которых выявлен подозрительный или подтвержденный случай заболевания COVID-19.
Для обеспечения достоверного статистического учета при наличии у пациента коронавирусной инфекции, или подозрения на нее, заключительный клинический диагноз должен быть сформулирован в соответствии с правилами МКБ-10.
В статистике заболеваемости в конце эпизода оказания медицинской помощи из нескольких имеющихся у пациента заболеваний должно быть выбрано только одно заболевание в качестве основного, на долю которого пришлась наибольшая часть использованных ресурсов (том 2, стр. 107).
Примеры формулировки диагнозов и кодирование COVID-19 по МКБ-10:
Пример 1.
Основное заболевание: Коронавирусная инфекция, вызванная COVID-19 (подтвержденная), среднетяжелая форма U07.1
Осложнения: внебольничная двусторонняя долевая пневмония
острый респираторный дистресс-синдром
дыхательная недостаточность
Сопутствующие заболевания: Постинфарктный кардиосклероз.
Артериальная гипертензия
Пример 2.
Основное заболевание: Подозрение на коронавирусную инфекцию, тяжелое течение U07.2
Осложнения: внебольничная двусторонняя бронхопневмония
дыхательная недостаточность
Сопутствующие заболевания: Сахарный диабет 2 типа с ангиопатией
Пример 3.
Основное заболевание: Контакт с больным коронавирусной инфекцией — Z20.8
Сопутствующие заболевания: Артериальная гипертензия
От правильности формулировки заключительного клинического диагноза зависит кодирование и выбор первоначальной причины смерти.
Примеры оформления медицинских свидетельств о смерти по МКБ-10:
Пример 1.
I а) отек легкого J81.X
б) долевая пневмония J18.1
в) Коронавирусная инфекция, вызванная COVID-10 U07.1
II Артериальная гипертензия I10.X
Сахарный диабет 2 типа с множественными осложнениями Е11.7
Пример 2.
I а) синдром респираторного расстройства J80.X
б) бронхопневмония J18.0
в) коронавирусная инфекция, неуточненная U07.2
II Рак дна желудка без метастазов C16.1
Артериальная гипертензия I10.X
Пример 3.
I а) долевая пневмония J18.1
б) коронавирусная инфекция, вызванная COVID-19 U07.2
в) Болезнь, вызванная ВИЧ, с проявлением множественных инфекций B20.7
II Артериальная гипертензия I10.X
Постинфарктный кардиосклероз I25.8
Кодирования статистической информации при наличии подозрения или установленного диагноза коронавирусной инфекции COVID-19 осуществляется в соответствии с нижеследующим порядком:
— U07.1 — Коронавирусная инфекция, вызванная вирусом COVID-19, вирус идентифицирован (подтвержден лабораторным тестированием независимо от тяжести клинических признаков или симптомов)
— U07.2 — Коронавирусная инфекция, вызванная вирусом COVID-19, вирус не идентифицирован (COVID-19 диагностируется клинически или эпидемиологически, но лабораторные исследования неубедительны или недоступны)
— Z03.8 — Наблюдение при подозрении на коронавирусную инфекцию
— Z22.8 — Носительство возбудителя коронавирусной инфекции
— Z20.8 — Контакт с больным коронавирусной инфекцией
— Z11.5 — Скрининговое обследование с целью выявления коронавирусной инфекции
— B34.2 — Коронавирусная инфекция неуточненная (кроме вызванной COVID-19)
— B33.8 — Коронавирусная инфекция уточненная (кроме вызванной COVID-19)
— Z29.0 — Изоляция
— При наличии пневмонии, вызванной COVID-19, рубрики J12 — J18 используются в качестве дополнительных кодов. При летальных исходах рубрики XXI класса МКБ-10 не используются.
Первичная медицинская документация (Талон пациента, получающего медицинскую помощь в амбулаторных условиях — форма N 025-1/у; Статистическая карта выбывшего из стационара — форма N 066/у) заполняется в установленном порядке. Дополнительные коды проставляются ручным способом в правом верхнем углу.
Клиническая картина
Cимптомы, течение
КЛИНИЧЕСКИЕ ОСОБЕННОСТИ КОРОНАВИРУСНОЙ ИНФЕКЦИИ
Инкубационный период составляет от 2 до 14 суток, в среднем 5 — 7 суток.
Для COVID-19 характерно наличие клинических симптомов острой респираторной вирусной инфекции:
— повышение температуры тела (> 90%);
— кашель (сухой или с небольшим количеством мокроты) в 80% случаев;
— одышка (55%);
— утомляемость (44%);
— ощущение заложенности в грудной клетке (> 20%).
Также могут отмечаться боль в горле, насморк, снижение обоняния и вкуса, признаки конъюнктивита.
Наиболее тяжелая одышка развивается к 6 — 8-му дню от момента инфицирования. Также установлено, что среди первых симптомов могут быть миалгия (11%), спутанность сознания (9%), головные боли (8%), кровохарканье (5%), диарея (3%), тошнота, рвота, сердцебиение. Данные симптомы в дебюте инфекции могут наблюдаться и при отсутствии повышения температуры тела.
Клинические варианты и проявления COVID-19:
— Острая респираторная вирусная инфекция (поражение только верхних отделов дыхательных путей);
— Пневмония без дыхательной недостаточности;
— Пневмония с ОДН;
— ОРДС;
— Сепсис;
— Септический (инфекционно-токсический) шок;
— Тромбозы;
— Тромбоэмболии.
Гипоксемия (снижение SpO2 менее 88%) развивается более чем у 30% пациентов.
Классификация COVID-19 по степени тяжести
Легкое течение
— Температура тела ниже 38 °C, кашель, слабость, боли в горле
— Отсутствие критериев среднетяжелого и тяжелого течения
Среднетяжелое течение
— Лихорадка выше 38 °C
— ЧДД более 22/мин
— Одышка при физических нагрузках
— Пневмония (подверженная с помощью КТ легких)
— SpO2 < 95%
— СРБ сыворотки крови более 10 мг/л
Тяжелое течение
— ЧДД более 30/мин
— SpO2 93%
— PaO2/FiO2 300 мм рт.ст.
— Прогрессирование изменений в легких, типичных для COVID-19 пневмонии (см. Приложение 1), по данным рентгенографии и/или КТ, в том числе увеличение распространенности выявленных изменений более чем на 25%, а также появление признаков других патологических состояний
— Снижение уровня сознания, ажитация
— Нестабильная гемодинамика (систолическое АД менее 90 мм рт.ст. или диастолическое АД менее 60 мм рт.ст., диурез менее 20 мл/час)
— Лактат артериальной крови > 2 ммоль/л
— qSOFA > 2 балла
Крайне тяжелое течение
— ОДН с необходимостью респираторной поддержки (инвазивная вентиляции легких)
— Септический шок
— Полиорганная недостаточность
У 80% пациентов заболевание протекает в легкой форме ОРВИ. Средний возраст пациентов в КНР составляет 51 год, наиболее тяжелые формы развивались у пациентов пожилого возраста (60 и более лет), среди заболевших пациентов часто отмечаются такие сопутствующие заболевания, как сахарный диабет (в 20%), артериальная гипертензия (в 15%), другие сердечно-сосудистые заболевания (15%).
Двадцать процентов подтвержденных случаев заболевания, зарегистрированных в КНР, были классифицированы органами здравоохранения КНР как тяжелые (15% тяжелых больных, 5% в критическом состоянии). При тяжелом течении часто наблюдались быстро прогрессирующее заболевание нижних дыхательных путей, пневмония, ОДН, ОРДС, сепсис и септический шок. В г. Ухань практически у всех пациентов с тяжелым течением заболевания зарегистрирована прогрессирующая ОДН: пневмония диагностируется у 100% больных, а ОРДС — более чем у 90% больных.
Диагностика
ДИАГНОСТИКА КОРОНАВИРУСНОЙ ИНФЕКЦИИ
АЛГОРИТМ ОБСЛЕДОВАНИЯ ПАЦИЕНТА С ПОДОЗРЕНИЕМ НА COVID-19
При наличии факторов, свидетельствующих о случае, подозрительном на коронавирусную инфекцию, вызванную SARS-CoV-2, пациентам вне зависимости от вида оказания медицинской помощи проводится комплекс клинического обследования для определения степени тяжести состояния, включающий сбор анамнеза, физикальное обследование, исследование диагностического материала с применением методов амплификации нуклеиновых кислот, пульсоксиметрию.
По результатам проведенного комплекса клинического обследования решается вопрос о виде оказания медицинской помощи и объеме дополнительного обследования. Диагноз устанавливается на основании клинического обследования, данных эпидемиологического анамнеза и результатов лабораторных исследований.
1. Подробная оценка всех жалоб, анамнеза заболевания, эпидемиологического анамнеза.
При сборе эпидемиологического анамнеза устанавливается наличие зарубежных поездок за 14 дней до первых симптомов, а также наличие тесных контактов за последние 14 дней с лицами, подозрительными на инфицирование SARS-CoV-2, или лицами, у которых диагноз подтвержден лабораторно.
2. Физикальное обследование с установлением степени тяжести состояния пациента, обязательно включающее:
— оценку видимых слизистых оболочек верхних дыхательных путей,
— аускультацию и перкуссию легких,
— пальпацию лимфатических узлов,
— исследование органов брюшной полости с определением размеров печени и селезенки,
— термометрию,
— оценку уровня сознания,
— измерение частоты сердечных сокращений, артериального давления, частоты дыхательных движений.
— пульсоксиметрия с измерением SpO2 для выявления дыхательной недостаточности и оценки выраженности гипоксемии.
3. Лабораторная диагностика этиологическая:
— выявление РНК SARS-CoV-2 с применением методов амплификации нуклеиновых кислот (информация представлена в разделе 4.2). Инструкция по проведению этиологической лабораторной диагностики коронавирусной инфекции представлена в Приложении 3.
4. Лабораторная диагностика общая:
Общий (клинический) анализ крови с определением уровня эритроцитов, гематокрита, лейкоцитов, тромбоцитов, лейкоцитарной формулы.
Биохимический анализ крови (мочевина, креатинин, электролиты, печеночные ферменты, билирубин, глюкоза, альбумин, лактат, лактатдегидрогеназа тропонин, ферритин). Биохимический анализ крови не дает какой-либо специфической информации, но обнаруживаемые отклонения могут указывать на наличие органной дисфункции, декомпенсацию сопутствующих заболеваний и развитие осложнений, имеют определенное прогностическое значение, оказывают влияние на выбор лекарственных средств и/или режим их дозирования.
Исследование уровня СРБ в сыворотке крови. Уровень СРБ коррелирует с тяжестью течения, распространенностью воспалительной инфильтрации и прогнозом при пневмонии.
5. Инструментальная диагностика общая:
Пульсоксиметрия с измерением SpO2 для выявления дыхательной недостаточности и оценки выраженности гипоксемии. Пульсоксиметрия является простым и надежным скрининговым методом, позволяющим выявлять пациентов с гипоксемией, нуждающихся в респираторной поддержке и оценивать ее эффективность.
Пациентам с признаками острой дыхательной недостаточности (ОДН) (SрO2 менее 90%) рекомендуется исследование газов артериальной крови с определением PaO2, PaCO2, pH, бикарбонатов, лактата.
Пациентам с признаками ОДН рекомендуется выполнение коагулограммы с определением протромбинового времени, фибриногена, D-димера и активированного частичного тромбопластинового времени (АЧТВ).
Методы лучевой диагностики применяют для выявления COVID-19 пневмоний, их осложнений, дифференциальной диагностики с другими заболеваниями легких, а также для определения степени выраженности и динамики изменений, оценки эффективности проводимой терапии.
Лучевые методы также необходимы для выявления и оценки характера патологических изменений в других анатомических областях и как средства контроля для инвазивных (интервенционных) медицинских вмешательств.
К методам лучевой диагностики патологии органов грудной полости пациентов с предполагаемой/установленной COVID-19 пневмонией относят:
— обзорную рентгенографию легких (РГ),
— компьютерную томографию легких (КТ),
— ультразвуковое исследование легких и плевральных полостей (УЗИ).
Стандартная РГ имеет низкую чувствительность в выявлении начальных изменений в первые дни заболевания и не может применяться для ранней диагностики. Информативность РГ повышается с увеличением длительности течения пневмонии. Рентгенография с использованием передвижных (палатных) аппаратов является основным методом лучевой диагностики патологии органов грудной полости в отделениях реанимации и интенсивной терапии (ОРИТ).
Применение передвижного (палатного) аппарата оправдано и для проведения обычных РГ исследований в рентгеновском кабинете. Важным преимуществом РГ в сравнении с КТ являются большая пропускная способность и меньшее время для противоэпидемических мероприятий в кабинете. Метод позволяет уверенно выявлять тяжелые формы пневмоний и отек легких различной природы, которые требуют госпитализации, в том числе направления в отделение реанимации и интенсивной терапии.
КТ имеет максимальную чувствительность в выявлении изменений в легких, характерных для COVID-19 пневмонии. Применение КТ целесообразно для первичной оценки органов грудной полости у пациентов с тяжелыми прогрессирующими формами заболевания, а также для дифференциальной диагностики выявленных изменений и оценки динамики процесса. При КТ можно выявить характерные изменения в легких у пациентов с COVID-19 еще до появления положительных лабораторных тестов на инфекцию с помощью методов амплификации нуклеиновых кислот. В то же время, КТ выявляет изменения легких у значительного числа асимптомных лиц, инфицированных вирусом, и у больных с легкой формой заболевания, которым не требуются госпитализация.
Результаты КТ в этих случаях не влияют на тактику лечения и прогноз заболевания. Поэтому массовое применение КТ для скрининга асимптомных и легких форм болезни не рекомендуется.
Ограничениями КТ в сравнении с РГ являются меньшая доступность технологии в отдельных медицинских организациях, городах и регионах; недоступность исследования для части пациентов, находящихся на искусственной вентиляции легких (ИВЛ); необходимость проведения более сложных и длительных противоэпидемических мероприятий в кабинетах; необходимость обеспечения безопасности персонала; высокая потребность в КТ-исследованиях для диагностики других заболеваний.
В связи с этим КТ может быть исследованием «первой линии» в тех медицинских организациях/территориях и в тех клинических ситуациях, когда имеется достаточное количество аппаратов и есть кадровое обеспечение для выполнения требуемого объема исследований без ущерба для своевременной диагностики других болезней (онкологических, неврологических и т.д.) у наиболее нуждающихся в этом исследовании пациентов.
УЗИ легких у пациентов с предполагаемой/известной COVID-19 пневмонией является дополнительным методом визуализации, который не заменяет и не исключает проведение РГ и КТ. При соблюдении правильной методики, выборе правильных показаний и наличии подготовленного врачебного персонала это исследование отличается высокой чувствительностью в выявлении интерстициальных изменений и консолидаций в легочной ткани, но только при субплевральном их расположении. Данные УЗИ не позволяют однозначно определить причину возникновения и/или действительную распространенность изменений в легочной ткани.
Следует учитывать, что УЗИ не является стандартной процедурой в диагностике пневмоний, оно не включено в клинические рекомендации и стандарты оказания медицинской помощи по диагностике и лечению внебольничной пневмонии. В связи с этим результативность исследований в значительной степени зависит от имеющегося опыта и квалификации врача, проводящего исследование, в конкретном медицинском учреждении.
Рекомендации
1. Рекомендовано выбирать методы визуализации при известной/предполагаемой COVID-19 пневмонии дифференцированно, в соответствии с имеющимися оборудованием и кадровыми ресурсами медицинской организации, а также структурой и количеством обследуемых пациентов.
2. Не рекомендовано применение методов лучевой диагностики при отсутствии симптомов респираторной инфекции у пациентов с положительными результатами лабораторных исследований на РНК SARS-CoV-2, а также при наличии эпидемиологических данных, указывающих на возможность инфицирования.
Комментарии. В доступных на данный период времени клинических рекомендациях указано, что применение РГ, КТ и УЗИ для скрининга (выявления патологии при отсутствии клинических симптомов) внебольничных пневмоний в целом и при COVID-19 в частности не целесообразно.
3. Не рекомендовано применение РГ, КТ и УЗИ при наличии симптомов респираторной инфекции на амбулаторном этапе лечения COVID-19 при стабильном состоянии пациента и отсутствии признаков дыхательной недостаточности.
Комментарии. Применение лучевых методов у пациентов с симптомами ОРВИ возможно в отдельных случаях по конкретным клиническим показаниям и при наличии технических и организационных возможностей. Методом выбора в этом случае является КТ легких по стандартному протоколу без внутривенного контрастирования в амбулаторных условиях. Использование РГ и УЗИ в этих случаях не целесообразно.
4. Все выявляемые при лучевых исследованиях признаки, включая КТ-симптомы, не являются специфичными для какого-либо вида инфекции и не позволяют установить этиологический диагноз. Вне клинической (эпидемической) ситуации они не позволяют отнести выявленные изменения к COVID-19 пневмонии и дифференцировать их с другими пневмониями и не воспалительными заболеваниями. Результаты лучевого исследования не заменяют результаты на наличие РНК SARS-CoV-2. Отсутствие изменений при КТ не исключает наличие COVID-19 инфекции и возможность развития пневмонии после проведения исследования.
5. Рекомендовано проведение лучевого исследования пациентам при необходимости их госпитализации, с клинической картиной тяжелой респираторной инфекции, признаками дыхательной недостаточности:
— показано выполнение КТ легких по стандартному протоколу без внутривенного контрастирования в стационарных условиях;
— показано выполнение РГ легких в двух проекциях, если проведение КТ в данной медицинской организации/клинической ситуации невозможно.
Комментарии. Внутривенное контрастирование при КТ у пациентов с известной/предполагаемой COVID-19 пневмонией проводится при подозрении на заболевания и патологические состояния (ТЭЛА, онкологические заболевания др.), диагностика которых невозможна без использования контрастных средств. Решение о внутривенном контрастировании принимает врач-рентгенолог совместно с врачом, направляющим пациента на КТ. Введение контрастного средства выполняется в соответствии с общими правилами проведения рентгеноконтрастных исследований.
6. Рекомендовано проведение лучевого исследования пациентам с тяжелым и крайне тяжелым течением респираторной инфекции с прогрессирующей дыхательной недостаточностью и нестабильными показателями гемодинамики, требующим лечения в условиях отделения реанимации и интенсивной терапии:
— оптимально: выполнение экстренного КТ исследования легких по стандартному протоколу без внутривенного контрастирования, если возможна транспортировка пациента в кабинет КТ до отделения реанимации и интенсивной терапии;
— возможно: выполнение экстренной РГ легких в отделении реанимации/интенсивной терапии с использованием передвижного (палатного) аппарата;
— возможно: выполнение УЗИ легких и плевральных полостей по клиническим показаниям в дополнение к РГ или КТ.
Комментарии. Применение УЗИ легких как дополнительного исследования возможно только при наличии технических возможностей и подготовленного персонала, имеющего опыт проведения исследований легких. Данные УЗИ дополняют, но не заменяют РГ и КТ легких. Подробная информация о применении УЗИ легких при COVID-19 пневмонии размещена на сайте http://www.rasudm.org
7. Оценка динамики течения выявленной пневмонии COVID-19 проводится по клиническим показаниям с применением следующих методов визуализации:
— оптимально: выполнение КТ исследования легких по стандартному протоколу без внутривенного контрастирования;
— возможно: РГ в двух проекциях в рентгеновском кабинете;
— выполнение УЗИ легких (как дополнительное исследование) при невозможности оценки динамики с помощью КТ и РГ при условии наличия (1) первоначальной информации об истинном объеме и причине поражения легких и (2) подготовленного врачебного персонала.
Комментарии. Кратность повторения КТ, РГ или УЗИ зависит от клинических показаний, диктующих необходимость оценки динамики. Рекомендуемая кратность повторения для КТ и РГ — не реже, чем один раз в 7 дней.
Объективная оценка динамики возможна только при сопоставлении данных одного вида исследования, например, КТ или РГ. Сравнение визуальной картины пневмонии при использовании различных методов визуализации затруднено и, как правило, субъективно. Возможно использование УЗИ легких, но только при условии наличия (1) первоначальной информации об истинном объеме и причине поражения легких и (2) подготовленного врачебного персонала.
8. Оценка динамики пневмонии COVID-19 в отделениях реанимации и интенсивной терапии проводится по клиническим показаниям:
— оптимально: выполнение КТ исследования легких по стандартному протоколу без внутривенного контрастирования при наличии технической возможности транспортировки пациентов в кабинет КТ;
— возможно: выполнение РГ легких при возможности транспортировки пациентов в рентгеновский кабинет и при невозможности КТ;
— возможно: выполнение РГ с помощью передвижного (палатного) рентгеновского аппарата;
— выполнение УЗИ легких (как дополнительное исследование) при невозможности оценки динамики с помощью КТ и РГ при условии наличия (1) первоначальной информации об истинном объеме и причине поражения легких и (2) подготовленного врачебного персонала.
Комментарии: следует учитывать ограниченную информативность РГ в отделении реанимации и интенсивной терапии с использованием передвижного (палатного) рентгеновского аппарата, в том числе из-за обычной практики исследования в одной прямой проекции. Выполнение УЗИ легких и плевральных полостей может быть дополнительным исследованием при невозможности проведения КТ, которое выполняется по клиническим показаниям, и при наличии персонала, имеющего опыт проведения и интерпретации таких исследований.
9. Рекомендовано использовать специальные меры по ограничению доз облучения при обследовании беременных, новорожденных и детей младшего возраста при возможности развития у них COVID-19 пневмонии.
Комментарии. Обследование беременных женщин с известной/предполагаемой COVID-19 пневмонией осуществляется с использованием стандартных методик РГ, КТ. Необходимо использовать предустановленные программы по ограничению доз облучения, нужна защита радиочувствительных органов и плода (области живота и таза) с применением стандартных защитных средств (фартуки, воротники), имеющихся в кабинетах. При невозможности и отказе от проведения КТ и РГ применяется УЗИ легких при наличии подготовленного врачебного персонала.
Обследование новорожденных и детей младшего возраста с известной/предполагаемой COVID-19 пневмонией по возможности начинается с применения УЗИ легких, плевральных полостей и средостения, при наличии клинических показаний продолжается с использованием РГ и/или КТ органов грудной полости.
10. При наличии клинических показаний все указанные методы лучевой диагностики могут применяться для оценки состояния других анатомических областей и отдельных органов с целью выявления патологических изменений и оценки их динамики.
11. При всех лучевых исследованиях должны быть обеспечены эпидемическая безопасность и защита персонала и пациентов согласно временным рекомендациям МЗ РФ для работы медучреждений в условиях эпидемии COVID-19.
Комментарии. Основными компонентами защиты персонала являются зонирование кабинетов лучевой диагностики, ограничение контактов между потоками потенциально инфицированных и неинфицированных пациентов, ограничение контактов персонала отделения/кабинетов лучевой диагностики, сменная работа персонала, обязательное применение средств индивидуальной защиты.
Уборка помещений кабинетов РГ, КТ и УЗИ, стерилизация оборудования и мебели кабинетов выполняются согласно настоящим временным методическим рекомендациям МЗ РФ.
12. Работа кабинетов/отделений лучевой диагностики организуется в круглосуточном режиме (смены по 6, 12 или 24 часа в сутки в зависимости от штатного расписания и загрузки конкретного лечебного учреждения). Рекомендуется создание в медицинских организациях системы дистанционного описания изображений дежурными врачами-рентгенологами.
Комментарии. Возможны следующие модели работы кабинетов/отделений лучевой диагностики медицинской организации:
а. Врач-рентгенолог и рентгенолаборант (два рентгенолаборанта — в зависимости от их наличия и клинической потребности) проводят исследования в кабинете КТ или РГ, имея контакт с потенциально инфицированными пациентами. Персонал одет в комплекты СИЗ согласно настоящим временным методическим рекомендациям МЗ РФ. Другие врачи (их число зависит от нагрузки и потребности в описаниях исследований) работают дистанционно в «чистой» зоне.
б. Рентгенолаборант (два рентгенолаборанта — в зависимости от их наличия и клинической потребности) проводит исследования в кабинете КТ или РГ, имея контакт с потенциально инфицированными пациентами. Персонал одет в комплекты СИЗ согласно настоящим временным рекомендациям МЗ РФ. Дежурные врачи (их число зависит от нагрузки и потребности в описаниях исследований) работают дистанционно в «чистой» зоне. При необходимости дежурный врач-рентгенолог надевает комплект СИЗ и перемещается в диагностический кабинет — потенциально инфицированную зону.
в. Врачи ультразвуковой диагностики проводят исследования, имея непосредственный контакт с инфицированными и потенциально инфицированными пациентами. Рекомендовано использование комплектов СИЗ согласно настоящим временным методическим рекомендациям МЗ РФ.
13. Рекомендации по формированию описаний и оценке изменений в легких и органах грудной полости при имеющейся/подозреваемой COVID-19 пневмонии представлены в Приложении 1.
Электрокардиография (ЭКГ) в стандартных отведениях рекомендуется всем пациентам. Данное исследование не несет в себе какой-либо специфической информации, однако в настоящее время известно, что вирусная инфекция и пневмония помимо декомпенсации хронических сопутствующих заболеваний увеличивают риск развития нарушений ритма и острого коронарного синдрома, своевременное выявление которых значимо влияет на прогноз. Кроме того, определенные изменения на ЭКГ (например, удлинение интервала QT) требуют внимания при оценке кардиотоксичности ряда антибактериальных препаратов (респираторные фторхинолоны, макролиды), противомалярийных препаратов, применяемых в настоящее время в качестве этиотропных препаратов для лечения COVID-19).
Решение о необходимости госпитализации пациента принимается врачом на основании комплекса клинико-эпидемиологических данных с учетом тяжести состояния пациента (среднетяжелое/тяжелое течение заболевания) и требований, предусмотренных приказом Минздрава России от 19.03.2020 N 198н «О временном порядке организации работы медицинских организаций в целях реализации мер по профилактике и снижению рисков распространения новой коронавирусной инфекции COVID-19».
ЛАБОРАТОРНАЯ ДИАГНОСТИКА COVID-19
Лабораторное обследование на COVID-19 с применением методов амплификации нуклеиновых кислот в обязательном порядке проводится следующим категориям лиц:
1) Вернувшиеся на территорию Российской Федерации с признаками респираторных заболеваний;
2) Контактировавшие с больным COVID-2019;
3) С диагнозом «внебольничная пневмония»;
4) Старше 65 лет, обратившиеся за медицинской помощью с симптомами респираторного заболевания;
5) Медицинские работники, имеющие риски инфицирования COVID-2019 на рабочих местах, — 1 раз в неделю, а при появлении симптомов, не исключающих COVID-2019, — немедленно;
6) Находящиеся в учреждениях постоянного пребывания независимо от организационно-правовой формы (специальные учебно-воспитательные учреждения закрытого типа, кадетские корпуса, дома-интернаты, учреждения ФСИН России) и персонал таких организаций — при появлении симптомов респираторного заболевания.
Лабораторное обследование на COVID-19 также рекомендуется проводить всем лицам с признаками острой респираторной инфекции по назначению медицинского работника.
Выявление РНК SARS-CoV-2 с помощью методов амплификации нуклеиновых кислот имеет основное значение для лабораторной диагностики COVID-19. Перечень зарегистрированных в Российской Федерации диагностических наборов реагентов для выявления РНК SARS-CoV-2 представлен в Приложении 4.
Выявление иммуноглобулинов класса G к SARS-CoV-2 имеет вспомогательное значение для диагностики текущей инфекции. Исследования постинфекционного иммунитета показали, что у большинства пациентов с COVID-19 иммуноглобулины класса G выявляются через 10 — 12 дней после первых признаков заболевания. Однако метод иммуноферментного анализа и другие методы, которые позволяют обнаруживать иммуноглобулины класса G к SARS-CoV-2, имеют принципиально важное значение для установления факта перенесенной ранее инфекции. Зарегистрированный в Российской Федерации диагностический набор реагентов для выявления иммуноглобулинов к SARS-CoV-2 представлен в Приложении 5.
Основным видом биоматериала для лабораторного исследования является материал, полученный при заборе мазка из носоглотки и/или ротоглотки. В качестве дополнительного материала для исследования могут использоваться мокрота (при наличии), промывные воды бронхов, полученные при фибробронхоскопии (бронхоальвеолярный лаваж), (эндо)трахеальный, назофарингеальный аспират, биопсийный или аутопсийный материал легких, цельная кровь, сыворотка, фекалии.
Все образцы, полученные для лабораторного исследования, следует считать потенциально инфекционными, и при работе с ними должны соблюдаться требования СП 1.3.3118-13 «Безопасность работы с микроорганизмами I — II групп патогенности (опасности)». Медицинские работники, которые собирают или транспортируют клинические образцы в лабораторию, должны быть обучены практике безопасного обращения с биоматериалом, строго соблюдать меры предосторожности и использовать средства индивидуальной защиты (СИЗ).
Транспортировка образцов осуществляется с соблюдением требований СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I — IV групп патогенности». На сопровождающем формуляре необходимо указать наименование подозреваемой ОРИ, предварительно уведомив лабораторию о том, какой образец транспортируется. Транспортировка возможна на льду.
Лабораторная диагностика COVID-2019 в субъектах Российской Федерации может проводиться в лабораториях организаций, имеющих санитарно-эпидемиологическое заключение на работу с возбудителями III — IV группы патогенности с использованием методов диагностики, не предполагающих накопление возбудителя, соответствующие условия работы и обученный персонал.
В случае получения положительного результата на COVID-19 руководитель лаборатории медицинской организации обязан немедленно проинформировать ближайший территориальный орган Роспотребнадзора и передать материал в Центр гигиены и эпидемиологии в субъекте Российской Федерации.
Медицинские организации, выявившие случай заболевания COVID-19 (в т.ч. подозрительный), вносят информацию о нем в информационную систему (https://ncov.ncmbr.ru) в соответствии с письмом Минздрава России N 30-4/И/2-1198 от 07.02.2020.
Для проведения дифференциальной диагностики у всех заболевших проводят исследования с применением методов амплификации нуклеиновых кислот на возбудители респираторных инфекций: вирусы гриппа типа A и B, респираторно-синцитиальный вирус (РСВ), вирусы парагриппа, риновирусы, аденовирусы, человеческие метапневмовирусы, MERS-CoV. Обязательно проведение микробиологической диагностики (культуральное исследование) и/или ПЦР-диагностики на Streptococcus pneumoniae, Haemophilus influenzae type B, Legionella pneumophila, а также иные возбудители бактериальных респираторных инфекций нижних дыхательных путей. Для экспресс-диагностики могут использоваться экспресс-тесты по выявлению пневмококковой и легионеллезной антигенурии.
Дифференциальный диагноз
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА COVID-19
Необходимо дифференцировать новую коронавирусную инфекцию с гриппом, острыми вирусными инфекциями, вызываемыми вирусами из группы ОРВИ (риновирус, аденовирус, РС-вирус, человеческие метапневмовирусы, MERS-CoV, парагрипп), вирусными гастроэнтеритами, бактериальными возбудителями респираторных инфекций.
Длительность инкубационного периода COVID-19 может колебаться от 1 до 14 дней, однако в среднем составляет 5 дней, тогда как длительность инкубационного периода гриппа и ОРВИ, как правило, не превышает 3 дней. При гриппе заболевание начинается резко, при COVID-19 и ОРВИ, как правило, постепенно. Как при COVID-19, так и при гриппе может отмечаться высокая лихорадка, кашель, слабость. При течении ОРВИ высокая лихорадка, слабость встречаются редко. При этом при гриппе и ОРВИ одышка и затрудненное дыхание отмечаются значительно реже, чем при COVID-19.
При вирусных гастроэнтеритах ведущим будет поражение желудочно-кишечного тракта, симптомы поражения дыхательных путей, как правило, выражены минимально.
В целом при проведении дифференциальной диагностики необходимо учитывать данные эпидемиологического анамнеза, клинические симптомы и их динамику.
Во всех подозрительных случаях показано обследование на SARS-COV-2 и возбудителей других респираторных инфекций.
Лечение
ЛЕЧЕНИЕ КОРОНАВИРУСНОЙ ИНФЕКЦИИ
Основным подходом к терапии COVID-19 должно быть упреждающее назначение лечения до развития полного симпмтомокомплекса жизнеугрожающих состояний, а именно пневмония, ОРДС, сепсис.
Лечение COVID-19 в соответствии с протоколами настоящих рекомендаций проводится в подтвержденных и вероятных случаях заболевания.
В рамках оказания медицинской помощи необходим мониторинг состояния пациента для выявления признаков ухудшения его клинического состояния. Пациенты, инфицированные SARS-CoV-2, должны получать поддерживающую патогенетическую и симптоматическую терапию.
Лечение сопутствующих заболеваний и осложнений осуществляется в соответствии с клиническими рекомендациями, стандартами медицинской помощи по данным заболеваниям.
ЭТИОТРОПНОЕ ЛЕЧЕНИЕ
Анализ литературных данных по клиническому опыту ведения пациентов с атипичной пневмонией, связанной с коронавирусами SARS-CoV и MERS-CoV, позволяет выделить несколько этиотропных препаратов, которые рекомендовано использовать в комбинации. К ним относятся хлорохин, гидроксихлорохин, лопинавир+ритонавир, азитромицин (в комбинации с гидроксилорохином), препараты интерферонов.
Среди препаратов, которые находятся на стадии клинических испытаний у пациентов с COVID-19, можно отметить также умифеновир, ремдесивир, фавипиравир.
По опубликованным данным, указанные лекарственные препараты сегодня также могут применяться при лечении пациентов с COVID-19. Однако имеющиеся на сегодня сведения о результатах терапии данными препаратами не позволяют сделать однозначный вывод об их эффективности или неэффективности, в связи с чем их применение допустимо по решению врачебной комиссии в установленном порядке, в случае если потенциальная польза для пациента превысит риск их применения.
Среди препаратов, представляющихся перспективными для лечения COVID-19, следует отметить группу противомалярийных средств: хлорохин, гидроксихлорохин, мефлохин. Эти препараты используются для терапии малярии и некоторых других протозойных инфекций. Кроме того, в связи с противовоспалительным и иммуносупрессивным эффектом, хлорохин и гидроксихлорохин нашли свое применение в лечении пациентов с системными заболеваниями соединительной ткани, такими как ревматоидный артрит и красная волчанка. Механизм действия противомалярийных препаратов против некоторых вирусных инфекций изучен не до конца, в опубликованных данных отмечаются несколько вариантов их воздействия на COVID-19, которые препятствуют проникновению вируса в клетку и его репликации. В небольших клинических исследованиях было показано, что комбинация азитромицина с гидроксихлорохином усиливает противовирусный эффект последнего.
Перед назначением противомалярийных препаратов и во время приема этих препаратов следует уделить особое внимание результату ЭКГ, в частности, величине QT. Противомалярийные препараты обладают кардиотоксичностью, и их прием может сопровождаться развитием, например, синдрома удлиненного QT. Вопросы о назначении этих препаратов в случае измененной ЭКГ и о дальнейшей терапии в случае возникших на лечении изменений ЭКГ решаются строго индивидуально, в тесном взаимодействии с кардиологами.
Для контроля кардиотоксичности противомалярийных препаратов необходимо проведение инструментального и клинического мониторинга, в том числе интервала QT, у следующих групп пациентов с повышенным риском:
1. Мужчины старше 55 лет;
2. Женщины старше 65 лет;
3. Лица любого возраста, имеющие в анамнезе сердечно-сосудистые заболевания.
ЭКГ назначается перед началом лечения, контроль осуществляется 1 раз в 5 дней. Продолжительность интервала QT корригированного оценивается по формуле Bazett, она не должна превышать 480 мс. При достижении порогового значения по рекомендации врача-кардиолога индивидуально назначаются бета-адреноблокаторы (бисопролол, карведилол, небиволол, метопролол).
При появлении жалоб на аритмию, ощущение сердцебиения, боли и дискомфорт в области сердца, эпизоды слабости и головокружения, синкопальные состояния назначается внеочередное ЭКГ.
Для пациентов, не включенных в группы повышенного риска кардиотоксичности, проводится клинический мониторинг. При появлении жалоб назначается ЭКГ.
Комбинированный препарат лопинавир+ритонавир является ингибитором протеазы ВИЧ. В ранее проведенных исследованиях было показано, что он также способен подавлять активность протеазы коронавируса. Предполагаемый на основе компьютерных моделирований противовирусный механизм действия в отношении нового коронавируса связан с воздействием на основную протеазу SARS-CoV-2 (эндопептидаза C30, неструктурный протеин Nsp5). Данный препарат нашел свое применение в лечении инфекции MERS-CoV, и сегодня может быть использован для терапии инфекции, вызываемой новым коронавирусом SARS-CoV-2. Проведенное рандомизированное контролируемое исследование продемонстрировало, что монотерапия лопинавиром+ритонавиром заболевания, вызванных SARS-CoV-2, не сокращала сроки госпитализации и не демонстрировала большую эффективность, чем стандартная симптоматическая терапия. В связи с этим применение препарата в монотерапии может быть рекомендовано только при наличии противопоказаний к назначению хлорохина, гидроксихлорохина, мефлохина.
Интерферон бета-1b (ИФН-1b) обладает антипролиферативной, противовирусной и иммуномодулирующей активностью. В текущих клинических исследованиях инфекции MERS-CoV ИФН-1b используется в комбинации с лопинавир+ритонавир. Проведенные ранее in vitro исследования показали, что он проявляет максимальную активность в сравнении с другими вариантами интерферонов (ИФН-1a, ИФН1b и ИФН1a). За счет способности стимулировать синтез противовоспалительных цитокинов препараты ИФН-1b могут оказывать положительный патогенетический эффект.
Рекомбинантный интерферон альфа 2b (ИФН-2b) в виде раствора для интраназального введения обладает иммуномодулирующим, противовоспалительным и противовирусным действием. Механизм действия основан на предотвращении репликации вирусов, попадающих в организм через дыхательные пути.
Этиотропное лечение COVID-19, особенно у больных с сопутствующей патологией, требует внимания к возможным лекарственным взаимодействиям. Лекарственные препараты, которые запрещено или не желательно принимать с этиотропной терапией COVID-19, указаны в Приложении 6.1, 6.2.
Принимая во внимание сходство клинической картины легких форм COVID-19 с клинической картиной сезонных ОРВИ, до подтверждения этиологического диагноза в схемы терапии следует включать препараты, рекомендуемые для лечения сезонных ОРВИ, такие как интназальные формы интерферона альфа, препараты индукторов интерферона, а также противовирусные препараты с широким спектром активности, такие как умифеновир.
Перечень возможных к назначению лекарственных препаратов для этиотропной терапии COVID-19 у взрослых приведен в приложении 7. Рекомендованные схемы лечения в зависимости от тяжести заболевания приведены в приложении 10. Учитывая отсутствие объективных доказательств эффективности применения вышеуказанных препаратов при COVID-19, назначение лечения должно обязательно сопровождаться получением добровольного информированного согласия пациента (или его законного представителя).
Согласно рекомендациям ВОЗ, возможно назначение препаратов с предполагаемой этиотропной эффективностью «off-label» (то есть применение с медицинской целью не соответствует инструкции по медицинскому применению), при этом их применение должно соответствовать этическим нормам, рекомендованным ВОЗ, и осуществляться на основании Федерального закона от 21 ноября 2011 г. N 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», Федерального закона от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств», Национального стандарта Российской Федерации ГОСТ Р ИСО 14155-2014 «Надлежащая клиническая практика», приказа Министерства здравоохранения Российской Федерации от 1 апреля 2016 г. N 200н «Об утверждении правил надлежащей клинической практики» (зарегистрирован Министерством юстиции Российской Федерации 23 августа 2016 г., регистрационный N 43357), Хельсинкской декларации Всемирной медицинской ассоциации (ВМА) об этических принципах проведения исследований с участием человека в качестве субъекта, декларированных на 64-ой Генеральной ассамблее ВМА, Форталеза, Бразилия, 2013 г.
Вышеуказанная практика оценки целесообразности применения лекарственных препаратов вне показаний, указанных в инструкции по медицинскому применению, является общепризнанной в мире.
В текущих условиях распространения новой коронавирусной инфекции и ограниченности доказательной базы по лечению COVID-19, использование препаратов в режиме «off-label» для оказания медицинской помощи пациентам с COVID-19 базируется на международных рекомендациях, а также согласованных экспертных мнениях, основанных на оценке степени пользы и риска при использовании терапии в режиме «off-label».
Клиническое использование плазмы антиковидной, патогенредуцированной
Согласно рекомендациям ВОЗ <1>, применение плазмы антиковидной, патогенредуцированной, заготовленной от лица с подтвержденным случаем COVID-19 в стадии выздоровления (далее — антиковидная плазма), с целью лечения заболеваний, характеризующихся эпидемическими вспышками и отсутствием специфического лечения, основано на концепции пассивной иммунизации. По опубликованным данным, в КНР и других странах применялась плазма, полученная от доноров-реконвалесцентов COVID-19, что нашло отражение в национальных руководствах по лечению COVID-19.
———————————
<1> World Health Organization. WHO Blood Regulators Network (BRN) Position Paper on Use of Convalescent Plasma, Serum or Immune Globulin Concentrates as an Element in Response to an Emerging Virus* September 2017 https://www.who.int/bloodproducts/brn/2017_BRN_PositionPaper_ConvalescentPlasma.pdf
В настоящее время ведется разработка протоколов клинического применения антиковидной плазмы для практического здравоохранения, включая определение показаний и противопоказаний к ее использованию, порядок медицинского обследования донора и правил заготовки.
Клиническое использование антиковидной плазмы должно осуществляться в соответствии с требованиями установленными постановлением Правительства Российской Федерации от 22 июня 2019 г. N 797 «Об утверждении Правил заготовки, хранения, транспортировки и клинического использования донорской крови и ее компонентов и о признании утратившими силу некоторых актов Правительства Российской Федерации», приказом Министерства здравоохранения Российской Федерации от 2 апреля 2013 N 183н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов».
Этиотропное лечение беременных, рожениц и родильниц
Этиотропное лечение COVID-19 женщин в период беременности и кормления грудью в настоящее время не разработано. Рекомбинантный интерферон бета-1b, противомалярийные препараты противопоказаны к применению во время беременности. Однако в качестве этиотропной терапии возможно назначение противовирусных препаратов с учетом их эффективности против COVID-19 по жизненным показаниям. В остальных случаях следует учитывать их безопасность при беременности и в период грудного вскармливания.
Лечение должно быть начато как можно раньше, что в большей степени обеспечивает выздоровление. Противовирусные препараты беременным с тяжелым или прогрессирующим течением заболевания необходимо назначать и в более поздние сроки от начала заболевания.
При назначении противовирусных препаратов кормящим женщинам решение вопроса о продолжении грудного вскармливания зависит от тяжести состояния матери.
ПАТОГЕНЕТИЧЕСКОЕ ЛЕЧЕНИЕ
В патогенезе ОРДС вследствие COVID-19 основную роль играет избыточный ответ иммунной системы со стремительно развивающимся тяжелым жизнеугрожающим синдромом высвобождения цитокинов. Синдром высвобождения цитокинов создает угрозу возникновения и прогрессирования ОРДС, причем интервал времени между первым и вторым событием может составлять менее 1 суток. В этих условиях чрезвычайно важно начать упреждающую терапию, основными препаратами которой являются блокаторы ИЛ-6. К ним относятся тоцилизумаб и сарилумаб, которые хорошо известны как препараты для лечения ревматоидного артрита. При отсутствии данных препаратов необходимо по жизненным показаниям начать терапию глюкокортикостероидами (ГКС). Кроме того, при среднетяжелых формах пневмоний с целью подавления гипервоспаления и развития серьезных поражений легких и других органов, обусловленных COVID-19, можно рассматривать назначение таблетированного препарата барицитиниб (относится к группе ингибиторов янус-киназ) в качестве дополнительной терапии.
Условиями для назначения упреждающей противовоспалительной терапии являются сочетание данных КТ ОГК: значительный объем уплотненной легочной ткани/распространенность 50 — 75% объема легких (КТ3) с 2-мя и более признаками
— снижение SpO2,
— СРБ > 60 мг/л или рост уровня СРБ в 3 раза на 8 — 14 дни заболевания,
— лихорадки > 38,0 °C в течение 5 дней,
— лейкоциты < 3,0 — 3,5 * 109/л,
— лимфоциты < 1 * 109/л и/или < 15%.
При наличии лабораторной возможности определения уровня ИЛ-6 упреждающая противовоспалительная терапия должна быть начата при значении > 40 пк/мл. Другим лабораторным ориентиром может служить уровень ферритина крови (> 1000 нг/мл).
Противопоказаниями для назначения ингибиторов рецепторов ИЛ-6 являются:
— сепсис, подтвержденный патогенами, отличными от COVID-19;
— вирусный гепатит В;
— сопутствующие заболевания, связанные, согласно клиническому решению, с неблагоприятным прогнозом;
— иммуносупрессивная терапия при трансплантации органов;
— нейтропения составляет < 0,5 * 109/л;
— повышение активности АСТ или АЛТ более чем в 5 раз превышает верхнюю границу нормы;
— тромбоцитопения < 50 * 109/л.
При туберкулезе ингибиторы рецепторов ИЛ-6 назначаются с осторожностью после консультации с фтизиатром.
Препараты для упреждающей противовоспалительной терапии представлены в Приложении 8.
В целом стероидная терапия, по-видимому, не добавляет преимуществ в отношении клинического исхода при лечении инфекции COVID-19. Напротив, терапия ГКС может замедлить выведение вируса. Однако у пациентов с подтвержденной ОРДС без инфекции COVID-19 описана польза от применения низких доз дексаметазона в течение ограниченного периода в значительном снижении смертности. И хотя это косвенное доказательство, представляется целесообразным рассматривать применение дексаметазона только у пациентов с подтвержденным ОРДС по показаниям интенсивности.
Следствием тяжелого жизнеугрожающего синдрома высвобождения цитокинов может стать развитие синдрома диссеминированного внутрисосудистого свертывания, который сопряжен с высоким риском венозной тромбоэмболии и летальных исходов. Клинические наблюдения показали, что назначение низкомолекулярных гепаринов (НМГ), а при их отсутствии гепарина, приводит к обеспечению радикальной выживаемости больных. Гепарин оказывает как непрямое, так и прямое противовоспалительное действие. Ликвидируя микротромбозы, гепарин нормализует микроциркуляцию в легком. Это способствует переводу патологического воспаления в эффективный иммунный ответ, таким образом, обеспечивая адъювантный эффект для противовоспалительной терапии.
При госпитализации пациентов с подозрением на COVID-19 или подтвержденным COVID-19 рекомендуется определение в крови уровня D-димера, протромбинового времени, фибриногена и развернутого анализа крови, включающего уровень тромбоцитов.
Назначение НМГ, как минимум, в профилактических дозах показано ВСЕМ госпитализированным пациентам. В случае недоступности НМГ возможно использование нефракционированного гепарина (НФГ).
Противопоказания для начала использования профилактических доз НМГ/НФГ — продолжающееся кровотечение, уровень тромбоцитов в крови ниже 25 * 109/л, выраженная почечная недостаточность (для НМГ). Повышенное Протромбиновое время и АЧТВ не относятся к противопоказаниям к назначению НМГ/НФГ.
При тромботических осложнениях (тромбоз глубоких вен, тромбоэмболия легочных артерий и тромбозы иной локализации) следует перейти на лечебные дозы НМГ/НФГ. Список возможных к назначению антикоагулянтных средств представлен в Приложении 9.
У пациентов с иммунной тромбоцитопенией в анамнезе для профилактики и лечения венозных тромбоэмболических осложнений рекомендуется использовать фондапаринукс натрия. Фондапаринукс натрия, в отличие препаратов НМГ/НФГ, лишен потенциально благоприятных плейотропных эффектов, однако с другой стороны он не способствует снижению уровня тромбоцитов в крови.
Низкомолекулярные гепарины, фондапаринукс натрия не рекомендуется использовать у пациентов с быстро меняющейся функцией почек.
Пациентам, получающим пероральные антикоагулянты по другим показаниям, при не тяжелых проявлениях COVID-19, их прием можно продолжить. При неприемлемых лекарственных взаимодействиях с препаратами для лечения COVID-19 (прием лопиновира/ритонавира), а также при тяжелой форме COVID-19 рекомендуется переход на лечебные дозы гепарина (предпочтительно низкомолекулярного).
Кратность определения D-димера, протромбинового времени, фибриногена и количества тромбоцитов зависит от тяжести по COVID-19 инфекции, важна динамика как в сторону повышения, так и понижения показателей.
Для диагностики ДВС-синдрома важно оценивать в динамике: количество тромбоцитов, фибриноген, D-димер, протромбиновое время. У госпитализированных больных при легком варианте течения 1 раз в 4 — 5 дней, при средней тяжести 1 раз в два дня, при тяжелом — ежедневно. Внеочередной анализ вышеперечисленных показателей берется при усугублении тяжести по COVID-19.
У пациентов с коагулопатией потребления при отсутствии кровотечений следует поддерживать уровень тромбоцитов выше 20 * 109/л, фибриногена — выше 2,0 г/л. У пациентов с кровотечениями следует поддерживать уровень тромбоцитов выше 20 * 109/л, фибриногена — выше 2,0 г/л, протромбиновое отношение < 1,5.
Основными критериями эффективности упреждающей противовоспалительной терапии являются динамика клинического ответа: снижение уровня лихорадки, улучшение самочувствия, появление аппетита, уменьшение одышки, повышение SpO2. При этом эффект от блокаторов ИЛ-6 наступает в течение 12 ч (чаще используются 1 — 2 инъекции), лечения ГКС — от 12 до 72 ч (курс 2 — 3 суток), терапии антикоагулянтами — от 120 ч (курс от 5 дней). Если эффект от упреждающей противовоспалительной терапии не получен, то необходимо предполагать другие причины ухудшения состояния (прогрессирование пневмонии, сепсис и др.).
При лечении COVID-19 необходимо обеспечивать достаточное поступление жидкости в организм. Восполнение суточной потребности в жидкости должно обеспечиваться преимущественно за счет пероральной регидратации. Суточная потребность в жидкости должна рассчитываться с учетом лихорадки, одышки, потерь жидкости при диарее, рвоте (в случае наличия у пациента таких симптомов). В среднем достаточное количество жидкости (1,5 — 2 литра в сутки и более, если нет противопоказаний по соматической патологии). При выраженной интоксикации, а также при дискомфорте в животе, тошноте и/или рвоте показаны энтеросорбенты (диоксид кремния коллоидный, полиметилсилоксанаполигидрат и другие).
Пациентам в тяжелом состоянии (ОРИТ) при наличии показаний проводится инфузионная терапия. Следует с осторожностью подходить к инфузионной терапии, поскольку избыточные трансфузии жидкостей могут ухудшить насыщение крови кислородом, особенно в условиях ограниченных возможностей искусственной вентиляции легких, а также спровоцировать или усугубить проявления ОРДС. Объем инфузионной терапии должен составлять 10 — 15 мл/кг/сут.
При проведении инфузионной терапии важное значение имеет скорость введения жидкости. Чем меньше скорость введения жидкости, тем безопаснее для пациента.
В условиях проведения инфузионной терапии врач оценивает суточный диурез, динамику артериального давления, изменения аускультативной картины в легких, гематокрита (не ниже 0.35/л). При снижении объема диуреза, повышении артериального давления, увеличения количества хрипов в легких, снижении гематокрита объем парентерально вводимой жидкости должен быть уменьшен.
Для снижения объема инфузионной терапии поддержание нутритивного статуса пациента при необходимости нужно проводить методом зондового питания с использованием стандартных и полуэлементарных смесей для энтерального питания. Питание должно быть частым и дробным для исключения переполнения желудка и уменьшения экскурсии легких.
С целью профилактики отека головного мозга и отека легких пациентам целесообразно проводить инфузионную терапию на фоне форсированного диуреза (фуросемид 1% 2 — 4 мл в/м или в/в болюсно).
С целью улучшения отхождения мокроты при продуктивном кашле назначают мукоактивные препараты (ацетилцистеин, амброксол, карбоцистеин).
Бронхолитическая ингаляционная терапия (с использованием небулайзера) с использованием сальбутамола, фенотерола, с применением комбинированных средств (ипратропия бромид+фенотерол) целесообразна при наличии бронхообструктивного синдрома.
Патогенетическое лечение у беременных, рожениц и родильниц
Жаропонижающим препаратом первого выбора является парацетамол, который назначается по 500 — 1000 мг до 4 раз в день (не более 4 г в сутки).
СИМПТОМАТИЧЕСКОЕ ЛЕЧЕНИЕ
Симптоматическое лечение включает:
— купирование лихорадки (жаропонижающие препараты — парацетамол);
— комплексную терапию ринита и/или ринофарингита (увлажняющие/элиминационные препараты, назальные деконгестанты);
— комплексную терапию бронхита (мукоактивные, бронхолитические и прочие средства).
Жаропонижающие назначают при температуре выше 38,0 — 38,5 °C. При плохой переносимости лихорадочного синдрома, головных болях, повышении артериального давления и выраженной тахикардии (особенно при наличии ишемических изменений или нарушениях ритма) жаропонижающие препараты используют и при более низких цифрах. Наиболее безопасным препаратом является парацетамол.
Для местного лечения ринита, фарингита, при заложенности и/или выделениях из носа начинают с солевых средств для местного применения на основе морской воды (изотонических, а при заложенности — гипертонических). В случае их неэффективности показаны назальные деконгенстанты. При неэффективности или выраженных симптомах могут быть использованы различные растворы с антисептическим действием.
Симптоматическое лечение у беременных, рожениц и родильниц
Во время беременности (II и III триместры), в послеродовом и постабортном периоде возможно применение муколитических средств с помощью mesh-небулайзера (амброксол 2 — 3 мл с изотоническим раствором 2 мл 3 раза в день) и бронходилататоров (ипратропия бромид + фенотерол по 20 капель в 2 — 4 мл изотонического раствора 2 раза в день). Во время беременности (I, II и III триместры), в послеродовом и постабортном периоде в качестве бронходилататора также может применяться сальбутамол с помощью mesh-небулайзера (2,5 — 5 мг 2 раза в день).
Необходимым компонентом комплексной терапии является адекватная респираторная поддержка. Показатели сатурации кислорода должны определяться у всех беременных с клиникой острого респираторного заболевания и/или с пневмонией.
Показаниями для перевода ОРИТ при коронавирусной инфекции являются быстропрогрессирующая ОДН (ЧД > 25 в 1 мин, SpO2 < 92%, а также другая органная недостаточность (2 и более балла по шкале SOFA).
АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ ПРИ ОСЛОЖНЕННЫХ ФОРМАХ ИНФЕКЦИИ
Выбор антибиотиков и способ их введения осуществляется на основании тяжести состояния пациента, анализе факторов риска встречи с резистентными микроорганизмами (наличие сопутствующих заболеваний, предшествующий прием антибиотиков и др.), результатов микробиологической диагностики.
У пациентов в тяжелом состоянии (ОРИТ) рекомендована комбинированная терапия: защищенные аминопенициллины (амоксициллин/клавуланат, амоксициллин/сульбактам), цефалоспорины третьего поколения (цефтриаксон, цефотаксим цефтаролина фосамил,) в/в в комбинации с азитромицином или кларитромицином в/в. Альтернативой является применение цефалоспоринов третьего поколения (цефтриаксон, цефтотаксим) в/в в комбинации с респираторным фторхинолоном (левофлоксацин, моксифлоксацин) в/в. При совместном использовании фторхинолонов с препаратами группы 4-аминохинолонов (хлорохин, гидроксихлорохин, мефлохин) следует учитывать риск потенциирования кардиотоксического эффекта.
По данным предыдущих эпидемий гриппа (2009 — 2010) и вспышек коронавирусной инфекции (2004, 2012) было показано увеличение частоты обнаружения инфицирования золотистым стафилококка, в том числе MRSA. Учитывая этот факт, у отдельных категорий пациентов (недавно перенесенные оперативные вмешательства, госпитализации или пребывание в доме престарелых, наличие постоянного внутривенного катетера, диализ) целесообразно эмпирическое назначение препаратов, обладающих антистафилококковой активностью (цефтаролина фосамил, линезолид, ванкомицин) в комбинации с азитромицином в/в или кларитромицином в/в, или респираторным фторхинолоном в/в.
У пациентов с факторами риска инфицирования P. aeruginosa (длительная терапия системными ГКС, муковисцидоз, вторичные бронхоэктазы, недавний прием системных антибиотиков) рекомендованы — комбинация -лактамного антибиотика с антисинегнойной активностью (пиперациллин/тазобактам, меропенем, имипенем/циластатин, дорипенем) с ципрофлоксацином или левофлоксацином; альтернатива — комбинация -лактамного препарата с антисинегнойной активностью с аминогликозидами II — III поколения и макролидами, либо респираторным фторхинолоном.
В случае клинической неэффективности, развитии нозокомиальных осложнений, выбор режима антимикробной терапии осуществлять на основании выявления факторов риска резистентных возбудителей, анализе предшествующей терапии, результатов микробиологической диагностики (пиперациллин/тазобактам, цефепим/сульбактам, меропенем, дорипенем, имипенем/циластатин, цефтолозан/тазобактам, цефтазидим/авибактам, тигециклин, азтреонам, амикацин и др.).
Особенности антибактериальной терапии у беременных, рожениц и родильниц
При осложненных формах инфекции антибактериальная терапия должна быть назначена в течение первых 2 — 3 часов после госпитализации.
Пациенткам с тяжелым течением заболевания антибактериальные препараты вводятся внутривенно.
При вторичной вирусно-бактериальной пневмонии (наиболее вероятные возбудители — Streptococcus pneumoniae, Staphylococcus aureus и Haemophilus influenza) предпочтительнее использовать следующие схемы антибиотикотерапии:
— цефалоспорин III поколения макролид;
— защищенный аминопенициллин макролид;
При третичной бактериальной пневмонии (наиболее вероятные возбудители — метициллинрезистентные штаммы Staphylococcus aureus, Haemophilus influenza) обосновано назначение следующих препаратов (в различных комбинациях):
— цефалоспорин IV поколения макролид;
— карбапенемы;
— ванкомицин;
— линезолид.
К антибактериальным лекарственным средствам противопоказанным при беременности относятся тетрациклины, фторхинолоны, сульфаниламиды.
Контроль кардиотоксичности при применении препаратов, применяемых в лечении COVID-19 (хлорохина, гидроксихлорохина, макролидов, фторхинолонов), представлен в Приложении 11.
АКУШЕРСКАЯ ТАКТИКА ПРИ COVID-19
Акушерская тактика определяется несколькими аспектами: тяжестью состояния пациентки, состоянием плода, сроком гестации. При средней степени тяжести и тяжелом течении заболевания до 12-й недели гестации в связи с высоким риском перинатальных осложнений, связанных как с воздействием вирусной инфекции, так и эмбриотоксичным действием лекарственных препаратов, возможно прерывание беременности после излечения инфекционного процесса. При отказе пациентки от прерывания беременности необходима биопсия ворсин хориона или плаценты до 12 — 14-й недель или амниоцентез с 16 недель гестации для выявления хромосомных аномалий плода.
Прерывание беременности и родоразрешение в разгар заболевания сопряжено с увеличением показателя материнской летальности и большим числом осложнений: утяжеление основного заболевания и вызванных им осложнений, развитие и прогрессирование дыхательной недостаточности, возникновение акушерских кровотечений, интранатальная гибель плода, послеродовые гнойно-септические осложнения. Однако при невозможности устранения гипоксии на фоне ИВЛ или при прогрессировании дыхательной недостаточности, развитии альвеолярного отека легких, а также при рефрактерном септическом шоке по жизненным показаниям в интересах матери и плода показано экстренное абдоминальное родоразрешение (кесарево сечение) с проведением всех необходимых мероприятий по профилактике коагулопатического и гипотонического акушерского кровотечения.
В сроке беременности до 20 недель экстренное кесарево сечение можно не проводить, так как беременная матка в этом сроке не влияет на сердечный выброс.
В сроке беременности 20 — 23 недели экстренное кесарево сечение проводится для сохранения жизни матери, но не плода, а в сроке более 24 недель — для спасения жизни матери и плода.
В случае развития спонтанной родовой деятельности в разгар заболевания (пневмонии) роды предпочтительно вести через естественные родовые пути под мониторным контролем состояния матери и плода.
Предпочтительным методом обезболивания является регионарная аналгезия при отсутствии противопоказаний. Противовирусная, антибактериальная, детоксикационная терапия, респираторная поддержка проводятся по показаниям.
Во втором периоде для профилактики развития дыхательной и сердечнососудистой недостаточности ограничить потуги. При необходимости быстрого окончания родов следует применить вакуум-экстракцию или акушерские щипцы.
Кесарево сечение выполняется при наличии абсолютных акушерских показаний, а также в случае непредотвратимости/неизбежности летального исхода матери с целью попытки сохранения жизни плода.
Анестезиологическое обеспечение операции кесарева сечения при тяжелом течении заболевания: в отсутствии признаков выраженной полиорганной недостаточности (до 2 баллов по шкале SOFA) возможно применение регионарных методов обезболивания на фоне респираторной поддержки, при выраженной полиорганной недостаточности — тотальная внутривенная анестезия с ИВЛ.
Всем пациенткам, независимо от срока беременности, показана профилактика кровотечения.
Во всех случаях вопрос о времени и методе родоразрешения решается индивидуально.
Клиническими критериями выписки из стационара беременных и родильниц являются:
— нормальная температура тела в течение 3-х дней;
— отсутствие симптомов поражения респираторного тракта;
— восстановление нарушенных лабораторных показателей;
— отсутствие акушерских осложнений (беременности, послеродового периода).
Выписка из стационара проводится после двукратного отрицательного результата лабораторного исследования на наличие РНК SARS-CoV-2 с интервалом не менее 1 дня.
Прогноз для матери и плода зависит от триместра гестации, в котором возникло заболевание, наличия преморбидного фона (курение, ожирение, фоновые заболевания органов дыхательной системы и ЛОР-органов, сахарный диабет, ВИЧ-инфекция), степени тяжести инфекционного процесса, наличия осложнений и своевременности начала противовирусной терапии.
Тактика ведения новорожденных в условиях пандемии коронавируса COVID-19
Маршрутизация новорожденных высокого риска по развитию COVID-19 основывается на выделении групп риска в зависимости от инфицирования матери.
Потенциально инфицированным SARS-CoV-2 считается ребенок:
— рожденный от матери, у которой выявлен подтвержденный случай COVID-19 за 14 дней до родов или от момента родов до 28 дня постнатального периода;
— рожденный от матери с подозрением на наличие инфицирования SARS-CoV-2, в том числе находившейся на самоизоляции (из группы подлежащих карантину по контакту с инфицированным SARS-CoV-2);
— новорожденный до 28 дней постнатального периода в случаях его контакта с инфицированными/потенциально инфицированными SARS-CoV-2 (включая членов семьи, опекунов, медицинский персонал и посетителей).
Инфицированным новорожденный считается при положительном результате исследования биоматериала на наличие РНК SARS-CoV-2 методом амплификации нуклеиновых кислот, вне зависимости от наличия или отсутствия клинической картины.
Ведение потенциально инфицированных COVID-19 новорожденных
В родильном зале
— Для присутствия на родах и перемещения ребенка должна быть заранее выделенная врачебно-сестринская бригада для новорожденного, которая приглашается в родильный зал не ранее начала потужного периода, ожидает рождения ребенка на расстоянии не менее 2-х метров от роженицы. Использование средств индивидуальной защиты обязательно.
— Число людей, оказывающих помощь в помещении должно быть минимизировано, чтобы уменьшить контакт с больным.
— Не рекомендовано отсроченное пережатие пуповины; не рекомендован контакт мать-ребенок; к груди не прикладывается, максимально быстро выносится из родильного зала.
— В зависимости от клинического состояния женщины возможно поддержание лактации для последующего грудного вскармливания ребенка после выздоровления матери.
— Первичная и реанимационная помощь новорожденному оказывается в свободном родильном зале или в специально выделенном помещении с учетом минимизации применения технологий, способствующих образованию внешнего инфицированного аэрозоля (санация трахеи, вентиляция мешком Амбу, неинвазивное введение сурфактанта).
— Предметы диагностики и лечения (стетоскоп, термометр и др.) и средства ухода должны быть индивидуального использования для каждого ребенка, после его перевода должны быть обработаны в соответствии с правилами.
— Врачи, медсестры и другой персонал, контактирующий с ребенком, должны находиться в средствах индивидуальной защиты.
— После рождения ребенок должен быть выведен из помещений, предназначенных для беременных, рожениц и родильниц с COVID-19(+), и изолирован в специально выделенном отделении (обычно отделение детской больницы). Транспортировка производится в транспортном кувезе, персонал использует средства защиты. Специально выделенный медицинский автотранспорт подлежит дезинфекции по правилам работы с особо опасными инфекциями.
— У новорожденного ребенка берутся мазки из носа и ротоглотки на COVID-19 сразу после перемещения из родильного зала или сразу после установления постнатального контакта с COVID-19-позитивными людьми из его окружения. Далее исследование на наличие РНК SARS-CoV-2 повторяется через 2 — 3 суток. Если оба результата исследования отрицательные, то ребенок считается COVID-19 негативным. Если ребенок по эпидемиологическим показаниям должен находиться в карантине, то контрольные исследования биологического материала из носа, ротоглотки, а также стула проводятся на 10 — 12 сутки карантина с целью принятия решения о возможности его прекращения к 14 суткам. Если один из результатов исследования на наличие РНК SARS-CoV-2 положительный, то ребенок считается инфицированным данным вирусом и дальнейшие контрольные исследования проводятся в соответствии с рекомендациями по ведению пациентов с COVID-19.
— Вакцинация и неонатальный скрининг откладываются до установления COVID-отрицательного статуса.
— При необходимости медицинская помощь новорожденному оказывается в соответствии с клиническими рекомендациями.
ОСНОВНЫЕ ПРИНЦИПЫ ТЕРАПИИ НЕОТЛОЖНЫХ СОСТОЯНИЙ
Показания для перевода в ОРИТ (достаточно одного из критериев):
— ЧДД более 30/мин
— SpO2 93%
— PaO2/FiO2 300 мм рт.ст.
— прогрессирование пневмонии (нарастание площади инфильтративных изменений более чем на 50% через 24 — 48 часов)
— снижение уровня сознания
— необходимость респираторной поддержки (неинвазивной и инвазивной вентиляции легких)
— нестабильная гемодинамика (систолическое АД менее 90 мм рт.ст. или диастолическое АД менее 60 мм рт.ст., потребность в вазопрессорных препаратах, диурез менее 0,5 мл/кг/час)
— синдром полиорганной недостаточности
— qSOFA > 2 балла
— лактат артериальной крови > 2 ммоль
Интенсивная терапия острой дыхательной недостаточности
Развитие острой дыхательной недостаточности является одним из наиболее частых осложнений COVID-19. У пациентов с тяжелым и крайне тяжелым течением (10 — 15%) примерно после 5-го дня болезни сохраняется лихорадка, появляются симптомы дыхательной недостаточности, прогрессируют инфильтративные изменения в легких (вирусная пневмония), ОРДС.
Даже при легком течении COVID-19 при проведении КТ легких у большинства пациентов отмечены инфильтративные изменения — так, SARS-CoV-2 обнаруживался в носоглоточных смывах у 59% пациентов, а наличие инфильтративных изменений на КТ легких — у 88% пациентов с вероятным COVID-19.
Особенности вирусной пневмонии и ОРДС при COVID-19
ОРДС при COVID-19 диагностирован в среднем на 8-е сутки от начала заболевания, частота развития ОРДС при поступлении в ОРИТ около 60%, индекс PaO2/FiO2 при поступлении в ОРИТ 136 (103 — 234) мм рт.ст.
У пациентов с ОРДС вследствие COVID-19 описаны 2 различных варианта поражений легких:
1. Малорекрутабельные легкие (собственно, вирусная пневмония, более ранняя стадия): нормальная податливость легочной ткани, участки только матового стекла на КТ легких, локализованные субплеврально и вдоль междолевых щелей, низкая рекрутабельность легких — показана ИВЛ в положении лежа на животе (прон-позиции), PEEP 10 — 12 см вод.ст.
2. Рекрутабельные легкие (собственно, ОРДС), 20 — 30% от всех ОРДС: низкая податливость респираторной системы, коллапс и ателектазирование альвеол, увеличение массы легочной ткани («влажные легкие»), высокая рекрутабельность легких — показана ИВЛ в прон-позиции, PEEP 15 — 20 см вод.ст.
Алгоритм оказания помощи при ОДН
Пациентам с острой дыхательной недостаточностью вследствие COVID-19 рекомендовано использовать пошаговый подход в выборе методов респираторной терапии для улучшения результатов лечения: при ОРДС легкой степени (PaO2/FiO2 200 — 300 мм рт.ст. или SpO2 80 — 90% при дыхании воздухом) рекомендовано использование стандартной оксигенотерапии (через лицевую маску или назальные канюли), высокопоточной оксигенации (ВПО) или неинвазивной ИВЛ (НИВЛ) в сочетании с прон-позицией, при ОРДС средней и тяжелой степени (PaO2/FiO2 обычно менее 150 мм рт.ст. или SpO2 менее 75% при дыхании воздухом) показана интубация трахеи и инвазивная ИВЛ в сочетании с прон-позицией (схема 1).

Схема 1. Пошаговый подход в выборе респираторной терапии COVID-19
Оксигенотерапия и НИВЛ
У пациентов с COVID-19 и насыщением гемоглобина кислородом менее 92% рекомендовано начало оксигенотерапии до достижения 96 — 98%.
Пациентам с гипоксемической ОДН вследствие COVID-19 на первом этапе рекомендовано использовать высокопоточную оксигенацию с потоком 30 — 60 л/мин вместо стандартной оксигенотерапии или НИВЛ, так как она имеет преимущества в обеспечении адекватной оксигенации и не увеличивает риск передачи инфекции; при использовании высокопоточной оксигенотерапии рекомендовано надеть на пациента защитную маску.
Пациентам с COVID-19 рекомендовано сочетание оксигенотерапии (стандартной или высокопоточной) с положением пациента лежа на животе не менее 12 — 16 часов в сутки, что приводит к улучшению оксигенации и возможному снижению летальности.
У пациентов с гипоксемической (паренхиматозной) ОДН при COVID-19 НИВЛ и высокопоточная оксигенация рекомендована при сочетании низкой рекрутабельности альвеол (собственно, вирусная (поли)очаговая пневмония) с незначительно сниженной или нормальной податливостью легких и грудной стенки, продемонстрировано преимущество высокопоточной оксигенации перед НИВЛ у этих пациентов.
При отсутствии технической возможности проведения высокопоточной оксигенотерапии или ее неэффективности рекомендовано использование неинвазивной вентиляции аппаратами НИВЛ для стационарного или домашнего использования в режиме CPAP до 15 — 18 см вод.ст. (см. клинические рекомендации ФАР «Применение неинвазивной вентиляции легких»).
При неэффективности НИВЛ — гипоксемии, метаболическом ацидозе или отсутствии увеличения индекса PaO2/FiO2 в течение 2 часов, высокой работе дыхания (десинхронизация с респиратором, участие вспомогательных мышц, «провалы» во время триггирования вдоха на кривой «давление-время») — показана интубация трахеи и переход к традиционной ИВЛ.
При наличии показаний у пациентов с ОРДС не следует задерживать интубацию трахеи и начало ИВЛ, так как отсрочка интубации трахеи при ОРДС ухудшает прогноз. При этом следует иметь в виду, что прогрессирование дыхательной недостаточности может происходить чрезвычайно быстро.
НИВЛ предпочтительнее использовать (по сравнению с высокопоточной оксигенацией) только у пациентов с сопутствующими заболеваниями — ХОБЛ, хронической сердечной недостаточностью.
Применение НИВЛ рекомендовано только при следующих условиях: сохранность сознания, стабильная гемодинамика, возможности сотрудничать с персоналом, отсутствие клаустрофобии (при применении шлемов) и сохранение механизма откашливания мокроты.
Неинвазивная респираторная поддержка не рекомендуется в следующих случаях (уровень достоверности доказательств 3, уровень убедительности рекомендаций B):
1) отсутствие самостоятельного дыхания (апноэ);
2) нестабильная гемодинамика (гипотензия, ишемия или инфаркт миокарда, жизнеугрожающая аритмия, неконтролируемая артериальная гипертензия);
3) невозможность обеспечить защиту дыхательных путей (нарушение кашля и глотания) и высокий риск аспирации;
4) избыточная бронхиальная секреция;
5) признаки нарушения сознания (возбуждение или угнетение сознания), неспособность пациента к сотрудничеству с медицинским персоналом;
6) лицевая травма, ожоги, анатомические нарушения, препятствующие установке маски;
7) выраженное ожирение;

9) активное кровотечение из желудочно-кишечного тракта;
10) обструкция верхних дыхательных путей;
11) дискомфорт от маски;
12) операции на верхних дыхательных путях.
Показаниями для интубации трахеи являются (достаточно одного критерия):
— гипоксемия (SpO2 < 92%) несмотря на высокопоточную оксигенотерапию или НИВЛ в положении лежа на животе,
— ЧДД более 35 в мин,
— нарастание видимой экскурсии грудной клетки,
— нарушение/изменение сознания,
— ухудшение визуализационной картины легких,
— остановка дыхания,
— нестабильная гемодинамика.
Прональная позиция у неинтубированных пациентов
Прональная позиция (положение пациента на животе) может быть также использована и у неинтубированных пациентов, которые получают кислородотерапию или неинвазивную вентиляцию легких (НВЛ).
Раннее применение прональной позиции в сочетании с кислородотерапией и НИВЛ может помочь избежать потребности в интубации почти у половины пациентов с ОРДС легкой степени тяжести; при добавлении к кислородотерапии или НИВЛ прональная позиции приводит к увеличению PaO2/FiO2 на 25 — 35 мм рт.ст., по сравнению с предшествующими показателями.
К основным механизмам действия прональной позиции относятся: расправление гравитационно-зависимых ателектазов; улучшение вентиляционно-перфузионного баланса; улучшение дренажа секрета из дыхательных путей; более гомогенное распределение вентиляции во время проведения терапии с положительным давлением.
Прональная позиция проводится не реже двух раз в сутки (оптимально общее время на животе 12 — 16 часов в сутки).
Противопоказания к прональной позиции: нарушение сознания (угнетение или ажитация); гипотензия; недавняя операция на брюшной или грудной полостях; массивное кровотечение; повреждения спинного мозга; нарушения ритма, которые могут потребовать дефибрилляции и/или массажа сердца.
Терапия гелий-кислородными газовыми смесями
В настоящее время изучается эффективность подогреваемой кислородно-гелиевой смеси гелиокс (70% Гелий/30% Кислород), в комплексной интенсивной терапии больных на начальных стадиях ОРДС. Терапия гелий-кислородными газовыми смесями проводится с помощью специальных аппаратов, обеспечивающих эффективную и безопасную ингаляцию термической гелий-кислородной смесью, позволяющих изменять процентное соотношение гелия и кислорода, а также температуры в любой момент времени в течение одной процедуры.
Инвазивная ИВЛ
Проведение ИВЛ направлено на обеспечение адекватного газообмена и минимизации потенциального ятрогенного повреждения легких. Основная стратегия применения ИВЛ при COVID-19 основана на временных клинических рекомендациях ФАР «Диагностика и интенсивная терапия острого респираторного дистресс-синдрома», 2020
Целевые значения газообмена при ИВЛ, ассоциированные с улучшением исхода при ОРДС:
— PaO2 90 — 105 мм рт.ст или SpO2 95 — 98%,
— PaCO2 30 — 50 мм рт.ст. или EtCO2 капнограммы 27 — 45 мм рт.ст.
При искусственной вентиляции легких у пациентов с ОРДС рекомендовано использовать дыхательный объем 6 — 8 мл/кг идеальной массы тела, так как применение ДО 9 мл/кг ИМТ и более приводит к увеличению осложнений и летальности.
Проведение «безопасной» ИВЛ возможно как в режимах с управляемым давлением (PC), так и в режимах с управляемым объемом (VC). При этом в режимах с управляемым объемом желательно использовать нисходящую форму инспираторного потока, так как она обеспечивает лучшее распределение газа в разных отделах легких и меньшее давление в дыхательных путях. В настоящее время отсутствуют убедительные данные о преимуществе какого-либо из вспомогательных режимов респираторной поддержки. При применении управляемых режимов респираторной поддержки следует как можно быстрее перейти к режимам вспомогательной вентиляции.
У пациентов с ОРДС легкой и средней степени тяжести при появлении инспираторных попыток пациента после интубации трахеи и реверсии миоплегии рекомендовано, при отсутствии патологических ритмов дыхания и технической возможности, переключить аппарат ИВЛ на полностью вспомогательный режим вентиляции (в большинстве аппаратов ИВЛ — режим PSV) для улучшения распределения газа в легких, профилактики ателектазирования легких и профилактики атрофии диафрагмы.
У пациентов с ОРДС вследствие COVID-19 рекомендовано использовать PEEP 10 — 20 см вод.ст. (в зависимости от типа ОРДС и рекрутабельности альвеол):
— при малорекрутабельных легких: очаговые повреждения альвеол на КТ, давление плато менее 30 см вод.ст., статическая податливость респираторной системы 40 мл/см вод.ст. и выше — PEEP 10 — 12 см вод.ст.;
— при рекрутабельных легких: сливные повреждения альвеол на КТ, картина «мокрой губки» на КТ, давление плато выше 30 см вод.ст., статическая податливость респираторной системы менее 40 мл/см вод.ст. и выше — PEEP 15 — 20 см вод.ст.
— даже при отнесении легких к нерекрутабельному типу рекомендовано повышение PEEP до 15 см вод.ст. для оценки эффективности.
Полная методология применения PEEP подробно описана в Клинических рекомендациях ФАР «Диагностика и интенсивная терапия острого респираторного дистресс-синдрома».
У пациентов с ОРДС вследствие COVID-19 рутинное применение маневров рекрутирования альвеол не рекомендовано вследствие невысокой рекрутабельности и высокого риска острого легочного сердца.
У пациентов с ОРДС вследствие COVID-19 при проведении ИВЛ рекомендовано использовать неинвертированное соотношение вдоха к выдоху для более равномерного распределения газа в легких и снижения отрицательного влияния ИВЛ на постнагрузку правого желудочка; рутинное применение инверсного соотношения вдоха к выдоху (более 1 к 1,2) не рекомендовано.
Вентиляция в положении лежа на животе (прональная позиция).
При проведении ИВЛ у пациентов с ОРДС вследствие COVID-19 рекомендовано использование положения лежа на животе в течение не менее 16 часов в сутки для улучшения оксигенации и возможного снижения летальности (уровень достоверности доказательств 1, уровень убедительности рекомендаций A). Методология прон-позиции: пациента следует положить на живот, предварительно положив валики под грудную клетку и таз с таким расчетом, чтобы живот не оказывал избыточного давления на диафрагму, а также не создавалось условий для развития пролежней лица.
Осложнения при вентиляции в положении лежа на животе:
— Перегибы и дислокации интубационных трубок и венозных катетеров;
— Трудность выполнения сердечно-легочной реанимации в случае остановки кровообращения;
— Развитие невритов периферических нервов верхних конечностей;
Повреждение носа и глаз — лицевой и периорбитальный отек развивается почти в 100% случаев; кератоконъюнктивит, требующий лечения, развивается у 20% пациентов.
При применении прон-позиции затруднен уход за пациентом: санация полости рта, трахеи, обработка глаз, лица.
Критерии прекращения применения прон-позиции:
увеличение PaO2/FiO2 более 200 мм рт.ст. при PEEP менее 10 мбар, сохраняющиеся в течение не менее 4 часов после последнего сеанса прон-позиции.
Медикаментозная седация и миоплегия при ИВЛ
При проведении ИВЛ пациентам с ОРДС легкой и средней степени следует использовать «легкий» уровень седации (оценке по Ричмондской шкале ажитации-седации (RASS) от -1 до -3 баллов), так как такая стратегия уменьшает длительность респираторной поддержки и улучшает исход, желательно избегать применения для седации бензодиазепинов.
У пациентов с тяжелым ОРДС (PaO2/FiO2 менее 120 мм рт.ст. при PEEP более 5 мбар) рекомендовано использовать нейро-мышечную блокаду, но только в течение первых 48 часов после интубации трахеи, что может приводить к уменьшению вентилятор-ассоциированного повреждения легких и снижению летальности; рутинное применение миорелаксантов для синхронизации с респиратором противопоказано.
Прекращение респираторной поддержки
У пациента с ОРДС вследствие COVID-19 рекомендовано продлевать респираторную поддержку (до 14 суток и более) даже при положительной динамике оксигенирующей функции легких, так как при COVID-19 возможно повторное ухудшение течения ОРДС, средняя продолжительность ИВЛ у выживших составляет 14 — 21 день.
Рекомендовано использовать общие и респираторные критерии готовности к прекращению респираторной поддержки для улучшения исходов и уменьшения продолжительности респираторной поддержки.
Основные респираторные критерии готовности к прекращению респираторной поддержки:
— PaO2/FiO2 более 300 мм рт.ст, то есть SpO2 при вдыхании воздуха 90% и более,
— Восстановление кашлевого рефлекса и кашлевого толчка,
— Отсутствие бронхореи,
— Индекс Тобина (f/Vt) менее 105.
Дополнительные респираторные критерии:
— Статическая податливость респираторной системы > 35 мл/мбар,
— Сопротивление дыхательных путей < 10 мбар/л/с,
— Отрицательное давление на вдохе (NIP — Negative Inspiratory Pressure или NIF — Negative Inspiratory Force) менее -20 мбар,
— Давление во время окклюзии дыхательного контура на вдохе за первые 100 мс (P0,1) 1 — 3 мбар,
— Уменьшение инфильтрации на рентгенограмме (и/или КТ) грудной клетки.
— Общие критерии готовности к прекращению респираторной поддержки:
— Отсутствие угнетения сознания и патологических ритмов дыхания,
— Полное прекращение действия миорелаксантов и других препаратов, угнетающих дыхание,
— Отсутствие признаков шока (мраморность кожных покровов, сосудистое пятно более 3 с, холодные конечности), жизнеопасных нарушений ритма, стабильность гемодинамики.
Для начала прекращения респираторной поддержки обязательно наличие всех основных респираторных и общих критериев готовности к прекращению респираторной поддержки.
Проведение экстракорпоральной мембранной оксигенации (ЭКМО)
В настоящее время имеется достаточно данных, свидетельствующих о возможных перспективах данного метода. Скорость прогрессирования ОДН у пациентов с тяжелой внебольничной пневмонией диктует необходимость осуществить заблаговременный контакт с центром, располагающим возможностями проведения ЭКМО.
ЭКМО проводится в отделениях, имеющих опыт использования данной технологии: стационары, в которых есть специалисты, в т.ч. хирурги, перфузиологи, владеющие техникой канюлизации центральных сосудов и настройкой ЭКМО.
Показания для ЭКМО
У пациентов с COVID-19 при сочетании ОРДС тяжелой степени, малорекрутабельных легких и острого легочного сердца (или высокого риска острого легочного сердца) следует как можно раньше начинать применение экстракорпоральной мембранной оксигенации, так как это приводит к снижению летальности.
Критериями начала ЭКМО являются:
— PaO2/FiO2 < 80 мм рт.ст. (при PEEP выше 15 см вод.ст и ИВЛ в положении лежа на животе;
— pH < 7,2;
— Оценка по шкале повреждения легких (LIS) более 3 баллов.
У пациентов с ОРДС вследствие COVID-19 рекомендована оценка по Шкале острого легочного сердца для решения вопроса о необходимости применении ЭКМО — 3 — 4 балла соответствуют высокому риску ОЛС:
— Пневмония как причина ОРДС (1 балл)
— PaO2/FiO2 < 150 мм рт.ст. (1 балл)
— PaCO2 > 48 мм рт.ст. (1 балл)
Движущее давление > 18 мбар (1 балл) При тяжелой рефракторной гипоксемии показано проведение экстракорпоральной мембранной оксигенации (ЭКМО). Основным показанием является ОРДС тяжелой степени с длительностью проведения любой ИВЛ (инвазивной или неинвазивной) не более 5 суток.
Противопоказания к ЭКМО:
1. Наличие геморрагических осложнений и снижение уровня тромбоцитов ниже критических значений (менее 50 000), наличие клиники внутричерепных кровоизлияний;
2. Вес пациента (ребенка) менее 2 кг.
Показания и противопоказания к ЭКМО представлены в таблице 1.
Таблица 1. Показания и противопоказания к ЭКМО
| Потенциальные показания к ЭКМО |
— Основные инструментальные критерии — оценка по шкале Мюррея более 3 и (или) PaO2/FiO2 < 150 при PEEP 10 см H2O в течение 6 часов (при невозможности измерения PaO2 — показатель SpO2/FiO2 < 200) — Давление плато 35 см H2O несмотря на снижение PEEP до 5 см H2O и снижение VT до минимального значения (4 мл/кг) и pH 7,15. |
| Противопоказания к ЭКМО |
— Тяжелые сопутствующие заболевания с ожидаемой продолжительностью жизни пациента не более 5 лет; — Полиорганная недостаточность или SOFA > 15 баллов; — Немедикаментозная кома (вследствие инсульта); — Техническая невозможность венозного или артериального доступа; — Индекс массы тела > 40кг/м2. |
Лечение пациентов с септическим шоком
При септическом шоке следует незамедлительно осуществить внутривенную инфузионную терапию кристаллоидными растворами (30 мл/кг/сутки, с высокой начальной скоростью инфузии — 1 л жидкости в течение 30 минут или менее). Особенно важно, оценивая волемический статус, предотвратить возможное развитие гиперволемии.
1. Если состояние пациента в результате болюсной инфузии растворов не улучшается и появляются признаки гиперволемии (т.е. влажные хрипы при аускультации, отек легких по данным рентгенографии грудной клетки), то необходимо сократить объемы вводимых растворов или прекратить инфузию.
Не рекомендуется использовать гипотонические растворы, декстраны или растворы гидроксиэтилкрахмала.
При отсутствии эффекта от стартовой инфузионной терапии назначают вазопрессоры (норэпинефрин, адреналин (эпинефрин) и дофамин). Вазопрессоры рекомендуется вводить в минимальных дозах, обеспечивающих поддержку перфузии (т.е. систолическое артериальное давление > 90 мм рт. ст.). Адреналин вводится в дозе от 0,2 до 0,5 мкг/кг/мин. Однако доза адреналина может быть увеличена до 1 и даже 1,5 мкг/кг/мин.
Введение норадреналина, дофамина и добутамина целесообразно при снижении сократимости миокарда и развитии сердечной недостаточности.
2. Эксперты ВОЗ рекомендуют при коронавирусной инфекции применять, по возможности, невысокие дозы гидрокортизона (до 200 мг/сутки) или преднизолона (до 75 мг/сутки) и непродолжительные курсы.
3. При гипоксемии с SpO2 < 93% показана кислородная терапия до достижения целевого уровня SpO2 94% у небеременных взрослых и детей, у беременных пациенток — до SpO2 94%.
Инфузионная терапия
Необходимо обеспечить достаточное количество жидкости при отсутствии противопоказаний и снижении диуреза, общее количество которой может быть увеличено при повышении потерь из ЖКТ (рвота, жидкий стул).
У пациентов с COVID-19 при отсутствии шока и патологических потерь жидкости рекомендована ограничительная стратегия инфузионной терапии — применение инфузионной терапии не показано, только энтеральное питание. Необходимо вести пациентов в нулевом или небольшом отрицательном балансе жидкости.
При наличии показаний инфузионная терапия требуется не выше 2 — 3 мл/кг/ч с обязательным контролем диуреза и оценкой распределения жидкости.
Растворы для инфузионной терапии:
— сбалансированные кристаллоидные растворы предпочтительнее),
— несбалансированные растворы (изотонический раствор натрия хлорида, раствор Рингера).
Инфузионная терапия проводится под обязательным контролем состояния пациентов, его артериального давления, оценки аускультативной картины в легких, с контролем величины гематокрита и диуреза (гематокрит не ниже 0,35 и диурез не ниже 0,5 мл/кг/ч). Гипотонические кристаллоидные растворы не должны рассматриваться как основа терапии, а коллоидные растворы не рекомендованы к применению.
Для поддержания отрицательного гидробаланса рекомендовано использованием диуретиков. Необходим контроль и коррекция Na+ (135 — 145 ммоль/л), осмолярности (280 мОсм/кг) и диуреза ( 60 мл/час).
ОСОБЫЕ ГРУППЫ ПАЦИЕНТОВ
Больные с артериальной гипертензией
В связи с тем, что ангиотензин-превращающий фермент 2 (АПФ 2) является функциональным рецептором для SARS-CoV-2, было высказано предположение, что это может объяснять высокий риск летального исхода при COVID-19 у пациентов с артериальной гипертензией, получающих препараты из группы ингибиторов АПФ или блокаторов рецепторов к ангиотензину. Эти опасения носили гипотетический характер и не получили практического подтверждения. Более того, имеются косвенные данные о возможном протективном действии этих препаратов при инфекции COVID-19. Экспертами Европейского общества кардиологов опубликовано заявление о том, что данных о неблагоприятных эффектах этих препаратов на течение COVID-19 нет, их прием настоятельно рекомендуется продолжать.
Больные с гиперлипидемией
Оснований для отмены гиполипидемических препаратов нет. Необходимо учитывать межлекарственное взаимодействие при назначении терапии.
Больные с острым коронарным синдромом
В связи с тем, что при COVID-19 обнаруживается неспецифическое повышение уровня тропонина, а также описаны случаи миокардитов, для подтверждения диагноза острого коронарного синдрома (ОКС) на фоне COVID-19 требуется более тщательное обследование. В целом тактика ведения пациентов с ОКС не должна отличаться от стандартно принятой. Пациенты с ОКС и с подозрением на COVID-19 должны направляться в стационары, имеющие возможность проведения чрескожного коронарного вмешательства.
Больные сахарным диабетом
В случае бессимптомного или среднетяжелого течения COVID-19 необходим контроль гликемии. При повышении гликемии необходимо усилить текущую терапию сахарного диабета, добавить инсулин-изофан человеческий генно-инженерный или аналог инсулина длительного действия.
Пациентам с респираторными проявлениями необходимо обеспечить контроль гликемии, при повышении гликемии выше 14,0 ммоль/л и дыхательной недостаточности отменить метформин, назначить инсулин короткого типа действия или базис-болюсную инсулинотерапию, контролировать гликемию каждые 6 — 8 ч под наблюдением эндокринолога или терапевта.
При возникновении дыхательной недостаточности или нарушении других жизненных функций необходимо:
— контролировать гликемию
— отменить метформин и другие пероральные сахароснижающие препараты
— назначить инсулин «короткого типа» действия непрерывным введением через инфузомат
— при гликемии выше 14,0 ммоль/л контролировать гликемию каждый час, при снижении гликемии менее 14,0 ммоль/л каждые 3 ч для изменения скорости подачи инсулина
— при назначении комбинированной противовирусной терапии ожидать повышения гликемии: проводить контроль каждые 1 — 3 ч, увеличить скорость подачи инсулина по результатам контроля (увеличение дозы инсулина может превышаться в 2 — 3 раза от исходной)
— наблюдение эндокринолога.
МОНИТОРИНГ КЛИНИЧЕСКИХ И ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ
Важным моментом при оказании медицинской помощи больным с COVID-19 или подозрением на COVID-19 является оценка динамики клинических и лабораторных показателей для своевременного назначения препаратов и своевременной коррекции терапии.
Клинические признаки, требующие мониторинга:
— температура тела (контроль ежедневно минимум два раза в день в утренние и вечерние часы), оценивается высота повышения температуры, кратность подъемов температуры в течение суток, длительность повышения температуры. Особого внимания требуют эпизоды повторного повышения температуры после нормализации в течение 1 и более суток
— ЧДД, оценивается ежедневно, в случае увеличения ЧДД необходимо ориентироваться не только на стандартные нормальные значения показателя, но и на прирост показателя у конкретного пациента в сравнении с исходным ЧДД. При развитии или нарастании признаков дыхательной недостаточности необходимо тщательно контролировать SpO2. При увеличении ЧДД более 22 в минуту на фоне в случае лечения на дому необходимо решать вопрос о госпитализации пациента в стационар.
— SpO2 оценивается ежедневно (у пациентов, находящихся в стационаре, 1 раз в три дня, при снижении показателя до уровня 93%, необходима дотация кислорода.
Для линейных отделений SpO2 на фоне оксигенотерапии должно быть 92%, если показатель меньше — показан переворот на живот. Если SpO2 в положении на животе менее 92%, показана консультация реаниматолога в течение часа. При проведении оксигенотерапии показано кратковременно прекращать ее не реже чем 1 раз в 2 часа, если при этом отмечается снижение SpO2 менее 85%, показан вызов реаниматолога в течение часа, если SpO2 снижается до 80% и менее — экстренный вызов реаниматолога.
Для отделений реанимации и интенсивной терапии SpO2 на фоне оксигенотерапии должно быть не менее 90%, если показатель меньше — показан переворот на живот. Если SpO2 в положении на животе менее 90%, показана интубация трахеи. Необходимо кратковременно прекращать подачу кислорода не реже чем 1 раз в 2 часа, если при этом отмечается снижение SpO2 менее 80%, показана интубация трахеи. Если при SpO2 на уровне 90 — 92% отмечается ЧДД более 26 в минуту, чувство нехватки воздуха, ажитация, беспокойство, угнетение сознания — показана интубация трахеи.
Лабораторные признаки, требующие мониторинга:
— уровень лейкоцитов, нейтрофилов, лимфоцитов, тромбоцитов;
— уровень АЛТ, АСТ, СРБ, ферритина, тропонина;
— уровень D-димера;
— протромбиновое время;
— уровень фибриногена;
— уровень ИЛ-6;
— количество T- и B-лимфоцитов.
Инструментальные признаки, требующие мониторинга, — характер и площадь поражения легких на КТ ОГК.
Алгоритм мониторинга лабораторных и инструментальных показателей представлен в Приложении 2.
ПОРЯДОК ВЫПИСКИ ПАЦИЕНТОВ ИЗ МЕДИЦИНСКОЙ ОРГАНИЗАЦИИ
Выписка пациентов с подтвержденным диагнозом COVID-19 разрешается при регрессе клинических проявлений болезни. Решение о выписке пациента может быть принято до получения двух отрицательных результатов лабораторного исследования на наличие РНК SARS-CoV-2.
Клинико-рентгенологические критерии выписки пациентов из медицинской организации:
1. Клинически:
— исчезновение лихорадки (температура тела менее 37,2 °C);
— отсутствие признаков нарастания дыхательной недостаточности при сатурации на воздухе более 96%;
— уменьшение уровня СРБ до уровня менее 2-х норм, уровень лейкоцитов выше 3,0 x 109/л.
2. Рентгенологически: Рентгенография и/или КТ перед выпиской для оценки динамики пневмонии не являются обязательными процедурами, но могут быть назначены лечащим врачом по другим клиническим показаниям. В остальных случаях контрольная рентгенография и/или КТ выполняется в амбулаторных условиях через 1 — 2 месяца после выписки пациента из стационара.
После выписки пациенту должно быть обеспечено оказание медицинской помощи на амбулаторном этапе, включающее в себя:
— ежедневное медицинское наблюдение, в том числе дистанционное;
— проведение при необходимости рентгенологического исследования и/или КТ органов грудной клетки;
— проведение в установленные сроки молекулярно-биологических исследований на наличие РНК коронавируса SARS-CoV-2.
Пациенту после выписки необходимо соблюдать режим самоизоляции до получения двух отрицательных исследований на наличие РНК SARS-CoV-2 (в том числе взятых при госпитализации).
В случае отсутствия у пациента условий для самоизоляции, рассмотреть вопрос о выписке пациента в медицинский обсерватор или другие медицинские организации, обеспечивающие условия изоляции на необходимый срок.
Транспортировка больных коронавирусной инфекцией из стационара
1. При наличии двух отрицательных анализов на коронавирус SARS-CoV-2, взятых с интервалом не менее 1-го дня, пациент выписывается и транспортируется любым доступным транспортом (личным или общественным).
2. При выписке пациента без двух отрицательных анализов, его транспортировка осуществляется санитарным транспортом до места самоизоляции. Водитель санитарного транспорта и сопровождающий больного медицинский работник (при нахождении в изолированной кабине водителя) при транспортировке больного должны использовать СИЗ: медицинская шапочка, одноразовый хирургический халат, медицинские перчатки, защитный респиратор класса не ниже FFP2 или аналог.
При нахождении транспортируемого больного в салоне совместно с водителем и сопровождающим медицинских работником, последние должны использовать полный комплект СИЗ: защитный комбинезон, соответствующий комбинезону инфекциониста защитному I типа, две пары медицинских перчаток, защитный респиратор класса не ниже FFP2 или аналог, защитные очки, бахилы.
ОСОБЕННОСТИ ВЕДЕНИЯ ДЕТЕЙ С COVID-19
По имеющимся данным, дети болеют реже, с менее выраженной клинической симптоматикой, реже требуют госпитализации, заболевание у них протекает легче, что, однако, не исключает случаев тяжелого течения.
Имеющиеся на сегодня данные свидетельствуют о том, что дети составляют до 10% в структуре инфицированных SARS-CoV-2 и до 2% в структуре пациентов с диагностированными клиническими случаями COVID-19.
В Российской Федерации дети составляют 7,6% зарегистрированных случаев COVID-19, количество и возрастная структура манифестных заболеваний у детей в настоящее время неизвестны. Заболевание у новорожденных детей наблюдается крайне редко, при этом внутриутробной передачи инфекции не доказано.
У детей существенно отличаются эпидемиологические факторы риска, т.к. только в 9% случаев заражение вирусом SARS-CoV-2 связано с путешествиями в другие страны и 91% заболевших имели местные контакты, преимущественно в семейных очагах.
У детей отмечается более легкое течение болезни, чем у взрослых, развитие вирусной пневмонии не характерно, симптомы менее выражены, летальные исходы чрезвычайно редки. У детей так же, как у взрослых, доминируют лихорадка и респираторный синдром, однако менее выражены лимфопения и воспалительные маркеры.
Инкубационный период у детей колеблется от 2 до 10 дней, чаще составляет 2 дня.
Клинические симптомы COVID-19 у детей соответствуют клинической картине острой респираторной вирусной инфекции, обусловленной другими вирусами: лихорадка, кашель, боли в горле, чихание, слабость, миалгии. Выраженность лихорадочной реакции может быть различна: лихорадка до 38 °C отмечается у половины больных детей, у трети детей регистрируется повышение температуры тела от 38,1 до 39,0 °C.
Накопленный опыт наблюдения за манифестными случаями COVID-19 у детей показывает, что характерное сочетание лихорадки, кашля и одышки имеет место только у 73% (93% у взрослых). Сопоставление частоты отдельных симптомов также показывает преобладание их у взрослых. По данным американских исследователей, лишь 56% пациентов детского возраста сообщили о лихорадке, 54% о кашле и 13% об одышке, по сравнению с 71%, 80% и 43%, соответственно, среди пациентов в возрасте 18 — 64 лет. У детей не только реже отмечают клинические проявления интоксикации (головная боль 28% против 58% у взрослых; миалгии — 23% против 61%) и дыхательной недостаточности, но и желудочно-кишечные проявления (тошнота/рвота — у 11% против 16%; абдоминальная боль — 5,8% против 12%; диарея — 13% против 31%). Тахикардия отмечается у половины госпитализированных детей, тахипноэ — у трети. У детей редко наблюдается снижение сатурации кислорода крови менее 92%.
По данным разных сведений от 5,7% до 20% детей с COVID-19 были госпитализированы, остальные лечились амбулаторно, в том числе пациенты с легкими, субклиническими и бессимптомными формами, у которых вирус SARS-CoV-2 был выделен при обследовании по контакту. В США у детей с COVID-19 госпитализация потребовалась только 1,6 — 2,5%, причем необходимости в оказании реанимационной помощи не отмечали.
Выраженность клинических проявлений коронавирусной инфекции варьирует от отсутствия симптомов (бессимптомное течение) или легких респираторных симптомов до тяжелой острой респираторной инфекции (ТОРИ), протекающей с:
— высокой лихорадкой;
— выраженным нарушением самочувствия вплоть до нарушения сознания;
— ознобом, потливостью;
— головными и мышечными болями;
— сухим кашлем, одышкой, учащенным и затрудненным дыханием;
— учащенным сердцебиением.
Наиболее частым проявлением ТОРИ является двусторонняя вирусная пневмония, осложненная ОРДС или отеком легких. Возможна остановка дыхания, что требует искусственной вентиляции легких и оказания помощи в условиях отделения анестезиологии и реанимации.
Неблагоприятные исходы развиваются при прогрессирующей дыхательной недостаточности, присоединении вторичной инфекции, протекающей в виде сепсиса.
Возможные осложнения:
— ОРДС;
— Острая сердечная недостаточность;
— Острая почечная недостаточность;
— Септический шок;
— Полиорганная недостаточность (нарушение функций многих органов и систем).
Не у всех детей с подозрением на COVID-19, переносивших тяжелые формы заболевания, был лабораторно выделен вирус SARS-CoV-2, что не позволяет исключить сочетанные инфекции или наличие других респираторных заболеваний у детей с подозрительными случаями заболеваний на основании клинико-эпидемиологических данных.
Легкая степень тяжести характеризуется повышением температуры тела не выше 38,5 °C, отсутствием одышки в покое, но возможно появление ее при физической нагрузке, сатурацией крови кислородом более 95% (SpO2 > 95%).
Средняя степень тяжести характеризуется повышением температуры тела выше 38,5 °C, отсутствием одышки в покое, но ее появлением при физической нагрузке (крике/плаче), SpO2 95%.
Тяжелая степень тяжести COVID-19 характеризуется диспноэ (чувство нехватки воздуха, стеснения в области грудной клетки, одышка или тахипноэ), цианозом/акроцианозом, SpO2 93%.
Крайне тяжелую степень тяжести регистрируют при развитии дыхательной недостаточности с необходимостью респираторной поддержки, респираторного дистресс-синдрома, шока, признаков полиорганной недостаточности (энцефалопатии, сердечно-сосудистой, почечной, печеночной недостаточности, синдрома диссеминированного внутрисосудистого свертывания).
Частота тяжелых и крайне тяжелых случаев заболевания не превышает одного процента. Случаи крайне тяжелого COVID-19 у детей регистрируют обычно при наличии факторов риска: тяжелых преморбидных заболеваний (дети, имеющие заболевания легких, врожденные пороки сердца, бронхолегочную дисплазию, болезнь Кавасаки, гидронефроз, лейкемию и др.), иммунодефицитные состояния разного генеза (чаще заболевают дети старше 5 лет; в 1,5 раза чаще регистрируют пневмонии), нельзя также исключить влияние на тяжесть состояния коинфекции с другими респираторными вирусами (респираторно-синцитиальный вирус, риновирус, бокавирус, аденовирус), для которых характерно поражение нижних отделов респираторного тракта (пневмония, бронхиолит).
При выявлении бессимптомной формы или легкой степени тяжести COVID-19 допустимо лечение в амбулаторных условиях, в том числе и на дому. В случае решения о возможности лечения в амбулаторных условиях врач должен объяснить родителям или другим законным представителям ребенка необходимость соблюдать режим изоляции. Законные представители ребенка, осуществляющие уход, подписывают информированное согласие установленного образца. При условии амбулаторного лечения возможно использовать дистанционное консультирование больного (законного представителя) с помощью телемедицинских технологий.
Показания для госпитализации детей с COVID-19 или подозрением на него:
1. Тяжелая или среднетяжелая степень тяжести респираторного заболевания или внебольничная пневмония.
2. Лихорадка выше 38,5 °C, в том числе по данным анамнеза, или ниже 36,0 °C или при длительности лихорадки выше 38,0 °C более 5 дней.
3. Одышка в покое или при беспокойстве.
4. Тахипноэ, не связанное с лихорадкой, более 20% от возрастной нормы: до 1 года — более 50, от 1 до 5 лет — более 40, старше 5 лет — более 30 в мин.
5. Тахикардия, не связанная с лихорадкой, более 20% от возрастной нормы: до 1 года — более 140, от 1 до 5 лет — более 130, старше 5 лет — более 120 в мин.
6. Парциальное давление кислорода (при наличии пульсоксиметра) — SpO2 95%.
7. Угнетение сознания (сонливость) или повышенное возбуждение, инверсия сна, отказ от еды и питья.
8. Судороги.
9. Отсутствие положительной динамики или нарастание клинической симптоматики на фоне проводимой терапии через 5 дней после начала заболевания.
10. Наличие тяжелых фоновых заболеваний:
— врожденные и приобретенные заболевания сердца, в том числе в анамнезе (пороки сердца, нарушения ритма, миокардиопатия или миокардит);
— хронические заболевания легких (бронхолегочная дисплазия, бронхиальная астма, муковисцидоз, бронхоэктатическая болезнь, врожденные пороки легких и др.);
— первичный или вторичный иммунодефицит, в том числе ВИЧ-инфекция, аутоиммунные заболевания, иммуносупрессивная терапия;
— онкогематологические заболевания, химиотерапия;
— метаболические заболевания (сахарный диабет, ожирение и др.);
— заболевания печени и почек.
11. Невозможность изоляции при проживании с лицами из групп риска.
12. Отсутствие условий для лечения на дому или гарантий выполнения рекомендаций (общежитие, учреждения социального обеспечения, пункт временного размещения, социально неблагополучная семья, плохие социально-бытовые условия).
Показания для перевода в ОРИТ:
— нарушение сознания (14 баллов и менее по шкале комы Глазго для соответствующей возрастной категории) или необъяснимое выраженное возбуждение (плач, крик) на фоне течения острой респираторной инфекции;
— увеличение частоты дыхания более чем на 15% от физиологических возрастных показателей в состоянии покоя;
— стонущее или кряхтящее дыхание;
— увеличение частоты сердечных сокращений более чем на 15% от физиологических возрастных показателей в состоянии покоя;
— цианоз и одышка, определяемые при визуальном осмотре, раздувание крыльев носа у детей первого года жизни;
— сатурация кислорода по пульсоксиметрии при дыхании атмосферным воздухом 93% и ниже;
— респираторный ацидоз (pCO2 > 50 мм рт. ст.);
— декомпенсированные нарушения кислотно-основного состояния крови (pH < 7,25);
— выраженные нарушения тканевой перфузии, артериальная гипотензия;
— лактат-ацидоз (концентрация лактата более 2,5 ммоль/л);
— артериальная гипотония с клиническими проявлениями шока;
— снижение диуреза до уровня олигоурии и ниже (ниже 50% от возрастной нормы и менее);
— появление кашля с примесью крови в мокроте, боли или тяжести в груди;
— появление признаков геморрагического синдрома.
В оказании медицинской помощи в условиях отделения реанимации и интенсивной терапии нуждаются от 0,5% до 2% госпитализированных детей.
В качестве противовирусной терапии детей с COVID-19 в случаях заболеваний среднетяжелой и легкой степени тяжести рекомендуются препараты интерферона-альфа, при тяжелой степени тяжести используются внутривенные иммуноглобулины, ингибиторы протеаз (лопинавир + ритонавир).
Интерферон-альфа может снизить вирусную нагрузку на начальных стадиях болезни, облегчить симптомы и уменьшить длительность болезни. Исследования в КНР у детей показали возможность более длительного выделения вируса с фекалиями, чем из верхних дыхательных путей (до 28 против 14 дней). Поэтому обоснованно применение препаратов интерферона-альфа в свечах, особенно с антиоксидантами, которые обеспечивают системное действие препарата, могут способствовать сокращению периода выделения вируса SARS-CoV-2 с фекалиями.
Умифеновир применяется у пациентов с COVID-19, однако отсутствуют доказательства его эффективности и безопасности. У детей возможно применение препарата в возрасте старше 6 лет.
Осельтамивир и другие противогриппозные средства могут применяться только у пациентов, инфицированных вирусом гриппа.
В настоящее время проводятся исследования в отношении эффективности хлорохина фосфата и гидроксихлорохина сульфата, в том числе и в комбинации с азитромицином при коронавирусной инфекции. По данным исследований использование хлорохина фосфата и гидроксихлорохина сульфата возможно у пациентов, масса тела которых более 50 кг.
Антибактериальная терапия показана при наличии признаков присоединения к инфекции COVID-19 бактериальной инфекции.
Выздоровление у детей преимущественно происходит в течение 1 — 2 недель.
Профилактика
ПРОФИЛАКТИКА КОРОНАВИРУСНОЙ ИНФЕКЦИИ
СПЕЦИФИЧЕСКАЯ ПРОФИЛАКТИКА COVID-19
В настоящее время во многих странах ведется разработка нескольких типов вакцин против COVID-19, однако разрешенные к применению препараты отсутствуют.
НЕСПЕЦИФИЧЕСКАЯ ПРОФИЛАКТИКА COVID-19
Мероприятия по предупреждению завоза и распространения COVID-19 на территории Российской Федерации регламентированы Распоряжениями Правительства РФ от 30.01.2020 N 140-р, от 31.01.2020 N 154-р, от 03.02.2020 N 194-р, от 18.02.2020 N 338-р, от 27.02.2020 N 447-р, от 27.02.2020 N 446-р, от 27.02.2020 N 448-р, от 16.03.2020 N 635-р, от 06.03.2020 N 550-р, от 12.03.2020 N 597-р, от 14.03.2020 N 622-р, от 16 марта 2020 г. N 730-р, от 27 марта 2020 г. N 763-р и постановлениями Главного государственного санитарного врача Российской Федерации от 24.01.2020 N 2, от 31.01.2020 N 3, от 02.03.2020 N 5, от 13.03.2020 N 6, от 18.03.2020 N 7, от 30.03.2020 N 9.
Мероприятия по недопущению распространения COVID-19 в медицинских организациях проводятся в соответствии с приказом Минздрава России от 19.03.2020 N 198н «О временном порядке организации работы медицинских организаций в целях реализации мер по профилактике и снижению рисков распространения новой коронавирусной инфекции COVID-19)» (в ред. Приказов Минздрава России от 27.03.2020 N 246н, от 02.04.2020 N 264н) и «Рекомендациями по предупреждению распространения новой коронавирусной инфекции (COVID-19) в медицинских организациях, осуществляющих оказание медицинской помощи в стационарных условиях» (письмо Роспотребнадзора от 9 апреля 2020 года N 02/6509-2020-32).
Неспецифическая профилактика представляет собой мероприятия, направленные на предотвращение распространения инфекции, и проводится в отношении источника инфекции (больной человек), механизма передачи возбудителя инфекции, а также потенциально восприимчивого контингента (защита лиц, находящихся и/или находившихся в контакте с больным человеком).
Мероприятия в отношении источника инфекции:
— изоляция больных и лиц с подозрением на заболевание;
— назначение этиотропной терапии.
Мероприятия, направленные на механизм передачи возбудителя инфекции:
— соблюдение правил личной гигиены (мыть руки с мылом, использовать одноразовые салфетки при чихании и кашле, прикасаться к лицу только чистыми салфетками или вымытыми руками);
— использование одноразовых медицинских масок, которые должны сменяться каждые 2 часа;
— использование СИЗ для медработников;
— проведение дезинфекционных мероприятий;
— обеззараживание и уничтожение медицинских отходов класса B;
— транспортировка больных специальным транспортом.
Мероприятия, направленные на восприимчивый контингент:
— элиминационная терапия, представляющая собой орошение слизистой оболочки полости носа изотоническим раствором хлорида натрия, обеспечивает снижение числа как вирусных, так бактериальных возбудителей инфекционных заболеваний;
— использование лекарственных средств для местного применения, обладающих барьерными функциями;
— своевременное обращение в медицинские организации в случае появления симптомов острой респираторной инфекции является одним из ключевых факторов профилактики осложнений.
МЕДИКАМЕНТОЗНАЯ ПРОФИЛАКТИКА COVID-19 У ВЗРОСЛЫХ
Для медикаментозной профилактики COVID-19 у взрослых возможно интраназальное введение рекомбинантного интерферона альфа.
Для медикаментозной профилактики COVID-19 у беременных возможно только интраназальное введение рекомбинантного интерферона альфа 2b.
В качестве препарата для химиопрофилактики рассматривается гидроксихлорохин, в случае его недоступности возможно использовать мефлохин.
В ряде стран в условиях напряженной эпидемической ситуации проводят медикаментозную профилактику хлорохином, гидроксихлорохином и мефлохином. Учитывая рост заболеваемости и высокие риски распространения инфекции на территории нашей страны, целесообразно назначение медикаментозной профилактики определенным группам населения (Приложение 12).
МЕРОПРИЯТИЯ ПО ПРЕДУПРЕЖДЕНИЮ РАСПРОСТРАНЕНИЯ COVID-19 В МЕДИЦИНСКОЙ ОРГАНИЗАЦИИ
При поступлении в приемное отделение медицинской организации, оказывающей медицинскую помощь в стационарных условиях, пациента с клиническими проявлениями острого респираторного вирусного заболевания с характерными для COVID-19 симптомами и данными эпидемиологического анамнеза, медицинский работник проводит комплекс первичных противоэпидемических мероприятий с использованием СИЗ.
Медицинский работник, не выходя из помещения, в котором выявлен пациент, с использованием имеющихся средств связи извещает руководителя медицинской организации о выявленном пациенте и его состоянии для решения вопроса об его изоляции по месту его выявления (бокс приемного отделения) до его перевода в мельцеровский бокс медицинской организации, где был выявлен больной, или госпитализации в специализированный инфекционный стационар при невозможности организовать изоляцию пациента в медицинской организации, где он был выявлен. В случае изоляции пациента по месту выявления, перевод в специализированный инфекционный стационар осуществляется после подтверждения диагноза COVID-19.
Медицинский работник должен использовать СИЗ (шапочка, противочумный (хирургический) халат, респиратор класса защиты FFP2 или FFP3), предварительно обработав руки и открытые части тела дезинфицирующими средствами.
Медицинские работники, выявившие пациента с клиническими проявлениями острого респираторного вирусного заболевания с характерными для новой коронавирусной инфекции COVID-19 симптомами, должны осуществлять наблюдение пациента до приезда и передачи его специализированной выездной бригаде скорой медицинской помощи.
После медицинской эвакуации пациента медицинский работник, выявивший пациента, снимает СИЗ, помещает их в бачок с дезинфицирующим раствором, обрабатывает дезинфицирующим раствором обувь и руки, полностью переодевается в запасной комплект одежды. Открытые части тела обрабатываются кожным антисептиком. Рот и горло прополаскивают 70% этиловым спиртом, в нос и в глаза закапывают 2% раствор борной кислоты.
Руководитель медицинской организации, в которой был выявлен пациент, организует сбор биологического материала (мазок из носо- и ротоглотки) у всех медицинских работников и лиц, находившихся с ним в контакте, и направляет их для проведения соответствующего лабораторного исследования.
В целях обеззараживания воздуха в приемном отделении проводится дезинфекция дезинфицирующими средствами, применяются бактерицидный облучатель или другое устройство для обеззараживания воздуха и (или) поверхностей для дезинфекции воздушной среды помещения. Количество необходимых облучателей рассчитывается в соответствии с инструкцией по их применению на кубатуру площади, на которой они будут установлены.
В случае подтверждения диагноза COVID-19 в стационаре необходимо выявить лиц, имевших контакт с пациентом, среди:
— находившихся в данном учреждении;
— переведенных или направленных (на консультацию, стационарное лечение) в другие медицинские организации, и выписанных;
— медицинских и иных работников (гардероб, регистратура, диагностические, смотровые кабинеты);
— посетителей медицинской организации, а также посетителей, покинувших медицинскую организацию к моменту выявления пациента; — лиц по месту жительства пациента, работы, учебы.
За лицами, контактными с пациентом, устанавливают медицинское наблюдение.
Медицинские отходы, в том числе биологические выделения пациентов (мокрота, моча, кал и др.), относятся к чрезвычайно эпидемиологически опасным отходам класса B и подлежат обязательному обеззараживанию (дезинфекции)/обезвреживанию физическими методами (термические, микроволновые, радиационные и другие), для чего в медицинской организации необходимо предусмотреть наличие специализированной установки, работающей с использованием таких методов. Вывоз необеззараженных отходов класса B за пределы территории медицинской организации не допускается. После аппаратных способов обеззараживания с применением физических методов и изменения внешнего вида отходов, отходы класса B могут накапливаться, временно храниться, транспортироваться, уничтожаться и захораниваться совместно с отходами класса A. Применение химических методов дезинфекции возможно только для обеззараживания пищевых отходов и выделений больных, а также при организации противоэпидемических мероприятий в очагах.
РАЦИОНАЛЬНОЕ ИСПОЛЬЗОВАНИЕ СРЕДСТВ ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ В МЕДИЦИНСКИХ ОРГАНИЗАЦИЯХ
С целью ограничения необоснованного расхода СИЗ рекомендуется рационально минимизировать потребности в них в медицинских организациях, а также обеспечить их правильное использование. Для минимизации потребности в СИЗ при одновременном обеспечении безопасности медицинских работников рекомендуется:
— с помощью технических и административных мер ограничить число лиц, работающих в зонах высокого риска и нуждающихся в использовании СИЗ;
— ограничить число медицинских работников, контактирующих с пациентами;
— минимизировать количество входов в палату;
— использовать дистанционное консультирование для пациентов и лиц с подозрением на COVID-19.
— внедрить в практику расширенное использование респираторов (ношение одного и того же респиратора при работе с несколькими пациентами, не снимая респиратор).
Респираторы, или фильтрующие полумаски, — это средство индивидуальной защиты органов дыхания (СИЗОД), предназначенное для снижения риска инфицирования медицинских работников, работающих в условиях высокого риска распространения инфекций, передающихся воздушно-капельным путем. Имеются основания полагать, что быстрому распространению коронавирусной инфекции способствует то, что вирус передается не только при непосредственном контакте с источником инфекции и воздушно-капельным путем (через крупные капли) как большинство ОРВИ, но и в существенной степени через инфекционные аэрозоли (инфицированный воздух). Поэтому применение респираторов (со степенью не ниже защиты FFP2) в зонах высокого риска инфицирования обязательно для медицинского персонала, занятого оказанием медицинской помощи больным новой коронавирусной инфекцией COVID-19.
Принцип работы респиратора состоит в высокоэффективной фильтрации вдыхаемого воздуха, благодаря которой резко снижается риск проникновения в дыхательные пути, в том числе в терминальные бронхиолы и альвеолы, инфекционного аэрозоля (стойкой взвеси в воздухе мельчайших частиц, содержащих жизнеспособные патогенные микроорганизмы).
Для обеспечения максимальной защиты при использовании респиратора должны быть выполнены ряд условий:
— используемые модели респиратора должны быть сертифицированы на соответствие требованиям по крайне мере одного из национальных или международных стандартов: ТР ТС 019/2011 «О безопасности средств индивидуальной защиты», или ГОСТ 12.4.294-2015 или EN 149:2001+A1:2009 «Respiratory protective devices — Filtering half masks to protect against particles»:
— Используемые респираторы должны иметь класс защиты не ниже FFP2;
— Респиратор должен правильно использоваться (правильное надевание, безопасное снятие, уход, обезвреживание и уничтожение как медицинских отходов класса B).
Правильное надевание — наиболее важное условие эффективности его применения для защиты от инфицирования. Правильное надевание абсолютно необходимо для обеспечения максимально герметичного прилегания краев полумаски респиратора к лицу для исключения возможности утечки неотфильтрованного инфицированного воздуха в зону дыхания, минуя высокоэффективный фильтр, каковым и является полумаска респиратора. Крайне важно ознакомиться и тщательно каждый раз выполнять требования инструкции по правильному надеванию респиратора в текстовом или графическом виде в соответствии с вышеперечисленными стандартами всегда находится на упаковке респиратора или во вкладыше.
После каждого надевания респиратора перед входом в зону высокого риска инфицирования необходимо проводить его проверку на утечку: сделать 2 — 3 форсированных вдоха-выдоха, при этом убедиться, что отсутствует подсос и выход воздуха по краям респиратора, а на вдохе респиратор плотно прижимается к лицу без утечки воздуха по краям. Если при этом выявлена утечка воздуха под полумаску, нужно проверить правильность одевания респиратора, повторно надеть его.
Длительность использования респиратора в течение рабочего дня ограничена только гигиеническими соображениями (необходимость приема пищи, появление избыточной влажности под полумаской в жаркую погоду и т.п.), поскольку эффективность фильтрации со временем только повышается при условии, что респиратор не поврежден и обеспечивает хорошее прилегание к лицу.
Безопасное снятие респиратора необходимо для исключения риска инфицирования с наружной поверхности респиратора в результате ее контакта с кожей в случае, если она контаминирована инфицированными биологическими жидкостями. Респиратор снимают в перчатках за резинки (сначала снимая нижнюю резинку, затем верхнюю), не касаясь наружной и внутренней поверхности полумаски респиратора.
Обеззараживание и/или обезвреживание использованных респираторов проводится в соответствии с требованиями к медицинским отходам класса B.
В условиях эпидемии инфекционных заболеваний важно применять организационные меры, позволяющие не только снизить риск внутрибольничного распространения инфекции, но и существенно сократить потребность в респираторах:
— Обучение персонала принципам правильного использования респираторов, в том числе исключение ношения их на шее или лбу во время перерывов в работе, правильное бережное хранение повышает не только эффективность их использования, но и продлевает их срок службы;
— Проведение оценки риска на основании анализа потоков пациентов, посетителей, лабораторных образцов и персонала;
— Максимальное разобщение потоков для выделения зон низкого риска (где использование СИЗОД не требуется) и высокого риска (где использование СИЗОД необходимо). Зоны высокого риска должны быть обозначены специальными предупреждающими знаками, запрещающими доступ туда посторонних лиц без средств защиты;
— Выделение зон отдыха персонала и помещений для офисной работы в максимально изолированных помещениях, куда исключен переток инфицированного воздуха из зон высокого риска. Использование СИЗОД в этих помещениях не требуется;
— Выделение на основе оценки риска более узких групп персонала, который работает в условиях наиболее высокого риска, где требуется применение СИЗОД. Прочий персонал при этом для работы в условиях низкого или среднего уровня риска может эффективно использовать перечисленные организационные меры по его снижению и меры контроля среды обитания (проветривание, ультрафиолетовые излучатели);
— Обязательное круглосуточное применение медицинских масок пациентами, представляющими риск распространения инфекции, вдвое снижает риск для окружающих;
— Применение максимально возможных режимов естественной вентиляции (постоянного максимально возможного проветривания) позволяет достичь резкого снижения концентрации инфекционного аэрозоля в воздухе помещений и соответственно резко снизить риск распространения инфекций через воздух;
— В зонах высокого риска распространения COVID-19 использование кондиционеров комнатного типа (сплит-систем) должно быть исключено, поскольку они фактически повышают риск инфицирования, так как способствуют поддержанию высоких концентраций инфекционного аэрозоля при блокированной естественной вентиляции. Применение различного рода воздухоочистителей-рециркуляторов, в том числе с источником УФБИ внутри, не является эффективной мерой снижения риска распространения воздушных инфекций, включая COVID-19, из-за недостаточной производительности (кратности воздухообмена в помещении), поэтому предпочтение нужно отдавать эффективной механической вентиляции или максимальному постоянному проветриванию.
В период эпидемического подъема заболеваемости COVID-19 их доступность может быть временно ограничена из-за резкого увеличения потребностей в них.
Предлагаемые рекомендации по более длительному и повторному использованию СИЗ имеют временный характер на период возможного недостаточного обеспечения СИЗ.
При дефиците респираторов в медицинской организации возможно введение режима их ограниченного повторного использования (использование одного и того же респиратора с надетой поверх него хирургической маской при многократных контактах с пациентами, при этом после каждого контакта необходима смена верхней хирургической маски).
Повторное использование респиратора тем же медицинским работником в условиях оказания помощи больным с COVID-19 возможно при выполнении следующих условий:
1. Респиратор физически не поврежден;
2. Респиратор обеспечивает плотное прилегание к лицу, исключающее утечку воздуха под полумаску;
3. Респиратор не создает избыточного сопротивления дыханию из-за повышенной влажности;
4. Респиратор не имеет видимых следов контаминации биологическими жидкостями.
Длительность и кратность повторного использования респиратора определяются выполнением всех вышеперечисленных условий. Если по крайней мере одно из вышеперечисленных условий не выполняется, безопасное повторное использование такого респиратора невозможно, и он подлежит обеззараживанию и/или обезвреживанию с последующим захоронением или уничтожением в соответствии с требованиями к медицинским отходам класса B.
Если предполагается повторное использование респиратора, его маркируют инициалами пользователя, дезинфицируют ультрафиолетовым бактерицидным облучением, дают полностью высохнуть, если респиратор влажный, и до использования хранят в бумажном пакете или салфетке.
Допустимо применение УФБИ для обеззараживания наружной поверхности использованных респираторов и их повторного использования. УФБИ, не проникая глубоко внутрь фильтрующего материала, эффективно обеззараживает его облучаемую поверхность, резко снижая риск контактного инфицирования. Для обеззараживания поверхности респиратора его оставляют в тщательно расправленном виде наружной поверхностью вверх по направлению к УФБИ облучателю открытого типа на расстоянии не более 2 м от него на не менее чем 30 минут. Суммарной дозы УФБИ достаточно для надежного обеззараживания незатененной поверхности фильтрующей полумаски для безопасного повторного ее использования при соблюдение вышеперечисленных стандартных мер предупреждения контактного инфицирования.
Использованные респираторы нельзя мыть, механически чистить, обрабатывать дезинфектантами, обеззараживать высокими температурами, паром и т.д. Между периодами повторного использования респиратор должен храниться в расправленном виде в сухом чистом месте (в салфетке или бумажном пакете с инициалами пользователя). Передача респиратора для использования другим человеком не допускается.
Использование поверх правильно одетого респиратора медицинской (хирургической) маски позволяет резко снизить вероятность контаминации наружной поверхности респиратора биологическими жидкостями. При этом после каждого снятия респиратора маска должна быть сброшена в контейнер для отходов класса B, а респиратор может использоваться повторно.
При ограниченном ресурсе респираторов в исключительных случаях допускается использование одноразовых хирургических масок при оказании медицинской помощи пациентам, не нуждающихся в проведении аэрозоль-генерирующих процедур (оксигенация, интубация, санация бронхиального дерева, ИВЛ и др.). В этом случае хирургическая маска должна быть также одета на пациента.
Информация
Источники и литература
-
Министерство здравоохранения Российской Федерации
- 1. Al-Tawfiq J.A., Memish Z.A. Update on therapeutic options for Middle East Respiratory Syndrome Coronavirus (MERS-CoV)//Expert review of anti-infective therapy. 2017. 15. N 3. С. 269 — 275.
2. Assiri A. et al. Middle East respiratory syndrome coronavirus infection during pregnancy: a report of 5 cases from Saudi Arabia//Clin Infect Dis. 2016. N 63. pp. 951 — 953.
3. Alserehi H. et al. Impact of Middle East respiratory syndrome coronavirus (MERS-CoV) on pregnancy and perinatal outcome//BMC Infect Dis. 2016. N 16, p. 105.
4. Baig A.M. et al. Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host-Virus Interaction, and Proposed Neurotropic Mechanisms. ACS Chem. Neurosci. 2020. doi: 10.1021/acschemneuro.0c00122.
5. Bassetti M. The Novel Chinese Coronavirus (2019-nCoV) Infections: challenges for fighting the storm https://doi.org/10.11/eci.13209 URL: https://onlinelibrary.wiley.com/doi/abs/10.1111/eci.13209
6. Behzadi M.A., Leyva-Grado V.H. Overview of Current Therapeutics and Novel Candidates Against Influenza, Respiratory Syncytial Virus, and Middle East Respiratory Syndrome Coronavirus Infections//Frontiers in microbiology. 2019. N 10. p. 1327.
7. Canada.ca. 2019 novel coronavirus: Symptoms and treatment The official website of the Government of Canada URL: https://www.canada.ca/en/public-health/services/diseases/2019-novel-coronavirusinfection/symptoms.html
8. CDC. 2019 Novel Coronavirus URL: https://www.cdc.gov/coronavirus/2019-ncov/index.html
9. Chen N. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study//Lancet. 2020. doi: 10.1016/S0140-6736(20)30211-7
10. Chong Y.P. et al. Antiviral Treatment Guidelines for Middle East Respiratory Syndrome//Infection & chemotherapy. 2015. 47. N 3. pp. 212 — 222.
11. Cinatl J. et al. Treatment of SARS with human interferons//Lancet. 2003. 362. N 9380. pp. 293 — 294.
12. Clinical management of severe acute respiratory infection when Middle East respiratory syndrome coronavirus (MERS-CoV) infection is suspected: Interim Guidance. Updated 2 July 2015. WHO/MERS/Clinical/15.1
13. Colson, P., Rolain, J.M., Lagier, J.C., Brouqui, P., & Raoult, D. Chloroquine and hydroxychloroquine as available weapons to fight COVID-19 International Journal of Antimicrobial Agents 2020.
14. Cortegiani, A., Ingoglia, G., Ippolito, M., Giarratano, A., & Einav, S. (2020). A systematic review on the efficacy and safety of chloroquine for the treatment of COVID-19. Journal of Critical Care.
15. Commonwealth of Australia | Department of Health. Novel coronavirus (2019-nCoV) URL: https://www.health.gov.au/health-topics/novel-coronavirus-2019-ncov
16. Corman V.M. et al. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR//Eurosurveillance. — 2020. — Т. 25. — N 3. — 25(3). doi: 10.2807/1560-7917.ES
17. Coronavirus.URL: https://multimedia.scmp.com/widgets/china/wuhanvirus/?fbclid=IwAR2hDHzpZEh5Nj360i2O 1ES78rXRFymAaFaUK6ZG4m0UTCV1xozulxX1jio
18. Dayer M.R. et al. Lopinavir; A Potent Drug against Coronavirus Infection: Insight from Molecular Docking Study//Arch Clin Infect Dis. 2017; 12(4):e13823. doi: 10.5812/archcid.13823
19. Dyall J. et al. Middle East Respiratory Syndrome and Severe Acute Respiratory Syndrome: Current Therapeutic Options and Potential Targets for Novel Therapies//Drugs. 2017. 77. N 18. С. 1935 — 1966.
20. European Commission. Novel coronavirus 2019-nCoV URL: https://ec.europa.eu/health/coronavirus_en
21. FDA. Novel coronavirus (2019-nCoV) URL: https://www.fda.gov/emergency-preparedness-andresponse/mcm-issues/novel-coronavirus-2019-ncov
22. Federal Ministry of Health. Current information on the coronavirus URL: https://www.bundesgesundheitsministerium.de/en/en/press/2020/coronavirus.html
23. Gao, J., Tian, Z., & Yang, X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. BioScience Trends 2020.
24. Gorbalenya A.E. et al. Severe acute respiratory syndrome-related coronavirus: The species and its viruses — a statement of the Coronavirus Study Group, 2020. doi: https://doi.org/10.1101/2020.02.07.937862
25. Hart B.J. et al. Interferon- and mycophenolic acid are potent inhibitors of Middle East respiratory syndrome coronavirus in cell-based assays//The Journal of general virology. 2014. 95. Pt 3. С. 571 — 577.
26. Huang C. et al. Cinical features of patients infected with 2019 novel coronavirus in Wuhan, China//Lancet. 2020 doi: 10.1016/S0140-6736(20)30183-5. [Epub ahead of print]
27. Ji W. et al. Homologous recombination within the spike glycoprotein of the newly identified coronavirus may boost cross-species transmission from snake to human//Journal of Medical Virology. — 2020.
28. Jeong S.Y. et al. MERS-CoV Infection in a Pregnant Woman in Korea. J Korean Med Sci. 2017 Oct;32(10):1717-1720. doi: 10.3346/jkms.2017.32.10.1717.
29. Junqiang L. et al. CT Imaging of the 2019 Novel Coronavirus (2019-nCoV) Pneumonia https://doi.org/10.1148/radiol.2020200236 URL: https://pubs.rsna.org/doi/10.1148/radiol.2020200236
30. Le Chang et al. Coronavirus Disease 2019: Coronaviruses and Blood Safety. Transfusion Medicine Reviews 2020. doi: 10.1016/j.tmrv.2020.02.003.
31. Li Q et al. Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia N Engl J Med. 2020 Jan 29. doi: 10.1056/NEJMoa2001316
32. Li X et al. Potential of large ‘first generation’ human-to-human transmission of 2019-nCoV. J Med Virol. 2020 Jan 30. doi: 10.1002/jmv.25693. [Epub ahead of print]
33. Lu H. Drug treatment options for the 2019-new coronavirus (2019-nCoV). Biosci Trends. 2020 Jan 28. doi: 10.5582/bst.2020.01020. [Epub ahead of print]
34. Mandell L.A. et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults//Clinical infectious diseases. — 2007. — Т. 44. — N Supplement_2. — pp. S27 — S72.
35. Mao L. et al. Neurological Manifestations of Hospitalized Patients with COVID-19 in Wuhan, China: A retrospective case series study; 2020. doi: https://doi.org/10.1101/2020.02.22.20026500
36. Ministere des Solidarites et de la SanteCoronavirus: questions-reponses URL: https://solidaritessante.gouv.fr/soins-et-maladies/maladies/maladies-infectieuses/coronavirus/coronavirus-questionsreponses
37. Mo Y., Fisher D.A. review of treatment modalities for Middle East Respiratory Syndrome//The Journal of antimicrobial chemotherapy. 2016. 71. N 12. pp. 3340 — 3350.
38. Momattin H. et al. Therapeutic options for Middle East respiratory syndrome coronavirus (MERS-CoV)-possible lessons from a systematic review of SARS-CoV therapy. Int J Infect Dis. 2013 Oct;17(10):e7928
39. National Health Commission of the People’s Republic of China. URL: http://en.nhc.gov.cn
40. Netland J. Severe Acute Respiratory Syndrome Coronavirus Infection Causes Neuronal Death in the Absence of Encephalitis in Mice Transgenic for Human ACE2. J Virol. 2008;82:7264-75.
doi:10.1128/JVI.00737-08.
41. NHS. Coronavirus (2019-nCoV) URL: https://www.nhs.uk/conditions/wuhan-novel-coronavirus/
42. Omrani A.S. et al. Ribavirin and interferon alfa-2a for severe Middle East respiratory syndrome coronavirus infection: a retrospective cohort study//The Lancet Infectious Diseases. 2014. Т. 14. N 11. pp. 1090 — 1095.
43. Outbreak of acute respiratory syndrome associated with a novel coronavirus, China: first local transmission in the EU/EEA — third update URL:
https://www.ecdc.europa.eu/sites/default/files/documents/novel-coronavirus-risk-assessment-china-31january-2020_0.pdf
44. Park M.H. et al. Emergency cesarean section in an epidemic of the Middle East respiratory syndrome: a case report Korean J Anesthesiol, 69 (2016), pp. 287 — 291, doi: 10.4097/kjae.2016.69.3.287
45. Phan L.T. et al. Importation and Human-to-Human Transmission of a Novel Coronavirus in Vietnam//New England Journal of Medicine. — 2020.
46. Phylogeny of SARS-like betacoronaviruses including novel coronavirus (nCoV). URL: https://nextstrain.org/groups/blab/sars-like-cov
47. Public Health England. Investigation and initial clinical management of possible cases of novel coronavirus (2019-nCoV) infection URL: https://www.gov.uk/government/publications/wuhan-novelcoronavirus-initial-investigation-of-possible-cases/investigation-and-initial-clinical-management-ofpossible-cases-of-wuhan-novel-coronavirus-wn-cov-infection
48. Royal Pharmaceutical Society of Great Britain Trading as Royal Pharmaceutical Society. Wuhan novel coronavirus URL: https://www.rpharms.com/resources/pharmacy-guides/wuhan-novel-coronavirus
49. The State Council The People’s Republic Of China URL: http://english.www.gov.cn/
50. The Centers for Disease Control and Prevention (CDC). Interim guidance for healthcare professionals on human infections with 2019 novel coronavirus (2019-nCoV).
URL: https://www.cdc.gov/coronavirus/2019-nCoV/hcp/index.html
51. Touret, F., & de Lamballerie, X. Of chloroquine and COVID-19. Antiviral Research, 104762.
52. Upchurch C.P. et al. Community-acquired pneumonia visualized on CT scans but not chest radiographs: pathogens, severity, and clinical outcomes//Chest. — 2018. — Т. 153. — N 3. — pp. 601 — 610.
53. Wang Z. et al. Clinical characteristics and therapeutic procedure for four cases with 2019 novel coronavirus pneumonia receiving combined Chinese and Western medicine treatment. Biosci Trends 2020. doi: 10.5582/bst.2020.01030.
54. World health organization. Managing Ethical Issues in Infectious Disease Outbreaks. Publication date: 2016. URL: https://www.who.int/ethics/publications/infectious-disease-outbreaks/en/
55. Wu P. et al. Real-time tentative assessment of the epidemiological characteristics of novel coronavirus infections in Wuhan, China, as at 22 January 2020//Eurosurveillance. 2020. Т. 25. N 3. doi: 10.2807/1560-7917.ES.2020.25.3.2000044
56. Zhang L, Liu Y. Potential Interventions for Novel Coronavirus in China:. J Med Virol 2020. doi: 10.1002/jmv.25707.
57. Zhang J. et al. Therapeutic and triage strategies for 2019 novel coronavirus disease in fever clinics. Lancet Respir Med 2020. doi: 10.1016/S2213-2600(20)30071-0.
58. Zumla A. et al. Coronaviruses — drug discovery and therapeutic options//Nature reviews. Drug discovery. 2016. 15. N 5. С. 327 — 347.
59. China CDC. Diagnosis and treatment protocol for COVID-19 patients (trial version 7, revised)
60. Портал непрерывного медицинского и фармацевтического образования Минздрава России URL: https://nmfo-vo.edu.rosminzdrav.ru/#/user-account/view-iom/e8b1f2ca-6be5-9125-4a1e
61. Всемирная организация здравоохранения. Временное руководство по рациональному использованию средств индивидуальной защиты от коронавирусной болезни (COVID-19): 19 марта 2020 г. URL: https://apps.who.int/iris/handle/10665/331498.
62. Всемирная организация здравоохранения. Клиническое руководство по ведению пациентов с тяжелой острой респираторной инфекцией при подозрении на инфицирование новым коронавирусом (2019-nCoV). Временные рекомендации. Дата публикации: 25 января 2020 г. URL:
http://www.euro.who.int/__data/assets/pdf_file/0020/426206/RUS-Clinical-Management-ofNovel_CoV_Final_without-watermark.pdf?ua=1.
63. Всемирная организация здравоохранения. Клиническое руководство по ведению пациентов с тяжелыми острыми респираторными инфекциями при подозрении на инфицирование БВРС-КоВ.
Временные рекомендации. Дата публикации: Июль 2015 г. URL: https://www.who.int/csr/disease/coronavirus_infections/case-management-ipc/ru/
64. Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека. Методические рекомендации МР 3.1.0140-18 «Неспецифическая профилактика гриппа и других острых респираторных инфекций».
65. Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020 Mar 27. doi: 10.1111/jth.14817.
66. Zhang W, Zhao Y, Zhang F, Wang Q, Li T, Liu Z, Wang J, Qin Y, Zhang X, Yan X, Zeng X, Zhang S. The use of anti-inflammatory drugs in the treatment of people with severe coronavirus disease 2019 (COVID-19): The experience of clinical immunologists from China.
67. Gautret F., Lagier J-C., Parola P. et al. Hydroxychloroquine and azithromycin as a treatment of COVID19: results of an openlabel non-randomized clinical trial. International Journal of Antimicrobial Agents
68. In Press 17 March 2020 — DOI: 10.1016/j.ijantimicag.2020.105949
69. Кузьменков А.Ю., Трушин И.В., Авраменко А.А., Эйдельштейн М.В., Дехнич А.В., Козлов Р.С. AMRmap: Интернет-платформа мониторинга антибиотикорезистентности. Клиническая микробиология и антимикробная химиотерапия. 2017;19(2):84-90.
70. Carmeli Y. et al. Health and economic outcomes of antibiotic resistance in Pseudomonas aeruginosa. Arch Intern Med. 1999 May 24;159(10):1127-32.
71. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=4a3c02bc-a256-48f2-90a8-14b48b7d197c&t=
72. Распоряжение Правительства РФ от 12 октября 2019 г. N 2406-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2020 год…»
73. Pogue J., Kaye K., Veve M., et al. «Real World» treatment of multi-drug resistant (MDR) or extensively-drug resistant (XDR) P. aeruginosa infections with ceftolozane/tazobactam (C/T) versus a polymyxin or aminoglycoside (Poly/AG) based regimen: a multicenter comparative effectiveness study. Proceedings of the IDweek 2018, October 3 — 7, San Francisco, USA. Poster/Abstract 2406.
74. Xiao A., et al J Clin Pharm. 2016; 56(1): 56 — 66; Luzelena Caro, David P. Nicolau, Jan J. De Waele et al. Lung penetration, bronchopulmonary pharmacokinetic/pharmacodynamic profile and safety of 3 g of ceftolozane/tazobactam administered to ventilated, critically ill patients with pneumonia. Journal of Antimicrobial Chemotherapy, dkaa049, https://doi.org/10.1093/jac/dkaa049 Published: 24 March 2020
75. Tommaso Lupia*, Silvia Scabini, Simone Mornese Pinna, Giovanni Di Perri, Francesco Giuseppe De Rosa, Silvia Corcione «2019 novel coronavirus (2019-nCoV) outbreak: A new challenge», Journal of Global Antimicrobial Resistance 21 (2020) 22 — 27
76. https://www.vmeda.org/wp-content/uploads/2020/03/koronavirus-metod-rekomendaczii.pdf
77. Lupia T. et al. 2019 novel coronavirus (2019-nCoV) outbreak: A new challenge Journal of Global Antimicrobial Resistance Volume 21, June 2020, Pages 22 — 27
78. Fan HH. et al. Repurposing of clinically approved drugs for treatment of coronavirus disease 2019 in a 2019-novel coronavirus (2019-nCoV) related coronavirus model. Chin Med J (Engl). 2020 Mar 6. doi: 10.1097/CM9.0000000000000797
79. Devaux CA, Rolain JM, Colson P, Raoult D. New insights on the antiviral effects of chloroquine against coronavirus: what to expect for COVID-19? Int J Antimicrob Agents. 2020 Mar 12:105938. doi: 10.1016/j.ijantimicag.2020.105938.
80. Ludvigsson JF. Systematic review of COVID-19 in children show milder cases and a better prognosis than adults https://doi.org/10.1111/apa.15270
81. World Health Organization. WHO Blood Regulators Network (BRN) Position Paper on Use of Convalescent Plasma, Serum or Immune Globulin Concentrates as an Element in Response to an Emerging Virus* September 2017 https://www.who.int/bloodproducts/brn/2017_BRN_PositionPaper_ConvalescentPlasma.pdf
82. World Health Organization. Infection prevention and control guidance for long-term care facilities in the context of COVID-19: interim guidance, 21 March 2020. World Health Organization; 2020.
83. Zhang W. et al. The use of anti-inflammatory drugs in the treatment of people with severe coronavirus disease 2019 (COVID-19): The Perspectives of clinical immunologists from China. Clin Immunol. 2020 Mar 25;214:108393. doi: 10.1016/j.clim.2020.108393. [Epub ahead of print]
84. Mehta P, et al. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020 Mar 28;395(10229):1033-1034. doi: 10.1016/S0140-6736(20)30628-0. Epub 2020 Mar 16.
85. Левшин Н.Ю., Баранов А.А., Аршинов А.В. Низкомолекулярный гепарин второго поколения: эффективность, безопасность, мотивация приоритетного применения в клинической практике. Трудный пациент. 2014. — N 6. С. 7 — 14.
- 1. Al-Tawfiq J.A., Memish Z.A. Update on therapeutic options for Middle East Respiratory Syndrome Coronavirus (MERS-CoV)//Expert review of anti-infective therapy. 2017. 15. N 3. С. 269 — 275.
Информация
СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ
АКЛ — абсолютное количество лимфоцитов
АКН — абсолютное количество нейтрофилов
АПФ — ангиотензин-превращающий фермент
АЧТВ — активированное частичное тромбопластиновое время
ВОЗ — Всемирная организация здравоохранения
ГЭБ — гематоэнцефалический барьер
ДН — дыхательная недостаточность
ИВЛ — искусственная вентиляция легких
ИФН — интерферон
КИЕ — калликреиновые инактивирующие единицы
КНР — Китайская Народная Республика
КТ — компьютерная томография
МЕ — международные единицы измерения
МНО — международное нормализованное отношение
МО — медицинская организация
НИВЛ — неинвазивная вентиляция легких
НМГ — низкомолекулярный гепарин
НФГ — нефракционированный гепарин
ОГК — органы грудной клетки
ОДН — острая дыхательная недостаточность
ОКС — острый коронарный синдром
ОРВИ — острая респираторная вирусная инфекция
ОРИ — острая респираторная инфекция
ОРДС — острый респираторный дистресс-синдром
ОРИТ — отделение реанимации и интенсивной терапии
ПЦР — полимеразная цепная реакция
РНК — рибонуклеиновая кислота
РСВ — респираторно-синцитиальный вирус
СИЗ — средства индивидуальной защиты
СИЗОД — средства индивидуальной защиты органов дыхания
СРБ — С-реактивный белок
СШ — септический шок
ТИБ — транспортировочный изолирующий бокс
ТОРИ — тяжелая острая респираторная инфекция
ТОРС (SARS) — тяжелый острый респираторный синдром
ТЭЛА — тромбоэмболия легочной артерии
УФБИ — ультрафиолетовое бактерицидное излучение
ФБС — фибробронхоскопия
ЭКГ — электрокардиография
ЭКМО — экстракорпоральная мембранная оксигенация
COVID-19 — инфекция, вызванная новым коронавирусом SARS-CoV-2
FiO2 — концентрация кислорода в дыхательной смеси
MDR — штаммы с множественной резистентностью
MERS — Ближневосточный респираторный синдром
MERS-CoV — коронавирус, вызвавший вспышку Ближневосточного респираторного синдрома
MRSA — метициллин-резистентный золотистый стафилококк
PaCO2 — парциальное давление в крови углекислого газа
PaO2 — парциальное давление в крови кислорода
PEEP — постоянно положительное давление в дыхательных путях (Positive End Expiratory Pressure)
PvO2 — напряжение кислорода в венозной крови
SARS (ТОРС) — тяжелый острый респираторный синдром
SARS-CoV — коронавирус, вызвавший вспышку тяжелого острого респираторного синдрома
SARS-CoV-2 — новый коронавирус, вызвавший вспышку инфекции в 2019 — 2020 гг.
SARS-CoV-2 — новый коронавирус, вызвавший вспышку инфекции в 2019 — 2020 гг.
SOFA — шкала SOFA (Sequential Organ Failure Assessment) для оценки органной недостаточности, риска смертности и сепсиса
SpO2 — уровень насыщенности крови кислородом (сатурация)
T — температура тела
Vt — дыхательный объем (мл)/масса тела (кг) пациента
XDR — штаммы с экстремальной резистентностью
СОСТАВ РАБОЧЕЙ ГРУППЫ
Камкин Евгений Геннадьевич — заместитель Министра здравоохранения Российской Федерации
Костенко Наталья Алексеевна — директор Департамента организации экстренной медицинской помощи и управления рисками здоровью Министерства здравоохранения Российской Федерации
Каракулина Екатерина Валерьевна — директор Департамента организации медицинской помощи и санаторно-курортного дела Министерства здравоохранения Российской Федерации
Авдеев Сергей Николаевич — главный внештатный специалист пульмонолог, заведующий кафедрой пульмонологии федерального государственного автономного образовательного учреждения высшего образования Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет), заместитель директора Федерального государственного бюджетного учреждения «Научно-исследовательский институт пульмонологии Федерального медико-биологического агентства»
Адамян Лейла Владимировна — главный внештатный специалист по акушерству и гинекологии, заместитель директора по научной работе Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации
Байбарина Елена Николаевна — директор департамента медицинской помощи детям и службы родовспоможения Министерства здравоохранения Российской Федерации
Баранов Александр Александрович — главный внештатный специалист педиатр, научный руководитель Федерального государственного автономного научного учреждения «Национальный медицинский исследовательский центр здоровья детей» Министерства здравоохранения Российской Федерации
Баранова Наталья Николаевна — главный врач Центра медицинской эвакуации и экстренной медицинской помощи Федерального государственного бюджетного учреждения «Всероссийский центр медицины катастроф «Защита» Министерства здравоохранения Российской Федерации
Белобородов Владимир Борисович — заведующий кафедрой инфекционных болезней Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации
Бойко Елена Алексеевна — начальник отдела координационно-аналитического центра по обеспечению химической и биологической безопасности федерального государственного бюджетного учреждения «Центр стратегического планирования и управления медикобиологическими рисками здоровью» Министерства здравоохранения Российской Федерации
Брико Николай Иванович — главный внештатный специалист эпидемиолог, заведующий кафедрой эпидемиологии и доказательной медицины Федерального государственного автономного образовательного учреждения высшего образования Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет)
Васильева Ирина Анатольевна — главный внештатный специалист-фтизиатр Минздрава России, директор федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Веселова Елена Игоревна — научный сотрудник отдела инфекционной патологии Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Волчкова Елена Васильевна — заведующая кафедрой инфекционных болезней Первого Московского государственного медицинского университета им. И.М. Сеченова
Волченков Григорий Васильевич — главный врач государственного бюджетного учреждения здравоохранения Владимирской области Центр специализированной фтизиопульмонологической помощи
Гапонова Татьяна Владимировна — главный внештатный специалист трансфузиолог Минздрава России, заместитель генерального директора по трансфузиологии Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр гематологии» Министерства здравоохранения Российской Федерации
Гончаров Сергей Федорович — главный внештатный специалист по медицине катастроф Минздрава России, директор Федерального государственного бюджетного учреждения «Всероссийский центр медицины катастроф «Защита» Министерства здравоохранения Российской Федерации
Даниленко Дарья Михайловна — заместитель директора по научной работе Федерального государственного бюджетного учреждения «Научно-исследовательский институт гриппа им. А.А. Смородинцева» Министерства здравоохранения Российской Федерации
Дмитриев Александр Сергеевич — врач-инфекционист группы анализа оказания медицинской помощи при инфекционных болезнях Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Драпкина Оксана Михайловна — главный внештатный специалист по терапии и общей врачебной профилактике, директор Федерального государственного учреждения «Национальный медицинский исследовательский центр профилактической медицины» Министерства здравоохранения Российской Федерации
Загребнева Алена Игоревна — доцент кафедры общей терапии ФУВ ФГБОУ ВО РНИМУ им. Н.И. Пирогова, главный внештатный ревматолог Департамента здравоохранения г. Москвы Зайцев Андрей Алексеевич — главный пульмонолог Министерства обороны Российской Федерации, главный пульмонолог Федерального государственного бюджетного учреждения «Главный военный клинический госпиталь имени академика Н.Н. Бурденко» Министерства обороны Российской Федерации
Зюзя Юлия Рашидовна — врач-патологоанатом Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Иванов Дмитрий Олегович — главный внештатный специалист неонатолог Министерства здравоохранения Российской Федерации, ректор ФГБУ ВО Санкт-Петербургского государственного педиатрического медицинского университета
Исаева Ирина Владимировна — заместитель начальника Штаба Всероссийской службы медицины катастроф Федерального государственного бюджетного учреждения «Всероссийский центр медицины катастроф «Защита» Министерства здравоохранения Российской Федерации
Каминский Григорий Дмитриевич — руководитель отдела инфекционной патологии Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Качанова Наталья Александровна — заведующая отделением организационно-методической работы Центра медицинской эвакуации и экстренной медицинской помощи Федерального государственного бюджетного учреждения «Всероссийский центр медицины катастроф «Защита» Министерства здравоохранения Российской Федерации
Клюев Олег Игоревич — заведующий отделением анестезиологии и реанимации с палатами реанимации и интенсивной терапии Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Лиознов Дмитрий Анатольевич — исполняющий обязанности директора Федерального государственного бюджетного учреждения «Научно-исследовательский институт гриппа им. А.А. Смородинцева» Министерства здравоохранения Российской Федерации
Лобзин Юрий Владимирович — главный внештатный специалист по инфекционным болезням у детей, директор Федерального государственного бюджетного учреждения «Детский научно-клинический центр инфекционных болезней Федерального медико-биологического агентства»
Лукина Галина Викторовна — заведующий научно-исследовательским отделом ревматологии, руководитель Московского городского ревматологического центра Государственного бюджетного учреждения здравоохранения «Московский клинический научный центр им. А.С. Логинова» департамента здравоохранения г. Москвы, ведущий научный сотрудник лаборатории изучения коморбидных инфекций и мониторинга безопасности лекарственной терапии Федерального государственного бюджетного научного учреждения «Научно-исследовательский институт ревматологии им. В.А. Насоновой»
Малеев Виктор Васильевич — советник директора по научной работе Федерального бюджетного учреждения науки Центральный научно-исследовательский институт эпидемиологии Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
Мамонова Нина Алексеевна — научный сотрудник лаборатории генетических технологий и трансляционных исследований Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Малинникова Елена Юрьевна — главный внештатный специалист по инфекционным болезням, заведующая кафедрой вирусологии Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации
Митьков Владимир Вячеславович — заведующий кафедрой ультразвуковой диагностики Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации
Молчанов Игорь Владимирович — главный внештатный специалист Минздрава России по анестезиологии-реаниматологии, заведующий кафедрой анестезиологии и реаниматологии Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации
Морозов Сергей Павлович — главный внештатный специалист по лучевой и инструментальной диагностике Минздрава России по Центральному Федеральному округу Российской Федерации, директор государственного бюджетного учреждения здравоохранения «Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения Москвы»
Никифоров Владимир Владимирович — заведующий кафедрой инфекционных болезней и эпидемиологии Федерального государственного автономного образовательного учреждения высшего образования «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации
Омельяновский Виталий Владимирович — генеральный директор Федерального государственного бюджетного учреждения «Центр экспертизы и контроля качества медицинской помощи» Министерства здравоохранения Российской Федерации
Панченко Елизавета Павловна — руководитель отдела клинических проблем атеротромбоза Института кардиологии им. А.Л. Мясникова Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр кардиологии» Министерства здравоохранения Российской Федерации
Панова Анна Евгеньенва — заведующая отделением лабораторной диагностикии Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Пименов Николай Николаевич — заведующий лабораторией эпидемиологии инфекционных болезней Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Плоскирева Антонина Александровна — заместитель директора по клинической работе Федерального бюджетного учреждения науки Центральный научно-исследовательский институт эпидемиологии Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
Проценко Денис Николаевич — главный внештатный специалист по анестезиологии — реаниматологии Департамента здравоохранения города Москвы, Главный врач ГБУЗ Городская клиническая больница N 40 ДЗМ, доцент кафедры анестезиологии и реаниматологии ГБОУ ВПО «РНИМУ имени Н.И. Пирогова» Минздрава России
Пшеничная Наталья Юрьевна — руководитель международного отдела по организации оказания медицинской помощи Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Родин Александр Анатольевич — заведующий отделением лучевой диагностики Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Романов Владимир Васильевич — заместитель руководителя Федерального медико-биологического агентства
Русских Анастасия Евгеньевна — научный сотрудник отдела дифференциальной диагностики и лечения туберкулеза и сочетанных инфекций Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Савченко Валерий Григорьевич — главный внештатный специалист гематолог Минздрава России, генеральный директор Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр гематологии» Министерства здравоохранения Российской Федерации
Самойлова Анастасия Геннадьевна — первый заместитель директора Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Синицын Валентин Евгеньевич — заведующий курсом лучевой диагностики и лучевой терапии факультета фундаментальной медицины Московского государственного университета имени М.В. Ломоносова, профессор кафедры рентгенологии и радиологии Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации
Степаненко Сергей Михайлович — главный внештатный детский специалист анестезиолог-реаниматолог, профессор кафедры детской хирургии педиатрического факультета Федерального государственного бюджетного образовательного учреждения высшего образования «Российский национальный исследовательский медицинский имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации
Суранова Татьяна Григорьевна — заместитель начальника управления организации медицинской защиты населения от экстремальных факторов Штаба ВСМК Федерального государственного бюджетного учреждения «Всероссийский центр медицины катастроф «Защита» Министерства здравоохранения Российской Федерации
Сухоруких Ольга Александровна — начальник отдела медицинского обеспечения стандартизации Федерального государственного бюджетного учреждения «Центр экспертизы и контроля качества медицинской помощи» Министерства здравоохранения Российской Федерации
Трагира Ирина Николаевна — руководитель центра инфекционных болезней Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Тюрин Игорь Евгеньевич — главный внештатный специалист по лучевой и инструментальной диагностике, заведующий кафедрой рентгенологии и радиологии Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации
Уртиков Александр Валерьевич — научный сотрудник лаборатории эпидемиологии инфекционных болезней Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Усков Александр Николаевич — главный внештатный специалист по инфекционным болезням у детей ФМБА России, заместитель директора Федерального государственного бюджетного учреждения «Детский научно-клинический центр инфекционных болезней Федерального медико-биологического агентства»
Фомичева Анастасия Александровна — врач-эпидемиолог центра инфекционных болезней, младший научный сотрудник лаборатории эпидемиологии инфекционных болезней Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Франк Георгий Авраамович — главный патологоанатом Минздрава России, заведующий кафедрой патологической анатомии Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации
Цинзерлинг Всеволод Александрович — заведующий НИО патоморфологии Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр имени В.А. Алмазова» Министерства Здравоохранения Российской Федерации
Ченцов Владимир Борисович — заведующий отделением реанимации и интенсивной терапии государственного бюджетного учреждения здравоохранения города Москвы «Инфекционная клиническая больница N 2 Департамента здравоохранения города Москвы»
Чуланов Владимир Петрович — заместитель директора по научной работе и инновационному развитию Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Шипулин Герман Александрович — заместитель директора Федерального государственного бюджетного учреждения «Центр стратегического планирования и управления медико-биологическими рисками здоровью» Министерства здравоохранения Российской Федерации
Шлемская Валерия Вадимовна — заместитель директора Федерального государственного бюджетного учреждения «Всероссийский центр медицины катастроф «Защита» Министерства здравоохранения Российской Федерации
Шульгина Марина Владимировна — советник директора по науке Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Министерства здравоохранения Российской Федерации
Ярошецкий Андрей Игоревич — заведующий отделом анестезиологии и реаниматологии НИИ Клинической хирургии Российского Национального исследовательского медицинского университета им. Н.И. Пирогова.
ПОРЯДОК ПРОВЕДЕНИЯ ПАТОЛОГОАНАТОМИЧЕСКИХ ВСКРЫТИЙ
В случае смерти в стационаре больного с установленным при жизни диагнозом COVID-19 или отнесенного к категории «подозрительный и вероятный случай COVID-19» патологоанатомическое вскрытие в соответствии с Федеральным законом N 323-ФЗ от 21.11.2011 «Об основах охраны здоровья граждан в Российской Федерации» и приказом Минздрава России N 354н от 06.06.2013 «О порядке проведения патологоанатомических вскрытий» проводится в патологоанатомических отделениях, обслуживающих данное учреждение здравоохранения. Отмена вскрытия не допускается. Категория сложности 5 (приложение 1 Приказа N 354н).
Администрация патологоанатомических бюро, патологоанатомических отделений больниц и бюро судебно-медицинской экспертизы обеспечивает соблюдение требований СП 1.3.3118-13 «Безопасность работы с микроорганизмами I — II групп патогенности (опасности)» и другими нормативными и методическими документами в отдельной секционной.
В патологоанатомическом отделении должен быть полный набор инструкций и необходимых средств для их реализации:
— Методическая папка с оперативным планом противоэпидемических мероприятий в случае выявления больного COVID-19;
— Схема оповещения;
— Памятка по технике вскрытия и забора материала для бактериологического исследования;
— Функциональные обязанности на всех сотрудников отделения;
— Защитная одежда (противочумный костюм II типа и др.);
— Укладка для забора материала;
— Стерильный секционный набор;
— Запас дезинфицирующих средств и емкости для их приготовления.
Медицинские отходы, образующиеся в результате патологоанатомического вскрытия таких трупов, подлежат обеззараживанию и/или обезвреживанию в соответствии с требованиями к медицинским отходам класса В (СанПиН 2.1.7.2790-10 «Санитарноэпидемиологические требования к обращению с медицинскими отходами»).
Патологоанатомическое вскрытие осуществляется в соответствии с Приказом Минздрава России N 354н в присутствии специалиста организации, уполномоченной осуществлять федеральный государственный санитарно-эпидемиологический надзор. Вскрытие проводит или его контролирует заведующий/ наиболее опытный патологоанатом. Вскрытие должно быть проведено в максимально возможные ранние сроки. Аутопсийный материал (кусочек легкого, а по клиническим показаниям и других органов) в кратчайшие сроки направляется в ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации на предмет наличия COVID-19, а также других вирусных и бактериальных возбудителей респираторных инфекций. Объем и вид биологического материала согласовывается с территориальным органом Роспотребнадзора.
В патологоанатомическом отделении проводится гистологическое исследование с изучением всех основных органов, подробным описанием морфологических изменений, особое внимание уделяя изменениям в органах дыхательной системы. В необходимых случаях следует использовать дополнительные окраски и методы исследования. Все диагностически значимые морфологические изменения необходимо по возможности фиксировать с помощью фото- (или видео-) съемки.
Для гистологического исследования забирают образцы каждого органа. Их фиксация по продолжительности должна соответствовать размерам кусочка. После фиксации кусочки ткани эпидемиологической опасности не представляют и дальнейшая пробоподготовка проводится обычным образом. Микроскопическое исследование включает в обязательном порядке: трахею (проксимальный и дистальный отделы); центральную часть легкого с сегментарными бронхами, правые и левые бронхи первого порядка; репрезентативные участки легочной паренхимы из правого и левого легкого. Кроме того, забирают фрагменты печени, селезенки, почки, сердца, надпочечника, поджелудочной железы, головного мозга с мягкой мозговой оболочкой, желудка, тонкой кишки, толстой кишки, внутригрудной лимфатический узел (например, бифуркационный), а при необходимости и других органов. При выявлении в ходе секционного исследования патологических изменений необходимо взять фрагменты измененных органов и тканей. При необходимости проводится маркировка образцов.
Окончательный патологоанатомический диагноз формулируется в соответствии с клиническими рекомендациями Российского общества патологоанатомов «Формулировка патологоанатомического диагноза при некоторых инфекционных и паразитарных болезнях» RPSA.1(2016) после завершения гистологического исследования и получения результатов лабораторных исследований. Проводится консультирование наблюдений ведущим специалистом по инфекционной патологии субъекта Российской Федерации, определенным его исполнительным органом в области здравоохранения, а при необходимости и ведущими специалистами страны из числа членов рабочей группы главного патологоанатома Минздрава России.
При формулировке патологоанатомического диагноза следует дифференцировать:
1) Наступление летального исхода от COVID-19, когда COVID-19 является основным заболеванием (первоначальной причиной смерти);
2) Наступление летального исхода от других заболеваний, при наличии COVID-19 (диагностированной с применением методов амплификации нуклеиновых кислот), но без ее клинико-морфологических проявлений, которые могли бы стать причиной смерти.
Наиболее частым осложнением COVID-19 является ОРДС. Кроме того, зарегистрированы такие осложнения, которые также могут рассматриваться как непосредственная причина смерти:
— Острая сердечная недостаточность;
— Острая почечная недостаточность;
— Септический шок;
— ДВС;
— Полиорганная недостаточность (нарушение функций многих органов и систем);
— Вторичные бактериальные и грибковые инфекции.
МАРШРУТИЗАЦИЯ ПАЦИЕНТОВ И ОСОБЕННОСТИ ЭВАКУАЦИОННЫХ МЕРОПРИЯТИЙ БОЛЬНЫХ ИЛИ ЛИЦ С ПОДОЗРЕНИЕМ НА COVID-19
МАРШРУТИЗАЦИЯ ПАЦИЕНТОВ И ЛИЦ С ПОДОЗРЕНИЕМ НА COVID-19
Порядок маршрутизации регулирует вопросы оказания медицинской помощи пациентам с COVID-19 в медицинских организациях.
Медицинская помощь пациентам с COVID-19 осуществляется в соответствии с приказом Министерства здравоохранения России от 19.03.2020 N 198н «О временном порядке организации работы медицинских организаций в целях реализации мер по профилактике и снижению рисков распространения новой коронавирусной инфекции COVID-19» (в ред. от 27.03.2020 и от 02.04.2020) в виде скорой, первичной медико-санитарной и специализированной медицинской помощи в медицинских организациях и их структурных подразделениях, а также в амбулаторных условиях (на дому).
В зависимости от степени тяжести состояния при подтверждении диагноза коронавирусной инфекции лечение осуществляют:
— Медицинские работники амбулаторных медицинских организаций на дому (в случае отсутствия у пациента клинических проявлений заболеваний или легком течении заболевания);
— В отделении для лечения инфекционных больных медицинской организации;
— В ОРИТ медицинской организации (при наличии показаний).
Скорая, в том числе скорая специализированная, медицинская помощь больным инфекционным заболеванием оказывается фельдшерскими выездными бригадами скорой медицинской помощи, врачебными выездными бригадами скорой медицинской помощи, специализированными выездными бригадами скорой медицинской помощи, бригадами экстренной медицинской помощи территориальных центров медицины катастроф.
Деятельность бригад направлена на проведение мероприятий по устранению угрожающих жизни состояний с последующей медицинской эвакуацией в медицинскую организацию, оказывающую стационарную медицинскую помощь больным инфекционными заболеваниями. Медицинская помощь больным инфекционными заболеваниями с жизнеугрожающими острыми состояниями, в том числе с инфекционно-токсическим, гиповолемическим шоком, отеком-набуханием головного мозга, острыми почечной и печеночной недостаточностью, острой сердечно-сосудистой и дыхательной недостаточностью, вне медицинской организации оказывается бригадами (в том числе реанимационными) скорой медицинской помощи.
ПОРЯДОК ОРГАНИЗАЦИИ МЕДИЦИНСКОЙ ПОМОЩИ
В целях обеспечения готовности к проведению противоэпидемических мероприятий в случае завоза и распространения COVID-19, медицинским организациям необходимо иметь оперативный план первичных противоэпидемических мероприятий при выявлении больного, подозрительного на данное заболевание, руководствоваться действующими нормативными, методическими документами, санитарным законодательством в установленном порядке, в том числе региональным Планом санитарно-противоэпидемических мероприятий по предупреждению завоза и распространения новой коронавирусной инфекции, вызванной SARS-CoV-2, утвержденным уполномоченным органом исполнительной власти субъекта Российской Федерации.
а) Порядок организации скорой, в том числе скорой специализированной, медицинской помощи.
Руководителям медицинских организаций, оказывающих скорую медицинскую помощь, необходимо обеспечить:
— Наличие запаса необходимых расходных материалов для отбора проб для проведения лабораторных исследований на наличие COVID-19, дезинфекционных средств и средств индивидуальной защиты.
— Информирование медицинских работников по вопросам профилактики, диагностики и лечения COVID-19.
— Выполнение Инструкции по соблюдению мер инфекционной безопасности для специализированных выездных бригад скорой медицинской помощи согласно Приложению N 13 к настоящим методическим рекомендациям.
— Передачу биологического материала пациентов (мазки из носо- и ротоглотки) при подозрении на COVID-19 в лаборатории медицинских организаций, имеющих эпидемиологическое заключение на работу с III и IV группами патогенности.
— Указание медицинскими работниками в бланке направления на лабораторное исследование диагноза «пневмония» при направлении биологического материала пациентов с внебольничной пневмонией для диагностики COVID-19.
— Системную работу по информированию населения о рисках COVID-19, мерах индивидуальной профилактики, необходимости своевременного обращения за медицинской помощью при появлении первых симптомов ОРВИ.
б) Порядок организации медицинской помощи в стационарных условиях.
Руководителям медицинских организаций, оказывающих медицинскую помощь в стационарных условиях, необходимо обеспечить:
— Наличие запаса необходимых расходных материалов для отбора биологического материала для проведения лабораторных исследований, дезинфекционных средств и средств индивидуальной защиты (очки, одноразовые перчатки, респиратор соответствующего класса защиты, противочумный костюм 1 типа или одноразовый халат, бахилы), обеспечение медицинскими изделиями, в том числе пульсоксиметрами, аппаратами искусственной вентиляции легких.
— Информирование медицинских работников по вопросам профилактики, диагностики и лечения COVID-19, а также сбора эпидемиологического анамнеза.
— Госпитализацию пациентов с нетипичным течением ОРВИ, внебольничной пневмонией.
— Проведение противоэпидемических мероприятий при выявлении подозрения на инфекционное заболевание, вызванное штамма SARS-CoV-2, в соответствии с требованиями Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека.
— Прием через приемно-смотровые боксы и (или) фильтр-боксы пациентов с признаками ОРВИ, внебольничных пневмоний и дальнейшую маршрутизацию пациентов в медицинской организации.
— Разделение работников медицинской организации на лиц, контактировавших с пациентами с симптомами ОРВИ, внебольничной пневмонией, и лиц неконтактировавших, исключив возможность их пересечения.
— Соблюдение температурного режима, режима проветривания, текущей дезинфекции в медицинской организации, использование работниками медицинской организации средств индивидуальной защиты.
— Проведение обеззараживания воздуха и поверхностей в помещениях с использованием бактерицидных облучателей и (или) других устройств для обеззараживания воздуха и (или) поверхностей.
— Контроль концентрации дезинфицирующих средств в рабочих растворах.
— Увеличение кратности дезинфекционных обработок помещений медицинских организаций.
— Передачу биологического материала от пациентов (мазки из носо- и ротоглотки) при подозрении на COVID-19 в лаборатории медицинских организаций, имеющих эпидемиологическое заключение на работу с III и IV группами патогенности, с оформлением Акта приема-передачи.
— Указание медицинскими работниками в бланке направления на лабораторное исследование диагноза «пневмония» при направлении биологического материала пациентов с внебольничной пневмонией для диагностики COVID-19.
— Информирование населения о рисках распространения COVID-19, мерах индивидуальной профилактики, обращая особое внимание на необходимость своевременного обращения за медицинской помощью при появлении первых симптомов ОРВИ.
— Рассмотрение возможности переноса сроков оказания медицинской помощи в плановой форме.
в) Порядок организации медицинской помощи в амбулаторных условиях и условиях дневного стационара.
Руководителям медицинских организаций, оказывающих медицинскую помощь в амбулаторных условиях и условиях дневного стационара необходимо обеспечить:
— Наличие запаса расходных материалов для отбора проб для проведения лабораторных исследований, дезинфекционных средств и медицинских изделий, включая средства индивидуальной защиты (очки, одноразовые перчатки, респиратор соответствующего класса защиты, противочумный костюм 1 типа или одноразовый халат, бахилы), медицинские изделия, включая пульсоксиметры.
— Информирование медицинских работников по вопросам профилактики, диагностики и лечения COVID-19, а также сбора эпидемиологического анамнеза.
— Госпитализацию пациентов с нетипичным течением ОРВИ и внебольничной пневмонией.
— Проведение противоэпидемических мероприятий при выявлении подозрения на COVID-19.
— Прием через приемно-смотровые боксы и (или) фильтр-боксы пациентов с признаками ОРВИ, а также схемы дальнейшей маршрутизации пациентов в медицинские организации, оказывающие медицинскую помощь в стационарных условиях.
— Соблюдение температурного режима, режима проветривания, текущей дезинфекции в медицинской организации, использование работниками медицинской организации средств индивидуальной защиты.
— Проведение обеззараживания воздуха и поверхностей в помещениях с использованием бактерицидных облучателей и (или) других устройств для обеззараживания воздуха и (или) поверхностей.
— Контроль концентрации дезинфицирующих средств в рабочих растворах.
— Увеличение кратности дезинфекционных обработок помещений медицинских организаций.
— Передачу биологического материала от пациентов (мазки из носо- и ротоглотки) при подозрении на COVID-19 в лаборатории медицинских организаций, имеющих эпидемиологическое заключение на работу с III и IV группами патогенности, с оформлением Акта приема-передачи.
— Указание медицинскими работниками в бланке направления на лабораторное исследование диагноза «пневмония» при направлении биологического материала пациентов с внебольничной пневмонией для диагностики COVID-19.
— Системную работу по информированию населения о рисках COVID-19, мерах индивидуальной профилактики, обращая особое внимание на необходимость своевременного обращения за медицинской помощью при появлении первых симптомов респираторных заболеваний.
— Указание медицинской помощи пациентам с ОРВИ в амбулаторных условиях, преимущественно на дому.
— Актуализацию сведений о лицах в возрасте старше 60 лет, а также лицах, страдающих хроническими заболеваниями бронхолегочной, сердечно-сосудистой и эндокринной систем, беременных женщинах, проживающих на территории обслуживания медицинской организации.
— Возможность дистанционной выписки лекарственных препаратов, доставки их на дом.
— Медицинское наблюдение (ежедневная термометрия, опрос гражданина медицинским работником, в том числе по телефону, на предмет наличия симптомов ОРВИ) граждан, вернувшихся из стран, в которых зарегистрированы случаи COVID-19, на период не менее 14 календарных дней с момента их возвращения, а также проживающих совместно с ними лиц. Передача сводной статистической информации о результатах медицинского наблюдения в территориальное управление Роспотребнадзора.
— Немедленную изоляцию и, при наличии показаний, госпитализацию пациентов в специально созданные для данного контингента медицинские организации, оказывающие медицинскую помощь в стационарных условиях, производить при появлении подозрения или установления факта заболевания COVID-19.
— Возможность оформления листков нетрудоспособности без посещения медицинской организации лицам, прибывшим в Российскую Федерацию из стран, в которых зарегистрированы случаи заболевания COVID-19, а также проживающим совместно с ними лицам.
ОСОБЕННОСТИ ЭВАКУАЦИОННЫХ МЕРОПРИЯТИЙ И ОБЩИЕ ПРИНЦИПЫ ГОСПИТАЛИЗАЦИИ БОЛЬНЫХ ИЛИ ЛИЦ С ПОДОЗРЕНИЕМ НА COVID-19
Госпитализация пациента осуществляется в медицинские организации, имеющие в своем составе мельцеровские боксы, либо в медицинские организации, перепрофилируемые под специализированные учреждения той административной территории, где был выявлен больной.
Требования к работе в инфекционных стационарах, изоляторах и обсерваторах в очагах заболеваний, вызванных микроорганизмами I — II групп патогенности, указаны в СП 1.3.3118-13 «Безопасность работы с микроорганизмами I — II групп патогенности (опасности)».
Оказание медицинской помощи больным с инфекционным заболеванием в процессе подготовки и проведения медицинской эвакуации выполняется в соответствии с действующим порядками, клиническими рекомендациями и стандартами.
При наличии жизнеугрожающих синдромокомплексов проводятся реанимационные мероприятия и интенсивная терапия по схемам, утвержденным в установленном порядке.
Транспортировка пациентов с инфекционным заболеванием осуществляется без транспортировочного изолирующего бокса (ТИБ) или в нем.
а) Транспортировка пациента с инфекционным заболеванием без транспортировочного изолирующего бокса
Мероприятия эпидбригад и/или бригад скорой медицинской помощи до начала транспортировки <1>.
———————————
<1> Мероприятия проводятся и при транспортировке больных с инфекционным заболеванием с применением транспортировочного изолирующего бокса.
Члены эпидбригады и/или бригады медицинской эвакуации по прибытии к месту выявления больного перед входом в помещение, где находится больной, под наблюдением врача — руководителя бригады надевают защитные костюмы в установленном порядке <1>.
Врач бригады:
— Уточняет у больного данные эпидемиологического анамнеза, круг лиц, которые общались с ним (с указанием даты, степени и длительности контакта);
— Определяет контингенты лиц, подлежащих изоляции, медицинскому наблюдению, экстренной профилактике;
— Обеспечивает контроль эвакуации больного и контактировавших с ним лиц;
— Сообщает незамедлительно согласно утвержденной схеме (старший врач смены) уточненные сведения о больном, о контактировавших с больным и проведенных первичных мероприятиях по локализации очага.
Бригада, выполняющая медицинскую эвакуацию инфекционного больного, должна состоять из врача и двух помощников (фельдшер, санитар), обученных требованиям соблюдения противоэпидемического режима и прошедших дополнительный инструктаж по вопросам дезинфекции.
Больной транспортируется в маске со всеми мерами предосторожности. Водитель транспортного средства, в котором осуществляется медицинская эвакуация, при наличии изолированной кабины должен быть одет в комбинезон, при отсутствии ее — в защитную одежду.
Водители (фельдшера-водители, санитары-водители) санитарного транспорта работают в защитной одежде в установленном порядке.
Сотрудники скорой медицинской помощи совместно с врачом инфекционистом в средствах индивидуальной защиты определяют количество и очередность эвакуации больных.
Уточняют маршрут эвакуации больного в медицинскую организацию. Транспортировка двух и более инфекционных больных на одной машине не допускается. Перевозка контактировавших с больными лиц вместе с больным на одной автомашине не допускается.
Машину скорой медицинской помощи оснащают медикотехническими, лекарственными, перевязочными средствами, противоэпидемической, реанимационной укладками.
Машина скорой медицинской помощи должна быть оснащена гидропультом или ручным распылителем, уборочной ветошью, емкостью с крышкой для приготовления рабочего раствора дезинфекционного средства и хранения уборочной ветоши; емкостью для сбора и дезинфекции выделений.
Необходимый набор дезинфицирующих средств из расчета на 1 сутки:
— Средство для дезинфекции выделений;
— Средство для дезинфекции поверхностей салона;
— Средство для обработки рук персонала (1 — 2 упаковки);
— Бактерицидный облучатель.
Расход дезинфицирующих средств, необходимых на 1 смену, рассчитывают в зависимости от того какое средство имеется в наличии и возможного числа выездов.
После доставки больного в инфекционный стационар бригада проходит на территории больницы полную санитарную обработку с дезинфекцией защитной одежды.
Машина и предметы ухода за больным подвергаются заключительной дезинфекции на территории больницы силами самой больницы или бригад учреждения дезинфекционного профиля (в соответствии с комплексным планом).
За членами бригады, проводившей медицинскую эвакуацию, устанавливается наблюдение на срок 14 дней.
б) Транспортировка пациента с инфекционным заболеванием с применением транспортировочного изолирующего бокса
Больные или лица с подозрением на COVID-19 перевозятся транспортом с использованием транспортировочного изолирующего бокса (ТИБ), оборудованного фильтровентиляционными установками, окнами для визуального мониторинга состояния пациента, двумя парами встроенных перчаток для проведения основных процедур во время транспортирования.
Для медицинской эвакуации пациента формируется медицинская бригада в составе 3-х специалистов: 1 врач специалист, 1 фельдшер, 1 санитар и водитель, обученных требованиям соблюдения противоэпидемического режима и прошедших дополнительный инструктаж по вопросам дезинфекции. Медицинские работники осуществляют прием пациента, его размещение в ТИБ и последующее сопровождение.
Медицинские работники и водитель должны быть одеты в защитную одежду.
Пациента готовят к транспортированию до помещения в ТИБ: на месте эвакуации врач бригады оценивает состояние пациента на момент транспортирования и решает вопрос о проведении дополнительных медицинских манипуляций.
Пациента размещают внутри камеры транспортировочного модуля в горизонтальном положении на спине и фиксируют ремнями; в ТИБ помещают необходимое для транспортирования и оказания медицинской помощи оборудование и медикаменты; после этого закрывают застежку-молнию. Проверяют надежность крепления фильтров, включают фильтровентиляционную установку на режим отрицательного давления.
После помещения пациента в ТИБ медицинский персонал бригады:
— Протирает руки в резиновых перчатках и поверхность клеенчатого фартука, орошает наружную поверхность транспортировочного модуля дезинфицирующим раствором с экспозицией в соответствии с инструкцией по применению;
— Проводит обработку защитных костюмов методом орошения дезинфицирующим раствором в соответствии с инструкцией по применению, затем снимает защитные костюмы и помещает их в мешки для опасных отходов;
— Орошает дезинфицирующим средством наружную поверхность мешков с использованными защитными костюмами и относит на транспортное средство.
В боксе инфекционного стационара пациента из ТИБ передают медицинским работникам стационара.
После доставки больного в стационар медицинский транспорт и ТИБ, а также находящиеся в нем предметы, использованные при транспортировании, обеззараживаются силами бригады дезинфекторов на территории инфекционного стационара на специальной, оборудованной стоком и ямой, площадке для дезинфекции транспорта, используемого для перевозки больных в соответствии с действующими методическими документами. Внутренние и внешние поверхности транспортировочного модуля и автотранспорта обрабатываются путем орошения из гидропульта разрешенными для работы с опасными вирусами дезинфицирующими средствами в концентрации в соответствии с инструкцией.
Фильтрующие элементы ТИБ и другие медицинские отходы утилизируют в установленном порядке.
Защитную и рабочую одежду по окончании транспортирования больного подвергают специальной обработке методом замачивания в дезинфицирующем растворе по вирусному режиму согласно инструкции по применению.
Все члены бригады обязаны пройти санитарную обработку в специально выделенном помещении инфекционного стационара.
За членами бригад, проводивших медицинскую эвакуацию, устанавливается наблюдение на срок 14 дней.
в) Мероприятия бригады дезинфекции
Мероприятия по дезинфекции проводятся с учетом письма Роспотребнадзора от 23.01.2020 N 02/770-2020-32 «Об инструкции по проведению дезинфекционных мероприятий для профилактики заболеваний, вызываемых коронавирусами».
По прибытии на место проведения дезинфекции члены бригады надевают защитную одежду. Заключительную дезинфекцию в транспортном средстве проводят немедленно после эвакуации больного.
Для проведения обеззараживания в очаг входят два члена бригады, один дезинфектор остается вне очага. В обязанность последнего входит прием вещей из очага для камерной дезинфекции, приготовление дезинфицирующих растворов, поднос необходимой аппаратуры.
Перед проведением дезинфекции необходимо закрыть окна и двери в помещениях, подлежащих обработке. Проведение заключительной дезинфекции начинают от входной двери здания, последовательно обрабатывая все помещения, включая комнату, где находился больной. В каждом помещении с порога, не входя в комнату, обильно орошают дезинфицирующим раствором пол и воздух.
Руководитель медицинской организации, в которой выявлен больной, подозрительный на коронавирусную инфекцию, вызванную SARS-CoV-2, осуществляет первичные противоэпидемические мероприятия согласно оперативному плану медицинской организации, как на случай выявления больного особо опасной инфекцией, с целью обеспечения своевременного информирования, временной изоляции, консультирования, эвакуации, проведения дезинфекции, оказания больному необходимой медицинской помощи в соответствии с действующими нормативными документами и санитарным законодательством, в том числе с санитарно-эпидемиологическими правилами СП 3.4.2318-08 «Санитарная охрана территории Российской Федерации».
Организация и проведение первичных противоэпидемических мероприятий в случаях выявления больного (трупа), подозрительного на заболевания инфекционными болезнями, вызывающими чрезвычайные ситуации в области санитарно-эпидемиологического благополучия населения проводится в соответствии с Методическими указаниями МУ 3.4.2552-09 (утв. Главным государственным санитарным врачом Российской Федерации 17.09.2009).
В медицинской организации, оказывающей медицинскую помощь больным и лицам с подозрением на COVID-19, согласно санитарным правилам необходимо наличие:
— Неснижаемого запаса СИЗ персонала (защитная одежда, маски, респираторы, очки/экраны, перчатки и другие);
— Укладки для забора биологического материала у больного (подозрительного);
— Укладки со средствами экстренной профилактики медицинских работников;
— Месячного запаса дезинфицирующих средств и аппаратуры;
— Тест-систем для лабораторной диагностики в случае выявления лиц с подозрением на коронавирусную инфекцию;
— Медицинского персонала, обученного действиям при выявлении больного (подозрительного на) COVID-19.
При использовании СИЗ обязательно следовать требованиям санитарных правил. Использованные материалы обеззараживаются и/или обезвреживаются и в последующем захораниваются или уничтожаются в соответствии с требованиями к медицинским отходам класса B. Дезинфекция рабочих поверхностей и биологических жидкостей больного проводится с использованием дезинфицирующих средств, содержащих хлор.
ОСНОВНЫЕ ПРИНЦИПЫ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ В АМБУЛАТОРНЫХ УСЛОВИЯХ (НА ДОМУ) ПАЦИЕНТАМ С УСТАНОВЛЕННЫМ ДИАГНОЗОМ COVID-19
При получении положительного результата лабораторных исследований биологического материала пациента на наличие COVID-19 (далее — результат теста на COVID-19) уполномоченное лицо медицинской организации:
— Уведомляет пациента о положительном результате теста на COVID-19;
— Оповещает о положительном результате теста на COVID-19 руководителя медицинской организации;
— Вносит в журнал учета пациентов с COVID-19 плановые даты для повторного забора биологического материала (мазки из носо- и ротоглотки) — 3-й, 11-й дни;
— Организует осмотр работников медицинской организации, контактировавших с заболевшим пациентом и, в случае выявления симптомов острой респираторной вирусной инфекцией, забор у них биоматериала (мазки из носо- и ротоглотки) для лабораторного исследования на наличие COVID-19;
— Осуществляет опрос пациента с целью уточнения его состояния;
— Осуществляет информирование медицинского работника, направляемого для оказания медицинской помощи пациенту, о положительном результате теста на COVID-19.
Медицинские работники, оказывающие медицинскую помощь на дому пациентам с положительным результатом теста на COVID-19, обязаны:
— Использовать средства индивидуальной защиты (очки, одноразовые перчатки, респиратор соответствующего класса защиты, противочумный костюм 1-го типа или одноразовый халат, бахилы);
— Иметь запас медицинских масок в количестве не менее 20 штук и предлагать их пациенту, прежде чем приступить к опросу и осмотру;
— Рекомендовать пациенту во время осмотра и опроса медицинским работником находиться в медицинской маске;
— Обрабатывать руки в перчатках дезинфицирующим средством;
— Находясь в квартире пациента не снимать средства индивидуальной защиты;
— После выхода из квартиры пациента снять средства индивидуальной защиты, упаковать их в пакет для медицинских отходов класса B и обеспечить их дальнейшую транспортировку для обезвреживания в соответствии с требованиями;
— По завершении оказания медицинской помощи пациенту сообщать уполномоченному лицу медицинской организации о лицах, имеющих контакт с пациентом.
Медицинская помощь пациенту с положительным результатом теста на COVID-19 может оказываться на дому в случае отсутствия клинических проявлений заболеваний или легком течении заболевания (температура тела менее 38,0 °C, ЧДД менее или равна 22 в мин., насыщение крови кислородом по данным пульсоксиметрии (SpO2) более или равна 93%, для детей — 95% и более).
— Пациенту с положительным результатом теста на COVID-19 при легком течении заболевания рекомендуется назначать лечение в соответствии с данными методическими рекомендациями.
— Пациент с легким течением заболевания должен быть проинформирован медицинским работником о необходимости вызова врача или бригады скорой медицинской помощи при ухудшении самочувствия (температура тела более 38,0 °C, появление затрудненного дыхания, одышки, появление или усиление кашля, снижение насыщения крови кислородом по данным пульсоксиметрии (SpO2) менее 93%), а также о возможных способах обращения за медицинской помощью.
— Лица, проживающие с пациентом с легким течением заболевания в одном помещении, должны быть проинформированы о рисках заболевания COVID-19 и необходимости временного проживания в другом месте.
— Пациент с легким течением заболевания и лица, проживающие с таким пациентом, должны быть проинформированы о том, что нарушение санитарно-эпидемиологических правил, повлекшее по неосторожности массовое заболевание, может повлечь привлечение их к уголовной ответственности, предусмотренной статьей 236 Уголовного кодекса Российской Федерации (Собрание законодательства Российской Федерации, 1996, N 25, ст. 2954; 2011, N 50, ст. 7362).
— Пациент с легким течением заболевания и лица, проживающие с таким пациентом, должны быть обеспечены информационными материалами по вопросам ухода за пациентами, больными COVID-19, и общими рекомендациями по защите от инфекций, передающихся воздушно-капельным и контактным путем.
— В случае принятия решения о дальнейшем оказании медицинской помощи пациенту в амбулаторных условиях (на дому) оформляется согласие на оказание медицинской помощи в амбулаторных условиях (на дому) и соблюдение режима изоляции при лечении COVID-19.
Пациент с положительным результатом теста на COVID-19 подлежит госпитализации при наличии одного из следующих обстоятельств:
— Один или оба признака вне зависимости от высоты температуры: ЧДД 22 и более движений в минуту, насыщение крови кислородом по данным пульсоксиметрии (SpO2) менее 93%;
— Легком течении заболевания, в случае если возраст пациента старше 65 лет или имеются симптомы острых респираторных вирусных инфекций в сочетании с хронической сердечной недостаточностью, сахарным диабетом, заболеванием дыхательной системы (бронхиальная астма, хроническая обструктивная болезнь легких), беременностью;
— Совместном проживании с лицами, относящимися к группам риска (лица в возрасте старше 65 лет, а также лица, страдающие хроническими заболеваниями бронхолегочной, сердечно-сосудистой и эндокринной систем, беременных женщин) и невозможности их отселения независимо от тяжести течения заболевания у пациента;
— Легком течении заболевания у детей в возрасте менее 3 лет или наличии у детей в возрасте до 18 лет симптомов острых респираторных вирусных инфекций в сочетании с хроническими заболеваниями: сердечной недостаточностью, сахарным диабетом, бронхиальной астмой, врожденными пороками сердца и легких, находящихся на иммуносупрессивной терапии;
— Беременности.
Медицинская организация, в которой наблюдается ребенок с положительным результатом теста на COVID-19 и отсутствием клинических проявлений заболеваний, обеспечивает ежедневный опрос участковой медицинской сестрой (по телефону) о состоянии пациента не менее 2-х раз в день, а также патронаж врача-педиатра участкового не реже 1 раза в 5 дней.
Медицинская организация, в которой наблюдается ребенок с положительным результатом теста на COVID-19 и легким течением заболевания, обеспечивает ежедневный опрос участковой медицинской сестрой (по телефону) о состоянии пациента не менее 2-х раз в день, а также патронаж врача-педиатра участкового (фельдшера) с учетом состояния ребенка не реже 1 раза в 2 дня.
Законный представитель, обеспечивающий уход за ребенком с положительным результатом теста на COVID-19, которому оказывается медицинская помощь на дому, должен быть проинформирован о рисках заболевания COVID-19 и необходимости соблюдения рекомендаций по защите от инфекций, передающихся воздушно-капельным и контактным путем, особенностям ухода за пациентами больными указанной инфекцией, а также иметь информацию, что нарушение санитарно-эпидемиологических правил, повлекшее по неосторожности массовое заболевание, может повлечь привлечение к уголовной ответственности, предусмотренной статьей 236 Уголовного кодекса Российской Федерации.
МАРШРУТИЗАЦИЯ ПАЦИЕНТОВ, НУЖДАЮЩИХСЯ В ЭКСТРЕННОЙ ХИРУРГИЧЕСКОЙ ПОМОЩИ
Экстренная хирургическая помощь пациентам с COVID-19, находящимся на стационарном лечении
Пациентам, находящимся на стационарном лечении, специализированная экстренная хирургическая помощь оказывается в многопрофильной инфекционной больнице или перепрофилированном многопрофильном стационаре для оказания помощи больным с COVID-19 (в операционном блоке, оборудованном для проведения операций у пациентов с COVID-19). При необходимости, в инфекционный стационар может быть вызвана специализированная хирургическая бригада из другого учреждения, если профильных специалистов нет на месте.
В ряде случаев решение о переводе пациента с COVID-19 для экстренной хирургической помощи в иной специализированный инфекционный стационар или перепрофилированный многопрофильный стационар может быть принято в индивидуальном порядке с учетом возможности безопасной транспортировки при отсутствии обусловленной транспортировкой угрозы для жизни. Специализированные хирургические бригады могут быть использованы в тех случаях, когда в лечебном учреждении нет специалистов соответствующего профиля или квалификации.
Экстренная хирургическая помощь пациентам с COVID-19, находящимся на домашнем лечении
Пациента госпитализируют для оказания экстренной хирургической помощи в многопрофильную инфекционную больницу или перепрофилированный многопрофильный стационар для оказания помощи больным с COVID-19. При необходимости в стационар может быть вызвана специализированная хирургическая бригада. Специализированные хирургические бригады могут быть использованы в тех случаях, когда в лечебном учреждении нет специалистов соответствующего профиля или квалификации. В остальных случаях экстренная хирургическая помощь оказывается специалистами многопрофильной инфекционной больницы.
Экстренная хирургическая помощь пациентам без COVID-19, находящимся на карантине в домашних условиях
Пациент доставляется для оказания экстренной помощи в специализированную хирургическую больницу, имеющую возможность изолировать подозрительных (условно инфицированных) пациентов с дальнейшим переводом в инфекционное отделение для пациентов с внебольничной пневмонией. Пациенту в экстренном порядке выполняют КТ ОГК с использованием соответствующих мер безопасности как для больного, так и для медицинского персонала (обязательно использование СИЗ) и лабораторное обследование на COVID-19.
Лабораторный диагностический тест на COVID-19 проводится в тех случаях, когда тест может выполнятся экстренно или неотложно. В других случаях результаты теста не могут влиять на принятие решения о маршрутизации пациента. При отсутствии клинических симптомов ОРВИ, пневмонии экстренную хирургическую помощь оказывают в специализированном хирургическом стационаре (имеющем в своем составе мельцеровские боксы или инфекционное отделение для пациентов с внебольничной пневмонией). Оказание медицинской помощи проводится медицинским персоналом, не контактирующим с пациентами с COVID-19, если пациент был на карантине более 14 дней или у него 2 отрицательных теста на COVID-19.
При выявлении внебольничной пневмонии или положительном тесте на COVID-19 экстренную хирургическую помощь оказывают в многопрофильной инфекционной больнице или перепрофилированном многопрофильном стационаре для оказания помощи больным с COVID-19, куда, в случае необходимости, может быть вызвана специализированная хирургическая бригада. В случае жизнеугрожающей ситуации и невозможности транспортировки хирургическая помощь оказывается на месте, с соблюдением всех санитарно-эпидемиологических мероприятий. В послеоперационном периоде пациент помещается в изолированный бокс или боксированное отделение, откуда осуществляется перевод в инфекционный или перепрофилированный многопрофильный стационар для оказания помощи больным с COVID-19 после стабилизации состояния пациента.
Экстренная хирургическая помощь пациентам без COVID-19
Пациент доставляется бригадой скорой медицинской помощи в многопрофильную клинику, выделенную для оказания экстренной хирургической помощи пациентам без COVID-19, имеющую возможность изолировать больных, подозрительных на внебольничную пневмонию или ОРВИ.
Пациенту в экстренном порядке выполняют КТ ОГК (с использованием соответствующих мер безопасности как для больного, так и для медицинского персонала) и лабораторное обследование на COVID-19. Лабораторный диагностический тест на COVID-19 проводится в тех случаях, когда тест может выполнятся экстренно или неотложно. В других случаях результаты теста не могут влиять на принятие решения о маршрутизации пациента. При отсутствии клинических признаков ОРВИ, пневмонии экстренную хирургическую помощь оказывают в специализированном хирургическом стационаре (имеющем в своем составе мельцеровские боксы или инфекционное отделение для пациентов с внебольничной пневмонией). Оказание медицинской помощи проводится медицинским персоналом, не контактирующим с пациентами с COVID-19, если пациент был на карантине более 14 дней или у него 2 отрицательных теста на COVID-19.
При выявлении внебольничной пневмонии, ОРВИ или положительном тесте на COVID-19 больной переводится для оказания экстренной хирургической помощи в многопрофильную инфекционную больницу или перепрофилированный многопрофильный стационар для оказания помощи больным с COVID-19, куда, в случае необходимости, может быть вызвана специализированная хирургическая бригада.
В случае жизнеугрожающей ситуации и невозможности транспортировки, помощь оказывается на месте с соблюдением всех санитарно-эпидемиологических мероприятий. В послеоперационном периоде пациент помещается в изолированный бокс или боксированное отделение, откуда осуществляется перевод в инфекционный или перепрофилированный многопрофильный стационар для оказания помощи больным с COVID-19 после стабилизации состояния.
Меры предосторожности для обеспечения безопасности медицинского персонала при оказании экстренной хирургической помощи
Образование мельчайших жидких частиц (аэрозолей) в ходе медицинских процедур может представлять угрозу для медицинского персонала из-за возможного содержания в аэрозоли SARS-CoV-2. Следующие процедуры считаются потенциально опасными в отношении образования аэрозолей, содержащих COVID-19:
— эндоскопия верхних отделов ЖКТ, подразумевающая открытую аспирацию содержимого верхних дыхательных путей;
— хирургические операции с использованием высокоскоростных устройств (пилы и пр.);
— некоторые экстренные стоматологические манипуляции (например, высокоскоростное сверление);
— неинвазивная вентиляция, например, двухуровневая вентиляция с положительным давлением в дыхательных путях и непрерывная вентиляция с положительным давлением в дыхательных путях, вентиляция высокочастотными колебаниями;
— стимуляция отхождения мокроты;
— высокопоточная назальная оксигенация.
Для пациентов с подозрительным или подтвержденным случаем COVID-19 любой из этих потенциально инфекционных процедур с образованием аэрозоли следует проводить только в случае крайней необходимости.
Рекомендуется, чтобы вентиляция как в ламинарном потоке, так и в обычных вентилируемых помещениях, была полностью включена во время хирургических манипуляций, особенно, если пациент инфицирован SARS-CoV-2. Максимальная вентиляция в операционной позволит защитить медицинский персонал от заражения вирусом. Воздух, выходящий из операционных в прилегающие больничные территории, будет сильно разбавлен и не должен рассматриваться в качестве возможного инфекционного агента.
Профилактика образования и высвобождения мельчайших жидких частиц (аэрозолей) в ходе хирургического вмешательств
Интраоперационное выделение хирургического дыма может нести в себе мельчайшие частицы вируса. С целью уменьшения выделения хирургического дыма, рекомендовано максимально снизить мощность электрокоагуляции. В ряде исследований было доказано, что в хирургическом дыме обнаруживаются коринебактерии, папилломавирус и ВИЧ. Известно, что концентрация дыма при проведении лапароскопической операции значительно выше, чем при открытых вмешательствах. Уменьшение пневмоперитонеума в конце операции позволяет в значительной степени снизить риск распространения мельчайших жидких частиц, особенно при резком извлечении троакаров и/или в ходе замены лапароскопических инструментов. С технической точки зрения должны применяться интеллектуальные проточные системы, позволяющие поддерживать внутрибрюшное давление на предельно низком уровне и эвакуирующим дым. Классические аспирационные системы, наоборот, подвержены более высокому риску передачи мельчайших частиц SARS-CoV-2.
Предпочтительно минимизировать различные манипуляции с кишечником, а также его вскрытие во время хирургических процедур, которые этого не предусматривают. Это особенно важно при выполнении лапароскопических манипуляций, чтобы снизить риск диффузии вируса в режиме инсуффляции CO2.
До настоящего момента не было ни одного факта передачи заболевания через мочу, тем не менее дренирование мочевого пузыря и/или мочеточника во время операций следует проводить с осторожностью, особенно в случае наличия пневмоперитонеума.
Защита медицинского персонала в операционных
Вся хирургическая бригада (включая хирургов, анестезиологов и медсестер) должна использовать дополнительные СИЗ при оперативных вмешательствах у больных с коронавирусной инфекцией. Защитные очки, маска FFP2/3 (в т.ч. маска с защитным козырьком) и защитная одежда (комбинезон) представляют собой необходимые предметы в случае выполнения любой инвазивной операции, выполняемой во время чрезвычайной ситуации с COVID-19. Хирурги должны минимизировать любые контакты с биологическими жидкостями пациента. Также необходимо проводить тщательную очистку и дезинфекцию всего оборудования, в том числе лапароскопических, эндоскопических стоек и хирургических консолей.
УЧЕТ ПАЦИЕНТОВ С COVID-19 В ИНФОРМАЦИОННОМ РЕСУРСЕ
В целях сбора сведений информации о пациентах с новой коронавирусной инфекцией, а также лицах с пневмонией, в том числе находящихся на амбулаторном лечении, разработана информационная система для (далее — информационный ресурс), которая размещена по адресу: https://covid.egisz.rosminzdrav.ru/.
В соответствии с постановлением Правительства Российской Федерации от 31.03.2020 N 373 «Об утверждении временных правил учета информации в целях предотвращения распространения новой коронавирусной инфекции (COVID-19)» необходимо обеспечить предоставление медицинскими организациями сведений о лицах с установленным диагнозом новой коронавирусной инфекции (COVID-19) и лицах с признаками пневмонии. Сведения направляются в соответствии с порядком, изложенным в инструкции по внесению сведений в информационный ресурс, размещенной по адресу http://portal.egisz.rosminzdrav.ru/materials/3557, в установленные сроки:
в течение 2 часов с момента установления диагноза новой коронавирусной инфекции (COVID-19) или госпитализации пациента с признаками пневмонии;
в течение 2 часов с момента получения результатов лабораторных исследований.
При внесении информации о пациенте необходимо указать:
а) дату появления клинических симптомов;
б) диагноз (указывается код по МКБ-10);
в) дату постановки диагноза;
г) наличие сопутствующих заболеваний:
— хронических заболеваний бронхолегочной системы;
— хронических заболеваний сердечно-сосудистой системы;
— хронических заболеваний эндокринной системы;
— онкологических заболеваний;
— ВИЧ-инфекции;
— туберкулеза;
— иных заболеваний.
д) наличие беременности;
е) сведения о вакцинации (грипп и пневмококковая инфекция (при наличии);
В ежедневном режиме необходимо обеспечить обновление медицинской информации о пациенте
а) сведения о проводимом лечении:
— противовирусное лечение;
— респираторная поддержка (ИВЛ, ЭКМО);
з) уровень сатурации кислорода в крови;
и) тяжесть течения заболевания.
В случае смерти пациента
а) в течение суток заполняется раздел «Заключительный клинический диагноз»:
— основной диагноз;
— осложнения основного заболевания (при наличии);
— сопутствующие заболевания (при наличии).
б) в течение суток с момента проведения вскрытия заполняется раздел «предварительный патологоанатомический (судебно-медицинский) диагноз» по результатам первого этапа патологоанатомического или судебно-медицинского исследования:
— основной диагноз;
— осложнения основного заболевания (при наличии);
— сопутствующие заболевания (при наличии);
— скан-копия первой части протокола патологоанатомического вскрытия или выписка из результатов наружного и внутреннего судебно-медицинского исследования, содержащая патологические изменения, которые легли в основу постановки судебно-медицинского диагноза.
в) «Медицинское свидетельство о смерти»:
— болезнь или состояние, непосредственно приведшее к смерти;
— патологическое состояние, которое привело к возникновению вышеуказанной причины;
— первоначальная причина смерти;
— внешняя причина при травмах и отравлениях (при наличии);
— прочие важные состояния, способствовавшие смерти, но не связанные с болезнью или патологическим состоянием (при наличии);
— скан-копия медицинского свидетельства о смерти.
г) после завершения патологоанатомического или судебно-медицинского исследования заполняется раздел «заключительный патологоанатомический (судебно-медицинский) диагноз»
— основной диагноз;
— осложнения основного заболевания (при наличии);
— сопутствующие заболевания (при наличии);
— скан-копия второй части протокола патологоанатомического исследования или выписка из результатов дополнительных лабораторных исследований в случае проведения судебно-медицинского исследования;
д) внесение изменений в поля «Медицинского свидетельства о смерти» (при необходимости в случае оформления взамен), приложить скан-копию медицинского свидетельства о смерти.
Для получения доступа к информационному ресурсу необходимо направить заявку на предоставление доступа по форме, приведенной в инструкции, на адрес электронной почты egisz@rt-eu.ru.
Приложение 1
А. Рекомендации по описанию данных рентгенографии и компьютерной томографии
1. Рентгенография органов грудной клетки
Методика выполнения
Рентгенография в рентгеновском кабинете проводится с использованием стационарного (или передвижного) рентгеновского аппарата в двух стандартных проекциях: прямой передней и правой боковой.
Рентгенография в отделении реанимации/интенсивной терапии проводится с использованием передвижного рентгенодиагностического аппарата в одной стандартной проекции: прямой задней при положении пациента на спине или в прямой передней при положении пациента на животе. При необходимости может быть выполнен снимок в боковой проекции горизонтально направленным пучком рентгеновского излучения (латерограмма). На рентгеновском снимке должна присутствовать стандартная маркировка и дополнительная информация (время проведения рентгенографии в часах и минутах; положение пациента в момент рентгенографии — на спине или на животе).
Для оценки пациентов с предполагаемой/известной COVID-19 пневмонией другие рентгенодиагностические методики (рентгеноскопия, линейная томография и проч.) не используются.
Протокол рентгенографического исследования
Протокол по результатам проведенной рентгенографии формируется по стандартным правилам:
— Вид исследования, проекции, положение пациента в момент рентгенографии.
— Все медицинские устройства и иные предметы, видимые на снимках (интубационная трубка, катетеры, дренажи, зонды, искусственные водители ритма, инородные тела и проч.), их расположение и правильность установки.
— Видимые патологические изменения:
— Наличие участков уплотнения легочной ткани, их расположение (периферическое, центральное, диффузное, нарастание в направлении диафрагмы/верхушек, если есть). Локальные изменения соотносятся с отдельными долями и/или сегментами. Участки уплотнения легочной ткани при рентгенографии обычно не разделяют на матовое стекло и консолидацию.
— Форма участков уплотнения: округлая, любая другая.
— Интенсивность тени уплотнений в легких: низкая (обычно соответствует симптому «матового стекла» при КТ), средней интенсивности (обычно соответствует консолидации при КТ), высокая (может наблюдаться при тотальном или субтотальном поражении легких) или их сочетание.
— Признаки нарушения легочного кровообращения: усиление (в т.ч. перераспределение в верхние доли) легочного рисунка, расширение корней легких, перибронхиальные муфты, линии Керли, расширение камер сердца, расширение сосудистой ножки сердца.
— Другие признаки патологии легких: полости, очаговые диссеминации, локальные долевые и сегментарные уплотнения и проч.
— Плевральные синусы: признаки плеврального выпота.
— Признаки пневмоторакса и/или пневмомедиастинума и/или пневмоперитонеума.
В заключении необходимо указать наличие патологических изменений и их распространенность.
В случае первичного исследования рекомендуется указать вероятность соответствия выявленных изменений пневмонии COVID-19 — высокая/типичная картина, средняя/неопределенная картина, низкая/нетипичная картина, норма (для оценки степени вероятности можно использовать приводимую ниже таблицу для формулировки заключений КТ) (например: вероятная рентгенологическая картина пневмонии COVID-19, или картина усиления легочного рисунка без характерных рентгенографических признаков пневмонии COVID-19, или рентгенологическая картина отека легких, или рентгенологическая картина абсцесса верхней доли правого легкого).
При повторных исследованиях обязательно указывается динамика изменений в грудной полости.
При необходимости указываются дополнительные исследования, которые по мнению рентгенолога могут помочь в оценке изменений: КТ, УЗИ, ФБС и др.
2. Описание результатов компьютерной томографии органов грудной полости.
Методика выполнения
Сканирование грудной клетки осуществляется по стандартной программе, установленной компанией производителем, в положении пациента на спине, с заведенными за голову руками, по возможности при спокойном задержанном вдохе.
При исследовании пациентов на ИВЛ задержка дыхания осуществится при короткой остановке дыхательных движений. Проведение КТ исследований пациентам на ИВЛ возможно только при наличии технических условий и возможности доставки пациента в кабинет.
Внутривенное контрастирование не требуется, но может применяться при подозрении на другие патологические состояния, например тромбоэмболию легочной артерии, а также онкологические заболевания и проч.
Протокол КТ исследования формируется по стандартным правилам, аналогичным рентгенографическому исследованию. Однако при этом используется терминология, принятая при описании данных КТ.
Для ускорения получения наиболее важных для врачей результатов КТ органов грудной клетки и определения тактики ведения пациента, возможно применение предварительных стандартизованных экспресс-форм протоколов, а само заключение оформляться в установленные сроки.
Примерная экспресс-форма приводится ниже, возможна ее модификация или коррекция — согласно потребностям конкретной медицинской организации.
Рекомендуемая экспресс-форма описания результатов КТ грудной клетки пациента с подозрением на COVID-пневмонию (дополняется полным протоколом исследования в пределах 12 — 24 часов)
| Дата и время исследования | ||
| Паспортные данные | ||
| Регистрационные данные | ||
| Вид исследования | КТ грудной клетки без внутривенного контрастирования | |
| Другое исследование | ||
| Изменения легочной ткани (матовое стекло консолидация) | ||
| Левое легкое | Есть/нет | |
| Правое легкое | Есть/нет | |
| Примерный объем выявленных изменений легких (визуально) | Минимальный | < 25% объема |
| Средний | 25 — 50% объема | |
| Значительный | 50 — 75% объема | |
| Критический | > 75% объема | |
| Другие важные находки (если есть) | ||
| Жидкость в плевральной полости <*> | ||
| Справа | Есть/нет | |
| Слева | Есть/нет | |
| Вероятность связи выявленных в легких изменений с вирусной (в частности, COVID-19) пневмонией по рекомендациям ACR/RSNA/ESR-ESTI | Типичная картина/Высокая вероятность | |
| Неопределенная картина | ||
| Другой диагноз | ||
| Норма/Нет изменений |
3. Общие рекомендации по протоколированию результатов КТ легких у пациентов с предполагаемой пневмонией COVID-19
Для правильной трактовки полученных данных до начала описания крайне важно получение клинической информации об истории заболевания и состояния пациента лечащего врача (желательно дистанционно, без прямого контакта).
В протоколе КТ исследования должны быть указаны:
— Дата появления симптомов болезни на день выполнения КТ (если известна).
— Методика сканирования, использование внутривенного контрастирования.
— Медицинские устройства и иные предметы в зоне сканирования (интубационная трубка, катетеры, дренажи, зонды, искусственные водители ритма, инородные тела и проч.), их расположение и правильность установки.
— Наличие изменений в легких по типу «матового стекла», консолидации, симптомов «булыжной мостовой», «воздушной бронхографии», обратного «ореола».
— Локализация изменений по долям и сегментам легких, а также преобладающее пространственное распределение (периферическое, центральное, диффузное; преимущественное заднее или переднее, верхнее или нижнее).
— Наличие и примерный объем жидкости в плевральной полости и/или перикарде.
— Указываются все другие находки (согласно стандартному протоколу описания КТ органов грудной клетки): находки в легочной ткани (очаги, полости, симптом «дерева в почках» и другие), состояние и ход трахеи и бронхов, состояние отдельных групп лимфоузлов, размеры и контуры магистральных сосудов и камер сердца. Состояние позвоночника и других костей в пределах зоны сканирования.
— Обязательным является описание динамики, если имеются данные предыдущих КТ.
— В заключении приводится вероятностная оценка связи выявленных изменений с COVID-19 согласно международным рекомендациям и примерный объем поражения легких (см. ниже).
Всегда следует помнить о том, что исследование может быть проведено пациенту с любой патологией легких, сердца, средостения и других органов!
Рекомендации по формулировке заключения (КТ исследование): вероятность связи выявленных изменений с COVID-19 пневмонией (рекомендации RSNA/ACR/BSTI/ESR-ESTI)
| Признаки патологии при КТ | Возможная формулировка в заключении: |
|
Типичная картина — Многочисленные двухсторонние субплевральные уплотнения легочной ткани по типу «матового стекла», — в том числе с консолидацией и/или с симптомом «булыжной мостовой» — Многочисленные двусторонние округлые участки уплотнения по типу «матового стекла» в глубине легочной ткани, — в том числе в сочетании с консолидацией и/или симптомом «булыжной мостовой» — Участки уплотнения легочной ткани в виде сочетания «матового стекла» и консолидации с симптомом «обратного ореола» как признаки организующейся пневмонии (см. Термины) |
Высокая вероятность пневмонии COVID-19, с учетом клинической картины имеются типичные КТ признаки заболевания |
| Следует отметить, что схожие изменения могут встречаться при других вирусных пневмониях, а также при болезнях соединительной ткани, быть связанными с токсическими действиями лекарств или иметь другую этиологию | |
|
Неопределенная картина — Участки «матового стекла» преимущественно прикорневой локализации; — Мелкие участки «матового стекла» без типичного (периферического) распределения, не округлой формы — Односторонние участки «матового стекла» в пределах одной доли, в сочетании с консолидацией или без нее |
Средняя (неопределенная) вероятность пневмонии COVID-19 Выявленные изменения могут быть проявлением COVID-19 пневмонии, но они неспецифичны и могут встречаться при других заболеваниях легких (указать каких, если возможно. Например, сердечная недостаточность, бактериальная пневмония и др.) |
| Следует осторожно интерпретировать результаты КТ у пациентов с хроническими сопутствующими заболеваниями, при которых высока вероятность появления изменений в грудной полости (ИБС, онкологические заболевания, патология почек и др.) | |
|
Нетипичная картина — Консолидация доли (сегмента) — Очаги (в том числе симптом «дерево в почках») — Объемные образования — Полости в легких и в участках консолидации — Равномерное утолщение междольковых перегородок с жидкостью в плевральных полостях (картина отека легких) — Субплевральные ретикулярные (сетчатые) изменения — Лимфаденопатия без изменений в легких |
Альтернативный диагноз Выявленные изменения нехарактерны для COVID-19 пневмонии. Следует рассмотреть возможность других заболеваний и патологических состояний (указать каких, если возможно. Например, туберкулез, рак легкого, бактериальная пневмония и др.) |
| Нормальная картина | Нет признаков пневмонии или других патологических изменений <*> |
<*> Следует иметь в виду, что на начальных стадиях болезни (1 — 5 дни) результаты КТ могут быть негативными. Нормальная КТ картина не исключает COVID-19 инфекции и не является ограничением в проведении иммунологических (ПЦР) тестов.
4. Оценка выраженности изменений в легких при КТ
Оценка выраженности (объема, площади, протяженности) изменений в легких у пациентов с предполагаемой/известной COVID-19 пневмонией может проводиться несколькими способами:
1. Визуальной оценке;
2. Применении полуколичественных шкал, предложенных рядом авторов;
3. На основании программ компьютерной оценки плотности легких и составления карт плотности легочной паренхимы.
В условиях большого тока пациентов, для быстрой оценки изменений в легких после проведения РГ и КТ, рекомендована так называемая «эмпирическая» визуальная шкала. Она основана на визуальной оценке примерного объема уплотненной легочной ткани в обоих легких в легких.
«Эмпирическая» визуальная шкала <*>
———————————
<*> Источник: S.Inui et al. Radiology: Cardiothoracic Imaging, 8 April 2020
Основана на визуальной оценке примерного объема уплотненной легочной ткани в обоих легких:
1. Отсутствие характерных проявлений (КТ-0)
2. Минимальный объем/распространенность < 25% объема легких (КТ-1)
3. Средний объем/распространенность 25 — 50% объема легких (КТ-2)
4. Значительный объем/распространенность 50 — 75% объема легких (КТ-3)
5. Критический объем/распространенность > 75% объема легких (КТ-4)
Компьютер-ассистированная диагностика
Ряд рабочих станций для современных аппаратов КТ и цифровой РГ оснащены компьютерными программами, которые предназначены для автоматического или полуавтоматического выделения и измерения объема зон «матового стекла» и консолидации. Применение таких программ позволяет проводить оценку объема измененной легочной ткани более объективно, чем «эмпирический» метод, особенно при наблюдении в динамике. При использовании таких компьютерных программ врач рентгенолог должен контролировать корректность выделения патологических участков в легких и принимать решение, пригодны ли получаемые с их помощью данные для клинического применения или нет.
В целом, данные визуализации могут интерпретироваться только в контексте клинической картины и результатов лабораторно-инструментальных показателей. Рентгенография и КТ играют важную, но не определяющую роль в оценке тяжести течения заболевания и определения прогноза его развития. Эти ограничения связаны, в том числе, с отсутствием характеристик поражения легочной ткани («матовое» стекло и/или консолидация) и других проявлений патологии (плевральный выпот, отек легких и др.). Поэтому объем поражения легких при РГ и КТ может не иметь прямой корреляции с клинической тяжестью заболевания.
5. Оценка динамики изменений в легких при COVID-19 пневмонии
Основные закономерности развития COVID-19 пневмонии связаны с трансформацией участков «матового стекла» в легочной ткани. В связи с этим КТ является предпочтительным методом оценки динамики. Однако для этой цели может использоваться и рентгенография, в случае если изменения видны на снимках, и есть возможность оценить их динамику. Рентгенография с использованием передвижного аппарата также является основной методикой при наблюдении пациентов в отделении реанимации и интенсивной терапии.
Оценка динамики предполагает использование одной методики. Сравнение изменений по данным различных методов и методик (например рентгенографии и КТ) не корректно.
Все рентгенологические исследования проводятся только по клиническим показаниям.
Кратность рентгенографических и КТ исследований в динамике определяет лечащий врач (врач отделения реанимации и интенсивной терапии).
Таблица 1. Динамика изменений в легких по данным рентгенографии и компьютерной томографии <*>
| Динамика процесса | Признаки |
| Начальные проявления в первые дни заболевания |
Типичная картина — Субплевральные участки уплотнения по типу «матового стекла» с консолидацией или без нее, с утолщением перегородок (симптом «булыжной мостовой») или без них; — Участки уплотнения по типу «матового стекла» округлой формы перибронхиального расположения, с консолидацией или без, с утолщением перегородок (симптом «булыжной мостовой») или без них; — Сочетание участков «матового стекла» и консолидации с симптомом «обратного ореола» и других признаков организующейся пневмонии; — расположение изменений двухстороннее, преимущественно периферическое. |
| Положительная динамика изменений (стабилизация) |
— Преобразование участков «матового стекла» в уплотнения по типу консолидации (нарастание плотности измененных участков легочной ткани) без видимого увеличения объема (протяженности) поражения легких; — Формирования картины организующейся пневмонии (см. Термины); — Уменьшение размеров уплотненных участков в легочной ткани |
| Отрицательная динамика изменений (прогрессирование) |
Нарастание изменений: — Увеличение размеров (протяженности, объема) имевшихся участков уплотнения по типу «матового стекла»; — Появление новых участков «матового стекла»; — Слияние отдельных участков «матового стекла» в более крупные уплотнения вплоть до субтотального поражения легких; — Выраженность участков «матового стекла» по-прежнему значительно преобладает над консолидацией Появление новых признаков других патологических процессов: — левожелудочковая недостаточность (гидростатический кардиогенный отек легких, двухсторонний плевральный выпот), — респираторный дистресс-синдром (отек легких) — бактериальная пневмония (новые локальные участки консолидации, левосторонний плевральный выпот) — абсцесс легкого и множественные септические эмболии, — пневмоторакс и пневмомедиастинум, — другие |
| Картина респираторного дистресс-синдрома |
Обычно есть: — Двухсторонние субтотальные уплотнения легочной ткани по типу консолидации и «матового стекла» — Расположение в средних и верхних отделах легких — Вздутие базальных сегментов — Градиент уплотнений в зависимости от положения пациента (на спине, на животе) — Симптом воздушной бронхографии Обычно нет (при отсутствии недостаточности кровообращения): — Линий Керли, перибронхиальных муфт — Расширения левых камер сердца, сосудистой ножки сердца — Жидкости в плевральных полостях |
| Разрешение |
— Уменьшение размеров участков консолидации и «матового стекла» (картины организующейся пневмонии) — Длительность существования изменений в легких может существенно превышать сроки клинических проявлений инфекции — Наличие остаточных уплотнений в легочной ткани не влияет на длительность терапии инфекционного заболевания и не является показанием к ее продолжению в отсутствии клинических проявлений острого воспалительного процесса |
6. Стандартная терминология при описании данных рентгенографии и компьютерной томографии легких
Ниже приведен краткий словарь основных терминов, обозначающий наиболее частые симптомы и синдромы патологии легких, выявляемые при рентгенографии и компьютерной томографии в связи с пневмонией COVID-19.
Краткий словарь основных рентгенологических терминов
| Симптом/метод выявления | Картина изменений |
| Матовое стекло/Значительно более точно выявляется при КТ, чем при РГ | Участок частично воздушной легочной ткани, на фоне которого видны сосуды, просветы бронхов и их стенки |
| Консолидация/Выявляется одинаково точно при РГ и КТ | Участок безвоздушной легочной ткани с видимыми в нем воздушными просветами бронхов и воздушными полостями (например, эмфиземы). Сосуды и стенки бронхов в зоне уплотнения не видны |
| Ретикулярные изменения/КТ-симптом. При рентгенографии обозначаются как сетчатая (ячеистая) деформация легочного рисунка | Тонкие линии патологически измененного легочного интерстиция, формирующие сеть |
| Симптом «булыжной мостовой» (синоним: симптом «лоскутного одеяла»)/КТ-симптом | Изображение ретикулярных изменений на фоне уплотнения по типу «матового стекла» |
| Перибронховаскулярные изменения (синоним: перибронховаскулярные муфты)/Одинаково выявляется при РГ и КТ | Утолщение видимых стенок бронхов, приводящее к увеличению их диаметра. Аналогично изменяется диаметр рядом расположенных артерий, но их стенки можно увидеть только при контрастировании |
| Перибронховаскулярное распределение/Одинаково выявляется при РГ и КТ | Расположение измененных участков легочной ткани вдоль бронхов и сосудов легкого |
| Кортикальное (субплевральное, периферическое) распределение/Одинаково выявляется при РГ и КТ | Расположение измененных участков легочной ткани вдоль висцеральной плевры (реберной, диафрагмальной, медиастинальной, междолевой) |
| Прикорневое (центральное) распределение/Одинаково выявляется при РГ и КТ | Расположение измененных участков легочной ткани в области корня легкого |
| Симптом воздушной бронхографии/КТ-симптом | Видимость заполненных воздухом бронхов в уплотненной легочной ткани. Свидетельствует о сохранении бронхиальной проходимости |
| Симптом ореола (синоним: симптом ободка)/КТ-симптом | Зона «матового стекла» вокруг зоны консолидации или участка деструкции (некроза). Обычно имеет кольцевидную форму |
| Симптом обратного ореола (синоним: симптом обратного ободка, симптом «атолла»)/КТ-симптом | Зона консолидации вокруг участка «матового стекла». Может иметь любую форму и размеры. Характерный признак организующейся пневмонии |
| Полость в легком или участке консолидации/Точнее выявляется при КТ, особенно при небольших размерах | Замкнутое патологическое пространство в легком с толстыми (> 2 — 3 мм) стенками, окруженное воздушной легочной тканью. Полость содержит газ, жидкость, некротические массы. Обычно наблюдается при бактериальных инфекциях и новообразованиях |
| Киста в легком/КТ-симптом | Замкнутое патологическое пространство в легком с тонкими (< 2 мм) стенками, заполненное газом или жидкостью |
| Очаг(и) в легких/Точнее выявляется при КТ (Термин «узелок» является синонимом, но не рекомендуется к употреблению) | Уплотнение в легочной ткани размером до 10 мм. Могут быть одиночными, единичными (до 6) и множественными (диссеминация) |
| Симптом «дерево в почках»/КТ-симптом | V- и Y-образные патологические структуры в легком размером до 1 см, представляющие заполненные патологическим содержимым и расширенные дистальные бронхи и бронхиолы. Важный признак бронхогенной инфекции нижних дыхательных путей |
| Картина организующейся пневмонии/совокупность КТ симптомов | Вариабельна. Обычно сочетание участков «матового стекла» и консолидации с симптомом обратного ободка и типичным перибронховаскулярным и/или субплевральным распределением |
Б. Рекомендации по ультразвуковой диагностике в условиях пандемии COVID-19
1) Ультразвуковое исследование легких у пациентов с подозрением или подтвержденным диагнозом «COVID-19» можно проводить на любых ультразвуковых аппаратах с условием обязательного соблюдения всех правил безопасности работы персонала и дезинфекции помещений и оборудования. Предпочтительно выделение одного или нескольких ультразвуковых аппаратов для работы с пациентами с подозрением или подтвержденным диагнозом «COVID-19». В зависимости от контингента исследуемых и технического оснащения учреждения могут использоваться конвексные (предпочтительно для взрослых), линейные (предпочтительно для новорожденных и детей младшего возраста), секторные фазированные и микроконвексные датчики.
2) Рекомендуется использование стандартизированной технологии ультразвукового исследования легких.
3) Для упрощения интерпретации данных и удобства динамического контроля рекомендуется оценка ультразвуковых изменений в легких по градациям.
4) Нет достаточного количества научных данных для использования ультразвукового исследования легких при сортировке пациентов с подозрением или подтвержденным диагнозом «COVID-19».
5) С помощью ультразвукового исследования легких нельзя поставить диагноз «COVID-19».
6) С помощью ультразвукового исследования легких нельзя исключить диагноз «COVID-19».
7) Нет достаточного количества научных данных для оценки тяжести поражения легких с помощью ультразвукового исследования. Результаты ультразвукового исследования легких должны сопоставляться с клинико-лабораторной картиной и данными компьютерной томографии. Самостоятельного значения при COVID-19 они не имеют.

9) Ультразвуковое исследование легких не может заменить рентгенографию и компьютерную томографию груди в динамическом наблюдении пациентов с пневмонией при COVID-19, но при увеличении потока пациентов может быть включено в рациональный алгоритм динамического наблюдения при условии наличия (1) первоначальной информации об истинном объеме и причине поражения легких и (2) подготовленного врачебного персонала.
10) Необходимо обязательное соблюдение правил безопасности работы персонала и дезинфекции помещений и оборудования независимо от того, по какой причине проводится ультразвуковое исследование пациентам с подозрением или подтвержденным диагнозом «COVID-19».
11) При наличии клинических показаний ультразвуковая диагностика может применяться для оценки состояния других анатомических областей и отдельных органов с целью выявления патологических изменений и оценки их динамики, однако в приоритете должен быть принцип разумной достаточности. Обязательным является проведение ультразвуковых исследований по экстренным показаниям. Обследования, не являющиеся необходимыми, следует отложить или отменить, чтобы свести к минимуму возможность контактов здоровых пациентов с пациентами группы риска по COVID-19 в условиях медицинской организации. При невозможности отмены плановых ультразвуковых исследований для уменьшения риска заражения COVID-19 важно: (1) соблюдать расписание приема с сохранением необходимого времени на каждого пациента; (2) увеличить интервалы между пациентами, чтобы избежать скопления ожидающих пациентов; (3) обеспечить расстояние между креслами для ожидания не менее 2 м друг от друга.
Более детально информация по ультразвуковому исследованию легких и безопасности ультразвуковых исследований в условиях COVID-19 представлена на сайте www.rasudm.org в следующих документах:
1. Abramowicz J.S., Basseal J. Заявление о позиции WFUMB: как безопасно проводить ультразвуковое исследование и обеззараживать ультразвуковое оборудование в условиях COVID-19//Ультразвуковая и функциональная диагностика. 2020. N 1. С. 12 — 23. Doi: 10.24835/1607-0771-2020-1-12-23. Опубликовано до печати. Режим доступа: //http://www.rasudm.org/files/WFUMB-Position-Statement-COVID.pdf, свободный. Загл. с экрана. 16.04.2020.
2. Митьков В.В., Сафонов Д.В., Митькова М.Д., Алехин М.Н., Катрич А.Н., Кабин Ю.В., Ветшева Н.Н., Худорожкова Е.Д. Консенсусное заявление РАСУДМ об ультразвуковом исследовании легких в условиях COVID-19 (версия 1)//Ультразвуковая и функциональная диагностика. 2020. N 1. С. 24 — 45. Doi: 10.24835/1607-0771-2020-1-24-45. Опубликовано до печати. Режим доступа: //http://www.rasudm.org/files|RASUDM-Consensus-Statement-COVID.pdf, свободный. Загл. с экрана. 16.04.2020.
Приложение 2
ЛАБОРАТОРНЫЙ И ИНСТРУМЕНТАЛЬНЫЙ МОНИТОРИНГ У БОЛЬНЫХ С COVID-19 ИЛИ ПОДОЗРЕНИЕМ НА COVID-19
Приложение 3
ИНСТРУКЦИЯ ПО ПРОВЕДЕНИЮ ЭТИОЛОГИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ КОРОНАВИРУСНОЙ ИНФЕКЦИИ
Общие положения
В соответствии с приказом Министерства здравоохранения Российской Федерации N 198н от 19.03.2020 (в ред. от 27.03.2020 и от 02.04.2020) и Временными методическими рекомендациями по лабораторной диагностике нового коронавируса 2019 (2019-COVIDn), утвержденным Главным санитарным врачом Российской Федерации 30.03.2020, этиологическая лабораторная диагностика коронавирусной инфекции проводится во всех лабораториях Российской Федерации вне зависимости от их организационно-правовой формы (далее — Лаборатория), имеющих санитарно-эпидемиологическое заключение о возможности проведения работ с возбудителями инфекционных заболеваний человека III — IV патогенности и условия для исследований с применением методов амплификации нуклеиновых кислот.
Для выявления возбудителя SARS-CoV-2 используются методы амплификации нуклеиновых кислот (без накопления возбудителя), с применением зарегистрированных в установленном порядке на территории Российской Федерации тест-систем, в соответствии с инструкцией по применению.
Этиологическая лабораторная диагностика COVID-19
В амбулаторных условиях для обследования пациентов применяются следующие алгоритмы. Взятие мазка из носа и ротоглотки в 1-й, 3-й и 11-й дни после обращения. Для пациентов взятие и исследование мазков из носа и ротоглотки в день обращения проводится по решению врача.
При помещении пациента в стационар обязательно исследование трех образцов биологических материалов, собранных в течение первых трех дней после появления симптомов заболевания.
Для выявления COVID-19 исследуются респираторные диагностические материалы, взятые у пациента: мазки из носоглотки и ротоглотки, мокрота, эндотрахеальный аспират, бронхоальвеолярный лаваж). Могут быть исследованы и другие виды диагностического материала: кровь (сыворотка, цельная кровь), моча.
Сбор, хранение и транспортировка диагностического материала
Взятие диагностического материала, его упаковка, маркировка и транспортировка осуществляется в соответствии с требованиями и правилами к работе с материалами, потенциально инфицированными возбудителями II группы патогенности, их хранении и транспортировки согласно МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I — IV групп патогенности» и «Временными рекомендациями по лабораторной диагностике новой коронавирусной инфекции, вызванной 2019-nCov», направленными в адрес органов исполнительной власти субъектов Российской Федерации в сфере охраны здоровья Роспотребнадзором письмом от 21.01.2020 N 02/706-2020-27.
Взятие диагностического материала, его маркировка и упаковка выполняется медицинским работником, прошедший инструктаж по санитарно-эпидемиологическим требованиям и правилам биологической безопасности при работе с пациентами, потенциально инфицированными микроорганизмами II группы патогенности. Биологический материал (мазки из носоглотки, ротоглотки, моча, фекалии) может быть отобран самостоятельно пациентом согласно инструкции. Сотрудники, осуществляющие взятие диагностического материала, должны быть обеспечены средствами индивидуальной защиты: респираторы типа FFP2 или их эквивалент, или пневмошлем, обеспечивающий более высокий уровень защиты; очки для защиты глаз или защитный экран; противочумный костюм, одноразовые латексные (резиновые) перчатки; водонепроницаемый фартук.
Мазок из носоглотки или ротоглотки (зева) берется стерильным тампоном, который, после взятия материала помещается в стерильную пластиковую пробирку с транспортной средой (с учетом рекомендаций производителя применяемых тест-систем/наборов реагентов). Для повышения концентрации вируса носоглоточные и орофарингеальные мазки должны быть помещены в одну пробирку. Температура при транспортировке должна быть +2° +8 °C. Время хранения образцов до исследования не должно превышать 5 дней при +2° +8 °C, может быть больше при -20 °C или -70 °C.
Мокрота собирается в одноразовый стерильный пластиковый контейнер объемом — 30 — 50 мл, герметично закрывающийся завинчивающейся пробкой. Диаметр горлышка контейнера должен быть не менее 30 мм. Убедитесь, что собранный материал представляет собой мокроту (отделяемое нижних дыхательных путей). Транспортировка образцов может проводиться при температуре +2° +8 °C. Время хранения образцов до исследования не должно превышать 48 часов при +2° +8 °C при хранении в транспортной среде, содержащей противогрибковые и антибактериальные препараты, более — при -20 °C или -70 °C.
Эндотрахеальный аспират, аспират носоглотки или смыв из носа собирается в стерильный одноразовый контейнер. Транспортировка образцов может проводиться при температуре +2° +8 °C. Время хранения образцов до исследования не должно превышать 48 часов дней +2° +8 °C, более — при -20 °C или -70 °C.
Бронхоальвеолярный лаваж собирается в стерильный одноразовый контейнер. Транспортировка образцов может проводиться при температуре +2°+8 °C. Время хранения образцов до исследования не должно превышать 48 часов при +2° +8 °C, более — при -20 °C или -70 °C.
Ткани биопсии или аутопсии, включая легкие, помещаются в одноразовые контейнеры с физиологическим раствором, содержащим противогрибковые и антибактериальные препараты, собирается в стерильный одноразовый контейнер). Транспортировка образцов может проводиться при температуре +2° +8 °C. Время хранения образцов до исследования не должно превышать 24 часов при +2° +8 °C, более — при -20 °C или -70 °C.
Для идентификации образцов контейнеры/пробирки маркируются в месте сбора с использованием самоклеящихся этикеток с информацией, обеспечивающей однозначную идентификацию образца и его соответствие направлению.
Транспортировка герметично закрытых контейнеров с образцами в лабораторию осуществляется в специальных контейнерах/биксах. Направления и другая документация на бумажных носителях передается в отдельном полиэтиленовом пакете.
При необходимости пересылки образцов в лабораторию другого медицинского учреждения выполняются требования к пересылке инфекционных материалов II группы патогенности (СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I — IV групп патогенности»).
Пробирки/контейнеры с образцами вместе с крышкой герметизируют различными пластификаторами (парафин, парафильм и др.); емкость маркируют. Образцы каждого пациента помещают в индивидуальный герметичный пакет с адсорбирующим материалом и дополнительно упаковывают в общий герметичный пакет.
Два или более образца одного пациента могут быть упакованы в один пластиковый пакет. Запрещается упаковывать образцы клинического материала от разных людей в одну упаковку.
Пакет с контейнерами помещают в герметично закрывающийся контейнер для транспортировки биологических материалов. Контейнер помещают в пенопластовый термоконтейнер с охлаждающими термоэлементами. Транспортный контейнер опечатывается и маркируется. В контейнер желательно поместить одноразовый индикатор, контролирующий соблюдение температуры от +2° до +8 °C.
Сопроводительные документы помещаются в индивидуальную упаковку отдельно от биологического материала и прочно прикрепляются снаружи контейнера.
Направление на исследование для этиологической диагностики COVID-19
Направление на лабораторное исследование оформляется в электронном виде (через систему удаленной электронной регистрации, или в виде электронного заказа в программе МИС врачом-клиницистом), или на бумажном носителе.
Направление на лабораторное исследование должно содержать:
— персональные данные пациента, обеспечивающие его однозначную идентификацию;
— наименование направившего биоматериал отделения (организации);
— диагноз заболевания: «пневмония» или «исследование на COVID-19»;
— указание вида диагностического материала;
— дату и время назначения лабораторного исследования;
— дату и время взятия материала;
— фамилию, имя, отчество (при наличии) и должности врача либо другого уполномоченного представителя, назначившего лабораторное исследование.
— фамилию, имя, отчество (при наличии) медицинского работника, осуществившего взятие биоматериала.
При направлении диагностических материалов для исследования в лабораторию другой медицинской организации, помимо сведений, перечисленных выше, должно быть указано наименование медицинской организации, в которую направляется диагностический материал.
Приложение 4
ПЕРЕЧЕНЬ ЗАРЕГИСТРИРОВАННЫХ В РОССИЙСКОЙ ФЕДЕРАЦИИ ДИАГНОСТИЧЕСКИХ НАБОРОВ РЕАГЕНТОВ ДЛЯ ВЫЯВЛЕНИЯ РНК SARS-COV-2
(ПО СОСТОЯНИЮ НА 23.04.2020)
| Дата государственной регистрации медицинского изделия | Регистрационный номер медицинского изделия | Наименование медицинского изделия | Наименование организации-производителя или организации-изготовителя медицинского изделия | Место нахождения организации-производителя или организации-изготовителя медицинского изделия |
| 11.02.2020 | РЗН 2020/9677 | Набор реагентов для выявления РНК коронавируса 2019-nCoV методом ПЦР с гибридизационно-флуоресцентной детекцией «Вектор-ПЦРрв-2019-nCoV-RG» по ТУ 21.20.23-088-05664012-2020 | ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора | 630559, Россия, Новосибирская область, р. п. Кольцово |
| 14.02.2020 | РЗН 2020/9700 | Набор реагентов для выявления РНК коронавирусов SARS/COVID-19 методом ПЦР с гибридизационно-флуоресцентной детекцией «Вектор-OneStepПЦР-CoV-RG» по ТУ 21.20.23-089-05664012-2020 | ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора | 630559, Россия, Новосибирская область, р. п. Кольцово |
| 20.03.2020 | РЗН 2020/9845 | Набор для выявления РНК коронавируса SARS-CoV-2 в биологическом материале методом изотермической амплификации в режиме реального времени в вариантах исполнения по ТУ 21.20.23-001-39070608-2020 | ООО «СМАРТЛАЙФКЕА» | 109316, Россия, Москва, Волгоградский пр-кт., д. 42, к. 24, ком. 27.2 |
| 27.03.2020 | РЗН 2020/9896 | Набор реагентов для выявления РНК коронавируса SARS-CoV-2 методом ОТ-ПЦР в режиме реального времени (РеалБест РНК SARS-CoV-2) по ТУ 21.20.23-106-23548172-2020 | АО «Вектор-Бест» | 630559, Россия, Новосибирская область, р. п. Кольцово, а/я 121 |
| 27.03.2020 | РЗН 2020/9765 | Набор реагентов для выявления РНК коронавируса SARS-CoV-2 тяжелого острого респираторного синдрома (COVID-19) методом полимеразной цепной реакции «АмплиТест SARS-CoV-2» | ФГБУ «ЦСП» Минздрава России | 119121, Россия, Москва, ул. Погодинская, д. 10, стр. 1 |
| 27.03.2020 | РЗН 2020/9904 | Набор реагентов для выявления РНК коронавируса SARS-CoV-2 методом полимеразной цепной реакции с обратной транскрипцией ПОЛИВИР SARS-CoV-2 | ООО НПФ «Литех» | 119435, Россия, г. Москва, ул. Малая Пироговская, д. 1, стр. 3 |
| 01.04.2020 | РЗН 2020/9948 | Набор реагентов для выявления РНК коронавирусов SARS-CoV-2 и подобных SARS-CoV методом обратной транскрипции и полимеразной цепной реакции в режиме реального времени (SARS-CoV-2/SARS-CoV) по ТУ 21.20.23-116-46482062-2020 | ООО «ДНК-Технология ТС» | 117246, Россия, Москва, Научный пр-д, д. 20, стр. 4 |
| 02.04.2020 | РЗН 2020/9957 | Набор реагентов для выявления РНК SARS-CoV-2 методом петлевой изотермальной амплификации «Изотерм SARS-CoV-2 РНК-скрин» по ТУ 21.20.23-069-26329720-2020 | АО «ГЕНЕРИУМ» | 601125, Россия, Владимирская область, Петушинский район, п. Вольгинский, ул. Заводская, стр. 273 |
| 03.04.2020 | РЗН 2020/9969 | Набор реагентов для выявления РНК короновируса 2019-nCoV методом полимеразной цепной реакции в реальном времени (ПЦР-РВ-2019-nCov) по ТУ 20.59.52-014-08534994-2020 | ФГБУ «48 ЦНИИ» Минобороны России | 141306, Россия, Московская область, Сергиево-Посадский район, г. Сергиев Посад-6, ул. Октябрьская, д. 11 |
| 07.04.2020 | РЗН 2014/1987 | Набор реагентов для выявления РНК коронавирусов, вызывающих тяжелую респираторную инфекцию: MERS-Cov (Middle East respiratory syndrome coronavirus) и SARS-Cov (Severe acute respiratory syndrome coronavirus), в биологическом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс Cov-Bat-FL» | ФБУН ЦНИИ Эпидемиологии Роспотребнадзора | 111123, Россия, Москва, ул. Новогиреевская, д. 3А |
| 14.04.2020 | РЗН 2020/10032 | Набор реагентов для выявления РНК вируса SARS-CoV-2 в биологическом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «SARS-CoV-2-ПЦР» по ТУ 21.20.23-002-28597318-2020 | ООО «МедипалТех» | 141980, Россия, Московская область, г. Дубна, ул. Программистов, д. 4, стр. 1, пом. 30/3 |
| 16.04.2020 | РЗН 2020/10064 | Набор реагентов для выявления РНК коронавирусов SARS-CoV-2, вызывающих тяжелую респираторную инфекцию, в биологическом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «SBT-DX-SARS-CoV-2» | ООО «Система-БиоТех» | 119034, Россия, Москва, пер. Гагаринский, д. 29, пом. I |
| 17.04.2020 | РЗН 2020/10088 | Набор для выявления РНК коронавируса SARS-CoV-2 в биологическом материале методом изотермической амплификации в режиме реального времени в вариантах исполнения по ТУ 21.10.60-004-06931260-2020 | ООО «ЭВОТЭК-МИРАЙ ГЕНОМИКС» | 117437, Россия, Москва, ул. Академика Арцимовича, д. 3Б, офис 11 |
| 17.04.2020 | РЗН 2020/10087 | Набор реагентов для выделения РНК вируса SARS-CoV-2 из биологического материала в вариантах исполнения по ТУ 21.10.60-002-06931260-2020 | ООО «ЭВОТЭК-МИРАЙ ГЕНОМИКС» | 117437, Россия, Москва, ул. Академика Арцимовича, д. 3Б, офис 11 |
| 21.04.2020 | РЗН 2020/10118 | Набор реагентов для выявления РНК коронавируса SARS-CoV-2 тяжелого острого респираторного синдрома (COVID-19) методом полимеразной цепной реакции с автоматической экстракцией РНК «АмплиТест SARS-CoV-2 авто» | ФГБУ «ЦСП» Минздрава России | 119121, Россия, Москва, ул. Погодинская, д. 10, стр. 1 |
| 23.04.2020 | РЗН 2020/10152 | Набор реагентов для выявления РНК коронавирусов SARS/COVID-19 методом ПЦР GeneFinder COVID-19 Plus RealAmp Kit (IFMR-45) | ООО «АВИВИР» | Республика Корея, OSANG Healthcare Co., Ltd., 132 |
Приложение 5
ЗАРЕГИСТРИРОВАННЫЕ
В РОССИЙСКОЙ ФЕДЕРАЦИИ ДИАГНОСТИЧЕСКИЕ НАБОРЫ РЕАГЕНТОВ ДЛЯ ВЫЯВЛЕНИЯ ИММУНОГЛОБУЛИНОВ К SARS-COV-2 (ПО СОСТОЯНИЮ НА 23.04.2020)
| Дата государственной регистрации медицинского изделия | Регистрационный номер медицинского изделия | Наименование медицинского изделия | Наименование организации-производителя медицинского изделия или организации-изготовителя медицинского изделия | Место нахождения организации-производителя медицинского изделия или организации-изготовителя медицинского изделия |
| 10.04.2020 | РЗН 2020/10017 | Набор реагентов для иммуноферментного выявления иммуноглобулинов класса G к коронавирусу SARS-CoV-2 «SARS-CoV-2-ИФА-Вектор» по ТУ 21.20.23-090-05664012-2020 | ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора | 630559, Россия, Новосибирская область, р. п. Кольцово. |
Приложение 6.1
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, КОТОРЫЕ ЗАПРЕЩЕНО ИЛИ НЕЖЕЛАТЕЛЬНО ПРИНИМАТЬ С ЭТИОТРОПНОЙ ТЕРАПИЕЙ COVID 19
<1>
| МНН лекарственного препарата | Этиотропная терапия COVID 19 | ||
| Лопинавир/ритонавир | Хлорохин | Гидроксихлорохин | |
| Антиретровирусные препараты <2> | |||
| Лопинавир/ритонавир | Неприменимо | Нежелательно | Нежелательно |
| Атазанавир | Неприменимо | Нежелательно | Нежелательно |
| Саквинавир | Неприменимо | Запрещено | Запрещено |
|
Рилпивирин/ тенофовир/ эмтрицитабин |
Неприменимо | Нежелательно | Нежелательно |
| Антиаритмики | |||
| Амиодарон | Запрещено <3> | Запрещено | Запрещено |
| Антимикробные средства | |||
| Рифампицин | Запрещено | Запрещено | Запрещено |
| Рифапентин | Нежелательно <4> | Запрещено | Запрещено |
| Антиконвульсанты | |||
| Карбамазепин | Нежелательно | Запрещено | Запрещено |
| Фенобарбитал | Нежелательно | Запрещено | Запрещено |
| Примидон | Нежелательно | Запрещено | Запрещено |
| Антипсихотические средства (нейролептики) | |||
| Кветиапин | Запрещено | Нежелательно | Нежелательно |
| Зипрасидон | Запрещено | Запрещено | Запрещено |
| Снотворные и седативные средства | |||
| Мидазолам | Запрещено | Разрешено | Разрешено |
| Противорвотные | |||
| Домперидон | Запрещено | Нежелательно | Нежелательно |
| Диуретические калийсберегающие средства | |||
| Эплеренон | Запрещено | Разрешено | Разрешено |
| Антиангинальные средства | |||
| Ивабрадин | Запрещено | Нежелательно | Нежелательно |
| Ранолазин | Запрещено | Нежелательно | Нежелательно |
| Гиполипидемические средства | |||
| Ловастатин | Запрещено | Разрешено | Разрешено |
| Симвастатин | Запрещено | Разрешено | Разрешено |
| Иммунодерпессивные средства | |||
| Сиролимус | Запрещено | Нежелательно | Нежелательно |
| Глюкокортикостероиды для местного применения | |||
| Будесонид | Запрещено | Разрешено | Разрешено |
| Флутиказон | Запрещено | Разрешено | Разрешено |
| Глюкокортикостероиды | |||
| Триамцинолон | Запрещено | Разрешено | Разрешено |
Примечание:
1. Данная таблица содержит список основных лекарственных взаимодействий, с полным перечнем можно ознакомиться на сайте https://www.covid19-druginteractions.org/
2. Основные взаимодействия хлорохина и гидроксихлорохина с антиретровирусными препаратами связаны с потенцированием пролонгирования интервала QT, вытекающей опасностью фибрилляции желудочков, необходимостью частого мониторирования ЭКГ у данных больных.
3. Запрещено — серьезные лекарственные взаимодействия, исключающие совместное назначение лекарственных средств
4. Нежелательно — потенциальные лекарственные взаимодействия, которые требуют специального (пристального) мониторирования, изменения дозирования или времени приема препаратов
Приложение 6.2
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ АНТИТРОМБОТИЧЕСКИХ И ПРЕПАРАТОВ ДЛЯ ЛЕЧЕНИЯ ПАЦИЕНТОВ С COVID-19
Приложение 7
СПИСОК ВОЗМОЖНЫХ К НАЗНАЧЕНИЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ COVID-19 У ВЗРОСЛЫХ
| Препарат (МНН) | Механизм действия | Формы выпуска | Схемы назначения | Противопоказания, особые указания, побочные эффекты | Ссылки |
| Гидроксихлорохин | Используется для лечения малярии и некоторых системных заболеваний соединительной ткани. Блокирует репликацию вируса, подавляет его цитопатическое действие и предотвращает стимуляцию неспецифического воспалительного ответа, которая отмечена у пациентов с COVID-19. | Таблетки | 400 мг 2 раза в первый день (утро, вечер), затем 200 мг 2 раза в сутки (утро, вечер) в течение 6 дней |
Часто вызывают нарушение сна, анорексию, тромбоцитопению, головную боль. С осторожностью пациентам с удлиненным интервалом QT, нарушением сердечного ритма. Противопоказан пациентам с ретинопатией; беременным женщинам; осторожно с почечной и печеночной недостаточностью, гепатитом при перенесенных гематологических заболеваниях при псориазе. При приеме мефлохина следует избегать деятельности, требующей высокой концентрации внимания и скорости психомоторных реакций. |
13, 50 |
| Хлорохин | 500 мг 2 раза в сутки в течение 7 дней | 13, 14, 23, 50, 51, 59 | |||
| Мефлохин |
1-й день: 250 мг 3 раза в день каждые 8 часов. 2-й день: 250 мг 2 раза в день каждые 12 ч. 3-й — 7-й дни: 250 мг 1 раз в день в одно и то же время. |
26, 78, 79 | |||
| Азитромицин | Полусинтетический антибиотик из группы макролидов, имеются данные о повышении эффективности в отношении COVID-19 при совместном применении с гидроксихлорохином. | Таблетки Лиофилизат для приготовления раствора для внутривенных инфузий | 500 мг per os или в/в 1 раз в сутки 5 дней |
Часто вызывает нарушения зрения, слуха, диарею, боли в животе, артралгии, лимфопению, сыпь. Противопоказан при тяжелой печеночной и/или почечной недостаточности, при беременности. С осторожностью — пациентам с удлиненным интервалом QT. — при совместном назначении терфенадина, варфарина, дигоксина. |
67 |
| Лопинавир+Ритонавир | Лопинавир — ингибитор ВИЧ-1 и ВИЧ-2 протеазы ВИЧ. Ритонавир — ингибитор аспартилпротеаз ВИЧ-1 и ВИЧ-2 | Таблетки Суспензия |
400 мг +100 мг per so каждые 12 часов в течение 14 дней. Может вводиться в виде суспензии 400 мг +100 мг (5 мл) каждые 12 часов в течение 14 дней через назогастральный зонд. |
Назначение лопинавира/ритонавира больным с ВИЧ-инфекцией только по согласованию с врачом СПИД Центра. Учитывать лекарственное взаимодействие с др. препаратами. Противопоказание — дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция, тяжелая печеночная недостаточность |
18, 33, 59 |
| Рекомбинантный интерферон бета-1b | Применяется для лечения рассеянного склероза, обладает противовирусным и иммуномодулирующим эффектом. | Раствор | 0.25 мг/мл (8 млн МЕ) подкожно в течение 14 дней (всего 7 инъекций) |
Часто вызывает гриппоподобный симптомокомплекс, реакции в месте введения препарата Противопоказан при беременности. |
25 |
| Рекомбинантный интерферон альфа | Обладает местным иммуномодулирующим, противовоспалительным и противовирусным действием. | Раствор | По 3 капли в каждый носовой ход (3000 МЕ) 5 раз в день в течение 5 дней | 11, 33, 42, 59 | |
| Умифеновир | По механизму противовирусного действия относится к ингибиторам слияния (фузии), взаимодействует с гемагглютинином вируса и препятствует слиянию липидной оболочки вируса и клеточных мембран. | капсулы | по 200 мг 4 раза в день в течение 5 — 7 дней | Противопоказан при беременности. | [81, 82, 83] |
Приложение 8
ПРЕПАРАТЫ УПРЕЖДАЮЩЕЙ ПРОТИВОВОСПАЛИТЕЛЬНОЙ ТЕРАПИИ COVID-19 У ВЗРОСЛЫХ
| Препарат (МНН) | Механизм действия | Формы выпуска | Схемы назначения | Противопоказания |
| Тоцилизумаб |
Препараты на основе моноклональных антител, ингибируют рецепторы ИЛ-6. Применяются для лечения ревматоидного артрита. При лечении COVID-19 предназначены для пациентов со среднетяжелым и тяжелым течением: с острым респираторным дистресс-синдромом, тяжелым жизнеугрожающим синдромом высвобождения цитокинов. |
Концентрат для приготовления раствора для инфузий | 400 мг разводят в 100 мл 0,9% раствора NaCl, вводят внутривенно капельно в течение 60 минут, при недостаточном эффекте повторить введение через 12 ч. Однократно вводить не более 800 мг. |
— Иммуносупрессивная терапия при трансплантации органов; — Нейтропения составляет менее 0,5 x 109 кл/л; — Повышение уровня АСТ или АЛТ более чем в 5 раз превышает верхнюю границу нормы; — Тромбоцитопения < 50 000/мм3. — При беременности — нежелателен. — Септический шок, полиорганная недостаточность |
| Сарилумаб | Раствор в шприц-ручках | Сарилумаб 200 мг или 400 мг (предварительно заполненный шприц-ручку в дозировке 200 мг (1 или 2 шприца в зависимости от дозы)) развести в 100 мл 0,9% раствора NaCl, вводить внутривенно капельно в течение 60 минут, при недостаточном эффекте повторить введение через 12 ч. | ||
| Метилпреднизолон | Относятся к глюкокортикостероидам, обладают иммуновоспалительным, | Раствор | 0,5 мг/кг 2 раза в сутки. | |
| Дексаметазон | иммунодеспрессивным, противошоковым фармакологическим действием. Влияют на все фазы воспаления. | Раствор | 12 мг 1 раз в сутки ИЛИ 4 мг * 3 раза в сутки в/в | |
| Барицитиниб | Является селективным ингибитором JAK1 и JAK2 киназ, применяется для лечения ревматоидного артрита. При лечении COVID-19 предназначены для пациентов со среднетяжелым течением в качестве дополнительной терапии | Таблетки | 4 мг один раз в сутки в течение 7 — 14 дней |
АКЛ < 0,5 x 109 кл/л, АКН < 1 x 109 кл/л, Гемоглобин < 8 г/дл, Клиренс креатинина < 30 мл/мин, Тяжелая печеночная недостаточность/если есть подозрение на лекарственное повреждение печени, Активный туберкулез, ТВГ/ТЭЛА в анамнезе С осторожностью: возраст старше 75 лет, прием ЦОГ-2 ингибиторов |
Приложение 9
СПИСОК ВОЗМОЖНЫХ К НАЗНАЧЕНИЮ АНТИТРОМБОТИЧЕСКИХ ПРЕПАРАТОВ ДЛЯ ЛЕЧЕНИЯ COVID-19 У ВЗРОСЛЫХ
| Препарат | Профилактическая доза | Лечебная доза |
| Нефракционированный гепарин | Подкожно 5000 ЕД 2 — 3 раза/сут | Внутривенная инфузия под контролем анти-Ха активности, т.к. АЧТВ может изменяться из-за развития коагулопатии. |
| Внутривенно болюсом 80 ЕД/кг (или 5000 ЕД) и инфузия с начальной скоростью 18 ЕД/кг/ч (или 1250 — 1300 ЕД/ч), затем подбор дозы по значениям анти-Ха-активности, которые должны быть в диапазоне от 0,6 до 1,0 ЕД/мл по данным амидолитического метода. | ||
| Далтепарин <*> | Подкожно 5000 МЕ 1 раз/сут | Подкожно 100 МЕ/кг 2 раза/сут |
| Надропарин кальция <*> | Подкожно 0,4 мл 1 раз/сут при массе 70 кг или 0,6 мл 1 раз/сут при массе > 70 кг | Подкожно 86 МЕ/кг 2 раза/сут |
| Эноксапарин натрия <*> | Подкожно 40 мг 1 раз/сут | Подкожно 100 МЕ (1 мг/кг) 2 раза/сут |
| Фондапаринукс натрия <**> | Подкожно 2,5 мг 1 раз/сут |
Подкожно 1 раз в сутки 5 мг при массе тела до 50 кг; 7,5 мг при массе тела 50 — 100 кг; 10 мг при массе тела выше 100 кг. |
———————————
Примечание:
<*> При выраженной почечной недостаточности требуется коррекция дозы, в наиболее тяжелых случаях противопоказаны (см. инструкцию к препаратам).
<**> Не является препаратом выбора; при выраженной почечной недостаточности противопоказан (см. инструкцию к препарату).
Приложение 10
РЕКОМЕНДОВАННЫЕ СХЕМЫ ЛЕЧЕНИЯ В ЗАВИСИМОСТИ ОТ ТЯЖЕСТИ ЗАБОЛЕВАНИЯ
| Форма заболевания | Возможные варианты схем лечения |
| Легкие формы |
Схема 1: Гидроксихлорохин <*> ИЛИ Схема 2: Хлорохин <*> ИЛИ Схема 3: Мефлохин <*> ИЛИ Схема 4: Рекомбинантный интерферон альфа + умифеновир |
| Средне-тяжелые формы (пневмония без дыхательной недостаточности) у пациентов младше 60 лет без сопутствующих хронических заболеваний |
Схема 1: Гидроксихлорохин <*> ИЛИ Схема 2: Хлорохин <*> ИЛИ Схема 3: Мефлохин <*> |
| Средне-тяжелые формы (пневмония без дыхательной недостаточности) у пациентов старше 60 лет или пациентов с сопутствующими хроническими заболеваниями |
Схема 1: Гидроксихлорохин + азитромицин +/- барицитиниб ИЛИ Схема 2: Мефлохин + азитромицин +/- барицитиниб ИЛИ Схема 3: Лопинавир/ритонавир + рекомбинантный интерферон бета-1b +/- барицитиниб |
| Тяжелые формы (пневмония с развитием дыхательной недостаточности, ОРДС) |
Схема 1: Гидроксихлорохин + азитромицин +/- тоцилизумаб (сарилумаб) ИЛИ Схема 2: Мефлохин + азитромицин +/- тоцилизумаб (сарилумаб) ИЛИ Схема 3: Лопинавир/ритонавир + рекомбинантный интерферон бета-1b +/- тоцилизумаб (сарилумаб) ИЛИ Схема 4: Лопинавир/ритонавир + гидроксихлорохин +/- тоцилизумаб (сарилумаб) |
———————————
Примечание:
<*> Возможно в комбинации с рекомбинантным интерфероном альфа.
Приложение 11
Приложение 12
РЕКОМЕНДОВАННЫЕ СХЕМЫ МЕДИКАМЕНТОЗНОЙ ПРОФИЛАКТИКИ COVID-19
| Группа | Рекомендованная схема |
| Здоровые лица и лица из группы риска (старше 60 лет или с сопутствующими хроническими заболеваниями) | Рекомбинантный интерферон альфа. Капли или спрей в каждый носовой ход 5 раз в день, до 1 месяца (разовая доза — 3000 ME, суточная доза — 15000 — 18000 ME), срок — 5 дней. |
| Постконтактная профилактика у лиц при единичном контакте с подтвержденным случаем COVID-19 |
1. Гидроксихлорохин 1-й день: 400 мг 2 раза (утро, вечер), далее по 400 мг 1 раз в неделю в течение 3 недель; |
|
2. Мефлохин 1-й и 2-й дни: 250 мг 2 раза (утро, вечер), 3-й день: 250 мг в сутки, далее по 250 мг 1 раз в неделю в течение 3 недель. |
|
| Профилактика COVID-19 у лиц, находящихся в очаге заражения |
1. Гидроксихлорохин 1-й день: 400 мг 2 раза с интервалом 12 ч, далее по 400 мг 1 раз в неделю в течение 8 недель; |
|
2. Мефлохин 1-й и 2-й дни: 250 мг 2 раза с интервалом 12 ч, 3-й день: 250 мг в сутки, далее по 250 мг 1 раз в неделю в течение 8 недель. |
Приложение 13
ИНСТРУКЦИЯ ПО СОБЛЮДЕНИЮ МЕР ИНФЕКЦИОННОЙ БЕЗОПАСНОСТИ ДЛЯ ВЫЕЗДНЫХ БРИГАД СКОРОЙ МЕДИЦИНСКОЙ ПОМОЩИ
1. Медицинские работники специализированной выездной бригады скорой медицинской помощи, выполняющей вызов к пациенту с подозрением на новую коронавирусную инфекцию COVID-19, непосредственно перед выездом надевают средства индивидуальной защиты. Средства индивидуальной защиты меняются после каждого больного.
2. Водитель специализированной выездной бригады скорой медицинской помощи также обеспечивается средствами индивидуальной защиты.
3. В процессе медицинской эвакуации пациента с подозрением на новую коронавирусную инфекцию COVID-19 дезинфекция воздуха в салоне автомобиля скорой медицинской помощи обеспечивается бактерицидными облучателями и (или) другими устройствами для обеззараживания воздуха и (или) поверхностей.
4. В случае загрязнения салона биологическим материалом от пациента с подозрением на новую коронавирусную инфекцию COVID-19 места загрязнения незамедлительно подвергают обеззараживанию.
5. Водитель и медицинские работники специализированных выездных бригад скорой медицинской помощи обязаны продезинфицировать обувь, средства индивидуальной защиты рук в отведенных местах после передачи пациента в медицинскую организацию, оказывающую медицинскую помощь в стационарных условиях, специально созданную для данного контингента пациентов (далее — специальная медицинская организация).
6. После завершения медицинской эвакуации пациента с подозрением на новую коронавирусную инфекцию COVID-19 в специальную медицинскую организацию автомобиль скорой медицинской помощи и предметы, использованные при медицинской эвакуации, обеззараживаются силами дезинфекторов на территории специальной медицинской организации на специально оборудованной площадке со стоком и ямой.
7. При невозможности проведения дезинфекции салона автомобиля скорой медицинской помощи силами дезинфекторов на территории специальной медицинской организации дезинфекция проводится водителем и медицинскими работниками специализированной выездной бригады скорой медицинской помощи.
8. Дезинфекции в салоне автомобиля скорой медицинской помощи подвергают все поверхности в салоне, в том числе поверхности медицинских изделий.
9. Обработка поверхностей проводится способом протирания ветошью, смоченной дезинфицирующим раствором, или способом орошения путем распыления дезинфицирующего раствора.
10. После экспозиции дезинфицирующий раствор смывают чистой водой, протирают сухой ветошью с последующим проветриванием до исчезновения запаха дезинфектанта.
11. Средства индивидуальной защиты, использовавшиеся при оказании медицинской помощи, уборочную ветошь собирают в пакеты и сбрасывают в специальные контейнеры для отходов класса В на территории специальной медицинской организации.
12. После проведения дезинфекции в салоне автомобиля скорой медицинской помощи при возвращении специализированной выездной бригады скорой медицинской помощи на станцию (подстанцию, отделение) скорой медицинской помощи проводится обеззараживание воздуха и поверхностей салона автомобиля скорой медицинской помощи бактерицидными облучателями и (или) другими устройствами для обеззараживания воздуха и (или) поверхностей в течение не менее 20 минут.
13. Водитель и медицинские работники специализированной выездной бригады скорой медицинской помощи после выполнения вызова обязаны пройти санитарную обработку, включающую протирание открытых участков тела кожным антисептиком.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Авторы
канд. мед. наук. Е. Ю. Кардонова – заведующая ОМО по инфекционным болезням ДЗМ
О. Д. Лазарова – врач-инфекционист организационно-методического отдела по инфекционным болезням ДЗМ
Профильный редактор
канд. мед. наук. С. В. Сметанина – главный внештатный специалист по инфекционным болезням ДЗМ, главный врач ГБУЗ «ИКБ №1 ДЗМ»
Записаться к специалисту можно через ЕМИАС
Коронавирусы (Coronaviridae) — это большое семейство РНК-содержащих вирусов, способных инфицировать как животных (их естественных хозяев), так и человека. У людей коронавирусы могут вызвать целый ряд заболеваний — от легких форм острой респираторной инфекции (ОРВИ) до тяжелого острого респираторного синдрома (ТОРС или SARS).
До 2002 г. коронавирусы рассматривались в качестве агентов, вызывающих нетяжелые заболевания верхних дыхательных путей (с крайне редкими летальными исходами). В период с 2002 по 2004 гг. коронавирус SARS-CoV из рода Betacoronavirus впервые стал причиной развития эпидемии так называемой атипичной пневмонии (ТОРС). С 2004 г. новых случаев атипичной пневмонии, вызванной SARS-CoV, не зарегистрировано. Очередная эпидемия, вызванная коронавирусом MERS-CoV, также из рода Betacoronavirus — ближневосточный коронавирусный синдром, началась в 2012 г. на Аравийским полуострове. В настоящий момент MERS-CoV продолжает циркулировать и вызывать новые случаи заболевания.
Всемирная организация здравоохранения (ВОЗ) 11 февраля 2020 г. определила официальное название инфекции, вызванной новым коронавирусом, — COVID-19 («Coronavirus disease 2019»). Международный комитет по таксономии вирусов 11 февраля 2020 г. присвоил официальное название возбудителю инфекции — SARS-CoV-2.
Передача инфекции осуществляется воздушно-капельным, воздушно-пылевым и контактным путями. Ведущим путем передачи SARS-CoV-2 является воздушно-капельный, который реализуется при кашле, чихании и разговоре на близком (менее 2 метров) расстоянии. Возможен контактный путь передачи, который реализуется во время рукопожатий и других видах непосредственного контакта с инфицированным человеком, а также через поверхности и предметы, контаминированные вирусом.
Штаммы SARS-CoV-2
Штаммы — это, если простыми словами, вариации одного вируса. Количество вариантов SARS-CoV-2 в настоящее время превышает 1000 различных генетический линий. Большинство зарегистрированных мутаций SARS-CoV-2 не имеют функционального значения.
Помимо самих штаммов на течение болезни влияют хронические заболевания, общее состояние здоровья, возраст и т. д.
На протяжении всей пандемии ученые внимательно следили за такими мутациями, как:
-
Альфа (впервые выявлен в Великобритании в сентябре 2020 года)
-
Бета (впервые выявлен в ЮАР в мае 2020 года)
-
Гамма (впервые обнаружен в Бразилии в ноябре 2020 года)
-
Дельта (впервые обнаружен в Индии в октябре 2020 года)
-
Омикрон (впервые обнаружен в ЮАР и Ботсване в ноябре 2021 года)
-
Эта
-
Лямбда
-
Мю
Симптомы COVID-19
- Лихорадка
-
Кашель
-
Одышка
-
Озноб
-
Утомляемость
-
Мышечные боли
-
Ощущение заложенности в грудной клетке
-
Головная боль
-
Боль в горле
-
Заложенность носа/насморк
-
Снижение обоняния и вкуса
-
Тошнота
-
Диарея
-
Сообщалось также об инсультах у некоторых людей, больных COVID-19.
Здесь важно знать следующее:
-
Лицо. Является ли одна сторона лица человека онемевшей или опущенной? Его улыбка кривая?
-
Руки. Одна рука слабая или онемела? Если человек попытается поднять обе руки, одна из рук не поднимется?
-
Речь. Может ли человек говорить ясно? Попросите его повторить за вами любое предложение.
-
Время. Каждая минута на счету, когда у кого-то появляются признаки инсульта. Срочно звоните 112!
-
Инкубационный период составляет от 2 до 14 суток, в среднем 5–7 суток.
По данным исследователей из Китая, самые распространенные симптомы среди людей, перенесших COVID-19:
-
Лихорадка 99%
-
Усталость 70%
-
Кашель 59%
-
Отсутствие аппетита 40%
-
Боли в теле 35%
-
Одышка 31%
-
У больных COVID-19 часто наблюдается артериальный и венозный тромбоз.
Классификация COVID-19 по степени тяжести
Легкое течение
-
Т тела <38 °C, кашель, слабость, боли в горле
-
Отсутствие критериев среднетяжелого и тяжелого течения
Среднетяжелое течение
-
Т тела > 38 °C
-
ЧДД > 22/мин
-
Одышка при физических нагрузках
-
Изменения при КТ (рентгенографии), типичные для вирусного поражения
-
SpO2 < 95%
-
СРБ сыворотки крови >10 мг/л
Тяжелое течение
-
ЧДД > 30/мин
-
SpO2 ≤ 93%
-
PaO2 /FiO2 ≤ 300 мм рт.ст.
-
Снижение уровня сознания, ажитация
-
Нестабильная гемодинамика (систолическое АД менее 90 мм рт.ст. или диастолическое АД менее 60 мм рт.ст., диурез менее 20 мл/час)
-
Изменения в легких при КТ (рентгенографии), типичные для вирусного поражения
-
Лактат артериальной крови > 2 ммоль/л
-
qSOFA > 2 балла
Крайне тяжелое течение
.
Стойкая фебрильная лихорадка
Острый респираторный дистресс-синдром (ОРДС)
Острая дыхательная недостаточность (ОДН) с необходимостью респираторной поддержки (инвазивная вентиляции легких)
Септический шок
Полиорганная недостаточность
Изменения в легких при КТ (рентгенографии), типичные для вирусного поражения критической степени или картина ОРДСВ среднем у 50% инфицированных заболевание протекает бессимптомно.
У 80% пациентов с наличием клинических симптомов заболевание протекает
в легкой форме ОРВИ.
Лечение
Что делать в случае бессимптомного или легкого течения COVID-19 и ОРВИ можно прочитать здесь
Что делать, если заболел ребенок?
-
Ваши действия:
-
Оставить ребенка дома, не отправлять в детский сад или школу.
-
Строго выполнять рекомендации медицинских работников по диагностике и лечению заболевания. Ни в коем случае не заниматься самолечением.
-
Необходимо позвонить в единую службу «122» или в call-центр Вашей поликлиники для дистанционной консультации с медицинским работником.
-
В случае ухудшения состояния необходимо позвонить в службу скорой помощи по номеру «103».
ВАЖНО: не стоит самостоятельно лечить ребенка антибиотиками. Антибиотики могут быть назначены только врачом-педиатром и только в случае наличия показаний.
По мере развития заболевания и наблюдения за течением болезни рекомендации могут быть скорректированы!
-
Используйте защитные маски или респираторы при нахождении в закрытых помещениях и контактах с другими людьми.
-
Тщательно и часто мойте руки и обрабатывайте их антисептиком.
-
По возможности минимизируйте посещения мест с большим скоплением людей, а в случае, если избежать этого невозможно, соблюдайте дистанцию 1,5–2 метра.
Эти простые профилактические меры снизят риск заражения.
Также напоминаем о необходимости пройти вакцинацию и своевременную ревакцинацию от коронавируса.
Москва вошла в топ-3 городов в мире по количеству инноваций в борьбе с COVID-19, поэтому вы можете:
-
Подать заявку на аудиконсультацию с врачом
-
Пациенты могут также получить телемедицинскую консультацию
-
Оформить больничный лист онлайн
-
Сдать тест на коронавирус — в Москве ежедневно делается 70 000 тестов и есть 20 центров диагностики пневмонии, которые работают круглосуточно без выходных по всему городу
Последствия COVID-19
Наиболее распространенным клиническим проявлением нового варианта коронавирусной инфекции является двусторонняя пневмония (вирусное диффузное альвеолярное повреждение с микроангиопатией), у 3–4% пациентов зарегистрировано развитие острого респираторного дистресс-синдрома (ОРДС). У части больных развивается гиперкоагуляционный синдром с тромбозами и тромбоэмболиями, поражаются также другие органы и системы (центральная нервная система, миокард, почки, печень, желудочно-кишечный тракт, эндокринная и иммунная системы), возможно развитие сепсиса и септического шока.
Как понять, что это: COVID-19, простуда или грипп
Длительность инкубационного периода COVID-19 может колебаться от 2 до 14 дней, однако в среднем составляет 5–7 дней, тогда как длительность инкубационного периода гриппа и ОРВИ, как правило, не превышает 3 дней. При гриппе заболевание начинается резко, при COVID-19 и ОРВИ, как правило, постепенно. Как при COVID-19, так и при гриппе может отмечаться высокая лихорадка, кашель, слабость. При течении ОРВИ высокая лихорадка, слабость встречаются редко. При этом при гриппе и ОРВИ одышка и затрудненное дыхание отмечаются значительно реже, чем при COVID-19.
Как долго может длиться пандемия
Невозможно сказать, как долго будет продолжаться пандемия. Существует множество факторов, в том числе усилия общественности по замедлению распространения, работа исследователей, направленная на то, чтобы узнать больше о вирусе, поиски лечения и массовая вакцинация населения.
Список литературы:
- «Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 14 (27.12.2021) / Министерство здравоохранения Российской Федерации, 2021 — 233 стр.
-
Письмо> Минздрава России от 26.01.2022 N 30–4/И/1-1019 <О направлении памятки для граждан о действиях в случае бессимптомного или легкого течения новой коронавирусной инфекции и острой респираторной вирусной инфекции
-
Coronavirus and COVID-19: What You Should Know, WebMD, Published 22/12/2021, Coronavirus & COVID-19 Overview: Symptoms, Risks, Prevention, Treatment & More (webmd.com)
-
Москва vs COVID-19, Официальный сайт Мэра Москвы, статистика от 10/02/2022, 5. Коронавирус: официальная информация и последние новости / Проекты / Сайт Москвы (mos.ru)
-
Временные методические рекомендации: Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 14 (27.12.2021) / Министерство здравоохранения Российской Федерации, 2021 — 233 стр. Документ
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Что такое коронавирусная болезнь COVID-19. Общая информация о заболевании
Вирус в настоящее время известен как коронавирус 2 тяжелого острого респираторного синдрома (Severe acute respiratory syndrome-related coronavirus 2 — SARS-CoV-2), и вызванное им заболевание называется коронавирусной болезнью 2019 (COronaVIrus Disease 2019 — COVID-19).
Коронавирусы – семейство РНК-содержащих вирусов, которые могут инфицировать как животных (крупного рогатого скота, птиц, собак), так и человека.
Вирусы, патогенные для животных, вызывают у них болезни печени, желудочно-кишечного тракта, повреждения мозга. Среди них наиболее изучен вирус инфекционного бронхита кур.
До 2002 года коронавирусы рассматривали в качестве агентов, которые могут вызывать нетяжелые заболевания верхних дыхательных путей. Смертельные исходы регистрировались крайне редко.
Семейство Coronaviridae содержит четыре рода вирусов:
-
альфа-коронавирус (alphaCoV)
-
бета-коронавирус (betaCoV)
-
дельта-коронавирус (deltaCoV)
-
гамма-коронавирус (gammaCoV)
Настоящая пандемия COVID19 вызвана вирусом SARS-Cov-2, который относится к роду β-коронавирусов. Инфицирование человека могут вызывать только альфа- и бетта- подтипы коронавируса.
Строение и размножение вирусов
Коронавирусы названы в соответствии с их внешним видом под электронным микроскопом. Вирусы выглядят так, как будто они покрыты остроконечными шипами, которые окружают их как корону.
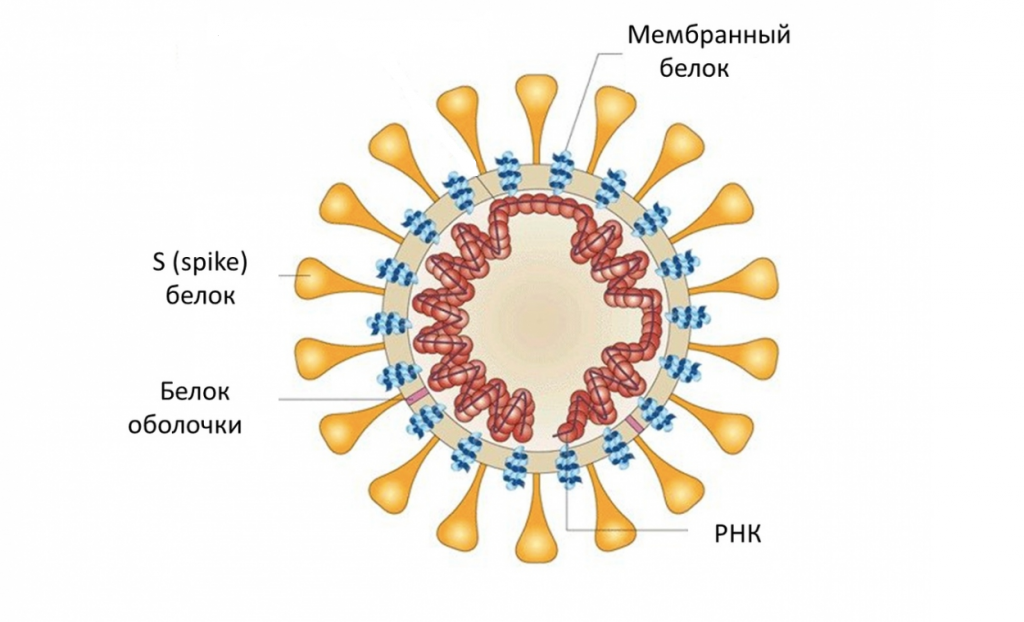
Для размножения и распространения, вирусам нужны живые клетки. Когда коронавирус находит подходящую клетку, он вводит в нее цепочку собственной РНК, которая содержит весь его генетический материал.Коронавирус взаимодействует с клетками посредством белков Spike (тех самых «шипов» на его поверхности). После проникновения в клетку происходит копирование и построение новых белков на основе генома вируса, что в конечном итоге приводит к сборке новых вирусных частиц.
Пути распространения
SARS-Cov-2 – относится к зооанторопонозным заболеваниям, то есть к заболеваниям общим для животных и человека. К этому же типу, в числе прочего, относят бешенство, лептоспироз, сибирскую язву, ящур.
Животные могут быть как резервуаром (естественной средой обитания вируса), так и источником инфекции при определенных условиях. По классификации Международного эпизоотического бюро (МЭБ) большинство коронавирусных инфекций относят к Типу 2+: болезни, передающиеся от диких животных домашним и человеку. Как известно, вспышка сегодняшней коронавирусной инфекции началась с рынка в китайском городе Ухань, на котором продаются морепродукты, летучие мыши, лягушки, змеи, птицы, сурки, кролики, и быстро поразила первых 50 человек.
Иными словами, первые пациенты получили вирус от животных, но масштаб пандемии COVID19 приобрел именно из-за передачи вирусной инфекции от человека к человеку.
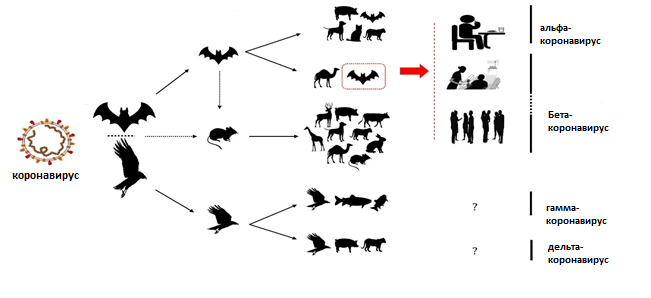
Ключевые резервуары и способ передачи коронавирусов (предполагаемые резервуары SARS-CoV-2 обведены красным на рис. 2); только α и β коронавирусы обладают способностью инфицировать людей. Пунктирная черная стрелка показывает возможность переноса вируса из летучей мыши, тогда как сплошная черная стрелка обозначает подтвержденный перенос.
С начала 21 века было зарегистрировано несколько вспышек болезней, вызванных коронавирусом: SARS-Cov (атипичная пневмония), MERS-Cov (ближневосточный респираторный синдром).
2002 год – эпидемия атипичной пневмонии (или тяжелого острого респираторного синдрома) была вызвана коронавирусом SARS-Cov. В процессе размножения вирус разрушал клетки легочной ткани и вызывал «атипичную» пневмонию. Эпидемия охватила 37 стран ближневосточного региона, было зарегистрировано более 800 тысяч случаев заражения, умерло 774 человека. С 2004 года новых случаев заболевания зафиксировано не было.
2012 год – вспышка ближневосточного респираторного синдрома, возбудителем которого также стал коронавирус, который получил название MERS-Cov. Во время вспышки было зафиксировано 2519 случаев заражения, из них более 860 со смертельным исходом. Вирус циркулирует по настоящее время, ежегодно регистрируются единичные случаи заболевания, вызываемые MERS-Cov.
Подробные исследования показали, что SARS-Cov передавался людям от циветт (хищных зверьков, дальних родственников кошки), а MERS-Cov – от одногорбых верблюдов. Генетическая последовательность нынешнего SARS-Cov-2 показала более 80% идентичности с SARS-CoV и 50% с MERS-CoV, причем как SARS-CoV, так и MERS-CoV происходят от летучих мышей. Существует вероятность того, что в передаче вируса человеку участвовал промежуточный хозяин. Более тщательный анализ показал, что по генам, кодирующим белки, SARS-Cov-2 ближе к коронавирусу змеи. Эти рептилии охотятся на летучих мышей, так что между ними вполне возможен обмен вирусами.
Понимание путей заражения и механизмов преодоления межвидового барьера очень важно для прогнозирования развития подобных вспышек эпидемий.
Например, если SARS-Cov-2 адаптирован к другим видам животных и мутация вируса произошла до попадания в организм человека (т.е. к человеку попал «случайно»), то велика вероятность повторных коронавирусных вспышек. И напротив, если вирус мутировал уже в организме человека, то разработка вакцины сможет полностью победить SARS-Cov-2.
Приоритетные задачи расследования по идентификации животного источника обсуждались на заседании неформальной консультативной группы МЭБ по COVID-19 и были представлены на Глобальном форуме ВОЗ по научным исследованиям и инновациям (11-12 февраля 2020 г.)
Список литературы:
1. Andersen KG, Rambaut A., Lipkin WI et al. Проксимальное происхождение SARS-CoV-2. NatMed 26, 450–452 (2020).
2. Muhammad AdnanShereen, SulimanKhan, AbeerKazmi,NadiaBashir,RabeeaSiddique. COVID-19 infection: Origin, transmission, and characteristics of human coronaviruses. Journal of Advanced Researc, July 2020, Pages 91-98July 2020, Pages 91-98
3. Официальный сайт Россельхознадзора
4. Jie Cui, Fang Li, and Zheng-Li Shi. Origin and evolution of pathogenic coronaviruses. NatRevMicrobiol. 2019; 17(3): 181–192.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
В интернете встречается очень много противоречивой информации о новой коронавирусной инфекции COVID-19. Данная статья призвана дать ответы на основные вопросы, в том числе предоставить информацию о профилактике заболевания и восстановления после него.
Для начала обратимся к терминам:
COVID-19 – сокращенно от Coronavirus disease 2019 – официальное название инфекции, определенное Всемирной организацией здравоохранения.
Новая коронавирусная инфекция (COVID 19) – официальное название COVID-19 на территории Российской Федерации.
SARS-CoV-2 – официальное название возбудителя инфекции, то есть конкретный подтип вируса из всего семейства коронавирусов.
Симптомы COVID-19
Симптомы весьма разнообразны и имеют различную частоту встречаемости. Нередко наблюдается асимптоматическое течение инфекции.
Самые частые симптомы:
- Лихорадка;
- Кашель (обычно сухой, влажный – менее частый симптом);
- Слабость.

Одновременное сочетание лихорадки, слабости и сухого кашля встречается только в 15% случаев!
Частые симптомы:
- Боль в мышцах;
- Затруднение дыхания (является ранним признаком ухудшения состояния);
- Отсутствие обоняния и/или вкуса (может быть единственным симптомом инфекции);
- Потеря аппетита;
- Насморк;
- Головная боль;
- Першение в горле;
- Сухость слизистых оболочек ротовой полости;
- Язвы ротовой полости.
Менее частые:
- Диарея и боль в животе (в редких случаях может быть единственным проявлением инфекции);
- Тошнота и рвота;
- Конъюнктивит;
- Кожная сыпь;
- Звон в ушах, головокружение, снижение слуха (редко).

У пожилых пациентов новая коронавирусная инфекция (COVID-19) может начаться с появления психических отклонений (делирий).
Формы COVID-19
По длительности течения выделяют:
- Острая форма – признаки и симптомы COVID-19 длятся до 4 недель;
- Сохраняющаяся симптоматическая инфекция COVID-19 — признаки и симптомы заболевания длятся более 4 недель, но не более 12 недель;
- Постковидный синдром — признаки и симптомы COVID-19, которые могут развиться как во во время инфицирования, так и после, продолжаются более 12 недель и не могут быть объяснены другим заболеванием.
Термин «Продолжительное течение COVID-19» включает в себя две формы заболевания:
- По данным заболеваемости в России, у 50% инфицированных людей симптомы отсутствуют. У 80% пациентов с симптомами заболевание протекает в легкой форме.
- У большинства пациентов симптомы исчезают полностью к 12 неделе от начала заболевания.
- На настоящий момент считается, что вероятность развития постковидного синдрома не связана с тяжестью теченияострой формы COVID-19.
- При постковидном синдроме симптомы могут изменяться с течением времени.
Диагностика инфекции COVID-19
Диагностика новой коронавирусной инфекции (COVID-19) заключается в лабораторном подтверждении наличия возбудителя, то есть вируса SARS-CoV-2 в организме, либо на подтверждении реакции иммунитета.

Все медицинские организации, которые выявили случай заболевания COVID-19, вносят информацию о нем в информационный ресурс в соответствии с постановлением Правительства Российской Федерации от 31 марта 2020 г. № 373 (с изменениями и дополнениями) «Об утверждении Временных правил учета информации в целях предотвращения распространения новой коронавирусной инфекции (COVID-19)».
Полимеразная цепная реакция (ПЦР):
- Используется для подтверждения активной инфекции, то есть наличия вируса в организме;
- Требует минимум несколько часов для получения результата;
- Специфичность около 100%, что означает, что положительный результат подтверждает наличие именно вируса SARS-CoV-2 в исследованном материале;
- Очень низкая частота ложно отрицательных результатов при правильном сборе материала;
- Неправильный сбор биоматериала может привести к ложно отрицательному результату;
- Не оценивает иммунитет;
- Метод не может быть использован для подтверждения предыдущей инфекции.
Изотермальная амплификация (LAMP):
- Используется для подтверждения активной инфекции, то есть наличия вируса в организме;
- Результат в течение 30-60 минут;
- Высокие специфичность и чувствительность;
- Неправильный сбор биоматериала может привести к ложно отрицательному результату;
- Для многих организаций требуется именно результат ПЦР-теста;
- Не оценивает иммунитет;
- Метод не может быть использован для подтверждения предыдущей инфекции.
Антигенный тест:
- Используется для подтверждения активной инфекции, то есть наличия вируса в организме;
- Результат в течение 10-15 минут (экспресс);
- Достаточно высокая частота ложно отрицательных результатов;
- Высокая специфичность;
- Не оценивает иммунитет;
- Метод не может быть использован для подтверждения предыдущей инфекции.
Тестирование на антитела класса IgM/IgA и IgG:
- Показывает наличие или отсутствие иммунного ответа, в том числе у людей, вакцинированных против новой коронавирусной инфекции (COVID-19);
- Наличие специфических антител к вирусу SARS-CoV-2 может использоваться в качестве доказательства встречи с инфекцией в прошлом;
- Для определения специфичности требуются дополнительные исследования;
- Чувствительность ниже, чем у ПЦР, поэтому нецелесообразно использовать тестирование на антитела для подтверждения острой инфекции;
- Точная интерпретация результатов не всегда возможна: значение уровня иммуноглобулинов различных классов требует дополнительных исследований.

Защитные уровни антител к коронавирусу SARS-CoV-2 не установлены! Невысокие цифры иммуноглобулинов класса G не означают низкую защиту, и, наоборот, высокие цифры – не означают сильную защиту. Для интерпретации результатов у вакцинированных людей зачастую ориентируются на то, что после перенесенной коронавирусной инфекции образуются антитела (иммуноглобулины класса G) к нуклеокапсидному белку (N), а к спайковому белку (S) антитела образуются как после перенесенного заболевания, так и после вакцинации.
Лечение
Лечение в случае заболевания должно быть назначено врачом с учетом наличия показаний и противопоказаний.
Также для лечения важны немедикаментозные методы лечения:
- Отдых;
- Обильное питье;
- Достаточное потребление пищи;
- Частое проветривание помещения;
- Дыхательная гимнастика;
- По мере улучшения самочувствия, постепенное увеличение физической активности;
- Забота о ментальном здоровье.
Если вы чувствуете тревогу, страх, постоянный упадок настроения, имеет смысл обратиться за профессиональной психологической помощью.
Реабилитация после ковида
Сделайте обследование после заболевания. При легком течении острой формы COVID-19 в случае полного выздоровления и отсутствия хронических заболеваний от дополнительного обследования организма можно воздержаться. Однако при среднетяжелом и тяжелом течении через 4 недели после выписки из стационара рекомендуется обратиться для осмотра к врачу-терапевту, а через 8 недель – пройти обследование. Оно включает в себя (перечень может меняться по решению врача):
- осмотр врача-терапевта;
- измерение уровня насыщения крови кислородом (сатурация);
- рентгенография органов грудной клетки;
- ЭХО-КГ при наличии показаний;
- спирография;
- при наличии патологических изменений по результатам вышеуказанных тестов показано проведение КТ легких. По результатам КТ принимается решение о необходимости консультации пульмонолога;
- общий клинический анализ крови;
- развернутый биохимический анализ крови: холестерин, ЛПНП, C-реактивный белок, АЛТ, АСТ, ЛДГ, креатинин;
- уровень D-димера в крови;
- при наличии значимого повышения D-димера проводится дуплексное сканирование вен нижних конечностей.
Важную роль в улучшении качества жизни и избавлении от остаточных симптомов играет правильное восстановление после болезни. Всемирная организация здравоохранения создала специальный материал для пациентов для самостоятельной реабилитации, который можно найти по ссылке: https://apps.who.int/iris/handle/10665/333288.
В случае сохранения симптомов определите, как они повлияли на вашу жизнь. Расскажите об этом врачу.
- Повседневная физическая активность: помогает устранить слабость, уменьшает симптомы одышки, а также оказывает положительное влияние на когнитивные функции, уменьшает стресс и улучшает настроение. Постепенно увеличивайте уровень ежедневной физической активности и интенсивность нагрузок.
- Дыхательная гимнастика тренирует дыхательные мышцы и легкие, улучшает кровообращение. Не рекомендуется выполнять дольше 10-15 минут, так как может приводить к головокружению. При наличии эпилепсии перед началом выполнения дыхательной гимнастики необходимо проконсультироваться с врачом!
- Если курите, необходимо отказаться от курения. Рекомендуется обратиться к врачу для участия в программах отказа от курения и, при необходимости, медикаментозной поддержки.
- Поддерживать оптимальную массу тела. В случае наличия избыточной массы тела рекомендуется сбросить вес для улучшения кровообращения, уменьшения нагрузки на сердце и суставы, снижения рисков сердечно-сосудистых катастроф.
- Правильное питание: средиземноморская диета считается оптимальным типом питания для поддержания здоровья. При наличии гипертонической болезни необходимо ограничить соль (не более 5 грамм в сутки). Не переедайте. Рацион должен содержать достаточное количество свежих овощей и фруктов.
- Потребляйте достаточное количество жидкости.
- Для восстановления когнитивных функций используйте головоломки, кроссворды, упражнения на развитие памяти и т.п. Начинайте с легких упражнений и затем постепенно повышайте уровень сложности. Также эффективны чтение, физические упражнения и новые хобби.
- Получайте поддержку. Если у вас нет возможности или желания получать ее от близких людей, обратитесь в группы поддержки, которые существуют как онлайн, так и оффлайн.
- Соблюдайте рекомендации врача для лечения имеющихся у вас хронических заболеваний. Обязательно следите за артериальным давлением, оно должно быть ниже 140/90 мм рт.ст.
- Рассмотрите перестановку в квартире для облегчения передвижений.
- Существуют исследования, результаты которых демонстрируют значительное уменьшение выраженности постковидного синдрома после вакцинации против COVID-19.
Лайфхак 1: Дополнительную информацию о восстановлении после COVID-19 можно найти на англоязычном сайте https://www.yourcovidrecovery.nhs.uk/ В браузерах есть функция перевода сайтов на русский язык.
Лайфхак 2: При нарушении концентрации и забывчивости разбивайте повседневные дела на задачи. Выполняйте задачи согласно списку и отмечайте сделанные. Используйте напоминания. После тяжелых задач планируйте легкие задачи.
Вакцинация
Вакцинация – это метод профилактики заболевания, направленный на развитие собственного иммунитета против возбудителя заболевания. Это достигается путём введения в организм частиц, похожих на возбудителя, его токсин, либо ослабленный микроорганизм.
В настоящее время в России доступны следующие вакцины: «Гам-КОВИД-Вак», «Гам-КОВИД-Вак-Лио», «Гам-КОВИД-Вак-М», «ЭпиВакКорона», «ЭпиВакКорона-Н», «КовиВак» и «Спутник Лайт».

Наша медицинская организация не проводит вакцинацию против новой коронавирусной инфекции!
Перед вакцинацией не рекомендуется проведение никаких дополнительных обследований. Если вы себя плохо чувствуете или у вас обострилось хроническое заболевание, отложите вакцинацию до нормализации самочувствия или прекращения обострения.

После того, как медицинская сестра введет вам вакцину, необходимо находиться около прививочного кабинета в течение 30 минут для того, чтобы медицинские работники могли вовремя выявить поствакцинальные реакции и осложнения и, в случае необходимости, оказать экстренную медицинскую помощь.
После вакцинации возможно развитие побочных эффектов. Их наличие или отсутствие не предсказывает эффективность вакцинации или уровень антител. Побочные эффекты, как правило, проходят через 2-3 дня и включают в себя:
- повышение температуры,
- головную боль,
- першение в горле,
- боль и покраснение в месте инъекции,
- озноб,
- сонливость,
- слабость,
- боль в мышцах и суставах,
- увеличение лимфатических узлов,
- тошноту, отсутствие аппетита, диарею.
При выполнении анализов могут выявляться кратковременные изменения: повышение уровня АЛТ, АСТ, креатинина и креатинфосфокиназы в сыворотке крови.
Лайфхак: при появлении повышения температуры примите жаропонижающее средство. При появлении головной боли, боли в мышцах и суставах, примите обезболивающее.
Осложнения развиваются крайне редко. Возможные серьезные побочные проявления после иммунизации:
- Аллергические реакции, в том числе крапивница, отек Квинке, анафилактический шок;
- Миокардит, перикардит;
- Обострение или дебют аутоиммунных заболеваний;
- Энцефалическая реакция (энцефалопатия);
- Синдром Гийена-Барре;
- Судороги/судорожный синдром;
- Острый нефрит;
- Нарушение свёртываемости крови (тромбоз, тромбоэмболия, ДВС-синдром и др.);
- Проявления, потребовавшие экстренной госпитализации по любому поводу, либо закончившиеся летально.

Учету подлежат все побочные проявления после вакцинации. Дальше проводятся исследования для определения, вызван ли данный тип события вакциной. Существуют события, которые совпадают по времени с вакцинацией, но не связаны с ней. Поэтому помните, после – не значит в следствие.
Перед вакцинацией необходимо пройти осмотр врача, который примет решение о допуске вас к вакцинации. Для вашего ознакомления приводим список противопоказаний.
«Гам-КОВИД-Вак» и «Гам-КОВИД-Вак-Лио»
Противопоказания:
- гиперчувствительность к одному из компонентов, входящему в состав вакцины;
- тяжелые аллергические реакции в прошлом (возможна вакцинация в условиях стационара около реанимационного оборудования);
- грудное вскармливание;
- острые заболевания, обострение хронических заболеваний – вакцинацию можно проводить через 2 недели после выздоровления или наступления ремиссии. В случае нетяжелых острых респираторных вирусных инфекций и острых инфекционных заболеваниях желудочно-кишечного тракта – вакцинация возможна сразу после нормализации температуры;
- возраст младше 18 лет;
- для II компонента противопоказанием являются также тяжелые поствакцинальные осложнения, включающие в себя анафилактический шок, тяжелые генерализированные аллергические реакции, судорожный синдром, подъем температуры выше 40°C и т.п. в ответ на введение компонента I вакцины;
- при аутоиммунных заболеваниях и злокачественных новообразованиях перед вакцинацией необходима консультация лечащего врача;
- беременным при наличии высокого риска тяжелого течения COVID-19 вакцинацию проводят после 22 недель беременности;
- для Гам-КОВИД-Вак-Лио дополнительно: возраст старше 60 лет, беременность.
«Гам-КОВИД-Вак-М»
Противопоказания:
- гиперчувствительность к одному из компонентов, входящему в состав вакцины;
- тяжелые аллергические реакции в прошлом;
- острые заболевания, обострение хронических заболеваний – вакцинацию можно проводить через 2 недели после выздоровления или наступления ремиссии. В случае нетяжелых острых респираторных вирусных инфекций и острых инфекционных заболеваниях желудочно-кишечного тракта – вакцинация возможна сразу после нормализации температуры;
- вакцина предназначена для людей возраста 12-17 лет, поэтому противопоказанием является возраст младше 12 лет.
«ЭпиВакКорона» и «ЭпиВакКорона-Н»
Противопоказания:
- гиперчувствительность к одному из компонентов, входящему в состав вакцины, в том числе на гидроксид алюминия;
- тяжелые аллергические реакции в прошлом;
- нежелательная реакция или возникновение поствакцинальных осложнений на предыдущее введение вакцины;
- острые заболевания, обострение хронических заболеваний – вакцинацию можно проводить не ранее, чем через месяц после выздоровления или наступления ремиссии. В случае нетяжелых острых респираторных вирусных инфекций и острых инфекционных заболеваниях желудочно-кишечного тракта – вакцинация возможна сразу после нормализации температуры;
- первичный иммунодефицит;
- злокачественные новообразования и злокачественные заболевания крови;
- беременность;
- грудное вскармливание;
- дети до 18 лет. У «ЭпиВакКорона-Н» — возраст старше 60 лет.
«КовиВак»
Противопоказания:
- возникновение в прошлом в ответ на введение любой вакцины серьезной поствакцинальной реакции: температура выше 40 °С, гиперемия или отек более 8 см в диаметре;
- возникновение в прошлом в ответ на введение любой вакцины серьезного поствакцинального осложнения: коллапс или шокоподобное состояние, возникшие в течение 48 часов после введения вакцины; судороги, вне зависимости от наличия сопровождающего лихорадочного состояния;
- тяжелые аллергические реакции в прошлом: анафилактический шок, отек Квинке, полиморфная экссудативная экзема, гиперчувствительность или аллергические реакции на введение каких-либо вакцин в анамнезе, известные аллергические реакции на компоненты вакцины и др.;
- беременность;
- грудное вскармливание;
- возраст младше 18 лет и возраст старше 60 лет;
- острые заболевания – вакцинацию можно проводить через 2 недели после выздоровления или наступления ремиссии. В случае нетяжелых острых респираторных вирусных инфекций и острых инфекционных заболеваниях желудочно-кишечного тракта – вакцинация возможна сразу после нормализации температуры;
- в случае наличия хронических инфекционных заболеваний вакцинацию проводят в период ремиссии, противопоказано проводить вакцинацию в период обострения.
- при наличии хронических заболеваний возможность вакцинации определяет врач на основании состояния пациента.
«Спутник Лайт»
Противопоказания:
- гиперчувствительность к одному из компонентов, входящему в состав вакцины;
- тяжелые аллергические реакции в прошлом;
- острые заболевания, обострение хронических заболеваний – вакцинацию можно проводить через 2 недели после выздоровления или наступления ремиссии. В случае нетяжелых острых респираторных вирусных инфекций и острых инфекционных заболеваниях желудочно-кишечного тракта — вакцинация возможна сразу после нормализации температуры;
- возраст младше 18 лет.
Коронавирусная инфекция SARS-CoV-2 (COVID-19) – потенциально опасное инфекционное заболевание верхних дыхательных путей, способное приводить к тяжелому воспалению легких.
Острый респираторный дистресс синдром — крайне тяжелое проявление дыхательной недостаточности, сопровождающееся развитием отека легких, нарушением внешнего дыхания и гипоксии. Кроме того, коронавирус провоцирует массовое высвобождение факторов воспаления, так называемый, цитокиновый шторм, который вызывает обширное поражение легких, сердечно-сосудистой, выделительной, нервной и других систем, приводя к полиорганной недостаточности.
Другим осложнением SARS-CoV-2 является синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром).Это состояние характеризуется массовой активацией факторов свертывания крови, приводящей к тромбозу микроциркуляторного русла (и, возможно, крупных сосудов). Затем повышенная свертываемость крови сменяется полной неспособностью крови к свертыванию из-за дефицита израсходованных факторов свертывания, что приводит к множественным кровоизлияниями и кровотечениям.
Причина
Возбудитель заболевания – РНК-содержащий вирус из семейства коронавирусов, которое включает в себя более 40 видов. Коронавирусы вызывают инфекционные болезни у животных, однако 7 представителей семейства также способны передаваться человеку.
У человека вирусы семейства коронавирусов ответственны за 20% случаев сезонных гриппоподобных заболеваний. Однако наряду с COVID-19, имеется как минимум два возбудителя, вызывающих атипичную пневмонию (SARS) — эпидемия 2002 года, и ближневосточный респираторный синдром (MERS) — эпидемия 2012 года. Оба эти заболевания характеризуются высокой смертностью, однако возбудитель SARS-CoV-2, при более низкой летальности, передается намного легче.
Эпидемиология
Основной путь распространения – воздушно-капельный (заражение происходит при вдыхании аэрозоля из мельчайших капель жидкости, образующегося во время кашля, при чихании или при разговоре с больным человеком или вирусоносителем). Коронавирусная инфекция также может передаваться контактным и/или фекально-оральным путем через грязные руки и предметы общего пользования, однако доля заразившихся таким способом не превышает несколько процентов.
Вирус неустойчив во внешней среде и быстро инактивируется обычными дезинфицирующими средствами – раствором гипохлорита, 70% этиловым спиртом и т.д. Солнечный свет и ультрафиолетовое излучение также губительно действуют на возбудителя. В прохладной (около 7оС) и влажной среде вирус может сохранять заразность до 7 дней. При температуре около 56оС возбудитель разрушается уже через 30 минут.
Инкубационный период
Опасность SARS-CoV-2 — в длительном инкубационном периоде (во время которого один больной может заразить десятки людей, не зная о инфекции). Первые симптомы начинают появляться в среднем через 5-6 дней после заражения. По некоторым данным у здоровых людей с крепким иммунитетом инкубационный период может достигать 14 и более дней.
Симптомы
Симптомы и другие характеристики коронавирусной инфекции соответствуют таковым при обычном сезонном гриппе (до 20% случаев ОРВИ и раньше вызывались коронавирусами других видов):
- высокая температура, лихорадка;
- сильные боли в горле;
- боли в мышцах, суставах;
- сухой кашель;
- слизистые выделения из носа;
- головные боли, головокружение, слабость.
Из специфических симптомов необходимо отметить:
- потерю обоняния;
- извращение вкуса;
- высыпания на подошве стоп.
До 70-80% заболевших переносит болезнь в лёгкой форме, с незначительным недомоганием или бессимптомно. У части больных инфекция переходит в нижние отделы дыхательных путей и вызывает воспаление легких. В таком случае пациент может жаловаться на одышку, недостаток воздуха, боли в грудной клетке, непродуктивный (сухой) кашель с небольшим количеством мокроты. Однако симптомов поражения легких может и не быть, вплоть до наступления тяжелой дыхательной недостаточности.
В примерно 5% случаев болезнь протекает в тяжелой форме, с поражением обоих легких и развитием респираторного дистресс синдрома. Характерным признаком патологии является снижение насыщения крови кислородом из-за нарушения дыхательной функции. Состояние является показанием для кислородной терапии. В крайне тяжелых случаях и при отказе легких пациента переводят на искусственную вентиляцию. Последние исследования обнаружили, что помимо поражения легких коронавирусная инфекция способна нарушать способность гемоглобина и эритроцитов переносить кислород, усугубляя гипоксию.
Для коронавирусной инфекции характерны атипичные формы заболевания, протекающие с преимущественным поражением центральной нервной системы в виде энцефалита, почек, желудочно-кишечного тракта, других органов и систем. В таких случаях ведущими симптомами выступают сильная головная боль, спутанность сознания, нарушение функции почек и диарея.
Осложнения коронавирусной инфекции – вторичная бактериальная пневмония, заражение крови, септический шок, нарушение свертывания крови с аномальными кровотечениями (синдром диссеминированного внутрисосудистого свертывания), цитокиновый шторм, полиорганная недостаточность.
Тяжесть болезни зависит от исходного состояния здоровья больного. Здоровые люди с крепким иммунитетом легко переносят коронавирусную инфекцию. При наличии хронических болезней, таких как гипертония, патологии почек и печени, ишемическая болезнь сердца, сердечная недостаточность, астма, сахарный диабет, высок риск развития тяжелой формы SARS-CoV-2, с большим количеством осложнений.
Диагностика
Основные методы диагностики коронавирусной инфекции – полимеразная цепная реакция (ПЦР) и иммуноферментный анализ (ИФА). Материалом для ПЦР исследования служат выделения из носа, носоглотки и полости рта. Забор материала проводится с помощью мазка. ИФА определяет антитела к COVID-19 в сыворотке крови.
Рентгенологическая диагностика коронавирусной инфекции проводится с помощью рентгенографии и/или компьютерной томографии легких, на снимках определяются характерные для COVID-19 изменения (рентгенологический симптом “матового стекла”, указывающий на повреждение альвеол легких).
Лечение
На сегодняшний день отсутствуют лекарственные препараты, обладающие доказанным противовирусным действием на коронавирус Covid-19. Проводится симптоматическое и патогенетическое лечение различными группами препаратов, направленное на облегчение отдельных симптомов болезни и профилактику осложнений.
ПЕРВИЧНАЯ КОНСУЛЬТАЦИЯ
от 7 000 руб
Профилактика
Обязательно следуйте правилам и мерам профилактики дальнейшего распространения СOVID-19. Исследования показали, что регулярное мытье рук с мылом снижает риск заражения коронавирусной инфекцией на 37%. В то же время почти все случаи заражения происходят в результате довольно длительного контакта с больным человеком, происходящем в замкнутом помещении. Чаще всего болеют семьями, заражая своих родных и близких в первую очередь.
Полностью исключить риск заражения невозможно – это касается не только коронавирусной инфекции, а инфекционных болезней в общем. Но, следуя простым правилам, можно обезопасить своих себя и своих родных, снизить скорость распространения вируса и не позволить ему заразить сразу большое количество людей.
Так как тяжесть болезни определяется состоянием иммунной системы, для профилактики и лечения COVID-19 могут использоваться иммуностимуляторы и иммуномодуляторы. Активный образ жизни, правильное питание, позитивное мышление и регулярные физические нагрузки защищают не только от коронавируса, но и от любой другой инфекции.
Наши врачи
Прием ведут:



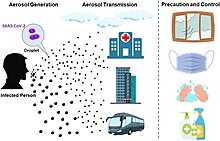







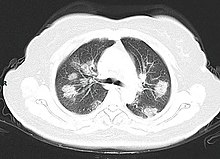








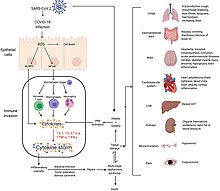


![Total confirmed cases of COVID‑19 per million people[320]](https://upload.wikimedia.org/wikipedia/commons/thumb/7/75/World_map_of_total_confirmed_COVID-19_cases_per_million_people.svg/255px-World_map_of_total_confirmed_COVID-19_cases_per_million_people.svg.png)

![Total confirmed deaths due to COVID‑19 per million people[321]](https://upload.wikimedia.org/wikipedia/commons/thumb/3/3a/World_map_of_total_confirmed_COVID-19_deaths_per_million_people_by_country.svg/255px-World_map_of_total_confirmed_COVID-19_deaths_per_million_people_by_country.svg.png)