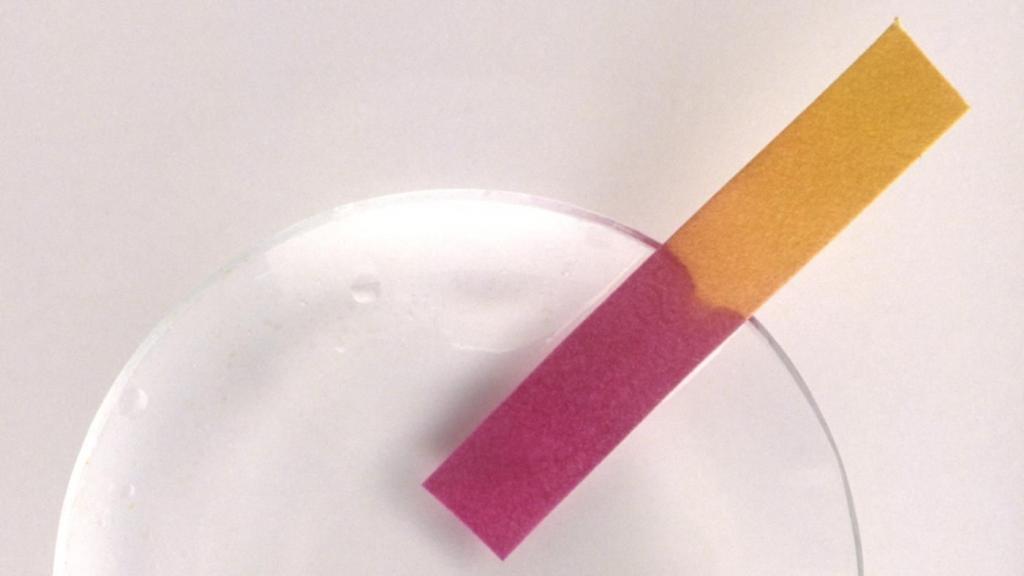Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Лакмус
Брутто-формула:
C12H7NO3
CAS# 1393-92-6
Категории:
Ароматические соединения
, Гетероциклы
, Кислотно-основные индикаторы
ChemSpider ID: 32033479
| CB4105042
4.5
⇌
8.3
pH
Названия
Русский:
- 7-гидроксифеноксазон
- Лакмус [Wiki]
English:
- 1H-Phenoxazin-1-one, 7-hydroxy-(CAS)
- 7-Hydroxy-1H-phenoxazin-1-one(IUPAC)
- 7-hydroxyphenoxazone
- Litmus [Wiki]
Формула:
/`|O|||`/`\`|`\N`/|`/`\<`/HO>`|//|O/
Химический состав
Как обозначается лакмус в химических уравнениях
Истинная, эмпирическая, или брутто-формула: C12H7NO3
Химический состав Лакмуса
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 12 | 67,6% |
| H | Водород | 1,008 | 7 | 3,3% |
| N | Азот | 14,007 | 1 | 6,6% |
| O | Кислород | 15,999 | 3 | 22,5% |
Молекулярная масса: 213,192
Лакмус (от нидерл. lekken жидкий, текучий и нидерл. moes — смесь, паста, каша) — красящее вещество природного происхождения, один из первых и наиболее широко известных кислотно-основных индикаторов. Наименование стандартного химического препарата «лакмусовая бумага» стало нарицательным в русском языке, как в химии для всех типов индикаторных бумаг, так и в повседневной жизни при описании знаковых явлений и событий.
В чистом виде представляет собой тёмный порошок со слабым запахом аммиака. Хорошо растворяется в чистой воде, образуя растворы фиолетового цвета. В кислых средах (pH менее 4,5) лакмус приобретает красную окраску, в щелочных (pH более 8,3) — синюю. У лакмуса, по сравнению с остальными индикаторами, сравнительно небольшая погрешность в определении среды вещества.
Фактически природный лакмус представляет собой сложную смесь 10—15 различных субстанций. Основными компонентами лакмуса считаются:
- азолитмин (англ. Azolitmin, сост. C9H10NO5) — может быть выделен из лакмуса экстракцией и использоваться как самостоятельный кислотно-щелочной индикатор;
- эритролитмин (англ. Erythrolitmin или Orcein Erythrolein, сост. C13H22O6);
Также экстракционным разделением из лакмуса могут быть выделены:
- спанолитмин (англ. Spaniolitmin);
- лейкоорцеин (англ. Leucoorcein);
- лейказолитмин (англ. Leucazolitmin).
Применяется как индикатор для определения реакции среды. На практике используется несколько препаративных форм лакмуса: водный раствор лакмуса, полоски и клочки ленты фильтровальной бумаги, пропитанные лакмусом — т. н. лакмусовая бумага, «лакмусовое молоко» (нем. Lackmusmilch).
Добывается из растительного сырья, в частности из некоторых лишайников: Roccella tinctoria (о-ва Кабо-Верде, Канарские о-ва, Мадейра, Азорские о-ва, западное побережье Южной Америки), Roccella fuciformis (Ангола и Мадагаскар), Roccella pygmaea (Алжир), Roccella phycopsis, Lecanora tartarea (Норвегия, Швеция), Variolaria dealbata (Пиренеи и Аверн), Ochrolechia parella (северо-запад Атлантического побережья Европы), Parmotrema tinctorum (Канарские острова), из различных видов рода Parmelia, Dendrographa leucophoea (США, Калифорния). Основными производителями лакмуса являются Мозамбик (из Roccella montagnei) и США (из Dendrographa leucophoea).
В течение длительного времени производство лакмуса было монополизировано и подробности методов его выделения были неизвестны. Изначально для получения лакмуса применялся следующий способ:
- растительное сырьё измельчают до порошкообразного состояния;
- порошок до 3-х недель вымачивают в содово-аммиачном растворе (сода или поташ + NH4OH) при постоянном перемешивании. Вместо раствора аммиака обычно использовалась моча (как источник ионов (CO3) 2- и NH4) + );
- после того, как в результате вымачивания (экстрагирования) и ферментации цвет смеси меняется с красного на голубой, осадок отделяют;
- после отделения осадка полученный голубой экстракт высушивается и размалывается. В результате образуется порошок смеси лакмусового и орцеинового пигментов;
- после спиртовой экстракции порошка карминово-красный раствор красящих веществ удаляется и остается тёмно-синий лакмус;
- прессовка осадка с гипсом или мелом позволяет получить легко крошащиеся блоки готового сухого лакмуса.
Современный способ получения орцеинового пигмента и лакмуса, запатентованный двумя английскими химиками (G. Gordon и Cuthbert Gordon) в 1758 году, заключался в следующем:
- растительное сырьё измельчают до порошкообразного состояния;
- порошок смешивают с водным раствором-суспензией извести-поташа и карбоната аммония и оставляют для ферментации на воздухе;
- примерно через 3 недели ферментации цвет смеси изменяется с фиолетового или коричневого на насыщенный синий;
- смесь разделяется на сите, выделенный раствор содержит до 90 % орцеина и до 8 % веществ лакмуса в пересчете на сухой остаток.
- далее раствор может использоваться для прессовки блоков из мела или гипса, либо выпариваться для последующей спиртовой экстракции орцеина.
Впервые лакмус был применён в качестве химического реагента и индикатора других веществ около 1300 г. испанским врачом и алхимиком Арнальдусом де Виланова (исп. Arnaldus de Villanova). С XVI-ого века, когда информация о способе получения лакмуса распространилась, голубой лакмус из лишайников Leuconora tartarea и Rocella tinctoria в промышленных количествах начал производиться в Голландии на экспорт под названиями «Bergmoos» и «Klippmoos». В 1704 году этот индикатор получил своё нынешнее название — лакмус. Название Lakmoes, ставшее прародителем современного названия препарата (англ. Litmus, нем. Lackmus, рус. Лакмус), было образовано от индогерманских корней «leg» (капать) и «mus» (каша) и отражало способ получения лакмуса — экстракцию по каплям из измельчённых в кашу лишайников. В 1640 году ботаники описали красящее вещество, которое они получали из душистого растения с тёмно-лиловыми цветками — гелиотропа. Химики вскоре стали использовать этот краситель в качестве индикатора (в растворах кислот он становился красным, а в щелочах синим). Изначально лакмус использовали в основном для исследования минеральных вод, но с 1670-х годов им в полной мере заинтересовались химики. Французский химик Пьер Поме писал: «Как только вношу незначительно малое количество кислоты, он становится красным, поэтому если кто хочет узнать, содержится ли в чём-нибудь кислота, его можно использовать». В связи с тем, что во Франции в широкое употребление у химиков сначала вошёл лакмус, выделенный из гелиотропа, во французском языке прижилось иное название лакмуса: tournesol, что означает «поворачивающийся за солнцем», а на греческом то же самое означает слово «гелиотроп». Позднее весь лакмус стали получать более дешёвым способом — из некоторых видов лишайников.
Для того, чтобы запомнить цвет лакмуса в различных средах, существует стихотворение:
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Существует словосочетание-мнемоника для запоминания индикаторных свойств лакмуса: «лак краски́с» (слышится как «лак раски́с»). Данное словосочетание означает, что «ЛАКмус КРАСный в КИСлоте».
Cреда водных растворов веществ. Индикаторы
Материалы портала onx.distant.ru
Определение характера среды водных растворов веществ. Индикаторы.
Среда водных растворов
Вода и водные растворы окружают нас повсюду. В воде и в водных растворах присутствуют ионы Н + и ОН — . Избыток или недостаток этих ионов определяет среду раствора.
В нейтральном растворе количество ионов водорода Н + равно количеству гидроксид-ионов ОН – .
[ Н + ] = [ ОН – ]
Если количество ионов водорода Н + больше количества гидроксид-ионов ОН – , то среда раствора кислая:
[ Н + ] > [ ОН – ]
Если количество ионов водорода Н + меньше количества гидроксид-ионов ОН – , то среда раствора щелочная:
[ Н + ] ОН – ]
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н + ] > [ОН – ] | [Н + ] = [ОН – ] | [Н + ] – ] |
| pH | pH = 7 | pH > 7 |
Индикаторы
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Растворы кислот и оснований
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H + и анионы кислотных остатков:
HA = H + + A –
При этом в растворе возникает избыток катионов водорода Н + , поэтому среда водных растворов кислот — кислая (что вполне логично).
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН – :
МеОH = Ме + + ОН –
При этом в растворе возникает избыток катионов гидроксид-анионов ОН – , поэтому среда водных растворов оснований — щелочная. Сильные основания (щелочи) хорошо растворимы в воде, поэтому среда их водных растворов — сильно щелочная. Нерастворимые основания в воде практически не растворяются, поэтому в водном растворе оказывается лишь небольшое количество ионов ОН – . Среда водного раствора аммиака слабо щелочная.
Растворы солей
Среда водных растворов солей определяется не только диссоциацией, но и особенностями взаимодействия катионов металлов и анионов кислотных остатков с водой — гидролизом солей .
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4 + ) и анионы кислотных остатков.
Катионы металлов, которым соответствуют слабые основания, притягивают из воды ионы ОН – , при этом в воде образуются избыточные катионы водорода Н + . Протекает гидролиз по катиону. Катионы металлов, которым соответствуют сильные основания, с водой таким образом не взаимодействуют.
Например , катионы Fe 3+ подвергаются гидролизу:
Fe 3+ + HOH ↔ FeOH 2+ + H +
Анионы кислотных остатков, которым соответствуют слабые кислоты, притягивают из воды катионы Н + , при этом в воде остаются гидроксид-анионы ОН – . Протекает гидролиз по аниону. Анионы кислотных остатков сильных кислот таким образом с водой не взаимодействуют.
Например , ацетат-ионы (остаток уксусной кислоты CH3COOH) подвергаются гидролизу:
CH3COO — + HOH ↔ CH3COOH + OH —
В зависимости от состава соли водные растворы солей могут иметь кислую, нейтральную или щелочную среду.
Типы гидролиза солей в водных растворах:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочна я | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO3 2 – | Na2CO3, гидролиз по аниону, среда щелочна я | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO3 2 – | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Что такое лакмус и чем он полезен
Легко объяснить, что такое лакмус — это химическое вещество природного происхождения, с помощью которого определяют кислотно-щелочной уровень воды или раствора. Попадая в кислотную среду, лакмус краснеет, в щелочную — приобретает синий оттенок, в нейтральную — фиолетовый. Это наиболее распространенный индикатор, который применяется в промышленности и может быть полезен в домашних условиях.
Происхождение и получение лакмуса

Вещество добывают промышленным способом из нескольких видов лишайников, произрастающих в Швеции, Норвегии, США, Южной Америке, Анголе, Мадагаскаре, на Канарских и Азорских островах и некоторых других местах. Лакмус и его свойства были открыты примерно в 1300 году. Долгое время добыча материала была монополизирована, способ получения тщательно скрывался. Сначала его добывали следующим методом:
- сырье измельчали;
- вымачивали в содово-аммиачном растворе до 21 суток, постоянно перемешивая массу, в некоторых случаях вместо химических препаратов использовали мочу;
- когда масса из красной превращалась в голубую, осадок фильтровали;
- голубое вещество тщательно просушивали и размалывали в порошок;
- затем препарат подвергали спиртовой экстракции;
- соединяли с гипсом или мелом, прессовали и в результате получали готовые блоки лакмуса, которые легко крошились для дальнейшего использования.
В XVIII веке химики начали применять водный раствор извести и карбоната аммония вместо содово-аммиачного.
Лакмусовая бумага
Индикаторная лакмусовая бумага представляет собой отрезки, пропитанные химическим веществом. Выпускается в виде отдельных полосок или в рулонах. Такой формат является наиболее распространенным.
Использовать лакмусовую бумагу очень легко. Достаточно оторвать одну полоску и погрузить в жидкость, которую необходимо исследовать. Почти сразу же бумага приобретет тот оттенок цвета, который соответствует кислотно-щелочному уровню исследуемого вещества. Вот что такое лакмус в действии.
Сфера применения
Применяется обычно для определения уровня PH в промышленности и в быту. Он используется:
- в химической промышленности для идентификации среды во время проведения исследований;
- в пищевой промышленности для распознавания уровня кислотности напитков и воды для питья;
- в косметологии при изготовлении кремов, тоников и прочих средств по уходу за кожей;
- в сельском хозяйстве для определения состава почвы;
- в медицине для проведения анализов мочи, слюны, прочих жидкостей и выделений;
- для определения кислотно-щелочного уровня воды в бассейнах, котлах отопления.
В повседневной жизни также будет нелишним знать, что такое лакмус и как его использовать. Любители растений, цветоводы и садоводы при помощи лакмусовой бумажки смогут определить уровень pH почвы и самодельных удобрений. Оптимальный кислотно-щелочной уровень почвы составляет 6-6,5 единиц для большинства растений. Если показатели отклоняются от нормы, растения замедляют рост, сбрасывают листву или прекращают цветение без видимых причин.
Аквариумные рыбки также чувствительны к уровню pH воды в аквариуме. Оптимальный баланс, который подходит для большинства разновидностей рыб и растений, составляет 6,3-7 единиц. Если показатели превышают отметку 7, растения могут погибнуть, а если опускаются ниже 6, рыбки могут не выжить.
Как магазинные, так и самодельные косметические средства должны иметь нейтральный уровень pH — примерно 5,5. Чтобы убедиться в этом, достаточно погрузить лакмусовую бумажку в жидкость или суспензию.
При некоторых заболеваниях важно контролировать кислотно-щелочной баланс крови или мочи. Для этого следует регулярно проводить тесты с лакмусовой бумагой в домашних условиях. В этом случае лечащий врач объяснит, что такое лакмус и как часто его следует применять.
Переносное значение слова «лакмус»
Этот химический термин нередко употребляется в переносном смысле. Вот что значит «лакмус»: нечто, что позволяет выяснить состояние какого-либо объекта, явления, события, системы. Например: «лакмусом наших отношений стал его подарок на 8 Марта».
источники:
http://chemege.ru/sreda-rastvorov-indikatory/
http://1ku.ru/obrazovanie/44900-chto-takoe-lakmus-i-chem-on-polezen/
Look up litmus in Wiktionary, the free dictionary.
Chemical structure of 7-hydroxyphenoxazone, the chromophore of litmus components
Litmus is a water-soluble mixture of different dyes extracted from lichens. It is often absorbed onto filter paper to produce one of the oldest forms of pH indicator, used to test materials for acidity. In an acidic medium, blue litmus paper turns red, and red litmus paper turns blue in a basic or alkaline medium.
History[edit]
The word «litmus» comes from an Old Norse word for «pulp».[1] About 1300 the Spanish physician Arnaldus de Villa Nova began using litmus to study acids and bases.[2][3]
From the 16th century onwards, the blue dye was extracted from some lichens, especially in the Netherlands.
Natural sources[edit]
Litmus can be found in different species of lichens. The dyes are extracted from such species as Roccella tinctoria (South American), Roccella fuciformis (Angola and Madagascar), Roccella pygmaea (Algeria), Roccella phycopsis, Lecanora tartarea (Norway, Sweden), Variolaria dealbata, Ochrolechia parella, Parmotrema tinctorum, and Parmelia. Currently, the main sources are Roccella montagnei (Mozambique) and Dendrographa leucophoea (California).[2]
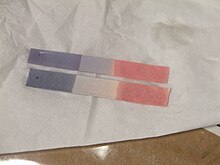
Uses[edit]
Litmus paper after being used
The main use of litmus is to test whether a solution is acidic or basic, as blue litmus paper turns red under acidic conditions, and red litmus paper turns blue under basic or alkaline conditions, with the color change occurring over the pH range 4.5–8.3 at 25 °C (77 °F). Neutral litmus paper is purple.[2] Wet litmus paper can also be used to test for water-soluble gases that affect acidity or basicity; the gas dissolves in the water and the resulting solution colors the litmus paper. For instance, ammonia gas, which is alkaline, turns red litmus paper blue. While all litmus paper acts as pH paper, the opposite is not true.
Litmus can also be prepared as an aqueous solution that functions similarly. Under acidic conditions, the solution is red, and under alkaline conditions, the solution is blue.
Chemical reactions other than acid–base can also cause a color change to litmus paper. For instance, chlorine gas turns blue litmus paper white; the litmus dye is bleached[4] because hypochlorite ions are present. This reaction is irreversible, so the litmus is not acting as an indicator in this situation.
Chemistry[edit]
The litmus mixture has the CAS number 1393-92-6 and contains 10 to around 15 different dyes. All of the chemical components of litmus are likely to be the same as those of the related mixture known as orcein, but in different proportions. In contrast with orcein, the principal constituent of litmus has an average molecular mass of 3300.[5] Acid-base indicators on litmus owe their properties to a 7-hydroxyphenoxazone chromophore.[6] Some fractions of litmus were given specific names including erythrolitmin (or erythrolein), azolitmin, spaniolitmin, leucoorcein, and leucazolitmin. Azolitmin shows nearly the same effect as litmus.[7]
A recipe to make litmus out of the lichens, as outlined on a UC Santa Barbara website says:[8]
Details are difficult to find because the processes were kept secret.
This summary of a modern manufacturing procedure is from The vanishing lichens, D H S Richardson, London, 1975.
The lichens (preferably Lecanora tartarea and Roccella tinctoria) are ground in a solution of sodium carbonate and ammonia.
Stir the lichens from time to time and the color changes from red to purple and finally blue after about four weeks. The lichens are then dried and powdered. At this stage the lichens contain partly litmus and partly orcein pigments. The orcein is removed by extraction with alcohol, leaving the pure blue litmus. It is marketed as blue lumps, masses, or tablets, after mixing with colorless compounds such as chalk and gypsum. Litmus paper is paper impregnated with this substance.
Mechanism[edit]
Red litmus contains a weak diprotic acid. When it is exposed to a basic compound, the hydrogen ions react with the added base. The conjugate base formed from the litmus acid has a blue color, so the wet red litmus paper turns blue in alkaline solution.
References[edit]
- ^ «Litmus». 7 October 2021.
- ^ a b c Neupert, Manfred (January 31, 2013). «Lackmus». Römpp Lexikon Chemie (in German).
- ^
Surber, Christian; Humbert, Philippe; Abels, Christoph; Maibach, Howard (2018). «The Acid Mantle: A Myth or an Essential Part of Skin Health?». In Surber, Christian; Abels, Christoph; Maibach, Howard (eds.). pH of the Skin: Issues and Challenges. Current Problems in Dermatology, ISSN 1421-5721, Volume 54. Basel: Karger Medical and Scientific Publishers. p. 3. ISBN 9783318063851. Retrieved 30 August 2022.In the early 14th century, the Spanish scholar, Arnaldus de Villa Nova (1235–1311), began to use litmus for studying acids and bases. This compound, extracted from a lichen, had been used as a dye since at least the time of the Vikings, but he was the first person known to use it as a test of acidity.
- ^ O’Leary, Donal (2000). «Chlorine». The Chemical Elements. Archived from the original on 2008-12-21.
- ^ Beecken, H.; E-M. Gottschalk; U. v Gizycki; H. Krämer; D. Maassen; H-G. Matthies; H. Musso; C. Rathjen; Ul. Zdhorszky (2003). «Orcein and Litmus». Biotechnic & Histochemistry. 78 (6): 289–302. doi:10.1080/10520290410001671362. PMID 15473576. S2CID 41944320.
- ^ H. Musso, C. Rathjen (1959). «Orcein dyes. X. Light absorption and chromophore of litmus». Chem. Ber. 92 (3): 751–3. doi:10.1002/cber.19590920331.
- ^ E.T. Wolf: Vollständige Übersicht der Elementar-analytischen Untersuchungen organischer Substanzen, S.450-453, veröffentlicht 1846, Verlag E. Anton (Germany)
- ^ «Students ask questions, UCSB scientists answer them». UCSB ScienceLine. 2002.
Look up litmus in Wiktionary, the free dictionary.
Chemical structure of 7-hydroxyphenoxazone, the chromophore of litmus components
Litmus is a water-soluble mixture of different dyes extracted from lichens. It is often absorbed onto filter paper to produce one of the oldest forms of pH indicator, used to test materials for acidity. In an acidic medium, blue litmus paper turns red, and red litmus paper turns blue in a basic or alkaline medium.
History[edit]
The word «litmus» comes from an Old Norse word for «pulp».[1] About 1300 the Spanish physician Arnaldus de Villa Nova began using litmus to study acids and bases.[2][3]
From the 16th century onwards, the blue dye was extracted from some lichens, especially in the Netherlands.
Natural sources[edit]
Litmus can be found in different species of lichens. The dyes are extracted from such species as Roccella tinctoria (South American), Roccella fuciformis (Angola and Madagascar), Roccella pygmaea (Algeria), Roccella phycopsis, Lecanora tartarea (Norway, Sweden), Variolaria dealbata, Ochrolechia parella, Parmotrema tinctorum, and Parmelia. Currently, the main sources are Roccella montagnei (Mozambique) and Dendrographa leucophoea (California).[2]
Uses[edit]
Litmus paper after being used
The main use of litmus is to test whether a solution is acidic or basic, as blue litmus paper turns red under acidic conditions, and red litmus paper turns blue under basic or alkaline conditions, with the color change occurring over the pH range 4.5–8.3 at 25 °C (77 °F). Neutral litmus paper is purple.[2] Wet litmus paper can also be used to test for water-soluble gases that affect acidity or basicity; the gas dissolves in the water and the resulting solution colors the litmus paper. For instance, ammonia gas, which is alkaline, turns red litmus paper blue. While all litmus paper acts as pH paper, the opposite is not true.
Litmus can also be prepared as an aqueous solution that functions similarly. Under acidic conditions, the solution is red, and under alkaline conditions, the solution is blue.
Chemical reactions other than acid–base can also cause a color change to litmus paper. For instance, chlorine gas turns blue litmus paper white; the litmus dye is bleached[4] because hypochlorite ions are present. This reaction is irreversible, so the litmus is not acting as an indicator in this situation.
Chemistry[edit]
The litmus mixture has the CAS number 1393-92-6 and contains 10 to around 15 different dyes. All of the chemical components of litmus are likely to be the same as those of the related mixture known as orcein, but in different proportions. In contrast with orcein, the principal constituent of litmus has an average molecular mass of 3300.[5] Acid-base indicators on litmus owe their properties to a 7-hydroxyphenoxazone chromophore.[6] Some fractions of litmus were given specific names including erythrolitmin (or erythrolein), azolitmin, spaniolitmin, leucoorcein, and leucazolitmin. Azolitmin shows nearly the same effect as litmus.[7]
A recipe to make litmus out of the lichens, as outlined on a UC Santa Barbara website says:[8]
Details are difficult to find because the processes were kept secret.
This summary of a modern manufacturing procedure is from The vanishing lichens, D H S Richardson, London, 1975.
The lichens (preferably Lecanora tartarea and Roccella tinctoria) are ground in a solution of sodium carbonate and ammonia.
Stir the lichens from time to time and the color changes from red to purple and finally blue after about four weeks. The lichens are then dried and powdered. At this stage the lichens contain partly litmus and partly orcein pigments. The orcein is removed by extraction with alcohol, leaving the pure blue litmus. It is marketed as blue lumps, masses, or tablets, after mixing with colorless compounds such as chalk and gypsum. Litmus paper is paper impregnated with this substance.
Mechanism[edit]
Red litmus contains a weak diprotic acid. When it is exposed to a basic compound, the hydrogen ions react with the added base. The conjugate base formed from the litmus acid has a blue color, so the wet red litmus paper turns blue in alkaline solution.
References[edit]
- ^ «Litmus». 7 October 2021.
- ^ a b c Neupert, Manfred (January 31, 2013). «Lackmus». Römpp Lexikon Chemie (in German).
- ^
Surber, Christian; Humbert, Philippe; Abels, Christoph; Maibach, Howard (2018). «The Acid Mantle: A Myth or an Essential Part of Skin Health?». In Surber, Christian; Abels, Christoph; Maibach, Howard (eds.). pH of the Skin: Issues and Challenges. Current Problems in Dermatology, ISSN 1421-5721, Volume 54. Basel: Karger Medical and Scientific Publishers. p. 3. ISBN 9783318063851. Retrieved 30 August 2022.In the early 14th century, the Spanish scholar, Arnaldus de Villa Nova (1235–1311), began to use litmus for studying acids and bases. This compound, extracted from a lichen, had been used as a dye since at least the time of the Vikings, but he was the first person known to use it as a test of acidity.
- ^ O’Leary, Donal (2000). «Chlorine». The Chemical Elements. Archived from the original on 2008-12-21.
- ^ Beecken, H.; E-M. Gottschalk; U. v Gizycki; H. Krämer; D. Maassen; H-G. Matthies; H. Musso; C. Rathjen; Ul. Zdhorszky (2003). «Orcein and Litmus». Biotechnic & Histochemistry. 78 (6): 289–302. doi:10.1080/10520290410001671362. PMID 15473576. S2CID 41944320.
- ^ H. Musso, C. Rathjen (1959). «Orcein dyes. X. Light absorption and chromophore of litmus». Chem. Ber. 92 (3): 751–3. doi:10.1002/cber.19590920331.
- ^ E.T. Wolf: Vollständige Übersicht der Elementar-analytischen Untersuchungen organischer Substanzen, S.450-453, veröffentlicht 1846, Verlag E. Anton (Germany)
- ^ «Students ask questions, UCSB scientists answer them». UCSB ScienceLine. 2002.
А Б В Г Д Е Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
ла́кмус, -а
Рядом по алфавиту:
лаке́йствовать , -твую, -твует
ла́ки , -ов, ед. лак, -а (народность)
лакирова́льный
лакирова́льщик , -а
лакирова́льщица , -ы, тв. -ей
лакирова́ние , -я
лакиро́ванный , кр. ф. -ан, -ана
лакирова́ть(ся) , -ру́ю, -ру́ет(ся)
лакиро́вка , -и
лакиро́вки , -вок, ед. -вка, -и (обувь)
лакиро́вочный
лакиро́вщик , -а
лакиро́вщица , -ы, тв. -ей
лакколи́т , -а
лакколи́товый
ла́кмус , -а
ла́кмусовый
лакну́ть , -ну́, -нёт
ла́ково-чёрный
ла́ковый
лакокра́ски , -сок
лакокра́сочный
ла́комить(ся) , -млю(сь), -мит(ся)
ла́комка , -и, р. мн. -мок, м. и ж.
ла́комство , -а
ла́комый
ла́комящий(ся)
лаконаливно́й
лакони́зм , -а
лакони́ческий
лакони́чность , -и
Морфологические и синтаксические свойства[править]
ла́к—мус
Существительное, неодушевлённое, мужской род, 2-е склонение (тип склонения 1a по классификации А. А. Зализняка).
Корень: -лакмус- [Тихонов, 1996].
Произношение[править]
- МФА: [ˈɫakmʊs]
Семантические свойства[править]
Значение[править]
- хим. красящее вещество природного происхождения, представляющее собой смесь различных органических соединений и используемое в качестве кислотно-основного индикатора ◆ Отсутствует пример употребления (см. рекомендации).
- разг. лакмусовая бумага ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
- индикатор, вещество
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Перевод[править]
Анаграммы[править]
- мускал
Библиография[править]
- Словарь новых слов русского языка (середина 50-х — середина 80-х годов) / Под ред. Н. З. Котеловой. — СПб. : Дмитрий Буланин, 1995. — ISBN 5-86007-016-0.
Морфологические и синтаксические свойства[править]
лакмус
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное, неодушевлённое, мужской род.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное, мужской род.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное, мужской род.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное, мужской род.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное, неодушевлённое, мужской род.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
Морфологические и синтаксические свойства[править]
лакмус
Существительное.
Корень: —.
Произношение[править]
Семантические свойства[править]
Значение[править]
- хим. лакмус ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
Этимология[править]
От нидерл. lakmoes «лакмус», из lak «лак» + moes «пюре».
Фразеологизмы и устойчивые сочетания[править]
Библиография[править]
— добывается из лишаев Rocella tinctoria, Lecanora tartarea и проч., из которых готовится также орсин и орсеин. Под влиянием кислорода воздуха и аммиака красящее вещество этих растений дает орсеин, в присутствии же соды или поташа при этих условиях получаются красящие вещества Л. Для приготовления Л., по Жели, поступают следующим образом. Измельченные растения смешивают с половинным (по весу) количеством поташа и смачивают несколько раз мочой, насыщенной углекислым аммонием, или водным раствором этой соли. Через 3 дня масса принимает рыжий оттенок, через 20—25 дней она становится ярко-красной, а через 30 — синей; лучшего качества Л. получается через 40 дней. Массу после этого смешивают с мелом и гипсом, формуют в небольшие кубики и высушивают, так что в продажном Л., кроме собственно красящих веществ, всегда встречаются аммиачные соли, поташ, мел, гипс, известь и пр. При действии на орсин влажного воздуха, в присутствии аммиака и соды, тоже получается Л. Что касается очистки Л., см. Индикаторы. Наиболее полное исследование лакмуса сделано Кеном (Каnе). Он выделил из Л., главным образом, четыре вещества: азолитмин, эритролитмин, эритролеин и спамолитмин. Азолитмин представляет бурый порошок, не растворимый в спирте и мало растворимый в воде; легко растворяется в щелочах и дает синее окрашивание. По Кену, состав его C 9H10NO5; другие красящие вещества Л. не содержат азота. Жерар предполагает, что он образуется непосредственно при действии аммиака и воздуха на орсин или при окислении орсеина. По Жерару, этот окислительный процессе идет скорее и легче в присутствии углекислых щелочей, что и объясняет необходимость поташа при фабричном изготовлении Л., именно образующийся в первую фазу орсеин при действии аммиака и кислорода на растительный пигмент лишаев в дальнейшем дает азолитмин. Эритролитмин — вещество красного цвета, плохо растворимое в воде и эфире и хорошо растворимое в спирте, из которого может быть кристаллизовано. С аммиаком дает соединение синего цвета, нерастворимое в воде. Эритролитмин растворим в крепких, щелочах с синим цветом. Состав его, до Кену, С 13 Н 22 О 6, и он есть продукт окисления эритролеиновой кислоты. Эритролеин не растворим в воде, растворяется в эфире и спирте с красным цветом, со щелочами дает красное окрашивание. Состав его С 13 Н 22 О 2. Спаниолитмин схож с азолитмином. Состав С 9 Н 7O8. Сернистый водород в момент выделения, хлористое олово и пр. восстанавливают эти вещества и обесцвечивают. Азолитмин, напр., дает бесцветное вещество лейказолитмин; на воздухе оно быстро окисляется и вновь приобретает окраску. Азолитмин и эритролитмин, взболтанные в воде, при пропускании хлора обесцвечиваются и дают хлоропроизводные. По Кену, наиболее существенной составной частью Л. (как индикатора) являются азолитмин и эритролитмин, спаниолитмин встречается редко, а эритролеин со щелочами дает красное окрашивание. О лакмусовой бумаге — см. Индикаторы.
С. Я. Вуколов. Δ.
Значение слова «лакмус»

-
ЛА́КМУС, -а, м.
1. Красящее вещество, добываемое из морских лишайников, меняющее цвет пропитанной им бумаги под действием кислот на красный, под действием щелочей — на синий.
2. То же, что
лакмусовая бумага
(см. лакмусовый).[Голл. lakmoes]
Источник (печатная версия): Словарь русского языка: В 4-х
т. / РАН,
Ин-т лингвистич.
исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.;
Полиграфресурсы,
1999;
(электронная версия): Фундаментальная
электронная
библиотека
-
Лакмус (от нидерл. lekken жидкий, текучий и нидерл. moes — смесь, паста, каша) — красящее вещество природного происхождения, один из первых и наиболее широко известных кислотно-основных индикаторов.
Наименование стандартного химического препарата «лакмусовая бумага» стало нарицательным в русском языке, как в химии для всех типов индикаторных бумаг, так и в повседневной жизни при описании знаковых явлений и событий.
Источник: Википедия
-
ЛА’КМУС, а, м. [от латин. lacca musci] — нарост на мхе] (хим.). Сине-лиловая краска,
служащая для изготовления лакмусовой бумаги.
|| То же, что лакмусовая бумага.
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940);
(электронная версия): Фундаментальная
электронная
библиотека
-
ла́кмус
1. хим. красящее вещество природного происхождения, представляющее собой смесь различных органических соединений и используемое в качестве кислотно-основного индикатора
2. разг. лакмусовая бумага
Источник: Викисловарь
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: заливный — это что-то нейтральное, положительное или отрицательное?
Ассоциации к слову «лакмус»
Синонимы к слову «лакмус»
Предложения со словом «лакмус»
- Вы говорите, что в первом стакане у меня был щелочной раствор лакмуса, в другом – такой же раствор метилоранжа, а в третьем, куда я слил содержимое двух первых, – хлорная вода.
- Если вам не скучно посидеть несколько минут без дела, могу на ваших глазах отварить несколько листьев красной капусты в кипящей воде, чтобы извлечь из них сок, содержащий органическую краску, напоминающую по своим свойствам лакмус.
- Данная книга – авантюра, которая направлена на придание определённого смысла идеям и решениям, стать лакмусом намерений и действий!
- (все предложения)
Понятия со словом «лакмус»
-
Лакмус (от нидерл. lekken жидкий, текучий и нидерл. moes — смесь, паста, каша) — красящее вещество природного происхождения, один из первых и наиболее широко известных кислотно-основных индикаторов.
- (все понятия)
Отправить комментарий
Дополнительно
Смотрите также
-
Вы говорите, что в первом стакане у меня был щелочной раствор лакмуса, в другом – такой же раствор метилоранжа, а в третьем, куда я слил содержимое двух первых, – хлорная вода.
-
Если вам не скучно посидеть несколько минут без дела, могу на ваших глазах отварить несколько листьев красной капусты в кипящей воде, чтобы извлечь из них сок, содержащий органическую краску, напоминающую по своим свойствам лакмус.
-
Данная книга – авантюра, которая направлена на придание определённого смысла идеям и решениям, стать лакмусом намерений и действий!
- (все предложения)
- фенолфталеин
- сапонин
- гипосульфит
- марганцовка
- квасцы
- (ещё синонимы…)
- опыты
- реагенты
- химия
- реакция
- лаборатория
- (ещё ассоциации…)
- Склонение
существительного «лакмус» - Разбор по составу слова «лакмус»
- Как правильно пишется слово «лакмус»