Lithium floating in oil |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lithium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (LITH-ee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery-white | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Li) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lithium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 1: hydrogen and alkali metals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [He] 2s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 453.65 K (180.50 °C, 356.90 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 1603 K (1330 °C, 2426 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 0.534 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 0.512 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 3220 K, 67 MPa (extrapolated) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 3.00 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 136 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.860 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0[2], +1 (a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 0.98 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 128±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 182 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of lithium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered cubic (bcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 6000 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 46 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 84.8 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 92.8 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +14.2×10−6 cm3/mol (298 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 4.9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 4.2 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 11 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 0.6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 5 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-93-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Johan August Arfwedson (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | William Thomas Brande (1821) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of lithium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Lithium (from Greek: λίθος, romanized: lithos, lit. ‘stone’) is a chemical element with the symbol Li and atomic number 3. It is a soft, silvery-white alkali metal. Under standard conditions, it is the least dense metal and the least dense solid element. Like all alkali metals, lithium is highly reactive and flammable, and must be stored in vacuum, inert atmosphere, or inert liquid such as purified kerosene or mineral oil. When cut, it exhibits a metallic luster, but moist air corrodes it quickly to a dull silvery gray, then black tarnish. It never occurs freely in nature, but only in (usually ionic) compounds, such as pegmatitic minerals, which were once the main source of lithium. Due to its solubility as an ion, it is present in ocean water and is commonly obtained from brines. Lithium metal is isolated electrolytically from a mixture of lithium chloride and potassium chloride.
The nucleus of the lithium atom verges on instability, since the two stable lithium isotopes found in nature have among the lowest binding energies per nucleon of all stable nuclides. Because of its relative nuclear instability, lithium is less common in the solar system than 25 of the first 32 chemical elements even though its nuclei are very light: it is an exception to the trend that heavier nuclei are less common.[4] For related reasons, lithium has important uses in nuclear physics. The transmutation of lithium atoms to helium in 1932 was the first fully man-made nuclear reaction, and lithium deuteride serves as a fusion fuel in staged thermonuclear weapons.[5]
Lithium and its compounds have several industrial applications, including heat-resistant glass and ceramics, lithium grease lubricants, flux additives for iron, steel and aluminium production, lithium metal batteries, and lithium-ion batteries. These uses consume more than three-quarters of lithium production.
Lithium is present in biological systems in trace amounts; its functions are uncertain. Lithium salts have proven to be useful as a mood stabilizer and antidepressant in the treatment of mental illness such as bipolar disorder.
Properties
Atomic and physical
Lithium ingots with a thin layer of black nitride tarnish
The alkali metals are also called the lithium family, after its leading element. Like the other alkali metals (which are sodium (Na), potassium (K), rubidium (Rb), caesium (Cs), and francium (Fr)), lithium has a single valence electron that is easily given up to form a cation.[6] Because of this, lithium is a good conductor of heat and electricity as well as a highly reactive element, though it is the least reactive of the alkali metals. Lithium’s low reactivity is due to the proximity of its valence electron to its nucleus (the remaining two electrons are in the 1s orbital, much lower in energy, and do not participate in chemical bonds).[6] Molten lithium is significantly more reactive than its solid form.[7][8]
Lithium metal is soft enough to be cut with a knife. When cut, it possesses a silvery-white color that quickly changes to gray as it oxidizes to lithium oxide.[6] Its melting point of 180.50 °C (453.65 K; 356.90 °F)[9] and its boiling point of 1,342 °C (1,615 K; 2,448 °F)[9] are each the highest of all the alkali metals while its density of 0.534 g/cm3 is the lowest.
Lithium has a very low density (0.534 g/cm3), comparable with pine wood.[10] It is the least dense of all elements that are solids at room temperature; the next lightest solid element (potassium, at 0.862 g/cm3) is more than 60% denser. Apart from helium and hydrogen, as a solid it is less dense than any other element as a liquid, being only two-thirds as dense as liquid nitrogen (0.808 g/cm3).[11] Lithium can float on the lightest hydrocarbon oils and is one of only three metals that can float on water, the other two being sodium and potassium.
Lithium’s coefficient of thermal expansion is twice that of aluminium and almost four times that of iron.[12] Lithium is superconductive below 400 μK at standard pressure[13] and at higher temperatures (more than 9 K) at very high pressures (>20 GPa).[14] At temperatures below 70 K, lithium, like sodium, undergoes diffusionless phase change transformations. At 4.2 K it has a rhombohedral crystal system (with a nine-layer repeat spacing); at higher temperatures it transforms to face-centered cubic and then body-centered cubic. At liquid-helium temperatures (4 K) the rhombohedral structure is prevalent.[15] Multiple allotropic forms have been identified for lithium at high pressures.[16]
Lithium has a mass specific heat capacity of 3.58 kilojoules per kilogram-kelvin, the highest of all solids.[17][18] Because of this, lithium metal is often used in coolants for heat transfer applications.[17]
Isotopes
Naturally occurring lithium is composed of two stable isotopes, 6Li and 7Li, the latter being the more abundant (92.5% natural abundance).[6][19][20] Both natural isotopes have anomalously low nuclear binding energy per nucleon (compared to the neighboring elements on the periodic table, helium and beryllium); lithium is the only low numbered element that can produce net energy through nuclear fission. The two lithium nuclei have lower binding energies per nucleon than any other stable nuclides other than hydrogen-1, deuterium and helium-3.[21] As a result of this, though very light in atomic weight, lithium is less common in the Solar System than 25 of the first 32 chemical elements.[4] Seven radioisotopes have been characterized, the most stable being 8Li with a half-life of 838 ms and 9Li with a half-life of 178 ms. All of the remaining radioactive isotopes have half-lives that are shorter than 8.6 ms. The shortest-lived isotope of lithium is 4Li, which decays through proton emission and has a half-life of 7.6 × 10−23 s.[22] The 6Li isotope is one of only five stable nuclides to have both an odd number of protons and an odd number of neutrons, the other four stable odd-odd nuclides being hydrogen-2, boron-10, nitrogen-14, and tantalum-180m.[23]
7Li is one of the primordial elements (or, more properly, primordial nuclides) produced in Big Bang nucleosynthesis. A small amount of both 6Li and 7Li are produced in stars during stellar nucleosynthesis, but it is further «burned» as fast as produced.[24] 7Li can also be generated in carbon stars.[25] Additional small amounts of both 6Li and 7Li may be generated from solar wind, cosmic rays hitting heavier atoms, and from early solar system 7Be and 10Be radioactive decay.[26]
Lithium isotopes fractionate substantially during a wide variety of natural processes,[27] including mineral formation (chemical precipitation), metabolism, and ion exchange. Lithium ions substitute for magnesium and iron in octahedral sites in clay minerals, where 6Li is preferred to 7Li, resulting in enrichment of the light isotope in processes of hyperfiltration and rock alteration. The exotic 11Li is known to exhibit a neutron halo, with 2 neutrons orbiting around its nucleus of 3 protons and 6 neutrons. The process known as laser isotope separation can be used to separate lithium isotopes, in particular 7Li from 6Li.[28]
Nuclear weapons manufacture and other nuclear physics applications are a major source of artificial lithium fractionation, with the light isotope 6Li being retained by industry and military stockpiles to such an extent that it has caused slight but measurable change in the 6Li to 7Li ratios in natural sources, such as rivers. This has led to unusual uncertainty in the standardized atomic weight of lithium, since this quantity depends on the natural abundance ratios of these naturally-occurring stable lithium isotopes, as they are available in commercial lithium mineral sources.[29]
Both stable isotopes of lithium can be laser cooled and were used to produce the first quantum degenerate Bose-Fermi mixture.[30]
Occurrence
Lithium is about as common as chlorine in the Earth’s upper continental crust, on a per-atom basis.
Astronomical
Although it was synthesized in the Big Bang, lithium (together with beryllium and boron) is markedly less abundant in the universe than other elements. This is a result of the comparatively low stellar temperatures necessary to destroy lithium, along with a lack of common processes to produce it.[31]
According to modern cosmological theory, lithium—in both stable isotopes (lithium-6 and lithium-7)—was one of the three elements synthesized in the Big Bang.[32] Though the amount of lithium generated in Big Bang nucleosynthesis is dependent upon the number of photons per baryon, for accepted values the lithium abundance can be calculated, and there is a «cosmological lithium discrepancy» in the universe: older stars seem to have less lithium than they should, and some younger stars have much more.[33] The lack of lithium in older stars is apparently caused by the «mixing» of lithium into the interior of stars, where it is destroyed,[34] while lithium is produced in younger stars. Although it transmutes into two atoms of helium due to collision with a proton at temperatures above 2.4 million degrees Celsius (most stars easily attain this temperature in their interiors), lithium is more abundant than computations would predict in later-generation stars.[19]
Lithium is also found in brown dwarf substellar objects and certain anomalous orange stars. Because lithium is present in cooler, less-massive brown dwarfs, but is destroyed in hotter red dwarf stars, its presence in the stars’ spectra can be used in the «lithium test» to differentiate the two, as both are smaller than the Sun.[19][36][37] Certain orange stars can also contain a high concentration of lithium. Those orange stars found to have a higher than usual concentration of lithium (such as Centaurus X-4) orbit massive objects—neutron stars or black holes—whose gravity evidently pulls heavier lithium to the surface of a hydrogen-helium star, causing more lithium to be observed.[19]
On 27 May 2020, astronomers reported that classical nova explosions are galactic producers of lithium-7.[38][39]
Terrestrial
Although lithium is widely distributed on Earth, it does not naturally occur in elemental form due to its high reactivity.[6] The total lithium content of seawater is very large and is estimated as 230 billion tonnes, where the element exists at a relatively constant concentration of 0.14 to 0.25 parts per million (ppm),[40][41] or 25 micromolar;[42] higher concentrations approaching 7 ppm are found near hydrothermal vents.[41]
Estimates for the Earth’s crustal content range from 20 to 70 ppm by weight.[43] Lithium constitutes about 0.002 percent of Earth’s crust.[44] In keeping with its name, lithium forms a minor part of igneous rocks, with the largest concentrations in granites. Granitic pegmatites also provide the greatest abundance of lithium-containing minerals, with spodumene and petalite being the most commercially viable sources.[43] Another significant mineral of lithium is lepidolite which is now an obsolete name for a series formed by polylithionite and trilithionite.[45][46] A newer source for lithium is hectorite clay, the only active development of which is through the Western Lithium Corporation in the United States.[47] At 20 mg lithium per kg of Earth’s crust,[48] lithium is the 25th most abundant element.
According to the Handbook of Lithium and Natural Calcium, «Lithium is a comparatively rare element, although it is found in many rocks and some brines, but always in very low concentrations. There are a fairly large number of both lithium mineral and brine deposits but only comparatively few of them are of actual or potential commercial value. Many are very small, others are too low in grade.»[49]
Chile is estimated (2020) to have the largest reserves by far (9.2 million tonnes),[50] and Australia the highest annual production (40,000 tonnes).[50] One of the largest reserve bases[note 1] of lithium is in the Salar de Uyuni area of Bolivia, which has 5.4 million tonnes. Other major suppliers include Australia, Argentina and China.[51][52] As of 2015, the Czech Geological Survey considered the entire Ore Mountains in the Czech Republic as lithium province. Five deposits are registered, one near Cínovec [cs] is considered as a potentially economical deposit, with 160 000 tonnes of lithium.[53] In December 2019, Finnish mining company Keliber Oy reported its Rapasaari lithium deposit has estimated proven and probable ore reserves of 5.280 million tonnes.[54]
In June 2010, The New York Times reported that American geologists were conducting ground surveys on dry salt lakes in western Afghanistan believing that large deposits of lithium are located there.[55] These estimates are «based principally on old data, which was gathered mainly by the Soviets during their occupation of Afghanistan from 1979–1989».[56] The Department of Defense estimated the lithium reserves in Afghanistan to amount to the ones in Bolivia and dubbed it as a potential «Saudi-Arabia of lithium».[57] In Cornwall, England, the presence of brine rich in lithium was well known due to the region’s historic mining industry, and private investors have conducted tests to investigate potential lithium extraction in this area.[58][59]
Biological
Lithium is found in trace amount in numerous plants, plankton, and invertebrates, at concentrations of 69 to 5,760 parts per billion (ppb). In vertebrates the concentration is slightly lower, and nearly all vertebrate tissue and body fluids contain lithium ranging from 21 to 763 ppb.[41] Marine organisms tend to bioaccumulate lithium more than terrestrial organisms.[60] Whether lithium has a physiological role in any of these organisms is unknown.[41]
Studies of lithium concentrations in mineral-rich soil give ranges between around 0.1 and 50−100 ppm, with some concentrations as high as 100−400 ppm, although it is unlikely that all of it is available for uptake by plants.[61] Lithium concentration in plant tissue is typically around 1 ppm, with some plant families bioaccumulating more lithium than others; lithium accumulation does not appear to affect the essential nutrient composition of plants.[61] Tolerance to lithium varies by plant species and typically parallels sodium tolerance; maize and Rhodes grass, for example, are highly tolerant to lithium injury while avocado and soybean are very sensitive.[61] Similarly, lithium at concentrations of 5 ppm reduces seed germination in some species (e.g. Asian rice and chickpea) but not in others (e.g. barley and wheat).[61]
Many of lithium’s major biological effects can be explained by its competition with other ions.[62]
The monovalent lithium ion Li+
competes with other ions such as sodium (immediately below lithium on the periodic table), which like lithium is also a monovalent alkali metal.
Lithium also competes with bivalent magnesium ions, whose ionic radius (86 pm) is approximately that of the lithium ion[62] (90 pm).
Mechanisms that transport sodium across cellular membranes also transport lithium.
For instance, sodium channels (both voltage-gated and epithelial) are particularly major pathways of entry for lithium.[62]
Lithium ions can also permeate through ligand-gated ion channels as well as cross both nuclear and mitochondrial membranes.[62]
Like sodium, lithium can enter and partially block (although not permeate) potassium channels and calcium channels.[62]
The biological effects of lithium are many and varied but its mechanisms of action are only partially understood.[63]
For instance, studies of lithium-treated patients with bipolar disorder show that, among many other effects, lithium partially reverses telomere shortening in these patients and also increases mitochondrial function, although how lithium produces these pharmacological effects is not understood.[63][64]
Even the exact mechanisms involved in lithium toxicity are not fully understood.
History
Johan August Arfwedson is credited with the discovery of lithium in 1817
Petalite (LiAlSi4O10) was discovered in 1800 by the Brazilian chemist and statesman José Bonifácio de Andrada e Silva in a mine on the island of Utö, Sweden.[65][66][67][68] However, it was not until 1817 that Johan August Arfwedson, then working in the laboratory of the chemist Jöns Jakob Berzelius, detected the presence of a new element while analyzing petalite ore.[69][70][71][72] This element formed compounds similar to those of sodium and potassium, though its carbonate and hydroxide were less soluble in water and less alkaline.[73] Berzelius gave the alkaline material the name «lithion/lithina«, from the Greek word λιθoς (transliterated as lithos, meaning «stone»), to reflect its discovery in a solid mineral, as opposed to potassium, which had been discovered in plant ashes, and sodium, which was known partly for its high abundance in animal blood. He named the metal inside the material «lithium».[6][67][72]
Arfwedson later showed that this same element was present in the minerals spodumene and lepidolite.[74][67] In 1818, Christian Gmelin was the first to observe that lithium salts give a bright red color to flame.[67][75] However, both Arfwedson and Gmelin tried and failed to isolate the pure element from its salts.[67][72][76] It was not isolated until 1821, when William Thomas Brande obtained it by electrolysis of lithium oxide, a process that had previously been employed by the chemist Sir Humphry Davy to isolate the alkali metals potassium and sodium.[19][76][77][78][79] Brande also described some pure salts of lithium, such as the chloride, and, estimating that lithia (lithium oxide) contained about 55% metal, estimated the atomic weight of lithium to be around 9.8 g/mol (modern value ~6.94 g/mol).[80] In 1855, larger quantities of lithium were produced through the electrolysis of lithium chloride by Robert Bunsen and Augustus Matthiessen.[67][81] The discovery of this procedure led to commercial production of lithium in 1923 by the German company Metallgesellschaft AG, which performed an electrolysis of a liquid mixture of lithium chloride and potassium chloride.[67][82][83]
Australian psychiatrist John Cade is credited with reintroducing and popularizing the use of lithium to treat mania in 1949.[84] Shortly after, throughout the mid 20th century, lithium’s mood stabilizing applicability for mania and depression took off in Europe and the United States.
The production and use of lithium underwent several drastic changes in history. The first major application of lithium was in high-temperature lithium greases for aircraft engines and similar applications in World War II and shortly after. This use was supported by the fact that lithium-based soaps have a higher melting point than other alkali soaps, and are less corrosive than calcium based soaps. The small demand for lithium soaps and lubricating greases was supported by several small mining operations, mostly in the US.
The demand for lithium increased dramatically during the Cold War with the production of nuclear fusion weapons. Both lithium-6 and lithium-7 produce tritium when irradiated by neutrons, and are thus useful for the production of tritium by itself, as well as a form of solid fusion fuel used inside hydrogen bombs in the form of lithium deuteride. The US became the prime producer of lithium between the late 1950s and the mid-1980s. At the end, the stockpile of lithium was roughly 42,000 tonnes of lithium hydroxide. The stockpiled lithium was depleted in lithium-6 by 75%, which was enough to affect the measured atomic weight of lithium in many standardized chemicals, and even the atomic weight of lithium in some «natural sources» of lithium ion which had been «contaminated» by lithium salts discharged from isotope separation facilities, which had found its way into ground water.[29][85]
Lithium is used to decrease the melting temperature of glass and to improve the melting behavior of aluminium oxide in the Hall-Héroult process.[86][87] These two uses dominated the market until the middle of the 1990s. After the end of the nuclear arms race, the demand for lithium decreased and the sale of department of energy stockpiles on the open market further reduced prices.[85] In the mid-1990s, several companies started to isolate lithium from brine which proved to be a less expensive option than underground or open-pit mining. Most of the mines closed or shifted their focus to other materials because only the ore from zoned pegmatites could be mined for a competitive price. For example, the US mines near Kings Mountain, North Carolina closed before the beginning of the 21st century.
The development of lithium ion batteries increased the demand for lithium and became the dominant use in 2007.[88] With the surge of lithium demand in batteries in the 2000s, new companies have expanded brine isolation efforts to meet the rising demand.[89][90]
It has been argued that lithium will be one of the main objects of geopolitical competition in a world running on renewable energy and dependent on batteries, but this perspective has also been criticised for underestimating the power of economic incentives for expanded production.[91]
Chemistry
«Lithium salt» redirects here. For Lithium salts used in medication, see Lithium (medication).
Of lithium metal
Lithium reacts with water easily, but with noticeably less vigor than other alkali metals. The reaction forms hydrogen gas and lithium hydroxide.[6] When placed over a flame, lithium compounds give off a striking crimson color, but when the metal burns strongly, the flame becomes a brilliant silver. Lithium will ignite and burn in oxygen when exposed to water or water vapor. In moist air, lithium rapidly tarnishes to form a black coating of lithium hydroxide (LiOH and LiOH·H2O), lithium nitride (Li3N) and lithium carbonate (Li2CO3, the result of a secondary reaction between LiOH and CO2).[43] Lithium is one of the few metals that react with nitrogen gas.[92][93]
Because of its reactivity with water, and especially nitrogen, lithium metal is usually stored in a hydrocarbon sealant, often petroleum jelly. Although the heavier alkali metals can be stored under mineral oil, lithium is not dense enough to fully submerge itself in these liquids.[19]
Lithium has a diagonal relationship with magnesium, an element of similar atomic and ionic radius. Chemical resemblances between the two metals include the formation of a nitride by reaction with N2, the formation of an oxide (Li
2O) and peroxide (Li
2O
2) when burnt in O2, salts with similar solubilities, and thermal instability of the carbonates and nitrides.[43][94] The metal reacts with hydrogen gas at high temperatures to produce lithium hydride (LiH).[95]
Lithium forms a variety of binary and ternary materials by direct reaction with the main group elements. These Zintl phases, although highly covalent, can be viewed as salts of polyatomic anions such as Si44-, P73-, and Te52-. With graphite, lithium forms a variety of intercalation compounds.[94]
It dissolves in ammonia (and amines) to give [Li(NH3)4]+ and the solvated electron.[94]
Inorganic compounds
Lithium forms salt-like derivatives with all halides and pseudohalides. Some examples include the halides LiF, LiCl, LiBr, LiI, as well as the pseudohalides and related anions. Lithium carbonate has been described as the most important compound of lithium.[94] This white solid is the principal product of beneficiation of lithium ores. It is a precursor to other salts including ceramics and materials for lithium batteries.
The compounds LiBH
4 and LiAlH
4 are useful reagents. These salts and many other lithium salts exhibit distinctively high solubility in ethers, in contrast with salts of heavier alkali metals.
In aqueous solution, the coordination complex [Li(H2O)4]+ predominates for many lithium salts. Related complexes are known with amines and ethers.
Organic chemistry
Organolithium compounds are numerous and useful. They are defined by the presence of a bond between carbon and lithium. They serve as metal-stabilized carbanions, although their solution and solid-state structures are more complex than this simplistic view.[96] Thus, these are extremely powerful bases and nucleophiles. They have also been applied in asymmetric synthesis in the pharmaceutical industry. For laboratory organic synthesis, many organolithium reagents are commercially available in solution form. These reagents are highly reactive, and are sometimes pyrophoric.
Like its inorganic compounds, almost all organic compounds of lithium formally follow the duet rule (e.g., BuLi, MeLi). However, it is important to note that in the absence of coordinating solvents or ligands, organolithium compounds form dimeric, tetrameric, and hexameric clusters (e.g., BuLi is actually [BuLi]6 and MeLi is actually [MeLi]4) which feature multi-center bonding and increase the coordination number around lithium. These clusters are broken down into smaller or monomeric units in the presence of solvents like dimethoxyethane (DME) or ligands like tetramethylethylenediamine (TMEDA).[97] As an exception to the duet rule, a two-coordinate lithate complex with four electrons around lithium, [Li(thf)4]+[((Me3Si)3C)2Li]–, has been characterized crystallographically.[98]
Production
| Country | Production | Reserves[note 1] | Resources |
|---|---|---|---|
| Argentina | 6,200 | 1,900,000 | 19,300,000 |
| Australia | 40,000 | 4,700,000 | 6,400,000 |
| Austria | — | — | 50,000 |
| Bolivia | — | — | 21,000,000 |
| Brazil | 1,900 | 95,000 | 470,000 |
| Canada | 0 | 530,000 | 2,900,000 |
| Chile | 18,000 | 9,200,000 | 9,600,000 |
| China | 14,000 | 1,500,000 | 5,100,000 |
| Czech Republic | — | — | 1,300,000 |
| DR Congo | — | — | 3,000,000 |
| Finland | — | — | 50,000 |
| Germany | — | — | 2,700,000 |
| Ghana | — | — | 90,000 |
| Kazakhstan | — | — | 50,000 |
| Mali | — | — | 700,000 |
| Mexico | — | — | 1,700,000 |
| Namibia | — | — | 50,000 |
| Peru | — | — | 880,000 |
| Portugal | 900 | 60,000 | 270,000 |
| Serbia | — | — | 1,200,000 |
| Spain | — | — | 300,000 |
| United States | 870[note 2] | 750,000 | 7,900,000 |
| Zimbabwe | 1,200 | 220,000 | 500,000 |
| World total | 82,000 | 21,000,000 | 86,000,000+ |
Lithium production has greatly increased since the end of World War II. The main sources of lithium are brines and ores.
Lithium metal is produced through electrolysis applied to a mixture of fused 55% lithium chloride and 45% potassium chloride at about 450 °C.[99]
Reserves and occurrence
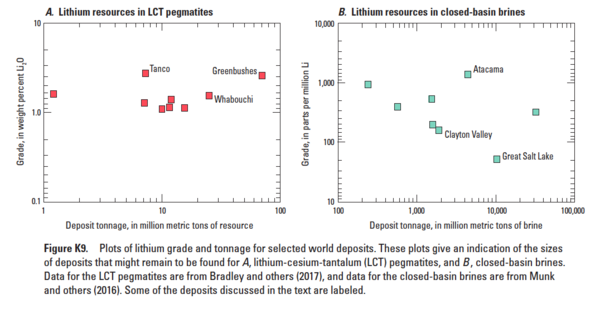
Scatter plots of lithium grade and tonnage for selected world deposits, as of 2017
The US Geological Survey (USGS) estimated worldwide identified lithium reserves in 2020 and 2021 to be 17 million and 21 million tonnes, respectively.[51][50] An accurate estimate of world lithium reserves is difficult.[100][101] One reason for this is that most lithium classification schemes are developed for solid ore deposits, whereas brine is a fluid that is problematic to treat with the same classification scheme due to varying concentrations and pumping effects.[102]
Following a hike in lithium price in 2015 and concern for insufficiency of lithium resource for the growing lithium-ion battery industry, a peer-reviewed analysis of USGS data in 2017 predicted that there will be no shortage of lithium and current estimates of reserves will increase along with the demand.[103] Worldwide lithium resources identified by USGS started to increase in 2017 owing to continuing exploration. Identified resources in 2016, 2017, 2018, 2019 and 2020 were 41, 47, 54, 62 and 80 million tonnes, respectively.[51]
In 2013, the world was estimated to contain about 15 million tonnes of lithium reserves, while 65 million tonnes of known resources were reasonable. 75% of lithium reserves could be found in the ten largest deposits of the world.[104] Another study noted that 83% of the geological resources of lithium are located in six brine, two pegmatite, and two sedimentary deposits.[105]
In the US, lithium is recovered from brine pools in Nevada.[17] A deposit discovered in 2013 in Wyoming’s Rock Springs Uplift is estimated to contain 228,000 tons. Additional deposits in the same formation were estimated to be as much as 18 million tons.[106] Similarly in Nevada, the McDermitt Caldera hosts lithium-bearing volcanic muds that consist of the largest known deposits of lithium within the United States.[107]
Lithium triangle
The world’s top four lithium-producing countries from 2019, as reported by the US Geological Survey are Australia, Chile, China and Argentina.[51]
The three countries of Chile, Bolivia, and Argentina make up a region known as the Lithium Triangle. The Lithium Triangle is known for its high-quality salt flats, which include Bolivia’s Salar de Uyuni, Chile’s Salar de Atacama, and Argentina’s Salar de Arizaro. The Lithium Triangle is believed to contain over 75% of existing known lithium reserves.[108] Deposits are also found in South America throughout the Andes mountain chain. Chile is the leading producer, followed by Argentina. Both countries recover lithium from brine pools. According to USGS, Bolivia’s Uyuni Desert has 5.4 million tonnes of lithium.[109][110] Half the world’s known reserves are located in Bolivia along the central eastern slope of the Andes. The Bolivian government has invested US$900 million and in 2021 successfully produced 540 tons[111][109] The brines in the salt pans of the Lithium Triangle vary widely in lithium content.[112] Concentrations can also vary in time as brines are fluids that are changeable and mobile.[112]
Since 2018 the Democratic Republic of Congo is known to have the largest lithium spodumene hard-rock deposit in the world.[113] The deposit located in Manono, DRC, may hold up to 1.5 billion tons of lithium spodumene hard-rock. The two largest pegmatites (known as the Carriere de l’Este Pegmatite and the Roche Dure Pegmatite) are each of similar size or larger than the famous Greenbushes Pegmatite in Western Australia. Thus, the Democratic Republic of Congo is expected to be a significant supplier of lithium to the world with its high grade and low impurities.
According to a later 2011 study by Lawrence Berkeley National Laboratory and the University of California, Berkeley, the then-estimated reserve base of lithium should not be a limiting factor for large-scale battery production for electric vehicles because an estimated 1 billion 40 kWh Li-based batteries could be built with those reserves[114] — about 10 kg of lithium per car.[115] Another 2011 study at the University of Michigan and Ford Motor Company found enough resources to support global demand until 2100, including the lithium required for the potential widespread transportation use. The study estimated global reserves at 39 million tons, and total demand for lithium during the 90-year period annualized at 12–20 million tons, depending on the scenarios regarding economic growth and recycling rates.[116]
In 2014, The Financialist stated that demand for lithium was growing at more than 12% a year. According to Credit Suisse, this rate exceeded projected availability by 25%. The publication compared the 2014 lithium situation with oil, whereby «higher oil prices spurred investment in expensive deepwater and oil sands production techniques»; that is, the price of lithium would continue to rise until more expensive production methods that could boost total output would receive the attention of investors.[117]
On 16 July 2018 2.5 million tonnes of high-grade lithium resources and 124 million pounds of uranium resources were found in the Falchani hard rock deposit in the region Puno, Peru.[118]
In 2020, Australia granted Major Project Status (MPS) to the Finniss Lithium Project for a strategically important lithium deposit: an estimated 3.45 million tonnes (Mt) of mineral resource at 1.4 percent lithium oxide.[119][120] Operational mining began in 2022.[121]
In 2019, world production of lithium from spodumene was around 80,000t per annum, primarily from the Greenbushes pegmatite and from some Chinese and Chilean sources. The Talison mine in Greenbushes is reported to be the largest and to have the highest grade of ore at 2.4% Li2O (2012 figures).[122]
Oceans are estimated to contain 230 billion tons of lithium,[123] but the concentration is 0.1-0.2ppm, making it more expensive to isolate with 2020 technology than from land based brine and rock.
Sources
Another potential source of lithium as of 2012 was identified as the leachates of geothermal wells, which are carried to the surface.[124] Recovery of this type of lithium has been demonstrated in the field; the lithium is separated by simple filtration.[125][clarification needed] Reserves are more limited than those of brine reservoirs and hard rock.[citation needed]
Pricing
In 1998, the price of lithium metal was about 95 USD/kg (or US$43/lb).[126] After the 2007 financial crisis, major suppliers, such as Sociedad Química y Minera (SQM), dropped lithium carbonate pricing by 20%.[127] Prices rose in 2012. A 2012 Business Week article outlined an oligopoly in the lithium space: «SQM, controlled by billionaire Julio Ponce, is the second-largest, followed by Rockwood, which is backed by Henry Kravis’s KKR & Co., and Philadelphia-based FMC», with Talison mentioned as the biggest producer.[128] Global consumption may jump to 300,000 metric tons a year by 2020[failed verification] from about 150,000 tons in 2012, to match the demand for lithium batteries that has been growing at about 25% a year, outpacing the 4% to 5% overall gain in lithium production.[128][needs update]
The price information service ISE — Institute of Rare Earths Elements and Strategic Metals — gives for various lithium substances in the average of the last six months (March to August 2022) the following kilo prices stable in the course: Lithium Carbonate, purity 99.5%min, from various producers between 63 and 72 EUR/kg. Lithium Hydroxide Monohydrate LiOH 56.5%min, China, at 66 to 72 EUR/kg; Delivered South Korea — 73 EUR/kg. Lithium Metal 99.9%min, Delivered China — 42 EUR/kg.[129]
Analyses of the extraction of lithium from seawater, published in 1975
Lithium and its compounds were historically isolated and extracted from hard rock but by the 1990s mineral springs, brine pools, and brine deposits had become the dominant source.[citation needed] Most of these were in Chile, Argentina and Bolivia.[50] Large lithium-clay deposits under development in the McDermitt caldera (Nevada, United States) require concentrated sulfuric acid to leach lithium from the clay ore.[130]
By early 2021, much of the lithium mined globally comes from either «spodumene, the mineral contained in hard rocks found in places such as Australia and North Carolina»[131] or from the salty brine pumped directly out of the ground, as it is in locations in Chile.[131][112] In Chile’s Salar de Atacama, the lithium concentration in the brine is raised by solar evaporation in a system of ponds.[112] The enrichment by evaporation process may require up to one-and-a-half years, when the brine reaches a lithium content of 6%.[112] The final processing in this example is done near the city of Antofagasta on the coast where pure lithium carbonate, lithium hydroxide, and lithium chloride are produced from the brine.[112]
Low-cobalt cathodes for lithium batteries are expected to require lithium hydroxide rather than lithium carbonate as a feedstock, and this trend favors rock as a source.[132][133][134]
The use of electrodialysis and electrochemical intercalation has been proposed to extract lithium compounds from seawater (which contains lithium at 0.2 parts per million), but it is not yet commercially viable.[135][136][137]
Environmental issues
The manufacturing processes of lithium, including the solvent and mining waste, presents significant environmental and health hazards.[138][139][140]
Lithium extraction can be fatal to aquatic life due to water pollution.[141] It is known to cause surface water contamination, drinking water contamination, respiratory problems, ecosystem degradation and landscape damage.[138] It also leads to unsustainable water consumption in arid regions (1.9 million liters per ton of lithium).[138] Massive byproduct generation of lithium extraction also presents unsolved problems, such as large amounts of magnesium and lime waste.[142]
In the United States, there is active competition between environmentally catastrophic open-pit mining, mountaintop removal mining and less damaging brine extraction mining in an effort to drastically expand domestic lithium mining capacity.[143] Environmental concerns include wildlife habitat degradation, potable water pollution including arsenic and antimony contamination, unsustainable water table reduction, and massive mining waste, including radioactive uranium byproduct and sulfuric acid discharge.
Human rights issues
A study of relationships between lithium extraction companies and indigenous peoples in Argentina indicated that the state may not have protected indigenous peoples’ right to free prior and informed consent, and that extraction companies generally controlled community access to information and set the terms for discussion of the projects and benefit sharing.[144]
Development of the Thacker Pass lithium mine in Nevada, United States, has met with protests and lawsuits from several indigenous tribes who have said they were not provided free prior and informed consent and that the project threatens cultural and sacred sites.[145] They have also expressed concerns that development of the project will create risks to indigenous women, because resource extraction is linked to missing and murdered indigenous women.[146] Protestors have been occupying the site of the proposed mine since January, 2021.[147][143]
Applications
Estimates of global lithium uses in 2011 (picture) and 2019 (numbers below)[148][149]
Ceramics and glass (18%)
Batteries (65%)
Lubricating greases (5%)
Continuous casting (3%)
Air treatment (1%)
Polymers
Primary aluminum production
Pharmaceuticals
Other (5%)
Batteries
In 2021, most lithium is used to make lithium-ion batteries for electric cars and mobile devices.
Ceramics and glass
Lithium oxide is widely used as a flux for processing silica, reducing the melting point and viscosity of the material and leading to glazes with improved physical properties including low coefficients of thermal expansion. Worldwide, this is one of the largest use for lithium compounds.[148][150] Glazes containing lithium oxides are used for ovenware. Lithium carbonate (Li2CO3) is generally used in this application because it converts to the oxide upon heating.[151]
Electrical and electronic
|
This section needs expansion with: beyond concerns about only lithium carbonate in the second paragraph. Lithium carbonate is simply not close to the most economically interesting lithium++ battery chemistry by late in the 2010s. You can help by adding to it. (March 2021) |
Late in the 20th century, lithium became an important component of battery electrolytes and electrodes, because of its high electrode potential. Because of its low atomic mass, it has a high charge- and power-to-weight ratio. A typical lithium-ion battery can generate approximately 3 volts per cell, compared with 2.1 volts for lead-acid and 1.5 volts for zinc-carbon. Lithium-ion batteries, which are rechargeable and have a high energy density, differ from lithium metal batteries, which are disposable (primary) batteries with lithium or its compounds as the anode.[152][153] Other rechargeable batteries that use lithium include the lithium-ion polymer battery, lithium iron phosphate battery, and the nanowire battery.
Over the years opinions have been differing about potential growth. A 2008 study concluded that «realistically achievable lithium carbonate production would be sufficient for only a small fraction of future PHEV and EV global market requirements», that «demand from the portable electronics sector will absorb much of the planned production increases in the next decade», and that «mass production of lithium carbonate is not environmentally sound, it will cause irreparable ecological damage to ecosystems that should be protected and that LiIon propulsion is incompatible with the notion of the ‘Green Car'».[52]
Lubricating greases
The third most common use of lithium is in greases. Lithium hydroxide is a strong base and, when heated with a fat, produces a soap made of lithium stearate. Lithium soap has the ability to thicken oils, and it is used to manufacture all-purpose, high-temperature lubricating greases.[17][154][155]
Metallurgy
Lithium (e.g. as lithium carbonate) is used as an additive to continuous casting mould flux slags where it increases fluidity,[156][157] a use which accounts for 5% of global lithium use (2011).[51] Lithium compounds are also used as additives (fluxes) to foundry sand for iron casting to reduce veining.[158]
Lithium (as lithium fluoride) is used as an additive to aluminium smelters (Hall–Héroult process), reducing melting temperature and increasing electrical resistance,[159] a use which accounts for 3% of production (2011).[51]
When used as a flux for welding or soldering, metallic lithium promotes the fusing of metals during the process[160] and eliminates the forming of oxides by absorbing impurities.[161] Alloys of the metal with aluminium, cadmium, copper and manganese are used to make high-performance, low density aircraft parts (see also Lithium-aluminium alloys).[162]
Silicon nano-welding
Lithium has been found effective in assisting the perfection of silicon nano-welds in electronic components for electric batteries and other devices.[163]
Lithium use in flares and pyrotechnics is due to its rose-red flame.[164]
Pyrotechnics
Lithium compounds are used as pyrotechnic colorants and oxidizers in red fireworks and flares.[17][165]
Air purification
Lithium chloride and lithium bromide are hygroscopic and are used as desiccants for gas streams.[17] Lithium hydroxide and lithium peroxide are the salts most used in confined areas, such as aboard spacecraft and submarines, for carbon dioxide removal and air purification. Lithium hydroxide absorbs carbon dioxide from the air by forming lithium carbonate, and is preferred over other alkaline hydroxides for its low weight.
Lithium peroxide (Li2O2) in presence of moisture not only reacts with carbon dioxide to form lithium carbonate, but also releases oxygen.[166][167] The reaction is as follows:
- 2 Li2O2 + 2 CO2 → 2 Li2CO3 + O2.
Some of the aforementioned compounds, as well as lithium perchlorate, are used in oxygen candles that supply submarines with oxygen. These can also include small amounts of boron, magnesium, aluminum, silicon, titanium, manganese, and iron.[168]
Optics
Lithium fluoride, artificially grown as crystal, is clear and transparent and often used in specialist optics for IR, UV and VUV (vacuum UV) applications. It has one of the lowest refractive indexes and the furthest transmission range in the deep UV of most common materials.[169] Finely divided lithium fluoride powder has been used for thermoluminescent radiation dosimetry (TLD): when a sample of such is exposed to radiation, it accumulates crystal defects which, when heated, resolve via a release of bluish light whose intensity is proportional to the absorbed dose, thus allowing this to be quantified.[170] Lithium fluoride is sometimes used in focal lenses of telescopes.[17][171]
The high non-linearity of lithium niobate also makes it useful in non-linear optics applications. It is used extensively in telecommunication products such as mobile phones and optical modulators, for such components as resonant crystals. Lithium applications are used in more than 60% of mobile phones.[172]
Organic and polymer chemistry
Organolithium compounds are widely used in the production of polymer and fine-chemicals. In the polymer industry, which is the dominant consumer of these reagents, alkyl lithium compounds are catalysts/initiators.[173] in anionic polymerization of unfunctionalized olefins.[174][175][176] For the production of fine chemicals, organolithium compounds function as strong bases and as reagents for the formation of carbon-carbon bonds. Organolithium compounds are prepared from lithium metal and alkyl halides.[177]
Many other lithium compounds are used as reagents to prepare organic compounds. Some popular compounds include lithium aluminium hydride (LiAlH4), lithium triethylborohydride, n-butyllithium and tert-butyllithium.
The launch of a torpedo using lithium as fuel
Military
Metallic lithium and its complex hydrides, such as Li[AlH4], are used as high-energy additives to rocket propellants.[19] Lithium aluminum hydride can also be used by itself as a solid fuel.[178]
The Mark 50 torpedo stored chemical energy propulsion system (SCEPS) uses a small tank of sulfur hexafluoride, which is sprayed over a block of solid lithium. The reaction generates heat, creating steam to propel the torpedo in a closed Rankine cycle.[179]
Lithium hydride containing lithium-6 is used in thermonuclear weapons, where it serves as fuel for the fusion stage of the bomb.[180]
Nuclear
Lithium-6 is valued as a source material for tritium production and as a neutron absorber in nuclear fusion. Natural lithium contains about 7.5% lithium-6 from which large amounts of lithium-6 have been produced by isotope separation for use in nuclear weapons.[181] Lithium-7 gained interest for use in nuclear reactor coolants.[182]
Lithium deuteride was used as fuel in the Castle Bravo nuclear device.
Lithium deuteride was the fusion fuel of choice in early versions of the hydrogen bomb. When bombarded by neutrons, both 6Li and 7Li produce tritium — this reaction, which was not fully understood when hydrogen bombs were first tested, was responsible for the runaway yield of the Castle Bravo nuclear test. Tritium fuses with deuterium in a fusion reaction that is relatively easy to achieve. Although details remain secret, lithium-6 deuteride apparently still plays a role in modern nuclear weapons as a fusion material.[183]
Lithium fluoride, when highly enriched in the lithium-7 isotope, forms the basic constituent of the fluoride salt mixture LiF-BeF2 used in liquid fluoride nuclear reactors. Lithium fluoride is exceptionally chemically stable and LiF-BeF2 mixtures have low melting points. In addition, 7Li, Be, and F are among the few nuclides with low enough thermal neutron capture cross-sections not to poison the fission reactions inside a nuclear fission reactor.[note 3][184]
In conceptualized (hypothetical) nuclear fusion power plants, lithium will be used to produce tritium in magnetically confined reactors using deuterium and tritium as the fuel. Naturally occurring tritium is extremely rare, and must be synthetically produced by surrounding the reacting plasma with a ‘blanket’ containing lithium where neutrons from the deuterium-tritium reaction in the plasma will fission the lithium to produce more tritium:
- 6Li + n → 4He + 3H.
Lithium is also used as a source for alpha particles, or helium nuclei. When 7Li is bombarded by accelerated protons 8Be is formed, which almost immediately undergoes fission to form two alpha particles. This feat, called «splitting the atom» at the time, was the first fully man-made nuclear reaction. It was produced by Cockroft and Walton in 1932.[185][186]
In 2013, the US Government Accountability Office said a shortage of lithium-7 critical to the operation of 65 out of 100 American nuclear reactors «places their ability to continue to provide electricity at some risk». Castle Bravo first used lithium-7, in the Shrimp, its first device, which weighed only 10 tons, and generated massive nuclear atmospheric contamination of Bikini Atoll. This perhaps accounts for the decline of US nuclear infrastructure.[187] The equipment needed to separate lithium-6 from lithium-7 is mostly a cold war leftover. The US shut down most of this machinery in 1963, when it had a huge surplus of separated lithium, mostly consumed during the twentieth century. The report said it would take five years and $10 million to $12 million to reestablish the ability to separate lithium-6 from lithium-7.[188]
Reactors that use lithium-7 heat water under high pressure and transfer heat through heat exchangers that are prone to corrosion. The reactors use lithium to counteract the corrosive effects of boric acid, which is added to the water to absorb excess neutrons.[188]
Medicine
Lithium is useful in the treatment of bipolar disorder.[189] Lithium salts may also be helpful for related diagnoses, such as schizoaffective disorder and cyclic major depression. The active part of these salts is the lithium ion Li+.[189] Lithium may increase the risk of developing Ebstein’s cardiac anomaly in infants born to women who take lithium during the first trimester of pregnancy.[190]
A 2022 review indicated that lithium therapy during treatment of bipolar disorder does not affect body weight.[191]
Precautions
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H260, H314 |
|
Precautionary statements |
P223, P231+P232, P280, P305+P351+P338, P370+P378, P422[192] |
| NFPA 704 (fire diamond) |
[193] 3 2 2
|
Lithium metal is corrosive and requires special handling to avoid skin contact. Breathing lithium dust or lithium compounds (which are often alkaline) initially irritate the nose and throat, while higher exposure can cause a buildup of fluid in the lungs, leading to pulmonary edema. The metal itself is a handling hazard because contact with moisture produces the caustic lithium hydroxide. Lithium is safely stored in non-reactive compounds such as naphtha.[194]
See also
- Cosmological lithium problem
- Dilithium
- Halo nucleus
- Isotopes of lithium
- List of countries by lithium production
- Lithia water
- Lithium–air battery
- Lithium burning
- Lithium compounds (category)
- Lithium-ion battery
- Lithium Tokamak Experiment
Notes
- ^ a b Appendixes Archived 6 November 2011 at the Wayback Machine. By USGS definitions, the reserve base «may encompass those parts of the resources that have a reasonable potential for becoming economically available within planning horizons beyond those that assume proven technology and current economics. The reserve base includes those resources that are currently economic (reserves), marginally economic (marginal reserves), and some of those that are currently subeconomic (subeconomic resources).»
- ^ In 2013
- ^ Beryllium and fluorine occur only as one isotope, 9Be and 19F respectively. These two, together with 7Li, as well as 2H, 11B, 15N, 209Bi, and the stable isotopes of C, and O, are the only nuclides with low enough thermal neutron capture cross sections aside from actinides to serve as major constituents of a molten salt breeder reactor fuel.
References
- ^ «Standard Atomic Weights: Lithium». CIAAW. 2009.
- ^ Li(0) atoms have been observed in various small lithium-chloride clusters; see Milovanović, Milan; Veličković, Suzana; Veljkovićb, Filip; Jerosimić, Stanka (30 October 2017). «Structure and stability of small lithium-chloride LinClm(0,1+) (n ≥ m, n = 1–6, m = 1–3) clusters». Physical Chemistry Chemical Physics (45). doi:10.1039/C7CP04181K.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ a b Numerical data from: Lodders, Katharina (10 July 2003). «Solar System Abundances and Condensation Temperatures of the Elements» (PDF). The Astrophysical Journal. The American Astronomical Society. 591 (2): 1220–1247. Bibcode:2003ApJ…591.1220L. doi:10.1086/375492. S2CID 42498829. Archived from the original (PDF) on 7 November 2015. Retrieved 1 September 2015. Graphed at File:SolarSystemAbundances.jpg
- ^ Nuclear Weapon Design. Federation of American Scientists (21 October 1998). fas.org
- ^ a b c d e f g Krebs, Robert E. (2006). The History and Use of Our Earth’s Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 978-0-313-33438-2.
- ^ Huang, Chuanfu; Kresin, Vitaly V. (June 2016). «Note: Contamination-free loading of lithium metal into a nozzle source». Review of Scientific Instruments. 87 (6): 066105. Bibcode:2016RScI…87f6105H. doi:10.1063/1.4953918. ISSN 0034-6748. PMID 27370506.
- ^ Addison, C. C. (1984). The chemistry of the liquid alkali metals. Chichester [West Sussex]: Wiley. ISBN 978-0471905080. OCLC 10751785.
- ^ a b «PubChem Element Summary for AtomicNumber 3, Lithium». National Center for Biotechnology Information. 2021. Retrieved 10 September 2021.
- ^ «It’s Elemental — The Element Lithium». education.jlab.org. Archived from the original on 5 October 2019. Retrieved 9 October 2019.
- ^ «Nitrogen, N2, Physical properties, safety, MSDS, enthalpy, material compatibility, gas liquid equilibrium, density, viscosity, inflammability, transport properties». Encyclopedia.airliquide.com. Archived from the original on 21 July 2011. Retrieved 29 September 2010.
- ^ «Coefficients of Linear Expansion». Engineering Toolbox. Archived from the original on 30 November 2012. Retrieved 9 January 2011.
- ^ Tuoriniemi, Juha; Juntunen-Nurmilaukas, Kirsi; Uusvuori, Johanna; Pentti, Elias; Salmela, Anssi; Sebedash, Alexander (2007). «Superconductivity in lithium below 0.4 millikelvin at ambient pressure». Nature. 447 (7141): 187–9. Bibcode:2007Natur.447..187T. doi:10.1038/nature05820. PMID 17495921. S2CID 4430500. Archived from the original on 25 June 2019. Retrieved 20 April 2018.
- ^ Struzhkin, V. V.; Eremets, M. I.; Gan, W; Mao, H. K.; Hemley, R. J. (2002). «Superconductivity in dense lithium». Science. 298 (5596): 1213–5. Bibcode:2002Sci…298.1213S. doi:10.1126/science.1078535. PMID 12386338. S2CID 21030510.
- ^ Overhauser, A. W. (1984). «Crystal Structure of Lithium at 4.2 K». Physical Review Letters. 53 (1): 64–65. Bibcode:1984PhRvL..53…64O. doi:10.1103/PhysRevLett.53.64.
- ^ Schwarz, Ulrich (2004). «Metallic high-pressure modifications of main group elements». Zeitschrift für Kristallographie. 219 (6–2004): 376–390. Bibcode:2004ZK….219..376S. doi:10.1524/zkri.219.6.376.34637. S2CID 56006683.
- ^ a b c d e f g Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics (81st ed.). CRC press. ISBN 978-0-8493-0481-1.[page needed]
- ^ SPECIFIC HEAT OF SOLIDS. bradley.edu
- ^ a b c d e f g Emsley, John (2001). Nature’s Building Blocks. Oxford: Oxford University Press. ISBN 978-0-19-850341-5.
- ^ «Isotopes of Lithium». Berkeley National Laboratory, The Isotopes Project. Archived from the original on 13 May 2008. Retrieved 21 April 2008.
- ^ File:Binding energy curve — common isotopes.svg shows binding energies of stable nuclides graphically; the source of the data-set is given in the figure background.
- ^ Sonzogni, Alejandro. «Interactive Chart of Nuclides». National Nuclear Data Center: Brookhaven National Laboratory. Archived from the original on 23 July 2007. Retrieved 6 June 2008.
- ^ Various (2002). Lide, David R. (ed.). Handbook of Chemistry & Physics (88th ed.). CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. Archived from the original on 24 July 2017. Retrieved 23 May 2008.
- ^ Asplund, M.; et al. (2006). «Lithium Isotopic Abundances in Metal-poor Halo Stars». The Astrophysical Journal. 644 (1): 229–259. arXiv:astro-ph/0510636. Bibcode:2006ApJ…644..229A. doi:10.1086/503538. S2CID 394822.
- ^ Denissenkov, P. A.; Weiss, A. (2000). «Episodic lithium production by extra-mixing in red giants». Astronomy and Astrophysics. 358: L49–L52. arXiv:astro-ph/0005356. Bibcode:2000A&A…358L..49D.
- ^ Chaussidon, M.; Robert, F.; McKeegan, K. D. (2006). «Li and B isotopic variations in an Allende CAI: Evidence for the in situ decay of short-lived 10Be and for the possible presence of the short−lived nuclide 7Be in the early solar system» (PDF). Geochimica et Cosmochimica Acta. 70 (1): 224–245. Bibcode:2006GeCoA..70..224C. doi:10.1016/j.gca.2005.08.016. Archived from the original (PDF) on 18 July 2010.
- ^ Seitz, H. M.; Brey, G. P.; Lahaye, Y.; Durali, S.; Weyer, S. (2004). «Lithium isotopic signatures of peridotite xenoliths and isotopic fractionation at high temperature between olivine and pyroxenes». Chemical Geology. 212 (1–2): 163–177. Bibcode:2004ChGeo.212..163S. doi:10.1016/j.chemgeo.2004.08.009.
- ^ Duarte, F. J (2009). Tunable Laser Applications. CRC Press. p. 330. ISBN 978-1-4200-6009-6.
- ^ a b Coplen, T. B.; Bohlke, J. K.; De Bievre, P.; Ding, T.; Holden, N. E.; Hopple, J. A.; Krouse, H. R.; Lamberty, A.; Peiser, H. S.; et al. (2002). «Isotope-abundance variations of selected elements (IUPAC Technical Report)». Pure and Applied Chemistry. 74 (10): 1987. doi:10.1351/pac200274101987.
- ^ Truscott, Andrew G.; Strecker, Kevin E.; McAlexander, William I.; Partridge, Guthrie B.; Hulet, Randall G. (30 March 2001). «Observation of Fermi Pressure in a Gas of Trapped Atoms». Science. 291 (5513): 2570–2572. Bibcode:2001Sci…291.2570T. doi:10.1126/science.1059318. ISSN 0036-8075. PMID 11283362. S2CID 31126288. Archived from the original on 13 March 2021. Retrieved 11 January 2020.
- ^ «Element Abundances» (PDF). Archived from the original (PDF) on 1 September 2006. Retrieved 17 November 2009.
- ^ Boesgaard, A. M.; Steigman, G. (1985). «Big bang nucleosynthesis – Theories and observations». Annual Review of Astronomy and Astrophysics. Palo Alto, CA. 23: 319–378. Bibcode:1985ARA&A..23..319B. doi:10.1146/annurev.aa.23.090185.001535. A86-14507 04–90.
- ^ Woo, Marcus (21 February 2017). «The Cosmic Explosions That Made the Universe». earth. BBC. Archived from the original on 21 February 2017. Retrieved 21 February 2017.
A mysterious cosmic factory is producing lithium. Scientists are now getting closer at finding out where it comes from
- ^ Cain, Fraser (16 August 2006). «Why Old Stars Seem to Lack Lithium». Archived from the original on 4 June 2016.
- ^ «First Detection of Lithium from an Exploding Star». Archived from the original on 1 August 2015. Retrieved 29 July 2015.
- ^ Cain, Fraser. «Brown Dwarf». Universe Today. Archived from the original on 25 February 2011. Retrieved 17 November 2009.
- ^ Reid, Neill (10 March 2002). «L Dwarf Classification». Archived from the original on 21 May 2013. Retrieved 6 March 2013.
- ^ Arizona State University (1 June 2020). «Class of stellar explosions found to be galactic producers of lithium». EurekAlert!. Archived from the original on 3 June 2020. Retrieved 2 June 2020.
- ^ Starrfield, Sumner; et al. (27 May 2020). «Carbon–Oxygen Classical Novae Are Galactic 7Li Producers as well as Potential Supernova Ia Progenitors». The Astrophysical Journal. 895 (1): 70. arXiv:1910.00575. Bibcode:2020ApJ…895…70S. doi:10.3847/1538-4357/ab8d23. S2CID 203610207.
- ^ «Lithium Occurrence». Institute of Ocean Energy, Saga University, Japan. Archived from the original on 2 May 2009. Retrieved 13 March 2009.
- ^ a b c d «Some Facts about Lithium». ENC Labs. Archived from the original on 10 July 2011. Retrieved 15 October 2010.
- ^ Schwochau, Klaus (1984). «Extraction of metals from sea water». Inorganic Chemistry. Topics in Current Chemistry. Vol. 124. Springer Berlin Heidelberg. pp. 91–133. doi:10.1007/3-540-13534-0_3. ISBN 978-3-540-13534-0. S2CID 93866412.
- ^ a b c d Kamienski, Conrad W.; McDonald, Daniel P.; Stark, Marshall W.; Papcun, John R. (2004). «Lithium and lithium compounds». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.1209200811011309.a01.pub2. ISBN 978-0471238966.
- ^ «lithium». Britannica encyclopedia. Archived from the original on 5 August 2020. Retrieved 4 August 2020.
- ^ Atkins, Peter (2010). Shriver & Atkins’ Inorganic Chemistry (5th ed.). New York: W. H. Freeman and Company. p. 296. ISBN 978-0199236176.
- ^ «Mindat.org — Mines, Minerals and More». www.mindat.org. Archived from the original on 22 April 2011. Retrieved 4 August 2019.
- ^ Moores, S. (June 2007). «Between a rock and a salt lake». Industrial Minerals. 477: 58.
- ^ Taylor, S. R.; McLennan, S. M.; The continental crust: Its composition and evolution, Blackwell Sci. Publ., Oxford, 330 pp. (1985). Cited in Abundances of the elements (data page)
- ^ Garrett, Donald (2004) Handbook of Lithium and Natural Calcium, Academic Press, cited in The Trouble with Lithium 2 Archived 14 July 2011 at the Wayback Machine, Meridian International Research (2008)
- ^ a b c d e «Mineral Commodity Summaries 2021» (PDF). U.S. Geological Survey. February 2021. Retrieved 17 March 2021.
- ^ a b c d e f Lithium Statistics and Information, U.S. Geological Survey, 2018, archived from the original on 3 March 2016, retrieved 25 July 2002
- ^ a b «The Trouble with Lithium 2» (PDF). Meridian International Research. 2008. Archived from the original (PDF) on 14 July 2011. Retrieved 29 September 2010.
- ^ Czech Geological Survey (October 2015). Mineral Commodity Summaries of the Czech Republic 2015 (PDF). Prague: Czech Geological Survey. p. 373. ISBN 978-80-7075-904-2. Archived (PDF) from the original on 6 January 2017.
- ^ «Ore Reserve grows its Finland lithium deposit by 50%». 2019. Archived from the original on 10 December 2019. Retrieved 10 December 2019.
- ^ Risen, James (13 June 2010). «U.S. Identifies Vast Riches of Minerals in Afghanistan». The New York Times. Archived from the original on 17 June 2010. Retrieved 13 June 2010.
- ^ Page, Jeremy; Evans, Michael (15 June 2010). «Taleban zones mineral riches may rival Saudi Arabia says Pentagon». The Times. London. Archived from the original on 14 May 2011.
- ^ Hosp, Gerald. «Afghanistan: die konfliktreichen Bodenschätze». Neue Zürcher Zeitung (in German). Retrieved 1 September 2021.
- ^ Bliss, Dominic (28 May 2021). «National Geographic». In Cornwall, ruinous tin and copper mines are yielding battery-grade lithium. Here’s what that means. Retrieved 13 June 2021.
- ^ «Cornwall lithium deposits ‘globally significant’«. BBC. 17 September 2020. Retrieved 13 June 2021.
- ^ Chassard-Bouchaud, C.; Galle, P.; Escaig, F.; Miyawaki, M. (1984). «Bioaccumulation of lithium by marine organisms in European, American, and Asian coastal zones: microanalytic study using secondary ion emission». Comptes Rendus de l’Académie des Sciences, Série III. 299 (18): 719–24. PMID 6440674.
- ^ a b c d Bach, Ricardo O.; Gallicchio, Vincent S., eds. (1990). Lithium and Cell Physiology. New York, NY: Springer New York. pp. 25–46. doi:10.1007/978-1-4612-3324-4. ISBN 978-1-4612-7967-9. S2CID 44374126.
- ^ a b c d e Jakobsson, Eric; Argüello-Miranda, Orlando; Chiu, See-Wing; Fazal, Zeeshan; Kruczek, James; Nunez-Corrales, Santiago; Pandit, Sagar; Pritchet, Laura (10 November 2017). «Towards a Unified Understanding of Lithium Action in Basic Biology and its Significance for Applied Biology». The Journal of Membrane Biology. Springer Science and Business Media LLC. 250 (6): 587–604. doi:10.1007/s00232-017-9998-2. ISSN 0022-2631. PMC 5696506. PMID 29127487.
- ^ a b Alda, M (17 February 2015). «Lithium in the treatment of bipolar disorder: pharmacology and pharmacogenetics». Molecular Psychiatry. Nature Publishing Group. 20 (6): 661–670. doi:10.1038/mp.2015.4. ISSN 1359-4184. PMC 5125816. PMID 25687772.
- ^ Martinsson, L; Wei, Y; Xu, D; Melas, P A; Mathé, A A; Schalling, M; Lavebratt, C; Backlund, L (2013). «Long-term lithium treatment in bipolar disorder is associated with longer leukocyte telomeres». Translational Psychiatry. Nature Publishing Group. 3 (5): e261–. doi:10.1038/tp.2013.37. ISSN 2158-3188. PMC 3669924. PMID 23695236.
- ^ D’Andraba (1800). «Des caractères et des propriétés de plusieurs nouveaux minérauxde Suède et de Norwège, avec quelques observations chimiques faites sur ces substances». Journal de Physique, de Chimie, d’Histoire Naturelle, et des Arts. 51: 239. Archived from the original on 13 July 2015.
- ^ «Petalite Mineral Information». Mindat.org. Archived from the original on 16 February 2009. Retrieved 10 August 2009.
- ^ a b c d e f g «Lithium:Historical information». Archived from the original on 16 October 2009. Retrieved 10 August 2009.
- ^ Weeks, Mary (2003). Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. p. 124. ISBN 978-0-7661-3872-8. Retrieved 10 August 2009.
- ^ Berzelius (1817). «Ein neues mineralisches Alkali und ein neues Metall» [A new mineral alkali and a new metal]. Journal für Chemie und Physik. 21: 44–48. Archived from the original on 3 December 2016. From p. 45: «Herr August Arfwedson, ein junger sehr verdienstvoller Chemiker, der seit einem Jahre in meinem Laboratorie arbeitet, fand bei einer Analyse des Petalits von Uto’s Eisengrube, einen alkalischen Bestandtheil, … Wir haben es Lithion genannt, um dadurch auf seine erste Entdeckung im Mineralreich anzuspielen, da die beiden anderen erst in der organischen Natur entdeckt wurden. Sein Radical wird dann Lithium genannt werden.» (Mr. August Arfwedson, a young, very meritorious chemist, who has worked in my laboratory for a year, found during an analysis of petalite from Uto’s iron mine, an alkaline component … We’ve named it lithion, in order to allude thereby to its first discovery in the mineral realm, since the two others were first discovered in organic nature. Its radical will then be named «lithium».)
- ^ «Johan August Arfwedson». Periodic Table Live!. Archived from the original on 7 October 2010. Retrieved 10 August 2009.
- ^ «Johan Arfwedson». Archived from the original on 5 June 2008. Retrieved 10 August 2009.
- ^ a b c van der Krogt, Peter. «Lithium». Elementymology & Elements Multidict. Archived from the original on 16 June 2011. Retrieved 5 October 2010.
- ^ Clark, Jim (2005). «Compounds of the Group 1 Elements». Archived from the original on 11 March 2009. Retrieved 10 August 2009.
- ^ See:
- Arwedson, Aug. (1818) «Undersökning af några vid Utö Jernmalmsbrott förekommende Fossilier, och af ett deri funnet eget Eldfast Alkali» Archived 25 November 2017 at the Wayback Machine, Afhandlingar i Fysik, Kemi och Mineralogi, 6 : 145–172. (in Swedish)
- Arwedson, Aug. (1818) «Untersuchung einiger bei der Eisen-Grube von Utö vorkommenden Fossilien und von einem darin gefundenen neuen feuerfesten Alkali» Archived 13 March 2021 at the Wayback Machine (Investigation of some minerals occurring at the iron mines of Utö and of a new refractory alkali found therein), Journal für Chemie und Physik, 22 (1) : 93–117. (in German)
- ^ Gmelin, C. G. (1818). «Von dem Lithon» [On lithium]. Annalen der Physik. 59 (7): 238–241. Bibcode:1818AnP….59..229G. doi:10.1002/andp.18180590702. Archived from the original on 9 November 2015.
p. 238 Es löste sich in diesem ein Salz auf, das an der Luft zerfloss, und nach Art der Strontiansalze den Alkohol mit einer purpurrothen Flamme brennen machte. (There dissolved in this [solvent; namely, absolute alcohol] a salt that deliquesced in air, and in the manner of strontium salts, caused the alcohol to burn with a purple-red flame.)
- ^ a b Enghag, Per (2004). Encyclopedia of the Elements: Technical Data – History –Processing – Applications. Wiley. pp. 287–300. ISBN 978-3-527-30666-4.
- ^ Brande, William Thomas (1821) A Manual of Chemistry, 2nd ed. London, England: John Murray, vol. 2, pp. 57-58. Archived 22 November 2015 at the Wayback Machine
- ^ «The Quarterly journal of science and the arts». The Quarterly Journal of Science and the Arts. Royal Institution of Great Britain. 5: 338. 1818. Archived from the original on 13 March 2021. Retrieved 5 October 2010.
- ^ «Timeline science and engineering». DiracDelta Science & Engineering Encyclopedia. Archived from the original on 5 December 2008. Retrieved 18 September 2008.
- ^ Brande, William Thomas; MacNeven, William James (1821). A manual of chemistry. Long. p. 191. Retrieved 8 October 2010.
- ^ Bunsen, R. (1855). «Darstellung des Lithiums» [Preparation of lithium]. Annalen der Chemie und Pharmacie. 94: 107–111. doi:10.1002/jlac.18550940112. Archived from the original on 6 November 2018. Retrieved 13 August 2015.
- ^ Green, Thomas (11 June 2006). «Analysis of the Element Lithium». echeat. Archived from the original on 21 April 2012.
- ^ Garrett, Donald E. (5 April 2004). Handbook of Lithium and Natural Calcium Chloride. p. 99. ISBN 9780080472904. Archived from the original on 3 December 2016.
- ^ Shorter, Edward (June 2009). «The history of lithium therapy». Bipolar Disorders. 11 (Suppl 2): 4–9. doi:10.1111/j.1399-5618.2009.00706.x. ISSN 1398-5647. PMC 3712976. PMID 19538681.
- ^ a b Ober, Joyce A. (1994). «Commodity Report 1994: Lithium» (PDF). United States Geological Survey. Archived (PDF) from the original on 9 June 2010. Retrieved 3 November 2010.
- ^ Deberitz, Jürgen; Boche, Gernot (2003). «Lithium und seine Verbindungen — Industrielle, medizinische und wissenschaftliche Bedeutung». Chemie in unserer Zeit. 37 (4): 258–266. doi:10.1002/ciuz.200300264.
- ^ Bauer, Richard (1985). «Lithium — wie es nicht im Lehrbuch steht». Chemie in unserer Zeit. 19 (5): 167–173. doi:10.1002/ciuz.19850190505.
- ^ Ober, Joyce A. (1994). «Minerals Yearbook 2007 : Lithium» (PDF). United States Geological Survey. Archived (PDF) from the original on 17 July 2010. Retrieved 3 November 2010.
- ^ Kogel, Jessica Elzea (2006). «Lithium». Industrial minerals & rocks: commodities, markets, and uses. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. p. 599. ISBN 978-0-87335-233-8. Archived from the original on 7 November 2020. Retrieved 6 November 2020.
- ^ McKetta, John J. (18 July 2007). Encyclopedia of Chemical Processing and Design: Volume 28 – Lactic Acid to Magnesium Supply-Demand Relationships. M. Dekker. ISBN 978-0-8247-2478-8. Archived from the original on 28 May 2013.
- ^ Overland, Indra (1 March 2019). «The geopolitics of renewable energy: Debunking four emerging myths» (PDF). Energy Research & Social Science. 49: 36–40. doi:10.1016/j.erss.2018.10.018. ISSN 2214-6296. Archived (PDF) from the original on 13 March 2021. Retrieved 25 August 2019.
- ^ Krebs, Robert E. (2006). The history and use of our earth’s chemical elements: a reference guide. Greenwood Publishing Group. p. 47. ISBN 978-0-313-33438-2. Archived from the original on 4 August 2016.
- ^ Institute, American Geological; Union, American Geophysical; Society, Geochemical (1 January 1994). «Geochemistry international». 31 (1–4): 115. Archived from the original on 4 June 2016.
- ^ a b c d Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 97–99. ISBN 978-0-08-022057-4.
- ^ Beckford, Floyd. «University of Lyon course online (powerpoint) slideshow». Archived from the original on 4 November 2005. Retrieved 27 July 2008.
definitions:Slides 8–10 (Chapter 14)
- ^ Sapse, Anne-Marie & von R. Schleyer, Paul (1995). Lithium chemistry: a theoretical and experimental overview. Wiley-IEEE. pp. 3–40. ISBN 978-0-471-54930-7. Archived from the original on 31 July 2016.
- ^ Nichols, Michael A.; Williard, Paul G. (1 February 1993). «Solid-state structures of n-butyllithium-TMEDA, -THF, and -DME complexes». Journal of the American Chemical Society. 115 (4): 1568–1572. doi:10.1021/ja00057a050. ISSN 0002-7863.
- ^ C., Mehrotra, R. (2009). Organometallic chemistry : a unified approach. [Place of publication not identified]: New Age International Pvt. ISBN 978-8122412581. OCLC 946063142.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 73. ISBN 978-0-08-037941-8.
- ^ Tarascon, J. M. (2010). «Is lithium the new gold?». Nature Chemistry. 2 (6): 510. Bibcode:2010NatCh…2..510T. doi:10.1038/nchem.680. PMID 20489722.
- ^ Woody, Todd (19 October 2011). «Lithium: The New California Gold Rush». Forbes. Archived from the original on 19 December 2014.
- ^ Houston, J.; Butcher, A.; Ehren, P.; Evans, K.; Godfrey, L. (2011). «The Evaluation of Brine Prospects and the Requirement for Modifications to Filing Standards» (PDF). Economic Geology. 106 (7): 1225–1239. doi:10.2113/econgeo.106.7.1225. Archived (PDF) from the original on 20 July 2018. Retrieved 28 June 2019.
- ^ Eftekhari, A. (2019). «Lithium Batteries for Electric Vehicles: From Economy to Research Strategy». ACS Sustainable Chem. Eng. 7 (6): 5602–5613. doi:10.1021/acssuschemeng.8b01494. S2CID 104468150.
- ^ Vikström, H.; Davidsson, S.; Höök, M. (2013). «Lithium availability and future production outlooks». Applied Energy. 110 (10): 252–266. doi:10.1016/j.apenergy.2013.04.005. Archived from the original on 11 October 2017. Retrieved 11 October 2017.
- ^ Grosjean, P.W.; Medina, P.A.; Keoleian, G.A.; Kesler, S.E.; Everson, M.P; Wallington, T.J. (2011). «Global Lithium Availability: A Constraint for Electric Vehicles?». Journal of Industrial Ecology. 15 (5): 760–775. doi:10.1111/j.1530-9290.2011.00359.x. hdl:2027.42/87046. S2CID 4734596.
- ^ Money Game Contributors (26 April 2013). «New Wyoming Lithium Deposit». Business Insider. Archived from the original on 3 May 2013.
- ^ Benson, Tom (16 August 2016). «Lithium enrichment in intracontinental rhyolite magmas leads to Li deposits in caldera basins». Nature Communications. 8 (1): 270. doi:10.1038/s41467-017-00234-y. PMC 5559592. PMID 28814716.
- ^ Halpern, Abel (30 January 2014). «The Lithium Triangle». Latin Trade. Archived from the original on 10 June 2018.
- ^ a b Romero, Simon (2 February 2009). «In Bolivia, a Tight Grip on the Next Big Resource». The New York Times. Archived from the original on 1 July 2017.
- ^ «USGS Mineral Commodities Summaries 2009» (PDF). USGS. Archived (PDF) from the original on 14 June 2010.
- ^ Dube, Ryan (11 August 2022). «The Place With the Most Lithium Is Blowing the Electric-Car Revolution». The Wall Street Journal. Vol. CCLXXX, no. 35. pp. A1, A8. ISSN 1042-9840. Retrieved 11 August 2022.
- ^ a b c d e f Cabello, J (2022). «Reserves, resources and lithium exploration in the salt flats of northern Chile». Andean Geology. 49 (2): 297–306. doi:10.5027/andgeoV49n2-3444] (inactive 31 December 2022).
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) - ^ «This Congo project could supply the world with lithium». MiningDotCom. 10 December 2018. Retrieved 26 March 2021.
- ^ Wadia, Cyrus; Albertus, Paul; Srinivasan, Venkat (2011). «Resource constraints on the battery energy storage potential for grid and transportation applications». Journal of Power Sources. 196 (3): 1593–8. Bibcode:2011JPS…196.1593W. doi:10.1016/j.jpowsour.2010.08.056. Archived from the original on 13 March 2021. Retrieved 28 June 2019.
- ^ Gaines, LL.; Nelson, P. (2010). «Lithium-Ion Batteries: Examining Material Demand and Recycling Issues». Argonne National Laboratory. Archived from the original on 3 August 2016. Retrieved 11 June 2016.
- ^ «University of Michigan and Ford researchers see plentiful lithium resources for electric vehicles». Green Car Congress. 3 August 2011. Archived from the original on 16 September 2011.
- ^ «The Precious Mobile Metal». The Financialist. Credit Suisse. 9 June 2014. Archived from the original on 23 February 2016. Retrieved 19 June 2014.
- ^ «Plateau Energy Metals Peru unit finds large lithium resources». Reuters. 16 July 2018. Archived from the original on 26 July 2018.
- ^ Matthis, Simon (17 March 2021). «Australia grants MPS for Core Lithium’s Finniss lithium project». MiningMetalNews. Retrieved 13 October 2022.
- ^ CORE Lithium : Finnis Lithium, retrieved 13 October 2022
- ^ «Finniss Lithium Project, Northern Territory, Australia». Mining Technology. 13 January 2022. Retrieved 13 October 2022.
- ^ «Greenbushes Lithium Mine». Golden Dragon Capital. Archived from the original on 19 January 2019. Retrieved 18 January 2019.
- ^ Sixie Yang; Fan Zhang; Huaiping Ding; Ping He (19 September 2018). «Lithium Metal Extraction from Seawater». Joule. Elsevier. 2 (9): 1648–1651. doi:10.1016/j.joule.2018.07.006.
- ^ Parker, Ann. Mining Geothermal Resources Archived 17 September 2012 at the Wayback Machine. Lawrence Livermore National Laboratory
- ^ Patel, P. (16 November 2011) Startup to Capture Lithium from Geothermal Plants. technologyreview.com
- ^ Ober, Joyce A. «Lithium» (PDF). United States Geological Survey. pp. 77–78. Archived (PDF) from the original on 11 July 2007. Retrieved 19 August 2007.
- ^ «SQM Announces New Lithium Prices – SANTIAGO, Chile». PR Newswire. 30 September 2009. Archived from the original on 30 May 2013.
- ^ a b Riseborough, Jesse. «IPad Boom Strains Lithium Supplies After Prices Triple». Bloomberg BusinessWeek. Archived from the original on 22 June 2012. Retrieved 1 May 2013.
- ^ «ISE Metal-qoutes»..access-date=29 September 2022.
- ^ Thacker Pass Lithium Mine Project Final Environmental Impact Statement (PDF) (Technical report). Bureau of Land Management and the U.S. Fish and Wildlife Service. 4 December 2020. DOI-BLM-NV-W010-2020-0012-EIS. Retrieved 16 March 2021.
- ^ a b Patterson, Scott; Ramkumar, Amrith (9 March 2021). «America’s Battery-Powered Car Hopes Ride on Lithium. One Producer Paves the Way». Wall Street Journal. Archived from the original on 12 March 2021. Retrieved 13 March 2021.
- ^ Cafariello, Joseph (10 March 2014). «Lithium: A Long-Term Investment Buy Lithium!». wealthdaily.com. Archived from the original on 12 June 2018. Retrieved 24 April 2015.
- ^ Kaskey, Jack (16 July 2014). «Largest Lithium Deal Triggered by Smartphones and Teslas». Bloomberg. Archived from the original on 12 June 2018. Retrieved 24 April 2015.
- ^ Marcelo Azevedo, Nicolò Campagnol, Toralf Hagenbruch, Ken Hoffman, Ajay Lala, Oliver Ramsbottom (June 2018). «Lithium and cobalt – a tale of two commodities». McKinsey. p. 9. Archived from the original on 11 December 2019. Retrieved 29 January 2020.
{{cite web}}: CS1 maint: multiple names: authors list (link) - ^ Chong Liu, Yanbin Li, Dingchang Lin, Po-Chun Hsu, Bofei Liu, Gangbin Yan, Tong Wu Yi Cui & Steven Chu (2020). «Lithium Extraction from Seawater through Pulsed Electrochemical Intercalation». Joule. 4 (7): 1459–1469. doi:10.1016/j.joule.2020.05.017. S2CID 225527170. Archived from the original on 13 March 2021. Retrieved 26 December 2020.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Tsuyoshi Hoshino (2015). «Innovative lithium recovery technique from seawater by using world-first dialysis with a lithium ionic superconductor». Desalination. 359: 59–63. doi:10.1016/j.desal.2014.12.018.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Robert F. Service (13 July 2020). «Seawater could provide nearly unlimited amounts of critical battery material». Science. Archived from the original on 13 January 2021. Retrieved 26 December 2020.
- ^ a b c Amui, Rachid (February 2020). «Commodities At a Glance: Special issue on strategic battery raw materials» (PDF). United Nations Conference on Trade and Development. 13 (UNCTAD/DITC/COM/2019/5). Retrieved 10 February 2021.
- ^ Application of Life-Cycle Assessment to Nanoscale Technology: Lithium-ion Batteries for Electric Vehicles (Report). Washington, DC: U.S. Environmental Protection Agency (EPA). 2013. EPA 744-R-12-001.
- ^ «Can Nanotech Improve Li-ion Battery Performance». Environmental Leader. 30 May 2013. Archived from the original on 21 August 2016. Retrieved 3 June 2013.
- ^ Katwala, Amit. «The spiralling environmental cost of our lithium battery addiction». Wired. Condé Nast Publications. Retrieved 10 February 2021.
- ^ Draper, Robert. «This metal is powering today’s technology—at what price?». National Geographic. No. February 2019. National Geographic Partners. Retrieved 10 February 2021.
- ^ a b «The Lithium Gold Rush: Inside the Race to Power Electric Vehicles». The New York Times. 6 May 2021. Retrieved 6 May 2021.
- ^ Marchegiani, Morgera, and Parks (21 November 2019). «Indigenous peoples’rights to natural resources in Argentina: the challenges of impact assessment, consent and fair andequitable benefit-sharing in cases of lithium mining». The International Journal of Human Rights.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Price, Austin (Summer 2021). «The Rush for White Gold». Earth Island Journal.
- ^ Chadwell, Jeri (21 July 2021). «Judge to decide on injunction request to halt work on Thacker Pass lithium mine». This is Reno. Retrieved 12 October 2021.
- ^ «Thacker Pass Lithium mine approval draws around-the-clock protest». Sierra Nevada Ally. 19 January 2021. Retrieved 16 March 2021.
- ^ a b «Lithium» (PDF). 2016. Archived (PDF) from the original on 30 November 2016. Retrieved 29 November 2016 – via US Geological Survey (USGS).
- ^ «Lithium» (PDF). USGS. USGS. Archived (PDF) from the original on 1 November 2020. Retrieved 15 November 2020.
- ^ «Fmclithium.com» (PDF). www.fmclithium.com. Archived from the original (PDF) on 7 September 2014.
- ^ Clark, Jim (2005). «Some Compounds of the Group 1 Elements». chemguide.co.uk. Archived from the original on 27 June 2013. Retrieved 8 August 2013.
- ^ «Disposable Batteries — Choosing between Alkaline and Lithium Disposable Batteries». Batteryreview.org. Archived from the original on 6 January 2014. Retrieved 10 October 2013.
- ^ «Battery Anodes > Batteries & Fuel Cells > Research > The Energy Materials Center at Cornell». Emc2.cornell.edu. Archived from the original on 22 December 2013. Retrieved 10 October 2013.
- ^ Totten, George E.; Westbrook, Steven R. & Shah, Rajesh J. (2003). Fuels and lubricants handbook: technology, properties, performance, and testing. Vol. 1. ASTM International. p. 559. ISBN 978-0-8031-2096-9. Archived from the original on 23 July 2016.
- ^ Rand, Salvatore J. (2003). Significance of tests for petroleum products. ASTM International. pp. 150–152. ISBN 978-0-8031-2097-6. Archived from the original on 31 July 2016.
- ^ The Theory and Practice of Mold Fluxes Used in Continuous Casting: A Compilation of Papers on Continuous Casting Fluxes Given at the 61st and 62nd Steelmaking Conference, Iron and Steel Society
- ^ Lu, Y. Q.; Zhang, G. D.; Jiang, M. F.; Liu, H. X.; Li, T. (2011). «Effects of Li2CO3 on Properties of Mould Flux for High Speed Continuous Casting». Materials Science Forum. 675–677: 877–880. doi:10.4028/www.scientific.net/MSF.675-677.877. S2CID 136666669.
- ^ «Testing 1-2-3: Eliminating Veining Defects», Modern Casting, July 2014, archived from the original on 2 April 2015, retrieved 15 March 2015
- ^ Haupin, W. (1987), Mamantov, Gleb; Marassi, Roberto (eds.), «Chemical and Physical Properties of the Hall-Héroult Electrolyte», Molten Salt Chemistry: An Introduction and Selected Applications, Springer, p. 449
- ^ Garrett, Donald E. (5 April 2004). Handbook of Lithium and Natural Calcium Chloride. Academic Press. p. 200. ISBN 9780080472904. Archived from the original on 3 December 2016.
- ^ Prasad, N. Eswara; Gokhale, Amol; Wanhill, R. J. H. (20 September 2013). Aluminum-Lithium Alloys: Processing, Properties, and Applications. Butterworth-Heinemann. ISBN 9780124016798. Archived from the original on 1 January 2021. Retrieved 6 November 2020.
- ^ Davis, Joseph R. ASM International. Handbook Committee (1993). Aluminum and aluminum alloys. ASM International. pp. 121–. ISBN 978-0-87170-496-2. Archived from the original on 28 May 2013. Retrieved 16 May 2011.
- ^ Karki, Khim; Epstein, Eric; Cho, Jeong-Hyun; Jia, Zheng; Li, Teng; Picraux, S. Tom; Wang, Chunsheng; Cumings, John (2012). «Lithium-Assisted Electrochemical Welding in Silicon Nanowire Battery Electrodes» (PDF). Nano Letters. 12 (3): 1392–7. Bibcode:2012NanoL..12.1392K. doi:10.1021/nl204063u. PMID 22339576. Archived (PDF) from the original on 10 August 2017.
- ^ Koch, Ernst-Christian (2004). «Special Materials in Pyrotechnics: III. Application of Lithium and its Compounds in Energetic Systems». Propellants, Explosives, Pyrotechnics. 29 (2): 67–80. doi:10.1002/prep.200400032.
- ^ Wiberg, Egon; Wiberg, Nils and Holleman, Arnold Frederick (2001) Inorganic chemistry Archived 18 June 2016 at the Wayback Machine, Academic Press. ISBN 0-12-352651-5, p. 1089
- ^ Mulloth, L.M. & Finn, J.E. (2005). «Air Quality Systems for Related Enclosed Spaces: Spacecraft Air». The Handbook of Environmental Chemistry. Vol. 4H. pp. 383–404. doi:10.1007/b107253. ISBN 978-3-540-25019-7.
- ^ «Application of lithium chemicals for air regeneration of manned spacecraft». Lithium Corporation of America & Aerospace Medical Research Laboratories. 1965. Archived from the original on 7 October 2012.
- ^ Markowitz, M. M.; Boryta, D. A.; Stewart, Harvey (1964). «Lithium Perchlorate Oxygen Candle. Pyrochemical Source of Pure Oxygen». Industrial & Engineering Chemistry Product Research and Development. 3 (4): 321–30. doi:10.1021/i360012a016.
- ^ Hobbs, Philip C. D. (2009). Building Electro-Optical Systems: Making It All Work. John Wiley and Sons. p. 149. ISBN 978-0-470-40229-0. Archived from the original on 23 June 2016.
- ^ Point Defects in Lithium Fluoride Films Induced by Gamma Irradiation. Proceedings of the 7th International Conference on Advanced Technology & Particle Physics: (ICATPP-7): Villa Olmo, Como, Italy. Vol. 2001. World Scientific. 2002. p. 819. ISBN 978-981-238-180-4. Archived from the original on 6 June 2016.
- ^ Sinton, William M. (1962). «Infrared Spectroscopy of Planets and Stars». Applied Optics. 1 (2): 105. Bibcode:1962ApOpt…1..105S. doi:10.1364/AO.1.000105.
- ^ «You’ve got the power: the evolution of batteries and the future of fuel cells» (PDF). Toshiba. Archived (PDF) from the original on 17 July 2011. Retrieved 17 May 2009.
- ^ «Organometallics». IHS Chemicals. February 2012. Archived from the original on 7 July 2012. Retrieved 2 January 2012.
- ^ Yurkovetskii, A. V.; Kofman, V. L.; Makovetskii, K. L. (2005). «Polymerization of 1,2-dimethylenecyclobutane by organolithium initiators». Russian Chemical Bulletin. 37 (9): 1782–1784. doi:10.1007/BF00962487. S2CID 94017312.
- ^ Quirk, Roderic P.; Cheng, Pao Luo (1986). «Functionalization of polymeric organolithium compounds. Amination of poly(styryl)lithium». Macromolecules. 19 (5): 1291–1294. Bibcode:1986MaMol..19.1291Q. doi:10.1021/ma00159a001.
- ^ Stone, F. G. A.; West, Robert (1980). Advances in organometallic chemistry. Academic Press. p. 55. ISBN 978-0-12-031118-7. Archived from the original on 13 March 2021. Retrieved 6 November 2020.
- ^ Bansal, Raj K. (1996). Synthetic approaches in organic chemistry. p. 192. ISBN 978-0-7637-0665-4. Archived from the original on 18 June 2016.
- ^ (PDF). 28 June 2003 https://web.archive.org/web/20030628230627/http://media.armadilloaerospace.com/misc/LiAl-Hydride.pdf. Archived from the original (PDF) on 28 June 2003.
- ^ Hughes, T.G.; Smith, R.B. & Kiely, D.H. (1983). «Stored Chemical Energy Propulsion System for Underwater Applications». Journal of Energy. 7 (2): 128–133. Bibcode:1983JEner…7..128H. doi:10.2514/3.62644.
- ^ Emsley, John (2011). Nature’s Building Blocks.
- ^ Makhijani, Arjun & Yih, Katherine (2000). Nuclear Wastelands: A Global Guide to Nuclear Weapons Production and Its Health and Environmental Effects. MIT Press. pp. 59–60. ISBN 978-0-262-63204-1. Archived from the original on 13 June 2016.
- ^ National Research Council (U.S.). Committee on Separations Technology and Transmutation Systems (1996). Nuclear wastes: technologies for separations and transmutation. National Academies Press. p. 278. ISBN 978-0-309-05226-9. Archived from the original on 13 June 2016.
- ^ Barnaby, Frank (1993). How nuclear weapons spread: nuclear-weapon proliferation in the 1990s. Routledge. p. 39. ISBN 978-0-415-07674-6. Archived from the original on 9 June 2016.
- ^ Baesjr, C. (1974). «The chemistry and thermodynamics of molten salt reactor fuels». Journal of Nuclear Materials. 51 (1): 149–162. Bibcode:1974JNuM…51..149B. doi:10.1016/0022-3115(74)90124-X. OSTI 4470742. Archived from the original on 13 March 2021. Retrieved 28 June 2019.
- ^ Agarwal, Arun (2008). Nobel Prize Winners in Physics. APH Publishing. p. 139. ISBN 978-81-7648-743-6. Archived from the original on 29 June 2016.
- ^ «‘Splitting the Atom’: Cockcroft and Walton, 1932: 9. Rays or Particles?» Archived 2 September 2012 at the Wayback Machine Department of Physics, University of Cambridge
- ^ Elements, American. «Lithium-7 Metal Isotope». American Elements. Archived from the original on 18 August 2019.
- ^ a b Wald, Matthew L. (8 October 2013). «Report Says a Shortage of Nuclear Ingredient Looms». The New York Times. Archived from the original on 1 July 2017.
- ^ a b Kean, Sam (2011). The Disappearing Spoon.
- ^ Yacobi S; Ornoy A (2008). «Is lithium a real teratogen? What can we conclude from the prospective versus retrospective studies? A review». Isr J Psychiatry Relat Sci. 45 (2): 95–106. PMID 18982835.
- ^ Gomes-da-Costa, Susana; Marx, Wolfgang; Corponi, Filippo; et al. (2022). «Lithium therapy and weight change in people with bipolar disorder: A systematic review and meta-analysis». Neuroscience and Biobehavioral Reviews. 134: 104266. doi:10.1016/j.neubiorev.2021.07.011. ISSN 0149-7634. PMID 34265322. S2CID 235802599.
- ^ «Lithium 265969». Sigma-Aldrich. Archived from the original on 13 March 2021. Retrieved 1 October 2018.
- ^ Technical data for Lithium Archived 23 March 2015 at the Wayback Machine. periodictable.com
- ^ Furr, A. K. (2000). CRC handbook of laboratory safety. Boca Raton: CRC Press. pp. 244–246. ISBN 978-0-8493-2523-6. Archived from the original on 13 March 2021. Retrieved 6 November 2020.
External links
- McKinsey review of 2018
- Lithium at The Periodic Table of Videos (University of Nottingham)
- International Lithium Alliance
- USGS: Lithium Statistics and Information
- Lithium Supply & Markets 2009 IM Conference 2009 Sustainable lithium supplies through 2020 in the face of sustainable market growth
- University of Southampton, Mountbatten Centre for International Studies, Nuclear History Working Paper No5.
- Lithium preserves by Country at investingnews.com

Lithium floating in oil |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lithium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (LITH-ee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery-white | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Li) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lithium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 1: hydrogen and alkali metals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [He] 2s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 453.65 K (180.50 °C, 356.90 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 1603 K (1330 °C, 2426 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 0.534 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 0.512 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 3220 K, 67 MPa (extrapolated) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 3.00 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 136 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.860 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0[2], +1 (a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 0.98 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 128±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 182 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of lithium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered cubic (bcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 6000 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 46 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 84.8 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 92.8 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +14.2×10−6 cm3/mol (298 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 4.9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 4.2 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 11 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 0.6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 5 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-93-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Johan August Arfwedson (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | William Thomas Brande (1821) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of lithium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Lithium (from Greek: λίθος, romanized: lithos, lit. ‘stone’) is a chemical element with the symbol Li and atomic number 3. It is a soft, silvery-white alkali metal. Under standard conditions, it is the least dense metal and the least dense solid element. Like all alkali metals, lithium is highly reactive and flammable, and must be stored in vacuum, inert atmosphere, or inert liquid such as purified kerosene or mineral oil. When cut, it exhibits a metallic luster, but moist air corrodes it quickly to a dull silvery gray, then black tarnish. It never occurs freely in nature, but only in (usually ionic) compounds, such as pegmatitic minerals, which were once the main source of lithium. Due to its solubility as an ion, it is present in ocean water and is commonly obtained from brines. Lithium metal is isolated electrolytically from a mixture of lithium chloride and potassium chloride.
The nucleus of the lithium atom verges on instability, since the two stable lithium isotopes found in nature have among the lowest binding energies per nucleon of all stable nuclides. Because of its relative nuclear instability, lithium is less common in the solar system than 25 of the first 32 chemical elements even though its nuclei are very light: it is an exception to the trend that heavier nuclei are less common.[4] For related reasons, lithium has important uses in nuclear physics. The transmutation of lithium atoms to helium in 1932 was the first fully man-made nuclear reaction, and lithium deuteride serves as a fusion fuel in staged thermonuclear weapons.[5]
Lithium and its compounds have several industrial applications, including heat-resistant glass and ceramics, lithium grease lubricants, flux additives for iron, steel and aluminium production, lithium metal batteries, and lithium-ion batteries. These uses consume more than three-quarters of lithium production.
Lithium is present in biological systems in trace amounts; its functions are uncertain. Lithium salts have proven to be useful as a mood stabilizer and antidepressant in the treatment of mental illness such as bipolar disorder.
Properties
Atomic and physical
Lithium ingots with a thin layer of black nitride tarnish
The alkali metals are also called the lithium family, after its leading element. Like the other alkali metals (which are sodium (Na), potassium (K), rubidium (Rb), caesium (Cs), and francium (Fr)), lithium has a single valence electron that is easily given up to form a cation.[6] Because of this, lithium is a good conductor of heat and electricity as well as a highly reactive element, though it is the least reactive of the alkali metals. Lithium’s low reactivity is due to the proximity of its valence electron to its nucleus (the remaining two electrons are in the 1s orbital, much lower in energy, and do not participate in chemical bonds).[6] Molten lithium is significantly more reactive than its solid form.[7][8]
Lithium metal is soft enough to be cut with a knife. When cut, it possesses a silvery-white color that quickly changes to gray as it oxidizes to lithium oxide.[6] Its melting point of 180.50 °C (453.65 K; 356.90 °F)[9] and its boiling point of 1,342 °C (1,615 K; 2,448 °F)[9] are each the highest of all the alkali metals while its density of 0.534 g/cm3 is the lowest.
Lithium has a very low density (0.534 g/cm3), comparable with pine wood.[10] It is the least dense of all elements that are solids at room temperature; the next lightest solid element (potassium, at 0.862 g/cm3) is more than 60% denser. Apart from helium and hydrogen, as a solid it is less dense than any other element as a liquid, being only two-thirds as dense as liquid nitrogen (0.808 g/cm3).[11] Lithium can float on the lightest hydrocarbon oils and is one of only three metals that can float on water, the other two being sodium and potassium.
Lithium’s coefficient of thermal expansion is twice that of aluminium and almost four times that of iron.[12] Lithium is superconductive below 400 μK at standard pressure[13] and at higher temperatures (more than 9 K) at very high pressures (>20 GPa).[14] At temperatures below 70 K, lithium, like sodium, undergoes diffusionless phase change transformations. At 4.2 K it has a rhombohedral crystal system (with a nine-layer repeat spacing); at higher temperatures it transforms to face-centered cubic and then body-centered cubic. At liquid-helium temperatures (4 K) the rhombohedral structure is prevalent.[15] Multiple allotropic forms have been identified for lithium at high pressures.[16]
Lithium has a mass specific heat capacity of 3.58 kilojoules per kilogram-kelvin, the highest of all solids.[17][18] Because of this, lithium metal is often used in coolants for heat transfer applications.[17]
Isotopes
Naturally occurring lithium is composed of two stable isotopes, 6Li and 7Li, the latter being the more abundant (92.5% natural abundance).[6][19][20] Both natural isotopes have anomalously low nuclear binding energy per nucleon (compared to the neighboring elements on the periodic table, helium and beryllium); lithium is the only low numbered element that can produce net energy through nuclear fission. The two lithium nuclei have lower binding energies per nucleon than any other stable nuclides other than hydrogen-1, deuterium and helium-3.[21] As a result of this, though very light in atomic weight, lithium is less common in the Solar System than 25 of the first 32 chemical elements.[4] Seven radioisotopes have been characterized, the most stable being 8Li with a half-life of 838 ms and 9Li with a half-life of 178 ms. All of the remaining radioactive isotopes have half-lives that are shorter than 8.6 ms. The shortest-lived isotope of lithium is 4Li, which decays through proton emission and has a half-life of 7.6 × 10−23 s.[22] The 6Li isotope is one of only five stable nuclides to have both an odd number of protons and an odd number of neutrons, the other four stable odd-odd nuclides being hydrogen-2, boron-10, nitrogen-14, and tantalum-180m.[23]
7Li is one of the primordial elements (or, more properly, primordial nuclides) produced in Big Bang nucleosynthesis. A small amount of both 6Li and 7Li are produced in stars during stellar nucleosynthesis, but it is further «burned» as fast as produced.[24] 7Li can also be generated in carbon stars.[25] Additional small amounts of both 6Li and 7Li may be generated from solar wind, cosmic rays hitting heavier atoms, and from early solar system 7Be and 10Be radioactive decay.[26]
Lithium isotopes fractionate substantially during a wide variety of natural processes,[27] including mineral formation (chemical precipitation), metabolism, and ion exchange. Lithium ions substitute for magnesium and iron in octahedral sites in clay minerals, where 6Li is preferred to 7Li, resulting in enrichment of the light isotope in processes of hyperfiltration and rock alteration. The exotic 11Li is known to exhibit a neutron halo, with 2 neutrons orbiting around its nucleus of 3 protons and 6 neutrons. The process known as laser isotope separation can be used to separate lithium isotopes, in particular 7Li from 6Li.[28]
Nuclear weapons manufacture and other nuclear physics applications are a major source of artificial lithium fractionation, with the light isotope 6Li being retained by industry and military stockpiles to such an extent that it has caused slight but measurable change in the 6Li to 7Li ratios in natural sources, such as rivers. This has led to unusual uncertainty in the standardized atomic weight of lithium, since this quantity depends on the natural abundance ratios of these naturally-occurring stable lithium isotopes, as they are available in commercial lithium mineral sources.[29]
Both stable isotopes of lithium can be laser cooled and were used to produce the first quantum degenerate Bose-Fermi mixture.[30]
Occurrence
Lithium is about as common as chlorine in the Earth’s upper continental crust, on a per-atom basis.
Astronomical
Although it was synthesized in the Big Bang, lithium (together with beryllium and boron) is markedly less abundant in the universe than other elements. This is a result of the comparatively low stellar temperatures necessary to destroy lithium, along with a lack of common processes to produce it.[31]
According to modern cosmological theory, lithium—in both stable isotopes (lithium-6 and lithium-7)—was one of the three elements synthesized in the Big Bang.[32] Though the amount of lithium generated in Big Bang nucleosynthesis is dependent upon the number of photons per baryon, for accepted values the lithium abundance can be calculated, and there is a «cosmological lithium discrepancy» in the universe: older stars seem to have less lithium than they should, and some younger stars have much more.[33] The lack of lithium in older stars is apparently caused by the «mixing» of lithium into the interior of stars, where it is destroyed,[34] while lithium is produced in younger stars. Although it transmutes into two atoms of helium due to collision with a proton at temperatures above 2.4 million degrees Celsius (most stars easily attain this temperature in their interiors), lithium is more abundant than computations would predict in later-generation stars.[19]
Lithium is also found in brown dwarf substellar objects and certain anomalous orange stars. Because lithium is present in cooler, less-massive brown dwarfs, but is destroyed in hotter red dwarf stars, its presence in the stars’ spectra can be used in the «lithium test» to differentiate the two, as both are smaller than the Sun.[19][36][37] Certain orange stars can also contain a high concentration of lithium. Those orange stars found to have a higher than usual concentration of lithium (such as Centaurus X-4) orbit massive objects—neutron stars or black holes—whose gravity evidently pulls heavier lithium to the surface of a hydrogen-helium star, causing more lithium to be observed.[19]
On 27 May 2020, astronomers reported that classical nova explosions are galactic producers of lithium-7.[38][39]
Terrestrial
Although lithium is widely distributed on Earth, it does not naturally occur in elemental form due to its high reactivity.[6] The total lithium content of seawater is very large and is estimated as 230 billion tonnes, where the element exists at a relatively constant concentration of 0.14 to 0.25 parts per million (ppm),[40][41] or 25 micromolar;[42] higher concentrations approaching 7 ppm are found near hydrothermal vents.[41]
Estimates for the Earth’s crustal content range from 20 to 70 ppm by weight.[43] Lithium constitutes about 0.002 percent of Earth’s crust.[44] In keeping with its name, lithium forms a minor part of igneous rocks, with the largest concentrations in granites. Granitic pegmatites also provide the greatest abundance of lithium-containing minerals, with spodumene and petalite being the most commercially viable sources.[43] Another significant mineral of lithium is lepidolite which is now an obsolete name for a series formed by polylithionite and trilithionite.[45][46] A newer source for lithium is hectorite clay, the only active development of which is through the Western Lithium Corporation in the United States.[47] At 20 mg lithium per kg of Earth’s crust,[48] lithium is the 25th most abundant element.
According to the Handbook of Lithium and Natural Calcium, «Lithium is a comparatively rare element, although it is found in many rocks and some brines, but always in very low concentrations. There are a fairly large number of both lithium mineral and brine deposits but only comparatively few of them are of actual or potential commercial value. Many are very small, others are too low in grade.»[49]
Chile is estimated (2020) to have the largest reserves by far (9.2 million tonnes),[50] and Australia the highest annual production (40,000 tonnes).[50] One of the largest reserve bases[note 1] of lithium is in the Salar de Uyuni area of Bolivia, which has 5.4 million tonnes. Other major suppliers include Australia, Argentina and China.[51][52] As of 2015, the Czech Geological Survey considered the entire Ore Mountains in the Czech Republic as lithium province. Five deposits are registered, one near Cínovec [cs] is considered as a potentially economical deposit, with 160 000 tonnes of lithium.[53] In December 2019, Finnish mining company Keliber Oy reported its Rapasaari lithium deposit has estimated proven and probable ore reserves of 5.280 million tonnes.[54]
In June 2010, The New York Times reported that American geologists were conducting ground surveys on dry salt lakes in western Afghanistan believing that large deposits of lithium are located there.[55] These estimates are «based principally on old data, which was gathered mainly by the Soviets during their occupation of Afghanistan from 1979–1989».[56] The Department of Defense estimated the lithium reserves in Afghanistan to amount to the ones in Bolivia and dubbed it as a potential «Saudi-Arabia of lithium».[57] In Cornwall, England, the presence of brine rich in lithium was well known due to the region’s historic mining industry, and private investors have conducted tests to investigate potential lithium extraction in this area.[58][59]
Biological
Lithium is found in trace amount in numerous plants, plankton, and invertebrates, at concentrations of 69 to 5,760 parts per billion (ppb). In vertebrates the concentration is slightly lower, and nearly all vertebrate tissue and body fluids contain lithium ranging from 21 to 763 ppb.[41] Marine organisms tend to bioaccumulate lithium more than terrestrial organisms.[60] Whether lithium has a physiological role in any of these organisms is unknown.[41]
Studies of lithium concentrations in mineral-rich soil give ranges between around 0.1 and 50−100 ppm, with some concentrations as high as 100−400 ppm, although it is unlikely that all of it is available for uptake by plants.[61] Lithium concentration in plant tissue is typically around 1 ppm, with some plant families bioaccumulating more lithium than others; lithium accumulation does not appear to affect the essential nutrient composition of plants.[61] Tolerance to lithium varies by plant species and typically parallels sodium tolerance; maize and Rhodes grass, for example, are highly tolerant to lithium injury while avocado and soybean are very sensitive.[61] Similarly, lithium at concentrations of 5 ppm reduces seed germination in some species (e.g. Asian rice and chickpea) but not in others (e.g. barley and wheat).[61]
Many of lithium’s major biological effects can be explained by its competition with other ions.[62]
The monovalent lithium ion Li+
competes with other ions such as sodium (immediately below lithium on the periodic table), which like lithium is also a monovalent alkali metal.
Lithium also competes with bivalent magnesium ions, whose ionic radius (86 pm) is approximately that of the lithium ion[62] (90 pm).
Mechanisms that transport sodium across cellular membranes also transport lithium.
For instance, sodium channels (both voltage-gated and epithelial) are particularly major pathways of entry for lithium.[62]
Lithium ions can also permeate through ligand-gated ion channels as well as cross both nuclear and mitochondrial membranes.[62]
Like sodium, lithium can enter and partially block (although not permeate) potassium channels and calcium channels.[62]
The biological effects of lithium are many and varied but its mechanisms of action are only partially understood.[63]
For instance, studies of lithium-treated patients with bipolar disorder show that, among many other effects, lithium partially reverses telomere shortening in these patients and also increases mitochondrial function, although how lithium produces these pharmacological effects is not understood.[63][64]
Even the exact mechanisms involved in lithium toxicity are not fully understood.
History
Johan August Arfwedson is credited with the discovery of lithium in 1817
Petalite (LiAlSi4O10) was discovered in 1800 by the Brazilian chemist and statesman José Bonifácio de Andrada e Silva in a mine on the island of Utö, Sweden.[65][66][67][68] However, it was not until 1817 that Johan August Arfwedson, then working in the laboratory of the chemist Jöns Jakob Berzelius, detected the presence of a new element while analyzing petalite ore.[69][70][71][72] This element formed compounds similar to those of sodium and potassium, though its carbonate and hydroxide were less soluble in water and less alkaline.[73] Berzelius gave the alkaline material the name «lithion/lithina«, from the Greek word λιθoς (transliterated as lithos, meaning «stone»), to reflect its discovery in a solid mineral, as opposed to potassium, which had been discovered in plant ashes, and sodium, which was known partly for its high abundance in animal blood. He named the metal inside the material «lithium».[6][67][72]
Arfwedson later showed that this same element was present in the minerals spodumene and lepidolite.[74][67] In 1818, Christian Gmelin was the first to observe that lithium salts give a bright red color to flame.[67][75] However, both Arfwedson and Gmelin tried and failed to isolate the pure element from its salts.[67][72][76] It was not isolated until 1821, when William Thomas Brande obtained it by electrolysis of lithium oxide, a process that had previously been employed by the chemist Sir Humphry Davy to isolate the alkali metals potassium and sodium.[19][76][77][78][79] Brande also described some pure salts of lithium, such as the chloride, and, estimating that lithia (lithium oxide) contained about 55% metal, estimated the atomic weight of lithium to be around 9.8 g/mol (modern value ~6.94 g/mol).[80] In 1855, larger quantities of lithium were produced through the electrolysis of lithium chloride by Robert Bunsen and Augustus Matthiessen.[67][81] The discovery of this procedure led to commercial production of lithium in 1923 by the German company Metallgesellschaft AG, which performed an electrolysis of a liquid mixture of lithium chloride and potassium chloride.[67][82][83]
Australian psychiatrist John Cade is credited with reintroducing and popularizing the use of lithium to treat mania in 1949.[84] Shortly after, throughout the mid 20th century, lithium’s mood stabilizing applicability for mania and depression took off in Europe and the United States.
The production and use of lithium underwent several drastic changes in history. The first major application of lithium was in high-temperature lithium greases for aircraft engines and similar applications in World War II and shortly after. This use was supported by the fact that lithium-based soaps have a higher melting point than other alkali soaps, and are less corrosive than calcium based soaps. The small demand for lithium soaps and lubricating greases was supported by several small mining operations, mostly in the US.
The demand for lithium increased dramatically during the Cold War with the production of nuclear fusion weapons. Both lithium-6 and lithium-7 produce tritium when irradiated by neutrons, and are thus useful for the production of tritium by itself, as well as a form of solid fusion fuel used inside hydrogen bombs in the form of lithium deuteride. The US became the prime producer of lithium between the late 1950s and the mid-1980s. At the end, the stockpile of lithium was roughly 42,000 tonnes of lithium hydroxide. The stockpiled lithium was depleted in lithium-6 by 75%, which was enough to affect the measured atomic weight of lithium in many standardized chemicals, and even the atomic weight of lithium in some «natural sources» of lithium ion which had been «contaminated» by lithium salts discharged from isotope separation facilities, which had found its way into ground water.[29][85]
Lithium is used to decrease the melting temperature of glass and to improve the melting behavior of aluminium oxide in the Hall-Héroult process.[86][87] These two uses dominated the market until the middle of the 1990s. After the end of the nuclear arms race, the demand for lithium decreased and the sale of department of energy stockpiles on the open market further reduced prices.[85] In the mid-1990s, several companies started to isolate lithium from brine which proved to be a less expensive option than underground or open-pit mining. Most of the mines closed or shifted their focus to other materials because only the ore from zoned pegmatites could be mined for a competitive price. For example, the US mines near Kings Mountain, North Carolina closed before the beginning of the 21st century.
The development of lithium ion batteries increased the demand for lithium and became the dominant use in 2007.[88] With the surge of lithium demand in batteries in the 2000s, new companies have expanded brine isolation efforts to meet the rising demand.[89][90]
It has been argued that lithium will be one of the main objects of geopolitical competition in a world running on renewable energy and dependent on batteries, but this perspective has also been criticised for underestimating the power of economic incentives for expanded production.[91]
Chemistry
«Lithium salt» redirects here. For Lithium salts used in medication, see Lithium (medication).
Of lithium metal
Lithium reacts with water easily, but with noticeably less vigor than other alkali metals. The reaction forms hydrogen gas and lithium hydroxide.[6] When placed over a flame, lithium compounds give off a striking crimson color, but when the metal burns strongly, the flame becomes a brilliant silver. Lithium will ignite and burn in oxygen when exposed to water or water vapor. In moist air, lithium rapidly tarnishes to form a black coating of lithium hydroxide (LiOH and LiOH·H2O), lithium nitride (Li3N) and lithium carbonate (Li2CO3, the result of a secondary reaction between LiOH and CO2).[43] Lithium is one of the few metals that react with nitrogen gas.[92][93]
Because of its reactivity with water, and especially nitrogen, lithium metal is usually stored in a hydrocarbon sealant, often petroleum jelly. Although the heavier alkali metals can be stored under mineral oil, lithium is not dense enough to fully submerge itself in these liquids.[19]
Lithium has a diagonal relationship with magnesium, an element of similar atomic and ionic radius. Chemical resemblances between the two metals include the formation of a nitride by reaction with N2, the formation of an oxide (Li
2O) and peroxide (Li
2O
2) when burnt in O2, salts with similar solubilities, and thermal instability of the carbonates and nitrides.[43][94] The metal reacts with hydrogen gas at high temperatures to produce lithium hydride (LiH).[95]
Lithium forms a variety of binary and ternary materials by direct reaction with the main group elements. These Zintl phases, although highly covalent, can be viewed as salts of polyatomic anions such as Si44-, P73-, and Te52-. With graphite, lithium forms a variety of intercalation compounds.[94]
It dissolves in ammonia (and amines) to give [Li(NH3)4]+ and the solvated electron.[94]
Inorganic compounds
Lithium forms salt-like derivatives with all halides and pseudohalides. Some examples include the halides LiF, LiCl, LiBr, LiI, as well as the pseudohalides and related anions. Lithium carbonate has been described as the most important compound of lithium.[94] This white solid is the principal product of beneficiation of lithium ores. It is a precursor to other salts including ceramics and materials for lithium batteries.
The compounds LiBH
4 and LiAlH
4 are useful reagents. These salts and many other lithium salts exhibit distinctively high solubility in ethers, in contrast with salts of heavier alkali metals.
In aqueous solution, the coordination complex [Li(H2O)4]+ predominates for many lithium salts. Related complexes are known with amines and ethers.
Organic chemistry
Organolithium compounds are numerous and useful. They are defined by the presence of a bond between carbon and lithium. They serve as metal-stabilized carbanions, although their solution and solid-state structures are more complex than this simplistic view.[96] Thus, these are extremely powerful bases and nucleophiles. They have also been applied in asymmetric synthesis in the pharmaceutical industry. For laboratory organic synthesis, many organolithium reagents are commercially available in solution form. These reagents are highly reactive, and are sometimes pyrophoric.
Like its inorganic compounds, almost all organic compounds of lithium formally follow the duet rule (e.g., BuLi, MeLi). However, it is important to note that in the absence of coordinating solvents or ligands, organolithium compounds form dimeric, tetrameric, and hexameric clusters (e.g., BuLi is actually [BuLi]6 and MeLi is actually [MeLi]4) which feature multi-center bonding and increase the coordination number around lithium. These clusters are broken down into smaller or monomeric units in the presence of solvents like dimethoxyethane (DME) or ligands like tetramethylethylenediamine (TMEDA).[97] As an exception to the duet rule, a two-coordinate lithate complex with four electrons around lithium, [Li(thf)4]+[((Me3Si)3C)2Li]–, has been characterized crystallographically.[98]
Production
| Country | Production | Reserves[note 1] | Resources |
|---|---|---|---|
| Argentina | 6,200 | 1,900,000 | 19,300,000 |
| Australia | 40,000 | 4,700,000 | 6,400,000 |
| Austria | — | — | 50,000 |
| Bolivia | — | — | 21,000,000 |
| Brazil | 1,900 | 95,000 | 470,000 |
| Canada | 0 | 530,000 | 2,900,000 |
| Chile | 18,000 | 9,200,000 | 9,600,000 |
| China | 14,000 | 1,500,000 | 5,100,000 |
| Czech Republic | — | — | 1,300,000 |
| DR Congo | — | — | 3,000,000 |
| Finland | — | — | 50,000 |
| Germany | — | — | 2,700,000 |
| Ghana | — | — | 90,000 |
| Kazakhstan | — | — | 50,000 |
| Mali | — | — | 700,000 |
| Mexico | — | — | 1,700,000 |
| Namibia | — | — | 50,000 |
| Peru | — | — | 880,000 |
| Portugal | 900 | 60,000 | 270,000 |
| Serbia | — | — | 1,200,000 |
| Spain | — | — | 300,000 |
| United States | 870[note 2] | 750,000 | 7,900,000 |
| Zimbabwe | 1,200 | 220,000 | 500,000 |
| World total | 82,000 | 21,000,000 | 86,000,000+ |
Lithium production has greatly increased since the end of World War II. The main sources of lithium are brines and ores.
Lithium metal is produced through electrolysis applied to a mixture of fused 55% lithium chloride and 45% potassium chloride at about 450 °C.[99]
Reserves and occurrence
Scatter plots of lithium grade and tonnage for selected world deposits, as of 2017
The US Geological Survey (USGS) estimated worldwide identified lithium reserves in 2020 and 2021 to be 17 million and 21 million tonnes, respectively.[51][50] An accurate estimate of world lithium reserves is difficult.[100][101] One reason for this is that most lithium classification schemes are developed for solid ore deposits, whereas brine is a fluid that is problematic to treat with the same classification scheme due to varying concentrations and pumping effects.[102]
Following a hike in lithium price in 2015 and concern for insufficiency of lithium resource for the growing lithium-ion battery industry, a peer-reviewed analysis of USGS data in 2017 predicted that there will be no shortage of lithium and current estimates of reserves will increase along with the demand.[103] Worldwide lithium resources identified by USGS started to increase in 2017 owing to continuing exploration. Identified resources in 2016, 2017, 2018, 2019 and 2020 were 41, 47, 54, 62 and 80 million tonnes, respectively.[51]
In 2013, the world was estimated to contain about 15 million tonnes of lithium reserves, while 65 million tonnes of known resources were reasonable. 75% of lithium reserves could be found in the ten largest deposits of the world.[104] Another study noted that 83% of the geological resources of lithium are located in six brine, two pegmatite, and two sedimentary deposits.[105]
In the US, lithium is recovered from brine pools in Nevada.[17] A deposit discovered in 2013 in Wyoming’s Rock Springs Uplift is estimated to contain 228,000 tons. Additional deposits in the same formation were estimated to be as much as 18 million tons.[106] Similarly in Nevada, the McDermitt Caldera hosts lithium-bearing volcanic muds that consist of the largest known deposits of lithium within the United States.[107]
Lithium triangle
The world’s top four lithium-producing countries from 2019, as reported by the US Geological Survey are Australia, Chile, China and Argentina.[51]
The three countries of Chile, Bolivia, and Argentina make up a region known as the Lithium Triangle. The Lithium Triangle is known for its high-quality salt flats, which include Bolivia’s Salar de Uyuni, Chile’s Salar de Atacama, and Argentina’s Salar de Arizaro. The Lithium Triangle is believed to contain over 75% of existing known lithium reserves.[108] Deposits are also found in South America throughout the Andes mountain chain. Chile is the leading producer, followed by Argentina. Both countries recover lithium from brine pools. According to USGS, Bolivia’s Uyuni Desert has 5.4 million tonnes of lithium.[109][110] Half the world’s known reserves are located in Bolivia along the central eastern slope of the Andes. The Bolivian government has invested US$900 million and in 2021 successfully produced 540 tons[111][109] The brines in the salt pans of the Lithium Triangle vary widely in lithium content.[112] Concentrations can also vary in time as brines are fluids that are changeable and mobile.[112]
Since 2018 the Democratic Republic of Congo is known to have the largest lithium spodumene hard-rock deposit in the world.[113] The deposit located in Manono, DRC, may hold up to 1.5 billion tons of lithium spodumene hard-rock. The two largest pegmatites (known as the Carriere de l’Este Pegmatite and the Roche Dure Pegmatite) are each of similar size or larger than the famous Greenbushes Pegmatite in Western Australia. Thus, the Democratic Republic of Congo is expected to be a significant supplier of lithium to the world with its high grade and low impurities.
According to a later 2011 study by Lawrence Berkeley National Laboratory and the University of California, Berkeley, the then-estimated reserve base of lithium should not be a limiting factor for large-scale battery production for electric vehicles because an estimated 1 billion 40 kWh Li-based batteries could be built with those reserves[114] — about 10 kg of lithium per car.[115] Another 2011 study at the University of Michigan and Ford Motor Company found enough resources to support global demand until 2100, including the lithium required for the potential widespread transportation use. The study estimated global reserves at 39 million tons, and total demand for lithium during the 90-year period annualized at 12–20 million tons, depending on the scenarios regarding economic growth and recycling rates.[116]
In 2014, The Financialist stated that demand for lithium was growing at more than 12% a year. According to Credit Suisse, this rate exceeded projected availability by 25%. The publication compared the 2014 lithium situation with oil, whereby «higher oil prices spurred investment in expensive deepwater and oil sands production techniques»; that is, the price of lithium would continue to rise until more expensive production methods that could boost total output would receive the attention of investors.[117]
On 16 July 2018 2.5 million tonnes of high-grade lithium resources and 124 million pounds of uranium resources were found in the Falchani hard rock deposit in the region Puno, Peru.[118]
In 2020, Australia granted Major Project Status (MPS) to the Finniss Lithium Project for a strategically important lithium deposit: an estimated 3.45 million tonnes (Mt) of mineral resource at 1.4 percent lithium oxide.[119][120] Operational mining began in 2022.[121]
In 2019, world production of lithium from spodumene was around 80,000t per annum, primarily from the Greenbushes pegmatite and from some Chinese and Chilean sources. The Talison mine in Greenbushes is reported to be the largest and to have the highest grade of ore at 2.4% Li2O (2012 figures).[122]
Oceans are estimated to contain 230 billion tons of lithium,[123] but the concentration is 0.1-0.2ppm, making it more expensive to isolate with 2020 technology than from land based brine and rock.
Sources
Another potential source of lithium as of 2012 was identified as the leachates of geothermal wells, which are carried to the surface.[124] Recovery of this type of lithium has been demonstrated in the field; the lithium is separated by simple filtration.[125][clarification needed] Reserves are more limited than those of brine reservoirs and hard rock.[citation needed]
Pricing
In 1998, the price of lithium metal was about 95 USD/kg (or US$43/lb).[126] After the 2007 financial crisis, major suppliers, such as Sociedad Química y Minera (SQM), dropped lithium carbonate pricing by 20%.[127] Prices rose in 2012. A 2012 Business Week article outlined an oligopoly in the lithium space: «SQM, controlled by billionaire Julio Ponce, is the second-largest, followed by Rockwood, which is backed by Henry Kravis’s KKR & Co., and Philadelphia-based FMC», with Talison mentioned as the biggest producer.[128] Global consumption may jump to 300,000 metric tons a year by 2020[failed verification] from about 150,000 tons in 2012, to match the demand for lithium batteries that has been growing at about 25% a year, outpacing the 4% to 5% overall gain in lithium production.[128][needs update]
The price information service ISE — Institute of Rare Earths Elements and Strategic Metals — gives for various lithium substances in the average of the last six months (March to August 2022) the following kilo prices stable in the course: Lithium Carbonate, purity 99.5%min, from various producers between 63 and 72 EUR/kg. Lithium Hydroxide Monohydrate LiOH 56.5%min, China, at 66 to 72 EUR/kg; Delivered South Korea — 73 EUR/kg. Lithium Metal 99.9%min, Delivered China — 42 EUR/kg.[129]
Analyses of the extraction of lithium from seawater, published in 1975
Lithium and its compounds were historically isolated and extracted from hard rock but by the 1990s mineral springs, brine pools, and brine deposits had become the dominant source.[citation needed] Most of these were in Chile, Argentina and Bolivia.[50] Large lithium-clay deposits under development in the McDermitt caldera (Nevada, United States) require concentrated sulfuric acid to leach lithium from the clay ore.[130]
By early 2021, much of the lithium mined globally comes from either «spodumene, the mineral contained in hard rocks found in places such as Australia and North Carolina»[131] or from the salty brine pumped directly out of the ground, as it is in locations in Chile.[131][112] In Chile’s Salar de Atacama, the lithium concentration in the brine is raised by solar evaporation in a system of ponds.[112] The enrichment by evaporation process may require up to one-and-a-half years, when the brine reaches a lithium content of 6%.[112] The final processing in this example is done near the city of Antofagasta on the coast where pure lithium carbonate, lithium hydroxide, and lithium chloride are produced from the brine.[112]
Low-cobalt cathodes for lithium batteries are expected to require lithium hydroxide rather than lithium carbonate as a feedstock, and this trend favors rock as a source.[132][133][134]
The use of electrodialysis and electrochemical intercalation has been proposed to extract lithium compounds from seawater (which contains lithium at 0.2 parts per million), but it is not yet commercially viable.[135][136][137]
Environmental issues
The manufacturing processes of lithium, including the solvent and mining waste, presents significant environmental and health hazards.[138][139][140]
Lithium extraction can be fatal to aquatic life due to water pollution.[141] It is known to cause surface water contamination, drinking water contamination, respiratory problems, ecosystem degradation and landscape damage.[138] It also leads to unsustainable water consumption in arid regions (1.9 million liters per ton of lithium).[138] Massive byproduct generation of lithium extraction also presents unsolved problems, such as large amounts of magnesium and lime waste.[142]
In the United States, there is active competition between environmentally catastrophic open-pit mining, mountaintop removal mining and less damaging brine extraction mining in an effort to drastically expand domestic lithium mining capacity.[143] Environmental concerns include wildlife habitat degradation, potable water pollution including arsenic and antimony contamination, unsustainable water table reduction, and massive mining waste, including radioactive uranium byproduct and sulfuric acid discharge.
Human rights issues
A study of relationships between lithium extraction companies and indigenous peoples in Argentina indicated that the state may not have protected indigenous peoples’ right to free prior and informed consent, and that extraction companies generally controlled community access to information and set the terms for discussion of the projects and benefit sharing.[144]
Development of the Thacker Pass lithium mine in Nevada, United States, has met with protests and lawsuits from several indigenous tribes who have said they were not provided free prior and informed consent and that the project threatens cultural and sacred sites.[145] They have also expressed concerns that development of the project will create risks to indigenous women, because resource extraction is linked to missing and murdered indigenous women.[146] Protestors have been occupying the site of the proposed mine since January, 2021.[147][143]
Applications
Estimates of global lithium uses in 2011 (picture) and 2019 (numbers below)[148][149]
Ceramics and glass (18%)
Batteries (65%)
Lubricating greases (5%)
Continuous casting (3%)
Air treatment (1%)
Polymers
Primary aluminum production
Pharmaceuticals
Other (5%)
Batteries
In 2021, most lithium is used to make lithium-ion batteries for electric cars and mobile devices.
Ceramics and glass
Lithium oxide is widely used as a flux for processing silica, reducing the melting point and viscosity of the material and leading to glazes with improved physical properties including low coefficients of thermal expansion. Worldwide, this is one of the largest use for lithium compounds.[148][150] Glazes containing lithium oxides are used for ovenware. Lithium carbonate (Li2CO3) is generally used in this application because it converts to the oxide upon heating.[151]
Electrical and electronic
|
This section needs expansion with: beyond concerns about only lithium carbonate in the second paragraph. Lithium carbonate is simply not close to the most economically interesting lithium++ battery chemistry by late in the 2010s. You can help by adding to it. (March 2021) |
Late in the 20th century, lithium became an important component of battery electrolytes and electrodes, because of its high electrode potential. Because of its low atomic mass, it has a high charge- and power-to-weight ratio. A typical lithium-ion battery can generate approximately 3 volts per cell, compared with 2.1 volts for lead-acid and 1.5 volts for zinc-carbon. Lithium-ion batteries, which are rechargeable and have a high energy density, differ from lithium metal batteries, which are disposable (primary) batteries with lithium or its compounds as the anode.[152][153] Other rechargeable batteries that use lithium include the lithium-ion polymer battery, lithium iron phosphate battery, and the nanowire battery.
Over the years opinions have been differing about potential growth. A 2008 study concluded that «realistically achievable lithium carbonate production would be sufficient for only a small fraction of future PHEV and EV global market requirements», that «demand from the portable electronics sector will absorb much of the planned production increases in the next decade», and that «mass production of lithium carbonate is not environmentally sound, it will cause irreparable ecological damage to ecosystems that should be protected and that LiIon propulsion is incompatible with the notion of the ‘Green Car'».[52]
Lubricating greases
The third most common use of lithium is in greases. Lithium hydroxide is a strong base and, when heated with a fat, produces a soap made of lithium stearate. Lithium soap has the ability to thicken oils, and it is used to manufacture all-purpose, high-temperature lubricating greases.[17][154][155]
Metallurgy
Lithium (e.g. as lithium carbonate) is used as an additive to continuous casting mould flux slags where it increases fluidity,[156][157] a use which accounts for 5% of global lithium use (2011).[51] Lithium compounds are also used as additives (fluxes) to foundry sand for iron casting to reduce veining.[158]
Lithium (as lithium fluoride) is used as an additive to aluminium smelters (Hall–Héroult process), reducing melting temperature and increasing electrical resistance,[159] a use which accounts for 3% of production (2011).[51]
When used as a flux for welding or soldering, metallic lithium promotes the fusing of metals during the process[160] and eliminates the forming of oxides by absorbing impurities.[161] Alloys of the metal with aluminium, cadmium, copper and manganese are used to make high-performance, low density aircraft parts (see also Lithium-aluminium alloys).[162]
Silicon nano-welding
Lithium has been found effective in assisting the perfection of silicon nano-welds in electronic components for electric batteries and other devices.[163]
Lithium use in flares and pyrotechnics is due to its rose-red flame.[164]
Pyrotechnics
Lithium compounds are used as pyrotechnic colorants and oxidizers in red fireworks and flares.[17][165]
Air purification
Lithium chloride and lithium bromide are hygroscopic and are used as desiccants for gas streams.[17] Lithium hydroxide and lithium peroxide are the salts most used in confined areas, such as aboard spacecraft and submarines, for carbon dioxide removal and air purification. Lithium hydroxide absorbs carbon dioxide from the air by forming lithium carbonate, and is preferred over other alkaline hydroxides for its low weight.
Lithium peroxide (Li2O2) in presence of moisture not only reacts with carbon dioxide to form lithium carbonate, but also releases oxygen.[166][167] The reaction is as follows:
- 2 Li2O2 + 2 CO2 → 2 Li2CO3 + O2.
Some of the aforementioned compounds, as well as lithium perchlorate, are used in oxygen candles that supply submarines with oxygen. These can also include small amounts of boron, magnesium, aluminum, silicon, titanium, manganese, and iron.[168]
Optics
Lithium fluoride, artificially grown as crystal, is clear and transparent and often used in specialist optics for IR, UV and VUV (vacuum UV) applications. It has one of the lowest refractive indexes and the furthest transmission range in the deep UV of most common materials.[169] Finely divided lithium fluoride powder has been used for thermoluminescent radiation dosimetry (TLD): when a sample of such is exposed to radiation, it accumulates crystal defects which, when heated, resolve via a release of bluish light whose intensity is proportional to the absorbed dose, thus allowing this to be quantified.[170] Lithium fluoride is sometimes used in focal lenses of telescopes.[17][171]
The high non-linearity of lithium niobate also makes it useful in non-linear optics applications. It is used extensively in telecommunication products such as mobile phones and optical modulators, for such components as resonant crystals. Lithium applications are used in more than 60% of mobile phones.[172]
Organic and polymer chemistry
Organolithium compounds are widely used in the production of polymer and fine-chemicals. In the polymer industry, which is the dominant consumer of these reagents, alkyl lithium compounds are catalysts/initiators.[173] in anionic polymerization of unfunctionalized olefins.[174][175][176] For the production of fine chemicals, organolithium compounds function as strong bases and as reagents for the formation of carbon-carbon bonds. Organolithium compounds are prepared from lithium metal and alkyl halides.[177]
Many other lithium compounds are used as reagents to prepare organic compounds. Some popular compounds include lithium aluminium hydride (LiAlH4), lithium triethylborohydride, n-butyllithium and tert-butyllithium.
The launch of a torpedo using lithium as fuel
Military
Metallic lithium and its complex hydrides, such as Li[AlH4], are used as high-energy additives to rocket propellants.[19] Lithium aluminum hydride can also be used by itself as a solid fuel.[178]
The Mark 50 torpedo stored chemical energy propulsion system (SCEPS) uses a small tank of sulfur hexafluoride, which is sprayed over a block of solid lithium. The reaction generates heat, creating steam to propel the torpedo in a closed Rankine cycle.[179]
Lithium hydride containing lithium-6 is used in thermonuclear weapons, where it serves as fuel for the fusion stage of the bomb.[180]
Nuclear
Lithium-6 is valued as a source material for tritium production and as a neutron absorber in nuclear fusion. Natural lithium contains about 7.5% lithium-6 from which large amounts of lithium-6 have been produced by isotope separation for use in nuclear weapons.[181] Lithium-7 gained interest for use in nuclear reactor coolants.[182]
Lithium deuteride was used as fuel in the Castle Bravo nuclear device.
Lithium deuteride was the fusion fuel of choice in early versions of the hydrogen bomb. When bombarded by neutrons, both 6Li and 7Li produce tritium — this reaction, which was not fully understood when hydrogen bombs were first tested, was responsible for the runaway yield of the Castle Bravo nuclear test. Tritium fuses with deuterium in a fusion reaction that is relatively easy to achieve. Although details remain secret, lithium-6 deuteride apparently still plays a role in modern nuclear weapons as a fusion material.[183]
Lithium fluoride, when highly enriched in the lithium-7 isotope, forms the basic constituent of the fluoride salt mixture LiF-BeF2 used in liquid fluoride nuclear reactors. Lithium fluoride is exceptionally chemically stable and LiF-BeF2 mixtures have low melting points. In addition, 7Li, Be, and F are among the few nuclides with low enough thermal neutron capture cross-sections not to poison the fission reactions inside a nuclear fission reactor.[note 3][184]
In conceptualized (hypothetical) nuclear fusion power plants, lithium will be used to produce tritium in magnetically confined reactors using deuterium and tritium as the fuel. Naturally occurring tritium is extremely rare, and must be synthetically produced by surrounding the reacting plasma with a ‘blanket’ containing lithium where neutrons from the deuterium-tritium reaction in the plasma will fission the lithium to produce more tritium:
- 6Li + n → 4He + 3H.
Lithium is also used as a source for alpha particles, or helium nuclei. When 7Li is bombarded by accelerated protons 8Be is formed, which almost immediately undergoes fission to form two alpha particles. This feat, called «splitting the atom» at the time, was the first fully man-made nuclear reaction. It was produced by Cockroft and Walton in 1932.[185][186]
In 2013, the US Government Accountability Office said a shortage of lithium-7 critical to the operation of 65 out of 100 American nuclear reactors «places their ability to continue to provide electricity at some risk». Castle Bravo first used lithium-7, in the Shrimp, its first device, which weighed only 10 tons, and generated massive nuclear atmospheric contamination of Bikini Atoll. This perhaps accounts for the decline of US nuclear infrastructure.[187] The equipment needed to separate lithium-6 from lithium-7 is mostly a cold war leftover. The US shut down most of this machinery in 1963, when it had a huge surplus of separated lithium, mostly consumed during the twentieth century. The report said it would take five years and $10 million to $12 million to reestablish the ability to separate lithium-6 from lithium-7.[188]
Reactors that use lithium-7 heat water under high pressure and transfer heat through heat exchangers that are prone to corrosion. The reactors use lithium to counteract the corrosive effects of boric acid, which is added to the water to absorb excess neutrons.[188]
Medicine
Lithium is useful in the treatment of bipolar disorder.[189] Lithium salts may also be helpful for related diagnoses, such as schizoaffective disorder and cyclic major depression. The active part of these salts is the lithium ion Li+.[189] Lithium may increase the risk of developing Ebstein’s cardiac anomaly in infants born to women who take lithium during the first trimester of pregnancy.[190]
A 2022 review indicated that lithium therapy during treatment of bipolar disorder does not affect body weight.[191]
Precautions
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H260, H314 |
|
Precautionary statements |
P223, P231+P232, P280, P305+P351+P338, P370+P378, P422[192] |
| NFPA 704 (fire diamond) |
[193] 3 2 2
|
Lithium metal is corrosive and requires special handling to avoid skin contact. Breathing lithium dust or lithium compounds (which are often alkaline) initially irritate the nose and throat, while higher exposure can cause a buildup of fluid in the lungs, leading to pulmonary edema. The metal itself is a handling hazard because contact with moisture produces the caustic lithium hydroxide. Lithium is safely stored in non-reactive compounds such as naphtha.[194]
See also
- Cosmological lithium problem
- Dilithium
- Halo nucleus
- Isotopes of lithium
- List of countries by lithium production
- Lithia water
- Lithium–air battery
- Lithium burning
- Lithium compounds (category)
- Lithium-ion battery
- Lithium Tokamak Experiment
Notes
- ^ a b Appendixes Archived 6 November 2011 at the Wayback Machine. By USGS definitions, the reserve base «may encompass those parts of the resources that have a reasonable potential for becoming economically available within planning horizons beyond those that assume proven technology and current economics. The reserve base includes those resources that are currently economic (reserves), marginally economic (marginal reserves), and some of those that are currently subeconomic (subeconomic resources).»
- ^ In 2013
- ^ Beryllium and fluorine occur only as one isotope, 9Be and 19F respectively. These two, together with 7Li, as well as 2H, 11B, 15N, 209Bi, and the stable isotopes of C, and O, are the only nuclides with low enough thermal neutron capture cross sections aside from actinides to serve as major constituents of a molten salt breeder reactor fuel.
References
- ^ «Standard Atomic Weights: Lithium». CIAAW. 2009.
- ^ Li(0) atoms have been observed in various small lithium-chloride clusters; see Milovanović, Milan; Veličković, Suzana; Veljkovićb, Filip; Jerosimić, Stanka (30 October 2017). «Structure and stability of small lithium-chloride LinClm(0,1+) (n ≥ m, n = 1–6, m = 1–3) clusters». Physical Chemistry Chemical Physics (45). doi:10.1039/C7CP04181K.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ a b Numerical data from: Lodders, Katharina (10 July 2003). «Solar System Abundances and Condensation Temperatures of the Elements» (PDF). The Astrophysical Journal. The American Astronomical Society. 591 (2): 1220–1247. Bibcode:2003ApJ…591.1220L. doi:10.1086/375492. S2CID 42498829. Archived from the original (PDF) on 7 November 2015. Retrieved 1 September 2015. Graphed at File:SolarSystemAbundances.jpg
- ^ Nuclear Weapon Design. Federation of American Scientists (21 October 1998). fas.org
- ^ a b c d e f g Krebs, Robert E. (2006). The History and Use of Our Earth’s Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 978-0-313-33438-2.
- ^ Huang, Chuanfu; Kresin, Vitaly V. (June 2016). «Note: Contamination-free loading of lithium metal into a nozzle source». Review of Scientific Instruments. 87 (6): 066105. Bibcode:2016RScI…87f6105H. doi:10.1063/1.4953918. ISSN 0034-6748. PMID 27370506.
- ^ Addison, C. C. (1984). The chemistry of the liquid alkali metals. Chichester [West Sussex]: Wiley. ISBN 978-0471905080. OCLC 10751785.
- ^ a b «PubChem Element Summary for AtomicNumber 3, Lithium». National Center for Biotechnology Information. 2021. Retrieved 10 September 2021.
- ^ «It’s Elemental — The Element Lithium». education.jlab.org. Archived from the original on 5 October 2019. Retrieved 9 October 2019.
- ^ «Nitrogen, N2, Physical properties, safety, MSDS, enthalpy, material compatibility, gas liquid equilibrium, density, viscosity, inflammability, transport properties». Encyclopedia.airliquide.com. Archived from the original on 21 July 2011. Retrieved 29 September 2010.
- ^ «Coefficients of Linear Expansion». Engineering Toolbox. Archived from the original on 30 November 2012. Retrieved 9 January 2011.
- ^ Tuoriniemi, Juha; Juntunen-Nurmilaukas, Kirsi; Uusvuori, Johanna; Pentti, Elias; Salmela, Anssi; Sebedash, Alexander (2007). «Superconductivity in lithium below 0.4 millikelvin at ambient pressure». Nature. 447 (7141): 187–9. Bibcode:2007Natur.447..187T. doi:10.1038/nature05820. PMID 17495921. S2CID 4430500. Archived from the original on 25 June 2019. Retrieved 20 April 2018.
- ^ Struzhkin, V. V.; Eremets, M. I.; Gan, W; Mao, H. K.; Hemley, R. J. (2002). «Superconductivity in dense lithium». Science. 298 (5596): 1213–5. Bibcode:2002Sci…298.1213S. doi:10.1126/science.1078535. PMID 12386338. S2CID 21030510.
- ^ Overhauser, A. W. (1984). «Crystal Structure of Lithium at 4.2 K». Physical Review Letters. 53 (1): 64–65. Bibcode:1984PhRvL..53…64O. doi:10.1103/PhysRevLett.53.64.
- ^ Schwarz, Ulrich (2004). «Metallic high-pressure modifications of main group elements». Zeitschrift für Kristallographie. 219 (6–2004): 376–390. Bibcode:2004ZK….219..376S. doi:10.1524/zkri.219.6.376.34637. S2CID 56006683.
- ^ a b c d e f g Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics (81st ed.). CRC press. ISBN 978-0-8493-0481-1.[page needed]
- ^ SPECIFIC HEAT OF SOLIDS. bradley.edu
- ^ a b c d e f g Emsley, John (2001). Nature’s Building Blocks. Oxford: Oxford University Press. ISBN 978-0-19-850341-5.
- ^ «Isotopes of Lithium». Berkeley National Laboratory, The Isotopes Project. Archived from the original on 13 May 2008. Retrieved 21 April 2008.
- ^ File:Binding energy curve — common isotopes.svg shows binding energies of stable nuclides graphically; the source of the data-set is given in the figure background.
- ^ Sonzogni, Alejandro. «Interactive Chart of Nuclides». National Nuclear Data Center: Brookhaven National Laboratory. Archived from the original on 23 July 2007. Retrieved 6 June 2008.
- ^ Various (2002). Lide, David R. (ed.). Handbook of Chemistry & Physics (88th ed.). CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. Archived from the original on 24 July 2017. Retrieved 23 May 2008.
- ^ Asplund, M.; et al. (2006). «Lithium Isotopic Abundances in Metal-poor Halo Stars». The Astrophysical Journal. 644 (1): 229–259. arXiv:astro-ph/0510636. Bibcode:2006ApJ…644..229A. doi:10.1086/503538. S2CID 394822.
- ^ Denissenkov, P. A.; Weiss, A. (2000). «Episodic lithium production by extra-mixing in red giants». Astronomy and Astrophysics. 358: L49–L52. arXiv:astro-ph/0005356. Bibcode:2000A&A…358L..49D.
- ^ Chaussidon, M.; Robert, F.; McKeegan, K. D. (2006). «Li and B isotopic variations in an Allende CAI: Evidence for the in situ decay of short-lived 10Be and for the possible presence of the short−lived nuclide 7Be in the early solar system» (PDF). Geochimica et Cosmochimica Acta. 70 (1): 224–245. Bibcode:2006GeCoA..70..224C. doi:10.1016/j.gca.2005.08.016. Archived from the original (PDF) on 18 July 2010.
- ^ Seitz, H. M.; Brey, G. P.; Lahaye, Y.; Durali, S.; Weyer, S. (2004). «Lithium isotopic signatures of peridotite xenoliths and isotopic fractionation at high temperature between olivine and pyroxenes». Chemical Geology. 212 (1–2): 163–177. Bibcode:2004ChGeo.212..163S. doi:10.1016/j.chemgeo.2004.08.009.
- ^ Duarte, F. J (2009). Tunable Laser Applications. CRC Press. p. 330. ISBN 978-1-4200-6009-6.
- ^ a b Coplen, T. B.; Bohlke, J. K.; De Bievre, P.; Ding, T.; Holden, N. E.; Hopple, J. A.; Krouse, H. R.; Lamberty, A.; Peiser, H. S.; et al. (2002). «Isotope-abundance variations of selected elements (IUPAC Technical Report)». Pure and Applied Chemistry. 74 (10): 1987. doi:10.1351/pac200274101987.
- ^ Truscott, Andrew G.; Strecker, Kevin E.; McAlexander, William I.; Partridge, Guthrie B.; Hulet, Randall G. (30 March 2001). «Observation of Fermi Pressure in a Gas of Trapped Atoms». Science. 291 (5513): 2570–2572. Bibcode:2001Sci…291.2570T. doi:10.1126/science.1059318. ISSN 0036-8075. PMID 11283362. S2CID 31126288. Archived from the original on 13 March 2021. Retrieved 11 January 2020.
- ^ «Element Abundances» (PDF). Archived from the original (PDF) on 1 September 2006. Retrieved 17 November 2009.
- ^ Boesgaard, A. M.; Steigman, G. (1985). «Big bang nucleosynthesis – Theories and observations». Annual Review of Astronomy and Astrophysics. Palo Alto, CA. 23: 319–378. Bibcode:1985ARA&A..23..319B. doi:10.1146/annurev.aa.23.090185.001535. A86-14507 04–90.
- ^ Woo, Marcus (21 February 2017). «The Cosmic Explosions That Made the Universe». earth. BBC. Archived from the original on 21 February 2017. Retrieved 21 February 2017.
A mysterious cosmic factory is producing lithium. Scientists are now getting closer at finding out where it comes from
- ^ Cain, Fraser (16 August 2006). «Why Old Stars Seem to Lack Lithium». Archived from the original on 4 June 2016.
- ^ «First Detection of Lithium from an Exploding Star». Archived from the original on 1 August 2015. Retrieved 29 July 2015.
- ^ Cain, Fraser. «Brown Dwarf». Universe Today. Archived from the original on 25 February 2011. Retrieved 17 November 2009.
- ^ Reid, Neill (10 March 2002). «L Dwarf Classification». Archived from the original on 21 May 2013. Retrieved 6 March 2013.
- ^ Arizona State University (1 June 2020). «Class of stellar explosions found to be galactic producers of lithium». EurekAlert!. Archived from the original on 3 June 2020. Retrieved 2 June 2020.
- ^ Starrfield, Sumner; et al. (27 May 2020). «Carbon–Oxygen Classical Novae Are Galactic 7Li Producers as well as Potential Supernova Ia Progenitors». The Astrophysical Journal. 895 (1): 70. arXiv:1910.00575. Bibcode:2020ApJ…895…70S. doi:10.3847/1538-4357/ab8d23. S2CID 203610207.
- ^ «Lithium Occurrence». Institute of Ocean Energy, Saga University, Japan. Archived from the original on 2 May 2009. Retrieved 13 March 2009.
- ^ a b c d «Some Facts about Lithium». ENC Labs. Archived from the original on 10 July 2011. Retrieved 15 October 2010.
- ^ Schwochau, Klaus (1984). «Extraction of metals from sea water». Inorganic Chemistry. Topics in Current Chemistry. Vol. 124. Springer Berlin Heidelberg. pp. 91–133. doi:10.1007/3-540-13534-0_3. ISBN 978-3-540-13534-0. S2CID 93866412.
- ^ a b c d Kamienski, Conrad W.; McDonald, Daniel P.; Stark, Marshall W.; Papcun, John R. (2004). «Lithium and lithium compounds». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.1209200811011309.a01.pub2. ISBN 978-0471238966.
- ^ «lithium». Britannica encyclopedia. Archived from the original on 5 August 2020. Retrieved 4 August 2020.
- ^ Atkins, Peter (2010). Shriver & Atkins’ Inorganic Chemistry (5th ed.). New York: W. H. Freeman and Company. p. 296. ISBN 978-0199236176.
- ^ «Mindat.org — Mines, Minerals and More». www.mindat.org. Archived from the original on 22 April 2011. Retrieved 4 August 2019.
- ^ Moores, S. (June 2007). «Between a rock and a salt lake». Industrial Minerals. 477: 58.
- ^ Taylor, S. R.; McLennan, S. M.; The continental crust: Its composition and evolution, Blackwell Sci. Publ., Oxford, 330 pp. (1985). Cited in Abundances of the elements (data page)
- ^ Garrett, Donald (2004) Handbook of Lithium and Natural Calcium, Academic Press, cited in The Trouble with Lithium 2 Archived 14 July 2011 at the Wayback Machine, Meridian International Research (2008)
- ^ a b c d e «Mineral Commodity Summaries 2021» (PDF). U.S. Geological Survey. February 2021. Retrieved 17 March 2021.
- ^ a b c d e f Lithium Statistics and Information, U.S. Geological Survey, 2018, archived from the original on 3 March 2016, retrieved 25 July 2002
- ^ a b «The Trouble with Lithium 2» (PDF). Meridian International Research. 2008. Archived from the original (PDF) on 14 July 2011. Retrieved 29 September 2010.
- ^ Czech Geological Survey (October 2015). Mineral Commodity Summaries of the Czech Republic 2015 (PDF). Prague: Czech Geological Survey. p. 373. ISBN 978-80-7075-904-2. Archived (PDF) from the original on 6 January 2017.
- ^ «Ore Reserve grows its Finland lithium deposit by 50%». 2019. Archived from the original on 10 December 2019. Retrieved 10 December 2019.
- ^ Risen, James (13 June 2010). «U.S. Identifies Vast Riches of Minerals in Afghanistan». The New York Times. Archived from the original on 17 June 2010. Retrieved 13 June 2010.
- ^ Page, Jeremy; Evans, Michael (15 June 2010). «Taleban zones mineral riches may rival Saudi Arabia says Pentagon». The Times. London. Archived from the original on 14 May 2011.
- ^ Hosp, Gerald. «Afghanistan: die konfliktreichen Bodenschätze». Neue Zürcher Zeitung (in German). Retrieved 1 September 2021.
- ^ Bliss, Dominic (28 May 2021). «National Geographic». In Cornwall, ruinous tin and copper mines are yielding battery-grade lithium. Here’s what that means. Retrieved 13 June 2021.
- ^ «Cornwall lithium deposits ‘globally significant’«. BBC. 17 September 2020. Retrieved 13 June 2021.
- ^ Chassard-Bouchaud, C.; Galle, P.; Escaig, F.; Miyawaki, M. (1984). «Bioaccumulation of lithium by marine organisms in European, American, and Asian coastal zones: microanalytic study using secondary ion emission». Comptes Rendus de l’Académie des Sciences, Série III. 299 (18): 719–24. PMID 6440674.
- ^ a b c d Bach, Ricardo O.; Gallicchio, Vincent S., eds. (1990). Lithium and Cell Physiology. New York, NY: Springer New York. pp. 25–46. doi:10.1007/978-1-4612-3324-4. ISBN 978-1-4612-7967-9. S2CID 44374126.
- ^ a b c d e Jakobsson, Eric; Argüello-Miranda, Orlando; Chiu, See-Wing; Fazal, Zeeshan; Kruczek, James; Nunez-Corrales, Santiago; Pandit, Sagar; Pritchet, Laura (10 November 2017). «Towards a Unified Understanding of Lithium Action in Basic Biology and its Significance for Applied Biology». The Journal of Membrane Biology. Springer Science and Business Media LLC. 250 (6): 587–604. doi:10.1007/s00232-017-9998-2. ISSN 0022-2631. PMC 5696506. PMID 29127487.
- ^ a b Alda, M (17 February 2015). «Lithium in the treatment of bipolar disorder: pharmacology and pharmacogenetics». Molecular Psychiatry. Nature Publishing Group. 20 (6): 661–670. doi:10.1038/mp.2015.4. ISSN 1359-4184. PMC 5125816. PMID 25687772.
- ^ Martinsson, L; Wei, Y; Xu, D; Melas, P A; Mathé, A A; Schalling, M; Lavebratt, C; Backlund, L (2013). «Long-term lithium treatment in bipolar disorder is associated with longer leukocyte telomeres». Translational Psychiatry. Nature Publishing Group. 3 (5): e261–. doi:10.1038/tp.2013.37. ISSN 2158-3188. PMC 3669924. PMID 23695236.
- ^ D’Andraba (1800). «Des caractères et des propriétés de plusieurs nouveaux minérauxde Suède et de Norwège, avec quelques observations chimiques faites sur ces substances». Journal de Physique, de Chimie, d’Histoire Naturelle, et des Arts. 51: 239. Archived from the original on 13 July 2015.
- ^ «Petalite Mineral Information». Mindat.org. Archived from the original on 16 February 2009. Retrieved 10 August 2009.
- ^ a b c d e f g «Lithium:Historical information». Archived from the original on 16 October 2009. Retrieved 10 August 2009.
- ^ Weeks, Mary (2003). Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. p. 124. ISBN 978-0-7661-3872-8. Retrieved 10 August 2009.
- ^ Berzelius (1817). «Ein neues mineralisches Alkali und ein neues Metall» [A new mineral alkali and a new metal]. Journal für Chemie und Physik. 21: 44–48. Archived from the original on 3 December 2016. From p. 45: «Herr August Arfwedson, ein junger sehr verdienstvoller Chemiker, der seit einem Jahre in meinem Laboratorie arbeitet, fand bei einer Analyse des Petalits von Uto’s Eisengrube, einen alkalischen Bestandtheil, … Wir haben es Lithion genannt, um dadurch auf seine erste Entdeckung im Mineralreich anzuspielen, da die beiden anderen erst in der organischen Natur entdeckt wurden. Sein Radical wird dann Lithium genannt werden.» (Mr. August Arfwedson, a young, very meritorious chemist, who has worked in my laboratory for a year, found during an analysis of petalite from Uto’s iron mine, an alkaline component … We’ve named it lithion, in order to allude thereby to its first discovery in the mineral realm, since the two others were first discovered in organic nature. Its radical will then be named «lithium».)
- ^ «Johan August Arfwedson». Periodic Table Live!. Archived from the original on 7 October 2010. Retrieved 10 August 2009.
- ^ «Johan Arfwedson». Archived from the original on 5 June 2008. Retrieved 10 August 2009.
- ^ a b c van der Krogt, Peter. «Lithium». Elementymology & Elements Multidict. Archived from the original on 16 June 2011. Retrieved 5 October 2010.
- ^ Clark, Jim (2005). «Compounds of the Group 1 Elements». Archived from the original on 11 March 2009. Retrieved 10 August 2009.
- ^ See:
- Arwedson, Aug. (1818) «Undersökning af några vid Utö Jernmalmsbrott förekommende Fossilier, och af ett deri funnet eget Eldfast Alkali» Archived 25 November 2017 at the Wayback Machine, Afhandlingar i Fysik, Kemi och Mineralogi, 6 : 145–172. (in Swedish)
- Arwedson, Aug. (1818) «Untersuchung einiger bei der Eisen-Grube von Utö vorkommenden Fossilien und von einem darin gefundenen neuen feuerfesten Alkali» Archived 13 March 2021 at the Wayback Machine (Investigation of some minerals occurring at the iron mines of Utö and of a new refractory alkali found therein), Journal für Chemie und Physik, 22 (1) : 93–117. (in German)
- ^ Gmelin, C. G. (1818). «Von dem Lithon» [On lithium]. Annalen der Physik. 59 (7): 238–241. Bibcode:1818AnP….59..229G. doi:10.1002/andp.18180590702. Archived from the original on 9 November 2015.
p. 238 Es löste sich in diesem ein Salz auf, das an der Luft zerfloss, und nach Art der Strontiansalze den Alkohol mit einer purpurrothen Flamme brennen machte. (There dissolved in this [solvent; namely, absolute alcohol] a salt that deliquesced in air, and in the manner of strontium salts, caused the alcohol to burn with a purple-red flame.)
- ^ a b Enghag, Per (2004). Encyclopedia of the Elements: Technical Data – History –Processing – Applications. Wiley. pp. 287–300. ISBN 978-3-527-30666-4.
- ^ Brande, William Thomas (1821) A Manual of Chemistry, 2nd ed. London, England: John Murray, vol. 2, pp. 57-58. Archived 22 November 2015 at the Wayback Machine
- ^ «The Quarterly journal of science and the arts». The Quarterly Journal of Science and the Arts. Royal Institution of Great Britain. 5: 338. 1818. Archived from the original on 13 March 2021. Retrieved 5 October 2010.
- ^ «Timeline science and engineering». DiracDelta Science & Engineering Encyclopedia. Archived from the original on 5 December 2008. Retrieved 18 September 2008.
- ^ Brande, William Thomas; MacNeven, William James (1821). A manual of chemistry. Long. p. 191. Retrieved 8 October 2010.
- ^ Bunsen, R. (1855). «Darstellung des Lithiums» [Preparation of lithium]. Annalen der Chemie und Pharmacie. 94: 107–111. doi:10.1002/jlac.18550940112. Archived from the original on 6 November 2018. Retrieved 13 August 2015.
- ^ Green, Thomas (11 June 2006). «Analysis of the Element Lithium». echeat. Archived from the original on 21 April 2012.
- ^ Garrett, Donald E. (5 April 2004). Handbook of Lithium and Natural Calcium Chloride. p. 99. ISBN 9780080472904. Archived from the original on 3 December 2016.
- ^ Shorter, Edward (June 2009). «The history of lithium therapy». Bipolar Disorders. 11 (Suppl 2): 4–9. doi:10.1111/j.1399-5618.2009.00706.x. ISSN 1398-5647. PMC 3712976. PMID 19538681.
- ^ a b Ober, Joyce A. (1994). «Commodity Report 1994: Lithium» (PDF). United States Geological Survey. Archived (PDF) from the original on 9 June 2010. Retrieved 3 November 2010.
- ^ Deberitz, Jürgen; Boche, Gernot (2003). «Lithium und seine Verbindungen — Industrielle, medizinische und wissenschaftliche Bedeutung». Chemie in unserer Zeit. 37 (4): 258–266. doi:10.1002/ciuz.200300264.
- ^ Bauer, Richard (1985). «Lithium — wie es nicht im Lehrbuch steht». Chemie in unserer Zeit. 19 (5): 167–173. doi:10.1002/ciuz.19850190505.
- ^ Ober, Joyce A. (1994). «Minerals Yearbook 2007 : Lithium» (PDF). United States Geological Survey. Archived (PDF) from the original on 17 July 2010. Retrieved 3 November 2010.
- ^ Kogel, Jessica Elzea (2006). «Lithium». Industrial minerals & rocks: commodities, markets, and uses. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. p. 599. ISBN 978-0-87335-233-8. Archived from the original on 7 November 2020. Retrieved 6 November 2020.
- ^ McKetta, John J. (18 July 2007). Encyclopedia of Chemical Processing and Design: Volume 28 – Lactic Acid to Magnesium Supply-Demand Relationships. M. Dekker. ISBN 978-0-8247-2478-8. Archived from the original on 28 May 2013.
- ^ Overland, Indra (1 March 2019). «The geopolitics of renewable energy: Debunking four emerging myths» (PDF). Energy Research & Social Science. 49: 36–40. doi:10.1016/j.erss.2018.10.018. ISSN 2214-6296. Archived (PDF) from the original on 13 March 2021. Retrieved 25 August 2019.
- ^ Krebs, Robert E. (2006). The history and use of our earth’s chemical elements: a reference guide. Greenwood Publishing Group. p. 47. ISBN 978-0-313-33438-2. Archived from the original on 4 August 2016.
- ^ Institute, American Geological; Union, American Geophysical; Society, Geochemical (1 January 1994). «Geochemistry international». 31 (1–4): 115. Archived from the original on 4 June 2016.
- ^ a b c d Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 97–99. ISBN 978-0-08-022057-4.
- ^ Beckford, Floyd. «University of Lyon course online (powerpoint) slideshow». Archived from the original on 4 November 2005. Retrieved 27 July 2008.
definitions:Slides 8–10 (Chapter 14)
- ^ Sapse, Anne-Marie & von R. Schleyer, Paul (1995). Lithium chemistry: a theoretical and experimental overview. Wiley-IEEE. pp. 3–40. ISBN 978-0-471-54930-7. Archived from the original on 31 July 2016.
- ^ Nichols, Michael A.; Williard, Paul G. (1 February 1993). «Solid-state structures of n-butyllithium-TMEDA, -THF, and -DME complexes». Journal of the American Chemical Society. 115 (4): 1568–1572. doi:10.1021/ja00057a050. ISSN 0002-7863.
- ^ C., Mehrotra, R. (2009). Organometallic chemistry : a unified approach. [Place of publication not identified]: New Age International Pvt. ISBN 978-8122412581. OCLC 946063142.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 73. ISBN 978-0-08-037941-8.
- ^ Tarascon, J. M. (2010). «Is lithium the new gold?». Nature Chemistry. 2 (6): 510. Bibcode:2010NatCh…2..510T. doi:10.1038/nchem.680. PMID 20489722.
- ^ Woody, Todd (19 October 2011). «Lithium: The New California Gold Rush». Forbes. Archived from the original on 19 December 2014.
- ^ Houston, J.; Butcher, A.; Ehren, P.; Evans, K.; Godfrey, L. (2011). «The Evaluation of Brine Prospects and the Requirement for Modifications to Filing Standards» (PDF). Economic Geology. 106 (7): 1225–1239. doi:10.2113/econgeo.106.7.1225. Archived (PDF) from the original on 20 July 2018. Retrieved 28 June 2019.
- ^ Eftekhari, A. (2019). «Lithium Batteries for Electric Vehicles: From Economy to Research Strategy». ACS Sustainable Chem. Eng. 7 (6): 5602–5613. doi:10.1021/acssuschemeng.8b01494. S2CID 104468150.
- ^ Vikström, H.; Davidsson, S.; Höök, M. (2013). «Lithium availability and future production outlooks». Applied Energy. 110 (10): 252–266. doi:10.1016/j.apenergy.2013.04.005. Archived from the original on 11 October 2017. Retrieved 11 October 2017.
- ^ Grosjean, P.W.; Medina, P.A.; Keoleian, G.A.; Kesler, S.E.; Everson, M.P; Wallington, T.J. (2011). «Global Lithium Availability: A Constraint for Electric Vehicles?». Journal of Industrial Ecology. 15 (5): 760–775. doi:10.1111/j.1530-9290.2011.00359.x. hdl:2027.42/87046. S2CID 4734596.
- ^ Money Game Contributors (26 April 2013). «New Wyoming Lithium Deposit». Business Insider. Archived from the original on 3 May 2013.
- ^ Benson, Tom (16 August 2016). «Lithium enrichment in intracontinental rhyolite magmas leads to Li deposits in caldera basins». Nature Communications. 8 (1): 270. doi:10.1038/s41467-017-00234-y. PMC 5559592. PMID 28814716.
- ^ Halpern, Abel (30 January 2014). «The Lithium Triangle». Latin Trade. Archived from the original on 10 June 2018.
- ^ a b Romero, Simon (2 February 2009). «In Bolivia, a Tight Grip on the Next Big Resource». The New York Times. Archived from the original on 1 July 2017.
- ^ «USGS Mineral Commodities Summaries 2009» (PDF). USGS. Archived (PDF) from the original on 14 June 2010.
- ^ Dube, Ryan (11 August 2022). «The Place With the Most Lithium Is Blowing the Electric-Car Revolution». The Wall Street Journal. Vol. CCLXXX, no. 35. pp. A1, A8. ISSN 1042-9840. Retrieved 11 August 2022.
- ^ a b c d e f Cabello, J (2022). «Reserves, resources and lithium exploration in the salt flats of northern Chile». Andean Geology. 49 (2): 297–306. doi:10.5027/andgeoV49n2-3444] (inactive 31 December 2022).
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) - ^ «This Congo project could supply the world with lithium». MiningDotCom. 10 December 2018. Retrieved 26 March 2021.
- ^ Wadia, Cyrus; Albertus, Paul; Srinivasan, Venkat (2011). «Resource constraints on the battery energy storage potential for grid and transportation applications». Journal of Power Sources. 196 (3): 1593–8. Bibcode:2011JPS…196.1593W. doi:10.1016/j.jpowsour.2010.08.056. Archived from the original on 13 March 2021. Retrieved 28 June 2019.
- ^ Gaines, LL.; Nelson, P. (2010). «Lithium-Ion Batteries: Examining Material Demand and Recycling Issues». Argonne National Laboratory. Archived from the original on 3 August 2016. Retrieved 11 June 2016.
- ^ «University of Michigan and Ford researchers see plentiful lithium resources for electric vehicles». Green Car Congress. 3 August 2011. Archived from the original on 16 September 2011.
- ^ «The Precious Mobile Metal». The Financialist. Credit Suisse. 9 June 2014. Archived from the original on 23 February 2016. Retrieved 19 June 2014.
- ^ «Plateau Energy Metals Peru unit finds large lithium resources». Reuters. 16 July 2018. Archived from the original on 26 July 2018.
- ^ Matthis, Simon (17 March 2021). «Australia grants MPS for Core Lithium’s Finniss lithium project». MiningMetalNews. Retrieved 13 October 2022.
- ^ CORE Lithium : Finnis Lithium, retrieved 13 October 2022
- ^ «Finniss Lithium Project, Northern Territory, Australia». Mining Technology. 13 January 2022. Retrieved 13 October 2022.
- ^ «Greenbushes Lithium Mine». Golden Dragon Capital. Archived from the original on 19 January 2019. Retrieved 18 January 2019.
- ^ Sixie Yang; Fan Zhang; Huaiping Ding; Ping He (19 September 2018). «Lithium Metal Extraction from Seawater». Joule. Elsevier. 2 (9): 1648–1651. doi:10.1016/j.joule.2018.07.006.
- ^ Parker, Ann. Mining Geothermal Resources Archived 17 September 2012 at the Wayback Machine. Lawrence Livermore National Laboratory
- ^ Patel, P. (16 November 2011) Startup to Capture Lithium from Geothermal Plants. technologyreview.com
- ^ Ober, Joyce A. «Lithium» (PDF). United States Geological Survey. pp. 77–78. Archived (PDF) from the original on 11 July 2007. Retrieved 19 August 2007.
- ^ «SQM Announces New Lithium Prices – SANTIAGO, Chile». PR Newswire. 30 September 2009. Archived from the original on 30 May 2013.
- ^ a b Riseborough, Jesse. «IPad Boom Strains Lithium Supplies After Prices Triple». Bloomberg BusinessWeek. Archived from the original on 22 June 2012. Retrieved 1 May 2013.
- ^ «ISE Metal-qoutes»..access-date=29 September 2022.
- ^ Thacker Pass Lithium Mine Project Final Environmental Impact Statement (PDF) (Technical report). Bureau of Land Management and the U.S. Fish and Wildlife Service. 4 December 2020. DOI-BLM-NV-W010-2020-0012-EIS. Retrieved 16 March 2021.
- ^ a b Patterson, Scott; Ramkumar, Amrith (9 March 2021). «America’s Battery-Powered Car Hopes Ride on Lithium. One Producer Paves the Way». Wall Street Journal. Archived from the original on 12 March 2021. Retrieved 13 March 2021.
- ^ Cafariello, Joseph (10 March 2014). «Lithium: A Long-Term Investment Buy Lithium!». wealthdaily.com. Archived from the original on 12 June 2018. Retrieved 24 April 2015.
- ^ Kaskey, Jack (16 July 2014). «Largest Lithium Deal Triggered by Smartphones and Teslas». Bloomberg. Archived from the original on 12 June 2018. Retrieved 24 April 2015.
- ^ Marcelo Azevedo, Nicolò Campagnol, Toralf Hagenbruch, Ken Hoffman, Ajay Lala, Oliver Ramsbottom (June 2018). «Lithium and cobalt – a tale of two commodities». McKinsey. p. 9. Archived from the original on 11 December 2019. Retrieved 29 January 2020.
{{cite web}}: CS1 maint: multiple names: authors list (link) - ^ Chong Liu, Yanbin Li, Dingchang Lin, Po-Chun Hsu, Bofei Liu, Gangbin Yan, Tong Wu Yi Cui & Steven Chu (2020). «Lithium Extraction from Seawater through Pulsed Electrochemical Intercalation». Joule. 4 (7): 1459–1469. doi:10.1016/j.joule.2020.05.017. S2CID 225527170. Archived from the original on 13 March 2021. Retrieved 26 December 2020.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Tsuyoshi Hoshino (2015). «Innovative lithium recovery technique from seawater by using world-first dialysis with a lithium ionic superconductor». Desalination. 359: 59–63. doi:10.1016/j.desal.2014.12.018.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Robert F. Service (13 July 2020). «Seawater could provide nearly unlimited amounts of critical battery material». Science. Archived from the original on 13 January 2021. Retrieved 26 December 2020.
- ^ a b c Amui, Rachid (February 2020). «Commodities At a Glance: Special issue on strategic battery raw materials» (PDF). United Nations Conference on Trade and Development. 13 (UNCTAD/DITC/COM/2019/5). Retrieved 10 February 2021.
- ^ Application of Life-Cycle Assessment to Nanoscale Technology: Lithium-ion Batteries for Electric Vehicles (Report). Washington, DC: U.S. Environmental Protection Agency (EPA). 2013. EPA 744-R-12-001.
- ^ «Can Nanotech Improve Li-ion Battery Performance». Environmental Leader. 30 May 2013. Archived from the original on 21 August 2016. Retrieved 3 June 2013.
- ^ Katwala, Amit. «The spiralling environmental cost of our lithium battery addiction». Wired. Condé Nast Publications. Retrieved 10 February 2021.
- ^ Draper, Robert. «This metal is powering today’s technology—at what price?». National Geographic. No. February 2019. National Geographic Partners. Retrieved 10 February 2021.
- ^ a b «The Lithium Gold Rush: Inside the Race to Power Electric Vehicles». The New York Times. 6 May 2021. Retrieved 6 May 2021.
- ^ Marchegiani, Morgera, and Parks (21 November 2019). «Indigenous peoples’rights to natural resources in Argentina: the challenges of impact assessment, consent and fair andequitable benefit-sharing in cases of lithium mining». The International Journal of Human Rights.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Price, Austin (Summer 2021). «The Rush for White Gold». Earth Island Journal.
- ^ Chadwell, Jeri (21 July 2021). «Judge to decide on injunction request to halt work on Thacker Pass lithium mine». This is Reno. Retrieved 12 October 2021.
- ^ «Thacker Pass Lithium mine approval draws around-the-clock protest». Sierra Nevada Ally. 19 January 2021. Retrieved 16 March 2021.
- ^ a b «Lithium» (PDF). 2016. Archived (PDF) from the original on 30 November 2016. Retrieved 29 November 2016 – via US Geological Survey (USGS).
- ^ «Lithium» (PDF). USGS. USGS. Archived (PDF) from the original on 1 November 2020. Retrieved 15 November 2020.
- ^ «Fmclithium.com» (PDF). www.fmclithium.com. Archived from the original (PDF) on 7 September 2014.
- ^ Clark, Jim (2005). «Some Compounds of the Group 1 Elements». chemguide.co.uk. Archived from the original on 27 June 2013. Retrieved 8 August 2013.
- ^ «Disposable Batteries — Choosing between Alkaline and Lithium Disposable Batteries». Batteryreview.org. Archived from the original on 6 January 2014. Retrieved 10 October 2013.
- ^ «Battery Anodes > Batteries & Fuel Cells > Research > The Energy Materials Center at Cornell». Emc2.cornell.edu. Archived from the original on 22 December 2013. Retrieved 10 October 2013.
- ^ Totten, George E.; Westbrook, Steven R. & Shah, Rajesh J. (2003). Fuels and lubricants handbook: technology, properties, performance, and testing. Vol. 1. ASTM International. p. 559. ISBN 978-0-8031-2096-9. Archived from the original on 23 July 2016.
- ^ Rand, Salvatore J. (2003). Significance of tests for petroleum products. ASTM International. pp. 150–152. ISBN 978-0-8031-2097-6. Archived from the original on 31 July 2016.
- ^ The Theory and Practice of Mold Fluxes Used in Continuous Casting: A Compilation of Papers on Continuous Casting Fluxes Given at the 61st and 62nd Steelmaking Conference, Iron and Steel Society
- ^ Lu, Y. Q.; Zhang, G. D.; Jiang, M. F.; Liu, H. X.; Li, T. (2011). «Effects of Li2CO3 on Properties of Mould Flux for High Speed Continuous Casting». Materials Science Forum. 675–677: 877–880. doi:10.4028/www.scientific.net/MSF.675-677.877. S2CID 136666669.
- ^ «Testing 1-2-3: Eliminating Veining Defects», Modern Casting, July 2014, archived from the original on 2 April 2015, retrieved 15 March 2015
- ^ Haupin, W. (1987), Mamantov, Gleb; Marassi, Roberto (eds.), «Chemical and Physical Properties of the Hall-Héroult Electrolyte», Molten Salt Chemistry: An Introduction and Selected Applications, Springer, p. 449
- ^ Garrett, Donald E. (5 April 2004). Handbook of Lithium and Natural Calcium Chloride. Academic Press. p. 200. ISBN 9780080472904. Archived from the original on 3 December 2016.
- ^ Prasad, N. Eswara; Gokhale, Amol; Wanhill, R. J. H. (20 September 2013). Aluminum-Lithium Alloys: Processing, Properties, and Applications. Butterworth-Heinemann. ISBN 9780124016798. Archived from the original on 1 January 2021. Retrieved 6 November 2020.
- ^ Davis, Joseph R. ASM International. Handbook Committee (1993). Aluminum and aluminum alloys. ASM International. pp. 121–. ISBN 978-0-87170-496-2. Archived from the original on 28 May 2013. Retrieved 16 May 2011.
- ^ Karki, Khim; Epstein, Eric; Cho, Jeong-Hyun; Jia, Zheng; Li, Teng; Picraux, S. Tom; Wang, Chunsheng; Cumings, John (2012). «Lithium-Assisted Electrochemical Welding in Silicon Nanowire Battery Electrodes» (PDF). Nano Letters. 12 (3): 1392–7. Bibcode:2012NanoL..12.1392K. doi:10.1021/nl204063u. PMID 22339576. Archived (PDF) from the original on 10 August 2017.
- ^ Koch, Ernst-Christian (2004). «Special Materials in Pyrotechnics: III. Application of Lithium and its Compounds in Energetic Systems». Propellants, Explosives, Pyrotechnics. 29 (2): 67–80. doi:10.1002/prep.200400032.
- ^ Wiberg, Egon; Wiberg, Nils and Holleman, Arnold Frederick (2001) Inorganic chemistry Archived 18 June 2016 at the Wayback Machine, Academic Press. ISBN 0-12-352651-5, p. 1089
- ^ Mulloth, L.M. & Finn, J.E. (2005). «Air Quality Systems for Related Enclosed Spaces: Spacecraft Air». The Handbook of Environmental Chemistry. Vol. 4H. pp. 383–404. doi:10.1007/b107253. ISBN 978-3-540-25019-7.
- ^ «Application of lithium chemicals for air regeneration of manned spacecraft». Lithium Corporation of America & Aerospace Medical Research Laboratories. 1965. Archived from the original on 7 October 2012.
- ^ Markowitz, M. M.; Boryta, D. A.; Stewart, Harvey (1964). «Lithium Perchlorate Oxygen Candle. Pyrochemical Source of Pure Oxygen». Industrial & Engineering Chemistry Product Research and Development. 3 (4): 321–30. doi:10.1021/i360012a016.
- ^ Hobbs, Philip C. D. (2009). Building Electro-Optical Systems: Making It All Work. John Wiley and Sons. p. 149. ISBN 978-0-470-40229-0. Archived from the original on 23 June 2016.
- ^ Point Defects in Lithium Fluoride Films Induced by Gamma Irradiation. Proceedings of the 7th International Conference on Advanced Technology & Particle Physics: (ICATPP-7): Villa Olmo, Como, Italy. Vol. 2001. World Scientific. 2002. p. 819. ISBN 978-981-238-180-4. Archived from the original on 6 June 2016.
- ^ Sinton, William M. (1962). «Infrared Spectroscopy of Planets and Stars». Applied Optics. 1 (2): 105. Bibcode:1962ApOpt…1..105S. doi:10.1364/AO.1.000105.
- ^ «You’ve got the power: the evolution of batteries and the future of fuel cells» (PDF). Toshiba. Archived (PDF) from the original on 17 July 2011. Retrieved 17 May 2009.
- ^ «Organometallics». IHS Chemicals. February 2012. Archived from the original on 7 July 2012. Retrieved 2 January 2012.
- ^ Yurkovetskii, A. V.; Kofman, V. L.; Makovetskii, K. L. (2005). «Polymerization of 1,2-dimethylenecyclobutane by organolithium initiators». Russian Chemical Bulletin. 37 (9): 1782–1784. doi:10.1007/BF00962487. S2CID 94017312.
- ^ Quirk, Roderic P.; Cheng, Pao Luo (1986). «Functionalization of polymeric organolithium compounds. Amination of poly(styryl)lithium». Macromolecules. 19 (5): 1291–1294. Bibcode:1986MaMol..19.1291Q. doi:10.1021/ma00159a001.
- ^ Stone, F. G. A.; West, Robert (1980). Advances in organometallic chemistry. Academic Press. p. 55. ISBN 978-0-12-031118-7. Archived from the original on 13 March 2021. Retrieved 6 November 2020.
- ^ Bansal, Raj K. (1996). Synthetic approaches in organic chemistry. p. 192. ISBN 978-0-7637-0665-4. Archived from the original on 18 June 2016.
- ^ (PDF). 28 June 2003 https://web.archive.org/web/20030628230627/http://media.armadilloaerospace.com/misc/LiAl-Hydride.pdf. Archived from the original (PDF) on 28 June 2003.
- ^ Hughes, T.G.; Smith, R.B. & Kiely, D.H. (1983). «Stored Chemical Energy Propulsion System for Underwater Applications». Journal of Energy. 7 (2): 128–133. Bibcode:1983JEner…7..128H. doi:10.2514/3.62644.
- ^ Emsley, John (2011). Nature’s Building Blocks.
- ^ Makhijani, Arjun & Yih, Katherine (2000). Nuclear Wastelands: A Global Guide to Nuclear Weapons Production and Its Health and Environmental Effects. MIT Press. pp. 59–60. ISBN 978-0-262-63204-1. Archived from the original on 13 June 2016.
- ^ National Research Council (U.S.). Committee on Separations Technology and Transmutation Systems (1996). Nuclear wastes: technologies for separations and transmutation. National Academies Press. p. 278. ISBN 978-0-309-05226-9. Archived from the original on 13 June 2016.
- ^ Barnaby, Frank (1993). How nuclear weapons spread: nuclear-weapon proliferation in the 1990s. Routledge. p. 39. ISBN 978-0-415-07674-6. Archived from the original on 9 June 2016.
- ^ Baesjr, C. (1974). «The chemistry and thermodynamics of molten salt reactor fuels». Journal of Nuclear Materials. 51 (1): 149–162. Bibcode:1974JNuM…51..149B. doi:10.1016/0022-3115(74)90124-X. OSTI 4470742. Archived from the original on 13 March 2021. Retrieved 28 June 2019.
- ^ Agarwal, Arun (2008). Nobel Prize Winners in Physics. APH Publishing. p. 139. ISBN 978-81-7648-743-6. Archived from the original on 29 June 2016.
- ^ «‘Splitting the Atom’: Cockcroft and Walton, 1932: 9. Rays or Particles?» Archived 2 September 2012 at the Wayback Machine Department of Physics, University of Cambridge
- ^ Elements, American. «Lithium-7 Metal Isotope». American Elements. Archived from the original on 18 August 2019.
- ^ a b Wald, Matthew L. (8 October 2013). «Report Says a Shortage of Nuclear Ingredient Looms». The New York Times. Archived from the original on 1 July 2017.
- ^ a b Kean, Sam (2011). The Disappearing Spoon.
- ^ Yacobi S; Ornoy A (2008). «Is lithium a real teratogen? What can we conclude from the prospective versus retrospective studies? A review». Isr J Psychiatry Relat Sci. 45 (2): 95–106. PMID 18982835.
- ^ Gomes-da-Costa, Susana; Marx, Wolfgang; Corponi, Filippo; et al. (2022). «Lithium therapy and weight change in people with bipolar disorder: A systematic review and meta-analysis». Neuroscience and Biobehavioral Reviews. 134: 104266. doi:10.1016/j.neubiorev.2021.07.011. ISSN 0149-7634. PMID 34265322. S2CID 235802599.
- ^ «Lithium 265969». Sigma-Aldrich. Archived from the original on 13 March 2021. Retrieved 1 October 2018.
- ^ Technical data for Lithium Archived 23 March 2015 at the Wayback Machine. periodictable.com
- ^ Furr, A. K. (2000). CRC handbook of laboratory safety. Boca Raton: CRC Press. pp. 244–246. ISBN 978-0-8493-2523-6. Archived from the original on 13 March 2021. Retrieved 6 November 2020.
External links
- McKinsey review of 2018
- Lithium at The Periodic Table of Videos (University of Nottingham)
- International Lithium Alliance
- USGS: Lithium Statistics and Information
- Lithium Supply & Markets 2009 IM Conference 2009 Sustainable lithium supplies through 2020 in the face of sustainable market growth
- University of Southampton, Mountbatten Centre for International Studies, Nuclear History Working Paper No5.
- Lithium preserves by Country at investingnews.com
ЛИ́ТИЙ -я;
м.
[от греч. lithos — камень, минерал] Химический элемент (Li), мягкий, очень лёгкий щелочной металл серебристо-белого цвета (в природе в чистом виде не встречается).
◁ Ли́тиевый, -ая, -ое.
* * *
ли́тий
(лат. Lithium), химический элемент I группы периодической системы, относится к щелочным металлам. Название от греч. líthos — камень (открыт в минерале петалите). Серебристо-белый, самый лёгкий из металлов; плотность 0,533 г/см3, tпл 180,5°C. Химически очень активен, окисляется при обычной температуре; реагирует с азотом, образуя нитрид Li3N. Минералы — сподумен, лепидолит и др. Изотоп Li — единственный промышленный источник для производства трития. Литий используют для раскисления, легирования и модифицирования сплавов (например, аэрона, склерона), как теплоноситель в ядерных реакторах, компонент сплавов на основе Mg и Al, анод в химических источниках тока; некоторые соединения лития входят в состав пластичных смазок, специальных стёкол, термостойкой керамики, используются в медицине.
* * *
ЛИТИЙ
ЛИ́ТИЙ (лат. Lithium), Li, химический элемент с атомным номером 3, атомная масса 6,941. Химический символ Li читается так же, как и название самого элемента.
Литий встречается в природе в виде двух стабильных нуклидов (см. НУКЛИД)6Li (7,52% по массе) и 7Li (92,48%). В периодической системе Д. И. Менделеева литий расположен во втором периоде, группе IA и принадлежит к числу щелочных металлов (см. ЩЕЛОЧНЫЕ МЕТАЛЛЫ). Конфигурация электронной оболочки нейтрального атома лития 1s22s1. В соединениях литий всегда проявляет степень окисления +1.
Металлический радиус атома лития 0,152 нм, радиус иона Li+ 0,078 нм. Энергии последовательной ионизации атома лития 5,39 и 75,6 эВ. Электроотрицательность по Полингу 0,98, самая большая у щелочных металлов.
В виде простого вещества литий — мягкий, пластичный, легкий, серебристый металл.
История открытия и получение
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном (см. АРФВЕДСОН Юхан Август)сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене (см. СПОДУМЕН)LiAl[Si2O6] и в лепидолите (см. ЛЕПИДОЛИТ)KLi1.5Al1.5[Si3AlO10](F,OH)2. Свое название получил из-за того, что был обнаружен в «камнях» (греч. Litos — камень). Характерное для соединений лития красное окрашивание пламени впервые наблюдал немецкий химик Х.Г.Гмелин в 1818 году. В этом же году английский химик Г. Дэви (см. ДЭВИ Гемфри) электролизом расплава гидроксида лития получил кусочек металла. Получить свободный металл в достаточных количествах удалось впервые только в 1855 году путем электролиза расплавленного хлорида:
2LiCl = 2Li + Cl2
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Нахождение в природе
Литий довольно широко распространен в земной коре, его содержание в ней составляет 6,5·10–3% по массе. Как уже упоминалось, основные минералы, содержащие литий, — это петалит (содержит 3,5—4,9 % Li2O), сподумен (6—7 % Li2O), лепидолит (4—6 % Li2,O) и амблигонит (см. АМБЛИГОНИТ)LiAl [PO4] — 8—10 % Li2,O. В виде примеси литий содержится в ряде породообразующих минералов, а также присутствует в рапе некоторых озер и в минерализованных водах. В морской воде содержится около 2·10-5 % лития.
Физические и химические свойства
Из металлов литий самый легкий, его плотность 0,534 г/см3 . Температура плавления 180,5°C, температура кипения 1326°C. При температурах от –193°C до температуры плавления устойчива кубическая объемно центрированная модификация лития с параметром элементарной ячейки а=0,350 нм.
Из-за небольшого радиуса и маленького ионного заряда литий по своим свойствам больше всего напоминает не другие щелочные металлы, а элемент группы IIA магний (см. МАГНИЙ). Литий химически очень активен. Он способен взаимодействовать с кислородом и азотом воздуха при обычных условиях, поэтому на воздухе он быстро окисляется с образованием темного налета продуктов взаимодействия:
4Li + O2 = 2Li2O,
6Li + N2 = 2Li3N
При контактах с галогенами литий самовоспламеняется при обычных условиях. Подобно магнию, нагретый литий способен гореть в CO2:
4Li + CO2 = C + 2Li2O
Стандартный электродный потенциал Li/Li+ имеет наибольшее отрицательное значение (E°298 = –3,05 B) по сравнению со стандартными электродными потенциалами других металлов. Это обусловлено большой энергией гидратации маленького иона Li+, что значительно смещает равновесие в сторону ионизации металла:
Liтвердый <> Li+раствор + e–
Для слабо сольватирующих растворителей значение электродного потенциала лития соответствует его меньшей химической активности в ряду щелочных металлов.
Соединения лития — соли — как правило, бесцветные кристаллические вещества. По химическому поведению соли лития несколько напоминают аналогичные соединения магния или кальция. Плохо растворимы в воде фторид LiF, карбонат Li2CO3, фосфат Li2PO4, хорошо растворим хлорат лития LiClO3 — это, пожалуй, одно из самых хорошо растворимых соединения в неорганической химии (при 18°C в 100 г воды растворяется 313,5 г LiClO3).
Оксид лития Li2O — белое твердое вещество — представляет собой типичный щелочной оксид. Li2O активно реагирует с водой с образованием гидроксида лития LiOH.
Этот гидроксид получают электролизом водных растворов LiCl:
2LiCl + 2H2O = 2LiOH + Cl2 + H2
LiOH — сильное основание, но оно отличается по свойствам от гидроксидов других щелочных металлов. Гидроксид лития уступает им в растворимости. При прокаливании гидроксид лития теряет воду:
2LiOH = Li2O + H2O
Большое значение в синтезе органических и неорганических соединений имеет гидрид лития LiH, который образуется при взаимодействии расплавленного лития с водородом:
2Li + H2 = 2LiH
LiH — ионное соединение, строение кристаллической решетки которого похоже на строение кристаллической решетки хлорида натрия NaCl. Гидрид лития можно использовать в качестве источника водорода для наполнения аэростатов и спасательного снаряжения (надувных лодок и т.п.), так как при его гидролизе образуется большое количество водорода (1 кг LiH дает 2,8 м3 H2):
LiH + H2O = LiOH + H2
Он также находит применение при синтезе различных гидридов, например, борогидрида лития:
BCl3 + 4LiH = Li[BH4] + 3LiCl.
Литий образует соединения с частично ковалентной связью Li—C, т. е. литийорганические соединения. Например, при реакции иодбензола C6H5I с литием в органических растворителях протекает реакция:
C6H5I + 2Li = C6H5Li + LiI.
Литийорганические соединения широко используются в органическом синтезе и в качестве катализаторов.
Применение
Из лития изготовляют аноды химических источников тока, работающих на основе неводных твердых электролитов. Жидкий литий может служить теплоносителем в ядерных реакторах. С использованием нуклида 6Li получают радиоактивный тритий 31H (Т):
63Li + 10n = 31H + 42He.
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий, в черной и цветной металлургии (для раскисления, повышения пластичности и прочности сплавов), для получения пластичных смазок. Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Биологическая роль
Литий в незначительных количествах присутствует в живых организмах, но по-видимому, не выполняет никаких биологических функций. Установлено его стимулирующее действие на некоторые процессы в растениях, способность повышать их устойчивость к заболеваниям.
В организме среднего человека (масса 70 кг) содержится около 0,7 мг лития. Токсическая доза 90—200 мг.
Особенности обращения с литием
Как и другие щелочные металлы, металлический литий способен вызывать ожоги кожи и слизистых, особенно в присутствии влаги. Поэтому работать с ним можно только в защитной одежде и очках. Хранят литий в герметичной таре под слоем минерального масла. Отходы лития нельзя выбрасывать в мусор, для уничтожения их следует обработать этиловым спиртом:
2С2Н5ОН + 2Li = 2С2Н5ОLi + Н2
Образовавшийся этилат лития затем разлагают водой до спирта и гидроксида лития LiOH.
Энциклопедический словарь.
2009.
Литий
Ли́тий (лат. Lithium; обозначается символом Li) — элемент главной подгруппы первой группы, второго периода периодической системы химических элементов таблицы Менделеева, с атомным номером 3. Простое вещество литий (CAS-номер: 7439-93-2) — мягкий щелочной металл серебристо-белого цвета.
История и происхождение названия
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите KLi1.5Al1.5[Si3AlO10](F,OH)2. Металлический литий впервые получил Гемфри Дэви в 1825 году.
Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Нахождение в природе
Геохимия лития
Литий по геохимическим свойствам относится к крупноионным литофильным элементам, в числе которых калий, рубидий и цезий. Содержание лития в верхней континентальной коре составляет 21 г/т, в морской воде 0,17 мг/л.
Основные минералы лития — слюда лепидолит — KLi1.5Al1.5[Si3AlO10] (F, OH)2 и пироксен сподумен — LiAl [Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространенных породообразующих минералах.
Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, высоким содержанием фтора и воды, и исключительно высокими концентрациями различных редких элементов, в том числе и лития.
Другой тип месторождений лития — рассолы некоторых сильносоленых озёр.
Месторождения
Месторождения лития известны в России (более 50% запасов страны сосредоточено в редкометальных месторождениях Мурманской области), Боливии, Аргентине, Мексике, Афганистане, Чили, США, Канаде, Бразилии, Испании, Швеции, Китае, Австралии, Зимбабве, Конго.
Получение
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси).
2LiCl = 2Li + Cl2
В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды).
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Химические свойства
Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранится в керосине (к тому же плотность лития столь мала, что он будет в нём плавать) и может непродолжительное время храниться на воздухе.
Во влажном воздухе медленно реагирует с азотом, находящимся в воздухе, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3. В кислороде при нагревании горит, превращаясь в оксид Li2O. Есть интересная особенность, что в интервале температур от 100 °C до 300 °C литий покрывается плотной оксидной плёнкой, и в дальнейшем не окисляется.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура возгорания находится около 300 °C. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2. Реагирует также с этиловым спиртом (с образованием алкоголята), с водородом (при 500—700 °C) с образованием гидрида лития, с аммиаком и с галогенами (с иодом — только при нагревании). При 130 °C реагирует с серой с образованием сульфида. В вакууме при температуре выше 200 °C реагирует с углеродом (образуется ацетиленид). При 600—700 °C литий реагирует с кремнием с образованием силицида. Химически растворим в жидком аммиаке (−40 °C), образуется синий раствор.
Литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках. Металлический литий вызывает ожоги при попадании на влажную кожу, слизистые оболочки и в глаза.
Источник: Википедия
Другие заметки по химии
- Распространение лития в природе и его промышленное извлечение.
- Характеристика простого вещества и промышленное получение металлического лития.
- Соединения лития.
ЛИТИЙ (Lithium) Li, химический элемент 1-й (Ia) группы Периодической системы, относится к щелочным элементам. Атомный номер 3, относительная атомная масса 6,941. Состоит из двух стабильных изотопов 6Li (7,52%) и 7Li (92,48%). Искусственным путем получены еще два изотопа лития: у 8Li период полураспада равен 0,841 с, а у 9Li 0,168 с.
Степень окисления +1.
Литий был открыт в 1817 шведским химиком и минералогом Августом Арфведсоном (Arfvedson August) (1792–1841), когда он работал в качестве ассистента в лаборатории Йёнса Якоба Берцелиуса. На основании химического анализа петалита (LiAlSi4O10) Арфведсон предположил, что в этом слоистом силикатном минерале есть некий щелочной элемент. Он отметил, что его соединения похожи на соединения натрия и калия, однако карбонат и гидроксид менее растворимы в воде. Арфведсон предложил для нового элемента название литий (от греческого liqoz – камень), указывающее на его происхождение. Он показал также, что этот элемент содержится в сподумене (силикатный пироксен) LiAlSi2O6 и в лепидолите (слюда), который имеет примерный состав K2Li3Al4Si7O21(OH,F)3.
В 1818 английский химик и физик Гемфри Дэви выделил металлический литий электролизом расплавленного гидроксида лития.
Распространение лития в природе и его промышленное извлечение.
Содержание лития в кристаллических горных породах составляет 1,8·10–3% по массе, что косвенно отражает относительное малую распространенность элемента во Вселенной. На Земле он имеет почти такую же распространенность как галлий (1,9·10–3%) и ниобий (2,0·10–3%). Промышленные месторождения минералов лития есть на всех континентах. Наиболее важным минералом является сподумен, большие месторождения которого имеются в США, Канаде, Бразилии, Аргентине, странах СНГ, Испании, Швеции, Китае, Австралии, Зимбабве и Конго.
Почти всю мировую добычу минералов лития контролируют три главных компании – Sons of Gwalia (Австралия), Tanco (Канада) и Bikita Minerals (Зимбабве). Добыча минералов лития за период 1994–2000 увеличилась с 6300 до 11 900 т. в год. При этом 50% мировых мощностей по добыче сподумена, лепидолита и других литиевых минералов в последние годы простаивает. Таким образом, есть необходимые резервы для наращивания объемов выпуска литиевой продукции и дефицит лития потребителям не грозит.
Содержание лития в большинстве коммерческих руд составляет 1–3%. Оно может быть увеличено флотацией до 4–6%.
Для получения нужных соединений лития сподумен нагревают до ~1100° С, а затем промывают серной кислотой при 250° С и выщелачивают образовавшийся сульфат лития водой. Действием карбоната натрия или хлороводорода его переводят в карбонат или хлорид, соответственно. Другим способом хлорид может быть получен прокаливанием промытой руды с известняком (карбонатом кальция) при 1000° С с последующим выщелачиванием водой в виде гидроксида лития и действием хлороводорода. В США также широко используется добыча соединений лития из природных рассолов.
Потребление минералов лития распределяется следующим образом: 25% используют заводы по производству огнеупорных изделий, 20% идет в производство специальных сортов стекол, столько же – на изготовление керамических изделий и глазурей, 12% потребляет собственно химическая промышленность, 10% – металлургическая, 5% литиевых минералов используется в производстве стекловолокна и 8% идет на нужды других отраслей. К областям специального применения относится растущий рынок сегнетоэлектриков, таких как танталат лития, для модулирования лазерных лучей. Предполагается, что в будущем будет резко расти спрос на металл и его соли в производстве литиевых батарей, используемых в мобильных телефонах и переносных компьютерах (в 1990-х темпы роста составляли 20–30% в год). В то же время будет падать потребление карбоната лития в алюминиевой промышленности, где новые технологии вообще не предусматривают использование этой соли.
Характеристика простого вещества и промышленное получение металлического лития.
Литий – серебристо-белый металл, мягкий и пластичный, тверже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объемноцентрированную решетку (координационное число 8), которая при холодной обработке переходит в кубическую плотноупакованную решетку, где каждый атом, имеющий двойную кубооктаэдрическую координацию, окружен 12 другими. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340° С, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см3).
В 1818 немецкий химик Леопольд Гмелин (Gmelin Leopold) (1788–1853) установил, что соли лития окрашивают бесцветное пламя в карминово-красный цвет.
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только ниже 380° С и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие пары щелочных металлов смешиваются друг с другом в любых соотношениях.
В целом, литий менее реакционноспособен, чем его аналоги. В то же время он намного легче других щелочных металлов реагирует с азотом, углеродом, кремнием и этим напоминает магний. Литий легко вступает в прямую реакцию с азотом с образованием нитрида Li3N (ни один другой щелочной металл не обладает этим свойством). Эта реакция, хотя и медленно, идет уже при комнатной температуре, а при 250° C ход ее значительно ускоряется. При сжигании литий образует оксид Li2O (с примесью пероксида Li2O2),
С водой литий реагирует с образованием гидроксида и выделением водорода. Литий растворяется в жидком аммиаке, образуя синий раствор с металлической проводимостью. Если сравнить молярные отношения, то он почти на 50% более растворим, чем натрий (15,66 и 10,93 моль на килограмм NH3, соответственно). В таком растворе литий медленно реагирует с аммиаком с выделением водорода и образованием амида LiNH2.
Потенциал восстановления для лития (–3,045 В) на первый взгляд кажется аномальным, так как он ниже, чем у других щелочных элементов. Это связано с тем, что катиону лития, имеющему наименьший радиус, соответствует максимальная энергия гидратации, что делает образование гидратированного катиона энергетически более выгодным по сравнению с другими щелочными металлами.
В значительных количествах металлический литий первыми выделили в 1855 (независимо друг от друга) немецкий химик Роберт Бунзен и англичанин О.Матиссен. Как и Дэви, они получали литий электролизом, только электролитом в их опытах служил расплав хлорида лития. Первое промышленное производство лития было налажено в Германии в 1923. Металлический литий и сейчас получают электролизом расплавленной смеси 55% хлорида лития и 45% хлорида калия при ~450° С. Выделяющийся на аноде хлор – ценный побочный продукт.
Для получения лития иногда применяют и восстановление другими элементами, образующими устойчивые оксиды:
2Li2O + Si = SiO2 + 4Li
Сегодня в мире производится более 1000 т лития в год.
Металлический литий был впервые использован в коммерческих целях в 1920-е в виде сплава со свинцом для изготовления подшипников. Сейчас он применяется в производстве высокопрочных легких алюминиевых сплавов для строительства самолетов. С магнием литий образует чрезвычайно легкие сплавы, используемые для изготовления бронированных пластин и элементов космических объектов. Например, сплав, содержащий 14% лития, 1% алюминия и 85% магния, имеет плотность 1,35 г см–3.
Литий стал эффективным средством для удаления из расплавленных металлов растворенных в них газов. Небольшими добавками лития легируют чугун, бронзы, монель-металл (сплав, выплавляемый из медно-никелевых руд), а также сплавы на основе магния, алюминия, цинка, свинца и некоторых других металлов.
Мелкодисперсный элементарный литий намного ускоряет реакцию полимеризации изопрена. Расплавленный металлический литий-7, имеющий малое сечение захвата тепловых нейтронов, используется в качестве теплоносителя в ядерных реакторах.
В будущем, возможно, перспективными источниками электроэнергии станут системы из батарей Li/FeSx. Эти батареи похожи на обычные свинцовые кислотные батареи наличием твердых электродов (отрицательный из сплава Li/Si, положительный из FeSx) и жидкого электролита (расплав LiCl/KCl при 400° С).
Соединения лития.
Литий большее сходен с магнием, чем со своими соседями по группе. Эта так называемая диагональная периодичность является следствием близости ионных радиусов элементов: R(Li+) 76 пм, R(Mg2+) 72 пм; для сравнения R(Na+) 102 пм. Арфведсон первым отметил при открытии лития как нового элемента, что его гидроксид и карбонат значительно менее растворимы, чем соответствующие соединения натрия и калия, и что карбонат (подобно карбонату магния) легче разлагается при нагревании. Подобным образом, фторид лития (как и фторид магния) гораздо менее растворим в воде, чем фториды других щелочных элементов. Это связано с высокой энергией кристаллической решетки, образованной катионами и анионами малых размеров. Напротив, соли лития с большими неполяризуемыми анионами, такими как перхлорат-ион, значительно более растворимы, чем соли других щелочных элементов, вероятно, из-за высокой энергии сольватации катиона лития. По той же причинам безводные соли очень гигроскопичны.
Соли лития склонны к образованию гидратов, обычно тригидратов, например LiX·3H2O (X = Cl, Br, I, ClO3, ClO4, MnO4, NO3, BF4 и т.д.). В большинстве этих соединений литий координирует шесть молекул Н2О, образуя цепочки из октаэдров с общими гранями. Сульфат лития, в отличие от сульфатов других щелочных элементов, не образует квасцы, так как гидратированный катион лития слишком мал, чтобы занять соответствующее место в структуре квасцов.
Оксид лития Li2O – единственный среди оксидов щелочных элементов, образующихся в качестве основного продукта при нагревании металла выше 200° С (на воздухе). Его получают и прокаливанием нитрата при 600° С (в присутствии меди):
4LiNO3 = 2Li2O + 4NO2 + O2
Он образуется при нагревании нитрита лития выше 190° С или карбоната лития выше 700° С в токе высушенного водорода.
Оксид лития добавляют к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса. Он является компонентом рентгенопрозрачных стекол и стекол с небольшим температурным коэффициентом линейного расширения. Оксид лития добавляют в глазури и эмали. Он повышает их химическую и термическую стойкость и прочность, снижает вязкость расплавов.
Пероксид лития Li2O2 в промышленности получают реакцией LiOH·H2O с пероксидом водорода с последующей дегидратацией гидропероксида острожным нагреванием при пониженном давлении. Это белое кристаллическое вещество разлагается до оксида лития при нагревании выше 195° С. Его используют в космических аппаратах для получения кислорода:
2Li2O2 + 2CO2 = 2Li2CO3 +O2
Гидроксид лития LiOH плавится при 470° С, при более высокой температуре испаряется и частично диссоциирует на оксид лития и воду:
2LiOH = Li2O + H2O
В парах при 820–870° С содержится 90% димера (LiOH)2.
Растворимость гидроксида лития в воде составляет 12,48 г на 100 г при 25° С. При выпаривании водных растворов гидроксида лития образуется моногидрат, который легко теряет воду при нагревании в инертной атмосфере или при пониженном давлении.
Гидроксид лития используется в производстве смазок на основе стеарата лития и для поглощения диоксида углерода в закрытых помещениях, например, в космических кораблях и на подводных лодках. Его преимущество по сравнению с другими щелочами – малая атомная масса. Добавка гидроксида лития к электролиту щелочных аккумуляторов примерно на одну пятую увеличивает их емкость и в 2–3 раза – срок службы.
Карбонат лития Li2CO3 – наиболее промышленно важное соединение лития и исходное вещество для получения большинства других его соединений. В отличие от других солей лития, Li2CO3 является безводным. Он мало растворим в воде, причем растворимость карбоната лития понижается с повышением температуры. При 25° С она равна 1,27 г на 100 г воды, а при 75° С – 0,85 г на 100 г воды.
Термическая устойчивость карбоната лития существенно ниже, чем аналогичных соединений других щелочных элементов. Выше температуры плавления (732° С) он разлагается:
Li2CO3 = Li2O + CO2
Карбонат лития используется в качестве флюса при нанесении фарфоровой эмали и в производстве специальных закаленных стекол, при этом ионы лития замещают более крупные ионы натрия. Соединение лития либо вводят в состав стеклянной шихты, либо натриевое стекло обрабатывают расплавом солей, содержащих ионы лития, чтобы вызвать обмен катионов на его поверхности.
Еще одна область применения карбоната лития – в производстве алюминия. Он на 7–10% увеличивает качество продукции за счет снижение температуры плавления электролита и увеличения силы тока. Кроме того, на 25–50% уменьшается нежелательное выделение фтора.
В 1949 было обнаружено, что небольшие (1–2 г) дозы карбоната лития при приеме через рот приводят к эффективному воздействию на маниакально-депрессивные психозы. Механизм воздействия еще не совсем понятен, однако побочные явления пока не обнаружены. Такие дозы поддерживают концентрацию лития в крови около 1 ммоль л–1, и его действие может быть связано с влиянием лития на баланс Na/K и (или) Mg/Ca.
Нитрат лития LiNO3 гигроскопичен и хорошо растворим в воде (45,8 масс. % при 25° С, то есть 6,64 моль л–1). Из водных растворов кристаллизуется в виде тригидрата.
Нитрат лития используется в виде низкотемпературных расплавов в лабораторных термостатах. Например смесь LiNO3:KNO3 (1:1) плавится при 125° С. Кроме того, нитрат лития применяют в пиротехнических смесях.
Фторид лития LiF мало растворим в воде (1,33 г/л при 25° С). Его получают взаимодействием гидроксида лития или солей лития с фтороводородом, фторидом аммония, гидродифторидом аммония или их водными растворами.
Еще в прошлом веке это вещество начали применять в металлургии как компонент многих флюсов. Фторид лития обладает термолюминесцентными свойствами. Он используется в рентгеновской и g-дозиметрии. Кристаллы фтористого лития, прозрачные для ультракоротких волн длиной до 100 нм, применяют в производстве оптических приборов, кроме того, фторид лития является компонентом электролитов при получении алюминия и фтора. Он входит в состав эмалей, глазурей, керамики, люминофоров и лазерных материалов.
Для атомной техники важно моноизотопное соединение пития – 7LiF, применяемое для растворения соединений урана и тория непосредственно в реакторах.
Хлорид лития LiCl хорошо растворим в воде (84,67 г на 100 г при 25° С) и многих органических растворителях. Большое сродство к воде служит основой для широкого применения рассолов хлорида (и бромида) лития в осушителях и воздушных кондиционерах.
Хлорид лития является сырьем для получения металлического лития. Другая область применения этого соединения – в качестве флюса при пайке алюминиевых частей автомобиля. Его используют и в производстве флотационных жидкостей, как катализатор органического синтеза. Хлорид лития служит средством против обледенения самолетов. Он является твердым электролитом в химических источниках тока для имплантированных кардиостимуляторов.
Гидрид лития LiH получают взаимодействием расплавленного лития с водородом при 630–730° С в сосуде из железа, не содержащего углерод. Он образует бесцветные кристаллы с кубической решеткой типа хлорида натрия. Гидрид лития имеет плотность 0,776 г/см3, температуру плавления 692° С (в инертной атмосфере). При электролизе в расплаве проводит электрический ток с выделением водорода на аноде. Под действием электромагнитного излучения в видимой, ультрафиолетовой или рентгеновской области окрашивается в голубой цвет благодаря образованию коллоидного раствора лития в гидриде лития.
Гидрид лития относительно устойчив в сухом воздухе, быстро гидролизуется парами воды. Реагирует с водой, кислотами и спиртами с выделением водорода. Из 1 кг гидрида лития можно получить 2,82 м3 этого газа. Гидрид лития используется для получения водорода, которым наполняют метеорологические шары-зонды в полевых условиях. Кроме того, он служит восстановителем в органическом синтезе, а также для получения бороводородов, алюмогдидрида лития LiAlH4 и других гидридных соединений.
Дейтерид лития-6 применяется в термоядерном оружии. Будучи твердым веществом, он позволяет хранить дейтерий при плюсовых температурах, кроме того, второй его компонент (литий-6) – это единственный промышленный источник получения трития:
63Li +10n ®31H + 42He
Стеарат лития Li(C17H35COO) легко образуется из гидроксида лития и животного или другого природного жира, применяется как загуститель и желирующий агент при превращении масел в консистентные смазки. Эти многоцелевые смазки сочетают высокую устойчивость к действию воды, хорошие свойства при низких температурах (–20° С) и отличную стабильность при высоких температурах (более 150° С). Они занимают почти половину общего рынка автомобильных смазок в США.
Комплексные соединения. Из всех щелочных элементов литий наиболее склонен к образованию комплексов, образует стабильный комплекс с ЭДТА (натриевой солью этилендиаминтетрауксусной кислоты). Устойчивыми являются комплексы лития с краун-эфирами.
Литиеорганические соединения легко получаются непосредственным взаимодействием лития с алкилгалогенидами (обычно используют хлориды) в петролейном эфире, циклогексане, бензоле или диэтиловом эфире:
2Li + RX ® LiR + LiX
Из-за высокой химической активности как реагентов, так и продуктов реакции нужно использовать инертную атмосферу, исключающую воздух и влагу. Выход продукта существенно увеличивается в присутствии 0,5–1% натрия в металлическом литии. Арильные производные лития получают из бутиллития (LiBu) и арилиодида:
LiBu + ArI ® LiAr + BuI
Наиболее удобный путь для получения винильных, аллильных и других ненасыщенных производных – реакция фениллития с тетравинилоловом:
4LiPh + Sn(CH=CH2)4® 4LiCH=CH2 + SnPh4
Если важнее выделить продукт реакции, чем использовать его в дальнейшем синтезе, используют реакцию между избытком лития и ртутьорганическим соединением:
2Li + HgR2® 2LiR + Hg
Литиеорганические соединения термически неустойчивы, и большинство из них постепенно разлагается до гидрида лития и алкена при комнатной или более высокой температуре. Среди наиболее устойчивых соединений – бесцветные кристаллические LiСН3 (разлагается выше 200° С) и LiС4Н9 (разлагается в небольшой степени при выдерживании в течение нескольких дней при 100° С). Обычно алкильные производные лития имеют тетрамерное или гексамерное строение.
Металлоорганические соединения лития (в частности, LiСН3 и LiС4Н9) являются ценными реактивами. Последние десятилетия они все более используются в промышленном и лабораторном органическом синтезе. Ежегодное производство одного только LiС4Н9 подскочило от нескольких килограммов до 1000 т. В большом количестве он применяется как катализатор полимеризации, алкилирующий агент и предшественник металлированных органических реагентов. Многие синтезы, подобные реакциям с участием реактивов Гриньяра, имеют явные преимущества по сравнению с ними по скорости реакции, отсутствию усложняющих процесс побочных реакций или удобству работы.
В реакциях литиеорганических соединений с алкилиодидами или, что более полезно, с карбонилами металлов образуются новые связи С–С. В последнем случае продуктами являются альдегиды или кетоны. Термическое разложение LiR приводит к удалению b-водородного атома с образованием олефина и LiH, этот процесс промышленно значим для получения алкенов с длинной концевой цепью. Арилпроизводные лития в неполярных растворителях дают карбоновые кислоты с диоксидом углерода и третичные спирты – с ароматическими кетонами. Литиеорганические соединения являются также ценными реагентами в синтезе других металлоорганических соединений путем обмена металл – галоген.
Наиболее ионными из металлоорганических соединений лития являются карбиды, образующиеся при взаимодействии лития с алкинами в жидком аммиаке. Самая крупная область промышленного применения LiHC2 – производство витамина А. Он влияет на этинилирование метилвинилкетона, приводящего к образованию ключевого промежуточного карбинольного соединения.
Елена Савинкина
Химический элемент с атомным номером 3
Химический элемент с атомным номером 3
 Литий, плавающий в масле Литий, плавающий в масле |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Литий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | () | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | серебристо-белый | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (Li) | [6,938, 6,997] условно: 6,94 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Литий в периодической таблице | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 1 : H и щелочные металлы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | s-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Щелочной металл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [He ] 2s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | твердое тело | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка плавления | 453,65 K (180,50 ° C, 356,90 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 1603 K (1330 ° C, 2426 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (около rt ) | 0,534 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при т.пл. ) | 0,512 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Критическая точка | 3220 K, 67 МПа (экстраполировано) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 3,00 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 136 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 24,860 Дж / (моль · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный пр. operties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Состояние окисления | +1(сильно основной оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 0,98 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергия ионизации |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 128 ± 7 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ван-дер-Ваальсовый радиус | 182 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное происхождение | изначальное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | объемно-центрированная кубическая (bcc)  |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкий стержень | 6000 м / с (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 46 мкм / (м · К) (при 25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое электропроводность | 84,8 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 92,8 нОм · м (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное упорядочение | парамагнитное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитная восприимчивость | + 14,2 · 10 см / моль (298 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 4,9 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 4,2 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 11 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Моосу | 0,6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 5 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7439-93-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dis covery | Йохан Август Арфведсон (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Первая изоляция | Уильям Томас Бранд (1821) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы лития | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ссылки |
Литий (от греч. : λίθος, романизированный : lithos, lit. «камень») — это химический элемент с символом Liи атомным номером 3. Это мягкий серебристо-белый щелочной металл. При стандартных условиях это самый легкий металл и самый легкий твердый элемент. Как и все щелочные металлы, литий очень реакционноспособен и легко воспламеняется, поэтому его необходимо хранить в минеральном масле. При резке он имеет металлический блеск, но влажный воздух быстро разъедает его до тускло-серебристо-серого, а затем черного тусклого налета. Он никогда не встречается в природе свободно, а только в (обычно ионных) соединениях, таких как пегматитовые минералы, которые когда-то были основным источником лития. Благодаря своей растворимости в виде иона он присутствует в океанской воде и обычно получается из рассолов. Металлический литий изолирован электролитически из смеси хлорида лития и хлорида калия.
. Ядро атома лития находится на грани нестабильности, поскольку два стабильных изотопа лития, встречающиеся в природе, имеют одни из самых низких энергий связи на нуклон из всех стабильных нуклидов. Из-за относительной ядерной нестабильности литий менее распространен в Солнечной системе, чем 25 из первых 32 химических элементов, даже несмотря на то, что его ядра очень легкие: это исключение из тенденции, согласно которой более тяжелые ядра встречаются реже. По связанным причинам литий имеет важное применение в ядерной физике. Превращение атомов лития в гелий в 1932 году было первой полностью искусственной ядерной реакцией, а дейтерид лития служит термоядерный синтез топливо в ступенчатом термоядерном оружии.
Литий и его соединения имеют несколько промышленных применений, включая термостойкое стекло и керамику, литиевые смазки смазочные материалы, флюсовые добавки для производства чугуна, стали и алюминия, литиевые батареи и литий-ионные батареи. На эти виды использования уходит более трех четвертей производства лития.
Литий присутствует в биологических системах в следовых количествах; его функции неопределенны. Соли лития оказались полезными в качестве стабилизирующего настроение лекарственного средства при лечении биполярного расстройства у людей.
Содержание
- 1 Свойства
- 1.1 Атомные и физические
- 1.2 Химия и соединения
- 1.2.1 Органическая химия
- 1.3 Изотопы
- 2 Возникновение
- 2.1 Астрономические
- 2.2 Наземные
- 2.3 Биологические
- 3 История
- 4 Производство
- 4.1 Запасы
- 4.2 Цены
- 4.3 Добыча
- 4.4 Инвестиции
- 5 Области применения
- 5.1 Керамика и стекло
- 5.2 Электротехника и электроника
- 5.3 Консистентные смазки
- 5.4 Металлургия
- 5.5 Кремниевая наносварка
- 5.6 Другое химическое и промышленное применение
- 5.6.1 Пиротехника
- 5.6.2 Очистка воздуха
- 5.6.3 Оптика
- 5.6.4 Органическая и полимерная химия
- 5.6.5 Военное применение
- 5.7 Ядерная промышленность
- 5.8 Медицина
- 6 Биологическая роль
- 7 Меры предосторожности
- 8 См. Также
- 9 Примечания
- 10 Источники
- 11 Внешние ссылки
Свойства
Атомные и физические

Как и другие щелочные металлы, литий имеет единственный валентный электрон, который легко превращается в катион . Из-за этого литий является хорошим проводником тепла и электричества, а также элементом с высокой реакционной способностью, хотя он наименее реактивен из щелочных металлов. Низкая реакционная способность лития связана с близостью его валентного электрона к его ядру (оставшиеся два электрона находятся на 1-й орбитали, что значительно ниже по энергии, и не участвуют в химических связях). Однако расплавленный литий значительно более активен, чем его твердая форма.
Металлический литий достаточно мягкий, чтобы его можно было разрезать ножом. После резки он приобретает серебристо-белый цвет, который быстро меняется на серый при окислении до оксида лития. Хотя он имеет одну из самых низких точек плавления среди всех металлов (180 ° C, 453 K), он имеет самые высокие точки плавления и кипения среди щелочных металлов.
Литий имеет очень высокую температуру. низкая плотность (0,534 г / см), сопоставимая с древесиной сосны. Это наименее плотный из всех элементов, находящихся в твердом состоянии при комнатной температуре; следующий по легкости твердый элемент (калий 0,862 г / см) более чем на 60% плотнее. Кроме того, за исключением гелия и водорода, в твердом виде он менее плотен, чем любой другой элемент в виде жидкости, будучи только на две трети плотнее, чем жидкий азот <162.>(0,808 г / см). Литий может плавать в самых легких углеводородных маслах и является одним из трех металлов, которые могут плавать в воде, два других — натрий и калий.

Литий коэффициент теплового расширения вдвое больше, чем у алюминия, и почти в четыре раза больше, чем у железа. Литий сверхпроводящий ниже 400 мкК при стандартном давлении и при более высоких температурах (более 9 К) при очень высоких давлениях (>20 ГПа). При температурах ниже 70 К литий, как и натрий, претерпевает бездиффузионные фазовые превращения. При 4,2 К он имеет ромбоэдрическую кристаллическую систему (с девятислойным повторяющимся интервалом); при более высоких температурах он превращается в гранецентрированный куб, а затем в объемноцентрированный куб. При температурах жидкого гелия (4 К) преобладает ромбоэдрическая структура. Для лития при высоких давлениях были идентифицированы множественные аллотропные формы.
Литий имеет массу удельную теплоемкость 3,58 килоджоулей на килограмм-кельвин, что является самым высоким показателем среди всех твердых веществ. Из-за этого металлический литий часто используется в охлаждающих жидкостях для теплопередачи.
Химия и соединения
Литий легко реагирует с водой, но с заметно меньшей энергией, чем другие щелочные металлы. В результате реакции образуется водород газ и гидроксид лития в водном растворе. Из-за своей реакционной способности с водой литий обычно хранится в углеводородном герметике, часто вазелин. Хотя более тяжелые щелочные металлы могут храниться в более плотных веществах, таких как минеральное масло, литий недостаточно плотный, чтобы полностью погрузиться в эти жидкости. Во влажном воздухе литий быстро тускнеет с образованием черного покрытия из гидроксида лития (LiOH и LiOH · H 2 O), нитрида лития (Li 3 N) и карбонат лития (Li 2CO3, результат вторичной реакции между LiOH и CO2 ).

При размещении над пламенем соединения лития приобретают поразительный малиновый цвет, но когда металл сильно горит, пламя становится сверкающим серебром. Литий воспламеняется и горит в кислороде при воздействии воды или водяных паров. Литий легковоспламеняющийся, и он потенциально взрывоопасен при контакте с воздухом и особенно с водой, хотя и в меньшей степени, чем другие щелочные металлы. Реакция лития с водой при нормальных температурах протекает быстро, но ненасильственно, поскольку Произведенный водород не воспламеняется сам по себе. Как и в случае со всеми щелочными металлами, литиевые возгорания трудно тушить, требуя порошковых огнетушителей (класса D типа). Литий — один из немногих металлов, который реагирует с азотом в нормальных условиях.
Литий имеет диагональное соотношение с магнием, элементом аналогичного атомный и ионный радиус. Химическое сходство между двумя металлами включает образование нитрида в результате реакции с N 2, образование оксида (Li. 2O) и пероксида. (Li. 2O. 2) при сжигании в солях O 2, с аналогичной растворимостью и термической нестабильностью карбонатов и нитридов. Металл реагирует с газообразным водородом при высоких температурах с образованием гидрида лития (LiH).
Другие известные бинарные соединения включают галогениды (LiF, LiCl, LiBr, LiI ), сульфид (Li. 2S ), супероксид (LiO. 2 ) и карбид (Li. 2C. 2 ). Известно много других неорганических соединений, в которых литий соединяется с анионами с образованием солей: бораты, амиды, карбонат, нитрат. или борогидрид (LiBH. 4 ). Литийалюминийгидрид (LiAlH. 4) обычно используется в качестве восстановителя в органическом синтезе.
LiHe, очень слабо взаимодействующее соединение Ван-дер-Ваальса, было обнаружено при очень низких температурах.
В отличие от других элементов в группе 1, неорганические соединения лития следуют правило дуэта, а не правило октетов.
Органическая химия
Известны литийорганические реагенты, в которых существует прямая связь между углеродом и атомами лития. Эти соединения имеют ковалентные связи металл-углерод, которые сильно поляризованы по отношению к углероду, что позволяет им эффективно служить в качестве стабилизированных металлом карбанионов, хотя их раствор и твердотельная структура более сложны, чем предполагает этот упрощенный взгляд. за счет образования олигомерных кластеров. Таким образом, это чрезвычайно мощные основания и нуклеофилы. Они также применялись в асимметричном синтезе в фармацевтической промышленности. Для лабораторного органического синтеза многие литийорганические реагенты коммерчески доступны в форме растворов. Эти реагенты обладают высокой реакционной способностью, а иногда и пирофорными.
Подобно его неорганическим соединениям, почти все органические соединения лития формально подчиняются правилу дуэта (например, BuLi, MeLi). Однако важно отметить, что в отсутствие координирующих растворителей или лигандов литийорганические соединения образуют димерные, тетрамерные и гексамерные кластеры (например, BuLi на самом деле представляет собой [BuLi] 6, а MeLi на самом деле представляет собой [MeLi] 4), которые имеют многоцентровую связь и увеличивают координационное число вокруг лития. Эти кластеры распадаются на более мелкие или мономерные единицы в присутствии растворителей, таких как диметоксиэтан (DME), или лигандов, таких как тетраметилэтилендиамин (TMEDA). В качестве исключения из правила дуэтов, двухкоординатный лифтный комплекс с четырьмя электронами вокруг лития, [Li (thf) 4 ] [((Me 3 Si) 3C)2Li ], был охарактеризован кристаллографически.
Изотопы
Встречающийся в природе литий состоит из двух стабильных изотопов, Li и Li, причем последний является более распространенным (92,5% естественное содержание ). Оба природных изотопа имеют аномально низкую энергию связи ядра на нуклон (по сравнению с соседними элементами в периодической таблице, гелий и бериллий ); литий — единственный элемент с низким номером, который может производить чистую энергию посредством ядерного деления. Два ядра лития имеют более низкую энергию связи на нуклон, чем любые другие стабильные нуклиды, кроме дейтерий и гелий-3. В результате этого, хотя и очень легкий по атомному весу, литий менее распространен в Солнечной системе, чем 25 из первых 32 химических элементов. Семь радиоизотопы были охарактеризованы, наиболее стабильными из которых являются Li с периодом полураспада 838 мс и Li с периодом полураспада 178 мс. Все оставшиеся радиоактивные изотопы имеют период полураспада менее 8,6 мс. Самым короткоживущим изотопом лития является Li, который распадается посредством испускания протона и имеет период полураспада 7,6 × 10 с.
Li является одним из первичных элементов (или, точнее, первичные нуклиды ), полученные в нуклеосинтезе Большого взрыва. Небольшое количество Li и Li производится в звездах, но считается, что они «сгорают » так же быстро, как и производятся. Дополнительные небольшие количества лития как из лития, так и из лития могут образовываться из солнечного ветра, космических лучей, поражающих более тяжелые атомы, и из-за радиоактивного распада Be и Be в ранней солнечной системе. В то время как литий создается в звездах во время звездного нуклеосинтеза, он далее сжигается. Li также может образовываться в углеродных звездах.
Изотопы лития существенно фракционируются во время широкого спектра естественных процессов, включая образование минералов (химическое осаждение), метаболизм и ионный обмен. Ионы лития замещают магний и железо в октаэдрических участках в глинистых минералах, где Li предпочтительнее Li, что приводит к обогащению легким изотопом в процессах гиперфильтрации и изменения пород. Известно, что экзотический Li демонстрирует ядерный гало. Процесс, известный как лазерное разделение изотопов, может использоваться для отделения изотопов лития, в частности лития от лития.
Производство ядерного оружия и другие приложения ядерной физики являются основным источником искусственного фракционирования лития. при этом легкий изотоп Li остается в промышленных и военных запасах до такой степени, что вызывает небольшое, но измеримое изменение отношения Li к Li в природных источниках, таких как реки. Это привело к необычной неопределенности в стандартизованном атомном весе лития, поскольку это количество зависит от естественных соотношений содержания этих встречающихся в природе стабильных изотопов лития, поскольку они доступны в коммерческих источниках минерального лития.
Оба стабильных изотопа лития могут быть охлаждены лазером и были использованы для получения первой квантово-вырожденной смеси Бозе — Ферми.
Встречаемость

Астрономические данные
Хотя это был синтезирован во время Большого взрыва, литий (вместе с бериллием и бором) значительно менее распространен во Вселенной, чем другие элементы. Это результат сравнительно низких звездных температур, необходимых для разрушения лития, а также отсутствия общих процессов для его производства.
Согласно современной космологической теории, литий — в обоих стабильных изотопах (литии-6 и литии). -7) — был одним из трех элементов, синтезированных в результате Большого взрыва. Хотя количество лития, образующегося в нуклеосинтезе при Большом взрыве, зависит от количества фотонов на барион, для принятых значений можно вычислить содержание лития, и там представляет собой «космологическое несоответствие лития » во Вселенной: более старые звезды, кажется, содержат меньше лития, чем должны, а некоторые более молодые звезды имеют гораздо больше. Недостаток лития в старых звездах, по-видимому, вызван «подмешиванием» лития внутрь звезд, где он разрушается, в то время как литий образуется в более молодых звездах. Хотя он превращает в два атома гелия из-за столкновения с протоном при температурах выше 2,4 миллиона градусов Цельсия (большинство звезд легко достигают этой температуры в своих недрах), литий более распространен, чем предсказывают современные вычисления, в звездах более позднего поколения.

Литий также обнаружен в коричневом карлике. субзвездные объекты и некоторые аномальные оранжевые звезды. Поскольку литий присутствует в более холодных и менее массивных коричневых карликах, но разрушается в более горячих красных карликах звезд, его присутствие в спектрах звезд можно использовать в «литиевом тесте», чтобы различить эти два карлика, поскольку оба меньше Солнца. Некоторые оранжевые звезды также могут содержать высокую концентрацию лития. Эти оранжевые звезды, как было обнаружено, имеют более высокую, чем обычно, концентрацию лития (например,) на орбите массивных объектов — нейтронных звезд или черных дыр — чья гравитация, очевидно, притягивает более тяжелый литий к поверхности водородно-гелиевой звезды, что приводит к обнаружению большего количества лития.
27 мая 2020 года астрономы сообщили, что классические новые звезды взрывы являются галактическими производителями лития.
Наземные
Хотя литий широко распространен на Земле, он не встречается в природе в элементарной форме из-за его высокой реакционной способности. Общее содержание лития в морской воде очень велико и оценивается в 230 миллиардов тонн, где элемент существует в относительно постоянной концентрации от 0,14 до 0,25 частей на миллион (ppm), или 25 микромолярных ; более высокие концентрации, приближающиеся к 7 ppm, обнаруживаются около гидротермальных источников.
Оценки содержания в земной коре находятся в диапазоне от 20 до 70 ppm по весу. Литий составляет около 0,002 процента земной коры. В соответствии со своим названием литий составляет незначительную часть магматических пород, с наибольшими концентрациями в гранитах. Гранитные пегматиты также содержат наибольшее количество литийсодержащих минералов, причем сподумен и петалит являются наиболее коммерчески жизнеспособными источниками. Другим важным минералом лития является лепидолит, который в настоящее время является устаревшим названием группы, образованной полилитионитом и трилитионитом. Новым источником лития является гекторит глина, единственная активная разработка которой осуществляется через Western Lithium Corporation в США. Литий, содержащий 20 мг лития на кг земной коры, занимает 25-е место по распространенности.
Согласно Справочнику по литию и природному кальцию, «Литий — сравнительно редкий элемент, хотя он содержится во многих породах и некоторых рассолах, но всегда в очень низких концентрациях. Существует довольно большое количество обоих месторождения литиевых минералов и рассола, но лишь сравнительно немногие из них представляют фактическую или потенциальную коммерческую ценность. Многие из них очень малы, другие имеют слишком низкое содержание «.
Геологическая служба США считает, что в 2010 году у Чили были самые большие запасы (7,5 млн тонн) и самый высокий годовой объем добычи (8 800 тонн). Одна из крупнейших резервных баз лития находится в районе Салар де Уюни в Боливии, где имеется 5,4 миллиона тонн. Другие крупные поставщики включают Австралию, Аргентину и Китай. По состоянию на 2015 год все Рудные горы в Чешской Республике считались литиевой провинцией. Зарегистрировано пять месторождений, одно около [cs ] рассматривается как потенциально экономичное месторождение, содержащее 160 000 тонн лития. В декабре 2019 года финская горнодобывающая компания Keliber Oy сообщила, что доказанные и вероятные запасы ее литиевого месторождения Рапасаари оцениваются в 5,280 миллиона тонн.
В июне 2010 года The New York Times сообщила, что американские геологи проводили наземные исследования на сухих соленых озерах в западном Афганистане, полагая, что там находятся большие залежи лития. «Представители Пентагона заявили, что их первоначальный анализ в одном месте в провинции Газни показал, что потенциал залежей лития такой же большой, как и в Боливии, которая теперь обладает крупнейшими известными запасами лития в мире». Эти оценки «основаны главным образом на старых данных, которые были собраны в основном Советским Союзом во время оккупации Афганистана с 1979–1989 годов». Стивен Петерс, глава проекта по разработке полезных ископаемых в Афганистане Геологической службы США, сказал, что ему не было известно об участии Геологической службы США в каких-либо новых изысканиях полезных ископаемых в Афганистане за последние два года. «Нам не известно о каких-либо открытиях лития», — сказал он. «
Лития (« литиевый рассол ») связана с местами добычи олова в Корнуолле, Англия, и рассматривается проект оценки испытательных скважин глубиной 400 м. В случае успеха горячие рассолы также будут обеспечивать геотермальной энергией для обеспечения процесса добычи и очистки лития.
Биологические
Литий в следовых количествах содержится во многих растениях, планктоне и беспозвоночных, в концентрациях от 69 до 5760 частей на миллиард (ppb). У позвоночных концентрация немного ниже, и почти все ткани и жидкости позвоночных животных содержат литий. от 21 до 763 частей на миллиард. Морские организмы склонны к биоаккумуляции лития больше, чем наземные организмы. Неизвестно, играет ли литий физиологическую роль в любом из этих организмов.
История

Петалит (LiAlSi 4O10) был открыт в 1 800 бразильским химиком и государственным деятелем Хосе Бонифасио де Андрада и Силва в шахте на острове Утё, Швеция. Однако только в 1817 году Йохан Август Арфведсон, тогда работавший в лаборатории химика Йонса Якоба Берцелиуса, обнаружил присутствие нового элемента, в то время как анализ петалитовой руды. Этот элемент образует соединения, аналогичные соединениям натрия и калия, хотя его карбонат и гидроксид менее растворимы в воде и менее щелочной. Берцелиус дал щелочному веществу название «литион / литина» от греческого слова λιθoς (транслитерированного как lithos, что означает «камень»), чтобы отразить его открытие в твердом минерале, в отличие от калия, который был обнаружен в золе растений., и натрий, который был известен отчасти своим высоким содержанием в крови животных. Он назвал металл внутри материала «литием».
Арфведсон позже показал, что этот же элемент присутствует в минералах сподумен и лепидолит. В 1818 году Кристиан Гмелин первым заметил, что соли лития придают пламени ярко-красный цвет. Однако и Арфведсон, и Гмелин пытались, но не смогли выделить чистый элемент из его солей. Он не был изолирован до 1821 года, когда Уильям Томас Бранде получил его с помощью электролиза оксида лития, процесса, который ранее использовал химик Сэр Хэмфри Дэви для выделения щелочных металлов калия и натрия. Бранде также описал некоторые чистые соли лития, такие как хлорид, и, оценив, что литий (оксид лития ) содержит около 55% металла, оценил атомный вес лития примерно в 9,8 г / моль (современный значение ~ 6,94 г / моль). В 1855 году большие количества лития были произведены путем электролиза хлорида лития Робертом Бунзеном и Августом Маттиссеном. Открытие этой процедуры привело к коммерческому производству лития в 1923 году немецкой компанией Metallgesellschaft AG, которая выполнила электролиз жидкой смеси хлорида лития и хлорида калия.
австралийский психиатр Джону Кейду приписывают повторное внедрение и популяризацию использования лития для лечения мании в 1949 году. Вскоре после этого, на протяжении середины 20-го века, стабилизирующее настроение литий стало применяться при мании и депрессии Взлетели в Европе и США.
Производство и использование лития претерпело несколько радикальных изменений в истории. Первое крупное применение лития было в высокотемпературных литиевых смазках для авиационных двигателей и аналогичных применений во время Второй мировой войны и вскоре после этого. Это использование подтверждается тем фактом, что мыла на основе лития имеют более высокую температуру плавления, чем другие щелочные мыла, и менее агрессивны, чем мыла на основе кальция. Небольшой спрос на литиевое мыло и консистентные смазки поддерживался несколькими небольшими горнодобывающими предприятиями, в основном в США.
Спрос на литий резко возрос во время холодной войны с производством ядерного термоядерного оружия. И литий-6, и литий-7 производят тритий при облучении нейтронами и, таким образом, полезны для производства самого трития, а также в виде твердого термоядерного топлива, используемого внутри водородных бомб в виде дейтерид лития. США стали основным производителем лития в период с конца 1950-х до середины 1980-х годов. В конце концов, запасы лития составляли примерно 42000 тонн гидроксида лития. Накопленный литий был обеднен литием-6 на 75%, что было достаточно, чтобы повлиять на измеренный атомный вес лития во многих стандартизированных химических веществах и даже на атомный вес лития в некоторых «естественных источниках» лития. иона, который был «загрязнен» солями лития, выпущенными из установок для разделения изотопов, которые попали в грунтовые воды.
Литий использовался для снижения температуры плавления стекла и улучшения плавления оксид алюминия при использовании процесса Холла-Эру. Эти два вида использования доминировали на рынке до середины 1990-х годов. После окончания гонки ядерных вооружений спрос на литий снизился, а продажа запасов энергии на открытом рынке еще больше снизила цены. В середине 1990-х годов несколько компаний начали добывать литий из рассола, что оказалось менее дорогостоящим вариантом, чем подземная или открытая добыча. Большинство рудников закрылись или переключились на другие материалы, потому что только руду из зональных пегматитов можно было добывать по конкурентоспособной цене. Например, американские шахты возле Кингс-Маунтин, Северная Каролина, закрылись до начала 21 века.
Разработка ионно-литиевых батарей увеличила спрос на литий и стала доминирующей областью применения в 2007 году. С резким ростом спроса на литий в батареях в 2000-х годах новые компании расширили усилия по извлечению рассола, чтобы удовлетворить растущий спрос.
Утверждалось, что литий будет одним из главных объектов геополитической конкуренции в мире, работающем на возобновляемых источниках энергии и зависящем от батарей, но эта точка зрения также подвергалась критике за недооценку силы экономических стимулов для расширения
Производство


Производство лития значительно увеличилось с конца Второй мировой войны. Металл отделен от других элементов в магматических минералах. Металл получают посредством электролиза из смеси расплавленного 55% хлорида лития и 45% хлорида калия при температуре около 450 ° C.
По состоянию на 2015 год большая часть мирового производства лития приходится на Южную Америку, где литийсодержащий рассол добывается из подземных бассейнов и концентрируется путем солнечного испарения. Стандартный метод экстракции — выпаривание воды из рассола. Каждая партия занимает от 18 до 24 месяцев.
.
Запасы
Мировые выявленные запасы в 2017, 2018, 2019 и 2020 годах были оценены Геологической службой США (USGS) в 14 миллионов., 16 миллионов, 14 миллионов и 17 миллионов тонн соответственно. Точная оценка мировых запасов лития затруднена. Одна из причин этого заключается в том, что большинство схем классификации лития разработаны для месторождений твердых руд, тогда как рассол представляет собой жидкость, которую проблематично обрабатывать с помощью той же схемы классификации из-за различных концентраций и эффектов закачки.
Выявлены мировые ресурсы лития. по USGS начал расти в 2017 году в связи с продолжением геологоразведочных работ. Выявленные ресурсы в 2016, 2017, 2018, 2019 и 2020 годах составляли 41, 47, 54, 62 и 80 миллионов тонн соответственно.
Согласно оценкам, в 2013 году мировые запасы лития составляли около 15 миллионов тонн, тогда как 65 миллионов тонн известных ресурсов были разумными. В общей сложности 75% всего обычно можно найти в десяти крупнейших месторождениях мира. Другое исследование показало, что 83% геологических ресурсов лития расположены в шести месторождениях рассола, двух пегматитовых и двух осадочных месторождениях.
Четыре ведущие страны-производители лития с 2019 года, по данным Геологической службы США. Австралия, Чили, Китай и Аргентина. На пересечении Чили, Боливии и Аргентины образуется регион, известный как Литиевый треугольник. Литиевый треугольник известен своими высококачественными солончаками, включая боливийский Салар де Уюни, чилийский Салар де Атакама и аргентинский Салар де Арисаро. Считается, что в Литиевом треугольнике содержится более 75% существующих известных запасов лития. Отложения находятся в Южной Америке по всей горной цепи Анд. Чили является ведущим производителем, за ним следует Аргентина. Обе страны извлекают литий из бассейнов с рассолом. По данным USGS, в боливийской пустыне Уюни содержится 5,4 миллиона тонн лития. Половина мировых запасов находится в Боливии вдольцентрально-восточного склона Анд. В 2009 году Боливия провела переговоры с японскими, французскими и корейскими фирмами о начале добычи.
| Страна | Производство | Запасы | Ресурсы |
|---|---|---|---|
| Аргентина | 6,400 | 1,700,000 | 17,000,000 |
| Австралия | 42,000 | 2,800,000 | 6,300,000 |
| Австрия | — | — | 75,000 |
| Боливия | — | — | 21,000,000 |
| Бразилия | 300 | 95,000 | 400,000 |
| Канада | 200 | 370,000 | 1,700,000 |
| Чили | 18,000 | 8,600,000 | 8,600,000 |
| Чешская Республика | — | — | 1,300,000 |
| ДР Конго | — | — | 3,000,000 |
| Финляндия | — | — | 40,000 |
| Германия | — | — | 2,500,000 |
| Казахстан | — | — | 40,000 |
| Мали | — | — | 1,000,000 |
| Мексика | — | — | 1,700,000 |
| Намибия | 500 | ? | 9,000 |
| Китайская Народная Республика | 7,500 | 1,000,000 | 4,500,000 |
| Перу | — | — | 130,000 |
| Португалия | 1,200 | 60,000 | 250,000 |
| Русси a | — | — | 1,000,000 |
| Сербия | — | — | 1,000,000 |
| Испания | — | — | 300,000 |
| США | 870 | 630,000 | 6,800,000 |
| Зимбабве | 1,600 | 230,000 | 540,000 |
| Всего в мире | 77,000 | 17,000,000 | 80,000,000+ |
В США литий извлекают из бассейнов солевого раствора в Неваде. Месторождение, обнаруженное в 2013 году в районе Rock Springs Uplift штата Вайоминг, оценивается в 228 000 тонн. Дополнительные месторождения в том же пласте оцениваются в 18 миллионов тонн.
На протяжении многих лет мнения о потенциальном росте расходились. Исследование 2008 года пришло к выводу, что «реально достижимого производства карбоната лития будет достаточно только для небольшой части будущих потребностей мирового рынка PHEV и EV », что «спрос со стороны сектора портативной электроники будет поглотить большую часть запланированного увеличения производства в следующем десятилетии, и что »массовое производство карбоната экологически безопасным, оно наносит непоправимый экологический ущерб, который следует защищать, и что LiIon установка несовместима с понятием «зеленого автомобиля» «.
Согласно более позднему исследованию 2011 года, проведенному Национальной лабораторией Лоуренса Беркли и Калифорнийским университетом, Беркли, тогда оцененные запасы лития не должны быть ограничивающими. фактор для крупномасштабного производства аккумуляторов для электромобилей, потому что примерно 1 миллиард 40 кВтч литиевых аккумуляторов можно было бы построить с этими запасами — около 10 кг лития на автомобиль. Другое исследование 2011 года на Мичиганский университет и Ford Motor Company использовать достаточно ресурсов, чтобы поддерживать мировой спрос до 2100 года, включая литий, используемый для широкого использования транспортных средств. Согласно исследованию, мировые запасы оцениваются в 39 миллионов тонн, а общий спрос для лития в 90-е годы Годовой период составил 12–20 миллионов тонн, в зависимости от сценариев экономического роста и темпов переработки.
В 2014 году The Financialist заявил, что спрос на литий растет более чем на 12% в год. По данным Credit Suisse, эта ставка превысила прогнозируемую доступность на 25%. В публикации сравнивается ситуация с литием в 2014 году с нефтью, где «более высокие цены на стимулирование инвестиций в дорогостоящие технологии добычи глубоководных и нефтеносных песков»; то есть цена на литий будет продолжать расти до тех пор, пока более дорогие методы производства, которые могут увеличить общий объем производства, привлекательное внимание производителей.
16 июля 2018 г. 2,5 миллиона высококачественных материалов лития и 124 миллиона фунтов были обнаружены в районе Пуно, Перу.
Согласно оценкам, в океанах содержится 230 миллиардов тонн лития, но его уровень составляет 0,1-0,2 части на миллион, поэтому по технологии 2020 года добывать дороже, чем из наземных рассолов и горных пород.
Ценообразование
В 1998 году цена металлического лития составляла около 95 США за кг (или 43 доллара США / фунт ). После финансового кризиса 2007 года, основные поставщики, такие как Sociedad Química y Minera (SQM), снизили цены на карбонат лития на 20%. В 2012 году цены выросли. В статье Business Week 2012 года описывалась олигополия в литиевом пространстве: «SQM, контролируемая миллиардером Хулио Понсе, является вторым по величине, за которым следует Rockwood, при поддержке Генри Крависа KKR Co. и FMC из Филадельфии », где Талисон упоминается как крупнейший производитель. Мировое потребление может вырасти до 300 000 метрических тонн в год к 2020 году с примерно 150 000 тонн в 2012 году, чтобы удовлетворить спрос на литиевые батареи, который растет примерно на 25% в год, опережая общий прирост производства лития на 4–5%.
Добыча

Исторически литий и его соединения извлекались из твердых пород до тех пор, пока соли извлекались из воды в минеральных источников, рассол залежи и залежи рассола стали доминирующим устройством в 1990-х годы. Добыча литиевых руд была более дорогостоящей и не учитывалась рыночными ценами, но к 2018 году твердые породы снова стали вносить значительный вклад. Катоды с низким содержанием кобальта для литиевых батарей, как ожидается, потребуют гидроксида лития, а не карбоната лития в качестве сырья, и эта тенденция отдает предпочтение горным породам в качестве источника.
Электродиализ был предложен для извлечения лития из морской воды, но это не так. коммерчески жизнеспособны.
Другой потенциальный источник лития — это выщелачивание геотермальных скважин, которые выносятся на поверхность. Восстановление лития было установлено в полевых условиях; литий отделяется простой фильтрацией. Затраты на технологические процессы и охрану окружающей среды — это в первую очередь затраты на уже действующую скважину; Таким образом, чистое воздействие на Землю может быть положительным.
Инвестиции
В настоящее время на рынке существует ряд вариантов инвестирования в металл. Покупка реальных запасов лития вероятно ли возможна, инвесторы могут покупать акции компаний, занимающихся добычей и производством лития. Кроме того, инвесторы могут приобрести специальный литиевый ETF, предлагающий доступ к группе товаропроизводителей.
Области применения

Керамика и стекло
Оксид лития широко используется в качестве флюса для обработки кремнезема, сниженная температура плавления и вязкость материала и приводит к глазури с улучшенными физическими свойствами, включая Карбонат лития (Li 2CO3) обычно используется в этом приложении, потому что он что он используется в этом приложении, потому что он используется для посуда, используются низкие коэффициенты теплового расширения.
Электрооборудование и электроника
Конец 20-го века века, литий стал важным компонентом аккумуляторной тролиты и электроды из-за высокого века дополнительно электрода. Из-за своей низкой атомной массы он имеет высокое отношение заряда и мощности к массе. Типичный литий-ионный аккумулятор может генерировать примерно 3 вольт на элемент, по сравнению с 2,1 вольтом для свинцово-кислотного и 1,5 вольт для угольно-цинкового.. Литий-ионные батареи, которые являются перезаряжаемыми и высокой плотностью энергии, отличаются от литиевых батарей, которые являются одноразовыми (первичными ) батареи с литием или его соединениями в качестве анода. Другие литиевые аккумуляторные батареи включают литий-ионную полимерную батарею, литий-железо-фосфатную батарею и батарею с нанолокой.
консистентные смазки
. третье по распространенности применения лития — в смазках. Гидроксид лития представляет собой сильное основание и при нагревании с жиром дает мыло, состоящее из стеарата лития. Литиевое мыло обладает способностью сгущать масла и используется для производства универсальных высокотемпературных консистентных смазок.
Металлургия
Литий (например, в виде карбоната лития) используется в качестве добавок к флюсовым шлакам для непрерывной разливки, где он увеличивает объемучесть, что составляет 5% от мирового потребления лития (2011). Соединения лития также используются в качестве добавок (флюсов) к формовочному песку для литья чугуна с целью уменьшения образования прожилок.
Литий (как фторид лития ) используется в качестве добавки к алюминиевые плавильные печи (процесс Холла — Эру ), снижающие температуру плавления и увеличивающее электрическое сопротивление, на использование которых приходится 3% производства (2011 г.).
При использовании в качестве флюса для сварки или пайки металлический литий способствует плавлению металлов во время процесса и устраняет образование оксидов за счет примесей. Сплавы металла с алюминием, кадмием, медью и марганцем используются для изготовления высокопроизводительных деталей самолетов (см. Также Литий-алюминиевые сплавы ).
Silicon nano -сварка
Было обнаружено, что литий эффективен в качестве совершенствованию кремниевых нано-сварных швов в электронных компонентах для электрических батарей и других устройств
Другое химическое и промышленное применение

Пиротехника
Соединения лития используются в качестве отехнических красителей и окислителей красного цвета фейерверки и факелы.
Очистка воздуха
Хлорид лития и бромид лития являются гигроскопичными и используются как осушители для газовых потоков. лития и пероксид лития часто употребляемой солью, наиболее используемыми в замкнуты х пространств, таких как на борту космических кораблей и подводных лодок, для удаления двуокиси углерода и очистки воздуха. Гидроксид лития абсорбирует диоксид углерода из воздуха, образуя карбонат лития, и предпочтительнее других щелочных гидроксидов из-за его небольшого веса.
Пероксид лития (Li 2O2) в присутствии влаги не только реагирует с диоксидом углерода с образованием карбоната лития, но также выделяет кислород. Реакция протекает следующим образом:
- 2 Li 2O2+ 2 CO 2 → 2 Li 2CO3+ O 2.
Некоторые из вышеупомянутых соединений, а также перхлорат лития, используются в кислородных свечах, которые снабжают подводные лодки кислородом . Они могут также ввести небольшие количества бора, магния, алюминия, кремния, титана, марганец и железо.
Оптика
Фторид лития, искусственно выращенный в виде кристалла, прозрачный и прозрачный и часто используется в специальной оптике для IR, UV и ВУФ (вакуумное УФ ) приложения. У него один из самых низких показателей преломления и самый дальний диапазон пропускания в глубоком УФ из самых распространенных материалов. Тонкоизмельченный порошок фторида лития использовался для термолюминесцентной дозиметрии (TLD): когда образец такого материала подвергается воздействию излучения, в нем накапливаются дефекты кристаллов, которые при нагревании исчезают через испускание голубоватого света, интенсивность которого составляет поглощенной дозе, что позволяет количественно оценить это. Фторид лития иногда используется в фокусных линзах телескопов.
Высокая нелинейность ниобата лития также делает его полезное в приложениях нелинейной оптики. Он широко используется в телекоммуникационных продуктах, таких как мобильные телефоны и оптические модуляторы, для таких компонентов, как резонансные кристаллы. Литиевые элементы используются более чем в 60% мобильных телефонов.
Органическая и полимерная химия
Литийорганические соединения широко используются в производстве полимеров и тонкой химии. В полимерной промышленности, которая является основным потребителем этих реагентов, алкиллитиевые соединения являются катализаторами / инициаторами. в анионной полимеризации нефункционализированных олефинов. В производстве тонких химикатов литийорганические соединения как сильные основания и как реагенты для образования углеродных углеродных связей. Литийорганические соединения получают из металлического лития и алкилгалогенидов.
Многие другие соединения лития используются в качестве реагентов для соединения. Некоторые популярные соединения включают алюмогидрид лития (LiAlH 4), триэтилборгидрид лития, н-бутитий и трет-бутиллитий <162.>обычно используются как используемые прочные основания, называемые супербазами.

Военное применение
Металлический ли и его сложные гидриды, такие как Ли [AlH 4], используются в качестве высокоэнергетических добавок к ракетному топливу. Литийалюминийгидрид может инсталлировать сам по себе в качестве твердого топлива.
В двигательной установке с накоплением химической энергии (SCEPS) торпеды Mark 50 используется небольшой резервуар с гексафторидом серы газ, который распыляется над блоком твердого лития. В результате реакции выделяется тепло, создаваемая пар для приведения в движение торпеды по замкнутому циклу Ренкина.
Гидрид лития, используется литий-6, используется в термоядерном оружии, где он служит топливом для стадии синтеза бомбы.
Ядерная
Литий-6 ценится как исходный материал для производства трития и нейтрона поглотитель в ядерном синтезе. Природный литий содержит около 7,5% лития-6, из которого путем разделения изотопов были произведены большие количества лития-6 для использования в ядерном оружии. Литий-7 заинтересовался использованием в ядерных реакторах теплоносителя.

Дейтерид лития было термоядерным топливом в ранней версиих водородной бомбы. При бомбардировке нейтронами и Li, и Li производят тритий — эта реакция, которая не была полностью понята, когда водородные бомбы были впервые испытаны, и была причиной разгона. результат ядерных испытаний Замок Браво . Тритий соединяется с дейтерием в реакции слияния, что относительно легко осуществить. Хотя детали остаются в секрете, дейтерид лития-6, по-видимому, все еще играет роль в современном ядерном оружии в качестве термоядерного материала.
Фторид лития, будучи высокообогащенным изотопом лития-7, образует основной компонент смеси фторидных солей LiF- BeF 2, используемой в жидких фторидных ядерных реакторах. Фторид лития исключительно химически стабилен, а смеси имеют LiF-BeF 2 низкие температуры плавления. Кроме того, Ли, Be и F являются одними из немногих нуклидов с достаточно низкими сечениями захвата тепловых нейтронов, чтобы не отравлять реакции деления внутри ядерного реактора деления.
В концептуальных (гипотетических) ядерных термоядерных установках литий будет поддерживать производство трития в реакторах с магнитным ограничением с использованием дейтерия и трития в качестве топлива. плазму «бланкетом», содержащим литий, где нейтроны дейтерий-тритиевой реакции в плазме расщепляют литий с образованием большего количества трития:
- Li + n → He + H.
Литий также используется в качестве источника альфа-частиц или ядер гелия. Когда Ли бомбардирует ускоренными протонами , образуется Be, который подвергается делению с образованием двух альфа-частиц. Этот подвиг, называвшийся «расщеплением атома» в то время, был первой полностью искусственной ядерной реакцией. Он был произведен Кокрофт и Уолтон в 1932 году.
В 2013 году Счетная палата правительства США сообщила, что нехватка лития-7 является критической Эксплуатацией 65 из 100 американских ядерных реакторов «ставит их способность обеспечивать электроэнергией определенным риском». Замок Браво впервые применил литий-7 в «Креветке», первое устройство, которое весило всего 10 тонн, вызвало массивное ядерное загрязнение атмосферы атолла Бикини. Возможно, этим объясняется упадок ядерной инфраструктуры США. Оборудование, необходимое для отделения лития-6 от лития-7, в основном является пережитком времен холодной войны. США остановили большую часть этого оборудования в 1963 году, когда у него был огромный запас выделенного лития, который в основном потреблялся в течение двадцатого века. В отчете говорится, что потребуется пять лет и от 10 до 12 миллионов долларов, чтобы восстановить способность отделять литий-6 от лития-7.
Реакторы, в которых литий-7 нагревает высокий давление и передает тепло за счет тепла. теплообменники, подверженные коррозии. В реакторах используется литий для противодействия коррозионному воздействию борной кислоты, которая добавляется в воду для избыточных нейтронов.
Медицина
Литий полезен при лечении биполярное расстройство. Соли лития также могут быть полезны при родственных диагнозах, таких как шизоаффективное расстройство и циклическая большая депрессия. Активной частью этих солей является ионная лития Ли. Они могут увеличить риск развития сердечной аномалии Эбштейна у младенцев, рожденных женщинами, принимающими литий в течение первого триместра беременности.
Литий также исследовался в качестве возможного лечения кластерные головные боли.
Биологическая роль
Основные пищевые источники лития — это зерно и овощи, а в некоторых регионах питьевая вода также содержит большое количество. Потребление человека рассматривается в зависимости от местоположения и диеты.
Литий впервые был обнаружен органах человека и тканях плода в конце 19 века. У людей нет определенных заболеваний, связанных с употреблением наркотиков и других преступлений. Биохимические механизмы действия лития, по-видимому, многофакторны и взаимосвязаны с функциями некоторых ферментов, гормонов и витаминов, а также факторов роста и трансформирующих факторов.
Меры предосторожности
| Опасности | |
|---|---|
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасно |
| Предупреждения об опасности GHS | H260, H314 |
| Меры предосторожности GHS | P223, P231 + 232, P280, P305 + 351 + 338, P370 + 378, P422 |
| NFPA 704 (огненный алмаз) |  2 3 2 2 3 2 |
Литий-металлический коррозионный и требует особого обращения во избежание контакта с кожей. 1. раздражает нос и горло, в то время как более сильное воздействие может вызвать скопление жидкости в легких, приводит к отеку легких. Сам металл представляет опасность при обращении, поскольку контакте с влагой образует едкий гидроксид лития. Литий безопасно хранится в нереактивных соединениях, таких как нафта.
См. Также
- Космологическая проблема лития
- Дилитий
- Галоидное ядро
- Изотопы лития
- Список стран по производству лития
- Литий-воздушная батарея
- Литий как инвестиция
- Горящий литий
- Литиевые соединения (категория)
- Литий-ионная батарея
- Литийорганический реагент
Примечания
Ссылки
Внешние ссылки
- Литий в Периодическая таблица видео (Университет Ноттингема)
- Международный литиевый альянс
- Геологическая служба США: статистика и информация по литию
- Предложение и рынки лития 2009 IM Conference 2009 Устойчивые поставки лития до 2020 года в условиях устойчивого роста рынка
- Саутгемптонский университет, Центр международных исследований Маунтбэттена, Рабочий документ №5 по ядерной истории.
- Литиевые консервы по странам на сайте investingnews.com
Латинские названия химических элементов (Таблица)
По древней традиции, корни которой тянутся к средним векам, все химические элементы получали свои названия на латинском языке; эта традиция не нарушается и в наше время. В начале XIX столетия для химических элементов были предложены сокращенные буквенные обозначения, которыми служили или одна начальная буква латинских названий элементов, или, значительно чаще, две буквы, начальная и одна из последующих. Так образовались современные знаки (символы) химических элементов, получившие впоследствии международное признание.
Русские названия химических элементов в большинстве представляют собой их латинские названия с измененными окончаниями в соответствии с особенностями нашего языка. Но вместе с тем можно назвать много элементов, которые имеют на русском языке особые названия, отличные от латинских. Этими названиями служат или коренные русские слова, например железо (Fe), медь (Сu), ртуть (Hg), или перевод латинского названия элемента на русский язык, например водород (Н), кислород (О). Для того, чтобы в этих случаях можно было понять происхождение символов, следует сопоставить их с латинскими названиями соответствующих элементов, указанными в табл. 2-16.
Попутно в примечаниях к таблице указываются те особые названия и обозначения химических элементов, которые применяются в научной литературе ряда зарубежных стран.
|
Русское название |
Символ |
Латинское название элемента |
|
Азот |
N |
Nitrogenium |
|
Актиний |
Ас |
Actinium |
|
Алюминий |
Аl |
Aluminium |
|
Америций |
Аm |
Americium |
|
Аргон 1) |
Аr |
Argon |
|
Астат |
At |
Astatinum |
|
Барий |
Bа |
Barium |
|
Бериллий 2) |
Be |
Beryllium |
|
Беркелий |
Bk |
Berkelium |
|
Бор |
В |
Borum |
|
Бром |
Вr |
Bromum |
|
Ванадий |
V |
Vanadium |
|
Висмут |
Bi |
Bismutum |
|
Водород |
Н |
Hydrogenium |
|
Вольфрам 3) |
W |
Wolframium |
|
Гадолиний |
Gd |
Gadolinium |
|
Галлий |
Ga |
Gallium |
|
Гафний |
Hf |
Hafnium |
|
Гелий |
Не |
Helium |
|
Германий |
Ge |
Germanium |
|
Гольмий |
Но |
Holmium |
|
Диспрозий |
Dy |
Dysprosium |
|
Европий |
Eu |
Europium |
|
Железо |
Fe |
Ferrum |
|
Золото |
Au |
Aurum |
|
Индий |
In |
Indium |
|
Иод 4) |
J |
Iodum |
|
Иридий |
Ir |
Iridium |
|
Иттербий |
Yb |
Ytterbium |
|
Иттрий |
Y |
Yttrium |
|
Кадмий |
Cd |
Cadmium |
|
Калий |
К |
Kalium |
|
Калифорний |
Cf |
Californium |
|
Кальций |
Ca |
Calcium |
|
Кислород |
О |
Oxygenium |
|
Кобальт |
Co |
Cobaltum |
|
Кремний |
Si |
Silicium |
|
Криптон |
Kr |
Krypton |
|
Ксенон 5) |
Xe |
Xenon |
|
Кюрий |
Cm |
Curium |
|
Лантан |
La |
Lanthanum |
|
Литий |
Li |
Lithium |
|
Лютеций 6) |
Lu |
Lutetium |
|
Магний |
Mg |
Magnesium |
|
Марганец |
Mn |
Manganum |
|
Медь |
Си |
Cuprum |
|
Менделевий |
Mv |
Mendelevium |
|
Молибден |
Мо |
Molybdanum |
|
Мышьяк |
As |
Arsenicum |
|
Натрий |
Na |
Natrium |
|
Неодим |
Nd |
Neodymium |
|
Неон |
Ne |
Neon |
|
Нептуний |
Np |
Neptunium |
|
Никель |
Ni |
Niccolum |
|
Ниобий 7) |
Mb |
Niobium |
|
Олово |
Sn |
Stannum |
|
Осмий |
Os |
Osmium |
|
Палладий |
Pd |
Palladium |
|
Платина |
Pt |
Platinum |
|
Плутоний |
Pu |
Plutonium |
|
Полоний |
Po |
Polonium |
|
Празеодим |
Pr |
Praseodimium |
|
Прометий |
Pm |
Promethium |
|
Протактиний |
Pa |
Protactinium |
|
Радий |
Ra |
Radium |
|
Радон |
Rn |
Radon |
|
Рений |
Re |
Renium |
|
Родий |
Rh |
Rhodium |
|
Ртуть |
Hg |
Hydrargyrum |
|
Рубидий |
Rb |
Rubidium |
|
Рутений |
Ru |
Ruthenium |
|
Самарий |
Sm |
Samarium |
|
Свинец |
Pb |
Plumbum |
|
Селен |
Se |
Selenium |
|
Сера |
S |
Sulfur |
|
Серебро |
Ag |
Argentum |
|
Скандий |
Sc |
Scandium |
|
Стронций |
Sr |
Strontium |
|
Сурьма |
Sb |
Stibium |
|
Таллий |
T1 |
Thallium |
|
Тантал |
Та |
Tantalum |
|
Теллур |
Те |
Tellurium |
|
Тербий |
Tb |
Terbium |
|
Технеций |
Tc |
Technetium |
|
Титан |
Ti |
Titanium |
|
Торий |
Th |
Thorium |
|
Туллий 9) |
Tu |
Thulium |
|
Углерод |
C |
Carboneum |
|
Уран |
U |
Uranium |
|
Фермий |
Fm |
Fermium |
|
Фосфор |
P |
Phosphorus |
|
Франций 10) |
Fr |
Francium |
|
Фтор |
F |
Fluorum |
|
Хлор |
Cl |
Chlorum |
|
Хром |
Cr |
Chromium |
|
Цезий |
Cs |
Cesium |
|
Церий |
Ce |
Cerium |
|
Цинк |
Zn |
Zincum |
|
Цирконий |
Zr |
Zirconium |
|
Эйнштейний |
En |
Einsteinium |
|
Эрбий |
Er |
Erbium |
Примечания к таблице:
1) Жансен и независимо от него Локьер в 1868 г. обнаружили в спектре солнца неизвестные до того времени линии; этот новый элемент был назван гелием, так как предполагалось, что он находится только на солнце. Через 27 лет Рамзаи и Клив обнаружили те же линии в спектре нового газа, полученного ими при анализе минерала клевеита; название гелий для этого элемента было сохранено.
2) Еще в конце XVIII в. было известно, что при действии серной кислоты на плавиковый шпат выделяется особая кислота, которая разъедает стекло. В 1810 г. Ампер показал, что эта кислота подобна соляной и является соединением с водородом некоторого неизвестного элемента, который он назвал фтором. В чистом виде фтор удалось получить Муассану только в 1886 г.
3) Окись магния была известна давно, ее исследовал Блэк еще в 1775 г. Деви в 1808 г. пытался получить металлический магний, но в чистом виде металл получить ему не удалось.
4) Двуокись титана была получена лабораторным путем еще в конце XVIII в., Берцелиус получал титан, но не вполне чистый. Более чистый металлический титан был получен Грегор, затем Муассаном.
5) Сернистые соединения мышьяка былп известны в древнее время.
6) В начале XIX в. была получена смесь ниобия и тантала, которая рассматривалась как новый элемент; ему было присвоено название колумбий. В Америке и Англии ниобий до сих пор носит название колумбий.
7) В виде окиси церий был получен в 1803 г.

9) Как особый металл платина была описана в 1750 г.; до 1810 г. единственным местом добычи платины была Колумбия. Затем платина была найдена в других местах, в том числе на Урале, который до настоящего времени является наиболее богатым источником ее получения.
10) Двуокись урана, полученная впервые еще в 1789 г., была принята вначале за новый элемент. Металлический уран был получен впервые в 1842 г., его радиоактивные свойства были открыты только в 1896 г.
_______________
Источник информации: КРАТКИЙ ФИЗИКО-ТЕХНИЧЕСКИЙ СПРАВОЧНИК/ Том 1, — М.: 1960.