| Нитрат кальция | |
 |
|
 |
|
 |
|
| Общие | |
|---|---|
| Традиционные названия | кальциевая селитра, норвежская селитра, азотнокислый кальций |
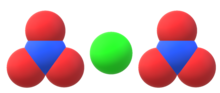
| Химическая формула | Са(NО3)2 |
| Физические свойства | |
| Состояние (ст. усл.) | гранулы сферической формы белого, светло-серого, светло-бежевого цвета |
| Молярная масса | (безводная) 164,088 г/моль;
(тетрагидрат) 236,15 г/моль |
| Плотность | (безводная) 2,504 г/см³;
(тетрагидрат) 1,896 г/см³ |
| Термические свойства | |
| Температура плавления | (безводная) 561 °C;
(тетрагидрат) 42,7 °C |
| Температура кипения | (безводная) разлагается;
(тетрагидрат) 132 °C |
| Температура вспышки | негорючая °C |
| Молярная теплоёмкость (ст. усл.) | 149,33 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -937,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | Безводной:
121,2 г/100 мл (20 °C); 271,0 г/100 мл (40 °C); 359 г/100 мл (51,6 °C). Тетрагидрата: 102 г/100 мл (0 °C); 129 г/100 мл (20 °C); (100 °C) 363 |
| Растворимость в | спирте и ацетоне |
| Структура | |
| Кристаллическая структура | кубическая (безводная)
моноклинная (тетрагидрат) |
| Классификация | |
| Рег. номер CAS | 10124-37-5 (безводная)
13477-34-4 (тетрагидрат) |
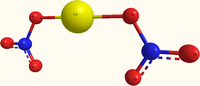
| SMILES | [Ca+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| Номер ООН | 1454 |
| RTECS | EW2985000 |
| Безопасность | |
| Токсичность |
0 1 3 |
Кальция нитрат (кальциевая селитра, азотнокислый кальций) — неорганическая соль азотной кислоты. Соединение сильно гигроскопично, поэтому его хранят без доступа влаги. Химическая формула Са(NО3)2.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Получение
- 2.1 Реакции с получением нитрата кальция
- 3 Применение
- 3.1 В сельском хозяйстве
- 3.2 В пиротехнике
Свойства
Физические свойства
Химические свойства
При 500 °C начинает разлагаться с выделением О2 и образованием сначала СаО и NO2. Кальциевая селитра при нормальных условиях негорючая, пожаро- и взрывобезопасная, устойчивая в интервале температур от −60 °C до +155 °C.
Получение
Получают кальция нитрат действием HNO3 на известняк или поглощением нитрозных газов (в основном NO2) известковым молоком. Применяют кальция нитрат как азотное удобрение и для получения особо чистого СаО.
Для получения гранулированной кальциевой селитры используется способ низкотемпературной нейтрализации азотной кислоты природным известняком или продуктами переработки известняка.
Реакции с получением нитрата кальция
Нитрат кальция производится путем обработки известняка с азотной кислотой, после нейтрализации аммиака:
- CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O.
Он также является побочным продуктом процесса Оддо при добыче фосфата кальция:
- Ca3(PO4)2 + 6HNO3 + 12H2O2 → H3PO4 + 3Ca(NO3)2 + 12H2O.
Так же как нитраты других щелочноземельных металлов и LiNO3, кальциевая селитра при нагревании разлагается на выпуске двуокиси азота:
- 2Ca(NO3)2 → 2CaO + 4NO2 + O2, ΔH°обр.=369 кДж/моль
Также нитрат кальция можно получить проделав следующие реакции:
Также образование нитрата кальция возможно и за счет атмосферных явлений:
(грозовой разряд)
Применение
Гранулированный, безводный нитрат кальция, применяется, как добавка в бетон, в качестве удобрения, для приготовления рассола в холодильной технике, в производстве реактивов, стеклопластиков, а также как один из компонентов для производства взрывчатки.
В сельском хозяйстве
Кальциевая селитра является физиологическим щелочным удобрением, пригодным для всех почв и прежде всего для закисленных почв. В сельском хозяйстве применяют как азотное удобрение. Выпускают в гранулированном виде; товарный продукт должен содержать не менее 15,5 % азота, кроме того, к нему добавляют в процессе производства 4—7 % нитрата аммония для уменьшения гигроскопичности удобрения; содержание влаги не должно превышать 15 %. Нитрат кальция вносят под все культуры. Наиболее эффективен на кислых почвах, особенно для весенней подкормки озимых.
В пиротехнике
Несмотря на то, что нитрат кальция в смеси с горючими веществами способен давать недорогой источник кирпично-красного пламени, применение его в этом качестве крайне ограничено из-за сильной гигроскопичности.
|
Соединения кальция |
|---|
|
Алюминаты кальция (mCaO·nAl2O3) • Алюмогидрид кальция (Ca[AlH4]2) • Амид кальция (Ca(NH2)2) • Арсенат кальция (Ca3(AsO4)2) • Ацетат кальция ((CH3COO)2Ca) • Бисульфид кальция (Ca(HS)2) • Борат кальция (Ca3(BO3)2) • Бромид кальция (CaBr2) • Вольфрамат кальция (CaWO4) • Гексаборид кальция (CaB6) • Гексафторсиликат кальция (CaSiF6) • Гидрид кальция (CaH2) • Гидроксид кальция (Ca(OH)2) • Гидроортофосфат кальция (CaHPO4) • Гипофосфит кальция (Ca(PH2O2)) • Гипохлорит кальция (Ca(ClO)2) • Глицерофосфат кальция (C3H7CaO6P) • Глюконат кальция (C12H22CaO14) • Дигидрокарбонат кальция (Ca(HCO3)2) • 2,5-дигидроксибензолсульфонат кальция (C12H10CaO10S2) • Дигидроортофосфат кальция (Ca(H2PO4)2) • Иодат кальция (Ca(IO3)2) • Иодид кальция (CaI2) • Карбид кальция (CaC2) • Карбонат кальция (CaCO3) • Моносилицид кальция (CaSi) • Нитрат кальция (Са(NО3)2) • Нитрид кальция (Ca3N2) • Оксалат кальция (СаС2О4) • Оксид кальция (CaO) • Ортофосфат кальция (Ca3(PO4)2) • Перманганат кальция (Ca(MnO4)2) • Пероксид кальция (CaO2) • Пирофосфат кальция (Ca2P2O7) • Силикат кальция (CaSiO3) • Силицид дикальция (Ca2Si) • Силицид кальция (CaSi2) • Сульфат кальция (CaSO4) • Сульфид кальция (CaS) • Сульфит кальция (CaSO3) • Тетрагидроалюминат кальция (Ca(AlH4)2) • Титанат кальция (CaTiO3) • Триметафосфат кальция (Ca3(P3O9)2) • Флюорит (CaF2) • Формиат кальция (Ca(HCOO)2) • Фосфид кальция (Ca3P2) • Фторид кальция (CaF2) • Хлорат кальция (Ca(ClO3)2) • Хлорид кальция (CaCl2) • Хлорная известь (Ca(Cl)OCl) • Хромат кальция (CaCrO4) • Цианамид кальция (CaCN2) • Цианид кальция (Ca(CN)2) • Цитрат кальция (Ca3(C6H5O7)2) • |
|
Нитраты |
|
|---|---|
|
Динитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2) |
 |
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|

|
|
|
|

|
|
| Names | |
|---|---|
| Other names
Kalksalpeter, Norgessalpeter, nitrocalcite, Norwegian salpeter, lime nitrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.289 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1454 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Ca(NO3)2 |
| Molar mass | 164.088 g/mol (anhydrous) 236.15 g/mol (tetrahydrate) |
| Appearance | colorless solid hygroscopic |
| Density | 2.504 g/cm3 (anhydrous) 1.896 g/cm3 (tetrahydrate) |
| Melting point | 561 °C (1,042 °F; 834 K) (anhydrous) 42.7 °C (109 °F; 316 K) (tetrahydrate) |
| Boiling point | decomposes (anhydrous) 132 °C (270 °F; 405 K) (tetrahydrate) |
|
Solubility in water |
anhydrous: 1212 g/L (20 °C) 2710 g/L (40 °C) tetrahydrate: |
| Solubility | soluble in ammonia almost insoluble in nitric acid |
| Solubility in ethanol | 51.4 g/100 g (20 °C) 62.9 g/100 g (40 °C)[1] |
| Solubility in methanol | 134 g/100 g (10 °C) 144 g/100 g (40 °C) 158 g/100 g (60 °C)[1] |
| Solubility in acetone | 16.8 g/kg (20 °C)[1] |
| Acidity (pKa) | 6.0 |
|
Magnetic susceptibility (χ) |
-45.9·10−6 cm3/mol |
| Structure | |
|
Crystal structure |
cubic (anhydrous) monoclinic (tetrahydrate) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H272, H302, H315, H319 |
|
Precautionary statements |
P210, P220, P221, P264, P270, P280, P301+P312, P302+P352, P305+P351+P338, P310, P321, P330, P332+P313, P337+P313, P362, P370+P378, P501 |
| NFPA 704 (fire diamond) |
2 0 1 OX |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
302 mg/kg (rat, oral) |
| Safety data sheet (SDS) | ICSC 1037 |
| Related compounds | |
|
Other anions |
Calcium sulfate Calcium chloride |
|
Other cations |
Magnesium nitrate Strontium nitrate Barium nitrate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Calcium nitrate, also called Norgessalpeter (Norwegian salpeter), is an inorganic compound with the formula Ca(NO3)2(H2O)x. The anhydrous compound, which is rarely encountered, absorbs moisture from the air to give the tetrahydrate. Both anhydrous and hydrated forms are colourless salts. Calcium nitrate is mainly used as a component in fertilizers, but it has other applications. Nitrocalcite is the name for a mineral which is a hydrated calcium nitrate that forms as an efflorescence where manure contacts concrete or limestone in a dry environment as in stables or caverns. A variety of related salts are known including calcium ammonium nitrate decahydrate and calcium potassium nitrate decahydrate.[2]
Production and reactivity[edit]
Norgessalpeter was synthesized at Notodden, Norway in 1905 by the Birkeland–Eyde process. Most of the world’s calcium nitrate is now made in Porsgrunn.
It is produced by treating limestone with nitric acid, followed by neutralization with ammonia:
- CaCO3 + 2 HNO3 → Ca(NO3)2 + CO2 + H2O
It is also an intermediate product of the Odda Process:
- Ca5(PO4)3OH + 10 HNO3 → 3 H3PO4 + 5 Ca(NO3)2 + H2O
It can also be prepared from an aqueous solution of ammonium nitrate, and calcium hydroxide:
- 2 NH4NO3 + Ca(OH)2 → Ca(NO3)2 + 2 NH4OH
Like related alkaline earth metal nitrates, calcium nitrate decomposes upon heating (starting at 500 °C) to release nitrogen dioxide:[2]
- 2 Ca(NO3)2 → 2 CaO + 4 NO2 + O2 ΔH = 369 kJ/mol
Applications[edit]
Use in agriculture[edit]
The fertilizer grade (15.5-0-0 + 19% Ca) is popular in the greenhouse and hydroponics trades; it contains ammonium nitrate and water, as the «double salt» 
Calcium nitrate is also used to control certain plant diseases. For example, dilute calcium nitrate (and calcium chloride) sprays are used to control bitter pit and cork spot in apple trees.[3]
Waste water treatment[edit]
Waste water treatment unit
Calcium nitrate is used in waste water pre-conditioning for odour emission prevention. The waste water pre-conditioning is based on establishing an anoxic biology in the waste water system. In the presence of nitrate, the metabolism for sulfates stops, thus preventing formation of hydrogen sulfide.[4] Additionally easy degradable organic matter is consumed, which otherwise can cause anaerobic conditions downstream as well as odour emissions itself. The concept is also applicable for surplus sludge treatment.[5]
Concrete[edit]
Calcium nitrate is used in set accelerating concrete admixtures. This use with concrete and mortar is based on two effects. The calcium ion accelerates formation of calcium hydroxide and thus precipitation and setting. This effect is used also in cold weather concreting agents as well as some combined plasticizers.[6] The nitrate ion leads to formation of iron hydroxide, whose protective layer reduces corrosion of the concrete reinforcement.[7]
Latex coagulant[edit]
Calcium nitrate is a very common coagulant in latex production, especially in dipping processes. Dissolved calcium nitrate is a part of the dipping bath solution. The warm former is dipped into the coagulation liquid and a thin film of the dipping liquid remains on the former. When now dipping the former into the latex the calcium nitrate will break up the stabilization of the latex solution and the latex will coagulate on the former.[8][9]
Cold packs[edit]
The dissolution of calcium nitrate tetrahydrate is highly endothermic (cooling). For this reason, calcium nitrate tetrahydrate is sometimes used for regenerable cold packs.[2]
Molten salts for heat transfer and storage[edit]
Calcium nitrate can be used as a part of molten salt mixtures. Typical are binary mixtures of calcium nitrate and potassium nitrate or ternary mixtures including also sodium nitrate.[10][11][12] Those molten salts can be used to replace thermo oil in concentrated solar power plants for the heat transfer, but mostly those are used in heat storage.
References[edit]
- ^ a b c Anatolievich, Kiper Ruslan. «Properties of substance: calcium nitrate». Retrieved 2015-09-09.
- ^ a b c «Nitrates and Nitrites». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2002. doi:10.1002/14356007.a17_265.
- ^ «Bitter Pit and Cork Spot». University of Wisconsin-Extension Cooperative Extension. UW-Madison, Dept of Horticulture.
- ^ Bentzen, G; Smith, A; Bennett, D; Webster, N; Reinholt, F; Sletholt, E; Hobson, J (1995). «Controlled dosing of nitrate for prevention of H2S in a sewer network and the effects on the subsequent treatment process». Water Science and Technology. 31 (7): 293. doi:10.1016/0273-1223(95)00346-O.
- ^ Einarsen, A.M.; ÆeesØy, A.; Rasmussen, A. I.; Bungum, S.; Sveberg, M. (2000). «Biological prevention and removal of hydrogen sulphide in sludge at Lillehammer Wastewater Treatment Plant». Water Sci. Technol. 41 (6): 175–187. doi:10.2166/wst.2000.0107.
- ^ Justines, H. (2010) «Calcium Nitrate as a Multifunctional Concrete Admixture» Concrete Magazine, Vol 44, No. 1, p.34. ISSN 0010-5317
- ^ Al-Amoudi, Omar S.Baghabra; Maslehuddin, Mohammed; Lashari, A.N; Almusallam, Abdullah A (2003). «Effectiveness of corrosion inhibitors in contaminated concrete». Cement and Concrete Composites. 25 (4–5): 439. doi:10.1016/S0958-9465(02)00084-7.
- ^ N. C. Dafader, Y. N. Jolly, M. E. Haque, F. Akhtar & M. U. Ahmad: The Role of Coagulants on the Preparation of Dipped film from Radiation Vulcanized Natural Rubber Latex. Polymer-Plastics Technology and Engineering. Volume 38, Issue 2, 1999, pages 267-274. Online: http://www.tandfonline.com/doi/abs/10.1080/03602559909351576
- ^ «Rubbercare — Choice Latex and Nitrile Gloves from a Trusted Manufacturer».
- ^ «Potassium calcium nitrate promising for CSP heat storage – Solar Novus Today».
- ^ European Patent Application EP0049761: Use of a ternary mixture of salts as a heat transmitting medium and/or as a heat storage medium. http://www.freepatentsonline.com/EP0049761A1.html
- ^ WIPO Patent Application WO/2014/044652: Use of a calcium potassium nitrate salt for the manufacture of a heat transfer fluid. http://www.freepatentsonline.com/WO2014044652A1.html
- v
- t
- e
Salts and covalent derivatives of the nitrate ion

|
|

|
|

|
|
| Names | |
|---|---|
| Other names
Kalksalpeter, Norgessalpeter, nitrocalcite, Norwegian salpeter, lime nitrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.289 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1454 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Ca(NO3)2 |
| Molar mass | 164.088 g/mol (anhydrous) 236.15 g/mol (tetrahydrate) |
| Appearance | colorless solid hygroscopic |
| Density | 2.504 g/cm3 (anhydrous) 1.896 g/cm3 (tetrahydrate) |
| Melting point | 561 °C (1,042 °F; 834 K) (anhydrous) 42.7 °C (109 °F; 316 K) (tetrahydrate) |
| Boiling point | decomposes (anhydrous) 132 °C (270 °F; 405 K) (tetrahydrate) |
|
Solubility in water |
anhydrous: 1212 g/L (20 °C) 2710 g/L (40 °C) tetrahydrate: |
| Solubility | soluble in ammonia almost insoluble in nitric acid |
| Solubility in ethanol | 51.4 g/100 g (20 °C) 62.9 g/100 g (40 °C)[1] |
| Solubility in methanol | 134 g/100 g (10 °C) 144 g/100 g (40 °C) 158 g/100 g (60 °C)[1] |
| Solubility in acetone | 16.8 g/kg (20 °C)[1] |
| Acidity (pKa) | 6.0 |
|
Magnetic susceptibility (χ) |
-45.9·10−6 cm3/mol |
| Structure | |
|
Crystal structure |
cubic (anhydrous) monoclinic (tetrahydrate) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H272, H302, H315, H319 |
|
Precautionary statements |
P210, P220, P221, P264, P270, P280, P301+P312, P302+P352, P305+P351+P338, P310, P321, P330, P332+P313, P337+P313, P362, P370+P378, P501 |
| NFPA 704 (fire diamond) |
2 0 1 OX |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
302 mg/kg (rat, oral) |
| Safety data sheet (SDS) | ICSC 1037 |
| Related compounds | |
|
Other anions |
Calcium sulfate Calcium chloride |
|
Other cations |
Magnesium nitrate Strontium nitrate Barium nitrate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Calcium nitrate, also called Norgessalpeter (Norwegian salpeter), is an inorganic compound with the formula Ca(NO3)2(H2O)x. The anhydrous compound, which is rarely encountered, absorbs moisture from the air to give the tetrahydrate. Both anhydrous and hydrated forms are colourless salts. Calcium nitrate is mainly used as a component in fertilizers, but it has other applications. Nitrocalcite is the name for a mineral which is a hydrated calcium nitrate that forms as an efflorescence where manure contacts concrete or limestone in a dry environment as in stables or caverns. A variety of related salts are known including calcium ammonium nitrate decahydrate and calcium potassium nitrate decahydrate.[2]
Production and reactivity[edit]
Norgessalpeter was synthesized at Notodden, Norway in 1905 by the Birkeland–Eyde process. Most of the world’s calcium nitrate is now made in Porsgrunn.
It is produced by treating limestone with nitric acid, followed by neutralization with ammonia:
- CaCO3 + 2 HNO3 → Ca(NO3)2 + CO2 + H2O
It is also an intermediate product of the Odda Process:
- Ca5(PO4)3OH + 10 HNO3 → 3 H3PO4 + 5 Ca(NO3)2 + H2O
It can also be prepared from an aqueous solution of ammonium nitrate, and calcium hydroxide:
- 2 NH4NO3 + Ca(OH)2 → Ca(NO3)2 + 2 NH4OH
Like related alkaline earth metal nitrates, calcium nitrate decomposes upon heating (starting at 500 °C) to release nitrogen dioxide:[2]
- 2 Ca(NO3)2 → 2 CaO + 4 NO2 + O2 ΔH = 369 kJ/mol
Applications[edit]
Use in agriculture[edit]
The fertilizer grade (15.5-0-0 + 19% Ca) is popular in the greenhouse and hydroponics trades; it contains ammonium nitrate and water, as the «double salt» 
Calcium nitrate is also used to control certain plant diseases. For example, dilute calcium nitrate (and calcium chloride) sprays are used to control bitter pit and cork spot in apple trees.[3]
Waste water treatment[edit]
Waste water treatment unit
Calcium nitrate is used in waste water pre-conditioning for odour emission prevention. The waste water pre-conditioning is based on establishing an anoxic biology in the waste water system. In the presence of nitrate, the metabolism for sulfates stops, thus preventing formation of hydrogen sulfide.[4] Additionally easy degradable organic matter is consumed, which otherwise can cause anaerobic conditions downstream as well as odour emissions itself. The concept is also applicable for surplus sludge treatment.[5]
Concrete[edit]
Calcium nitrate is used in set accelerating concrete admixtures. This use with concrete and mortar is based on two effects. The calcium ion accelerates formation of calcium hydroxide and thus precipitation and setting. This effect is used also in cold weather concreting agents as well as some combined plasticizers.[6] The nitrate ion leads to formation of iron hydroxide, whose protective layer reduces corrosion of the concrete reinforcement.[7]
Latex coagulant[edit]
Calcium nitrate is a very common coagulant in latex production, especially in dipping processes. Dissolved calcium nitrate is a part of the dipping bath solution. The warm former is dipped into the coagulation liquid and a thin film of the dipping liquid remains on the former. When now dipping the former into the latex the calcium nitrate will break up the stabilization of the latex solution and the latex will coagulate on the former.[8][9]
Cold packs[edit]
The dissolution of calcium nitrate tetrahydrate is highly endothermic (cooling). For this reason, calcium nitrate tetrahydrate is sometimes used for regenerable cold packs.[2]
Molten salts for heat transfer and storage[edit]
Calcium nitrate can be used as a part of molten salt mixtures. Typical are binary mixtures of calcium nitrate and potassium nitrate or ternary mixtures including also sodium nitrate.[10][11][12] Those molten salts can be used to replace thermo oil in concentrated solar power plants for the heat transfer, but mostly those are used in heat storage.
References[edit]
- ^ a b c Anatolievich, Kiper Ruslan. «Properties of substance: calcium nitrate». Retrieved 2015-09-09.
- ^ a b c «Nitrates and Nitrites». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2002. doi:10.1002/14356007.a17_265.
- ^ «Bitter Pit and Cork Spot». University of Wisconsin-Extension Cooperative Extension. UW-Madison, Dept of Horticulture.
- ^ Bentzen, G; Smith, A; Bennett, D; Webster, N; Reinholt, F; Sletholt, E; Hobson, J (1995). «Controlled dosing of nitrate for prevention of H2S in a sewer network and the effects on the subsequent treatment process». Water Science and Technology. 31 (7): 293. doi:10.1016/0273-1223(95)00346-O.
- ^ Einarsen, A.M.; ÆeesØy, A.; Rasmussen, A. I.; Bungum, S.; Sveberg, M. (2000). «Biological prevention and removal of hydrogen sulphide in sludge at Lillehammer Wastewater Treatment Plant». Water Sci. Technol. 41 (6): 175–187. doi:10.2166/wst.2000.0107.
- ^ Justines, H. (2010) «Calcium Nitrate as a Multifunctional Concrete Admixture» Concrete Magazine, Vol 44, No. 1, p.34. ISSN 0010-5317
- ^ Al-Amoudi, Omar S.Baghabra; Maslehuddin, Mohammed; Lashari, A.N; Almusallam, Abdullah A (2003). «Effectiveness of corrosion inhibitors in contaminated concrete». Cement and Concrete Composites. 25 (4–5): 439. doi:10.1016/S0958-9465(02)00084-7.
- ^ N. C. Dafader, Y. N. Jolly, M. E. Haque, F. Akhtar & M. U. Ahmad: The Role of Coagulants on the Preparation of Dipped film from Radiation Vulcanized Natural Rubber Latex. Polymer-Plastics Technology and Engineering. Volume 38, Issue 2, 1999, pages 267-274. Online: http://www.tandfonline.com/doi/abs/10.1080/03602559909351576
- ^ «Rubbercare — Choice Latex and Nitrile Gloves from a Trusted Manufacturer».
- ^ «Potassium calcium nitrate promising for CSP heat storage – Solar Novus Today».
- ^ European Patent Application EP0049761: Use of a ternary mixture of salts as a heat transmitting medium and/or as a heat storage medium. http://www.freepatentsonline.com/EP0049761A1.html
- ^ WIPO Patent Application WO/2014/044652: Use of a calcium potassium nitrate salt for the manufacture of a heat transfer fluid. http://www.freepatentsonline.com/WO2014044652A1.html
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
Физические свойства
Нитрат кальция Ca(NO3)2 — соль щелочного металла кальция и азотной кислоты. Белый, при нагревании разлагается. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 164,09; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 561º C (разлагается).
Способ получения
1. Нитрат кальция можно путем взаимодействия кальция и разбавленной азотной кислоты, образуется нитрат кальция, оксид азота (I) и вода:
4Ca + 10HNO3 = 4Ca(NO3)2 + 2N2O↑ + 5H2O,
если кальций будет взаимодействовать с очень разбавленной азотной кислотой, то на выходе будет образовываться нитрат кальция, нитрат аммония и вода:
4Ca + 10HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O
2. В результате взаимодействия сульфида кальция и концентрированной азотной кислоты образуется нитрат кальция, сера, оксид азота (IV) и вода:
CaS + 4HNO3 = Ca(NO3)2 + S↓ + 2NO2↑ + 2H2O
Качественная реакция
Качественная реакция на нитрат кальция — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат кальция образует сульфат кальция, нитрат меди, бурый газ оксид азота и воду:
Cu + 2Ca(NO3)2 + 2H2SO4 = Cu(NO3)2 + 2CaSO4 + 2NO2 ↑ + 2H2O
Химические свойства
1. Hитрат кальция разлагается при температуре 450 — 500º С с образованием нитрита кальция и кислорода:
Ca(NO3)2 = Ca(NO2)2 + O2,
а если температуре поднимется выше 561оС, то на выходе реакции будут образовываться оксид кальция, оксид азота (IV) и кислород:
2Ca(NO3)2 = 2CaO + 4NO2 + O2
2. Нитрат кальция реагирует с простыми веществами:
2.1. Нитрат кальция вступает в реакцию с атомным водородом (цинком и в присутствии соляной кислоты). В результате реакции образуется нитрат кальция и вода:
Ca(NO3)2 + 2Zn + 4HCl = Ca(NO2)2 + 2ZnCl2 + 2H2O
3. Возможны реакции между нитратом кальция и сложными веществами:
Нитрат кальция вступает в реакцию с cолями:
В результате реакции между нитратом кальция и гидрофосфатом натрия при кипении образуется фосфат кальция, азотная кислота и нитрат натрия:
3Ca(NO3)2 + 2Na2HPO4 = Ca3(PO4)2↓ + 4NaNO3 + 2HNO3
| Нитрат кальция | |
|---|---|
 |
|
 |
|
| Общие | |
| Традиционные названия | кальциевая селитра, норвежская селитра, азотнокислый кальций |
| Хим. формула (b) | CaN2O6 |
| Физические свойства | |
| Состояние (b) | гранулы сферической формы белого, светло-серого, светло-бежевого цвета |
| Молярная масса (b) | 164,088 г/моль (b) |
| Плотность (b) |
(безводная) 2,504 г/см³; (тетрагидрат) 1,896 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления (b) |
(безводная) 561 °C; (тетрагидрат) 42,7 °C |
| • кипения (b) |
(безводная) разлагается; (тетрагидрат) 132 °C |
| • вспышки (b) | негорючая °C |
| Мол. теплоёмк. (b) | 149,33 Дж/(моль·К) |
| Энтальпия | |
| • образования | -937,2 кДж/моль |
| Химические свойства | |
| Растворимость (b) | |
| • в воде |
Безводной: 121,2 г/100 мл (20 °C); 271,0 г/100 мл (40 °C); 359 г/100 мл (51,6 °C). Тетрагидрата: 102 г/100 мл (0 °C); 129 г/100 мл (20 °C); (100 °C) 363 г/100 мл |
| • в | спирте (b) и ацетоне (b) |
| Структура | |
| Кристаллическая структура (b) |
кубическая (безводная) моноклинная (тетрагидрат) |
| Классификация | |
| Рег. номер CAS (b) |
10124-37-5 (безводная) 13477-34-4 (тетрагидрат) |
| PubChem (b) | 24963 |
| Рег. номер EINECS (b) | 233-332-1 |
| SMILES (b) |
[Ca+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI (b) |
InChI=1S/Ca.2NO3/c;2*2-1(3)4/q+2;2*-1 ZCCIPPOKBCJFDN-UHFFFAOYSA-N |
| RTECS (b) | EW2985000 |
| ChEBI | 64205 |
| Номер ООН (b) | 1454 |
| ChemSpider (b) | 23336 и 21500286 |
| Безопасность | |
| NFPA 704 (b) |
 0 1 3 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Кальция нитрат, кальциевая селитра, азотнокислый кальций — неорганическая (b) соль (b) азотной кислоты (b) . Соединение сильно гигроскопично (b) , поэтому его хранят без доступа влаги (b) . Химическая формула Са(NО3)2.
Свойства
Физические свойства
Вещество представляет собой белый порошок без цвета, вкуса и запаха. Он хорошо растворим в воде.
Молярная масса тетрагидрата нитрата кальция — 236,15 г/моль, безводного — 164,088 г/моль.
Химические свойства
При 500 °C начинает разлагаться с выделением О2 (b) и образованием сначала Ca(NO2)2 (b) , а затем СаО (b) и NO2 (b) .
Кальциевая селитра при нормальных условиях негорючая, пожаро- и взрывобезопасная, устойчивая в интервале температур от −60 °C до +155 °C. Вещество представляет собой соль азотной кислоты и гидроксида кальция. Соответственно, оно имеет все свойства, характерные для солей кислот. Например,
Ионы кальция образуют устойчивые соединения с краун эфирами.
Получение
Получают нитрат кальция действием HNO3 (b) на известняк (b) или поглощением нитрозных газов (в основном NO2 (b) ) известковым молоком (b) . Применяют его как азотное удобрение (b) и для получения особо чистого СаО (b) .
Для получения гранулированной кальциевой селитры используется способ низкотемпературной нейтрализации азотной кислоты природным известняком или продуктами переработки известняка (b) .
Реакции с получением нитрата кальция
Нитрат кальция производится путём обработки известняка (b) с азотной кислотой (b) , после нейтрализации (b) аммиака (b) :
- CaCO3 (b) + 2HNO3 (b) → Ca(NO3)2 + CO2 (b) + H2O (b) .
Он также является побочным продуктом процесса Оддо (b) при добыче фосфата кальция (b) :
- Ca3(PO4)2 (b) + 6HNO3 (b) → 2H3PO4 (b) + 3Ca(NO3)2.
Так же как нитраты других щелочноземельных металлов и LiNO3 (b) , кальциевая селитра при нагревании разлагается на выпуске диоксида азота (b) :
- 2Ca(NO3)2 → 2CaO (b) + 4NO2 (b) + O2 (b) , ΔH°обр. (b) =369 кДж/моль
Другие реакции получения нитрата кальция:
- (конц.)
- (конц.)
В атмосфере образование нитрата кальция возможно по следующей цепочке реакций:
- (грозовой разряд)
-
Применение
Гранулированный, безводный нитрат кальция, применяется как добавка в бетон (b) , в качестве удобрения (b) , для приготовления рассола в холодильной технике, в производстве реактивов (b) , стеклопластиков (b) , а также как один из компонентов для производства взрывчатки (b) .
В сельском хозяйстве
Нитрат кальция является физиологическим щелочным удобрением, пригодным для всех почв и прежде всего для закисленных почв. В сельском хозяйстве применяют как азотное удобрение (b) . Выпускают в гранулированном виде; товарный продукт должен содержать не менее 15,5 % азота (b) , кроме того, к нему добавляют в процессе производства 4—7 % нитрата аммония (b) для уменьшения гигроскопичности (b) удобрения; содержание влаги (b) не должно превышать 15 %. Нитрат кальция вносят под все культуры. Наиболее эффективен на кислых почвах (b) , особенно для весенней подкормки озимых (b) .
В пиротехнике (b)
Несмотря на то, что нитрат кальция в смеси с горючими веществами способен давать недорогой источник кирпично-красного пламени, применение его в этом качестве крайне ограничено из-за сильной гигроскопичности.
Нитраты (b) |
|
|---|---|
|
|
| Нитрат кальция | |
|---|---|
 |
|
 |
|
 |
|
| Общие | |
| Традиционные названия | кальциевая селитра, норвежская селитра, азотнокислый кальций |
| Хим. формула | Са(NО3)2 |
| Физические свойства | |
| Состояние | гранулы сферической формы белого, светло-серого, светло-бежевого цвета |
| Молярная масса |
(безводная) 164,088 г/моль; (тетрагидрат) 236,15 г/моль |
| Плотность |
(безводная) 2,504 г/см³; (тетрагидрат) 1,896 г/см³ |
| Термические свойства | |
| Т. плав. |
(безводная) 561 °C; (тетрагидрат) 42,7 °C |
| Т. кип. |
(безводная) разлагается; (тетрагидрат) 132 °C |
| Т. всп. | негорючая °C |
| Мол. теплоёмк. | 149,33 Дж/(моль·К) |
| Энтальпия образования | -937,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде |
Безводной: Тетрагидрата: (100 °C) 363 г/100 мл |
| Растворимость в | спирте и ацетоне |
| Структура | |
| Кристаллическая структура |
кубическая (безводная) моноклинная (тетрагидрат) |
| Классификация | |
| Рег. номер CAS |
10124-37-5 (безводная) 13477-34-4 (тетрагидрат) |
| PubChem | 24963 |
| Рег. номер EINECS | 233-332-1 |
| SMILES |
[Ca+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI |
1S/Ca.2NO3/c;2*2-1(3)4/q+2;2*-1 ZCCIPPOKBCJFDN-UHFFFAOYSA-N |
| RTECS | EW2985000 |
| ChEBI | 64205 |
| Номер ООН | 1454 |
| ChemSpider | 23336 и 21500286 |
| Безопасность | |
| Токсичность |
0 1 3 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Кальция нитрат (кальциевая селитра, азотнокислый кальций) — неорганическая соль азотной кислоты. Соединение сильно гигроскопично, поэтому его хранят без доступа влаги. Химическая формула Са(NО3)2.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Получение
- 2.1 Реакции с получением нитрата кальция
- 3 Применение
- 3.1 В сельском хозяйстве
- 3.2 В пиротехнике
Свойства
Физические свойства
Химические свойства
При 500 °C начинает разлагаться с выделением О2 и образованием сначала Ca(NO2)2, а затем СаО и NO2. Кальциевая селитра при нормальных условиях негорючая, пожаро- и взрывобезопасная, устойчивая в интервале температур от −60 °C до +155 °C.
Получение
Получают кальция нитрат действием HNO3 на известняк или поглощением нитрозных газов (в основном NO2) известковым молоком. Применяют кальция нитрат как азотное удобрение и для получения особо чистого СаО.
Для получения гранулированной кальциевой селитры используется способ низкотемпературной нейтрализации азотной кислоты природным известняком или продуктами переработки известняка.
Реакции с получением нитрата кальция
Нитрат кальция производится путём обработки известняка с азотной кислотой, после нейтрализации аммиака:
- CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O.
Он также является побочным продуктом процесса Оддо при добыче фосфата кальция:
- Ca3(PO4)2 + 6HNO3 → 2H3PO4 + 3Ca(NO3)2.
Так же как нитраты других щелочноземельных металлов и LiNO3, кальциевая селитра при нагревании разлагается на выпуске диоксида азота:
- 2Ca(NO3)2 → 2CaO + 4NO2 + O2, ΔH°обр.=369 кДж/моль
Также нитрат кальция можно получить проделав следующие реакции:
Также образование нитрата кальция возможно и за счет атмосферных явлений:
(грозовой разряд)
Применение
Гранулированный, безводный нитрат кальция, применяется как добавка в бетон, в качестве удобрения, для приготовления рассола в холодильной технике, в производстве реактивов, стеклопластиков, а также как один из компонентов для производства взрывчатки.
В сельском хозяйстве
Нитрат кальция является физиологическим щелочным удобрением, пригодным для всех почв и прежде всего для закисленных почв.
В сельском хозяйстве применяют как азотное удобрение. Выпускают в гранулированном виде; товарный продукт должен содержать не менее 15,5 % азота, кроме того, к нему добавляют в процессе производства 4—7 % нитрата аммония для уменьшения гигроскопичности удобрения; содержание влаги не должно превышать 15 %. Нитрат кальция вносят под все культуры. Наиболее эффективен на кислых почвах, особенно для весенней подкормки озимых.
В пиротехнике
Несмотря на то, что нитрат кальция в смеси с горючими веществами способен давать недорогой источник кирпично-красного пламени, применение его в этом качестве крайне ограничено из-за сильной гигроскопичности.













 (грозовой разряд)
(грозовой разряд)




