This article is about aluminium(III) oxide, Al2O3. For other uses, see Aluminium oxides.

|
|

|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.014.265 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Al2O3 |
| Molar mass | 101.960 g·mol−1 |
| Appearance | white solid |
| Odor | odorless |
| Density | 3.987g/cm3 |
| Melting point | 2,072 °C (3,762 °F; 2,345 K)[3] |
| Boiling point | 2,977 °C (5,391 °F; 3,250 K)[4] |
|
Solubility in water |
insoluble |
| Solubility | insoluble in all solvents |
| log P | 0.31860[1] |
|
Magnetic susceptibility (χ) |
−37.0×10−6 cm3/mol |
| Thermal conductivity | 30 W·m−1·K−1[2] |
|
Refractive index (nD) |
nω=1.768–1.772 nε=1.760–1.763 Birefringence 0.008 |
| Structure | |
|
Crystal structure |
Trigonal, hR30 |
|
Space group |
R3c (No. 167) |
|
Lattice constant |
a = 478.5 pm, c = 1299.1 pm |
|
Coordination geometry |
octahedral |
| Thermochemistry | |
|
Std molar |
50.92 J·mol−1·K−1[5] |
|
Std enthalpy of |
−1675.7 kJ/mol[5] |
| Pharmacology | |
|
ATC code |
D10AX04 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
| NFPA 704 (fire diamond) |
0 0 0 |
| Flash point | Non-flammable |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
OSHA 15 mg/m3 (Total Dust) OSHA 5 mg/m3 (Respirable Fraction) ACGIH/TLV 10 mg/m3 |
|
REL (Recommended) |
none[6] |
|
IDLH (Immediate danger) |
N.D.[6] |
| Related compounds | |
|
Other anions |
aluminium hydroxide aluminium sulfide aluminium selenide |
|
Other cations |
boron trioxide gallium(III) oxide indium oxide thallium(III) oxide |
| Supplementary data page | |
| Aluminium oxide (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium oxide is a chemical compound of aluminium and oxygen with the chemical formula Al2O3. It is the most commonly occurring of several aluminium oxides, and specifically identified as aluminium oxide. It is commonly called alumina and may also be called aloxide, aloxite, or alundum in various forms or applications. It occurs naturally in its crystalline polymorphic phase α-Al2O3 as the mineral corundum, varieties of which form the precious gemstones ruby and sapphire. Al2O3 is significant in its use to produce aluminium metal, as an abrasive owing to its hardness, and as a refractory material owing to its high melting point.[7]
Natural occurrence[edit]
Corundum is the most common naturally occurring crystalline form of aluminium oxide.[8] Rubies and sapphires are gem-quality forms of corundum, which owe their characteristic colours to trace impurities. Rubies are given their characteristic deep red colour and their laser qualities by traces of chromium. Sapphires come in different colours given by various other impurities, such as iron and titanium. An extremely rare, δ form, occurs as the mineral deltalumite.[9][10]
Properties[edit]
Aluminium oxide in its powdered form
Al2O3 is an electrical insulator but has a relatively high thermal conductivity (30 Wm−1K−1)[2] for a ceramic material. Aluminium oxide is insoluble in water. In its most commonly occurring crystalline form, called corundum or α-aluminium oxide, its hardness makes it suitable for use as an abrasive and as a component in cutting tools.[7]
Aluminium oxide is responsible for the resistance of metallic aluminium to weathering. Metallic aluminium is very reactive with atmospheric oxygen, and a thin passivation layer of aluminium oxide (4 nm thickness) forms on any exposed aluminium surface in a matter of hundreds of picoseconds.[better source needed][11] This layer protects the metal from further oxidation. The thickness and properties of this oxide layer can be enhanced using a process called anodising. A number of alloys, such as aluminium bronzes, exploit this property by including a proportion of aluminium in the alloy to enhance corrosion resistance. The aluminium oxide generated by anodising is typically amorphous, but discharge assisted oxidation processes such as plasma electrolytic oxidation result in a significant proportion of crystalline aluminium oxide in the coating, enhancing its hardness.
Aluminium oxide was taken off the United States Environmental Protection Agency’s chemicals lists in 1988. Aluminium oxide is on the EPA’s Toxics Release Inventory list if it is a fibrous form.[12]
Amphoteric nature[edit]
Aluminium oxide is an amphoteric substance, meaning it can react with both acids and bases, such as hydrofluoric acid and sodium hydroxide, acting as an acid with a base and a base with an acid, neutralising the other and producing a salt.
- Al2O3 + 6 HF → 2 AlF3 + 3 H2O
- Al2O3 + 2 NaOH + 3 H2O → 2 NaAl(OH)4 (sodium aluminate)
Structure[edit]
Corundum from Brazil, size about 2×3 cm.
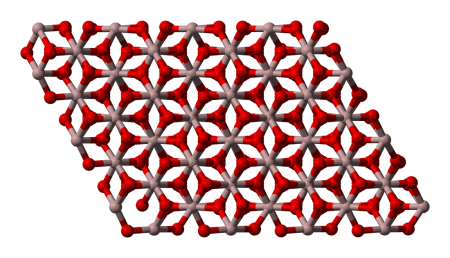
The most common form of crystalline aluminium oxide is known as corundum, which is the thermodynamically stable form.[13] The oxygen ions form a nearly hexagonal close-packed structure with the aluminium ions filling two-thirds of the octahedral interstices. Each Al3+ center is octahedral. In terms of its crystallography, corundum adopts a trigonal Bravais lattice with a space group of R3c (number 167 in the International Tables). The primitive cell contains two formula units of aluminium oxide.
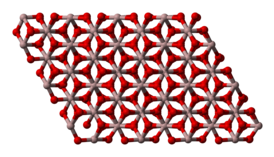
Aluminium oxide also exists in other metastable phases, including the cubic γ and η phases, the monoclinic θ phase, the hexagonal χ phase, the orthorhombic κ phase and the δ phase that can be tetragonal or orthorhombic.[13][14] Each has a unique crystal structure and properties. Cubic γ-Al2O3 has important technical applications. The so-called β-Al2O3 proved to be NaAl11O17.[15]
Molten aluminium oxide near the melting temperature is roughly 2/3 tetrahedral (i.e. 2/3 of the Al are surrounded by 4 oxygen neighbors), and 1/3 5-coordinated, with very little (<5%) octahedral Al-O present.[16] Around 80% of the oxygen atoms are shared among three or more Al-O polyhedra, and the majority of inter-polyhedral connections are corner-sharing, with the remaining 10–20% being edge-sharing.[16] The breakdown of octahedra upon melting is accompanied by a relatively large volume increase (~33%), the density of the liquid close to its melting point is 2.93 g/cm3.[17] The structure of molten alumina is temperature dependent and the fraction of 5- and 6-fold aluminium increases during cooling (and supercooling), at the expense of tetrahedral AlO4 units, approaching the local structural arrangements found in amorphous alumina.[18]
Production[edit]
Aluminium hydroxide minerals are the main component of bauxite, the principal ore of aluminium. A mixture of the minerals comprise bauxite ore, including gibbsite (Al(OH)3), boehmite (γ-AlO(OH)), and diaspore (α-AlO(OH)), along with impurities of iron oxides and hydroxides, quartz and clay minerals.[19] Bauxites are found in laterites. Bauxite is typically purified using the Bayer process:
- Al2O3 + H2O + NaOH → NaAl(OH)4
- Al(OH)3 + NaOH → NaAl(OH)4
Except for SiO2, the other components of bauxite do not dissolve in base. Upon filtering the basic mixture, Fe2O3 is removed. When the Bayer liquor is cooled, Al(OH)3 precipitates, leaving the silicates in solution.
- NaAl(OH)4 → NaOH + Al(OH)3
The solid Al(OH)3 Gibbsite is then calcined (heated to over 1100 °C) to give aluminium oxide:[7]
- 2 Al(OH)3 → Al2O3 + 3 H2O
The product aluminium oxide tends to be multi-phase, i.e., consisting of several phases of aluminium oxide rather than solely corundum.[14] The production process can therefore be optimized to produce a tailored product. The type of phases present affects, for example, the solubility and pore structure of the aluminium oxide product which, in turn, affects the cost of aluminium production and pollution control.[14]
Applications[edit]
Known as alpha alumina in materials science communities or alundum (in fused form) or aloxite[20] in the mining and ceramic communities aluminium oxide finds wide use. Annual world production of aluminium oxide in 2015 was approximately 115 million tonnes, over 90% of which is used in the manufacture of aluminium metal.[7] The major uses of speciality aluminium oxides are in refractories, ceramics, polishing and abrasive applications. Large tonnages of aluminium hydroxide, from which alumina is derived, are used in the manufacture of zeolites, coating titania pigments, and as a fire retardant/smoke suppressant.
Over 90% of the aluminium oxide, normally termed Smelter Grade Alumina (SGA), produced is consumed for the production of aluminium, usually by the Hall–Héroult process. The remainder, normally called speciality alumina is used in a wide variety of applications which reflect its inertness, temperature resistance and electrical resistance.[21]
Fillers[edit]
Being fairly chemically inert and white, aluminium oxide is a favored filler for plastics. Aluminium oxide is a common ingredient in sunscreen and is sometimes also present in cosmetics such as blush, lipstick, and nail polish.
Glass[edit]
Many formulations of glass have aluminium oxide as an ingredient.[22] Aluminosilicate glass is a commonly used type of glass that often contains 5% to 10% alumina.
Catalysis[edit]
Aluminium oxide catalyses a variety of reactions that are useful industrially. In its largest scale application, aluminium oxide is the catalyst in the Claus process for converting hydrogen sulfide waste gases into elemental sulfur in refineries. It is also useful for dehydration of alcohols to alkenes.
Aluminium oxide serves as a catalyst support for many industrial catalysts, such as those used in hydrodesulfurization and some Ziegler–Natta polymerizations.
Gas purification[edit]
Aluminium oxide is widely used to remove water from gas streams.[23]
Abrasive[edit]
Aluminium oxide is used for its hardness and strength. Its naturally occurring form, corundum, is a 9 on the Mohs scale of mineral hardness (just below diamond). It is widely used as an abrasive, including as a much less expensive substitute for industrial diamond. Many types of sandpaper use aluminium oxide crystals. In addition, its low heat retention and low specific heat make it widely used in grinding operations, particularly cutoff tools. As the powdery abrasive mineral aloxite, it is a major component, along with silica, of the cue tip «chalk» used in billiards. Aluminium oxide powder is used in some CD/DVD polishing and scratch-repair kits. Its polishing qualities are also behind its use in toothpaste. It is also used in microdermabrasion, both in the machine process available through dermatologists and estheticians, and as a manual dermal abrasive used according to manufacturer directions.
Paint[edit]
Aluminium oxide flakes are used in paint for reflective decorative effects, such as in the automotive or cosmetic industries.[citation needed]
Composite fiber[edit]
Aluminium oxide has been used in a few experimental and commercial fiber materials for high-performance applications (e.g., Fiber FP, Nextel 610, Nextel 720).[24] Alumina nanofibers in particular have become a research field of interest.
Armor[edit]
Some body armors utilize alumina ceramic plates, usually in combination with aramid or UHMWPE backing to achieve effectiveness against most rifle threats. Alumina ceramic armor is readily available to most civilians in jurisdictions where it is legal, but is not considered military grade.[25] It is also used to produce bullet-proof alumina glass capable to withstand impact of .50 BMG calibre rounds.
Abrasion protection[edit]
Aluminium oxide can be grown as a coating on aluminium by anodizing or by plasma electrolytic oxidation (see the «Properties» above). Both the hardness and abrasion-resistant characteristics of the coating originate from the high strength of aluminium oxide, yet the porous coating layer produced with conventional direct current anodizing procedures is within a 60–70 Rockwell hardness C range[26] which is comparable only to hardened carbon steel alloys, but considerably inferior to the hardness of natural and synthetic corundum. Instead, with plasma electrolytic oxidation, the coating is porous only on the surface oxide layer while the lower oxide layers are much more compact than with standard DC anodizing procedures and present a higher crystallinity due to the oxide layers being remelted and densified to obtain α-Al2O3 clusters with much higher coating hardness values circa 2000 Vickers hardness.[citation needed]
Aluminium oxide output in 2005
Alumina is used to manufacture tiles which are attached inside pulverized fuel lines and flue gas ducting on coal fired power stations to protect high wear areas. They are not suitable for areas with high impact forces as these tiles are brittle and susceptible to breakage.
Electrical insulation[edit]
Aluminium oxide is an electrical insulator used as a substrate (silicon on sapphire) for integrated circuits but also as a tunnel barrier for the fabrication of superconducting devices such as single-electron transistors and superconducting quantum interference devices (SQUIDs).
For its application as an electrical insulator in integrated circuits, where the conformal growth of a thin film is a prerequisite and the preferred growth mode is atomic layer deposition, Al2O3 films can be prepared by the chemical exchange between trimethylaluminum (Al(CH3)3) and H2O:[27]
- 2 Al(CH3)3 + 3 H2O → Al2O3 + 6 CH4
H2O in the above reaction can be replaced by ozone (O3) as the active oxidant and the following reaction then takes place:[28][29]
- 2 Al(CH3)3 + O3 → Al2O3 + 3 C2H6
The Al2O3 films prepared using O3 show 10–100 times lower leakage current density compared with those prepared by H2O.
Aluminium oxide, being a dielectric with relatively large band gap, is used as an insulating barrier in capacitors.[30]
Other[edit]
In lighting, translucent aluminium oxide is used in some sodium vapor lamps.[31] Aluminium oxide is also used in preparation of coating suspensions in compact fluorescent lamps.
In chemistry laboratories, aluminium oxide is a medium for chromatography, available in basic (pH 9.5), acidic (pH 4.5 when in water) and neutral formulations.
Health and medical applications include it as a material in hip replacements[7] and birth control pills.[32]
It is used as a scintillator[33]
and dosimeter for radiation protection and therapy applications for its optically stimulated luminescence properties.[citation needed]
Insulation for high-temperature furnaces is often manufactured from aluminium oxide. Sometimes the insulation has varying percentages of silica depending on the temperature rating of the material. The insulation can be made in blanket, board, brick and loose fiber forms for various application requirements.
Small pieces of aluminium oxide are often used as boiling chips in chemistry.
It is also used to make spark plug insulators.[34]
Using a plasma spray process and mixed with titania, it is coated onto the braking surface of some bicycle rims to provide abrasion and wear resistance.[citation needed]
Most ceramic eyes on fishing rods are circular rings made from aluminium oxide.[citation needed]
In its finest powdered (white) form, called Diamantine, aluminium oxide is used as a superior polishing abrasive in watchmaking and clockmaking.[35]
Aluminium oxide is also used in the coating of stanchions in the motorcross and mountainbike industry.
This coating is combined with molybdenumdisulfate to provide long term lubrication of the surface.[36]
See also[edit]
- Aluminium oxide nanoparticle
- Bauxite tailings
- Beta-alumina solid electrolyte, a fast ion conductor
- Charged Aerosol Release Experiment (CARE)
- List of alumina refineries
- Micro-Pulling-Down
- Transparent alumina
References[edit]
- ^ «Aluminum oxide_msds».
- ^ a b Material Properties Data: Alumina (Aluminum Oxide) Archived 2010-04-01 at the Wayback Machine. Makeitfrom.com. Retrieved on 2013-04-17.
- ^ Patnaik, P. (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 978-0-07-049439-8.
- ^ Raymond C. Rowe; Paul J. Sheskey; Marian E. Quinn (2009). «Adipic acid». Handbook of Pharmaceutical Excipients. Pharmaceutical Press. pp. 11–12. ISBN 978-0-85369-792-3.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ISBN 978-0-618-94690-7.
- ^ a b NIOSH Pocket Guide to Chemical Hazards. «#0021». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d e «Alumina (Aluminium Oxide) – The Different Types of Commercially Available Grades». The A to Z of Materials. 3 May 2002. Archived from the original on 10 October 2007. Retrieved 27 October 2007.
- ^ Elam, J. W. (October 2010). Atomic Layer Deposition Applications 6. The Electrochemical Society. ISBN 9781566778213.
- ^ «Deltalumite».
- ^ «List of Minerals». 21 March 2011.
- ^ Campbell, Timothy; Kalia, Rajiv; Nakano, Aiichiro; Vashishta, Priya; Ogata, Shuji; Rodgers, Stephen (1999). «Dynamics of Oxidation of Aluminium Nanoclusters using Variable Charge Molecular-Dynamics Simulations on Parallel Computers» (PDF). Physical Review Letters. 82 (24): 4866. Bibcode:1999PhRvL..82.4866C. doi:10.1103/PhysRevLett.82.4866. Archived (PDF) from the original on 2010-07-01.
- ^ «EPCRA Section 313 Chemical List For Reporting Year 2006» (PDF). US EPA. Archived from the original (PDF) on 2008-05-22. Retrieved 2008-09-30.
- ^ a b I. Levin; D. Brandon (1999). «Metastable Alumina Polymorphs: Crystal Structures and Transition Sequences». Journal of the American Ceramic Society. 81 (8): 1995–2012. doi:10.1111/j.1151-2916.1998.tb02581.x.
- ^ a b c Paglia, G. (2004). «Determination of the Structure of γ-Alumina using Empirical and First Principles Calculations Combined with Supporting Experiments» (free download). Curtin University of Technology, Perth. Retrieved 2009-05-05.
- ^ Wiberg, E.; Holleman, A. F. (2001). Inorganic Chemistry. Elsevier. ISBN 978-0-12-352651-9.
- ^ a b Skinner, L.B.; et al. (2013). «Joint diffraction and modeling approach to the structure of liquid alumina». Phys. Rev. B. 87 (2): 024201. Bibcode:2013PhRvB..87b4201S. doi:10.1103/PhysRevB.87.024201.
- ^ Paradis, P.-F.; et al. (2004). «Non-Contact Thermophysical Property Measurements of Liquid and Undercooled Alumina». Jpn. J. Appl. Phys. 43 (4): 1496–1500. Bibcode:2004JaJAP..43.1496P. doi:10.1143/JJAP.43.1496. S2CID 250779901.
- ^ Shi, C; Alderman, O L G; Berman, D; Du, J; Neuefeind, J; Tamalonis, A; Weber, R; You, J; Benmore, C J (2019). «The structure of amorphous and deeply supercooled liquid alumina». Frontiers in Materials. 6 (38): 38. Bibcode:2019FrMat…6…38S. doi:10.3389/fmats.2019.00038.
- ^ «Bauxite and Alumina Statistics and Information». USGS. Archived from the original on 6 May 2009. Retrieved 2009-05-05.
- ^ «Aloxite». ChemIndustry.com database. Archived from the original on 25 June 2007. Retrieved 24 February 2007.
- ^ Evans, K. A. (1993). «Properties and uses of aluminium oxides and aluminium hydroxides». In Downs, A. J. (ed.). The Chemistry of Aluminium, Indium and Gallium. Blackie Academic. ISBN 978-0751401035.
- ^ Akers, Michael J. (2016-04-19). Sterile Drug Products: Formulation, Packaging, Manufacturing and Quality. CRC Press. ISBN 9781420020564.
- ^ Hudson, L. Keith; Misra, Chanakya; Perrotta, Anthony J.; Wefers, Karl and Williams, F. S. (2002) «Aluminum Oxide» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a01_557.
- ^ Mallick, P.K. (2008). Fiber-reinforced composites materials, manufacturing, and design (3rd ed., [expanded and rev. ed.] ed.). Boca Raton, FL: CRC Press. pp. Ch.2.1.7. ISBN 978-0-8493-4205-9.
- ^ «Ballistic Resistance of Body Armor» (PDF). US Department of Justice. NIJ. Retrieved 31 August 2018.
- ^ Osborn, Joseph H. (2014). «understanding and specifying anodizing: what a manufacturer needs to know». OMW Corporation. Archived from the original on 2016-11-20. Retrieved 2018-06-02.
- ^ Higashi GS, Fleming (1989). «Sequential surface chemical reaction limited growth of high quality Al2O3 dielectrics». Appl. Phys. Lett. 55 (19): 1963–65. Bibcode:1989ApPhL..55.1963H. doi:10.1063/1.102337.
- ^ Kim JB; Kwon DR; Chakrabarti K; Lee Chongmu; Oh KY; Lee JH (2002). «Improvement in Al2O3 dielectric behavior by using ozone as an oxidant for the atomic layer deposition technique». J. Appl. Phys. 92 (11): 6739–42. Bibcode:2002JAP….92.6739K. doi:10.1063/1.1515951.
- ^ Kim, Jaebum; Chakrabarti, Kuntal; Lee, Jinho; Oh, Ki-Young; Lee, Chongmu (2003). «Effects of ozone as an oxygen source on the properties of the Al2O3 thin films prepared by atomic layer deposition». Mater Chem Phys. 78 (3): 733–38. doi:10.1016/S0254-0584(02)00375-9.
- ^ Belkin, A.; Bezryadin, A.; Hendren, L.; Hubler, A. (20 April 2017). «Recovery of Alumina Nanocapacitors after High Voltage Breakdown». Scientific Reports. 7 (1): 932. Bibcode:2017NatSR…7..932B. doi:10.1038/s41598-017-01007-9. PMC 5430567. PMID 28428625.
- ^ «GE Innovation Timeline 1957–1970». Archived from the original on 16 February 2009. Retrieved 2009-01-12.
- ^ «DailyMed — JUNEL FE 1/20- norethindrone acetate and ethinyl estradiol, and ferrous fumarate». dailymed.nlm.nih.gov. Archived from the original on 2017-03-13. Retrieved 2017-03-13.
- ^ V.B. Mikhailik, H. Kraus (2005). «Low-temperature spectroscopic and scintillation characterisation of Ti-doped Al2O3«. Nucl. Instr. Phys. Res. A. 546 (3): 523–534. Bibcode:2005NIMPA.546..523M. doi:10.1016/j.nima.2005.02.033.
- ^ Farndon, John (2001). Aluminum. Marshall Cavendish. p. 19. ISBN 9780761409472.
Aluminum oxide is also used to make spark plug insulators.
- ^ de Carle, Donald (1969). Practical Watch Repair. N.A.G. Press Ltd. p. 164. ISBN 0719800307.
- ^ «Kashima Coat — Products / Services | Next-generation anodize boasting light weight, high lubrication, and superb wear resistance. The answer is Miyaki’s Kashima Coat».
External links[edit]
- CDC — NIOSH Pocket Guide to Chemical Hazards
This article is about aluminium(III) oxide, Al2O3. For other uses, see Aluminium oxides.

|
|

|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.014.265 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Al2O3 |
| Molar mass | 101.960 g·mol−1 |
| Appearance | white solid |
| Odor | odorless |
| Density | 3.987g/cm3 |
| Melting point | 2,072 °C (3,762 °F; 2,345 K)[3] |
| Boiling point | 2,977 °C (5,391 °F; 3,250 K)[4] |
|
Solubility in water |
insoluble |
| Solubility | insoluble in all solvents |
| log P | 0.31860[1] |
|
Magnetic susceptibility (χ) |
−37.0×10−6 cm3/mol |
| Thermal conductivity | 30 W·m−1·K−1[2] |
|
Refractive index (nD) |
nω=1.768–1.772 nε=1.760–1.763 Birefringence 0.008 |
| Structure | |
|
Crystal structure |
Trigonal, hR30 |
|
Space group |
R3c (No. 167) |
|
Lattice constant |
a = 478.5 pm, c = 1299.1 pm |
|
Coordination geometry |
octahedral |
| Thermochemistry | |
|
Std molar |
50.92 J·mol−1·K−1[5] |
|
Std enthalpy of |
−1675.7 kJ/mol[5] |
| Pharmacology | |
|
ATC code |
D10AX04 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
| NFPA 704 (fire diamond) |
0 0 0 |
| Flash point | Non-flammable |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
OSHA 15 mg/m3 (Total Dust) OSHA 5 mg/m3 (Respirable Fraction) ACGIH/TLV 10 mg/m3 |
|
REL (Recommended) |
none[6] |
|
IDLH (Immediate danger) |
N.D.[6] |
| Related compounds | |
|
Other anions |
aluminium hydroxide aluminium sulfide aluminium selenide |
|
Other cations |
boron trioxide gallium(III) oxide indium oxide thallium(III) oxide |
| Supplementary data page | |
| Aluminium oxide (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium oxide is a chemical compound of aluminium and oxygen with the chemical formula Al2O3. It is the most commonly occurring of several aluminium oxides, and specifically identified as aluminium oxide. It is commonly called alumina and may also be called aloxide, aloxite, or alundum in various forms or applications. It occurs naturally in its crystalline polymorphic phase α-Al2O3 as the mineral corundum, varieties of which form the precious gemstones ruby and sapphire. Al2O3 is significant in its use to produce aluminium metal, as an abrasive owing to its hardness, and as a refractory material owing to its high melting point.[7]
Natural occurrence[edit]
Corundum is the most common naturally occurring crystalline form of aluminium oxide.[8] Rubies and sapphires are gem-quality forms of corundum, which owe their characteristic colours to trace impurities. Rubies are given their characteristic deep red colour and their laser qualities by traces of chromium. Sapphires come in different colours given by various other impurities, such as iron and titanium. An extremely rare, δ form, occurs as the mineral deltalumite.[9][10]
Properties[edit]
Aluminium oxide in its powdered form
Al2O3 is an electrical insulator but has a relatively high thermal conductivity (30 Wm−1K−1)[2] for a ceramic material. Aluminium oxide is insoluble in water. In its most commonly occurring crystalline form, called corundum or α-aluminium oxide, its hardness makes it suitable for use as an abrasive and as a component in cutting tools.[7]
Aluminium oxide is responsible for the resistance of metallic aluminium to weathering. Metallic aluminium is very reactive with atmospheric oxygen, and a thin passivation layer of aluminium oxide (4 nm thickness) forms on any exposed aluminium surface in a matter of hundreds of picoseconds.[better source needed][11] This layer protects the metal from further oxidation. The thickness and properties of this oxide layer can be enhanced using a process called anodising. A number of alloys, such as aluminium bronzes, exploit this property by including a proportion of aluminium in the alloy to enhance corrosion resistance. The aluminium oxide generated by anodising is typically amorphous, but discharge assisted oxidation processes such as plasma electrolytic oxidation result in a significant proportion of crystalline aluminium oxide in the coating, enhancing its hardness.
Aluminium oxide was taken off the United States Environmental Protection Agency’s chemicals lists in 1988. Aluminium oxide is on the EPA’s Toxics Release Inventory list if it is a fibrous form.[12]
Amphoteric nature[edit]
Aluminium oxide is an amphoteric substance, meaning it can react with both acids and bases, such as hydrofluoric acid and sodium hydroxide, acting as an acid with a base and a base with an acid, neutralising the other and producing a salt.
- Al2O3 + 6 HF → 2 AlF3 + 3 H2O
- Al2O3 + 2 NaOH + 3 H2O → 2 NaAl(OH)4 (sodium aluminate)
Structure[edit]
Corundum from Brazil, size about 2×3 cm.
The most common form of crystalline aluminium oxide is known as corundum, which is the thermodynamically stable form.[13] The oxygen ions form a nearly hexagonal close-packed structure with the aluminium ions filling two-thirds of the octahedral interstices. Each Al3+ center is octahedral. In terms of its crystallography, corundum adopts a trigonal Bravais lattice with a space group of R3c (number 167 in the International Tables). The primitive cell contains two formula units of aluminium oxide.
Aluminium oxide also exists in other metastable phases, including the cubic γ and η phases, the monoclinic θ phase, the hexagonal χ phase, the orthorhombic κ phase and the δ phase that can be tetragonal or orthorhombic.[13][14] Each has a unique crystal structure and properties. Cubic γ-Al2O3 has important technical applications. The so-called β-Al2O3 proved to be NaAl11O17.[15]
Molten aluminium oxide near the melting temperature is roughly 2/3 tetrahedral (i.e. 2/3 of the Al are surrounded by 4 oxygen neighbors), and 1/3 5-coordinated, with very little (<5%) octahedral Al-O present.[16] Around 80% of the oxygen atoms are shared among three or more Al-O polyhedra, and the majority of inter-polyhedral connections are corner-sharing, with the remaining 10–20% being edge-sharing.[16] The breakdown of octahedra upon melting is accompanied by a relatively large volume increase (~33%), the density of the liquid close to its melting point is 2.93 g/cm3.[17] The structure of molten alumina is temperature dependent and the fraction of 5- and 6-fold aluminium increases during cooling (and supercooling), at the expense of tetrahedral AlO4 units, approaching the local structural arrangements found in amorphous alumina.[18]
Production[edit]
Aluminium hydroxide minerals are the main component of bauxite, the principal ore of aluminium. A mixture of the minerals comprise bauxite ore, including gibbsite (Al(OH)3), boehmite (γ-AlO(OH)), and diaspore (α-AlO(OH)), along with impurities of iron oxides and hydroxides, quartz and clay minerals.[19] Bauxites are found in laterites. Bauxite is typically purified using the Bayer process:
- Al2O3 + H2O + NaOH → NaAl(OH)4
- Al(OH)3 + NaOH → NaAl(OH)4
Except for SiO2, the other components of bauxite do not dissolve in base. Upon filtering the basic mixture, Fe2O3 is removed. When the Bayer liquor is cooled, Al(OH)3 precipitates, leaving the silicates in solution.
- NaAl(OH)4 → NaOH + Al(OH)3
The solid Al(OH)3 Gibbsite is then calcined (heated to over 1100 °C) to give aluminium oxide:[7]
- 2 Al(OH)3 → Al2O3 + 3 H2O
The product aluminium oxide tends to be multi-phase, i.e., consisting of several phases of aluminium oxide rather than solely corundum.[14] The production process can therefore be optimized to produce a tailored product. The type of phases present affects, for example, the solubility and pore structure of the aluminium oxide product which, in turn, affects the cost of aluminium production and pollution control.[14]
Applications[edit]
Known as alpha alumina in materials science communities or alundum (in fused form) or aloxite[20] in the mining and ceramic communities aluminium oxide finds wide use. Annual world production of aluminium oxide in 2015 was approximately 115 million tonnes, over 90% of which is used in the manufacture of aluminium metal.[7] The major uses of speciality aluminium oxides are in refractories, ceramics, polishing and abrasive applications. Large tonnages of aluminium hydroxide, from which alumina is derived, are used in the manufacture of zeolites, coating titania pigments, and as a fire retardant/smoke suppressant.
Over 90% of the aluminium oxide, normally termed Smelter Grade Alumina (SGA), produced is consumed for the production of aluminium, usually by the Hall–Héroult process. The remainder, normally called speciality alumina is used in a wide variety of applications which reflect its inertness, temperature resistance and electrical resistance.[21]
Fillers[edit]
Being fairly chemically inert and white, aluminium oxide is a favored filler for plastics. Aluminium oxide is a common ingredient in sunscreen and is sometimes also present in cosmetics such as blush, lipstick, and nail polish.
Glass[edit]
Many formulations of glass have aluminium oxide as an ingredient.[22] Aluminosilicate glass is a commonly used type of glass that often contains 5% to 10% alumina.
Catalysis[edit]
Aluminium oxide catalyses a variety of reactions that are useful industrially. In its largest scale application, aluminium oxide is the catalyst in the Claus process for converting hydrogen sulfide waste gases into elemental sulfur in refineries. It is also useful for dehydration of alcohols to alkenes.
Aluminium oxide serves as a catalyst support for many industrial catalysts, such as those used in hydrodesulfurization and some Ziegler–Natta polymerizations.
Gas purification[edit]
Aluminium oxide is widely used to remove water from gas streams.[23]
Abrasive[edit]
Aluminium oxide is used for its hardness and strength. Its naturally occurring form, corundum, is a 9 on the Mohs scale of mineral hardness (just below diamond). It is widely used as an abrasive, including as a much less expensive substitute for industrial diamond. Many types of sandpaper use aluminium oxide crystals. In addition, its low heat retention and low specific heat make it widely used in grinding operations, particularly cutoff tools. As the powdery abrasive mineral aloxite, it is a major component, along with silica, of the cue tip «chalk» used in billiards. Aluminium oxide powder is used in some CD/DVD polishing and scratch-repair kits. Its polishing qualities are also behind its use in toothpaste. It is also used in microdermabrasion, both in the machine process available through dermatologists and estheticians, and as a manual dermal abrasive used according to manufacturer directions.
Paint[edit]
Aluminium oxide flakes are used in paint for reflective decorative effects, such as in the automotive or cosmetic industries.[citation needed]
Composite fiber[edit]
Aluminium oxide has been used in a few experimental and commercial fiber materials for high-performance applications (e.g., Fiber FP, Nextel 610, Nextel 720).[24] Alumina nanofibers in particular have become a research field of interest.
Armor[edit]
Some body armors utilize alumina ceramic plates, usually in combination with aramid or UHMWPE backing to achieve effectiveness against most rifle threats. Alumina ceramic armor is readily available to most civilians in jurisdictions where it is legal, but is not considered military grade.[25] It is also used to produce bullet-proof alumina glass capable to withstand impact of .50 BMG calibre rounds.
Abrasion protection[edit]
Aluminium oxide can be grown as a coating on aluminium by anodizing or by plasma electrolytic oxidation (see the «Properties» above). Both the hardness and abrasion-resistant characteristics of the coating originate from the high strength of aluminium oxide, yet the porous coating layer produced with conventional direct current anodizing procedures is within a 60–70 Rockwell hardness C range[26] which is comparable only to hardened carbon steel alloys, but considerably inferior to the hardness of natural and synthetic corundum. Instead, with plasma electrolytic oxidation, the coating is porous only on the surface oxide layer while the lower oxide layers are much more compact than with standard DC anodizing procedures and present a higher crystallinity due to the oxide layers being remelted and densified to obtain α-Al2O3 clusters with much higher coating hardness values circa 2000 Vickers hardness.[citation needed]
Aluminium oxide output in 2005
Alumina is used to manufacture tiles which are attached inside pulverized fuel lines and flue gas ducting on coal fired power stations to protect high wear areas. They are not suitable for areas with high impact forces as these tiles are brittle and susceptible to breakage.
Electrical insulation[edit]
Aluminium oxide is an electrical insulator used as a substrate (silicon on sapphire) for integrated circuits but also as a tunnel barrier for the fabrication of superconducting devices such as single-electron transistors and superconducting quantum interference devices (SQUIDs).
For its application as an electrical insulator in integrated circuits, where the conformal growth of a thin film is a prerequisite and the preferred growth mode is atomic layer deposition, Al2O3 films can be prepared by the chemical exchange between trimethylaluminum (Al(CH3)3) and H2O:[27]
- 2 Al(CH3)3 + 3 H2O → Al2O3 + 6 CH4
H2O in the above reaction can be replaced by ozone (O3) as the active oxidant and the following reaction then takes place:[28][29]
- 2 Al(CH3)3 + O3 → Al2O3 + 3 C2H6
The Al2O3 films prepared using O3 show 10–100 times lower leakage current density compared with those prepared by H2O.
Aluminium oxide, being a dielectric with relatively large band gap, is used as an insulating barrier in capacitors.[30]
Other[edit]
In lighting, translucent aluminium oxide is used in some sodium vapor lamps.[31] Aluminium oxide is also used in preparation of coating suspensions in compact fluorescent lamps.
In chemistry laboratories, aluminium oxide is a medium for chromatography, available in basic (pH 9.5), acidic (pH 4.5 when in water) and neutral formulations.
Health and medical applications include it as a material in hip replacements[7] and birth control pills.[32]
It is used as a scintillator[33]
and dosimeter for radiation protection and therapy applications for its optically stimulated luminescence properties.[citation needed]
Insulation for high-temperature furnaces is often manufactured from aluminium oxide. Sometimes the insulation has varying percentages of silica depending on the temperature rating of the material. The insulation can be made in blanket, board, brick and loose fiber forms for various application requirements.
Small pieces of aluminium oxide are often used as boiling chips in chemistry.
It is also used to make spark plug insulators.[34]
Using a plasma spray process and mixed with titania, it is coated onto the braking surface of some bicycle rims to provide abrasion and wear resistance.[citation needed]
Most ceramic eyes on fishing rods are circular rings made from aluminium oxide.[citation needed]
In its finest powdered (white) form, called Diamantine, aluminium oxide is used as a superior polishing abrasive in watchmaking and clockmaking.[35]
Aluminium oxide is also used in the coating of stanchions in the motorcross and mountainbike industry.
This coating is combined with molybdenumdisulfate to provide long term lubrication of the surface.[36]
See also[edit]
- Aluminium oxide nanoparticle
- Bauxite tailings
- Beta-alumina solid electrolyte, a fast ion conductor
- Charged Aerosol Release Experiment (CARE)
- List of alumina refineries
- Micro-Pulling-Down
- Transparent alumina
References[edit]
- ^ «Aluminum oxide_msds».
- ^ a b Material Properties Data: Alumina (Aluminum Oxide) Archived 2010-04-01 at the Wayback Machine. Makeitfrom.com. Retrieved on 2013-04-17.
- ^ Patnaik, P. (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 978-0-07-049439-8.
- ^ Raymond C. Rowe; Paul J. Sheskey; Marian E. Quinn (2009). «Adipic acid». Handbook of Pharmaceutical Excipients. Pharmaceutical Press. pp. 11–12. ISBN 978-0-85369-792-3.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ISBN 978-0-618-94690-7.
- ^ a b NIOSH Pocket Guide to Chemical Hazards. «#0021». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d e «Alumina (Aluminium Oxide) – The Different Types of Commercially Available Grades». The A to Z of Materials. 3 May 2002. Archived from the original on 10 October 2007. Retrieved 27 October 2007.
- ^ Elam, J. W. (October 2010). Atomic Layer Deposition Applications 6. The Electrochemical Society. ISBN 9781566778213.
- ^ «Deltalumite».
- ^ «List of Minerals». 21 March 2011.
- ^ Campbell, Timothy; Kalia, Rajiv; Nakano, Aiichiro; Vashishta, Priya; Ogata, Shuji; Rodgers, Stephen (1999). «Dynamics of Oxidation of Aluminium Nanoclusters using Variable Charge Molecular-Dynamics Simulations on Parallel Computers» (PDF). Physical Review Letters. 82 (24): 4866. Bibcode:1999PhRvL..82.4866C. doi:10.1103/PhysRevLett.82.4866. Archived (PDF) from the original on 2010-07-01.
- ^ «EPCRA Section 313 Chemical List For Reporting Year 2006» (PDF). US EPA. Archived from the original (PDF) on 2008-05-22. Retrieved 2008-09-30.
- ^ a b I. Levin; D. Brandon (1999). «Metastable Alumina Polymorphs: Crystal Structures and Transition Sequences». Journal of the American Ceramic Society. 81 (8): 1995–2012. doi:10.1111/j.1151-2916.1998.tb02581.x.
- ^ a b c Paglia, G. (2004). «Determination of the Structure of γ-Alumina using Empirical and First Principles Calculations Combined with Supporting Experiments» (free download). Curtin University of Technology, Perth. Retrieved 2009-05-05.
- ^ Wiberg, E.; Holleman, A. F. (2001). Inorganic Chemistry. Elsevier. ISBN 978-0-12-352651-9.
- ^ a b Skinner, L.B.; et al. (2013). «Joint diffraction and modeling approach to the structure of liquid alumina». Phys. Rev. B. 87 (2): 024201. Bibcode:2013PhRvB..87b4201S. doi:10.1103/PhysRevB.87.024201.
- ^ Paradis, P.-F.; et al. (2004). «Non-Contact Thermophysical Property Measurements of Liquid and Undercooled Alumina». Jpn. J. Appl. Phys. 43 (4): 1496–1500. Bibcode:2004JaJAP..43.1496P. doi:10.1143/JJAP.43.1496. S2CID 250779901.
- ^ Shi, C; Alderman, O L G; Berman, D; Du, J; Neuefeind, J; Tamalonis, A; Weber, R; You, J; Benmore, C J (2019). «The structure of amorphous and deeply supercooled liquid alumina». Frontiers in Materials. 6 (38): 38. Bibcode:2019FrMat…6…38S. doi:10.3389/fmats.2019.00038.
- ^ «Bauxite and Alumina Statistics and Information». USGS. Archived from the original on 6 May 2009. Retrieved 2009-05-05.
- ^ «Aloxite». ChemIndustry.com database. Archived from the original on 25 June 2007. Retrieved 24 February 2007.
- ^ Evans, K. A. (1993). «Properties and uses of aluminium oxides and aluminium hydroxides». In Downs, A. J. (ed.). The Chemistry of Aluminium, Indium and Gallium. Blackie Academic. ISBN 978-0751401035.
- ^ Akers, Michael J. (2016-04-19). Sterile Drug Products: Formulation, Packaging, Manufacturing and Quality. CRC Press. ISBN 9781420020564.
- ^ Hudson, L. Keith; Misra, Chanakya; Perrotta, Anthony J.; Wefers, Karl and Williams, F. S. (2002) «Aluminum Oxide» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a01_557.
- ^ Mallick, P.K. (2008). Fiber-reinforced composites materials, manufacturing, and design (3rd ed., [expanded and rev. ed.] ed.). Boca Raton, FL: CRC Press. pp. Ch.2.1.7. ISBN 978-0-8493-4205-9.
- ^ «Ballistic Resistance of Body Armor» (PDF). US Department of Justice. NIJ. Retrieved 31 August 2018.
- ^ Osborn, Joseph H. (2014). «understanding and specifying anodizing: what a manufacturer needs to know». OMW Corporation. Archived from the original on 2016-11-20. Retrieved 2018-06-02.
- ^ Higashi GS, Fleming (1989). «Sequential surface chemical reaction limited growth of high quality Al2O3 dielectrics». Appl. Phys. Lett. 55 (19): 1963–65. Bibcode:1989ApPhL..55.1963H. doi:10.1063/1.102337.
- ^ Kim JB; Kwon DR; Chakrabarti K; Lee Chongmu; Oh KY; Lee JH (2002). «Improvement in Al2O3 dielectric behavior by using ozone as an oxidant for the atomic layer deposition technique». J. Appl. Phys. 92 (11): 6739–42. Bibcode:2002JAP….92.6739K. doi:10.1063/1.1515951.
- ^ Kim, Jaebum; Chakrabarti, Kuntal; Lee, Jinho; Oh, Ki-Young; Lee, Chongmu (2003). «Effects of ozone as an oxygen source on the properties of the Al2O3 thin films prepared by atomic layer deposition». Mater Chem Phys. 78 (3): 733–38. doi:10.1016/S0254-0584(02)00375-9.
- ^ Belkin, A.; Bezryadin, A.; Hendren, L.; Hubler, A. (20 April 2017). «Recovery of Alumina Nanocapacitors after High Voltage Breakdown». Scientific Reports. 7 (1): 932. Bibcode:2017NatSR…7..932B. doi:10.1038/s41598-017-01007-9. PMC 5430567. PMID 28428625.
- ^ «GE Innovation Timeline 1957–1970». Archived from the original on 16 February 2009. Retrieved 2009-01-12.
- ^ «DailyMed — JUNEL FE 1/20- norethindrone acetate and ethinyl estradiol, and ferrous fumarate». dailymed.nlm.nih.gov. Archived from the original on 2017-03-13. Retrieved 2017-03-13.
- ^ V.B. Mikhailik, H. Kraus (2005). «Low-temperature spectroscopic and scintillation characterisation of Ti-doped Al2O3«. Nucl. Instr. Phys. Res. A. 546 (3): 523–534. Bibcode:2005NIMPA.546..523M. doi:10.1016/j.nima.2005.02.033.
- ^ Farndon, John (2001). Aluminum. Marshall Cavendish. p. 19. ISBN 9780761409472.
Aluminum oxide is also used to make spark plug insulators.
- ^ de Carle, Donald (1969). Practical Watch Repair. N.A.G. Press Ltd. p. 164. ISBN 0719800307.
- ^ «Kashima Coat — Products / Services | Next-generation anodize boasting light weight, high lubrication, and superb wear resistance. The answer is Miyaki’s Kashima Coat».
External links[edit]
- CDC — NIOSH Pocket Guide to Chemical Hazards
Оксид алюминия
Способы получения
Оксид алюминия можно получить различными методами:
1. Горением алюминия на воздухе:
4Al + 3O2 → 2Al2O3
2. Разложением гидроксида алюминия при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
3. Оксид алюминия можно получить разложением нитрата алюминия:
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
Химические свойства
Оксид алюминия — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например, оксид алюминия взаимодействует с оксидом натрия:
Na2O + Al2O3 → 2NaAlO2
2. Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом оксид алюминия проявляет кислотные свойства.
Например, оксид алюминия взаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды:
2NaOH + Al2O3 → 2NaAlO2 + H2O
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например, оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
Al2O3 + 3SO3 → Al2(SO4)3
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например, оксид алюминия реагирует с серной кислотой:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
6. Оксид алюминия проявляет слабые окислительные свойства.
Например, оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Al2O3 + 3CaH2 → 3CaO + 2Al + 3H2
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
2Al2O3 → 4Al + 3O2
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Как правило, в качестве сырья для получения оксида алюминия служат бокситы, алуниты, а также нефелины. При содержании в них оксида алюминия более 6−7% производство ведется основным способом — методом Байера, а при меньшем содержании вещества используют метод спекания руды с известью или содой.
Метод Байера — это гидрохимический способ получения глинозема из бокситов. Он представляет собой обработку измельченной породы в шаровых мельницах, затем бокситы обрабатывают щелочными растворами при температуре 225−250°С. Полученный таким образом состав алюмината натрия разбавляют водным раствором и фильтруют.
В процессе фильтрации шлам, содержащий оксид алюминия, свойства которого соответствуют стандартным, подвергают разложению на центрифугах. Выделяется около ½ образовавшегося при этом Аl (ОН)3. Его отфильтровывают и прокаливают во вращающихся печах или в кипящем слое при температуре ~ 1200 °C. В результате получается глинозем, содержащий 15−60% α-Аl2О3. Применение данного метода позволяет сохранить маточный раствор для использования в последующих операциях по выщелачиванию бокситов.
Метод спекания руды с известью или содой работает следующим образом: высококремнистую измельченную руду (нефелин и др.) смешивают с содой и известняком и спекают во вращающихся печах при 1250−1300 °С. Полученную массу выщелачивают водным щелочным раствором. Раствор алюмината Na отделяют от шлама, затем освобождают от SiO2, осаждая его в автоклаве при давлении около 0,6 Мпа, а затем известью при атмосферном давлении и разлагают алюминат газообразным СО2. Полученный Аl (ОН)3 отделяют от раствора и прокаливают при температуре около 1200 °C. При переработке нефелина, помимо глинозема, получают Na2CO3, K2CO3 и цемент.
При производстве глинозема из алунитов одновременно получают H2SO4 и K2SO4. Алунитовую руду обжигают при 500−580°С в восстановительной атмосфере и обрабатывают раствором NaOH по способу Байера.
Для производства высокопрочной корундовой керамики применяют порошок оксида алюминия, полученный термическим разложением некоторых солей алюминия, например, азотнокислого, алюмоаммиачных квасцов различной степени чистоты. Оксид алюминия, полученный при разложении солей, является высокодисперсным порошком γ-Al2O3 (при прокаливании до 1200°С) и обладает большой химической активностью.
Для получения ультра- и нанодисперсных порошков Аl2O3, которые используются в технологии конструкционной и инструментальной керамики, широкое распространение получил способ совместного осаждения гидроксидов (СОГ) и плазмохимического синтеза (ПХС).
Сущность метода СОГ заключается в растворении солей алюминия, например, AlCl3 в растворе аммиака и последующем выпадении образующихся гидратов в осадок. Процесс ведут при низких температурах и больших сроках выдержки. Полученные гидроксиды сушат и прокаливают, в результате образуется порошок Аl2O3 с размером частиц 10−100 нм.
В технологии ПХС водный раствор Al (NO3)3 подается в сопло плазмотрона. В каплях раствора возникают чрезвычайно высокие температурные градиенты, происходит очень быстрый процесс синтеза и кристаллизации Аl2O3. Частицы порошка имеют сферическую форму и размер 0,1−1 мкм.
| Оксид алюминия | |
 |
|
| Общие | |
|---|---|
| Сокращения | Корунд |
| Химическая формула | Al2O3 |
| Физические свойства | |
| Состояние (ст. усл.) | кристаллическое |
| Молярная масса | 101.96 г/моль |
| Плотность | 3,99 г/см³ |
| Термические свойства | |
| Температура плавления | 2044 °C |
| Температура кипения | 2980[1] °C |
| Энтальпия образования (ст. усл.) | −1675.7 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1344-28-1 |
Оксид алюминия Al2O3 — в природе распространён как глинозём, нестехиометрическая смесь оксидов алюминия, калия, натрия, магния и т. д.
Свойства
Бесцветные нерастворимые в воде кристаллы.
- химические свойства — амфотерный оксид. Практически не растворим в кислотах. Растворяется в горячих растворах и расплавах щелочей.
- tпл 2044 °C.
- Является полупроводником n-типа, но несмотря на это используется в качестве диэлектриков в алюминиевых электролитических конденсаторах.
- Диэлектрическая проницаемость 9,5 — 10.
- Электрическая прочность 10 кВ/мм.
| Модификация | Плотность, г/см3 |
|---|---|
| α-Al2O3 | 3.99[2] |
| θ-Al2O3 | 3.61[3] |
| γ-Al2O3 | 3.68[4] |
| κ-Al2O3 | 3.77[5] |
Получение
Получают из бокситов, нефелинов, каолина, алунитов алюминатным или хлоридным методом. Сырьё в производстве алюминия, катализатор, адсорбент, огнеупорный и абразивный материал.
Чистый оксид алюминия может находиться в нескольких кристаллических формах: α-Al2O3 (корунд), γ-Al2O3, δ-Al2O3, θ-Al2O3, χ-Al2O3 и др.
Применение
Средние цены на глинозем металлургического сорта в 2009 году — $178/тонна[2] Оксид алюминия (α-Al2O3), как минерал, называется корунд. Крупные прозрачные кристаллы корунда используются как драгоценные камни. Из-за примесей корунд бывает окрашен в разные цвета: красный корунд называется рубином, синий, традиционно — сапфиром. Согласно принятым в ювелирном деле правилам, сапфиром называют кристаллический α-оксид алюминия любой окраски, кроме красной. В настоящее время кристаллы ювелирного корунда выращивают искусственно, но природные камни всё равно ценятся выше, хотя по виду не отличаются. Также корунд применяется как огнеупорный материал. Остальные кристаллические формы используются, как правило, в качестве катализаторов, адсорбентов, инертных наполнителей в физических исследованиях и химической промышленности.
Так называемый β-оксид алюминия в действительности представляет собой смешанный оксид алюминия и натрия. Он и соединения с его структурой вызывают большой научный интерес в качестве металлопроводящего твёрдого электролита.
γ-модификации оксида алюминия применяются в качестве носителя катализаторов, сырья для производства смешанных катализаторов, осушителя в различных процессах химических, нефтехимических производств (ГОСТ 8136-85).
Литература
- Pillet, S.; Souhassou, M.; Lecomte, C.; Schwarz, K. и др. Acta Crystallograica A (39, 1983-) (2001), 57, 209—303
- Husson, E.; Repelin, Y. Europen Journal of Solid State Inogranic Chemistry
- Gutierrez, M.; Taga, A.; Johansson, B. Physical Review, Serie 3. B — Condensed Matter (18, 1978-) (2001), 65, 0121011-0121014
- Smrcok, L.; Langer, V.; Halvarsson, M. Ruppi, S. Zeitschrift fuer Kristallographie (149, 1979-) (2001), 216, 409—412
См. также
- Алунд
- Электрокорунд
- Боксит
- Корунд
Ссылки
- Получение и переработка глинозема
- Получение наноразмерного оксида алюминия
Примечания
- ↑ Mallinckrodt Baker, MSDS Aluminum Oxide: Material Safety Data Sheet (A28440). Архивировано из первоисточника 22 августа 2011.
- ↑ по материалам mineral.ru
| Оксид алюминия | |
|---|---|
 |
|
| Хим. формула | Al2O3 |
| Состояние | кристаллическое |
| Молярная масса | 101,96 г/моль |
| Плотность | 3,99 г/см³ |
| Т. плав. | 2044 °C |
| Т. кип. | 2980 °C |
| Энтальпия образования | −1675,7 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| ГОСТ | ГОСТ 8136-85 |
| Рег. номер CAS | 1344-28-1 |
| PubChem | 9989226 |
| Рег. номер EINECS | 215-691-6 |
| SMILES |
[O-2].[O-2].[O-2].[Al+3].[Al+3] |
| InChI |
1S/2Al.3O/q2*+3;3*-2 PNEYBMLMFCGWSK-UHFFFAOYSA-N |
| RTECS | BD1200000 |
| ChEBI | 30187 |
| ChemSpider | 8164808 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Оксид алюминия Al2O3 — бинарное соединение алюминия и кислорода. В природе распространён как основная составляющая часть глинозёма, нестехиометрической смеси оксидов алюминия, калия, натрия, магния и т. д. В модификации корунд имеет атомную кристаллическую решётку.
Содержание
- 1 Свойства
- 1.1 Плотность
- 1.2 Основные модификации оксида алюминия
- 2 Получение
- 3 Применение
Свойства
Бесцветные нерастворимые в воде кристаллы. Амфотерный оксид. Практически не растворим в кислотах. Растворяется в горячих растворах и расплавах щелочей. Является диэлектриком, но некоторые исследователи считают его полупроводником n-типа. Диэлектрическая проницаемость 9,5—10. Электрическая прочность 10 кВ/мм.
Плотность
| Модификация | Плотность, г/см3 |
|---|---|
| α-Al2O3 | 3,99 |
| θ-Al2O3 | 3,61 |
| γ-Al2O3 | 3,68 |
| κ-Al2O3 | 3,77 |
Основные модификации оксида алюминия
В природе можно встретить только тригональную α-модификацию оксида алюминия в виде минерала корунда и его редких драгоценных разновидностей (рубин, сапфир и т. д.). Она является единственной термодинамически стабильной формой Al2O3. При термообработке гидроксидов алюминия около 400 °С получают кубическую γ-форму. При 1100—1200 °С с γ-модификацией происходит необратимое превращение в α-Al2O3, однако скорость этого процесса невелика, и для завершения фазового перехода необходимо либо наличие минерализаторов, либо повышение температуры обработки до 1400—1450 °С.
Известны также следующие кристаллические модификации оксида алюминия: кубическая η-фаза, моноклинная θ-фаза, гексагональная χ-фаза, орторомбическая κ-фаза. Спорным остаётся существование δ-фазы, которая может быть тетрагональной или орторомбической.
Вещество, иногда описываемое как β-Al2O3, на самом деле представляет собой не чистый оксид алюминия, а ряд алюминатов щелочных и щёлочноземельных металлов со следующими общими формулами: MeO·6Al2O3 и Me2O·11Al2O3, где MeO — это оксиды кальция, бария, стронция и т. д., а ME2O — оксиды натрия, калия, лития и других щелочных металлов. При 1600—1700 °С β-модификация разлагается на α-Al2O3 и оксид соответствующего металла, который выделяется в виде пара.
Получение
Получают из бокситов, нефелинов, каолина, алунитов алюминатным или хлоридным методом. Сырьё в производстве алюминия, катализатор, адсорбент, огнеупорный и абразивный материал.
- 3Cu2O + 2Al →1000∘C 6Cu + Al2O3
- 2Al(OH)3 →t Al2O3 + 3H2O
Плёнки оксида алюминия на поверхности алюминия получают электрохимическими или химическими методами. Так, например, получают диэлектрический слой в алюминиевых электролитических конденсаторах. В микроэлектронике также применяется эпитаксия оксида алюминия, которая многими учёными считается перспективной, например, в изоляции затворов полевых транзисторов.
Применение
Оксид алюминия (Al2O3), как минерал, называется корунд. Крупные прозрачные кристаллы корунда используются как драгоценные камни. Из-за примесей корунд бывает окрашен в разные цвета: красный корунд (содержащий примеси хрома) называется рубином, синий, традиционно — сапфиром. Согласно принятым в ювелирном деле правилам, сапфиром называют кристаллический α-оксид алюминия любой окраски, кроме красной. В настоящее время кристаллы ювелирного корунда выращивают искусственно, но природные камни всё равно ценятся выше, хотя по виду не отличаются. Также корунд применяется как огнеупорный материал. Остальные кристаллические формы используются, как правило, в качестве катализаторов, адсорбентов, инертных наполнителей в физических исследованиях и химической промышленности.
Керамика на основе оксида алюминия обладает высокой твёрдостью, огнеупорностью и антифрикционными свойствами, а также является хорошим изолятором. Она используется в горелках газоразрядных ламп, подложек интегральных схем, в запорных элементах керамических трубопроводных кранов, в зубных протезах и т. д.
Так называемый β-оксид алюминия в действительности представляет собой смешанный оксид алюминия и натрия. Он и соединения с его структурой вызывают большой научный интерес в качестве металлопроводящего твёрдого электролита.
γ-Модификации оксида алюминия применяются в качестве носителя катализаторов, сырья для производства смешанных катализаторов, осушителя в различных процессах химических, нефтехимических производств (ГОСТ 8136-85).
| Оксид алюминия | |
|---|---|
— |
|
| Общие | |
| Хим. формула | Al2O3 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 101,96 г/моль |
| Плотность | 3,99 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 2044 °C |
| • кипения | 2980[1] °C |
| Энтальпия | |
| • образования | −1675,7 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1344-28-1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Окси́д алюми́ния Al2O3 — белое тугоплавкое вещество, бинарное соединение алюминия и кислорода. В природе распространён в виде глинозёма, составляющая часть глин[2], нестехиометрической смеси оксидов алюминия, калия, натрия, магния и т. д. В модификации корунда имеет атомную кристаллическую решётку.
Свойства
Бесцветные нерастворимые в воде кристаллы. Амфотерный оксид. Практически не растворим в кислотах. Растворяется в горячих растворах и расплавах щелочей. Является диэлектриком[3][4][5], но некоторые[6][7] исследователи считают его полупроводником n-типа. Диэлектрическая проницаемость 9,5—10. Электрическая прочность 10 кВ/мм.
Химическая активность зависит от условий получения.
Плотность
| Модификация | Плотность, г/см3 |
|---|---|
| α-Al2O3 | 3,99[2] |
| θ-Al2O3 | 3,61[3] |
| γ-Al2O3 | 3,68[4] |
| κ-Al2O3 | 3,77[5] |
Основные модификации оксида алюминия
В природе можно встретить только тригональную α-модификацию оксида алюминия в виде минерала корунда и его редких драгоценных разновидностей (рубин, сапфир и т. д.). Она является единственной термодинамически стабильной формой Al2O3. При термообработке гидроксидов алюминия около 400 °С получают кубическую γ-форму. При 1100—1200 °С с γ-модификацией происходит необратимое превращение в α-Al2O3, однако скорость этого процесса невелика, и для завершения фазового перехода необходимо либо наличие минерализаторов, либо повышение температуры обработки до 1400—1450 °С[8].
Известны также следующие кристаллические модификации оксида алюминия: кубическая η-фаза, моноклинная θ-фаза, гексагональная χ-фаза, орторомбическая κ-фаза. Спорным остаётся существование δ-фазы, которая может быть тетрагональной или орторомбической[8][9].
Вещество, иногда описываемое как β-Al2O3, на самом деле представляет собой не чистый оксид алюминия, а ряд алюминатов щелочных и щёлочноземельных металлов со следующими общими формулами: MeO·6Al2O3 и Me2O·11Al2O3, где МеО — это оксиды кальция, бария, стронция и т. д., а Ме2О — оксиды натрия, калия, лития и других щелочных металлов. При 1600—1700 °С β-модификация разлагается на α-Al2O3 и оксид соответствующего металла, который выделяется в виде пара.
Получение
Получают из бокситов, нефелинов, каолина, алунитов алюминатным или хлоридным методом. Сырьё в производстве алюминия, катализатор, адсорбент, огнеупорный и абразивный материал.
- [math]displaystyle{ mathsf{3Cu_2O + 2Al xrightarrow{1000 ^circ C} 6Cu + Al_2O_3} }[/math]
- [math]ce{ 2Al(OH)3 ->[{t}] Al2O3 + 3H2O }[/math]
Плёнки оксида алюминия на поверхности алюминия получают электрохимическими или химическими методами. Так, например, получают диэлектрический слой в алюминиевых электролитических конденсаторах. В микроэлектронике также применяется эпитаксия оксида алюминия, которая многими учёными считается перспективной, например, в изоляции затворов полевых транзисторов[4][5].
Применение
Оксид алюминия (Al2O3), как минерал, называется корунд. Крупные прозрачные кристаллы корунда используются как драгоценные камни. Из-за примесей корунд бывает окрашен в разные цвета: красный корунд (содержащий примеси хрома) называется рубином, синий, традиционно — сапфиром. Согласно принятым в ювелирном деле правилам, сапфиром называют кристаллический α-оксид алюминия любой окраски, кроме красной. В настоящее время кристаллы ювелирного корунда выращивают искусственно, но природные камни всё равно ценятся выше, хотя по виду не отличаются. Также корунд применяется как огнеупорный материал. Остальные кристаллические формы используются, как правило, в качестве катализаторов, адсорбентов, инертных наполнителей в физических исследованиях и химической промышленности.
Керамика на основе оксида алюминия обладает высокой твёрдостью, огнеупорностью и антифрикционными свойствами, а также является хорошим изолятором. Она используется в горелках газоразрядных ламп, подложек интегральных схем, в запорных элементах керамических трубопроводных кранов, в зубных протезах и т. д.
Так называемый β-оксид алюминия в действительности представляет собой смешанный оксид алюминия и натрия. Он и соединения с его структурой вызывают большой научный интерес в качестве металлопроводящего твёрдого электролита.
γ-Модификации оксида алюминия применяются в качестве носителя катализаторов, сырья для производства смешанных катализаторов, осушителя в различных процессах химических, нефтехимических производств (ГОСТ 8136-85).
Оксид алюминия используется для получения алюминия в промышленности.
Оксидная плёнка
Алюминий, являясь химически активным металлом, моментально образует при соприкосновении с кислородом воздуха на поверхности изделий из него тончайшую защитную оксидную плёнку Al2O3.
- Защита от окисления и коррозии
- В электротехнике
См. также
- Электрокорунд (Алунд)
- Алюминоз[en] — пневмокониоз возникающий от вдыхания пыли металлического алюминия или оксида алюминия[10][11][12][13][14]
Примечания
- ↑ Mallinckrodt Baker, MSDS Aluminum Oxide: Material Safety Data Sheet (A28440). Дата обращения: 8 октября 2008. Архивировано 21 августа 2011 года.
- ↑ Алюминия окись // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ Архивированная копия. Дата обращения: 29 июля 2018. Архивировано 17 июля 2018 года.
- ↑ 4,0 4,1 Higashi G. S., Fleming C. G. Sequential surface chemical reaction limited growth of high quality Al2O3dielectrics (англ.) // Applied Physics Letters. — 1989. — 6 November (vol. 55, no. 19). — P. 1963—1965. — ISSN 0003-6951. — doi:10.1063/1.102337. [исправить]
- ↑ 5,0 5,1 Архивированная копия. Дата обращения: 29 июля 2018. Архивировано 6 января 2022 года.
- ↑ Полупроводниковые Свойства Плёнок Пористого Оксида Алюминия. Дата обращения: 29 июля 2018. Архивировано 29 июля 2018 года.
- ↑ Полупроводниковое стекло — Стекло Полупроводник Алюминий. Дата обращения: 29 июля 2018. Архивировано 29 июля 2018 года.
- ↑ 8,0 8,1 Paglia, G. Determination of the Structure of γ-Alumina using Empirical and First Principles Calculations Combined with Supporting Experiments (PhD Thesis) (англ.). — Curtin University of Technology, Perth, 2004.
- ↑ I. Levin and D. Brandon. Metastable Alumina Polymorphs: Crystal Structures and Transition Sequnces (англ.) // Journal of the American Ceramic Society (англ.) (рус. : journal. — 1998. — Vol. 81, no. 8. — P. 1995—2012. — doi:10.1111/j.1151-2916.1998.tb02581.x.
- ↑ Алюминоз // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1974. — Т. 1 : А — Антибиоз. — 576 с. : ил.
- ↑ Алюминоз // Большая советская энциклопедия : в 66 т. (65 т. и 1 доп.) / гл. ред. О. Ю. Шмидт. — М. : Советская энциклопедия, 1926—1947.
- ↑ Гринберг Л. М., Валамина И. Е., Мещерякова Е. Ю., Зубарев И. В., Шур В. Я., Рослая Н. А. Способ морфологической диагностики алюминоза (бокситового пневмокониоза) лёгкого с помощью поляризационной микроскопии Архивная копия от 3 февраля 2021 на Wayback Machine // Патент RU 2660589 C1 от 27.07.2017 г. ФГБОУ ВО УГМУ Минздрава России.
- ↑ Архангельский В. И., Мельниченко П. И. Лёгочный алюминоз, Астмоидный алюминоз / Гигиена. Compendium // М.: ГЭОТАР-Медиа, 2012. — 392 с., ил. ISBN 978-5-9704-2042-3. С. 341.
- ↑ «Архив патологий» // Журнал, том 48, выпуск 1, Всесоюзное научное общество патологоанатомов // М.: Медицина, 1986 г.
Литература
- Pillet, S.; Souhassou, M.; Lecomte, C.; Schwarz, K. и др. Acta Crystallograica A (39, 1983-) (2001), 57, 209—303
- Husson, E.; Repelin, Y. Europen Journal of Solid State Inogranic Chemistry
- Gutierrez, M.; Taga, A.; Johansson, B. Physical Review, Serie 3. B — Condensed Matter (18, 1978-) (2001), 65, 0121011-0121014
- Smrcok, L.; Langer, V.; Halvarsson, M. Ruppi, S. Zeitschrift fuer Kristallographie (149, 1979-) (2001), 216, 409—412
Ссылки
- Получение и переработка глинозема Архивная копия от 8 сентября 2008 на Wayback Machine
- Получение наноразмерного оксида алюминия Архивная копия от 14 сентября 2014 на Wayback Machine
| п • о • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Оксид алюминия, свойства, получение, химические реакции.
Оксид алюминия – неорганическое вещество, имеет химическую формулу Al2O3.
Краткая характеристика оксида алюминия
Модификации оксида алюминия
Физические свойства оксида алюминия
Получение оксида алюминия
Химические свойства оксида алюминия
Химические реакции оксида алюминия
Применение и использование оксида алюминия
Краткая характеристика оксида алюминия:
Оксид алюминия – неорганическое вещество, не имеющее цвета.
Оксид алюминия содержит три атома кислорода и два атома алюминия.
Химическая формула оксида алюминия Al2O3.
В природе встречается в виде глинозема и корунда.
В воде не растворяется.
Амфотерный оксид. Проявляет в зависимости от условий либо основные, либо кислотные свойства. Свои химические свойства проявляет будучи разогретым до высоких температур- порядка 1000 оС.
Модификации оксида алюминия:
Известны следующие кристаллические модификации оксида алюминия: α-Al2O3, θ-Al2O3, γ-Al2O3, κ-Al2O3, η-Al2O3, χ-Al2O3.
Модификации оксида алюминия имеют различные плотности:
α-Al2O3 – 3,99 г/см3,
θ-Al2O3 – 3,61 г/см3,
γ-Al2O3 – 3,68 г/см3,
κ-Al2O3 – 3,77 г/см3.
α-модификация оксида алюминия является единственной термодинамически стабильной формой Al2O3.
Физические свойства оксида алюминия*:
| Наименование параметра: | Значение: |
| Химическая формула | Al2O3 |
| Синонимы и названия на иностранном языке | aluminum oxide α-form (англ.)
corundum (англ.) алюминия окись α-форма (рус.) корунд (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные тригональные кристаллы |
| Цвет | из-за примесей оксид алюминия, как минерал, может быть окрашен в разные цвета |
| Вкус | —** |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3990 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,99 |
| Температура кипения, °C | 3530 |
| Температура плавления, °C | 2050 |
| Молярная масса, г/моль | 101,96 |
| Твердость по шкале Мооса | 9 |
Примечание:
* оксида алюминия α-формы.
** — нет данных.
Получение оксида алюминия:
Оксид алюминия получают методом восстановления алюминием металлов из их оксидов: хрома, молибдена, вольфрама, ванадия и др. (металлотермия).
Он получается в результате следующих металлотермических реакций:
Cr2O3 + 2Al → Al2O3 + 2Cr (t = 800 oC);
3CuO + 2Al → Al2O3 + 3Cu (t = 1000-1100 oC) и т.д.
Химические свойства оксида алюминия. Химические реакции оксида алюминия:
Оксид алюминия относится к амфотерным оксидам.
Химические свойства оксида алюминия аналогичны свойствам амфотерных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида алюминия с алюминием:
4Al + Al2O3 ⇄ Al2О (t = 1450 °C).
В результате реакции образуется оксид алюминия.
2. реакция оксида алюминия с углеродом:
2Al2O3 + 9С → 2Al4С3 + 6CО (t = 1800 °C).
В результате реакции образуется соль – карбид алюминия и оксид углерода.
3. реакция оксида алюминия, углерода и азота:
Al2O3 + 3С + N2 → 2AlN + 3CО (t = 1600-1800 °C).
В результате реакции образуется соль – нитрид алюминия и оксид углерода.
4. реакция оксида алюминия с оксидом натрия:
Na2О + Al2O3 → 2NaAlО2 (t = 2000 °C).
В результате реакции образуется соль – алюминат натрия.
5. реакция оксида алюминия с оксидом калия:
K2О + Al2O3 → 2KAlО2 (t = 1000 °C).
В результате реакции образуется соль – алюминат калия.
6. реакция оксида алюминия с оксидом магния:
MgО + Al2O3 → MgAl2О4 (t = 1600 °C).
В результате реакции образуется соль – алюминат магния (шпинель).
7. реакция оксида алюминия с оксидом кальция:
CaО + Al2O3 → Ca(AlО2)2 (t = 1200-1300 °C).
В результате реакции образуется соль – алюминат кальция.
8. реакция оксида алюминия с оксидом азота:
Al2O3 + 3N2О5 → 2Al(NO3)3 (t = 35-40 °C).
В результате реакции образуются соль – нитрат алюминия.
9. реакция оксида алюминия с оксидом кремния:
Al2O3 + SiО2 → Al2SiО5.
В результате реакции образуется соль – силикат алюминия. Реакция протекает при спекании реакционной смеси.
10. реакция оксида алюминия с гидроксидом натрия:
Al2O3 + 2NaOH → 2NaAlO2 + H2О (t = 900-1100 oC).
Сплавление оксида алюминия с сухим гидроксидом натрия. В результате реакции образуется соль – алюминат натрия и вода.
11. реакция оксида алюминия с гидроксидом калия:
Al2O3 + 2KOH → 2KAlO2 + H2О (t = 900-1100 oC).
Сплавление оксида алюминия с сухим гидроксидом калия. В результате реакции образуется соль – алюминат калия и вода.
12. реакция оксида алюминия с карбонатом натрия:
Al2O3 + Na2СO3 → 2NaAlO2 + СО2 (t = 1000-1200 oC).
В результате реакции образуется соль – алюминат натрия и оксид углерода.
13. реакция оксида алюминия с плавиковой кислотой:
Al2O3 + 6HF → 2AlF3 + 3H2O (t = 450-600 oC).
В результате химической реакции получается соль – фторид алюминия и вода.
14. реакция оксида алюминия с азотной кислотой:
Al2O3 + 6HNO3 → 2Al(NO3)2 + 3H2O.
В результате химической реакции получается соль – нитрат алюминия и вода.
Аналогично проходят реакции оксида алюминия и с другими кислотами.
15. реакция оксида алюминия с бромистым водородом (бромоводородом):
Al2O3 + 6HBr → 2AlBr3 + 3H2O.
В результате химической реакции получается соль – бромид алюминия и вода.
16. реакция оксида алюминия с йодоводородом:
Al2O3 + 6HI → 2AlI3 + 3H2O.
В результате химической реакции получается соль – йодид алюминия и вода.
17. реакция оксида алюминия с аммиаком:
Al2O3 + 2NH3 → 2AlN + 3H2O (t = 1000 oC).
В результате химической реакции получается соль – нитрид алюминия и вода.
18. реакция электролиза оксида алюминия:
2Al2O3 → 4Al + 3О2 (t = 900 oC).
Электролиз проводят в расплаве. В результате химической реакции получается алюминий и кислород.
Применение и использование оксида алюминия:
Оксид алюминия используется для производства алюминия, в виде порошка – для огнеупорных, химически стойких и абразивных материалов, в виде кристаллов – для изготовления лазеров и синтетических драгоценных камней (рубины, сапфиры и др.), окрашенных примесями оксидов других металлов.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид алюминия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида алюминия
реакции с оксидом алюминия
Коэффициент востребованности
15 351
| Оксид алюминия | |
|---|---|
 |
|
| Общие | |
| Хим. формула (b) | Al2O3 |
| Физические свойства | |
| Состояние (b) | кристаллическое (b) |
| Молярная масса (b) | 101,96 г/моль (b) |
| Плотность (b) | 3,99 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления (b) | 2044 °C |
| • кипения (b) | 2980[1] °C |
| Энтальпия | |
| • образования | −1675,7 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[2] |
| Классификация | |
| Рег. номер CAS (b) | 1344-28-1 |
| PubChem (b) | 9989226 |
| Рег. номер EINECS (b) | 215-691-6 |
| SMILES (b) |
[O-2].[O-2].[O-2].[Al+3].[Al+3] |
| InChI (b) |
InChI=1S/2Al.3O/q2*+3;3*-2 PNEYBMLMFCGWSK-UHFFFAOYSA-N |
| RTECS (b) | BD1200000 |
| ChEBI | 30187 |
| ChemSpider (b) | 8164808 |
| Безопасность | |
| NFPA 704 (b) |
 0 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д алюми́ния Al2O3 — белое тугоплавкое вещество, бинарное соединение алюминия (b) и кислорода (b) . В природе распространён в виде глинозёма, составляющая часть глин (b) [3], нестехиометрической смеси оксидов алюминия, калия (b) , натрия (b) , магния и т. д. В модификации корунда имеет атомную кристаллическую решётку.
Свойства
Бесцветные нерастворимые в воде кристаллы. Амфотерный оксид (b) . Практически не растворим в кислотах. Растворяется в горячих растворах и расплавах щелочей. Является диэлектриком (b) [4][5][6], но некоторые[7][8] исследователи считают его полупроводником n-типа (b) . Диэлектрическая проницаемость (b) 9,5—10. Электрическая прочность (b) 10 кВ/мм.
Химическая активность зависит от условий получения.
Плотность
| Модификация | Плотность, г/см3 |
|---|---|
| α-Al2O3 (b) | 3,99[2] |
| θ-Al2O3 | 3,61[3] |
| γ-Al2O3 | 3,68[4] |
| κ-Al2O3 | 3,77[5] |
Основные модификации оксида алюминия
В природе можно встретить только тригональную α-модификацию оксида алюминия в виде минерала корунда (b) и его редких драгоценных разновидностей (рубин (b) , сапфир (b) и т. д.). Она является единственной термодинамически стабильной формой Al2O3. При термообработке гидроксидов алюминия (b) около 400 °С получают кубическую γ-форму. При 1100—1200 °С с γ-модификацией происходит необратимое превращение в α-Al2O3, однако скорость этого процесса невелика, и для завершения фазового перехода необходимо либо наличие минерализаторов (b) , либо повышение температуры обработки до 1400—1450 °С[9].
Известны также следующие кристаллические модификации оксида алюминия: кубическая η-фаза, моноклинная θ-фаза, гексагональная χ-фаза, орторомбическая κ-фаза. Спорным остаётся существование δ-фазы, которая может быть тетрагональной или орторомбической[9][10].
Вещество, иногда описываемое как β-Al2O3, на самом деле представляет собой не чистый оксид алюминия, а ряд алюминатов щелочных и щёлочноземельных металлов со следующими общими формулами: MeO·6Al2O3 и Me2O·11Al2O3, где МеО — это оксиды кальция, бария, стронция и т. д., а Ме2О — оксиды натрия, калия, лития и других щелочных металлов. При 1600—1700 °С β-модификация разлагается на α-Al2O3 и оксид соответствующего металла, который выделяется в виде пара.
Получение
Получают из бокситов (b) , нефелинов (b) , каолина (b) , алунитов (b) алюминатным (b) или хлоридным методом. Сырьё в производстве алюминия (b) , катализатор (b) , адсорбент (b) , огнеупорный и абразивный (b) материал.
Плёнки оксида алюминия на поверхности алюминия получают электрохимическими или химическими методами. Так, например, получают диэлектрический слой в алюминиевых электролитических конденсаторах (b) . В микроэлектронике также применяется эпитаксия (b) оксида алюминия, которая многими учёными считается перспективной, например, в изоляции затворов полевых транзисторов[5][6].
Применение
Оксид алюминия (Al2O3), как минерал, называется корунд (b) . Крупные прозрачные кристаллы корунда используются как драгоценные камни. Из-за примесей корунд бывает окрашен в разные цвета: красный корунд (содержащий примеси хрома) называется рубином (b) , синий, традиционно — сапфиром (b) . Согласно принятым в ювелирном деле правилам, сапфиром называют кристаллический α-оксид алюминия любой окраски, кроме красной. В настоящее время кристаллы ювелирного корунда выращивают искусственно, но природные камни всё равно ценятся выше, хотя по виду не отличаются. Также корунд применяется как огнеупорный (b) материал. Остальные кристаллические формы используются, как правило, в качестве катализаторов (b) , адсорбентов (b) , инертных наполнителей в физических исследованиях и химической промышленности.
Керамика (b) на основе оксида алюминия обладает высокой твёрдостью, огнеупорностью и антифрикционными свойствами, а также является хорошим изолятором (b) . Она используется в горелках газоразрядных ламп (b) , подложек интегральных схем (b) , в запорных элементах керамических трубопроводных кранов (b) , в зубных протезах (b) и т. д.
Так называемый β-оксид алюминия в действительности представляет собой смешанный оксид алюминия и натрия (b) . Он и соединения с его структурой вызывают большой научный интерес в качестве металлопроводящего твёрдого электролита (b) .
γ-Модификации оксида алюминия применяются в качестве носителя катализаторов, сырья для производства смешанных катализаторов, осушителя в различных процессах химических, нефтехимических производств (ГОСТ 8136-85).
Оксид алюминия используется для получения алюминия (b) в промышленности.
Оксидная плёнка
Алюминий, являясь химически активным металлом, моментально образует при соприкосновении с кислородом воздуха на поверхности изделий из него тончайшую защитную оксидную плёнку (b) Al2O3.
- Защита от окисления и коррозии
|
|
Этот раздел статьи ещё не написан. Согласно замыслу одного или нескольких участников Википедии, на этом месте должен располагаться специальный раздел. |
- В электротехнике
|
|
Этот раздел статьи ещё не написан. Согласно замыслу одного или нескольких участников Википедии, на этом месте должен располагаться специальный раздел. |
См. также
- Электрокорунд (Алунд) (b)
- Алюминоз (b) [en] — пневмокониоз (b) возникающий от вдыхания пыли металлического алюминия или оксида алюминия[11][12][13][14][15]
Примечания
- ↑ Mallinckrodt Baker, MSDS Aluminum Oxide: Material Safety Data Sheet (A28440). Дата обращения: 8 октября 2008. Архивировано 21 августа 2011 года.
- ↑ http://www.cdc.gov/niosh/npg/npgd0021.html
- ↑ Алюминия окись // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров (b) . — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ Архивированная копия. Дата обращения: 29 июля 2018. Архивировано 17 июля 2018 года.
- 1 2 Higashi G. S., Fleming C. G. Sequential surface chemical reaction limited growth of high quality Al2O3dielectrics (англ.) // Applied Physics Letters. — 1989. — 6 November (vol. 55, no. 19). — P. 1963—1965. — ISSN (b) 0003-6951. — doi (b) :10.1063/1.102337. [исправить]
- 1 2 Архивированная копия. Дата обращения: 29 июля 2018. Архивировано 6 января 2022 года.
- ↑ Полупроводниковые Свойства Плёнок Пористого Оксида Алюминия. Дата обращения: 29 июля 2018. Архивировано 29 июля 2018 года.
- ↑ Полупроводниковое стекло — Стекло Полупроводник Алюминий. Дата обращения: 29 июля 2018. Архивировано 29 июля 2018 года.
- 1 2 Paglia, G. Determination of the Structure of γ-Alumina using Empirical and First Principles Calculations Combined with Supporting Experiments (PhD Thesis) (англ.). — Curtin University of Technology, Perth, 2004.
- ↑ I. Levin and D. Brandon. Metastable Alumina Polymorphs: Crystal Structures and Transition Sequnces (англ.) // Journal of the American Ceramic Society (англ.) (рус. (b) : journal. — 1998. — Vol. 81, no. 8. — P. 1995—2012. — doi (b) :10.1111/j.1151-2916.1998.tb02581.x.
- ↑ Алюминоз // Большая медицинская энциклопедия (b) : в 30 т. / гл. ред. Б. В. Петровский (b) . — 3-е изд. — М. : Советская энциклопедия (b) , 1974. — Т. 1 : А — Антибиоз. — 576 с. : ил.
- ↑ Алюминоз // Большая советская энциклопедия (b) : в 66 т. (65 т. и 1 доп.) / гл. ред. О. Ю. Шмидт (b) . — М. : Советская энциклопедия (b) , 1926—1947.
- ↑ Гринберг Л. М., Валамина И. Е., Мещерякова Е. Ю., Зубарев И. В., Шур В. Я., Рослая Н. А.Способ морфологической диагностики алюминоза (бокситового пневмокониоза) лёгкого с помощью поляризационной микроскопииАрхивная копия от 3 февраля 2021 на Wayback Machine (b) // Патент RU 2660589 C1 от 27.07.2017 г. ФГБОУ ВО УГМУ (b) Минздрава России.
- ↑ Архангельский В. И., Мельниченко П. И.Лёгочный алюминоз, Астмоидный алюминоз / Гигиена. Compendium // М.: ГЭОТАР-Медиа (b) , 2012. — 392 с., ил. ISBN 978-5-9704-2042-3. С. 341.
- ↑ «Архив патологий» // Журнал, том 48, выпуск 1, Всесоюзное научное общество патологоанатомов // М.: Медицина, 1986 г.
Литература
- Pillet, S.; Souhassou, M.; Lecomte, C.; Schwarz, K. и др. Acta Crystallograica A (39, 1983-) (2001), 57, 209—303
- Husson, E.; Repelin, Y. Europen Journal of Solid State Inogranic Chemistry
- Gutierrez, M.; Taga, A.; Johansson, B. Physical Review, Serie 3. B — Condensed Matter (18, 1978-) (2001), 65, 0121011-0121014
- Smrcok, L.; Langer, V.; Halvarsson, M. Ruppi, S. Zeitschrift fuer Kristallographie (149, 1979-) (2001), 216, 409—412
Ссылки
- Получение и переработка глиноземаАрхивная копия от 8 сентября 2008 на Wayback Machine (b)
- Получение наноразмерного оксида алюминияАрхивная копия от 14 сентября 2014 на Wayback Machine (b)
| п •о •рОксиды (b) | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O (b) | ||||||||||||||||
| Li2O (b) LiCoO2 (b) Li3PaO4 (b) Li5PuO6 (b) Ba2LiNpO6 (b) LiAlO2 (b) Li3NpO4 (b) Li2NpO4 (b) Li5NpO6 (b) LiNbO3 (b) |
BeO (b) | B2O3 (b) | С3О2 (b) C12O9 (b) CO (b) C12O12 (b) C4O6 (b) CO2 (b) |
N2O (b) NO (b) N2O3 (b) N4O6 (b) NO2 (b) N2O4 (b) N2O5 (b) |
O | F | ||||||||||
| Na2O (b) NaPaO3 (b) NaAlO2 (b) Na2PtO3 (b) |
MgO (b) | AlO (b) Al2O3 (b) NaAlO2 (b) LiAlO2 (b) AlO(OH) (b) |
SiO (b) SiO2 (b) |
P4O (b) P4O2 (b) P2O3 (b) P4O8 (b) P2O5 (b) |
S2O (b) SO (b) SO2 (b) SO3 (b) |
Cl2O (b) ClO2 (b) Cl2O6 (b) Cl2O7 (b) |
||||||||||
| K2O (b) K2PtO3 (b) KPaO3 (b) |
CaO (b) Ca3OSiO4 (b) CaTiO3 (b) |
Sc2O3 (b) | TiO (b) Ti2O3 (b) TiO2 (b) TiOSO4 (b) CaTiO3 (b) BaTiO3 (b) |
VO (b) V2O3 (b) V3O5 (b) VO2 (b) V2O5 (b) |
FeCr2O4 (b) CrO (b) Cr2O3 (b) CrO2 (b) CrO3 (b) MgCr2O4 (b) |
MnO (b) Mn3O4 (b) Mn2O3 (b) MnO(OH) (b) Mn5O8 (b) MnO2 (b) MnO3 (b) Mn2O7 (b) |
FeCr2O4 (b) FeO (b) Fe3O4 (b) Fe2O3 (b) |
CoFe2O4 (b) CoO (b) Co3O4 (b) CoO(OH) (b) Co2O3 (b) CoO2 (b) |
NiO (b) NiFe2O4 (b) Ni3O4 (b) NiO(OH) (b) Ni2O3 (b) |
Cu2O (b) CuO (b) CuFe2O4 (b) Cu2O3 (b) CuO2 (b) |
ZnO (b) | Ga2O (b) Ga2O3 (b) |
GeO (b) GeO2 (b) |
As2O3 (b) As2O4 (b) As2O5 (b) |
SeOCl2 (b) SeOBr2 (b) SeO2 (b) Se2O5 (b) SeO3 (b) |
Br2O (b) Br2O3 (b) BrO2 (b) |
| Rb2O (b) RbPaO3 (b) Rb4O6 (b) |
SrO (b) | Y2O3 (b) YOF (b) YOCl (b) |
ZrO(OH)2 (b) ZrO2 (b) ZrOS (b) Zr2О3Сl2 (b) |
NbO (b) Nb2O3 (b) NbO2 (b) Nb2O5 (b) Nb2O3(SO4)2 (b) LiNbO3 (b) |
Mo2O3 (b) Mo4O11 (b) MoO2 (b) Mo2O5 (b) MoO3 (b) |
TcO2 (b) Tc2O7 (b) |
Ru2O3 (b) RuO2 (b) Ru2O5 (b) RuO4 (b) |
RhO (b) Rh2O3 (b) RhO2 (b) |
PdO (b) Pd2O3 (b) PdO2 (b) |
Ag2O (b) Ag2O2 (b) |
Cd2O (b) CdO (b) |
In2O (b) InO (b) In2O3 (b) |
SnO (b) SnO2 (b) |
Sb2O3 (b) Sb2O4 (b) Hg2Sb2O7 (b) Sb2O5 (b) |
TeO2 (b) TeO3 (b) |
I2O4 (b) I4O9 (b) I2O5 (b) |
| Cs2O (b) Cs2ReCl5O (b) |
BaO (b) BaPaO3 (b) BaTiO3 (b) BaPtO3 (b) |
HfO(OH)2 (b) HfO2 (b) |
Ta2O (b) TaO (b) TaO2 (b) Ta2O5 (b) |
WO2Br2 (b) WO2 (b) WO2Cl2 (b) WOBr4 (b) WOF4 (b) WOCl4 (b) WO3 (b) |
Re2O (b) ReO (b) Re2O3 (b) ReO2 (b) Re2O5 (b) ReO3 (b) Re2O7 (b) |
OsO (b) Os2O3 (b) OsO2 (b) OsO4 (b) |
Ir2O3 (b) IrO2 (b) |
PtO (b) Pt3O4 (b) Pt2O3 (b) PtO2 (b) K2PtO3 (b) Na2PtO3 (b) PtO3 (b) |
Au2O (b) AuO (b) Au2O3 (b) |
Hg2O (b) HgO (b) (Hg3O2)SO4 (b) Hg2O(CN)2 (b) Hg2Sb2O7 (b) Hg3O2Cl2 (b) Hg5O4Cl2 (b) |
Tl2O (b) Tl2O3 (b) |
Pb2O (b) PbO (b) Pb3O4 (b) Pb2O3 (b) PbO2 (b) |
BiO (b) Bi2O3 (b) Bi2O4 (b) Bi2O5 (b) |
PoO (b) PoO2 (b) PoO3 (b) |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S (b) La2O3 (b) |
Ce2O3 (b) CeO2 (b) |
PrO (b) Pr2O2S (b) Pr2O3 (b) Pr6O11 (b) PrO2 (b) |
NdO (b) Nd2O2S (b) Nd2O3 (b) NdHO (b) |
Pm2O3 (b) | SmO (b) Sm2O3 (b) |
EuO (b) Eu3O4 (b) Eu2O3 (b) EuO(OH) (b) Eu2O2S (b) |
Gd2O3 (b) | Tb | Dy2O3 (b) | Ho2O3 (b) Ho2O2S (b) |
Er2O3 (b) | Tm2O3 (b) | YbO (b) Yb2O3 (b) |
Lu2O2S (b) Lu2O3 (b) LuO(OH) (b) |
||
| Ac2O3 (b) | UO2 (b) UO3 (b) U3O8 (b) |
PaO (b) PaO2 (b) Pa2O5 (b) PaOS (b) |
ThO2 (b) | NpO (b) NpO2 (b) Np2O5 (b) Np3O8 (b) NpO3 (b) |
PuO (b) Pu2O3 (b) PuO2 (b) PuO3 (b) PuO2F2 (b) |
AmO2 (b) | Cm2O3 (b) CmO2 (b) |
Bk2O3 (b) | Cf2O3 (b) | Es | Fm | Md | No | Lr |
Соединения алюминия (b) * |
|
|---|---|
| Интерметаллиды |
|
| Оксиды, гидроксиды |
|
| Соли |
|
| Алюминаты |
|
| Галогениды |
|
| Металлоорганические соединения |
|
| Соединения с неметаллами |
|
| Гидриды |
|
| Другие |
|









