
|
|
| Names | |
|---|---|
| Other names
Zinc white, calamine, philosopher’s wool, Chinese white, flowers of zinc |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.013.839 |
| EC Number |
|
|
Gmelin Reference |
13738 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 3077 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
ZnO |
| Molar mass | 81.406 g/mol[1] |
| Appearance | White solid[1] |
| Odor | Odorless |
| Density | 5.606 g/cm3[1] |
| Melting point | 1,974 °C (3,585 °F; 2,247 K) (decomposes)[1][5] |
| Boiling point | 2,360 °C (4,280 °F; 2,630 K) (decomposes) |
|
Solubility in water |
0.0004% (17.8°C)[2] |
| Band gap | 3.3 eV (direct) |
|
Magnetic susceptibility (χ) |
−27.2·10−6 cm3/mol[3] |
|
Refractive index (nD) |
n1=2.013, n2=2.029[4] |
| Structure[6] | |
|
Crystal structure |
Wurtzite |
|
Space group |
C6v4—P63mc |
|
Lattice constant |
a = 3.2495 Å, c = 5.2069 Å |
|
Formula units (Z) |
2 |
|
Coordination geometry |
Tetrahedral |
| Thermochemistry[7] | |
|
Heat capacity (C) |
40.3 J·K−1mol−1 |
|
Std molar |
43.7±0.4 J·K−1mol−1 |
|
Std enthalpy of |
-350.5±0.3 kJ mol−1 |
|
Gibbs free energy (ΔfG⦵) |
-320.5 kJ mol−1 |
| Pharmacology | |
|
ATCvet code |
QA07XA91 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H400, H401 |
|
Precautionary statements |
P273, P391, P501 |
| NFPA 704 (fire diamond) |
2 1 0 |
| Flash point | 1,436 °C (2,617 °F; 1,709 K) |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
240 mg/kg (intraperitoneal, rat)[8] 7950 mg/kg (rat, oral)[9] |
|
LC50 (median concentration) |
2500 mg/m3 (mouse)[9] |
|
LCLo (lowest published) |
2500 mg/m3 (guinea pig, 3–4 h)[9] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 5 mg/m3 (fume) TWA 15 mg/m3 (total dust) TWA 5 mg/m3 (resp dust)[2] |
|
REL (Recommended) |
Dust: TWA 5 mg/m3 C 15 mg/m3
Fume: TWA 5 mg/m3 ST 10 mg/m3[2] |
|
IDLH (Immediate danger) |
500 mg/m3[2] |
| Safety data sheet (SDS) | ICSC 0208 |
| Related compounds | |
|
Other anions |
Zinc sulfide Zinc selenide Zinc telluride |
|
Other cations |
Cadmium oxide Mercury(II) oxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Zinc oxide is an inorganic compound with the formula ZnO. It is a white powder that is insoluble in water. ZnO is used as an additive in numerous materials and products including cosmetics, food supplements, rubbers, plastics, ceramics, glass, cement, lubricants,[10] paints, ointments, adhesives, sealants, pigments, foods, batteries, ferrites, fire retardants, and first-aid tapes. Although it occurs naturally as the mineral zincite, most zinc oxide is produced synthetically.[11]
ZnO is a wide-band gap semiconductor of the II-VI semiconductor group. The native doping of the semiconductor due to oxygen vacancies or zinc interstitials is n-type.[12] Other favorable properties include good transparency, high electron mobility, wide band gap, and strong room-temperature luminescence. Those properties make ZnO valuable for a variety of emerging applications: transparent electrodes in liquid crystal displays, energy-saving or heat-protecting windows, and electronics as thin-film transistors and light-emitting diodes.
Chemical properties[edit]
Pure ZnO is a white powder, but in nature it occurs as the rare mineral zincite, which usually contains manganese and other impurities that confer a yellow to red color.[13]
Crystalline zinc oxide is thermochromic, changing from white to yellow when heated in air and reverting to white on cooling.[14] This color change is caused by a small loss of oxygen to the environment at high temperatures to form the non-stoichiometric Zn1+xO, where at 800 °C, x = 0.00007.[14]
Zinc oxide is an amphoteric oxide. It is nearly insoluble in water, but it will dissolve in most acids, such as hydrochloric acid:[15]
- ZnO + 2 HCl → ZnCl2 + H2O
Solid zinc oxide will also dissolve in alkalis to give soluble zincates:
- ZnO + 2 NaOH + H2O → Na2[Zn(OH)4]
ZnO reacts slowly with fatty acids in oils to produce the corresponding carboxylates, such as oleate or stearate. When mixed with a strong aqueous solution of zinc chloride, ZnO forms cement-like products best described as zinc hydroxy chlorides.[16] This cement was used in dentistry.[17]
ZnO also forms cement-like material when treated with phosphoric acid; related materials are used in dentistry.[17] A major component of zinc phosphate cement produced by this reaction is hopeite, Zn3(PO4)2·4H2O.[18]
ZnO decomposes into zinc vapor and oxygen at around 1975 °C with a standard oxygen pressure. In a carbothermic reaction, heating with carbon converts the oxide into zinc vapor at a much lower temperature (around 950 °C).[15]
- ZnO + C → Zn(Vapor) + CO
Physical properties[edit]
Structure[edit]
Zinc oxide crystallizes in two main forms, hexagonal wurtzite[19] and cubic zincblende. The wurtzite structure is most stable at ambient conditions and thus most common. The zincblende form can be stabilized by growing ZnO on substrates with cubic lattice structure. In both cases, the zinc and oxide centers are tetrahedral, the most characteristic geometry for Zn(II). ZnO converts to the rocksalt motif at relatively high pressures about 10 GPa.[12] The many remarkable medical properties of creams containing ZnO can be explained by its elastic softness, which is characteristic of tetrahedral coordinated binary compounds close to the transition to octahedral structures.[20]
Hexagonal and zincblende polymorphs have no inversion symmetry (reflection of a crystal relative to any given point does not transform it into itself). This and other lattice symmetry properties result in piezoelectricity of the hexagonal and zincblende ZnO, and pyroelectricity of hexagonal ZnO.
The hexagonal structure has a point group 6 mm (Hermann–Mauguin notation) or C6v (Schoenflies notation), and the space group is P63mc or C6v4. The lattice constants are a = 3.25 Å and c = 5.2 Å; their ratio c/a ~ 1.60 is close to the ideal value for hexagonal cell c/a = 1.633.[21] As in most group II-VI materials, the bonding in ZnO is largely ionic (Zn2+O2−) with the corresponding radii of 0.074 nm for Zn2+ and 0.140 nm for O2−. This property accounts for the preferential formation of wurtzite rather than zinc blende structure,[22] as well as the strong piezoelectricity of ZnO. Because of the polar Zn−O bonds, zinc and oxygen planes are electrically charged. To maintain electrical neutrality, those planes reconstruct at atomic level in most relative materials, but not in ZnO – its surfaces are atomically flat, stable and exhibit no reconstruction.[23] However, studies using wurtzoid structures explained the origin of surface flatness and the absence of reconstruction at ZnO wurtzite surfaces[24] in addition to the origin of charges on ZnO planes.
Mechanical properties[edit]
ZnO is a relatively soft material with approximate hardness of 4.5 on the Mohs scale.[10] Its elastic constants are smaller than those of relevant III-V semiconductors, such as GaN. The high heat capacity and heat conductivity, low thermal expansion and high melting temperature of ZnO are beneficial for ceramics.[25] The E2 optical phonon in ZnO exhibits an unusually long lifetime of 133 ps at 10 K.[26]
Among the tetrahedrally bonded semiconductors, it has been stated that ZnO has the highest piezoelectric tensor, or at least one comparable to that of GaN and AlN.[27] This property makes it a technologically important material for many piezoelectrical applications, which require a large electromechanical coupling. Therefore, ZnO in the form of thin film has been one of the most studied resonator materials for thin-film bulk acoustic resonators.
Electrical and optical properties[edit]
ZnO has a relatively large direct band gap of ~3.3 eV at room temperature. Advantages associated with a large band gap include higher breakdown voltages, ability to sustain large electric fields, lower electronic noise, and high-temperature and high-power operation. The band gap of ZnO can further be tuned to ~3–4 eV by its alloying with magnesium oxide or cadmium oxide.[12]
Most ZnO has n-type character, even in the absence of intentional doping. Nonstoichiometry is typically the origin of n-type character, but the subject remains controversial.[28] An alternative explanation has been proposed, based on theoretical calculations, that unintentional substitutional hydrogen impurities are responsible.[29] Controllable n-type doping is easily achieved by substituting Zn with group-III elements such as Al, Ga, In or by substituting oxygen with group-VII elements chlorine or iodine.[30]
Reliable p-type doping of ZnO remains difficult. This problem originates from low solubility of p-type dopants and their compensation by abundant n-type impurities. This problem is observed with GaN and ZnSe. Measurement of p-type in «intrinsically» n-type material is complicated by the inhomogeneity of samples.[31]
Current limitations to p-doping limit electronic and optoelectronic applications of ZnO, which usually require junctions of n-type and p-type material. Known p-type dopants include group-I elements Li, Na, K; group-V elements N, P and As; as well as copper and silver. However, many of these form deep acceptors and do not produce significant p-type conduction at room temperature.[12]
Electron mobility of ZnO strongly varies with temperature and has a maximum of ~2000 cm2/(V·s) at 80 K.[32] Data on hole mobility are scarce with values in the range 5–30 cm2/(V·s).[33]
ZnO discs, acting as a varistor, are the active material in most surge arresters.[34][35]
Zinc oxide is noted for its strongly nonlinear optical properties, especially in bulk. The nonlinearity of ZnO nanoparticles can be fine-tuned according to their size.[36]
Production[edit]
For industrial use, ZnO is produced at levels of 105 tons per year[13] by three main processes:[25]
Indirect process[edit]
In the indirect or French process, metallic zinc is melted in a graphite crucible and vaporized at temperatures above 907 °C (typically around 1000 °C). Zinc vapor reacts with the oxygen in the air to give ZnO, accompanied by a drop in its temperature and bright luminescence. Zinc oxide particles are transported into a cooling duct and collected in a bag house. This indirect method was popularized by LeClaire (France) in 1844 and therefore is commonly known as the French process. Its product normally consists of agglomerated zinc oxide particles with an average size of 0.1 to a few micrometers. By weight, most of the world’s zinc oxide is manufactured via French process.
Direct process[edit]
The direct or American process starts with diverse contaminated zinc composites, such as zinc ores or smelter by-products. The zinc precursors are reduced (carbothermal reduction) by heating with a source of carbon such as anthracite to produce zinc vapor, which is then oxidized as in the indirect process. Because of the lower purity of the source material, the final product is also of lower quality in the direct process as compared to the indirect one.
Wet chemical process[edit]
A small amount of industrial production involves wet chemical processes, which start with aqueous solutions of zinc salts, from which zinc carbonate or zinc hydroxide is precipitated. The solid precipitate is then calcined at temperatures around 800 °C.
Laboratory synthesis[edit]
The red and green colors of these synthetic ZnO crystals result from different concentrations of oxygen vacancies.[37]
Numerous specialised methods exist for producing ZnO for scientific studies and niche applications. These methods can be classified by the resulting ZnO form (bulk, thin film, nanowire), temperature («low», that is close to room temperature or «high», that is T ~ 1000 °C), process type (vapor deposition or growth from solution) and other parameters.
Large single crystals (many cubic centimeters) can be grown by the gas transport (vapor-phase deposition), hydrothermal synthesis,[23][37][38] or melt growth.[5] However, because of the high vapor pressure of ZnO, growth from the melt is problematic. Growth by gas transport is difficult to control, leaving the hydrothermal method as a preference.[5] Thin films can be produced by chemical vapor deposition, metalorganic vapour phase epitaxy, electrodeposition, pulsed laser deposition, sputtering, sol–gel synthesis, atomic layer deposition, spray pyrolysis, etc.
Ordinary white powdered zinc oxide can be produced in the laboratory by electrolyzing a solution of sodium bicarbonate with a zinc anode. Zinc hydroxide and hydrogen gas are produced. The zinc hydroxide upon heating decomposes to zinc oxide:
- Zn + 2 H2O → Zn(OH)2 + H2
- Zn(OH)2 → ZnO + H2O
ZnO nanostructures[edit]
Nanostructures of ZnO can be synthesized into a variety of morphologies including nanowires, nanorods, tetrapods, nanobelts, nanoflowers, nanoparticles etc. Nanostructures can be obtained with most above-mentioned techniques, at certain conditions, and also with the vapor–liquid–solid method.[23][39][40] The synthesis is typically carried out at temperatures of about 90 °C, in an equimolar aqueous solution of zinc nitrate and hexamine, the latter providing the basic environment. Certain additives, such as polyethylene glycol or polyethylenimine, can improve the aspect ratio of the ZnO nanowires.[41] Doping of the ZnO nanowires has been achieved by adding other metal nitrates to the growth solution.[42] The morphology of the resulting nanostructures can be tuned by changing the parameters relating to the precursor composition (such as the zinc concentration and pH) or to the thermal treatment (such as the temperature and heating rate).[43]
Aligned ZnO nanowires on pre-seeded silicon, glass, and gallium nitride substrates have been grown using aqueous zinc salts such as zinc nitrate and zinc acetate in basic environments.[44] Pre-seeding substrates with ZnO creates sites for homogeneous nucleation of ZnO crystal during the synthesis. Common pre-seeding methods include in-situ thermal decomposition of zinc acetate crystallites, spincoating of ZnO nanoparticles and the use of physical vapor deposition methods to deposit ZnO thin films.[45][46] Pre-seeding can be performed in conjunction with top down patterning methods such as electron beam lithography and nanosphere lithography to designate nucleation sites prior to growth. Aligned ZnO nanowires can be used in dye-sensitized solar cells and field emission devices.[47][48]
History[edit]
Zinc compounds were probably used by early humans, in processed[11] and unprocessed forms, as a paint or medicinal ointment, but their composition is uncertain. The use of pushpanjan, probably zinc oxide, as a salve for eyes and open wounds, is mentioned in the Indian medical text the Charaka Samhita, thought to date from 500 BC or before.[49] Zinc oxide ointment is also mentioned by the Greek physician Dioscorides (1st century AD).[50] Galen suggested treating ulcerating cancers with zinc oxide,[51] as did Avicenna in his The Canon of Medicine. It is used as an ingredient in products such as baby powder and creams against diaper rashes, calamine cream, anti-dandruff shampoos, and antiseptic ointments.[52]
The Romans produced considerable quantities of brass (an alloy of zinc and copper) as early as 200 BC by a cementation process where copper was reacted with zinc oxide.[53] The zinc oxide is thought to have been produced by heating zinc ore in a shaft furnace. This liberated metallic zinc as a vapor, which then ascended the flue and condensed as the oxide. This process was described by Dioscorides in the 1st century AD.[54] Zinc oxide has also been recovered from zinc mines at Zawar in India, dating from the second half of the first millennium BC.[50]
From the 12th to the 16th century zinc and zinc oxide were recognized and produced in India using a primitive form of the direct synthesis process. From India, zinc manufacture moved to China in the 17th century. In 1743, the first European zinc smelter was established in Bristol, United Kingdom.[55] Around 1782 Louis-Bernard Guyton de Morveau proposed replacing lead white with zinc oxide.[56]
The main usage of zinc oxide (zinc white) was in paints and as an additive to ointments. Zinc white was accepted as a pigment in oil paintings by 1834 but it did not mix well with oil. This problem was solved by optimizing the synthesis of ZnO. In 1845, LeClaire in Paris was producing the oil paint on a large scale, and by 1850, zinc white was being manufactured throughout Europe. The success of zinc white paint was due to its advantages over the traditional white lead: zinc white is essentially permanent in sunlight, it is not blackened by sulfur-bearing air, it is non-toxic and more economical. Because zinc white is so «clean» it is valuable for making tints with other colors, but it makes a rather brittle dry film when unmixed with other colors. For example, during the late 1890s and early 1900s, some artists used zinc white as a ground for their oil paintings. All those paintings developed cracks over the years.[57]
In recent times, most zinc oxide was used in the rubber industry to resist corrosion. In the 1970s, the second largest application of ZnO was photocopying. High-quality ZnO produced by the «French process» was added to photocopying paper as a filler. This application was soon displaced by titanium.[25]
Applications[edit]
The applications of zinc oxide powder are numerous, and the principal ones are summarized below. Most applications exploit the reactivity of the oxide as a precursor to other zinc compounds. For material science applications, zinc oxide has high refractive index, high thermal conductivity, binding, antibacterial and UV-protection properties. Consequently, it is added into materials and products including plastics, ceramics, glass, cement,[58] rubber, lubricants,[10] paints, ointments, adhesive, sealants, concrete manufacturing, pigments, foods, batteries, ferrites, fire retardants, etc.[59]
Rubber manufacture[edit]
Between 50% and 60% of ZnO use is in the rubber industry.[60] Zinc oxide along with stearic acid is used in the vulcanization of rubber[25][61] ZnO additives also protect rubber from fungi (see medical applications) and UV light.
Ceramic industry[edit]
Ceramic industry consumes a significant amount of zinc oxide, in particular in ceramic glaze and frit compositions. The relatively high heat capacity, thermal conductivity and high temperature stability of ZnO coupled with a comparatively low coefficient of expansion are desirable properties in the production of ceramics. ZnO affects the melting point and optical properties of the glazes, enamels, and ceramic formulations. Zinc oxide as a low expansion, secondary flux improves the elasticity of glazes by reducing the change in viscosity as a function of temperature and helps prevent crazing and shivering. By substituting ZnO for BaO and PbO, the heat capacity is decreased and the thermal conductivity is increased. Zinc in small amounts improves the development of glossy and brilliant surfaces. However, in moderate to high amounts, it produces matte and crystalline surfaces. With regard to color, zinc has a complicated influence.[60]
Medicine[edit]
Zinc oxide as a mixture with about 0.5% iron(III) oxide (Fe2O3) is called calamine and is used in calamine lotion. Two minerals, zincite and hemimorphite, have been historically called calamine. When mixed with eugenol, a ligand, zinc oxide eugenol is formed, which has applications as a restorative and prosthodontic in dentistry.[17][62]
Reflecting the basic properties of ZnO,[further explanation needed] fine particles of the oxide have deodorizing and antibacterial[63] properties and for that reason are added into materials including cotton fabric, rubber, oral care products,[64][65] and food packaging.[66][67] Enhanced antibacterial action of fine particles compared to bulk material is not exclusive to ZnO and is observed for other materials, such as silver.[68] This property results from the increased surface area of the fine particles.
Zinc oxide is used in mouthwash products and toothpastes as an anti-bacterial agent proposed to prevent plaque and tartar formation,[69] and to control bad breath by reducing the volatile gases and volatile sulfur compounds (VSC) in the mouth.[70] Along with zinc oxide or zinc salts, these products also commonly contain other active ingredients, such as cetylpyridinium chloride,[71] xylitol,[72] hinokitiol,[73] essential oils and plant extracts.[74][75]
Zinc oxide is widely used to treat a variety of skin conditions, including atopic dermatitis, contact dermatitis, itching due to eczema, diaper rash and acne.[76] Zinc oxide is also often added into sunscreens.[76]
It is used in products such as baby powder and barrier creams to treat diaper rashes, calamine cream, anti-dandruff shampoos, and antiseptic ointments.[52][77] It is also a component in tape (called «zinc oxide tape») used by athletes as a bandage to prevent soft tissue damage during workouts.[78]
Zinc oxide can be used[79] in ointments, creams, and lotions to protect against sunburn and other damage to the skin caused by ultraviolet light (see sunscreen). It is the broadest spectrum UVA and UVB absorber[80][81] that is approved for use as a sunscreen by the U.S. Food and Drug Administration (FDA),[82] and is completely photostable.[83] When used as an ingredient in sunscreen, zinc oxide blocks both UVA (320–400 nm) and UVB (280–320 nm) rays of ultraviolet light. Zinc oxide and the other most common physical sunscreen, titanium dioxide, are considered to be nonirritating, nonallergenic, and non-comedogenic.[84] Zinc from zinc oxide is, however, slightly absorbed into the skin.[85]
Many sunscreens use nanoparticles of zinc oxide (along with nanoparticles of titanium dioxide) because such small particles do not scatter light and therefore do not appear white. The nanoparticles are not absorbed into the skin more than regular-sized zinc oxide particles are,[86] and are only absorbed into the outermost layer of the skin but not into the body.[86]
Zinc oxide nanoparticles can enhance the antibacterial activity of ciprofloxacin. It has been shown that nano ZnO that has an average size between 20 nm and 45 nm can enhance the antibacterial activity of ciprofloxacin against Staphylococcus aureus and Escherichia coli in vitro. The enhancing effect of this nanomaterial is concentration dependent against all test strains. This effect may be due to two reasons. First, zinc oxide nanoparticles can interfere with NorA protein, which is developed for conferring resistance in bacteria and has pumping activity that mediates the effluxing of hydrophilic fluoroquinolones from a cell. Second, zinc oxide nanoparticles can interfere with Omf protein, which is responsible for the permeation of quinolone antibiotics into the cell.[87]
Cigarette filters[edit]
Zinc oxide is a component of cigarette filters. A filter consisting of charcoal impregnated with zinc oxide and iron oxide removes significant amounts of hydrogen cyanide (HCN) and hydrogen sulfide (H2S) from tobacco smoke without affecting its flavor.[59]
Food additive[edit]
Zinc oxide is added to many food products, including breakfast cereals, as a source of zinc,[88] a necessary nutrient. (Zinc sulfate is also used for the same purpose.) Some prepackaged foods also include trace amounts of ZnO even if it is not intended as a nutrient.
Zinc oxide was linked to dioxin contamination in pork exports in the 2008 Chilean pork crisis. The contamination was found to be due to dioxin contaminated zinc oxide used in pig feed.[89]
Pigment[edit]
Zinc oxide (zinc white) is used as a pigment in paints and is more opaque than lithopone, but less opaque than titanium dioxide.[11] It is also used in coatings for paper. Chinese white is a special grade of zinc white used in artists’ pigments.[90] The use of zinc white as a pigment in oil painting started in the middle of 18th century.[91] It has partly replaced the poisonous lead white and was used by painters such as Böcklin, Van Gogh,[92] Manet, Munch and others. It is also a main ingredient of mineral makeup (CI 77947).[93]
UV absorber[edit]
Micronized and nano-scale zinc oxide provides strong protection against UVA and UVB ultraviolet radiation, and are consequently used in sunscreens,[94] and also in UV-blocking sunglasses for use in space and for protection when welding, following research by scientists at Jet Propulsion Laboratory (JPL).[95]
Coatings[edit]
Paints containing zinc oxide powder have long been utilized as anticorrosive coatings for metals. They are especially effective for galvanized iron. Iron is difficult to protect because its reactivity with organic coatings leads to brittleness and lack of adhesion. Zinc oxide paints retain their flexibility and adherence on such surfaces for many years.[59]
ZnO highly n-type doped with aluminium, gallium, or indium is transparent and conductive (transparency ~90%, lowest resistivity ~10−4 Ω·cm[96]). ZnO:Al coatings are used for energy-saving or heat-protecting windows. The coating lets the visible part of the spectrum in but either reflects the infrared (IR) radiation back into the room (energy saving) or does not let the IR radiation into the room (heat protection), depending on which side of the window has the coating.[13]
Plastics, such as polyethylene naphthalate (PEN), can be protected by applying zinc oxide coating. The coating reduces the diffusion of oxygen through PEN.[97] Zinc oxide layers can also be used on polycarbonate in outdoor applications. The coating protects polycarbonate from solar radiation, and decreases its oxidation rate and photo-yellowing.[98]
Corrosion prevention in nuclear reactors[edit]
Zinc oxide depleted in 64Zn (the zinc isotope with atomic mass 64) is used in corrosion prevention in nuclear pressurized water reactors. The depletion is necessary, because 64Zn is transformed into radioactive 65Zn under irradiation by the reactor neutrons.[99]
Methane reforming[edit]
Zinc oxide (ZnO) is used as a pretreatment step to remove hydrogen sulfide (H2S) from natural gas following hydrogenation of any sulfur compounds prior to a methane reformer, which can poison the catalyst. At temperatures between about 230–430 °C (446–806 °F), H2S is converted to water by the following reaction:[100]
- H2S + ZnO → H2O + ZnS
Potential applications[edit]
Electronics[edit]
Photograph of an operating ZnO UV laser diode and the corresponding device structure.[101]
ZnO has wide direct band gap (3.37 eV or 375 nm at room temperature). Therefore, its most common potential applications are in laser diodes and light emitting diodes (LEDs).[103] Moreover, ultrafast nonlinearities and photoconductive functions have been reported in ZnO.[104] Some optoelectronic applications of ZnO overlap with that of GaN, which has a similar band gap (~3.4 eV at room temperature). Compared to GaN, ZnO has a larger exciton binding energy (~60 meV, 2.4 times of the room-temperature thermal energy), which results in bright room-temperature emission from ZnO. ZnO can be combined with GaN for LED-applications. For instance, a transparent conducting oxide layer and ZnO nanostructures provide better light outcoupling.[105] Other properties of ZnO favorable for electronic applications include its stability to high-energy radiation and its ability to be patterned by wet chemical etching.[106] Radiation resistance[107] makes ZnO a suitable candidate for space applications. ZnO is the most promising candidate in the field of random lasers to produce an electronically pumped UV laser source.
The pointed tips of ZnO nanorods result in a strong enhancement of an electric field. Therefore, they can be used as field emitters.[108]
Aluminium-doped ZnO layers are used as transparent electrodes. The components Zn and Al are much cheaper and less toxic compared to the generally used indium tin oxide (ITO). One application which has begun to be commercially available is the use of ZnO as the front contact for solar cells or of liquid crystal displays.[109]
Transparent thin-film transistors (TTFT) can be produced with ZnO. As field-effect transistors, they do not need a p–n junction,[110] thus avoiding the p-type doping problem of ZnO. Some of the field-effect transistors even use ZnO nanorods as conducting channels.[111]
Zinc oxide nanorod sensor[edit]
Zinc oxide nanorod sensors are devices detecting changes in electric current passing through zinc oxide nanowires due to adsorption of gas molecules. Selectivity to hydrogen gas was achieved by sputtering palladium clusters on the nanorod surface. The addition of palladium appears to be effective in the catalytic dissociation of hydrogen molecules into atomic hydrogen, increasing the sensitivity of the sensor device. The sensor detects hydrogen concentrations down to 10 parts per million at room temperature, whereas there is no response to oxygen.[112][113] ZnO have been used as immobilization layers in immunosensors enabling the distribution of antibodies across the entire region probed by the measuring electric field applied to the microelectrodes.[114]
Piezoelectricity[edit]
The piezoelectricity in textile fibers coated in ZnO have been shown capable of fabricating «self-powered nanosystems» with everyday mechanical stress from wind or body movements.[115][116]
In 2008 the Center for Nanostructure Characterization at the Georgia Institute of Technology reported producing an electricity generating device (called flexible charge pump generator) delivering alternating current by stretching and releasing zinc oxide nanowires. This mini-generator creates an oscillating voltage up to 45 millivolts, converting close to seven percent of the applied mechanical energy into electricity. Researchers used wires with lengths of 0.2–0.3 mm and diameters of three to five micrometers, but the device could be scaled down to smaller size.[117]
ZnO as anode of Li-ion battery
In form of a thin film ZnO has been demonstrated in miniaturised high frequency thin film resonators, sensors and filters.
Li-ion battery and supercapacitors[edit]
ZnO is a promising anode material for lithium-ion battery because it is cheap, biocompatible, and environmentally friendly. ZnO has a higher theoretical capacity (978 mAh g−1) than many other transition metal oxides such as CoO (715 mAh g−1), NiO (718 mAh g−1) and CuO (674 mAh g−1).[118] ZnO is also used as an electrode in supercapacitors.[119]
Safety[edit]
As a food additive, zinc oxide is on the U.S. FDA’s list of generally recognized as safe, or GRAS, substances.[120]
Zinc oxide itself is non-toxic; it is hazardous, however, to inhale zinc oxide fumes, such as generated when zinc or zinc alloys are melted and oxidized at high temperature. This problem occurs while melting alloys containing brass because the melting point of brass is close to the boiling point of zinc.[121] Exposure to zinc oxide in the air, which also occurs while welding galvanized (zinc plated) steel, can result in a malady called metal fume fever. For this reason, typically galvanized steel is not welded, or the zinc is removed first.[122][dubious – discuss]
In sunscreen formulations containing zinc oxide and other UV absorbers, zinc oxide was found to cause photodegradation of small-molecule UV absorbers, which exhibited toxicity in embryonic zebrafish assays.[123]
See also[edit]
- Depleted zinc oxide
- Zinc oxide nanoparticle
- Gallium(III) nitride
- List of inorganic pigments
- Zinc
- Zinc oxide eugenol
- Zinc peroxide
- Zinc smelting
- Zinc–air battery
- Zinc–zinc oxide cycle
- ZnO nanostructures
References[edit]
- ^ a b c d Haynes, p. 4.100
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0675». National Institute for Occupational Safety and Health (NIOSH).
- ^ Haynes, p. 4.136
- ^ Haynes, p. 4.144
- ^ a b c Takahashi K, Yoshikawa A, Sandhu A (2007). Wide bandgap semiconductors: fundamental properties and modern photonic and electronic devices. Springer. p. 357. ISBN 978-3-540-47234-6.
- ^ Haynes, p. 4.152
- ^ Haynes, pp. 5.3, 5.16
- ^ Zinc oxide. Chem.sis.nlm.nih.gov. Retrieved on 2015-11-17.
- ^ a b c «Zinc oxide». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c Battez AH, González R, Viesca JL, Fernández JE, Fernández JD, Machado A, Chou R, Riba J (2008). «CuO, ZrO2 and ZnO nanoparticles as antiwear additive in oil lubricants». Wear. 265 (3–4): 422–428. doi:10.1016/j.wear.2007.11.013.
- ^ a b c De Liedekerke M (2006). «2.3. Zinc Oxide (Zinc White): Pigments, Inorganic, 1». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a20_243.pub2.
- ^ a b c d Özgür Ü, Alivov YI, Liu C, Teke A, Reshchikov M, Doğan S, Avrutin VC, Cho SJ, Morkoç AH (2005). «A comprehensive review of ZnO materials and devices». Journal of Applied Physics. 98 (4): 041301–041301–103. Bibcode:2005JAP….98d1301O. doi:10.1063/1.1992666.
- ^ a b c Klingshirn C (April 2007). «ZnO: material, physics and applications». ChemPhysChem. 8 (6): 782–803. doi:10.1002/cphc.200700002. PMID 17429819.
- ^ a b Wiberg E, Holleman AF (2001). Inorganic Chemistry. Elsevier. ISBN 978-0-12-352651-9.
- ^ a b Greenwood NN, Earnshaw A (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Nicholson JW (1998). «The chemistry of cements formed between zinc oxide and aqueous zinc chloride». Journal of Materials Science. 33 (9): 2251–2254. Bibcode:1998JMatS..33.2251N. doi:10.1023/A:1004327018497. S2CID 94700819.
- ^ a b c Ferracane JL (2001). Materials in Dentistry: Principles and Applications. Lippincott Williams & Wilkins. pp. 70, 143. ISBN 978-0-7817-2733-4.
- ^ Park CK, Silsbee MR, Roy DM (1998). «Setting reaction and resultant structure of zinc phosphate cement in various orthophosphoric acid cement-forming liquids». Cement and Concrete Research. 28 (1): 141–150. doi:10.1016/S0008-8846(97)00223-8.
- ^ Fierro JL (2006). Metal Oxides: Chemistry & Applications. CRC Press. p. 182. ISBN 978-0824723712.
- ^ Phillips JC (1970). «Ionicity of the Chemical Bond in Crystals». Reviews of Modern Physics. 42 (3): 317–356. Bibcode:1970RvMP…42..317P. doi:10.1103/RevModPhys.42.317.
- ^ Rossler U, ed. (1999). Landolt-Bornstein, New Series, Group III. Vol. 17B, 22, 41B. Springer, Heidelberg.
- ^ Klingshirn CF, Waag A, Hoffmann A, Geurts J (2010). Zinc Oxide: From Fundamental Properties Towards Novel Applications. Springer. pp. 9–10. ISBN 978-3-642-10576-0.
- ^ a b c Baruah S, Dutta J (February 2009). «Hydrothermal growth of ZnO nanostructures». Science and Technology of Advanced Materials. 10 (1): 013001. Bibcode:2009STAdM..10a3001B. doi:10.1088/1468-6996/10/1/013001. PMC 5109597. PMID 27877250.
- ^ Abdulsattar MA (2015). «Capped ZnO (3, 0) nanotubes as building blocks of bare and H passivated wurtzite ZnO nanocrystals». Superlattices and Microstructures. 85: 813–819. Bibcode:2015SuMi…85..813A. doi:10.1016/j.spmi.2015.07.015.
- ^ a b c d Porter F (1991). Zinc Handbook: Properties, Processing, and Use in Design. CRC Press. ISBN 978-0-8247-8340-2.
- ^ Millot M, Tena-Zaera R, Munoz-Sanjose V, Broto JM, Gonzalez J (2010). «Anharmonic effects in ZnO optical phonons probed by Raman spectroscopy». Applied Physics Letters. 96 (15): 152103. Bibcode:2010ApPhL..96o2103M. doi:10.1063/1.3387843. hdl:10902/23620.
- ^ Posternak M, Resta R, Baldereschi A (October 1994). «Ab initio study of piezoelectricity and spontaneous polarization in ZnO». Physical Review B. 50 (15): 10715–10721. Bibcode:1994PhRvB..5010715D. doi:10.1103/PhysRevB.50.10715. PMID 9975171.
- ^ Look DC, Hemsky JW, Sizelove JR (1999). «Residual Native Shallow Donor in ZnO». Physical Review Letters. 82 (12): 2552–2555. Bibcode:1999PhRvL..82.2552L. doi:10.1103/PhysRevLett.82.2552. S2CID 53476471.
- ^ Janotti A, Van de Walle CG (January 2007). «Hydrogen multicentre bonds». Nature Materials. 6 (1): 44–7. Bibcode:2007NatMa…6…44J. doi:10.1038/nmat1795. PMID 17143265.
- ^ Kato H, Sano M, Miyamoto K, Yao T (2002). «Growth and characterization of Ga-doped ZnO layers on a-plane sapphire substrates grown by molecular beam epitaxy». Journal of Crystal Growth. 237–239: 538–543. Bibcode:2002JCrGr.237..538K. doi:10.1016/S0022-0248(01)01972-8.
- ^ Ohgaki T, Ohashi N, Sugimura S, Ryoken H, Sakaguchi I, Adachi Y, Haneda H (2008). «Positive Hall coefficients obtained from contact misplacement on evident n-type ZnO films and crystals». Journal of Materials Research. 23 (9): 2293–2295. Bibcode:2008JMatR..23.2293O. doi:10.1557/JMR.2008.0300.
- ^ Wagner P, Helbig R (1974). «Halleffekt und anisotropie der beweglichkeit der elektronen in ZnO». Journal of Physics and Chemistry of Solids. 35 (3): 327–335. Bibcode:1974JPCS…35..327W. doi:10.1016/S0022-3697(74)80026-0.
- ^ Ryu YR, Lee TS, White HW (2003). «Properties of arsenic-doped p-type ZnO grown by hybrid beam deposition». Applied Physics Letters. 83 (1): 87. Bibcode:2003ApPhL..83…87R. doi:10.1063/1.1590423.
- ^
René Smeets, Lou van der Sluis, Mirsad Kapetanovic, David F. Peelo, Anton Janssen.
«Switching in Electrical Transmission and Distribution Systems».
2014.
p. 316. - ^
Mukund R. Patel.
«Introduction to Electrical Power and Power Electronics».
2012.
p. 247. - ^ Irimpan L, Krishnan Deepthy BA, Nampoori VPN, Radhakrishnan P (2008). «Size-dependent enhancement of nonlinear optical properties in nanocolloids of ZnO» (PDF). Journal of Applied Physics. 103 (3): 033105–033105–7. Bibcode:2008JAP…103c3105I. doi:10.1063/1.2838178.
- ^ a b Schulz D, Ganschow S, Klimm D, Struve K (2008). «Inductively heated Bridgman method for the growth of zinc oxide single crystals». Journal of Crystal Growth. 310 (7–9): 1832–1835. Bibcode:2008JCrGr.310.1832S. doi:10.1016/j.jcrysgro.2007.11.050.
- ^ Baruah S, Thanachayanont C, Dutta J (April 2008). «Growth of ZnO nanowires on nonwoven polyethylene fibers». Science and Technology of Advanced Materials. 9 (2): 025009. Bibcode:2008STAdM…9b5009B. doi:10.1088/1468-6996/9/2/025009. PMC 5099741. PMID 27877984.
- ^ Miao L, Ieda Y, Tanemura S, Cao YG, Tanemura M, Hayashi Y, Toh S, Kaneko K (2007). «Synthesis, microstructure and photoluminescence of well-aligned ZnO nanorods on Si substrate». Science and Technology of Advanced Materials. 8 (6): 443–447. Bibcode:2007STAdM…8..443M. doi:10.1016/j.stam.2007.02.012.
- ^ Xu S, Wang ZL (2011). «One-dimensional ZnO nanostructures: Solution growth and functional properties». Nano Res. 4 (11): 1013–1098. CiteSeerX 10.1.1.654.3359. doi:10.1007/s12274-011-0160-7. S2CID 137014543.
- ^ Zhou Y, Wu W, Hu G, Wu H, Cui S (2008). «Hydrothermal synthesis of ZnO nanorod arrays with the addition of polyethyleneimine». Materials Research Bulletin. 43 (8–9): 2113–2118. doi:10.1016/j.materresbull.2007.09.024.
- ^ Cui J, Zeng Q, Gibson UJ (2006-04-15). «Synthesis and magnetic properties of Co-doped ZnO nanowires». Journal of Applied Physics. 99 (8): 08M113. Bibcode:2006JAP….99hM113C. doi:10.1063/1.2169411.
- ^ Elen K, Van den Rul H, Hardy A, Van Bael MK, D’Haen J, Peeters R, et al. (February 2009). «Hydrothermal synthesis of ZnO nanorods: a statistical determination of the significant parameters in view of reducing the diameter». Nanotechnology. 20 (5): 055608. Bibcode:2009Nanot..20e5608E. doi:10.1088/0957-4484/20/5/055608. PMID 19417355. S2CID 206056816.
- ^ Greene LE, Law M, Goldberger J, Kim F, Johnson JC, Zhang Y, et al. (July 2003). «Low-temperature wafer-scale production of ZnO nanowire arrays». Angewandte Chemie. 42 (26): 3031–4. doi:10.1002/anie.200351461. PMID 12851963.
- ^ Wu W (2009). «Effects of Seed Layer Characteristics on the Synthesis of ZnO Nanowires». Journal of the American Ceramic Society. 92 (11): 2718–2723. doi:10.1111/j.1551-2916.2009.03022.x.
- ^ Greene LE, Law M, Tan DH, Montano M, Goldberger J, Somorjai G, Yang P (July 2005). «General route to vertical ZnO nanowire arrays using textured ZnO seeds». Nano Letters. 5 (7): 1231–6. Bibcode:2005NanoL…5.1231G. doi:10.1021/nl050788p. PMID 16178216.
- ^ Hua G (2008). «Fabrication of ZnO nanowire arrays by cycle growth in surfactantless aqueous solution and their applications on dye-sensitized solar cells». Materials Letters. 62 (25): 4109–4111. doi:10.1016/j.matlet.2008.06.018.
- ^ Lee JH, Chung YW, Hon MH, Leu C (2009-05-07). «Density-controlled growth and field emission property of aligned ZnO nanorod arrays». Applied Physics A. 97 (2): 403–408. Bibcode:2009ApPhA..97..403L. doi:10.1007/s00339-009-5226-y. S2CID 97205678.
- ^ Craddock PT (1998). «Zinc in India». 2000 years of zinc and brass. British Museum. p. 27. ISBN 978-0-86159-124-4.
- ^ a b Craddock PT (2008). «Mining and Metallurgy, chapter 4». In Oleson JP (ed.). The Oxford Handbook of Engineering and Technology in the Classical World. Oxford University Press. pp. 111–112. ISBN 978-0-19-518731-1.
- ^ Winchester DJ, Winchester DP, Hudis CA, Norton L (2005). Breast Cancer (Atlas of Clinical Oncology). PMPH USA. p. 3. ISBN 978-1550092721.
- ^ a b Harding FJ (2007). Breast Cancer: Cause – Prevention – Cure. Tekline Publishing. p. 83. ISBN 978-0-9554221-0-2.
- ^ «Zinc». Encyclopædia Britannica. 10 March 2009.
- ^ Craddock PT (2009). «The origins and inspirations of zinc smelting». Journal of Materials Science. 44 (9): 2181–2191. Bibcode:2009JMatS..44.2181C. doi:10.1007/s10853-008-2942-1. S2CID 135523239.
- ^ General Information of Zinc from the National Institute of Health, WHO, and International Zinc Association. Retrieved 10 March 2009
- ^ «Zinc White».
- ^ «Zinc white: History of use». Pigments through the ages. webexhibits.org.
- ^ Sanchez-Pescador R, Brown JT, Roberts M, Urdea MS (February 1988). «The nucleotide sequence of the tetracycline resistance determinant tetM from Ureaplasma urealyticum». Nucleic Acids Research. 16 (3): 1216–7. doi:10.1093/nar/16.3.1216. PMC 334766. PMID 3344217.
- ^ a b c Ambica Dhatu Private Limited. Applications of ZnO. Archived December 19, 2019, at the Wayback Machine Access date January 25, 2009.
- ^ a b Moezzi A, McDonagh AM, Cortie MB (2012). «Review: Zinc oxide particles: Synthesis, properties and applications». Chemical Engineering Journal. 185–186: 1–22. doi:10.1016/j.cej.2012.01.076.
- ^ Brown HE (1957). Zinc Oxide Rediscovered. New York: The New Jersey Zinc Company.
- ^ van Noort R (2002). Introduction to Dental Materials (2d ed.). Elsevier Health Sciences. ISBN 978-0-7234-3215-9.
- ^ Padmavathy N, Vijayaraghavan R (July 2008). «Enhanced bioactivity of ZnO nanoparticles-an antimicrobial study». Science and Technology of Advanced Materials. 9 (3): 035004. Bibcode:2008STAdM…9c5004P. doi:10.1088/1468-6996/9/3/035004. PMC 5099658. PMID 27878001.
- ^ ten Cate JM (February 2013). «Contemporary perspective on the use of fluoride products in caries prevention». British Dental Journal. 214 (4): 161–7. doi:10.1038/sj.bdj.2013.162. PMID 23429124.
- ^ Rošin-Grget K, Peroš K, Sutej I, Bašić K (November 2013). «The cariostatic mechanisms of fluoride». Acta Medica Academica. 42 (2): 179–88. doi:10.5644/ama2006-124.85. PMID 24308397.
- ^ Li Q, Chen S, Jiang W (2007). «Durability of nano ZnO antibacterial cotton fabric to sweat». Journal of Applied Polymer Science. 103: 412–416. doi:10.1002/app.24866.
- ^ Saito M (1993). «Antibacterial, Deodorizing, and UV Absorbing Materials Obtained with Zinc Oxide (ZnO) Coated Fabrics». Journal of Industrial Textiles. 23 (2): 150–164. doi:10.1177/152808379302300205. S2CID 97726945.
- ^ Akhavan O, Ghaderi E (February 2009). «Enhancement of antibacterial properties of Ag nanorods by electric field». Science and Technology of Advanced Materials. 10 (1): 015003. Bibcode:2009STAdM..10a5003A. doi:10.1088/1468-6996/10/1/015003. PMC 5109610. PMID 27877266.
- ^ Lynch, Richard J.M. (August 2011). «Zinc in the mouth, its interactions with dental enamel and possible effects on caries; a review of the literature». International Dental Journal. 61: 46–54. doi:10.1111/j.1875-595X.2011.00049.x. PMC 9374993. PMID 21762155.
- ^ Cortelli, José Roberto; Barbosa, Mônica Dourado Silva; Westphal, Miriam Ardigó (August 2008). «Halitosis: a review of associated factors and therapeutic approach». Brazilian Oral Research. 22 (suppl 1): 44–54. doi:10.1590/S1806-83242008000500007. PMID 19838550.
- ^ «SmartMouth Clinical DDS Activated Mouthwash». smartmouth.com.
- ^ «Oxyfresh». Oxyfresh.com.
- ^ «Dr ZinX». drzinx.com.
- ^ Steenberghe, Daniel Van; Avontroodt, Pieter; Peeters, Wouter; Pauwels, Martine; Coucke, Wim; Lijnen, An; Quirynen, Marc (September 2001). «Effect of Different Mouthrinses on Morning Breath». Journal of Periodontology. 72 (9): 1183–1191. doi:10.1902/jop.2000.72.9.1183. PMID 11577950.
- ^ Harper, D. Scott; Mueller, Laura J.; Fine, James B.; Gordon, Jeffrey; Laster, Larry L. (June 1990). «Clinical Efficacy of a Dentifrice and Oral Rinse Containing Sanguinaria Extract and Zinc Chloride During 6 Months of Use». Journal of Periodontology. 61 (6): 352–358. doi:10.1902/jop.1990.61.6.352. PMID 2195152.
- ^ a b Gupta, Mrinal; Mahajan, Vikram K.; Mehta, Karaninder S.; Chauhan, Pushpinder S. (2014). «Zinc Therapy in Dermatology: A Review». Dermatology Research and Practice. 2014: 709152. doi:10.1155/2014/709152. PMC 4120804. PMID 25120566.
- ^ British National Formulary (2008). «Section 13.2.2 Barrier Preparations».
- ^ Hughes G, McLean NR (December 1988). «Zinc oxide tape: a useful dressing for the recalcitrant finger-tip and soft-tissue injury». Archives of Emergency Medicine. 5 (4): 223–7. doi:10.1136/emj.5.4.223. PMC 1285538. PMID 3233136.
- ^ Dhatu A (10 October 2019). «Zinc oxide as the chemical for skin care». Retrieved 22 October 2019.
- ^ «Critical Wavelength & Broad Spectrum UV Protection». mycpss.com. Retrieved 15 April 2018.
- ^ More BD (2007). «Physical sunscreens: on the comeback trail». Indian Journal of Dermatology, Venereology and Leprology. 73 (2): 80–5. doi:10.4103/0378-6323.31890. PMID 17456911.
- ^ «Sunscreen». U.S. Food and Drug Administration.
- ^ Mitchnick MA, Fairhurst D, Pinnell SR (January 1999). «Microfine zinc oxide (Z-cote) as a photostable UVA/UVB sunblock agent». Journal of the American Academy of Dermatology. 40 (1): 85–90. doi:10.1016/S0190-9622(99)70532-3. PMID 9922017.
- ^ «What to Look for in a Sunscreen». The New York Times. June 10, 2009.
- ^ Agren MS (2009). «Percutaneous absorption of zinc from zinc oxide applied topically to intact skin in man». Dermatologica. 180 (1): 36–9. doi:10.1159/000247982. PMID 2307275.
- ^ a b Burnett ME, Wang SQ (April 2011). «Current sunscreen controversies: a critical review». Photodermatology, Photoimmunology & Photomedicine. 27 (2): 58–67. doi:10.1111/j.1600-0781.2011.00557.x. PMID 21392107. S2CID 29173997.
- ^ Banoee M, Seif S, Nazari ZE, Jafari-Fesharaki P, Shahverdi HR, Moballegh A, et al. (May 2010). «ZnO nanoparticles enhanced antibacterial activity of ciprofloxacin against Staphylococcus aureus and Escherichia coli». Journal of Biomedical Materials Research Part B: Applied Biomaterials. 93 (2): 557–61. doi:10.1002/jbm.b.31615. PMID 20225250.
- ^ Quaker cereals content. quakeroats.com
- ^ Kim M, Kim DG, Choi SW, Guerrero P, Norambuena J, Chung GS (February 2011). «Formation of polychlorinated dibenzo-p-dioxins/dibenzofurans (PCDD/Fs) from a refinery process for zinc oxide used in feed additives: a source of dioxin contamination in Chilean pork». Chemosphere. 82 (9): 1225–9. Bibcode:2011Chmsp..82.1225K. doi:10.1016/j.chemosphere.2010.12.040. PMID 21216436.
- ^ St Clair K (2016). The Secret Lives of Colour. London: John Murray. p. 40. ISBN 9781473630819. OCLC 936144129.
- ^ Kuhn, H. (1986) «Zinc White», pp. 169–186 in Artists’ Pigments. A Handbook of Their History and Characteristics, Vol. 1. L. Feller (ed.). Cambridge University Press, London. ISBN 978-0521303743
- ^ Vincent van Gogh, ‘Wheatfield with Cypresses, 1889, pigment analysis at ColourLex
- ^ Bouchez C. «The Lowdown on Mineral Makeup». WebMD. Retrieved January 25, 2009.
- ^ US Environment Protection Agency: Sunscreen What are the active Ingredients in Sunscreen – Physical Ingredients:»The physical compounds titanium dioxide and zinc oxide reflect, scatter, and absorb both UVA and UVB rays.» A table lists them as providing extensive physical protection against UVA and UVB
- ^ Look Sharp While Seeing Sharp. NASA Scientific and Technical Information (2006). Retrieved 17 October 2009. JPL scientists developed UV-protective sunglasses using dyes and «zinc oxide, which absorbs ultraviolet light»
- ^ Schmidtmende L, MacManusdriscoll J (2007). «ZnO – nanostructures, defects, and devices». Materials Today. 10 (5): 40–48. doi:10.1016/S1369-7021(07)70078-0.
- ^ Guedri-Knani L, Gardette JL, Jacquet M, Rivaton A (2004). «Photoprotection of poly(ethylene-naphthalate) by zinc oxide coating». Surface and Coatings Technology. 180–181: 71–75. doi:10.1016/j.surfcoat.2003.10.039.
- ^ Moustaghfir A, Tomasella E, Rivaton A, Mailhot B, Jacquet M, Gardette JL, Cellier J (2004). «Sputtered zinc oxide coatings: structural study and application to the photoprotection of the polycarbonate». Surface and Coatings Technology. 180–181: 642–645. doi:10.1016/j.surfcoat.2003.10.109.
- ^ Cowan RL (2001). «BWR water chemistry?a delicate balance». Nuclear Energy. 40 (4): 245–252. doi:10.1680/nuen.40.4.245.39338.
- ^ Robinson, Victor S. (1978) «Process for desulfurization using particulate zinc oxide shapes of high surface area and improved strength» U.S. Patent 4,128,619
- ^ Liu XY, Shan CX, Zhu H, Li BH, Jiang MM, Yu SF, Shen DZ (September 2015). «Ultraviolet Lasers Realized via Electrostatic Doping Method». Scientific Reports. 5: 13641. Bibcode:2015NatSR…513641L. doi:10.1038/srep13641. PMC 4555170. PMID 26324054.
- ^ Zheng ZQ, Yao JD, Wang B, Yang GW (June 2015). «Light-controlling, flexible and transparent ethanol gas sensor based on ZnO nanoparticles for wearable devices». Scientific Reports. 5: 11070. Bibcode:2015NatSR…511070Z. doi:10.1038/srep11070. PMC 4468465. PMID 26076705.
- ^ Bakin A, El-Shaer A, Mofor AC, Al-Suleiman M, Schlenker E, Waag A (2007). «ZnMgO-ZnO quantum wells embedded in ZnO nanopillars: Towards realisation of nano-LEDs». Physica Status Solidi C. 4 (1): 158–161. Bibcode:2007PSSCR…4..158B. doi:10.1002/pssc.200673557.
- ^ Torres-Torres, C.; Castro-Chacón, J. H.; Castañeda, L.; Rojo, R. Rangel; Torres-Martínez, R.; Tamayo-Rivera, L.; Khomenko, A. V. (2011-08-15). «Ultrafast nonlinear optical response of photoconductive ZnO films with fluorine nanoparticles». Optics Express. 19 (17): 16346–16355. Bibcode:2011OExpr..1916346T. doi:10.1364/OE.19.016346. ISSN 1094-4087. PMID 21934998.
- ^ Bakin A (2010). «ZnO – GaN Hybrid Heterostructures as Potential Cost Efficient LED Technology». Proceedings of the IEEE. 98 (7): 1281–1287. doi:10.1109/JPROC.2009.2037444. S2CID 20442190.
- ^ Look D (2001). «Recent advances in ZnO materials and devices». Materials Science and Engineering B. 80 (1–3): 383–387. doi:10.1016/S0921-5107(00)00604-8.
- ^ Kucheyev SO, Williams JS, Jagadish C, Zou J, Evans C, Nelson AJ, Hamza AV (2003-03-31). «Ion-beam-produced structural defects in ZnO» (PDF). Physical Review B. 67 (9): 094115. Bibcode:2003PhRvB..67i4115K. doi:10.1103/physrevb.67.094115.
- ^ Li YB, Bando Y, Golberg D (2004). «ZnO nanoneedles with tip surface perturbations: Excellent field emitters». Applied Physics Letters. 84 (18): 3603. Bibcode:2004ApPhL..84.3603L. doi:10.1063/1.1738174.
- ^ Oh BY, Jeong MC, Moon TH, Lee W, Myoung JM, Hwang JY, Seo DS (2006). «Transparent conductive Al-doped ZnO films for liquid crystal displays». Journal of Applied Physics. 99 (12): 124505–124505–4. Bibcode:2006JAP….99l4505O. doi:10.1063/1.2206417.
- ^ Nomura K, Ohta H, Ueda K, Kamiya T, Hirano M, Hosono H (May 2003). «Thin-film transistor fabricated in single-crystalline transparent oxide semiconductor». Science. 300 (5623): 1269–72. Bibcode:2003Sci…300.1269N. doi:10.1126/science.1083212. PMID 12764192. S2CID 20791905.
- ^ Heo YW, Tien LC, Kwon Y, Norton DP, Pearton SJ, Kang BS, Ren F (2004). «Depletion-mode ZnO nanowire field-effect transistor». Applied Physics Letters. 85 (12): 2274. Bibcode:2004ApPhL..85.2274H. doi:10.1063/1.1794351.
- ^ Wang HT, Kang BS, Ren F, Tien LC, Sadik PW, Norton DP, Pearton SJ, Lin J (2005). «Hydrogen-selective sensing at room temperature with ZnO nanorods». Applied Physics Letters. 86 (24): 243503. Bibcode:2005ApPhL..86x3503W. doi:10.1063/1.1949707.
- ^ Tien LC, Sadik PW, Norton DP, Voss LF, Pearton SJ, Wang HT, et al. (2005). «Hydrogen sensing at room temperature with Pt-coated ZnO thin films and nanorods». Applied Physics Letters. 87 (22): 222106. Bibcode:2005ApPhL..87v2106T. doi:10.1063/1.2136070.
- ^ Sanguino, P.; Monteiro, Tiago; Bhattacharyya, S. R.; Dias, C. J.; Igreja, Rui; Franco, Ricardo (1 December 2014). «ZnO nanorods as immobilization layers for interdigitated capacitive immunosensors». Sensors and Actuators B: Chemical. 204: 211–217. doi:10.1016/j.snb.2014.06.141. ISSN 0925-4005.
- ^ Keim B (February 13, 2008). «Piezoelectric Nanowires Turn Fabric Into Power Source». Wired News. CondéNet. Archived from the original on February 15, 2008.
- ^ Qin Y, Wang X, Wang ZL (February 2008). «Microfibre-nanowire hybrid structure for energy scavenging». Nature. 451 (7180): 809–13. Bibcode:2008Natur.451..809Q. doi:10.1038/nature06601. PMID 18273015. S2CID 4411796.
- ^ «New Small-scale Generator Produces Alternating Current By Stretching Zinc Oxide Wires». Science Daily. November 10, 2008.
- ^ Zheng X, Shen G, Wang C, Li Y, Dunphy D, Hasan T, et al. (April 2017). «Bio-inspired Murray materials for mass transfer and activity». Nature Communications. 8: 14921. Bibcode:2017NatCo…814921Z. doi:10.1038/ncomms14921. PMC 5384213. PMID 28382972.
- ^ Sreejesh, M.; Dhanush, S.; Rossignol, F.; Nagaraja, H. S. (2017-04-15). «Microwave assisted synthesis of rGO/ZnO composites for non-enzymatic glucose sensing and supercapacitor applications». Ceramics International. 43 (6): 4895–4903. doi:10.1016/j.ceramint.2016.12.140. ISSN 0272-8842.
- ^ «Zinc oxide». Database of Select Committee on GRAS Substances (SCOGS) Reviews. U.S. Food and Drug Administration. Archived from the original on 16 April 2014. Retrieved 2009-08-03.
- ^ Gray T. «The Safety of Zinc Casting». The Wooden Periodic Table Table.
- ^ Calvert JB. «Introduction to Zinc and its Uses». Archived from the original on 2006-08-27.
- ^ Ginzburg AL, Blackburn RS, Santillan C, Truong L, Tanguay RL, Hutchison JE (2021). «Zinc oxide-induced changes to sunscreen ingredient efficacy and toxicity under UV irradiation». Photochem Photobiol Sci. 20 (10): 1273–1285. doi:10.1007/s43630-021-00101-2. PMC 8550398. PMID 34647278.
Cited sources[edit]
- Haynes WM, ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
Reviews[edit]
- Özgür Ü, Alivov YI, Liu C, Teke A, Reshchikov M, Doğan S, et al. (2005). «A comprehensive review of ZnO materials and devices». Journal of Applied Physics. 98 (4): 041301–041301–103. Bibcode:2005JAP….98d1301O. doi:10.1063/1.1992666.
- Bakin A, Waag A (29 March 2011). «ZnO Epitaxial Growth». In Bhattacharya P, Fornari R, Kamimura H (eds.). Comprehensive Semiconductor Science and Technology 6 Volume Encyclopaedia. Elsevier. ISBN 978-0-444-53143-8.
- Baruah S, Dutta J (February 2009). «Hydrothermal growth of ZnO nanostructures». Science and Technology of Advanced Materials. 10 (1): 013001. Bibcode:2009STAdM..10a3001B. doi:10.1088/1468-6996/10/1/013001. PMC 5109597. PMID 27877250.
- Janisch R (2005). «Transition metal-doped TiO 2 and ZnO—present status of the field». Journal of Physics: Condensed Matter. 17 (27): R657–R689. Bibcode:2005JPCM…17R.657J. doi:10.1088/0953-8984/17/27/R01. S2CID 118610509.
- Heo YW (2004). «ZnO nanowire growth and devices». Materials Science and Engineering: R: Reports. 47 (1–2): 1–47. doi:10.1016/j.mser.2004.09.001.
- Klingshirn C (2007). «ZnO: From basics towards applications». Physica Status Solidi B. 244 (9): 3027–3073. Bibcode:2007PSSBR.244.3027K. doi:10.1002/pssb.200743072. S2CID 97461963.
- Klingshirn C (April 2007). «ZnO: material, physics and applications». ChemPhysChem. 8 (6): 782–803. doi:10.1002/cphc.200700002. PMID 17429819.
- Lu JG, Chang P, Fan Z (2006). «Quasi-one-dimensional metal oxide materials—Synthesis, properties and applications». Materials Science and Engineering: R: Reports. 52 (1–3): 49–91. CiteSeerX 10.1.1.125.7559. doi:10.1016/j.mser.2006.04.002.
- Xu S, Wang ZL (2011). «One-dimensional ZnO nanostructures: Solution growth and functional properties». Nano Research. 4 (11): 1013–1098. CiteSeerX 10.1.1.654.3359. doi:10.1007/s12274-011-0160-7. S2CID 137014543.
- Xu S, Wang ZL (2011). «Oxide nanowire arrays for light-emitting diodes and piezoelectric energy harvesters». Pure and Applied Chemistry. 83 (12): 2171–2198. doi:10.1351/PAC-CON-11-08-17. S2CID 18770461.
External links[edit]
- Zincite properties
- International Chemical Safety Card 0208.
- NIOSH Pocket Guide to Chemical Hazards.
- Zinc oxide in the Pesticide Properties DataBase (PPDB)
- Zinc white pigment at ColourLex

|
|
| Names | |
|---|---|
| Other names
Zinc white, calamine, philosopher’s wool, Chinese white, flowers of zinc |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.013.839 |
| EC Number |
|
|
Gmelin Reference |
13738 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 3077 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
ZnO |
| Molar mass | 81.406 g/mol[1] |
| Appearance | White solid[1] |
| Odor | Odorless |
| Density | 5.606 g/cm3[1] |
| Melting point | 1,974 °C (3,585 °F; 2,247 K) (decomposes)[1][5] |
| Boiling point | 2,360 °C (4,280 °F; 2,630 K) (decomposes) |
|
Solubility in water |
0.0004% (17.8°C)[2] |
| Band gap | 3.3 eV (direct) |
|
Magnetic susceptibility (χ) |
−27.2·10−6 cm3/mol[3] |
|
Refractive index (nD) |
n1=2.013, n2=2.029[4] |
| Structure[6] | |
|
Crystal structure |
Wurtzite |
|
Space group |
C6v4—P63mc |
|
Lattice constant |
a = 3.2495 Å, c = 5.2069 Å |
|
Formula units (Z) |
2 |
|
Coordination geometry |
Tetrahedral |
| Thermochemistry[7] | |
|
Heat capacity (C) |
40.3 J·K−1mol−1 |
|
Std molar |
43.7±0.4 J·K−1mol−1 |
|
Std enthalpy of |
-350.5±0.3 kJ mol−1 |
|
Gibbs free energy (ΔfG⦵) |
-320.5 kJ mol−1 |
| Pharmacology | |
|
ATCvet code |
QA07XA91 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H400, H401 |
|
Precautionary statements |
P273, P391, P501 |
| NFPA 704 (fire diamond) |
2 1 0 |
| Flash point | 1,436 °C (2,617 °F; 1,709 K) |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
240 mg/kg (intraperitoneal, rat)[8] 7950 mg/kg (rat, oral)[9] |
|
LC50 (median concentration) |
2500 mg/m3 (mouse)[9] |
|
LCLo (lowest published) |
2500 mg/m3 (guinea pig, 3–4 h)[9] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 5 mg/m3 (fume) TWA 15 mg/m3 (total dust) TWA 5 mg/m3 (resp dust)[2] |
|
REL (Recommended) |
Dust: TWA 5 mg/m3 C 15 mg/m3
Fume: TWA 5 mg/m3 ST 10 mg/m3[2] |
|
IDLH (Immediate danger) |
500 mg/m3[2] |
| Safety data sheet (SDS) | ICSC 0208 |
| Related compounds | |
|
Other anions |
Zinc sulfide Zinc selenide Zinc telluride |
|
Other cations |
Cadmium oxide Mercury(II) oxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Zinc oxide is an inorganic compound with the formula ZnO. It is a white powder that is insoluble in water. ZnO is used as an additive in numerous materials and products including cosmetics, food supplements, rubbers, plastics, ceramics, glass, cement, lubricants,[10] paints, ointments, adhesives, sealants, pigments, foods, batteries, ferrites, fire retardants, and first-aid tapes. Although it occurs naturally as the mineral zincite, most zinc oxide is produced synthetically.[11]
ZnO is a wide-band gap semiconductor of the II-VI semiconductor group. The native doping of the semiconductor due to oxygen vacancies or zinc interstitials is n-type.[12] Other favorable properties include good transparency, high electron mobility, wide band gap, and strong room-temperature luminescence. Those properties make ZnO valuable for a variety of emerging applications: transparent electrodes in liquid crystal displays, energy-saving or heat-protecting windows, and electronics as thin-film transistors and light-emitting diodes.
Chemical properties[edit]
Pure ZnO is a white powder, but in nature it occurs as the rare mineral zincite, which usually contains manganese and other impurities that confer a yellow to red color.[13]
Crystalline zinc oxide is thermochromic, changing from white to yellow when heated in air and reverting to white on cooling.[14] This color change is caused by a small loss of oxygen to the environment at high temperatures to form the non-stoichiometric Zn1+xO, where at 800 °C, x = 0.00007.[14]
Zinc oxide is an amphoteric oxide. It is nearly insoluble in water, but it will dissolve in most acids, such as hydrochloric acid:[15]
- ZnO + 2 HCl → ZnCl2 + H2O
Solid zinc oxide will also dissolve in alkalis to give soluble zincates:
- ZnO + 2 NaOH + H2O → Na2[Zn(OH)4]
ZnO reacts slowly with fatty acids in oils to produce the corresponding carboxylates, such as oleate or stearate. When mixed with a strong aqueous solution of zinc chloride, ZnO forms cement-like products best described as zinc hydroxy chlorides.[16] This cement was used in dentistry.[17]
ZnO also forms cement-like material when treated with phosphoric acid; related materials are used in dentistry.[17] A major component of zinc phosphate cement produced by this reaction is hopeite, Zn3(PO4)2·4H2O.[18]
ZnO decomposes into zinc vapor and oxygen at around 1975 °C with a standard oxygen pressure. In a carbothermic reaction, heating with carbon converts the oxide into zinc vapor at a much lower temperature (around 950 °C).[15]
- ZnO + C → Zn(Vapor) + CO
Physical properties[edit]
Structure[edit]
Zinc oxide crystallizes in two main forms, hexagonal wurtzite[19] and cubic zincblende. The wurtzite structure is most stable at ambient conditions and thus most common. The zincblende form can be stabilized by growing ZnO on substrates with cubic lattice structure. In both cases, the zinc and oxide centers are tetrahedral, the most characteristic geometry for Zn(II). ZnO converts to the rocksalt motif at relatively high pressures about 10 GPa.[12] The many remarkable medical properties of creams containing ZnO can be explained by its elastic softness, which is characteristic of tetrahedral coordinated binary compounds close to the transition to octahedral structures.[20]
Hexagonal and zincblende polymorphs have no inversion symmetry (reflection of a crystal relative to any given point does not transform it into itself). This and other lattice symmetry properties result in piezoelectricity of the hexagonal and zincblende ZnO, and pyroelectricity of hexagonal ZnO.
The hexagonal structure has a point group 6 mm (Hermann–Mauguin notation) or C6v (Schoenflies notation), and the space group is P63mc or C6v4. The lattice constants are a = 3.25 Å and c = 5.2 Å; their ratio c/a ~ 1.60 is close to the ideal value for hexagonal cell c/a = 1.633.[21] As in most group II-VI materials, the bonding in ZnO is largely ionic (Zn2+O2−) with the corresponding radii of 0.074 nm for Zn2+ and 0.140 nm for O2−. This property accounts for the preferential formation of wurtzite rather than zinc blende structure,[22] as well as the strong piezoelectricity of ZnO. Because of the polar Zn−O bonds, zinc and oxygen planes are electrically charged. To maintain electrical neutrality, those planes reconstruct at atomic level in most relative materials, but not in ZnO – its surfaces are atomically flat, stable and exhibit no reconstruction.[23] However, studies using wurtzoid structures explained the origin of surface flatness and the absence of reconstruction at ZnO wurtzite surfaces[24] in addition to the origin of charges on ZnO planes.
Mechanical properties[edit]
ZnO is a relatively soft material with approximate hardness of 4.5 on the Mohs scale.[10] Its elastic constants are smaller than those of relevant III-V semiconductors, such as GaN. The high heat capacity and heat conductivity, low thermal expansion and high melting temperature of ZnO are beneficial for ceramics.[25] The E2 optical phonon in ZnO exhibits an unusually long lifetime of 133 ps at 10 K.[26]
Among the tetrahedrally bonded semiconductors, it has been stated that ZnO has the highest piezoelectric tensor, or at least one comparable to that of GaN and AlN.[27] This property makes it a technologically important material for many piezoelectrical applications, which require a large electromechanical coupling. Therefore, ZnO in the form of thin film has been one of the most studied resonator materials for thin-film bulk acoustic resonators.
Electrical and optical properties[edit]
ZnO has a relatively large direct band gap of ~3.3 eV at room temperature. Advantages associated with a large band gap include higher breakdown voltages, ability to sustain large electric fields, lower electronic noise, and high-temperature and high-power operation. The band gap of ZnO can further be tuned to ~3–4 eV by its alloying with magnesium oxide or cadmium oxide.[12]
Most ZnO has n-type character, even in the absence of intentional doping. Nonstoichiometry is typically the origin of n-type character, but the subject remains controversial.[28] An alternative explanation has been proposed, based on theoretical calculations, that unintentional substitutional hydrogen impurities are responsible.[29] Controllable n-type doping is easily achieved by substituting Zn with group-III elements such as Al, Ga, In or by substituting oxygen with group-VII elements chlorine or iodine.[30]
Reliable p-type doping of ZnO remains difficult. This problem originates from low solubility of p-type dopants and their compensation by abundant n-type impurities. This problem is observed with GaN and ZnSe. Measurement of p-type in «intrinsically» n-type material is complicated by the inhomogeneity of samples.[31]
Current limitations to p-doping limit electronic and optoelectronic applications of ZnO, which usually require junctions of n-type and p-type material. Known p-type dopants include group-I elements Li, Na, K; group-V elements N, P and As; as well as copper and silver. However, many of these form deep acceptors and do not produce significant p-type conduction at room temperature.[12]
Electron mobility of ZnO strongly varies with temperature and has a maximum of ~2000 cm2/(V·s) at 80 K.[32] Data on hole mobility are scarce with values in the range 5–30 cm2/(V·s).[33]
ZnO discs, acting as a varistor, are the active material in most surge arresters.[34][35]
Zinc oxide is noted for its strongly nonlinear optical properties, especially in bulk. The nonlinearity of ZnO nanoparticles can be fine-tuned according to their size.[36]
Production[edit]
For industrial use, ZnO is produced at levels of 105 tons per year[13] by three main processes:[25]
Indirect process[edit]
In the indirect or French process, metallic zinc is melted in a graphite crucible and vaporized at temperatures above 907 °C (typically around 1000 °C). Zinc vapor reacts with the oxygen in the air to give ZnO, accompanied by a drop in its temperature and bright luminescence. Zinc oxide particles are transported into a cooling duct and collected in a bag house. This indirect method was popularized by LeClaire (France) in 1844 and therefore is commonly known as the French process. Its product normally consists of agglomerated zinc oxide particles with an average size of 0.1 to a few micrometers. By weight, most of the world’s zinc oxide is manufactured via French process.
Direct process[edit]
The direct or American process starts with diverse contaminated zinc composites, such as zinc ores or smelter by-products. The zinc precursors are reduced (carbothermal reduction) by heating with a source of carbon such as anthracite to produce zinc vapor, which is then oxidized as in the indirect process. Because of the lower purity of the source material, the final product is also of lower quality in the direct process as compared to the indirect one.
Wet chemical process[edit]
A small amount of industrial production involves wet chemical processes, which start with aqueous solutions of zinc salts, from which zinc carbonate or zinc hydroxide is precipitated. The solid precipitate is then calcined at temperatures around 800 °C.
Laboratory synthesis[edit]
The red and green colors of these synthetic ZnO crystals result from different concentrations of oxygen vacancies.[37]
Numerous specialised methods exist for producing ZnO for scientific studies and niche applications. These methods can be classified by the resulting ZnO form (bulk, thin film, nanowire), temperature («low», that is close to room temperature or «high», that is T ~ 1000 °C), process type (vapor deposition or growth from solution) and other parameters.
Large single crystals (many cubic centimeters) can be grown by the gas transport (vapor-phase deposition), hydrothermal synthesis,[23][37][38] or melt growth.[5] However, because of the high vapor pressure of ZnO, growth from the melt is problematic. Growth by gas transport is difficult to control, leaving the hydrothermal method as a preference.[5] Thin films can be produced by chemical vapor deposition, metalorganic vapour phase epitaxy, electrodeposition, pulsed laser deposition, sputtering, sol–gel synthesis, atomic layer deposition, spray pyrolysis, etc.
Ordinary white powdered zinc oxide can be produced in the laboratory by electrolyzing a solution of sodium bicarbonate with a zinc anode. Zinc hydroxide and hydrogen gas are produced. The zinc hydroxide upon heating decomposes to zinc oxide:
- Zn + 2 H2O → Zn(OH)2 + H2
- Zn(OH)2 → ZnO + H2O
ZnO nanostructures[edit]
Nanostructures of ZnO can be synthesized into a variety of morphologies including nanowires, nanorods, tetrapods, nanobelts, nanoflowers, nanoparticles etc. Nanostructures can be obtained with most above-mentioned techniques, at certain conditions, and also with the vapor–liquid–solid method.[23][39][40] The synthesis is typically carried out at temperatures of about 90 °C, in an equimolar aqueous solution of zinc nitrate and hexamine, the latter providing the basic environment. Certain additives, such as polyethylene glycol or polyethylenimine, can improve the aspect ratio of the ZnO nanowires.[41] Doping of the ZnO nanowires has been achieved by adding other metal nitrates to the growth solution.[42] The morphology of the resulting nanostructures can be tuned by changing the parameters relating to the precursor composition (such as the zinc concentration and pH) or to the thermal treatment (such as the temperature and heating rate).[43]
Aligned ZnO nanowires on pre-seeded silicon, glass, and gallium nitride substrates have been grown using aqueous zinc salts such as zinc nitrate and zinc acetate in basic environments.[44] Pre-seeding substrates with ZnO creates sites for homogeneous nucleation of ZnO crystal during the synthesis. Common pre-seeding methods include in-situ thermal decomposition of zinc acetate crystallites, spincoating of ZnO nanoparticles and the use of physical vapor deposition methods to deposit ZnO thin films.[45][46] Pre-seeding can be performed in conjunction with top down patterning methods such as electron beam lithography and nanosphere lithography to designate nucleation sites prior to growth. Aligned ZnO nanowires can be used in dye-sensitized solar cells and field emission devices.[47][48]
History[edit]
Zinc compounds were probably used by early humans, in processed[11] and unprocessed forms, as a paint or medicinal ointment, but their composition is uncertain. The use of pushpanjan, probably zinc oxide, as a salve for eyes and open wounds, is mentioned in the Indian medical text the Charaka Samhita, thought to date from 500 BC or before.[49] Zinc oxide ointment is also mentioned by the Greek physician Dioscorides (1st century AD).[50] Galen suggested treating ulcerating cancers with zinc oxide,[51] as did Avicenna in his The Canon of Medicine. It is used as an ingredient in products such as baby powder and creams against diaper rashes, calamine cream, anti-dandruff shampoos, and antiseptic ointments.[52]
The Romans produced considerable quantities of brass (an alloy of zinc and copper) as early as 200 BC by a cementation process where copper was reacted with zinc oxide.[53] The zinc oxide is thought to have been produced by heating zinc ore in a shaft furnace. This liberated metallic zinc as a vapor, which then ascended the flue and condensed as the oxide. This process was described by Dioscorides in the 1st century AD.[54] Zinc oxide has also been recovered from zinc mines at Zawar in India, dating from the second half of the first millennium BC.[50]
From the 12th to the 16th century zinc and zinc oxide were recognized and produced in India using a primitive form of the direct synthesis process. From India, zinc manufacture moved to China in the 17th century. In 1743, the first European zinc smelter was established in Bristol, United Kingdom.[55] Around 1782 Louis-Bernard Guyton de Morveau proposed replacing lead white with zinc oxide.[56]
The main usage of zinc oxide (zinc white) was in paints and as an additive to ointments. Zinc white was accepted as a pigment in oil paintings by 1834 but it did not mix well with oil. This problem was solved by optimizing the synthesis of ZnO. In 1845, LeClaire in Paris was producing the oil paint on a large scale, and by 1850, zinc white was being manufactured throughout Europe. The success of zinc white paint was due to its advantages over the traditional white lead: zinc white is essentially permanent in sunlight, it is not blackened by sulfur-bearing air, it is non-toxic and more economical. Because zinc white is so «clean» it is valuable for making tints with other colors, but it makes a rather brittle dry film when unmixed with other colors. For example, during the late 1890s and early 1900s, some artists used zinc white as a ground for their oil paintings. All those paintings developed cracks over the years.[57]
In recent times, most zinc oxide was used in the rubber industry to resist corrosion. In the 1970s, the second largest application of ZnO was photocopying. High-quality ZnO produced by the «French process» was added to photocopying paper as a filler. This application was soon displaced by titanium.[25]
Applications[edit]
The applications of zinc oxide powder are numerous, and the principal ones are summarized below. Most applications exploit the reactivity of the oxide as a precursor to other zinc compounds. For material science applications, zinc oxide has high refractive index, high thermal conductivity, binding, antibacterial and UV-protection properties. Consequently, it is added into materials and products including plastics, ceramics, glass, cement,[58] rubber, lubricants,[10] paints, ointments, adhesive, sealants, concrete manufacturing, pigments, foods, batteries, ferrites, fire retardants, etc.[59]
Rubber manufacture[edit]
Between 50% and 60% of ZnO use is in the rubber industry.[60] Zinc oxide along with stearic acid is used in the vulcanization of rubber[25][61] ZnO additives also protect rubber from fungi (see medical applications) and UV light.
Ceramic industry[edit]
Ceramic industry consumes a significant amount of zinc oxide, in particular in ceramic glaze and frit compositions. The relatively high heat capacity, thermal conductivity and high temperature stability of ZnO coupled with a comparatively low coefficient of expansion are desirable properties in the production of ceramics. ZnO affects the melting point and optical properties of the glazes, enamels, and ceramic formulations. Zinc oxide as a low expansion, secondary flux improves the elasticity of glazes by reducing the change in viscosity as a function of temperature and helps prevent crazing and shivering. By substituting ZnO for BaO and PbO, the heat capacity is decreased and the thermal conductivity is increased. Zinc in small amounts improves the development of glossy and brilliant surfaces. However, in moderate to high amounts, it produces matte and crystalline surfaces. With regard to color, zinc has a complicated influence.[60]
Medicine[edit]
Zinc oxide as a mixture with about 0.5% iron(III) oxide (Fe2O3) is called calamine and is used in calamine lotion. Two minerals, zincite and hemimorphite, have been historically called calamine. When mixed with eugenol, a ligand, zinc oxide eugenol is formed, which has applications as a restorative and prosthodontic in dentistry.[17][62]
Reflecting the basic properties of ZnO,[further explanation needed] fine particles of the oxide have deodorizing and antibacterial[63] properties and for that reason are added into materials including cotton fabric, rubber, oral care products,[64][65] and food packaging.[66][67] Enhanced antibacterial action of fine particles compared to bulk material is not exclusive to ZnO and is observed for other materials, such as silver.[68] This property results from the increased surface area of the fine particles.
Zinc oxide is used in mouthwash products and toothpastes as an anti-bacterial agent proposed to prevent plaque and tartar formation,[69] and to control bad breath by reducing the volatile gases and volatile sulfur compounds (VSC) in the mouth.[70] Along with zinc oxide or zinc salts, these products also commonly contain other active ingredients, such as cetylpyridinium chloride,[71] xylitol,[72] hinokitiol,[73] essential oils and plant extracts.[74][75]
Zinc oxide is widely used to treat a variety of skin conditions, including atopic dermatitis, contact dermatitis, itching due to eczema, diaper rash and acne.[76] Zinc oxide is also often added into sunscreens.[76]
It is used in products such as baby powder and barrier creams to treat diaper rashes, calamine cream, anti-dandruff shampoos, and antiseptic ointments.[52][77] It is also a component in tape (called «zinc oxide tape») used by athletes as a bandage to prevent soft tissue damage during workouts.[78]
Zinc oxide can be used[79] in ointments, creams, and lotions to protect against sunburn and other damage to the skin caused by ultraviolet light (see sunscreen). It is the broadest spectrum UVA and UVB absorber[80][81] that is approved for use as a sunscreen by the U.S. Food and Drug Administration (FDA),[82] and is completely photostable.[83] When used as an ingredient in sunscreen, zinc oxide blocks both UVA (320–400 nm) and UVB (280–320 nm) rays of ultraviolet light. Zinc oxide and the other most common physical sunscreen, titanium dioxide, are considered to be nonirritating, nonallergenic, and non-comedogenic.[84] Zinc from zinc oxide is, however, slightly absorbed into the skin.[85]
Many sunscreens use nanoparticles of zinc oxide (along with nanoparticles of titanium dioxide) because such small particles do not scatter light and therefore do not appear white. The nanoparticles are not absorbed into the skin more than regular-sized zinc oxide particles are,[86] and are only absorbed into the outermost layer of the skin but not into the body.[86]
Zinc oxide nanoparticles can enhance the antibacterial activity of ciprofloxacin. It has been shown that nano ZnO that has an average size between 20 nm and 45 nm can enhance the antibacterial activity of ciprofloxacin against Staphylococcus aureus and Escherichia coli in vitro. The enhancing effect of this nanomaterial is concentration dependent against all test strains. This effect may be due to two reasons. First, zinc oxide nanoparticles can interfere with NorA protein, which is developed for conferring resistance in bacteria and has pumping activity that mediates the effluxing of hydrophilic fluoroquinolones from a cell. Second, zinc oxide nanoparticles can interfere with Omf protein, which is responsible for the permeation of quinolone antibiotics into the cell.[87]
Cigarette filters[edit]
Zinc oxide is a component of cigarette filters. A filter consisting of charcoal impregnated with zinc oxide and iron oxide removes significant amounts of hydrogen cyanide (HCN) and hydrogen sulfide (H2S) from tobacco smoke without affecting its flavor.[59]
Food additive[edit]
Zinc oxide is added to many food products, including breakfast cereals, as a source of zinc,[88] a necessary nutrient. (Zinc sulfate is also used for the same purpose.) Some prepackaged foods also include trace amounts of ZnO even if it is not intended as a nutrient.
Zinc oxide was linked to dioxin contamination in pork exports in the 2008 Chilean pork crisis. The contamination was found to be due to dioxin contaminated zinc oxide used in pig feed.[89]
Pigment[edit]
Zinc oxide (zinc white) is used as a pigment in paints and is more opaque than lithopone, but less opaque than titanium dioxide.[11] It is also used in coatings for paper. Chinese white is a special grade of zinc white used in artists’ pigments.[90] The use of zinc white as a pigment in oil painting started in the middle of 18th century.[91] It has partly replaced the poisonous lead white and was used by painters such as Böcklin, Van Gogh,[92] Manet, Munch and others. It is also a main ingredient of mineral makeup (CI 77947).[93]
UV absorber[edit]
Micronized and nano-scale zinc oxide provides strong protection against UVA and UVB ultraviolet radiation, and are consequently used in sunscreens,[94] and also in UV-blocking sunglasses for use in space and for protection when welding, following research by scientists at Jet Propulsion Laboratory (JPL).[95]
Coatings[edit]
Paints containing zinc oxide powder have long been utilized as anticorrosive coatings for metals. They are especially effective for galvanized iron. Iron is difficult to protect because its reactivity with organic coatings leads to brittleness and lack of adhesion. Zinc oxide paints retain their flexibility and adherence on such surfaces for many years.[59]
ZnO highly n-type doped with aluminium, gallium, or indium is transparent and conductive (transparency ~90%, lowest resistivity ~10−4 Ω·cm[96]). ZnO:Al coatings are used for energy-saving or heat-protecting windows. The coating lets the visible part of the spectrum in but either reflects the infrared (IR) radiation back into the room (energy saving) or does not let the IR radiation into the room (heat protection), depending on which side of the window has the coating.[13]
Plastics, such as polyethylene naphthalate (PEN), can be protected by applying zinc oxide coating. The coating reduces the diffusion of oxygen through PEN.[97] Zinc oxide layers can also be used on polycarbonate in outdoor applications. The coating protects polycarbonate from solar radiation, and decreases its oxidation rate and photo-yellowing.[98]
Corrosion prevention in nuclear reactors[edit]
Zinc oxide depleted in 64Zn (the zinc isotope with atomic mass 64) is used in corrosion prevention in nuclear pressurized water reactors. The depletion is necessary, because 64Zn is transformed into radioactive 65Zn under irradiation by the reactor neutrons.[99]
Methane reforming[edit]
Zinc oxide (ZnO) is used as a pretreatment step to remove hydrogen sulfide (H2S) from natural gas following hydrogenation of any sulfur compounds prior to a methane reformer, which can poison the catalyst. At temperatures between about 230–430 °C (446–806 °F), H2S is converted to water by the following reaction:[100]
- H2S + ZnO → H2O + ZnS
Potential applications[edit]
Electronics[edit]
Photograph of an operating ZnO UV laser diode and the corresponding device structure.[101]
ZnO has wide direct band gap (3.37 eV or 375 nm at room temperature). Therefore, its most common potential applications are in laser diodes and light emitting diodes (LEDs).[103] Moreover, ultrafast nonlinearities and photoconductive functions have been reported in ZnO.[104] Some optoelectronic applications of ZnO overlap with that of GaN, which has a similar band gap (~3.4 eV at room temperature). Compared to GaN, ZnO has a larger exciton binding energy (~60 meV, 2.4 times of the room-temperature thermal energy), which results in bright room-temperature emission from ZnO. ZnO can be combined with GaN for LED-applications. For instance, a transparent conducting oxide layer and ZnO nanostructures provide better light outcoupling.[105] Other properties of ZnO favorable for electronic applications include its stability to high-energy radiation and its ability to be patterned by wet chemical etching.[106] Radiation resistance[107] makes ZnO a suitable candidate for space applications. ZnO is the most promising candidate in the field of random lasers to produce an electronically pumped UV laser source.
The pointed tips of ZnO nanorods result in a strong enhancement of an electric field. Therefore, they can be used as field emitters.[108]
Aluminium-doped ZnO layers are used as transparent electrodes. The components Zn and Al are much cheaper and less toxic compared to the generally used indium tin oxide (ITO). One application which has begun to be commercially available is the use of ZnO as the front contact for solar cells or of liquid crystal displays.[109]
Transparent thin-film transistors (TTFT) can be produced with ZnO. As field-effect transistors, they do not need a p–n junction,[110] thus avoiding the p-type doping problem of ZnO. Some of the field-effect transistors even use ZnO nanorods as conducting channels.[111]
Zinc oxide nanorod sensor[edit]
Zinc oxide nanorod sensors are devices detecting changes in electric current passing through zinc oxide nanowires due to adsorption of gas molecules. Selectivity to hydrogen gas was achieved by sputtering palladium clusters on the nanorod surface. The addition of palladium appears to be effective in the catalytic dissociation of hydrogen molecules into atomic hydrogen, increasing the sensitivity of the sensor device. The sensor detects hydrogen concentrations down to 10 parts per million at room temperature, whereas there is no response to oxygen.[112][113] ZnO have been used as immobilization layers in immunosensors enabling the distribution of antibodies across the entire region probed by the measuring electric field applied to the microelectrodes.[114]
Piezoelectricity[edit]
The piezoelectricity in textile fibers coated in ZnO have been shown capable of fabricating «self-powered nanosystems» with everyday mechanical stress from wind or body movements.[115][116]
In 2008 the Center for Nanostructure Characterization at the Georgia Institute of Technology reported producing an electricity generating device (called flexible charge pump generator) delivering alternating current by stretching and releasing zinc oxide nanowires. This mini-generator creates an oscillating voltage up to 45 millivolts, converting close to seven percent of the applied mechanical energy into electricity. Researchers used wires with lengths of 0.2–0.3 mm and diameters of three to five micrometers, but the device could be scaled down to smaller size.[117]
ZnO as anode of Li-ion battery
In form of a thin film ZnO has been demonstrated in miniaturised high frequency thin film resonators, sensors and filters.
Li-ion battery and supercapacitors[edit]
ZnO is a promising anode material for lithium-ion battery because it is cheap, biocompatible, and environmentally friendly. ZnO has a higher theoretical capacity (978 mAh g−1) than many other transition metal oxides such as CoO (715 mAh g−1), NiO (718 mAh g−1) and CuO (674 mAh g−1).[118] ZnO is also used as an electrode in supercapacitors.[119]
Safety[edit]
As a food additive, zinc oxide is on the U.S. FDA’s list of generally recognized as safe, or GRAS, substances.[120]
Zinc oxide itself is non-toxic; it is hazardous, however, to inhale zinc oxide fumes, such as generated when zinc or zinc alloys are melted and oxidized at high temperature. This problem occurs while melting alloys containing brass because the melting point of brass is close to the boiling point of zinc.[121] Exposure to zinc oxide in the air, which also occurs while welding galvanized (zinc plated) steel, can result in a malady called metal fume fever. For this reason, typically galvanized steel is not welded, or the zinc is removed first.[122][dubious – discuss]
In sunscreen formulations containing zinc oxide and other UV absorbers, zinc oxide was found to cause photodegradation of small-molecule UV absorbers, which exhibited toxicity in embryonic zebrafish assays.[123]
See also[edit]
- Depleted zinc oxide
- Zinc oxide nanoparticle
- Gallium(III) nitride
- List of inorganic pigments
- Zinc
- Zinc oxide eugenol
- Zinc peroxide
- Zinc smelting
- Zinc–air battery
- Zinc–zinc oxide cycle
- ZnO nanostructures
References[edit]
- ^ a b c d Haynes, p. 4.100
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0675». National Institute for Occupational Safety and Health (NIOSH).
- ^ Haynes, p. 4.136
- ^ Haynes, p. 4.144
- ^ a b c Takahashi K, Yoshikawa A, Sandhu A (2007). Wide bandgap semiconductors: fundamental properties and modern photonic and electronic devices. Springer. p. 357. ISBN 978-3-540-47234-6.
- ^ Haynes, p. 4.152
- ^ Haynes, pp. 5.3, 5.16
- ^ Zinc oxide. Chem.sis.nlm.nih.gov. Retrieved on 2015-11-17.
- ^ a b c «Zinc oxide». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c Battez AH, González R, Viesca JL, Fernández JE, Fernández JD, Machado A, Chou R, Riba J (2008). «CuO, ZrO2 and ZnO nanoparticles as antiwear additive in oil lubricants». Wear. 265 (3–4): 422–428. doi:10.1016/j.wear.2007.11.013.
- ^ a b c De Liedekerke M (2006). «2.3. Zinc Oxide (Zinc White): Pigments, Inorganic, 1». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a20_243.pub2.
- ^ a b c d Özgür Ü, Alivov YI, Liu C, Teke A, Reshchikov M, Doğan S, Avrutin VC, Cho SJ, Morkoç AH (2005). «A comprehensive review of ZnO materials and devices». Journal of Applied Physics. 98 (4): 041301–041301–103. Bibcode:2005JAP….98d1301O. doi:10.1063/1.1992666.
- ^ a b c Klingshirn C (April 2007). «ZnO: material, physics and applications». ChemPhysChem. 8 (6): 782–803. doi:10.1002/cphc.200700002. PMID 17429819.
- ^ a b Wiberg E, Holleman AF (2001). Inorganic Chemistry. Elsevier. ISBN 978-0-12-352651-9.
- ^ a b Greenwood NN, Earnshaw A (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Nicholson JW (1998). «The chemistry of cements formed between zinc oxide and aqueous zinc chloride». Journal of Materials Science. 33 (9): 2251–2254. Bibcode:1998JMatS..33.2251N. doi:10.1023/A:1004327018497. S2CID 94700819.
- ^ a b c Ferracane JL (2001). Materials in Dentistry: Principles and Applications. Lippincott Williams & Wilkins. pp. 70, 143. ISBN 978-0-7817-2733-4.
- ^ Park CK, Silsbee MR, Roy DM (1998). «Setting reaction and resultant structure of zinc phosphate cement in various orthophosphoric acid cement-forming liquids». Cement and Concrete Research. 28 (1): 141–150. doi:10.1016/S0008-8846(97)00223-8.
- ^ Fierro JL (2006). Metal Oxides: Chemistry & Applications. CRC Press. p. 182. ISBN 978-0824723712.
- ^ Phillips JC (1970). «Ionicity of the Chemical Bond in Crystals». Reviews of Modern Physics. 42 (3): 317–356. Bibcode:1970RvMP…42..317P. doi:10.1103/RevModPhys.42.317.
- ^ Rossler U, ed. (1999). Landolt-Bornstein, New Series, Group III. Vol. 17B, 22, 41B. Springer, Heidelberg.
- ^ Klingshirn CF, Waag A, Hoffmann A, Geurts J (2010). Zinc Oxide: From Fundamental Properties Towards Novel Applications. Springer. pp. 9–10. ISBN 978-3-642-10576-0.
- ^ a b c Baruah S, Dutta J (February 2009). «Hydrothermal growth of ZnO nanostructures». Science and Technology of Advanced Materials. 10 (1): 013001. Bibcode:2009STAdM..10a3001B. doi:10.1088/1468-6996/10/1/013001. PMC 5109597. PMID 27877250.
- ^ Abdulsattar MA (2015). «Capped ZnO (3, 0) nanotubes as building blocks of bare and H passivated wurtzite ZnO nanocrystals». Superlattices and Microstructures. 85: 813–819. Bibcode:2015SuMi…85..813A. doi:10.1016/j.spmi.2015.07.015.
- ^ a b c d Porter F (1991). Zinc Handbook: Properties, Processing, and Use in Design. CRC Press. ISBN 978-0-8247-8340-2.
- ^ Millot M, Tena-Zaera R, Munoz-Sanjose V, Broto JM, Gonzalez J (2010). «Anharmonic effects in ZnO optical phonons probed by Raman spectroscopy». Applied Physics Letters. 96 (15): 152103. Bibcode:2010ApPhL..96o2103M. doi:10.1063/1.3387843. hdl:10902/23620.
- ^ Posternak M, Resta R, Baldereschi A (October 1994). «Ab initio study of piezoelectricity and spontaneous polarization in ZnO». Physical Review B. 50 (15): 10715–10721. Bibcode:1994PhRvB..5010715D. doi:10.1103/PhysRevB.50.10715. PMID 9975171.
- ^ Look DC, Hemsky JW, Sizelove JR (1999). «Residual Native Shallow Donor in ZnO». Physical Review Letters. 82 (12): 2552–2555. Bibcode:1999PhRvL..82.2552L. doi:10.1103/PhysRevLett.82.2552. S2CID 53476471.
- ^ Janotti A, Van de Walle CG (January 2007). «Hydrogen multicentre bonds». Nature Materials. 6 (1): 44–7. Bibcode:2007NatMa…6…44J. doi:10.1038/nmat1795. PMID 17143265.
- ^ Kato H, Sano M, Miyamoto K, Yao T (2002). «Growth and characterization of Ga-doped ZnO layers on a-plane sapphire substrates grown by molecular beam epitaxy». Journal of Crystal Growth. 237–239: 538–543. Bibcode:2002JCrGr.237..538K. doi:10.1016/S0022-0248(01)01972-8.
- ^ Ohgaki T, Ohashi N, Sugimura S, Ryoken H, Sakaguchi I, Adachi Y, Haneda H (2008). «Positive Hall coefficients obtained from contact misplacement on evident n-type ZnO films and crystals». Journal of Materials Research. 23 (9): 2293–2295. Bibcode:2008JMatR..23.2293O. doi:10.1557/JMR.2008.0300.
- ^ Wagner P, Helbig R (1974). «Halleffekt und anisotropie der beweglichkeit der elektronen in ZnO». Journal of Physics and Chemistry of Solids. 35 (3): 327–335. Bibcode:1974JPCS…35..327W. doi:10.1016/S0022-3697(74)80026-0.
- ^ Ryu YR, Lee TS, White HW (2003). «Properties of arsenic-doped p-type ZnO grown by hybrid beam deposition». Applied Physics Letters. 83 (1): 87. Bibcode:2003ApPhL..83…87R. doi:10.1063/1.1590423.
- ^
René Smeets, Lou van der Sluis, Mirsad Kapetanovic, David F. Peelo, Anton Janssen.
«Switching in Electrical Transmission and Distribution Systems».
2014.
p. 316. - ^
Mukund R. Patel.
«Introduction to Electrical Power and Power Electronics».
2012.
p. 247. - ^ Irimpan L, Krishnan Deepthy BA, Nampoori VPN, Radhakrishnan P (2008). «Size-dependent enhancement of nonlinear optical properties in nanocolloids of ZnO» (PDF). Journal of Applied Physics. 103 (3): 033105–033105–7. Bibcode:2008JAP…103c3105I. doi:10.1063/1.2838178.
- ^ a b Schulz D, Ganschow S, Klimm D, Struve K (2008). «Inductively heated Bridgman method for the growth of zinc oxide single crystals». Journal of Crystal Growth. 310 (7–9): 1832–1835. Bibcode:2008JCrGr.310.1832S. doi:10.1016/j.jcrysgro.2007.11.050.
- ^ Baruah S, Thanachayanont C, Dutta J (April 2008). «Growth of ZnO nanowires on nonwoven polyethylene fibers». Science and Technology of Advanced Materials. 9 (2): 025009. Bibcode:2008STAdM…9b5009B. doi:10.1088/1468-6996/9/2/025009. PMC 5099741. PMID 27877984.
- ^ Miao L, Ieda Y, Tanemura S, Cao YG, Tanemura M, Hayashi Y, Toh S, Kaneko K (2007). «Synthesis, microstructure and photoluminescence of well-aligned ZnO nanorods on Si substrate». Science and Technology of Advanced Materials. 8 (6): 443–447. Bibcode:2007STAdM…8..443M. doi:10.1016/j.stam.2007.02.012.
- ^ Xu S, Wang ZL (2011). «One-dimensional ZnO nanostructures: Solution growth and functional properties». Nano Res. 4 (11): 1013–1098. CiteSeerX 10.1.1.654.3359. doi:10.1007/s12274-011-0160-7. S2CID 137014543.
- ^ Zhou Y, Wu W, Hu G, Wu H, Cui S (2008). «Hydrothermal synthesis of ZnO nanorod arrays with the addition of polyethyleneimine». Materials Research Bulletin. 43 (8–9): 2113–2118. doi:10.1016/j.materresbull.2007.09.024.
- ^ Cui J, Zeng Q, Gibson UJ (2006-04-15). «Synthesis and magnetic properties of Co-doped ZnO nanowires». Journal of Applied Physics. 99 (8): 08M113. Bibcode:2006JAP….99hM113C. doi:10.1063/1.2169411.
- ^ Elen K, Van den Rul H, Hardy A, Van Bael MK, D’Haen J, Peeters R, et al. (February 2009). «Hydrothermal synthesis of ZnO nanorods: a statistical determination of the significant parameters in view of reducing the diameter». Nanotechnology. 20 (5): 055608. Bibcode:2009Nanot..20e5608E. doi:10.1088/0957-4484/20/5/055608. PMID 19417355. S2CID 206056816.
- ^ Greene LE, Law M, Goldberger J, Kim F, Johnson JC, Zhang Y, et al. (July 2003). «Low-temperature wafer-scale production of ZnO nanowire arrays». Angewandte Chemie. 42 (26): 3031–4. doi:10.1002/anie.200351461. PMID 12851963.
- ^ Wu W (2009). «Effects of Seed Layer Characteristics on the Synthesis of ZnO Nanowires». Journal of the American Ceramic Society. 92 (11): 2718–2723. doi:10.1111/j.1551-2916.2009.03022.x.
- ^ Greene LE, Law M, Tan DH, Montano M, Goldberger J, Somorjai G, Yang P (July 2005). «General route to vertical ZnO nanowire arrays using textured ZnO seeds». Nano Letters. 5 (7): 1231–6. Bibcode:2005NanoL…5.1231G. doi:10.1021/nl050788p. PMID 16178216.
- ^ Hua G (2008). «Fabrication of ZnO nanowire arrays by cycle growth in surfactantless aqueous solution and their applications on dye-sensitized solar cells». Materials Letters. 62 (25): 4109–4111. doi:10.1016/j.matlet.2008.06.018.
- ^ Lee JH, Chung YW, Hon MH, Leu C (2009-05-07). «Density-controlled growth and field emission property of aligned ZnO nanorod arrays». Applied Physics A. 97 (2): 403–408. Bibcode:2009ApPhA..97..403L. doi:10.1007/s00339-009-5226-y. S2CID 97205678.
- ^ Craddock PT (1998). «Zinc in India». 2000 years of zinc and brass. British Museum. p. 27. ISBN 978-0-86159-124-4.
- ^ a b Craddock PT (2008). «Mining and Metallurgy, chapter 4». In Oleson JP (ed.). The Oxford Handbook of Engineering and Technology in the Classical World. Oxford University Press. pp. 111–112. ISBN 978-0-19-518731-1.
- ^ Winchester DJ, Winchester DP, Hudis CA, Norton L (2005). Breast Cancer (Atlas of Clinical Oncology). PMPH USA. p. 3. ISBN 978-1550092721.
- ^ a b Harding FJ (2007). Breast Cancer: Cause – Prevention – Cure. Tekline Publishing. p. 83. ISBN 978-0-9554221-0-2.
- ^ «Zinc». Encyclopædia Britannica. 10 March 2009.
- ^ Craddock PT (2009). «The origins and inspirations of zinc smelting». Journal of Materials Science. 44 (9): 2181–2191. Bibcode:2009JMatS..44.2181C. doi:10.1007/s10853-008-2942-1. S2CID 135523239.
- ^ General Information of Zinc from the National Institute of Health, WHO, and International Zinc Association. Retrieved 10 March 2009
- ^ «Zinc White».
- ^ «Zinc white: History of use». Pigments through the ages. webexhibits.org.
- ^ Sanchez-Pescador R, Brown JT, Roberts M, Urdea MS (February 1988). «The nucleotide sequence of the tetracycline resistance determinant tetM from Ureaplasma urealyticum». Nucleic Acids Research. 16 (3): 1216–7. doi:10.1093/nar/16.3.1216. PMC 334766. PMID 3344217.
- ^ a b c Ambica Dhatu Private Limited. Applications of ZnO. Archived December 19, 2019, at the Wayback Machine Access date January 25, 2009.
- ^ a b Moezzi A, McDonagh AM, Cortie MB (2012). «Review: Zinc oxide particles: Synthesis, properties and applications». Chemical Engineering Journal. 185–186: 1–22. doi:10.1016/j.cej.2012.01.076.
- ^ Brown HE (1957). Zinc Oxide Rediscovered. New York: The New Jersey Zinc Company.
- ^ van Noort R (2002). Introduction to Dental Materials (2d ed.). Elsevier Health Sciences. ISBN 978-0-7234-3215-9.
- ^ Padmavathy N, Vijayaraghavan R (July 2008). «Enhanced bioactivity of ZnO nanoparticles-an antimicrobial study». Science and Technology of Advanced Materials. 9 (3): 035004. Bibcode:2008STAdM…9c5004P. doi:10.1088/1468-6996/9/3/035004. PMC 5099658. PMID 27878001.
- ^ ten Cate JM (February 2013). «Contemporary perspective on the use of fluoride products in caries prevention». British Dental Journal. 214 (4): 161–7. doi:10.1038/sj.bdj.2013.162. PMID 23429124.
- ^ Rošin-Grget K, Peroš K, Sutej I, Bašić K (November 2013). «The cariostatic mechanisms of fluoride». Acta Medica Academica. 42 (2): 179–88. doi:10.5644/ama2006-124.85. PMID 24308397.
- ^ Li Q, Chen S, Jiang W (2007). «Durability of nano ZnO antibacterial cotton fabric to sweat». Journal of Applied Polymer Science. 103: 412–416. doi:10.1002/app.24866.
- ^ Saito M (1993). «Antibacterial, Deodorizing, and UV Absorbing Materials Obtained with Zinc Oxide (ZnO) Coated Fabrics». Journal of Industrial Textiles. 23 (2): 150–164. doi:10.1177/152808379302300205. S2CID 97726945.
- ^ Akhavan O, Ghaderi E (February 2009). «Enhancement of antibacterial properties of Ag nanorods by electric field». Science and Technology of Advanced Materials. 10 (1): 015003. Bibcode:2009STAdM..10a5003A. doi:10.1088/1468-6996/10/1/015003. PMC 5109610. PMID 27877266.
- ^ Lynch, Richard J.M. (August 2011). «Zinc in the mouth, its interactions with dental enamel and possible effects on caries; a review of the literature». International Dental Journal. 61: 46–54. doi:10.1111/j.1875-595X.2011.00049.x. PMC 9374993. PMID 21762155.
- ^ Cortelli, José Roberto; Barbosa, Mônica Dourado Silva; Westphal, Miriam Ardigó (August 2008). «Halitosis: a review of associated factors and therapeutic approach». Brazilian Oral Research. 22 (suppl 1): 44–54. doi:10.1590/S1806-83242008000500007. PMID 19838550.
- ^ «SmartMouth Clinical DDS Activated Mouthwash». smartmouth.com.
- ^ «Oxyfresh». Oxyfresh.com.
- ^ «Dr ZinX». drzinx.com.
- ^ Steenberghe, Daniel Van; Avontroodt, Pieter; Peeters, Wouter; Pauwels, Martine; Coucke, Wim; Lijnen, An; Quirynen, Marc (September 2001). «Effect of Different Mouthrinses on Morning Breath». Journal of Periodontology. 72 (9): 1183–1191. doi:10.1902/jop.2000.72.9.1183. PMID 11577950.
- ^ Harper, D. Scott; Mueller, Laura J.; Fine, James B.; Gordon, Jeffrey; Laster, Larry L. (June 1990). «Clinical Efficacy of a Dentifrice and Oral Rinse Containing Sanguinaria Extract and Zinc Chloride During 6 Months of Use». Journal of Periodontology. 61 (6): 352–358. doi:10.1902/jop.1990.61.6.352. PMID 2195152.
- ^ a b Gupta, Mrinal; Mahajan, Vikram K.; Mehta, Karaninder S.; Chauhan, Pushpinder S. (2014). «Zinc Therapy in Dermatology: A Review». Dermatology Research and Practice. 2014: 709152. doi:10.1155/2014/709152. PMC 4120804. PMID 25120566.
- ^ British National Formulary (2008). «Section 13.2.2 Barrier Preparations».
- ^ Hughes G, McLean NR (December 1988). «Zinc oxide tape: a useful dressing for the recalcitrant finger-tip and soft-tissue injury». Archives of Emergency Medicine. 5 (4): 223–7. doi:10.1136/emj.5.4.223. PMC 1285538. PMID 3233136.
- ^ Dhatu A (10 October 2019). «Zinc oxide as the chemical for skin care». Retrieved 22 October 2019.
- ^ «Critical Wavelength & Broad Spectrum UV Protection». mycpss.com. Retrieved 15 April 2018.
- ^ More BD (2007). «Physical sunscreens: on the comeback trail». Indian Journal of Dermatology, Venereology and Leprology. 73 (2): 80–5. doi:10.4103/0378-6323.31890. PMID 17456911.
- ^ «Sunscreen». U.S. Food and Drug Administration.
- ^ Mitchnick MA, Fairhurst D, Pinnell SR (January 1999). «Microfine zinc oxide (Z-cote) as a photostable UVA/UVB sunblock agent». Journal of the American Academy of Dermatology. 40 (1): 85–90. doi:10.1016/S0190-9622(99)70532-3. PMID 9922017.
- ^ «What to Look for in a Sunscreen». The New York Times. June 10, 2009.
- ^ Agren MS (2009). «Percutaneous absorption of zinc from zinc oxide applied topically to intact skin in man». Dermatologica. 180 (1): 36–9. doi:10.1159/000247982. PMID 2307275.
- ^ a b Burnett ME, Wang SQ (April 2011). «Current sunscreen controversies: a critical review». Photodermatology, Photoimmunology & Photomedicine. 27 (2): 58–67. doi:10.1111/j.1600-0781.2011.00557.x. PMID 21392107. S2CID 29173997.
- ^ Banoee M, Seif S, Nazari ZE, Jafari-Fesharaki P, Shahverdi HR, Moballegh A, et al. (May 2010). «ZnO nanoparticles enhanced antibacterial activity of ciprofloxacin against Staphylococcus aureus and Escherichia coli». Journal of Biomedical Materials Research Part B: Applied Biomaterials. 93 (2): 557–61. doi:10.1002/jbm.b.31615. PMID 20225250.
- ^ Quaker cereals content. quakeroats.com
- ^ Kim M, Kim DG, Choi SW, Guerrero P, Norambuena J, Chung GS (February 2011). «Formation of polychlorinated dibenzo-p-dioxins/dibenzofurans (PCDD/Fs) from a refinery process for zinc oxide used in feed additives: a source of dioxin contamination in Chilean pork». Chemosphere. 82 (9): 1225–9. Bibcode:2011Chmsp..82.1225K. doi:10.1016/j.chemosphere.2010.12.040. PMID 21216436.
- ^ St Clair K (2016). The Secret Lives of Colour. London: John Murray. p. 40. ISBN 9781473630819. OCLC 936144129.
- ^ Kuhn, H. (1986) «Zinc White», pp. 169–186 in Artists’ Pigments. A Handbook of Their History and Characteristics, Vol. 1. L. Feller (ed.). Cambridge University Press, London. ISBN 978-0521303743
- ^ Vincent van Gogh, ‘Wheatfield with Cypresses, 1889, pigment analysis at ColourLex
- ^ Bouchez C. «The Lowdown on Mineral Makeup». WebMD. Retrieved January 25, 2009.
- ^ US Environment Protection Agency: Sunscreen What are the active Ingredients in Sunscreen – Physical Ingredients:»The physical compounds titanium dioxide and zinc oxide reflect, scatter, and absorb both UVA and UVB rays.» A table lists them as providing extensive physical protection against UVA and UVB
- ^ Look Sharp While Seeing Sharp. NASA Scientific and Technical Information (2006). Retrieved 17 October 2009. JPL scientists developed UV-protective sunglasses using dyes and «zinc oxide, which absorbs ultraviolet light»
- ^ Schmidtmende L, MacManusdriscoll J (2007). «ZnO – nanostructures, defects, and devices». Materials Today. 10 (5): 40–48. doi:10.1016/S1369-7021(07)70078-0.
- ^ Guedri-Knani L, Gardette JL, Jacquet M, Rivaton A (2004). «Photoprotection of poly(ethylene-naphthalate) by zinc oxide coating». Surface and Coatings Technology. 180–181: 71–75. doi:10.1016/j.surfcoat.2003.10.039.
- ^ Moustaghfir A, Tomasella E, Rivaton A, Mailhot B, Jacquet M, Gardette JL, Cellier J (2004). «Sputtered zinc oxide coatings: structural study and application to the photoprotection of the polycarbonate». Surface and Coatings Technology. 180–181: 642–645. doi:10.1016/j.surfcoat.2003.10.109.
- ^ Cowan RL (2001). «BWR water chemistry?a delicate balance». Nuclear Energy. 40 (4): 245–252. doi:10.1680/nuen.40.4.245.39338.
- ^ Robinson, Victor S. (1978) «Process for desulfurization using particulate zinc oxide shapes of high surface area and improved strength» U.S. Patent 4,128,619
- ^ Liu XY, Shan CX, Zhu H, Li BH, Jiang MM, Yu SF, Shen DZ (September 2015). «Ultraviolet Lasers Realized via Electrostatic Doping Method». Scientific Reports. 5: 13641. Bibcode:2015NatSR…513641L. doi:10.1038/srep13641. PMC 4555170. PMID 26324054.
- ^ Zheng ZQ, Yao JD, Wang B, Yang GW (June 2015). «Light-controlling, flexible and transparent ethanol gas sensor based on ZnO nanoparticles for wearable devices». Scientific Reports. 5: 11070. Bibcode:2015NatSR…511070Z. doi:10.1038/srep11070. PMC 4468465. PMID 26076705.
- ^ Bakin A, El-Shaer A, Mofor AC, Al-Suleiman M, Schlenker E, Waag A (2007). «ZnMgO-ZnO quantum wells embedded in ZnO nanopillars: Towards realisation of nano-LEDs». Physica Status Solidi C. 4 (1): 158–161. Bibcode:2007PSSCR…4..158B. doi:10.1002/pssc.200673557.
- ^ Torres-Torres, C.; Castro-Chacón, J. H.; Castañeda, L.; Rojo, R. Rangel; Torres-Martínez, R.; Tamayo-Rivera, L.; Khomenko, A. V. (2011-08-15). «Ultrafast nonlinear optical response of photoconductive ZnO films with fluorine nanoparticles». Optics Express. 19 (17): 16346–16355. Bibcode:2011OExpr..1916346T. doi:10.1364/OE.19.016346. ISSN 1094-4087. PMID 21934998.
- ^ Bakin A (2010). «ZnO – GaN Hybrid Heterostructures as Potential Cost Efficient LED Technology». Proceedings of the IEEE. 98 (7): 1281–1287. doi:10.1109/JPROC.2009.2037444. S2CID 20442190.
- ^ Look D (2001). «Recent advances in ZnO materials and devices». Materials Science and Engineering B. 80 (1–3): 383–387. doi:10.1016/S0921-5107(00)00604-8.
- ^ Kucheyev SO, Williams JS, Jagadish C, Zou J, Evans C, Nelson AJ, Hamza AV (2003-03-31). «Ion-beam-produced structural defects in ZnO» (PDF). Physical Review B. 67 (9): 094115. Bibcode:2003PhRvB..67i4115K. doi:10.1103/physrevb.67.094115.
- ^ Li YB, Bando Y, Golberg D (2004). «ZnO nanoneedles with tip surface perturbations: Excellent field emitters». Applied Physics Letters. 84 (18): 3603. Bibcode:2004ApPhL..84.3603L. doi:10.1063/1.1738174.
- ^ Oh BY, Jeong MC, Moon TH, Lee W, Myoung JM, Hwang JY, Seo DS (2006). «Transparent conductive Al-doped ZnO films for liquid crystal displays». Journal of Applied Physics. 99 (12): 124505–124505–4. Bibcode:2006JAP….99l4505O. doi:10.1063/1.2206417.
- ^ Nomura K, Ohta H, Ueda K, Kamiya T, Hirano M, Hosono H (May 2003). «Thin-film transistor fabricated in single-crystalline transparent oxide semiconductor». Science. 300 (5623): 1269–72. Bibcode:2003Sci…300.1269N. doi:10.1126/science.1083212. PMID 12764192. S2CID 20791905.
- ^ Heo YW, Tien LC, Kwon Y, Norton DP, Pearton SJ, Kang BS, Ren F (2004). «Depletion-mode ZnO nanowire field-effect transistor». Applied Physics Letters. 85 (12): 2274. Bibcode:2004ApPhL..85.2274H. doi:10.1063/1.1794351.
- ^ Wang HT, Kang BS, Ren F, Tien LC, Sadik PW, Norton DP, Pearton SJ, Lin J (2005). «Hydrogen-selective sensing at room temperature with ZnO nanorods». Applied Physics Letters. 86 (24): 243503. Bibcode:2005ApPhL..86x3503W. doi:10.1063/1.1949707.
- ^ Tien LC, Sadik PW, Norton DP, Voss LF, Pearton SJ, Wang HT, et al. (2005). «Hydrogen sensing at room temperature with Pt-coated ZnO thin films and nanorods». Applied Physics Letters. 87 (22): 222106. Bibcode:2005ApPhL..87v2106T. doi:10.1063/1.2136070.
- ^ Sanguino, P.; Monteiro, Tiago; Bhattacharyya, S. R.; Dias, C. J.; Igreja, Rui; Franco, Ricardo (1 December 2014). «ZnO nanorods as immobilization layers for interdigitated capacitive immunosensors». Sensors and Actuators B: Chemical. 204: 211–217. doi:10.1016/j.snb.2014.06.141. ISSN 0925-4005.
- ^ Keim B (February 13, 2008). «Piezoelectric Nanowires Turn Fabric Into Power Source». Wired News. CondéNet. Archived from the original on February 15, 2008.
- ^ Qin Y, Wang X, Wang ZL (February 2008). «Microfibre-nanowire hybrid structure for energy scavenging». Nature. 451 (7180): 809–13. Bibcode:2008Natur.451..809Q. doi:10.1038/nature06601. PMID 18273015. S2CID 4411796.
- ^ «New Small-scale Generator Produces Alternating Current By Stretching Zinc Oxide Wires». Science Daily. November 10, 2008.
- ^ Zheng X, Shen G, Wang C, Li Y, Dunphy D, Hasan T, et al. (April 2017). «Bio-inspired Murray materials for mass transfer and activity». Nature Communications. 8: 14921. Bibcode:2017NatCo…814921Z. doi:10.1038/ncomms14921. PMC 5384213. PMID 28382972.
- ^ Sreejesh, M.; Dhanush, S.; Rossignol, F.; Nagaraja, H. S. (2017-04-15). «Microwave assisted synthesis of rGO/ZnO composites for non-enzymatic glucose sensing and supercapacitor applications». Ceramics International. 43 (6): 4895–4903. doi:10.1016/j.ceramint.2016.12.140. ISSN 0272-8842.
- ^ «Zinc oxide». Database of Select Committee on GRAS Substances (SCOGS) Reviews. U.S. Food and Drug Administration. Archived from the original on 16 April 2014. Retrieved 2009-08-03.
- ^ Gray T. «The Safety of Zinc Casting». The Wooden Periodic Table Table.
- ^ Calvert JB. «Introduction to Zinc and its Uses». Archived from the original on 2006-08-27.
- ^ Ginzburg AL, Blackburn RS, Santillan C, Truong L, Tanguay RL, Hutchison JE (2021). «Zinc oxide-induced changes to sunscreen ingredient efficacy and toxicity under UV irradiation». Photochem Photobiol Sci. 20 (10): 1273–1285. doi:10.1007/s43630-021-00101-2. PMC 8550398. PMID 34647278.
Cited sources[edit]
- Haynes WM, ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
Reviews[edit]
- Özgür Ü, Alivov YI, Liu C, Teke A, Reshchikov M, Doğan S, et al. (2005). «A comprehensive review of ZnO materials and devices». Journal of Applied Physics. 98 (4): 041301–041301–103. Bibcode:2005JAP….98d1301O. doi:10.1063/1.1992666.
- Bakin A, Waag A (29 March 2011). «ZnO Epitaxial Growth». In Bhattacharya P, Fornari R, Kamimura H (eds.). Comprehensive Semiconductor Science and Technology 6 Volume Encyclopaedia. Elsevier. ISBN 978-0-444-53143-8.
- Baruah S, Dutta J (February 2009). «Hydrothermal growth of ZnO nanostructures». Science and Technology of Advanced Materials. 10 (1): 013001. Bibcode:2009STAdM..10a3001B. doi:10.1088/1468-6996/10/1/013001. PMC 5109597. PMID 27877250.
- Janisch R (2005). «Transition metal-doped TiO 2 and ZnO—present status of the field». Journal of Physics: Condensed Matter. 17 (27): R657–R689. Bibcode:2005JPCM…17R.657J. doi:10.1088/0953-8984/17/27/R01. S2CID 118610509.
- Heo YW (2004). «ZnO nanowire growth and devices». Materials Science and Engineering: R: Reports. 47 (1–2): 1–47. doi:10.1016/j.mser.2004.09.001.
- Klingshirn C (2007). «ZnO: From basics towards applications». Physica Status Solidi B. 244 (9): 3027–3073. Bibcode:2007PSSBR.244.3027K. doi:10.1002/pssb.200743072. S2CID 97461963.
- Klingshirn C (April 2007). «ZnO: material, physics and applications». ChemPhysChem. 8 (6): 782–803. doi:10.1002/cphc.200700002. PMID 17429819.
- Lu JG, Chang P, Fan Z (2006). «Quasi-one-dimensional metal oxide materials—Synthesis, properties and applications». Materials Science and Engineering: R: Reports. 52 (1–3): 49–91. CiteSeerX 10.1.1.125.7559. doi:10.1016/j.mser.2006.04.002.
- Xu S, Wang ZL (2011). «One-dimensional ZnO nanostructures: Solution growth and functional properties». Nano Research. 4 (11): 1013–1098. CiteSeerX 10.1.1.654.3359. doi:10.1007/s12274-011-0160-7. S2CID 137014543.
- Xu S, Wang ZL (2011). «Oxide nanowire arrays for light-emitting diodes and piezoelectric energy harvesters». Pure and Applied Chemistry. 83 (12): 2171–2198. doi:10.1351/PAC-CON-11-08-17. S2CID 18770461.
External links[edit]
- Zincite properties
- International Chemical Safety Card 0208.
- NIOSH Pocket Guide to Chemical Hazards.
- Zinc oxide in the Pesticide Properties DataBase (PPDB)
- Zinc white pigment at ColourLex
| Оксид цинка | |
|---|---|
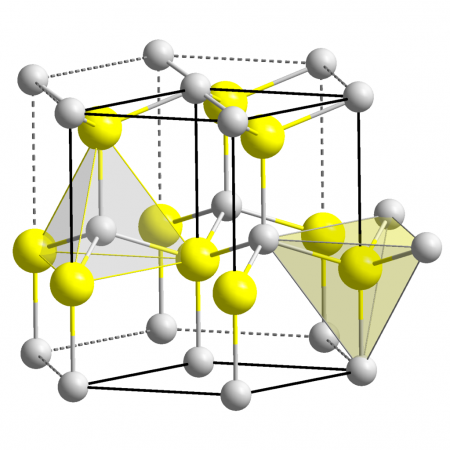 |
|
 |
|
| Систематическое наименование |
Цинка оксид |
| Хим. формула | ZnO |
| Состояние | твёрдое |
| Молярная масса | 81,408 г/моль |
| Плотность | 5,61 г/см³ |
| Температура | |
| • плавления | 3587 ± 1 °F |
| • сублимации | 1800 °C |
| Мол. теплоёмк. | 40,28 Дж/(моль·К) |
| Энтальпия | |
| • образования | -350,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Показатель преломления | 2,015 и 2,068 |
| Кристаллическая структура | гексагональная сингония, a = 0,32495 нм, c = 0,52069 нм, z = 2 |
| ГОСТ | ГОСТ 10262-73 |
| Рег. номер CAS | 1314-13-2 |
| PubChem | 14806 |
| Рег. номер EINECS | 215-222-5 |
| SMILES |
O=[Zn] |
| InChI |
1S/O.Zn XLOMVQKBTHCTTD-UHFFFAOYSA-N |
| RTECS | ZH4810000 |
| ChEBI | ZH4810000 |
| ChemSpider | 14122 |
| Предельная концентрация | аэрозоль в воздухе рабочей зоны 0,5 мг/м3 в атмосферном воздухе 0,05 мг/м3 |
| Токсичность | Токсичен, при вдыхании пыли вызывает литейную лихорадку |
| Фразы риска (R) | R50/53 |
| Фразы безопасности (S) | S60, S61 |
| Краткие характер. опасности (H) | H410 |
| Меры предостор. (P) | P273 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Оксид цинка (окись цинка) ZnO — бесцветный кристаллический порошок, нерастворимый в воде, желтеющий при нагревании и сублимирующийся при 1800 °C.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Нахождение в природе
- 3 Получение
- 4 Применение
- 4.1 В химической промышленности
- 4.2 В электронике
- 4.3 В медицине
- 5 Безопасность и токсичность
Свойства
Физические свойства
- Теплопроводность: 54 Вт/(м·К).
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ. Естественное смещение стехиометрического отношения в сторону обогащения кислородом придаёт ему электронный тип проводимости.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещённой зоны и сдвигом края в спектре поглощения из УФ-области в синюю область видимого спектра.
Химические свойства
Химически оксид цинка амфотерен — реагирует с кислотами с образованием соответствующих солей цинка, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксоцинкаты (например, Na2[Zn(OH)4], Ba2[Zn(OH)6] и др.):
- [Zn(OH)3]− + OH− ⟶ [Zn(OH)4]2−
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
- ZnO + 4NH3 + H2O ⟶ [Zn(NH3)4](OH)2
При сплавлении со щелочами и оксидами некоторых металлов оксид цинка образует цинкаты:
- ZnO + 2NaOH ⟶ Na2ZnO2 + H2O
- ZnO + CoO ⟶ CoZnO2
При сплавлении с оксидом бора и диоксидом кремния оксид цинка образует стеклообразные бораты и силикаты:
- ZnO + B2O3 ⟶ Zn(BO2)2
- ZnO + SiO2 ⟶ ZnSiO3
При смешивании порошка оксида цинка с концентрированным раствором хлорида цинка образуется быстро (за 2—3 минуты) твердеющая масса — цинковый цемент.
Нахождение в природе
Известен природный минерал цинкит, состоящий в основном из оксида цинка.
Получение
- Сжиганием паров цинка в кислороде («французский процесс»).
- Термическим разложением некоторых солей цинка:
- ацетата Zn(CH3COO)2;
- гидроксида Zn(OH)2;
- карбоната ZnCO3;
- нитрата Zn(NO3)2.
- Окислительным обжигом сульфида ZnS.
- С помощью гидротермальный синтез
- Извлечением из пылей и шламов заводов чёрной металлургии, особенно перерабатывающих металлолом (он содержит значительную долю оцинкованного железа).
Применение
Оксид цинка широко применяют в химической, фармацевтической промышленности. Применяется в составе зубных паст и цементов в терапевтической стоматологии, в косметических кремах для загара и косметических процедурах, в производстве в качестве наполнителя резины, искусственной кожи и резинотехнических изделий. Применяется в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка применяют при производстве стекла и керамики.
В химической промышленности
- Активатор вулканизации некоторых типов каучуков.
- Вулканизирующий агент хлоропреновых каучуков.
- Катализатор получения метанола.
- Белый пигмент при производстве красок и эмалей (в настоящее время (2007 г.) вытесняется нетоксичным диоксидом титана TiO2).
- Наполнитель и пигмент в производстве:
- резины;
- пластмасс;
- бумаги;
- парфюмерных и косметических средств.
- Добавка к кормам для животных.
- В производстве стекла и красок на основе жидкого стекла;
- Как один из компонентов преобразователя ржавчины.
Известно также, что оксид цинка обладает фотокаталитической активностью, что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время не используется.
В электронике
Оксид цинка применяется для производства варисторов, которые используются в современных ограничителях перенапряжений (ОПН) взамен морально устаревших газонаполненных разрядников.
Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров. На основе оксида цинка создан светодиод голубого цвета.
Тонкие плёнки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры.
Также оксид цинка входит в состав теплопроводных паст, например, пасты КПТ-8.
В медицине
В медицине используется в качестве компонента лекарственных средств наружного применения, используемых в дерматологии. Обладает противовоспалительным, подсушивающим, адсорбирующим, вяжущим и антисептическим действием.
Применяют в виде присыпки, мази, пасты, линимента. Является одним из компонентов ряда комплексных дерматологических и косметических препаратов, таких как «Цинковая мазь», «Паста Лассара» и пр.
Фармакологическое действие обусловлено тем, что оксид цинка образует альбуминаты и денатурирует белки. При нанесении на поражённую поверхность уменьшает явления экссудации, воспаления и раздражения тканей, образует защитный барьер от действия раздражающих факторов.
Может применяться при дерматите, в том числе пелёночном, опрелостях, потнице, поверхностных ранах и ожогах (солнечные ожоги, порезы, царапины), язвенных поражениях кожи (трофических язвах), пролежнях, экземе в стадии обострения, простом герпесе, стрептодермии.
Безопасность и токсичность
Соединение малотоксично, но его пыль вредна для органов дыхания, ПДК в воздухе рабочих помещений — 0,5 мг/м³ (по ГОСТ 10262-73). Пыль соединения может образовываться при термической обработке изделий из латуни.
Химическое название
Цинка оксид
Химические свойства
Цинка оксид (окись цинка) – это кристаллический порошок без цвета, который не растворим в воде, этиловом спирте. Хорошо растворяется в разведенной минеральной кислоте и уксусной кислоте. Под действием высокой температуры желтеет (из-за смещения края в спектре поглощения до синей области), сублимируется при 1800 градусах Цельсия. Молярная масса = 81,4 грамма на моль. Формула Оксида Цинка: ZnO. Обладает свойством поглощать углекислый газ из воздуха.
С чем реагирует вещество? По химическим свойствам – это амфотерное соединение, реагирует с кислотами, образуя соли, вступает в реакцию с кислотными и основными оксидами, а с растворами щелочей образует комплексные соединения. Оксид растворяется в р-ре аммиака в воде, при этом образуется комплексный аммиакат. Средство вступает в реакцию с оксидами металлов и щелочью, образуя цинкаты; с оксидом кремния и бора – силикаты и бораты. Оксид Цинка не реагирует с медью, кислородом, водой. Химическое соединение получают из природного минерала цинкита, при сжигании паров Zn в кислороде; при термическом разложении гидроксида, карбоната и нитрата Zn; с помощью гидротермального синтеза и оксилительного обжига сульфида.
Средство нашло широкое применение в фармацевтической и химической промышленности; при создании зубной пасты, цемента в стоматологии; вещество добавляют в состав косметики и кремов для загара; применяют в нефтеперерабатывающей, шинной и лакокрасочной промышленности; используют во время производства керамики и стекла, в электронике; добавляют в корм для животных; используют для преобразования ржавчины. Вещество слабо токсично. При вдыхании пыли с оксидом может развиться литейная лихорадка.
Фармакологическое действие
Антисептическое, подсушивающее, вяжущее, адсорбирующее.
Фармакодинамика и фармакокинетика
Вещество обладает способностью при нанесении на поверхность кожи и раневую поверхность денатурировать белки и образовывать альбуминаты. Средство значительно уменьшает выраженность процесса экксудации, снимает воспаление и раздражение. Образует барьерную пленку на коже, которая защищает ее от действия неблагоприятных факторов, обладает абсорбирующим эффектом.
Лекарство используют в виде присыпок, паст и мазей, линимента.
Показания к применению
Применение окиси цинка:
- при дерматитах, от потницы и опрелостей;
- для лечения поверхностных ран и ожогов, порезов, ссадин, царапин;
- при лечении пролежней, трофических язв, экземы, герпеса, стрептодермии.
Противопоказания
Окись Цинка нельзя использовать на наличии аллергии на активный компонент.
Побочные действия
Редко возникают зуд, аллергические высыпания на коже, гиперемия.
Инструкция по применению (Способ и дозировка)
Цинка Оксид используют местно, наружно. В зависимости от лекарственной формы и болезни применяют разные схемы лечения.
Передозировка
Нет сведений о передозировке. Возможно развитие аллергических реакций.
Взаимодействие
Окись Цинка несовместима с ихтаммолом в составе мази.
Особые указания
Препараты на основе Цинка Оксида следует применять в соответствии с рекомендациями врача.
Нельзя допускать попадания лекарства в глаза.
Детям
Средство можно использовать при лечении пациентов всех возрастных категорий.
При беременности и лактации
Вещество разрешено к использованию во время беременности и при лактации.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Торговые названия средства: Циндол, Цинковая мазь, Паста Лассара, Цинка окись, Деситин, Цинковая паста. Является компонентом следующих средств: Судокрем, Кетоцин, Валискин, Паста Теймурова, Салицилово-Цинковая мазь и другие.
Отзывы
Отзывы о применении вещества оставляют в основном девушки, желающие избавится от акне. Лечебный эффект наступает достаточно быстро, средство хорошо переносится, при соблюдении рекомендаций по применению не пересушивает кожу. На форумах также активно обсуждается вред Оксида Цинка в косметике. Следует отметить, что данное вещество вреда коже не приносит, а напротив, улучшает ее состояние, обладает антиоксидантным действием, защищает от воздействия неблагоприятных факторов. Поэтому при грамотном применении средства, оно редко вызывает аллергические или другие побочные реакции.
Цена Оксида Цинка, где купить
Купить Оксид Цинка в аптеке можно в виде Цинковой Мази, стоимостью 30 рублей за 50 граммовый флакон. Приблизительная цена на мазь Деситин, 40% составляет 230 рублей за 57 тубу.
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Цинка оксид
- Брутто формула
- Фармакологическая группа вещества Цинка оксид
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Цинка оксид
- Противопоказания
- Способ применения и дозы
- Меры предосторожности
- Торговые названия с действующим веществом Цинка оксид
Структурная формула
Русское название
Цинка оксид
Английское название
Zinc oxide
Латинское название вещества Цинка оксид
Zinci oxydum (род. Zinci oxydi)
Фармакологическая группа вещества Цинка оксид
Фармакологическое действие
—
антисептическое, вяжущее, подсушивающее.
Характеристика
Противовоспалительное средство для местного применения. Белый или белый с желтоватым оттенком аморфный порошок без запаха. Поглощает из воздуха углекислый газ. Практически нерастворим в воде и этаноле, растворим в разведенных минеральных кислотах и уксусной кислоте, в растворах щелочей.
Фармакология
Образует альбуминаты и денатурирует белки. При нанесении на пораженную поверхность кожи уменьшает выраженность экссудативных процессов, устраняет местные проявления воспаления и раздражения; обладает адсорбирующим действием, образует защитное покрытие на коже, которое уменьшает воздействие на нее раздражающих факторов. Применяют наружно в виде присыпки, мази, пасты, линимента.
Применение вещества Цинка оксид
Дерматит, в т.ч пеленочный дерматит (лечение и профилактика), опрелость, потница; поверхностные раны и ожоги (в т.ч. солнечные ожоги, порезы, царапины), язвенные поражения кожи (в т.ч. трофические язвы), пролежни; экзема в стадии обострения, простой герпес, стрептодермия.
Противопоказания
Гиперчувствительность.
Способ применения и дозы
Наружно. Наносят на очищенную и высушенную кожу 4–6 раз в день. При лечении ожогов и ран возможно использование под повязку. Для профилактики пеленочной сыпи у детей мазь наносят на участки тела, находящиеся в длительном контакте с мокрым бельем.
Меры предосторожности
Не следует допускать попадания в глаза.
Торговые названия с действующим веществом Цинка оксид
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Присыпка детская |
от 58.00 до 101.00 |
| Циндол |
от 46.00 до 115.00 |
| Цинковая мазь |
от 25.00 до 2615.00 |
| Цинковая паста |
от 54.00 до 54.00 |
Оксид, или окись цинка — неорганическое вещество, востребованное в разных 
Свойства
Белый мелкий кристаллический порошок, не растворимый в воде. Возгоняется при t +1800 °C, плавится при 2000 °C. Обладает полупроводниковыми свойствами, низкой теплопроводностью, поглощает ультрафиолет. Тонкие пленки обладают пьезоэлектрическими качествами. При нагревании становится желтым, после остывания опять белеет. Не горит. При контакте с кожей не вызывает раздражения, наоборот, обладает противовоспалительным и обеззараживающим действием.
Цинк окись — амфотерный оксид, вступающий в реакцию и с кислотами, и со щелочами. Реакция с кислотами приводит к получению солей, со щелочами — комплексных соединений гидроксоцинкатов. Взаимодействует с водородом, углеродом, раствором аммиака, угарным газом, метаном, карбидом кальция, ферросилицием. В результате сплавления с оксидами и гидроксидами металлов получаются цинкаты, а если сплавлять реагент с оксидом бора или оксидом кремния, то образуются борат и силикат цинка.
Меры предосторожности

Хранить реагент следует в герметичной таре (полиэтиленовые и бумажные мешки или пакеты; стальные, картонные, фанерные бочки и контейнеры), так как доступ к углекислоте и влаге из воздуха может привести к перекристаллизации в углекислый цинк. Если из-за длительного неправильного хранения оксид цинка все же превратился в углекислый цинк, то ему можно вернуть первоначальные свойства, прокалив его. Окись цинка хранят в крытых, сухих складах без доступа солнечного света. Допустимый диапазон температур хранения — от -40 до +40 °С.
Применение оксида цинка
— Наполнитель и краситель для резины, полимеров, бумаги; вулканизирующий агент 
— Используется при получении стекла и красок на базе жидкого стекла; составов-преобразователей ржавчины; фотокаталитических обеззараживающих покрытий стен и потолков в больницах; искусственной кожи, подошвенных резин.
— Наполнитель кремов, мазей, пудр и присыпок в косметологии и фармацевтике. Ингредиент кремов для загара, зубных паст.
— Минеральная добавка для животных кормов.
— Сырье в стекольной и керамической индустрии.
— В радиоэлектронной промышленности на основе окиси цинка изготавливают варисторы (полупроводниковые элементы, проводимость которых зависит от напряжения), люминофоры, голубые светодиоды, порошковые лазеры, тонкие пленки для сенсоров.
— В металлургии — для изготовления электрокабеля.
— В медицине применяется как антисептик, подсушивающее, вяжущее, адсорбирующее вещество. Его добавляют во многие наружные дерматологические средства для лечения экзем, пролежней, детской потницы, простого герпеса, ран, порезов, ожогов, язв.
— В стоматологии изготавливают абразивные материалы, добавляют в стоматологический цемент. В хирургии используются резинотехнические изделия на основе оксида цинка.
В нашем интернет-магазине вы можете купить оксид цинка высокого качества по доступной цене. Есть доставка и возможность самовывоза. Покупать у нас удобно и выгодно!
- ZnO
-
Оксид цинка Общие Систематическое наименование Цинка оксид Химическая формула ZnO Отн. молек. масса N а. е. м. Молярная масса 81.41 г/моль Физические свойства Плотность вещества 5.606 г/см³ Состояние (ст. усл.) твёрдое Термические свойства Температура плавления 1985 °C Температура кипения N °C Температура разложения N °C Молярная теплоёмкость (ст. усл.) N Дж/(моль·К) Химические свойства pKa N Растворимость в воде 0,16 г/100 мл Классификация номер CAS [1314-13-2] Окси́д ци́нка (окись цинка, цинковые белила) — химическое соединение цинка с кислородом, имеющее формулу ZnO.
Белый, желтеющий при нагревании порошок. Кристалл при комнатной температуре бесцветен.
-
См. также: Оксид цинка (лекарственное средство)
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 1.3 Кристаллические свойства
- 1.4 Пьезоэлектрические свойства
- 2 Нанокристаллический оксид цинка
- 3 Получение
- 4 Применение
- 5 Влияние на человека
- 6 Литература
Свойства
Физические свойства
- Молекулярный вес: 81,37
- Температура плавления:
- при давлении 52 атмосферы — около 2000° C
- при атмосферном давлении и 1950° C — возгоняется
- Плотность:
- в порошке 5,5…5,6 г/см³
- в виде кристалла 5,7 г/см³.
- Растворимость в воде:
- при 18° C — 0,00052 г/100 мл
- при 29° C — 1,6·10-4 г/100 мл
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещенной зоны и сдвигом края в спектре поглощения из УФ-области в синюю.
Химические свойства
- Амфотерен — реагирует с кислотами с образованием солей
- Растворяется в:
- щелочах
- водном растворе аммиака
Кристаллические свойства
Пьезоэлектрические свойства
Нанокристаллический оксид цинка
Получение
- природный минерал цинкит
- сжиганием паров цинка в кислороде («французский процесс»)
- термическим разложением соединений:
- ацетата Zn(CH3COO)2
- гидроксида Zn(OH)2
- карбоната ZnCO3
- нитрата Zn(NO3)2
- окислительным обжигом сульфида ZnS
- гидротермальный синтез[1]
Применение
- активатор вулканизации некоторых каучуков
- вулканизирующий агент хлоропреновых каучуков
- катализатор синтеза метанола
- белый пигмент при производстве красок и эмалей (в настоящее время (2007) вытеснен нетоксичной двуокисью титана TiO2)
- наполнитель и пигмент в производстве:
- резины
- пластмасс
- бумаги
- парфюмерии и косметики
- В медицине в виде присыпок и в составе мазей как антисептик. См. статью: Оксид цинка (лекарственное средство).
- добавка к кормам для животных
- в производстве стекла и красок на основе жидкого стекла
Известно также, что оксид цинка обладает фотокаталитической активностью, что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время не используется.
Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров. На основе оксида цинка создали светодиод голубого цвета. Тонкие пленки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры.
Свойства оксида цинка обуславливают его широко применение в фармацевтической промышленности. Оксид цинка нашел широкое применение в создании абразивных зубных паст и цементов в терапевтической стоматологии, в кремах для загара и косметических процедурах, в производстве электрокабеля, искусственной кожи и резинотехнических изделий. Кроме того, применение распространено в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка участвует процессе производства стекла и керамики.
Влияние на человека
Слабо токсичен, ПДК в воздухе рабочих помещений — 6 мг/м³. Пыль может образовываться при обжиге изделий из латуни.
Литература
- ↑ S. Baruah and J. Dutta «Review: Hydrothermal growth of ZnO nanostructures» Sci. Technol. Adv. Mater. 10 (2009) 013001 скачать бесплатно
- В.И.Перельман Краткий справочник химика. — М.-Л.: Химия, 1964.
- статья «Цинка окись» в БСЭ
-
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «ZnO» в других словарях:
-
ZNO — steht für: Flugplatz Hildesheim in Niedersachsen als IATA Code ZnO steht für: Zinkoxid, eine chemische Verbindung aus Zink und Sauerstoff Diese Seite ist eine Begriffsklärung zur Unterscheidung mehrerer … Deutsch Wikipedia
-
ZnO — steht für: Flugplatz Hildesheim in Niedersachsen als IATA Code ZnO steht für: Zinkoxid, eine chemische Verbindung aus Zink und Sauerstoff … Deutsch Wikipedia
-
ZnO — Zinc inc (z[i^][ng]k), n. [G. zink, probably akin to zinn tin: cf. F. zinc, from the German. Cf. {Tin}.] (Chem.) An abundant element of the magnesium cadmium group, extracted principally from the minerals zinc blende, smithsonite, calamine, and… … The Collaborative International Dictionary of English
-
ZnO — Oxyde de zinc Oxyde de zinc poudre d oxyde de zinc Général Nom IUPAC Oxyde de zinc … Wikipédia en Français
-
znȍjav — prid. 〈odr. ī〉 kome je izbio znoj na koži; oznojen, znojan … Veliki rječnik hrvatskoga jezika
-
znȍjavōst — ž svojstvo onoga što je znojavo i stanje onoga koji je znojav … Veliki rječnik hrvatskoga jezika
-
ZNO — Zinc Oxide (Academic & Science » Chemistry) * Zinio Reader Magazine file (Computing » File Extensions) … Abbreviations dictionary
-
ZNO — abbr. Zinc Oxide … Dictionary of abbreviations
-
ZnO — aeronaut. abbr. Zinc Oxide … United dictionary of abbreviations and acronyms
-
brı̏žno — pril., {{c=1}}v. {{ref}}brižljivo{{/ref}} … Veliki rječnik hrvatskoga jezika
Оксид цинка, характеристика, свойства и получение, химические реакции.
Оксид цинка – неорганическое вещество, имеет химическую формулу ZnO.
Краткая характеристика оксида цинка
Физические свойства оксида цинка
Получение оксида цинка
Химические свойства оксида цинка
Химические реакции оксида цинка
Применение и использование оксида цинка
Краткая характеристика оксида цинка:
Оксид цинка – неорганическое вещество белого цвета.
Так как валентность цинка равна двум, то оксид цинка содержит один атом кислорода и один атом цинка.
Химическая формула оксида цинка ZnO.
При нагревании желтеет. При температуре 1800 оС сублимируется.
В воде не растворяется.
Оксид цинка относится к малотоксичным веществам. Его пыль вредна для органов дыхания.
Физические свойства оксида цинка:
| Наименование параметра: | Значение: |
| Химическая формула | ZnO |
| Синонимы и названия иностранном языке | zinc oxide (англ.)
цинкит (рус.) цинковые белила (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые гексагональные кристаллы |
| Цвет | белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 5610 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 5,61 |
| Температура сублимации, °C | 1800 |
| Температура плавления, °C | 1975 |
| Молярная масса, г/моль | 81,408 |
| Теплопроводность, Вт/(м·К) | 54 |
* Примечание:
— нет данных.
Получение оксида цинка:
В природе встречается в виде минерала цинкита, который практически полностью состоит из оксида цинка.
Оксид цинка также получают в результате следующих химических реакций:
- 1. сжиганием цинка в кислороде:
2Zn + О2 → 2ZnО (t > 250 oC).
- 2. путем термического разложения гидроксида цинка:
Zn(OH)2 → ZnO + H2О (t = 100-250 oC).
- 3. путем термического разложения карбоната цинка:
ZnCO3 → ZnO + CO2 (t = 200-300 oC).
- 4. путем термического разложения нитрата цинка:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2 (t = 300-500 oC).
- 5. путем окислительного обжига сульфида цинка:
2ZnS + 3O2 → 2ZnO + 2SO2 (t = 800-1000 oC).
- 6. путем термического разложения ацетата цинка.
Химические свойства оксида цинка. Химические реакции оксида цинка:
Оксид цинка относится к амфотерным оксидам. Он проявляет в зависимости от условий либо основные, либо кислотные свойства.
Химические свойства оксида цинка аналогичны свойствам амфотерных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида цинка с углеродом:
ZnO + C → Zn + CO (t = 1200-1300 oC).
В результате реакции образуется цинк и оксид углерода (II). Таким образом, цинк восстанавливается из оксида цинка коксом или углем при температуре 1200-1300 oC.
2. реакция оксида цинка с оксидом кремния:
ZnО + SiО2 → ZnSiО3 (t = 1200-1400 oC),
2ZnО + SiО2 → Zn2SiО4 (t = 900-1000 oC).
Оксид кремния является кислотным оксидом. В результате реакции в первом случае образуется соль – метасиликат цинка, во втором – ортосиликат цинка.
3. реакция оксида цинка с оксидом серы:
ZnО + SО2 → ZnSО3.
Оксид серы является кислотным оксидом. В результате реакции образуется соль – сульфит цинка.
4. реакция оксида цинка с оксидом бора:
ZnО + B2О3 → Zn(BО2)2.
В результате реакции образуется соль – борат цинка.
5. реакция оксида цинка с оксидом углерода:
ZnО + СО → Zn + CO2 (t = 700 oC).
В результате реакции образуется цинк и углекислый газ.
6. реакция оксида цинка с оксидом бария:
ZnО + BaО → BaZnО2 (t = 1100 oC).
В результате реакции образуется соль – цинкат бария.
7. реакция оксида цинка с оксидом хрома:
ZnО + CrО3 → ZnCrО4.
В результате реакции образуется соль – хромат цинка.
8. реакция оксида цинка с оксидом железа:
ZnО + Fe2О3 → Fe2ZnО4 (t = 800-1000 oC),
ZnО + Fe2О3 → ZnFe2О4 (t = 800-1000 oC).
В результате реакции образуется оксид железа-цинка.
9. реакция оксида цинка с оксидом молибдена:
ZnО + MoО3 → ZnMoО4.
В результате реакции образуется соль – молибдат цинка.
10. реакция оксида цинка с оксидом ванадия:
2ZnО + VО2 → Zn2VО4 (t = 1500-1700 oC).
В результате реакции образуется соль – тетраоксованадат цинка.
11. реакция оксида цинка с оксидом марганца:
3ZnО + MnО2 → MnZn3О5 (t = 700-800 oC),
ZnО + Mn2О3 → ZnMn2О4 (t = 900 oC).
В результате реакции образуется в первом случае – оксид марганца-трицинка, во втором – оксид марганца-цинка.
12. реакция оксида цинка с оксидом вольфрама:
ZnО + WО3 → ZnWО4 (t = 600-800 oC).
В результате реакции образуется соль – вольфрамат цинка.
13. реакция оксида цинка с сульфидом цинка:
2ZnO + ZnS → 3Zn + SO2.
В результате химической реакции получается цинк и оксид цинка.
14. реакция оксида цинка с хлоридом цинка и водой:
ZnO + ZnCl2 + H2O → 2Zn(OH)Cl (t = 100-130 oC).
В результате химической реакции получается быстро (2-3 минуты) твердеющая масса – хлорид-гидроксид цинка (т.н. цинковый цемент). Хлорид цинка – концентрированный раствор.
15. реакция оксида цинка с плавиковой кислотой:
ZnO + 2HF → ZnF2 + H2O.
В результате химической реакции получается соль – фторид цинка и вода.
16. реакция оксида цинка с азотной кислотой:
ZnO + 2HNO3 → 2Zn(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат цинка и вода.
17. реакция оксида цинка с ортофосфорной кислотой:
3ZnO + 2H3PO4 → Zn3(PO4)2 + 3H2O.
В результате химической реакции получается соль – ортофосфат цинка и вода. Ортофосфорная кислота изначально растворена в воде.
Аналогично проходят реакции оксида цинка и с другими кислотами.
18. реакция оксида цинка с бромистым водородом (бромоводородом):
ZnO + 2HBr → ZnBr2 + H2O.
В результате химической реакции получается соль – бромид цинка и вода.
19. реакция оксида цинка с йодоводородом:
ZnO + 2HI → ZnI2 + H2O.
В результате химической реакции получается соль – йодид цинка и вода.
20. реакция оксида цинка с сероводородом:
ZnO + H2S → ZnS + H2O (t = 450-550 oC).
В результате химической реакции получается соль – сульфид цинка и вода.
21. реакция оксида цинка с гидроксидом натрия:
ZnO + 2NaOH → Na2ZnO2 + H2O (t = 500-600 oC).
В результате химической реакции получается соль – цинкат натрия и вода.
22. реакция оксида цинка с гидроксидом натрия и водой:
ZnO + NaOH + H2O → Na[Zn(OН)3] (t = 100 oC),
ZnO + 2NaOH + H2O → Na2[Zn(OН)4] (t = 90 oC).
В результате химической реакции в первом случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 40 %. Реакция протекает при кипении.
В результате химической реакции во втором случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 60 %. Реакция протекает при температуре 90 oC.
23. реакция оксида цинка с гидратом аммиака:
ZnО + 4(NH3•H2O) → [Zn(NH3)4](OH)2 + 3H2O.
В результате реакции образуются гидроксид тетраамминцинка и вода. Гидрат аммиака – концентрированный раствор.
24. реакция оксида цинка с хлоридом аммония:
ZnО + 2NH4Cl → ZnCl2 + 2NH3 + H2O (t°).
В результате реакции образуются хлорид цинка, аммиак и вода.
Применение и использование оксида цинка:
Оксид цинка применяется в качестве наполнителя, компонента или катализатора в химической, фармацевтической, резинотехнической, лакокрасочной и нефтеперерабатывающей промышленности, в производстве стекла и керамики, а также медицине.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид цинка реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида цинка
реакции с оксидом цинка
Коэффициент востребованности
8 743
| Оксид цинка | |
|---|---|
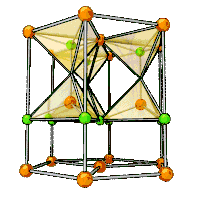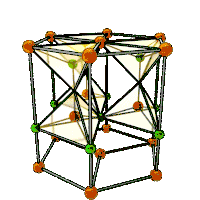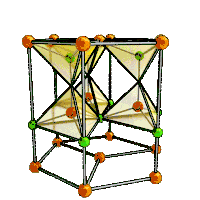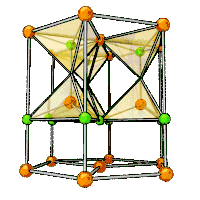 |
|
 |
|
| Общие | |
| Систематическое наименование |
Цинка оксид |
| Хим. формула |
 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 81,408 г/моль |
| Плотность | 5,61 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1975 °C |
| • сублимации | 1800 °C |
| Мол. теплоёмк. | 40,28 Дж/(моль·К) |
| Энтальпия | |
| • образования | -350,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Оптические свойства | |
| Показатель преломления |
2,015 и 2,068CRC Handbook of Chemistry and Physics. — 92nd. — CRC Press, 2011. — ISBN 978-1439855119. |
| Структура | |
| Кристаллическая структура | гексагональная сингония, a = 0,32495 нм, c = 0,52069 нм, z = 2 |
| Классификация | |
| Рег. номер CAS | 1314-13-2 |
| PubChem | 14806 |
| Рег. номер EINECS | 215-222-5 |
| SMILES |
O=[Zn] |
| InChI |
InChI=1S/O.Zn XLOMVQKBTHCTTD-UHFFFAOYSA-N |
| RTECS | ZH4810000 |
| ChEBI | ZH4810000 |
| ChemSpider | 14122 |
| Безопасность | |
| Предельная концентрация |
аэрозоль в воздухе рабочей зоны 0,5 мг/м3 в атмосферном воздухе 0,05 мг/м3 |
| Токсичность | Токсичен, при вдыхании пыли вызывает литейную лихорадку |
| Фразы риска (R) | R50/53 |
| Фразы безопасности (S) | S60, S61 |
| Краткие характер. опасности (H) |
H410 |
| Меры предостор. (P) |
P273 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС |
|
| NFPA 704 |
1 2 0
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д ци́нка (о́кись цинка) 
Свойства
Физические свойства
- Теплопроводность: 54 Вт/(м·К)[2].
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ. Естественное смещение стехиометрического отношения в сторону обогащения кислородом придаёт ему электронный тип проводимости.
Эффективная масса носителей заряда mp 0,59me; mn 0,24me.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещённой зоны и сдвигом края в спектре поглощения из УФ-области в синюю область видимого спектра.
При температурах 1350—1800 °C оксид цинка сублимируется, сублимация идет через механизм разложения оксида цинка на цинк и кислород в высокотемпературной зоне и образование оксида в низкотемпературной зоне, скорости сублимации зависят от состава газовой среды, в которой она проводится[3].
Химические свойства
Химически оксид цинка амфотерен — реагирует с кислотами с образованием соответствующих солей цинка, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксоцинкаты (например, ![{displaystyle {ce {Na2[Zn(OH)4],}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5fe0c645cfa870a55ab8ce7fe8d2b33ab3da9cd1)
![{displaystyle {ce {Ba2[Zn(OH)6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6942d7642b58bf88a659f6ebc05118ea434b7300)
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
При сплавлении со щелочами и оксидами некоторых металлов оксид цинка образует цинкаты:
При сплавлении с оксидом бора и диоксидом кремния оксид цинка образует стеклообразные бораты и силикаты:
При смешивании порошка оксида цинка с концентрированным раствором хлорида цинка образуется быстро (за 2—3 минуты) твердеющая масса — цинковый цемент[4].
Нахождение в природе
Известен природный минерал цинкит, состоящий в основном из оксида цинка.
Получение
- Сжиганием паров цинка в кислороде («французский процесс»).
- Термическим разложением некоторых солей цинка:
- Окислительным обжигом сульфида
.
- С помощью гидротермального синтеза[5].
- Извлечением из пылей и шламов заводов чёрной металлургии, особенно перерабатывающих металлолом (он содержит значительную долю оцинкованного железа).
Применение
Оксид цинка широко применяют в химической и фармацевтической промышленности. Применяется в составе зубных паст и цементов в терапевтической стоматологии, в солнцезащитных кремах, в косметических процедурах, в производстве в качестве наполнителя резины, искусственной кожи и резинотехнических изделий. Применяется в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка применяют при производстве стекла и керамики.
В химической промышленности
- Активатор вулканизации некоторых типов каучуков.
- Вулканизирующий агент хлоропреновых каучуков.
- Катализатор получения метанола.
- Белый пигмент при производстве красок и эмалей (в настоящее время (2007 год) вытесняется нетоксичным диоксидом титана
).
- Наполнитель и пигмент в производстве:
- резины;
- пластмасс;
- бумаги;
- парфюмерных и косметических средств.
- Добавка к кормам для животных.
- В производстве стекла и красок на основе жидкого стекла;
- Как один из компонентов преобразователя ржавчины[источник не указан 1473 дня].
Известно также, что оксид цинка обладает фотокаталитической активностью[источник не указан 1473 дня], что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время не используется[источник не указан 1473 дня].
В электронике
Оксид цинка применяется для производства варисторов, которые используются в современных ограничителях перенапряжений (ОПН) взамен морально устаревших газонаполненных разрядников.
Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров[источник не указан 1473 дня]. На основе оксида цинка в комбинации с нитридом галлия создан светодиод голубого цвета[6][7].
Тонкие плёнки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры[8][9].
Также оксид цинка входит в состав теплопроводных паст, например, пасты КПТ-8.
В медицине

Туба с цинковой мазью
В медицине используется в качестве компонента лекарственных средств наружного применения, используемых в дерматологии. Обладает противовоспалительным, подсушивающим, адсорбирующим, вяжущим и антисептическим действием.
Применяют в виде присыпки, мази, пасты, линимента. Является одним из компонентов ряда комплексных дерматологических и косметических препаратов, таких как «Цинковая мазь», «Паста Лассара» и пр.
Фармакологическое действие обусловлено тем, что оксид цинка образует альбуминаты и денатурирует белки. При нанесении на поражённую поверхность уменьшает явления экссудации, воспаления и раздражения тканей, образует защитный барьер от действия раздражающих факторов.
Может применяться при дерматите, в том числе пелёночном, опрелостях, потнице, поверхностных ранах и ожогах (солнечные ожоги, порезы, царапины), язвенных поражениях кожи (трофических язвах), пролежнях, экземе в стадии обострения, простом герпесе, стрептодермии.
Безопасность и токсичность
Соединение малотоксично, но его пыль вредна для органов дыхания и может вызвать литейную лихорадку, ПДК в воздухе рабочих помещений — 0,5 мг/м³ (по ГОСТ 10262-73). Пыль соединения может образовываться при термической обработке изделий из латуни и литья медных сплавов содержащих цинк.
Примечания
- ↑ http://www.cdc.gov/niosh/npg/npgd0675.html
- ↑ Термопрокладки. Дата обращения: 8 июля 2012. Архивировано 15 марта 2011 года.
- ↑ Anthrop, Donald F.; Searcy, Alan W. (1964-08). “Sublimation and Thermodynamic Properties of Zinc Oxide”. The Journal of Physical Chemistry. 68 (8): 2335—2342. DOI:10.1021/j100790a052. eISSN 1541-5740. ISSN 0022-3654. Дата обращения 2020-09-22.
- ↑ Справочник химика. Цинковый цемент.
- ↑ S. Baruah and J. Dutta «Review: Hydrothermal growth of ZnO nanostructures» Sci. Technol. Adv. Mater. 10 (2009) 013001 скачать бесплатно (недоступная ссылка)
- ↑ Liu XY, Shan CX, Zhu H, Li BH, Jiang MM, Yu SF, Shen DZ (September 2015). “Ultraviolet Lasers Realized via Electrostatic Doping Method”. Scientific Reports. 5: 13641. Bibcode:2015NatSR…513641L. DOI:10.1038/srep13641. PMC 4555170. PMID 26324054.
- ↑ Bakin A, El-Shaer A, Mofor AC, Al-Suleiman M, Schlenker E, Waag A (2007). “ZnMgO-ZnO quantum wells embedded in ZnO nanopillars: Towards realisation of nano-LEDs”. Physica Status Solidi C. 4 (1): 158—161. Bibcode:2007PSSCR…4..158B. DOI:10.1002/pssc.200673557.
- ↑ Wang HT, Kang BS, Ren F, Tien LC, Sadik PW, Norton DP, Pearton SJ, Lin J (2005). “Hydrogen-selective sensing at room temperature with ZnO nanorods”. Applied Physics Letters. 86 (24): 243503. Bibcode:2005ApPhL..86x3503W. DOI:10.1063/1.1949707.
- ↑ Tien LC, Sadik PW, Norton DP, Voss LF, Pearton SJ, Wang HT, et al. (2005). “Hydrogen sensing at room temperature with Pt-coated ZnO thin films and nanorods”. Applied Physics Letters. 87 (22): 222106. Bibcode:2005ApPhL..87v2106T. DOI:10.1063/1.2136070.
Литература
- Перельман В. И. Краткий справочник химика. — М.—Л.: Химия, 1964.
- Бовина Л. А. и др. Физика соединений AIIBVI / под ред. А. Н. Георгобиани, М. К. Шейнкмана. — М.: Наука, Гл. ред. физ.-мат. лит., 1986. — 319, [1] с.: рис., табл. — 2600 экз.
- Статья «Цинка окись» в Большой советской энциклопедии.
Дополнительная литература
- Özgür Ü., Alivov Ya. I., Liu C., Teke A., Reshchikov M. A., Doğan S., Avrutin V., Cho S.-J., Morkoç H. A comprehensive review of ZnO materials and devices // Journal of Applied Physics. — 2005. — Vol. 98. — P. 041301. — ISSN 00218979. — doi:10.1063/1.1992666.
| п • <abbr title=»Обсуждение этого шаблона»>о</abbr> • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Эта страница в последний раз была отредактирована 28 ноября 2022 в 08:19.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.






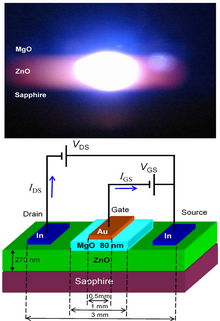






![{displaystyle {ce {[Zn(OH)3]- + OH- -> [Zn(OH)4]^{2-}.}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b990d10b8bc1e36ed7dccc6b6a9b2fc1d3cb3054)
2.}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c12136821e205c3f6c42331779fc8803ac9e0f57)





