ФОСФОРА ОКСИДЫ
- ФОСФОРА ОКСИДЫ
-
В качестве индивидуальных B-B установлены: P4O, P4O2 (P2O), P4O6 (P2O3), P4O8, P4O10 (P2O5), PO3; молекулы изображенных в скобках Ф. о. существуют в виде димеров. Теоретически показана вероятность существования (при окислении паров P) метастабильных Ф. о. ряда P4On, где n =6-9, и продуктов их диссоциации — PO, PO2. Молекула PO обнаруживается лишь спектроскопически в парах. Наиб. изучены P4O6 и P4O10. Нек-рые св-ва Ф. о. представлены в таблице.
Монооксид тетрафосфора P4O- красно-бурые кристаллы; плотн. 1,891 г/см 3; при 270-280 0C воспламеняется; в сухом воздухе устойчив до 350 0C, при нагр. в инертном газе разлагается с выделением P и P4O10; с водой не реагирует, во влажном состоянии разлагается на воздухе выше 100 0C. Образуется P4O при сжигании P в недостатке кислорода, при взаимод. POCl3 с Al, Zn (100 0C) или белым фосфором (250 0C), а также при длит. выдержке на воздухе р-ра P в PCl3 и диэтиловом эфире.
СВОЙСТВА ОКСИДОВ ФОСФОРА
Показатель
P4O6
Р 4 О 8
P4O10
H
О
О’
Т. пл.0 С
23,9
_
420,5
562,5
580,5
T. кип., 0C
174
180 б
340,5 б
605,5
605,5
Плотн., г/см 3
2,135
2,537
2,28
2,72
2,84
, Дж/(моль
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.Игры ⚽ Поможем сделать НИР
- ФОСФОРА КИСЛОТЫ
- Ф
Полезное
Смотреть что такое «ФОСФОРА ОКСИДЫ» в других словарях:
-
Фосфора оксиды — Известны следующие оксиды фосфора: Название Формула Температура плавления Температура кипения Оксид фосфора(III) P2O3 (P4O6) 23.8 °C 173.5 °C Оксид фосфора(V) P2O5 (P4O10) 569 °C 591 °C … Википедия
-
ФОСФОРА ОКСИДЫ — Р4О6, (РО2)n, Р4О10. Наиболее важны Р4О6 (фосфористый ангидрид) с tпл 23,9 .С и Р4О10 (фосфорный ангидрид). Последние также обозначают формулами Р2О3 и Р2О5 соответственно. Р2О5 осушитель газов и жидкостей, дегидратирующий агент, катализатор… … Большой Энциклопедический словарь
-
фосфора оксиды — Наиболее важны Р2О3 (или Р4О6) с tпл 23,9°C и Р2О5 (или Р4О10) с tпл 420°C. Р2О5 осушитель газов и жидкостей, дегидратирующий агент, катализатор полимеризации изобутилена, компонент фосфатных стёкол и др. * * * ФОСФОРА ОКСИДЫ ФОСФОРА ОКСИДЫ,… … Энциклопедический словарь
-
ФОСФОРА ОКСИДЫ — наиболее важны Р2О3 (или Р4О6) с tпл 23,9 оС и Р2О5 (или Р4О10) с tпл 420 °С. Р2О5 осушитель газов и жидкостей, дегидратирующий агент, катализатор полимеризации изобутилена, компонент фосфатных стёкол и др … Естествознание. Энциклопедический словарь
-
Оксиды фосфора — Известны следующие оксиды фосфора: Название Формула Температура плавления Температура кипения Оксид тетрафосфора P4O Диоксид тетрафосфора P4O2 Оксид фосфора(III) P2O3 (P4O6) 23,8 °C 173,5 °C Оксид фосфора(IV) P4O8 Оксид фосфора(V) P2O5 (P4O10)… … Википедия
-
Оксиды свинца — Монооксид свинца (PbO). β PbO «массикот», обладает характерным жёлтым цветом. Оксиды свинца группа соединений свинца с кислородом. Pb2O Оксид свинца (1+) (сведения о данном соединении требую … Википедия
-
АЗОТА ФОСФОРА СЕМЕЙСТВО — ПОДГРУППА VA. СЕМЕЙСТВО АЗОТА ФОСФОРА Тенденция изменения свойств от неметаллических до металлических, которая выявлена в подгруппах IIIA и IVA, характерна и для этой подгруппы. Переход к металличности (хотя и нерезкий) начинается с мышьяка, у… … Энциклопедия Кольера
-
Оксид фосфора(V) — Оксид фосфора(V) … Википедия
-
Кислотные оксиды — (ангидриды) – оксиды, проявляющие кислотные свойства и образующие соответствующие кислородсодержащие кислоты. Образованы типичными неметаллами и некоторыми переходными элементами. Элементы в кислотных оксидах обычно проявляют степень окисления от … Википедия
-
Оксид фосфора(III) — Оксид фосфора(III) … Википедия
18+
© Академик, 2000-2023
-
Обратная связь:
Техподдержка,
Реклама на сайте
- 👣 Путешествия
Экспорт словарей на сайты, сделанные на PHP,
Joomla,
Drupal,
WordPress, MODx.
- Пометить текст и поделиться
- Искать во всех словарях
- Искать в переводах
- Искать в Интернете
Поделиться ссылкой на выделенное
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
4P + 5O2 → 2P2O5
Химические свойства
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например, оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2HNO3 → 2HPO3 + N2O5
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
2. Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот:
P2O5 + 3H2O → 2H3PO4
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
P2O5 + 2H2O → 2H4P2O7
P2O5 + H2O → HPO3
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями.
Например, оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
Еще пример: оксид фосфора взаимодействует с оксидом бария (при сплавлении):
P2O5 + 3BaO → Ba3(PO4)2
Admin
Морфемный разбор слова:
Однокоренные слова к слову:
Оксид фосфора (V): получение и свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Источник
Оксид фосфора(V)
| Оксид фосфора(V) | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид фосфора(V) |
| Химическая формула | P4O10 |
| Физические свойства | |
| Состояние (ст. усл.) | белый порошок |
| Отн. молек. масса | 283.889 а. е. м. |
| Молярная масса | 283.889 г/моль |
| Плотность | 2.39 г/см³ |
| Термические свойства | |
| Температура плавления | 420 о С(Н-форма),569 (О-форма) °C |
| Температура кипения | возгоняется при 359 (Н-форма) °C |
| Энтальпия образования (ст. усл.) | -3010,1 кДж/моль |
| Химические свойства | |
| Растворимость в воде | реагирует г/100 мл |
| Классификация | |
| Рег. номер CAS | [1314-56-3] (P2O5) [16752-60-6] (P4O10) |
Пентаокс́ид фосфора (фо́сфорный ангидрид, пятиокись фосфора, оксид фосфора(V)) — P2O5, кислотный оксид.
Содержание
Строение
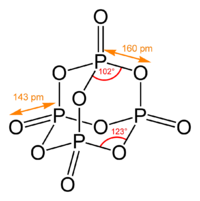
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b — 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P2O5 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360 о С) и активно взаимодействует с водой. Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (
580 о С) и менее химически активны. H-форма переходит в О-форму при 300—360 о C.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:

Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P4O10 с основными оксидами образует различные твердые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Литература
Полезное
Смотреть что такое «Оксид фосфора(V)» в других словарях:
Оксид фосфора — Оксид фосфора: Оксид фосфора(III) Оксид фосфора(V) … Википедия
Оксид фосфора(III) — Оксид фосфора(III) … Википедия
Фосфора оксиды — Известны следующие оксиды фосфора: Название Формула Температура плавления Температура кипения Оксид фосфора(III) P2O3 (P4O6) 23.8 °C 173.5 °C Оксид фосфора(V) P2O5 (P4O10) 569 °C 591 °C … Википедия
Оксид углерода(II) — Оксид углерода(II) … Википедия
фосфора(V) оксид — fosforo(V) oksidas statusas T sritis chemija formulė P₂O₅ atitikmenys: angl. phosphorus pentoxide; phosphorus(V) oxide rus. фосфора пентоксид; фосфора пятиокись; фосфора(V) оксид; фосфорный ангидрид ryšiai: sinonimas – difosforo pentoksidas … Chemijos terminų aiškinamasis žodynas
фосфора(III) оксид — fosforo(III) oksidas statusas T sritis chemija formulė P₂O₃ atitikmenys: angl. phosphorus trioxide; phosphorus(III) oxide rus. фосфора трехокись; фосфора(III) оксид; фосфористый ангидрид ryšiai: sinonimas – difosforo trioksidas … Chemijos terminų aiškinamasis žodynas
фосфора пентоксид — fosforo(V) oksidas statusas T sritis chemija formulė P₂O₅ atitikmenys: angl. phosphorus pentoxide; phosphorus(V) oxide rus. фосфора пентоксид; фосфора пятиокись; фосфора(V) оксид; фосфорный ангидрид ryšiai: sinonimas – difosforo pentoksidas … Chemijos terminų aiškinamasis žodynas
фосфора пятиокись — fosforo(V) oksidas statusas T sritis chemija formulė P₂O₅ atitikmenys: angl. phosphorus pentoxide; phosphorus(V) oxide rus. фосфора пентоксид; фосфора пятиокись; фосфора(V) оксид; фосфорный ангидрид ryšiai: sinonimas – difosforo pentoksidas … Chemijos terminų aiškinamasis žodynas
Оксид углерода (II) — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
фосфора трехокись — fosforo(III) oksidas statusas T sritis chemija formulė P₂O₃ atitikmenys: angl. phosphorus trioxide; phosphorus(III) oxide rus. фосфора трехокись; фосфора(III) оксид; фосфористый ангидрид ryšiai: sinonimas – difosforo trioksidas … Chemijos terminų aiškinamasis žodynas
Источник
Оксид фосфора (III): получение и химические свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода :
Химические свойства оксида фосфора (III)
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
а со щелочами – с образованием солей (фосфитов):
Источник
Оксид фосфора (V), свойства, получение, химические реакции
Оксид фосфора (V), свойства, получение, химические реакции.
Оксид фосфора (V) – неорганическое вещество, имеет химическую формулу P4O10 и P2O5.
Краткая характеристика оксида фосфора (V). Формула оксида фосфора (V) :
Оксид фосфора (V) – неорганическое вещество белого цвета.
Оксид фосфора (V) содержит четыре атома фосфора и десять атомов кислорода.
Химическая формула оксида фосфора (V) P4O10 и P2O5. Для простоты записи используют последнюю формулу.
В воде не растворяется, а взаимодействует с ней, образуя кислоты.
Модификации оксида фосфора (V):
Твердый оксид фосфора (V) склонен к полиморфизму. Существуют три формы-модификации оксида фосфора (V): H, O`, O и G формы-модификации.
| гексагональная H-форма | орторомбическая O`-форма | орторомбическая O-форма | G-форма | |
| Состояние вещества | Кристаллический вид | Кристаллический | Кристаллический вид | Стекловидный вид |
| Характер стабильности формы | Метастабильная форма | Стабильная форма | Метастабильная форма | |
| Другие характеристики | a=0,744 нм, угол = 87°, пространственная группа R3C | a=1,63 нм, b=0,814 нм, c=0,526 нм, пространственная группа Fdd2 | a=0,923 нм, b = 0,718 нм, c = 0,494 нм, пространственная группа Pnam |
H-форма переходит в O-форму при 300-360 °C (процесс заканчивается при 378 °C).
Источник
Оксид фосфора (V)
Оксид фосфора (V) [P2O5] – соединение фосфора с кислородом, существует в виде димера P4O10 (декаоксид тетрафосфора). Наиболее употребима формула состава P2O5 (пентаоксид фосфора).
Устаревшее название – фосфорный ангидрид. Является действующим веществом всех фосфорсодержащих удобрений
Традиционно содержание Фосфора в удбрениях выражают содержанием Оксида фосфора.
Все свойства Фосфора, как питательного элемента описаны в статье Фосфор.
Химические и физические свойства
Оксид фосфора – бесцветное аморфное или стекловидное вещество, существующеев трех кристаллических, двух аморфных и двух жидких формах. [1]
Токсичное вещество. Вызывает ожоги кожи и раздражение слизистой оболочки.
Пентаоксид фосфора очень гигроскопичен. Реагирует со спиртами эфирами, фенолами, кислотами и прочими веществами. В процессе реакции с органическими веществами происходит разрыв связей фосфора с кислородом, и образуются фосфорорганические соединения. Вступает в химические реакции с аммиаком (NH3) и галогеноводородами с образованием фосфатов аммония и оксигалогенидов фосфора. С основными оксидами образует фосфаты. [3]
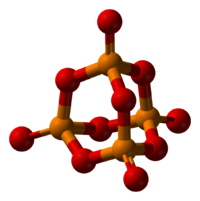
Трехмерная модель молекулы
Содержание пентаоксида фосфора в почве и удобрениях
Фактически в почве имеются только соли ортофосфорной кислоты H3PO4, но в сложных удобрениях могут быть и соли мета-, пиро- и полифосфорных кислот. [4]
Основой для образования ортофосфорной кислоты является пентаоксида фосфора. Именно поэтому, а так же в связи с тем, что растения не поглощают элементарный фосфор, условлено обозначать концентрацию фосфора через содержание пентаоксида фосфора. [2]
P2O5 + 3H2O → 2H3PO4
Двузамещенные соли двухвалентных катионов в воде не растворимы, но легко растворяются в слабокислых кислотах корневых выделений и органических кислотах жизнедеятельности микроорганизмов. В этой связи они так же являются хорошим источником P2O5 для растений. [4]
Поглощение пентаоксида фосфора растениями
Как указывалось выше, в природе основной источник фосфора – это соли ортофосфорнонй кислоты H3PO4. Однако после гидролиза пиро-, поли- и метафосфаты так же используются практически всеми культурами.
Гидролиз пирофосфата натрия:
Гидролиз триполифосфата натрия:
Гидролиз метафосфат иона (в кислой среде):
Некоторые растения приспособились усваивать фосфат-ион из фосфорорганических соединений (фитин, глицефосфаты и прочее). Корни данных растений выделяют особый фермент (фотофтазу), который и отщипляет анион фосфорной кислоты от органических соединений, а затем растения поглощают этот анион. К подобного рода растениям относятся горох, бобы, кукуруза. Причем фосфатазная активность возрастает в условиях фосфорного голода.
Опытным путем установлено, что поглощаемый корнями фосфор прежде всего идет на синтез нуклеотидов, а для дальнейшего продвижения в наземную часть фосфаты вновь поступают в проводящие сосуды корня в виде минеральных соединений. [4]
Рерасчет содержения фосфора в удобрениях
В некоторых случаях требуется рассчитать процентное содержание фосфора в удобрении, если дано содержание по P2O5. Расчет производится по формуле:
y = x,% × 30,974 (молярная масса P) × 2 / 30,974 (молярная масса P) × 2 + 15,999 (молярная масса O) × 5
х – содержание P2O5 в удобрении, %;
y – содержание P в удобрении, %
y = x, % × 0,43643
в удобрении содержится 40% оксида фосфора
для пересчета процентного содержания элемента фосфор в удобрении нужно умножить массовую долю оксида в удобрении на массовую долю элемента в оксиде (для P2O5 – 0,43643): 40 * 0,43643 = 17,4572 %
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется оксид фосфора, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется оксид фосфора», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 376.
Показано записей: 20.
1. Оксид фосфора(V)
Брутто-формула:
O10P4
Названия
Русский:
- Оксид фосфора(V)
- Пентаоксид фосфора
- пятиокись фосфора
- фосфорный ангидрид
;
;
;
;
English:
- Diphosphorus pentoxide
- Phosphoric anhydride
- Phosphoric oxide
- Phosphoric pentoxide
- Phosphorus oxide
- Phosphorus pentaoxide
- Phosphorus pentoxide
;
;
;
;
;
;
;
$slope(15)$L(1.5)O||P`/O|P:l`/O/O/P:rO«|O`_(A120)O|P<`/O_#l><O_#r>_(A120,N2)O
2. Оксид фосфора(III)
Брутто-формула:
O6P4
CAS# 10248-58-5
Названия
Русский:
- Оксид фосфора(III) [Wiki]
- Фосфористый ангидрид
- гексаоксид тетрафосфора
;
;
;
English:
- 2,4,6,8,9,10-hexaoxa-1,3,5,7-tetraphosphatricyclo[3.3.1.13,7]decane(IUPAC)
- Phosphorus trioxide [Wiki]
- Tricyclo[3.3.1.13,7]tetraphosphoxane(IUPAC)
- tetraphosphorus hexaoxide
;
;
;
;
$slope(15)$L(1.5)P`/O|P:lO/P:r`|O`_(A120,w+)O_(A90,w2)P<_(A165,w2)O_(w-)#l><_(A15,w2)O_(w-)#r>
P_(y1.5)O_q6P_q6O_q6P_q6O_q6$L(.866)_(A60)O_(A0)P<_(A-60)O_(A0)>O`/
3. Оксихлорид фосфора
Брутто-формула:
Cl3OP
CAS# 10025-87-3
Названия
Русский:
- Оксихлорид фосфора [Wiki]
- трихлороксид фосфора(V)
- фосфора хлорокись
- фосфорилхлорид
- хлорангидрид фосфористой кислоты
;
;
;
;
;
English:
- EINECS:233-046-7
- Phosphonyl trichloride
- Phosphoric trichloride
- Phosphorouschloride oxide (POCl3)
- Phosphoroxychloride
- Phosphoroxytrichloride
- Phosphorus chloride oxide (POCl3)
- Phosphorus monoxidetrichloride
- Phosphorus oxide trichloride
- Phosphorus oxychloride
- Phosphorus trichloride oxide
- Phosphoruschloride oxide (PCl3O)
- Phosphorusoxytrichloride
- Phosphoryl chloride [Wiki]
- Phosphoryl trichloride
- Phosphorylchloride (8CI)
- Trichlorophosphine oxide
- Trichlorophosphorus oxide
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
Cl/P`|O|<_(A75,w+)Cl>dCl
4. Дифосфора триоксид
Брутто-формула:
O3P2
CAS# 1314-24-5
Названия
Русский:
- Дифосфора триоксид
;
English:
- Dioxodiphosphoxane
- Diphosphorus trioxide
- UN2578
;
;
;
5. Ортофосфорная кислота
Брутто-формула:
H3O4P
CAS# 7664-38-2
Названия
Русский:
- Ортофосфорная кислота [Wiki]
- Фосфорная кислота
;
;
English:
- E-338
- E338
- Orthophosphoric acid
- Phosphoric acid(IUPAC) [Wiki]
- phosphoric(V) acid
- trihydroxidooxidophosphorus(IUPAC)
- trihydroxylphosphine oxide
;
;
;
;
;
;
;
HO/P`|O|<_(A70,w+)O-H>_(A15,d+)O/H
6. Метафосфорная кислота
Брутто-формула:
HO3P
CAS# 10343-62-1
Названия
Русский:
- Метафосфорная кислота
;
English:
- Metaphosphoric acid
- monometaphosphoric acid
;
;
7. пирофосфорная кислота
Брутто-формула:
H4O7P2
CAS# 2466-09-3
Названия
Русский:
- Гептаоксодифосфат(V) водорода(IUPAC)
- Дифосфорная кислота [Wiki]
- пирофосфорная кислота
;
;
;
English:
- Diphosphoric acid(IUPAC)
- Pyrophosphoric acid [Wiki]
- μ-oxido-bis(dihydroxidooxidophosphorus)(IUPAC)
;
;
;
HO/P`|O|<_(A80,L1.2)OH>O/P`|O|<_(A80,L1.2)OH>OH
HO-P`|O|<|OH>-O-P`|O|<|OH>-OH
HO_(A-15,d-)P`|O|<_(A100,w+)HO>O/P`|O|<_(A80,w+)OH>_(A15,d+)OH
OH|P<`HO>`/O/O/P</OH>O«|OH
8. Триметафосфорная кислота
Брутто-формула:
H3O9P3
CAS# 13566-25-1
Названия
Русский:
- Полифосфорная кислота
- Триметафосфорная кислота
;
;
English:
- 1,3,5,2,4,6-trioxatriphosphinane-2,4,6-triol 2,4,6-trioxide
- trimetaphosphoric acid
;
;
OH`/P<`\O>`/O|P|O`|<`HO>O/P<|OH>/O`/`|O`
9. Ортофосфат калия
Брутто-формула:
K3O4P
Названия
Русский:
- Ортофосфат калия(IUPAC)
- Фосфорнокислый калий
- калия фосфат
- фосфат калия
;
;
;
;
English:
- Potassium phosphate
- Tripotassium phosphate(IUPAC)
- tribasic
;
;
;
K^+O`^-/P`|O|<_(A75)O^-# -0K^+>_(A15)O^-/0K^+
10. Фосфат кальция
Брутто-формула:
Ca3O8P2
CAS# 7758-87-4
Названия
Русский:
- Фосфат кальция
- кальция фосфат
- ортофосфат кальция(IUPAC)
- фосфорнокислый кальций
;
;
;
;
English:
- Calcigenol simple
- Calcium orthophosphate
- Calcium phosphate
- Calcium phosphate tribasic
- E341(iii)
- Phosphoric acid, calcium salt (2:3)(IUPAC)(CAS)
- Tricalcium diphosphate(IUPAC)
- tricalcium;diphosphate(IUPAC)(CAS)
;
;
;
;
;
;
;
;
$slope(45)$L(1.2)Ca^++hO`^-/P<`O`^-`/h>/O`/O^-/hCa^++/hO`^-P`/O/<O^->/O^-hCa^++`/h#-3
$L(1.2)Ca^2+O`^-_(A-15,d-)P<_(A105,w+)O`^->`|O|O^-/0Ca^2+O`^-/P`|O|<_(A75,w+)O^->_(A15,d+)O^-/0Ca^2+
11. Дигидроортофосфат калия
Брутто-формула:
H2KO4P
CAS# 7778-77-0
Названия
Русский:
- Дигидроортофосфат калия [Wiki]
- Монофосфат калия
- дигидрофосфат калия
- калий фосфорнокислый однозамещенный
;
;
;
;
English:
- Monobasic potassium phosphate
- Monopotassium monophosphate
- Monopotassium orthophosphate
- Monopotassium phosphate [Wiki]
- Phosphoric acid, monopotassium salt(CAS)
- Potassium acid phosphate
- Potassium dihydrogen phosphate(IUPAC)
- Potassium phosphate monobasic
- Potassium phosphate, monobasic
- Sorensen’s potassium phosphate
- potassium;dihydrogen phosphate(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
K^+_(x1.1,N0)O`^-_(x1)P<`|OH>|O`|-OH
HO/P<_q4HO><_pp4O>/O^-hK^+
K^+O//P<`|OH><_(A75,w+)OH>_(A15,d+)O^-
12. Фосфористая кислота
Брутто-формула:
H3O3P
CAS# 13598-36-2
Названия
Русский:
- Фосфористая кислота [Wiki]
- фосфоновая кислота
;
;
English:
- Dihydroxyphosphine oxide
- Orthophosphorous acid
- Phosphonic acid(CAS) [Wiki]
- Phosphorous acid
- PubChem 107909
- Trihydroxyphosphine
- dihydroxy(oxo)phosphanium(IUPAC)
;
;
;
;
;
;
;
HO_(A-15)P<_(A115)HO>`|O|H
H|P`/O/<_(A75,w+)OH>_(A15)OH
HO/$dashes(-)P<_(A75,w+)OH>_(A15)OH
13. Фосфат бария
Брутто-формула:
Ba3O8P2
CAS# 13517-08-3
Названия
Русский:
- Бария фосфат
- Соль бария и ортофосфорной кислоты
- Фосфат бария [Wiki]
;
;
;
English:
- AC1L4XBC
- Barium phosphate
- Barium phosphate (3:2)
- Barium phosphate, tribasic
- EINECS:236-856-9
- Phosphoric acid, barium salt (2:3)
- Phosphoric acid, bariumsalt (2:3)(CAS)
- Tribarium diphosphate
- barium(2+) diphosphate
- barium(2+);diphosphate(IUPAC)
;
;
;
;
;
;
;
;
;
;
Ba^++/0O`^-# -P`|O|<|O^->-O^-/0Ba^++O`^-# -P`|O|<|O^->-O^-Ba^++
$slope(45)$L(1.2)Ba^2+hO`^-/P<`O`^-`/h>O`/O^-hBa^2+hO`^-/P`O</O^->O^-/hBa^2+`h#-3
14. тетраметафосфорная кислота
Брутто-формула:
H4O12P4
Названия
Русский:
- тетраметафосфорная кислота
;
English:
- Tetrametaphosphoric acid
;
O=P<-OH>_(A-67.5,L1.4)O_p8P<`||O><|OH>_p8O_p8P<=O><`-HO>_p8O_p8P<||O><`|OH>_p8O_p8
P_(x1.2)O_p8P@:v(o:OH)<_(a-45)&o><_(a-105,N2)O>@()_p8O_p8P@v(HO)_p8O_p8P@v(HO)_p8O_p8@v()
15. Фосфор
Брутто-формула:
P
CAS# 7723-14-0
Названия
16. Фосфат алюминия
Брутто-формула:
AlO4P
CAS# 7784-30-7
Названия
Русский:
- Фосфат алюминия [Wiki]
- алюминий фосфорнокислый
- ортофосфат алюминия
;
;
;
English:
- Aluminium phosphate [Wiki]
- Aluminophosphoric acid
- Aluminum Phosphoric Acid
- Aluminum acid phosphate
- Aluminum monophosphate
- Aluminum phosphate
- Aluminum phosphate (1:1)
- Aluphos
- EINECS:232-056-9
- Monoaluminum phosphate
- Phosphalugel
- Phosphoric acid, aluminum salt (1:1)(CAS)
- aluminum;phosphate(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
;
;
Al^3+/0O`^-# -P`|O|<-O^->|O^-
Al^3+O`^-/P`|O|<_(A75,w+)O^->_(A15,d+)O^-
17. Фосфид алюминия
Брутто-формула:
AlP
CAS# 20859-73-8
Названия
Русский:
- Фосфид алюминия
- Фосфористый алюминий
;
;
English:
- ALUMINUM PHOSPHIDE
- Aluminium monophosphide
- Aluminium phosphide
- Aluminium phosphide (AlP)
- Aluminium(III) phosphide
- Aluminiumphosphid
- Aluminum monophosphide
- Aluminum phosphide (AlP)
- Aluminum phosphide, (AlP)(CAS)
- Celphide
- Celphine
- Celphos
- Delicia
- Delicia gastoxin
- Detia Gas Ex-B
- Detia-Ex-B
- Epifume
- Fumitoxin
- Gastion
- Phosfume
- Phosphure d’aluminium
- Phostoxin
- Phostoxin A
- UN 1397
- alumanylidynephosphane(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
18. Псилоцибин
Брутто-формула:
C12H17N2O4P
CAS# 520-52-5
Названия
Русский:
- 4-фосфорилокси-N,N-диметилтриптамин
- [3-(2-диметиламиноэтил)-1H-индол-4-ил] дигидрофосфат
- Псилоцибин [Wiki]
;
;
;
English:
- 1H-Indol-4-ol,3-[2-(dimethylamino)ethyl]-, 4-(dihydrogen phosphate)(CAS)
- 1H-Indol-4-ol,3-[2-(dimethylamino)ethyl]-, dihydrogen phosphate (ester) (9CI)
- 3-(2-Dimethylaminoethyl)indol-4-yl dihydrogen phosphate
- 4-Phosphoryl-N,N-dimethyltryptamine
- Cy 39
- Indocybin
- Indol-4-ol,3-(2-dimethylaminoethyl)-, phosphate (6CI)
- Indol-4-ol,3-[2-(dimethylamino)ethyl]-, dihydrogen phosphate (ester) (8CI)
- O-Phosphoryl-4-hydroxy-N,N-dimethyltryptamine
- Psilocibin
- Psilocin phosphate ester
- Psilocine phosphate
- Psilocybin [Wiki]
- Psilocybine
- Psilocybinum
- Psilotsibin
- Psylocybin
- Teonanacatl
- [3-[2-(dimethylamino)ethyl]-1H-indol-4-yl] dihydrogen phosphate(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
HOP<_pp4O><_q4O^->O||`/`\`|//|_qN<_(y.5)H>_q_qq<_q>/-/N`^+<_(y-.5)H><_(A-130)>-
HOP<_q4OH><_pp4O>O||`/`\`|//|_qN<_(y.5)H>_q_qq<_q>/-/N<`>-
`/<|`OPO3H2>`\`|//|`|/N<_(y-.5)H>||<_#1>_(A30)CH2-CH2-N(CH3)2
`-`\/=</O`P<`=O><`|OH>_(A-30)O^->`//_qN<_(y.5)H>_q_qq<_q>_(a54)_p6_q6N`^+<_q6H3C><_(A-30)CH3>_(A45)H
19. Гуанозинмонофосфат
Брутто-формула:
C10H14N5O8P
CAS# 85-32-5
Названия
Русский:
- 5′-гуанидиловая кислота
- ГМФ
- Гуанозинмонофосфат [Wiki]
- гуаниловая кислота
- гуанозинфосфорная кислота
- эфир фосфорной кислоты и гуанозинового нуклеозида
;
;
;
;
;
;
English:
- 5′-Gmp
- 5′-Guanidylic acid,
- 5′-Guanylic acid(CAS)
- 5′-Guanylic acid,
- E626
- GMP
- Guanidine monophosphate
- Guanosine 5′-(dihydrogen phosphate)
- Guanosine 5′-monophosphate
- Guanosine 5′-phosphate
- Guanosine 5′-phosphoricacid
- Guanosine monophosphate [Wiki]
- [(2R,3S,4R,5R)-5-(2-amino-6-oxo-3H-purin-9-yl)-3,4-dihydroxyoxolan-2-yl]methyl dihydrogen phosphate(IUPAC)
- guanosine-5′-monophosphate
- guanosine-phosphate
- guanylate
- guanylic acid
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
/`|O|NH|<NH2>`//N«||_qN_qq_qN<_q>|:a_(x-%a:.5,y%h:.8,W+)<|OH>_(x-1)<|OH>_(x-%a,y-%h,W-)<_(x#-1;a,y-.5)O_#a>`|`-O`-P<`||O><|OH>`-HO
`/|O`|`N`||<`H2N>/N<_(y-.5)H>||_qN_qq_qN<_q>_(a54,w-)_(a-54)<`-dHO>_p<_(a-54,d+)HO>_p<_pO_p>_(a-54,w+)O/P<_qq4O><_p4OH>/OH
20. Хлорид фосфора(V)
Брутто-формула:
Cl5P
CAS# 10026-13-8
Названия
Русский:
- Пентахлорид фосфора
- Хлорид фосфора(V) [Wiki]
- пятихлористый фосфор
- хлорангидрид фосфорной кислоты
;
;
;
;
English:
- PCl5
- Pentachlorophosphorane
- Phosphorus pentachloride(IUPAC) [Wiki]
- Phosphorus(V) chloride(IUPAC)
- UN 1806
- pentachloro-λ5-phosphane(IUPAC)
- pentachloro-λ5-phosphane(IUPAC)
;
;
;
;
;
;
;
Cl|P<`-Cl><|Cl><wCl></dCl>
Cl|P<_(a36)Cl><_(a-36)Cl><_(a108)Cl>_(a-108)Cl
Информация
Традиционно содержание Фосфора в удбрениях выражают содержанием Оксида фосфора.
Все свойства Фосфора, как питательного элемента описаны в статье Фосфор.
Подробнее >>>
Химические и физические свойства
Оксид фосфора – бесцветное аморфное или стекловидное вещество, существующеев трех кристаллических, двух аморфных и двух жидких формах.[1]
Токсичное вещество. Вызывает ожоги кожи и раздражение слизистой оболочки.
Пентаоксид фосфора очень гигроскопичен. Реагирует со спиртами эфирами, фенолами, кислотами и прочими веществами. В процессе реакции с органическими веществами происходит разрыв связей фосфора с кислородом, и образуются фосфорорганические соединения. Вступает в химические реакции с аммиаком (NH3) и галогеноводородами с образованием фосфатов аммония и оксигалогенидов фосфора. С основными оксидами образует фосфаты.[3]
Трехмерная модель молекулы
Трехмерная модель молекулы

Содержание пентаоксида фосфора в почве и удобрениях
Фактически в почве имеются только соли ортофосфорной кислоты H3PO4, но в сложных удобрениях могут быть и соли мета-, пиро- и полифосфорных кислот.[4]
Основой для образования ортофосфорной кислоты является пентаоксида фосфора. Именно поэтому, а так же в связи с тем, что растения не поглощают элементарный фосфор, условлено обозначать концентрацию фосфора через содержание пентаоксида фосфора.[2]
P2O5 + 3H2O → 2H3PO4
Все встречающиеся в почве соли ортофосфорной кислоты и одновалентных катионов (NH4+, Na+, K+) и однозамещенные соли двухвалентных катионов (Ca(H2PO4)2 и Mg(H2PO4)2) растворимы в воде.
Двузамещенные соли двухвалентных катионов в воде не растворимы, но легко растворяются в слабокислых кислотах корневых выделений и органических кислотах жизнедеятельности микроорганизмов. В этой связи они так же являются хорошим источником P2O5 для растений.[4]
Поглощение пентаоксида фосфора растениями
Как указывалось выше, в природе основной источник фосфора – это соли ортофосфорнонй кислоты H3PO4. Однако после гидролиза пиро-, поли- и метафосфаты так же используются практически всеми культурами.
Гидролиз пирофосфата натрия:
Na4P2O7 + H2O + 2H+ → 2NaH2PO4 +2Na+
Гидролиз триполифосфата натрия:
Na5P3O10 + 2H2O + 2H+ → 3NaH2PO4 +2Na+
Гидролиз метафосфат иона (в кислой среде):
(PO3)66- + 3H2O → H2P3O103- + H2P2O72- + H2PO4—
Ортофосфорная кислота, будучи трехосновной отдиссоциирует три аниона H2PO—4, HPO42-, PO4 3- . В условиях слабокислой реакции среды, именно в них возделываются растения, наиболее распространен и доступен первый ион, в меньшей степени второй и практически недоступен третий. Однако люпин, гречиха, горчица, горох, донник, конопля и другие растения способны усваивать фосфор из трехзамещенных фосфатов.[4]
Некоторые растения приспособились усваивать фосфат-ион из фосфорорганических соединений (фитин, глицефосфаты и прочее). Корни данных растений выделяют особый фермент (фотофтазу), который и отщипляет анион фосфорной кислоты от органических соединений, а затем растения поглощают этот анион. К подобного рода растениям относятся горох, бобы, кукуруза. Причем фосфатазная активность возрастает в условиях фосфорного голода.
Многие растения могут питаться фосфором из очень разбавленных растворов, вплоть до 0,01 мг /л P2O5 . Естественно, что удовлетворить потребность в фосфоре растения могут только при условии постоянного возобновления в нем концентрации хотя бы такого же низкого уровня.
Опытным путем установлено, что поглощаемый корнями фосфор прежде всего идет на синтез нуклеотидов, а для дальнейшего продвижения в наземную часть фосфаты вновь поступают в проводящие сосуды корня в виде минеральных соединений.[4]
Рерасчет содержения фосфора в удобрениях
В некоторых случаях требуется рассчитать процентное содержание фосфора в удобрении, если дано содержание по P2O5. Расчет производится по формуле:
y = x,% × 30,974 (молярная масса P) × 2 / 30,974 (молярная масса P) × 2 + 15,999 (молярная масса O) × 5
где:
х – содержание P2O5 в удобрении, %;
y – содержание P в удобрении, %
Или:
y = x, % × 0,43643
Например:
в удобрении содержится 40% оксида фосфора
для пересчета процентного содержания элемента фосфор в удобрении нужно умножить массовую долю оксида в удобрении на массовую долю элемента в оксиде (для P2O5 – 0,43643): 40 * 0,43643 = 17,4572 %
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Ван Везер «Фосфор и его соединения». Монография. т. 1.: Изд-во иностранной литературы, М., 1962.
2.
Калинский А.А., Вильдфлуш И.Р., Ионас В.А. и др. – Агрохимия в вопросах и ответах – Мн.: Урожай,1991. – 240 с.: ил.
3.
Химическая энциклопедия: в пяти томах: т.1: А-Дарзана/Редкол.: Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия, 1988. – 623.: ил
4.
Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Свернуть
Список всех источников

 , Дж/(моль
, Дж/(моль


















