|
|

|
|
| Names | |
|---|---|
| IUPAC name
Calcium oxide |
|
| Other names
Quicklime, burnt lime, unslaked lime, pebble lime, calcia |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.763 |
| EC Number |
|
| E number | E529 (acidity regulators, …) |
|
Gmelin Reference |
485425 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1910 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
CaO |
| Molar mass | 56.0774 g/mol |
| Appearance | White to pale yellow/brown powder |
| Odor | Odorless |
| Density | 3.34 g/cm3[1] |
| Melting point | 2,613 °C (4,735 °F; 2,886 K)[1] |
| Boiling point | 2,850 °C (5,160 °F; 3,120 K) (100 hPa)[2] |
|
Solubility in water |
Reacts to form calcium hydroxide |
| Solubility in Methanol | Insoluble (also in diethyl ether, octanol) |
| Acidity (pKa) | 12.8 |
|
Magnetic susceptibility (χ) |
−15.0×10−6 cm3/mol |
| Structure | |
|
Crystal structure |
Cubic, cF8 |
| Thermochemistry | |
|
Std molar |
40 J·mol−1·K−1[3] |
|
Std enthalpy of |
−635 kJ·mol−1[3] |
| Pharmacology | |
|
ATCvet code |
QP53AX18 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H314, H315, H335 |
|
Precautionary statements |
P260, P261, P264, P270, P271, P280, P301+P312, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P310, P312, P321, P330, P332+P313, P362, P363, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
3 0 2
|
| Flash point | Non-flammable[4] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 5 mg/m3[4] |
|
REL (Recommended) |
TWA 2 mg/m3[4] |
|
IDLH (Immediate danger) |
25 mg/m3[4] |
| Safety data sheet (SDS) | Hazard.com |
| Related compounds | |
|
Other anions |
Calcium sulfide Calcium hydroxide Calcium selenide Calcium telluride |
|
Other cations |
Beryllium oxide Magnesium oxide Strontium oxide Barium oxide Radium oxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
Calcium oxide (CaO), commonly known as quicklime or burnt lime, is a widely used chemical compound. It is a white, caustic, alkaline, crystalline solid at room temperature. The broadly used term «lime» connotes calcium-containing inorganic materials, in which carbonates, oxides and hydroxides of calcium, silicon, magnesium, aluminium, and iron predominate. By contrast, quicklime specifically applies to the single chemical compound calcium oxide. Calcium oxide that survives processing without reacting in building products such as cement is called free lime.[5]
Quicklime is relatively inexpensive. Both it and a chemical derivative (calcium hydroxide, of which quicklime is the base anhydride) are important commodity chemicals.
Preparation[edit]
Calcium oxide is usually made by the thermal decomposition of materials, such as limestone or seashells, that contain calcium carbonate (CaCO3; mineral calcite) in a lime kiln. This is accomplished by heating the material to above 825 °C (1,517 °F),[6][7] a process called calcination or lime-burning, to liberate a molecule of carbon dioxide (CO2), leaving quicklime behind. This is also one of the few chemical reactions known in prehistoric times.[8]
- CaCO3(s) → CaO(s) + CO2(g)
The quicklime is not stable and, when cooled, will spontaneously react with CO2 from the air until, after enough time, it will be completely converted back to calcium carbonate unless slaked with water to set as lime plaster or lime mortar.
Annual worldwide production of quicklime is around 283 million tonnes. China is by far the world’s largest producer, with a total of around 170 million tonnes per year. The United States is the next largest, with around 20 million tonnes per year.[9]
Approximately 1.8 t of limestone is required per 1.0 t of quicklime. Quicklime has a high affinity for water and is a more efficient desiccant than silica gel. The reaction of quicklime with water is associated with an increase in volume by a factor of at least 2.5.[10]
Uses[edit]
A demonstration of slaking of quicklime as a strongly exothermic reaction. Drops of water are added to pieces of quicklime. After a while, a pronounced exothermic reaction occurs (‘slaking of lime’). The temperature can reach up to some 300 °C (572 °F).
- The major use of quicklime is in the basic oxygen steelmaking (BOS) process. Its usage varies from about 30 to 50 kilograms (65–110 lb) per ton of steel. The quicklime neutralizes the acidic oxides, SiO2, Al2O3, and Fe2O3, to produce a basic molten slag.[10]
- Ground quicklime is used in the production of aerated concrete blocks, with densities of ca. 0.6–1.0 g/cm3 (9.8–16.4 g/cu in).[10]
- Quicklime and hydrated lime can considerably increase the load carrying capacity of clay-containing soils. They do this by reacting with finely divided silica and alumina to produce calcium silicates and aluminates, which possess cementing properties.[10]
- Small quantities of quicklime are used in other processes; e.g., the production of glass, calcium aluminate cement, and organic chemicals.[10]
- Heat: Quicklime releases thermal energy by the formation of the hydrate, calcium hydroxide, by the following equation:[11]
-
- CaO (s) + H2O (l) ⇌ Ca(OH)2 (aq) (ΔHr = −63.7 kJ/mol of CaO)
- As it hydrates, an exothermic reaction results and the solid puffs up. The hydrate can be reconverted to quicklime by removing the water by heating it to redness to reverse the hydration reaction. One litre of water combines with approximately 3.1 kilograms (6.8 lb) of quicklime to give calcium hydroxide plus 3.54 MJ of energy. This process can be used to provide a convenient portable source of heat, as for on-the-spot food warming in a self-heating can, cooking, and heating water without open flames. Several companies sell cooking kits using this heating method.[12]
- It is known as a food additive to the FAO as an acidity regulator, a flour treatment agent and as a leavener.[13] It has E number E529.
- Light: When quicklime is heated to 2,400 °C (4,350 °F), it emits an intense glow. This form of illumination is known as a limelight, and was used broadly in theatrical productions before the invention of electric lighting.[14]
- Cement: Calcium oxide is a key ingredient for the process of making cement.
- As a cheap and widely available alkali. About 50% of the total quicklime production is converted to calcium hydroxide before use. Both quick- and hydrated lime are used in the treatment of drinking water.[10]
- Petroleum industry: Water detection pastes contain a mix of calcium oxide and phenolphthalein. Should this paste come into contact with water in a fuel storage tank, the CaO reacts with the water to form calcium hydroxide. Calcium hydroxide has a high enough pH to turn the phenolphthalein a vivid purplish-pink color, thus indicating the presence of water.
- Paper: Calcium oxide is used to regenerate sodium hydroxide from sodium carbonate in the chemical recovery at Kraft pulp mills.
- Plaster: There is archeological evidence that Pre-Pottery Neolithic B humans used limestone-based plaster for flooring and other uses.[15][16][17] Such Lime-ash floor remained in use until the late nineteenth century.
- Chemical or power production: Solid sprays or slurries of calcium oxide can be used to remove sulfur dioxide from exhaust streams in a process called flue-gas desulfurization.
- Mining: Compressed lime cartridges exploit the exothermic properties of quicklime to break rock. A shot hole is drilled into the rock in the usual way and a sealed cartridge of quicklime is placed within and tamped. A quantity of water is then injected into the cartridge and the resulting release of steam, together with the greater volume of the residual hydrated solid, breaks the rock apart. The method does not work if the rock is particularly hard.[18][19][20]
- Disposal of corpses: Historically, it was mistakenly believed that quicklime was efficacious in accelerating the decomposition of corpses. The application of quicklime can, in fact, promote preservation. Quicklime can aid in eradicating the stench of decomposition, which may have led people to the erroneous conclusion.[21]
Weapon[edit]
In 80 BC, the Roman general Sertorius deployed choking clouds of caustic lime powder to defeat the Characitani of Hispania, who had taken refuge in inaccessible caves.[22] A similar dust was used in China to quell an armed peasant revolt in 178 AD, when lime chariots equipped with bellows blew limestone powder into the crowds.[23]
Quicklime is also thought to have been a component of Greek fire. Upon contact with water, quicklime would increase its temperature above 150 °C (302 °F) and ignite the fuel.[24]
David Hume, in his History of England, recounts that early in the reign of Henry III, the English Navy destroyed an invading French fleet by blinding the enemy fleet with quicklime.[25] Quicklime may have been used in medieval naval warfare – up to the use of «lime-mortars» to throw it at the enemy ships.[26]
Substitutes[edit]
Limestone is a substitute for lime in many applications, which include agriculture, fluxing, and sulfur removal. Limestone, which contains less reactive material, is slower to react and may have other disadvantages compared with lime, depending on the application; however, limestone is considerably less expensive than lime. Calcined gypsum is an alternative material in industrial plasters and mortars. Cement, cement kiln dust, fly ash, and lime kiln dust are potential substitutes for some construction uses of lime. Magnesium hydroxide is a substitute for lime in pH control, and magnesium oxide is a substitute for dolomitic lime as a flux in steelmaking.[27]
Safety[edit]
Because of vigorous reaction of quicklime with water, quicklime causes severe irritation when inhaled or placed in contact with moist skin or eyes. Inhalation may cause coughing, sneezing, and labored breathing. It may then evolve into burns with perforation of the nasal septum, abdominal pain, nausea and vomiting. Although quicklime is not considered a fire hazard, its reaction with water can release enough heat to ignite combustible materials.[28]
Natural occurrence[edit]
It is noteworthy that CaO is also a separate mineral species, named lime. A pyrometamorphic mineral, it is rare, as it is unstable in moist air quickly turning into portlandite, Ca(OH)2.[29][30]
References[edit]
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.55. ISBN 1-4398-5511-0.
- ^ Calciumoxid Archived 2013-12-30 at the Wayback Machine. GESTIS database
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0093». National Institute for Occupational Safety and Health (NIOSH).
- ^ «free lime» Archived 2017-12-09 at the Wayback Machine. DictionaryOfConstruction.com.
- ^ Merck Index of Chemicals and Drugs, 9th edition monograph 1650
- ^ Kumar, Gupta Sudhir; Ramakrishnan, Anushuya; Hung, Yung-Tse (2007), Wang, Lawrence K.; Hung, Yung-Tse; Shammas, Nazih K. (eds.), «Lime Calcination», Advanced Physicochemical Treatment Technologies, Totowa, NJ: Humana Press, vol. 5, pp. 611–633, doi:10.1007/978-1-59745-173-4_14, ISBN 978-1-58829-860-7, retrieved 2022-07-26
- ^ «Lime throughout history | Lhoist — Minerals and lime producer». Lhoist.com. Retrieved 10 March 2022.
- ^ Miller, M. Michael (2007). «Lime». Minerals Yearbook (PDF). U.S. Geological Survey. p. 43.13.
- ^ a b c d e f Tony Oates (2007), «Lime and Limestone», Ullmann’s Encyclopedia of Industrial Chemistry (7th ed.), Wiley, pp. 1–32, doi:10.1002/14356007.a15_317, ISBN 978-3527306732
- ^ Collie, Robert L. «Solar heating system» U.S. Patent 3,955,554 issued May 11, 1976
- ^ Gretton, Lel. «Lime power for cooking — medieval pots to 21st century cans». Old & Interesting. Retrieved 13 February 2018.
- ^ «Compound Summary for CID 14778 — Calcium Oxide». PubChem.
- ^ Gray, Theodore (September 2007). «Limelight in the Limelight». Popular Science: 84. Archived from the original on 2008-10-13. Retrieved 2009-03-31.
- ^ Neolithic man: The first lumberjack?. Phys.org (August 9, 2012). Retrieved on 2013-01-22.
- ^ Karkanas, P.; Stratouli, G. (2011). «Neolithic Lime Plastered Floors in Drakaina Cave, Kephalonia Island, Western Greece: Evidence of the Significance of the Site». The Annual of the British School at Athens. 103: 27–41. doi:10.1017/S006824540000006X. S2CID 129562287.
- ^ Connelly, Ashley Nicole (May 2012) Analysis and Interpretation of Neolithic Near Eastern Mortuary Rituals from a Community-Based Perspective. Baylor University Thesis, Texas
- ^ Walker, Thomas A (1888). The Severn Tunnel Its Construction and Difficulties. London: Richard Bentley and Son. p. 92.
- ^ «Scientific and Industrial Notes». Manchester Times. Manchester, England: 8. 13 May 1882.
- ^ US Patent 255042, 14 March 1882
- ^
- ^ Plutarch, «Sertorius 17.1–7», Parallel Lives
- ^ Adrienne Mayor (2005), «Ancient Warfare and Toxicology», in Philip Wexler (ed.), Encyclopedia of Toxicology, vol. 4 (2nd ed.), Elsevier, pp. 117–121, ISBN 0-12-745354-7
- ^ Croddy, Eric (2002). Chemical and biological warfare: a comprehensive survey for the concerned citizen. Springer. p. 128. ISBN 0-387-95076-1.
- ^ David Hume (1756). History of England. Vol. I.
- ^ Sayers, W. (2006). «The Use of Quicklime in Medieval Naval Warfare». The Mariner’s Mirror. Volume 92. Issue 3. pp. 262–269.
- ^ «Lime» (PDF). Prd-wret.s3-us-west-2.amazonaws.com. p. 96. Retrieved 2022-03-10.
- ^ CaO MSDS Archived 2012-05-01 at the Wayback Machine. Hazard.com
- ^ «Lime». Mindat.org. Retrieved 10 March 2022.
- ^ «List of Minerals». Ima-mineralogy.org. 21 March 2011.
External links[edit]
- Lime Statistics & Information from the United States Geological Survey
- Factors Affecting the Quality of Quicklime
- American Scientist (discussion of 14C dating of mortar)
- Chemical of the Week – Lime
- Material Safety Data Sheet
- CDC – NIOSH Pocket Guide to Chemical Hazards

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Calcium oxide |
|
| Other names
Quicklime, burnt lime, unslaked lime, pebble lime, calcia |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.763 |
| EC Number |
|
| E number | E529 (acidity regulators, …) |
|
Gmelin Reference |
485425 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1910 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
CaO |
| Molar mass | 56.0774 g/mol |
| Appearance | White to pale yellow/brown powder |
| Odor | Odorless |
| Density | 3.34 g/cm3[1] |
| Melting point | 2,613 °C (4,735 °F; 2,886 K)[1] |
| Boiling point | 2,850 °C (5,160 °F; 3,120 K) (100 hPa)[2] |
|
Solubility in water |
Reacts to form calcium hydroxide |
| Solubility in Methanol | Insoluble (also in diethyl ether, octanol) |
| Acidity (pKa) | 12.8 |
|
Magnetic susceptibility (χ) |
−15.0×10−6 cm3/mol |
| Structure | |
|
Crystal structure |
Cubic, cF8 |
| Thermochemistry | |
|
Std molar |
40 J·mol−1·K−1[3] |
|
Std enthalpy of |
−635 kJ·mol−1[3] |
| Pharmacology | |
|
ATCvet code |
QP53AX18 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H314, H315, H335 |
|
Precautionary statements |
P260, P261, P264, P270, P271, P280, P301+P312, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P310, P312, P321, P330, P332+P313, P362, P363, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
3 0 2
|
| Flash point | Non-flammable[4] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 5 mg/m3[4] |
|
REL (Recommended) |
TWA 2 mg/m3[4] |
|
IDLH (Immediate danger) |
25 mg/m3[4] |
| Safety data sheet (SDS) | Hazard.com |
| Related compounds | |
|
Other anions |
Calcium sulfide Calcium hydroxide Calcium selenide Calcium telluride |
|
Other cations |
Beryllium oxide Magnesium oxide Strontium oxide Barium oxide Radium oxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
Calcium oxide (CaO), commonly known as quicklime or burnt lime, is a widely used chemical compound. It is a white, caustic, alkaline, crystalline solid at room temperature. The broadly used term «lime» connotes calcium-containing inorganic materials, in which carbonates, oxides and hydroxides of calcium, silicon, magnesium, aluminium, and iron predominate. By contrast, quicklime specifically applies to the single chemical compound calcium oxide. Calcium oxide that survives processing without reacting in building products such as cement is called free lime.[5]
Quicklime is relatively inexpensive. Both it and a chemical derivative (calcium hydroxide, of which quicklime is the base anhydride) are important commodity chemicals.
Preparation[edit]
Calcium oxide is usually made by the thermal decomposition of materials, such as limestone or seashells, that contain calcium carbonate (CaCO3; mineral calcite) in a lime kiln. This is accomplished by heating the material to above 825 °C (1,517 °F),[6][7] a process called calcination or lime-burning, to liberate a molecule of carbon dioxide (CO2), leaving quicklime behind. This is also one of the few chemical reactions known in prehistoric times.[8]
- CaCO3(s) → CaO(s) + CO2(g)
The quicklime is not stable and, when cooled, will spontaneously react with CO2 from the air until, after enough time, it will be completely converted back to calcium carbonate unless slaked with water to set as lime plaster or lime mortar.
Annual worldwide production of quicklime is around 283 million tonnes. China is by far the world’s largest producer, with a total of around 170 million tonnes per year. The United States is the next largest, with around 20 million tonnes per year.[9]
Approximately 1.8 t of limestone is required per 1.0 t of quicklime. Quicklime has a high affinity for water and is a more efficient desiccant than silica gel. The reaction of quicklime with water is associated with an increase in volume by a factor of at least 2.5.[10]
Uses[edit]
A demonstration of slaking of quicklime as a strongly exothermic reaction. Drops of water are added to pieces of quicklime. After a while, a pronounced exothermic reaction occurs (‘slaking of lime’). The temperature can reach up to some 300 °C (572 °F).
- The major use of quicklime is in the basic oxygen steelmaking (BOS) process. Its usage varies from about 30 to 50 kilograms (65–110 lb) per ton of steel. The quicklime neutralizes the acidic oxides, SiO2, Al2O3, and Fe2O3, to produce a basic molten slag.[10]
- Ground quicklime is used in the production of aerated concrete blocks, with densities of ca. 0.6–1.0 g/cm3 (9.8–16.4 g/cu in).[10]
- Quicklime and hydrated lime can considerably increase the load carrying capacity of clay-containing soils. They do this by reacting with finely divided silica and alumina to produce calcium silicates and aluminates, which possess cementing properties.[10]
- Small quantities of quicklime are used in other processes; e.g., the production of glass, calcium aluminate cement, and organic chemicals.[10]
- Heat: Quicklime releases thermal energy by the formation of the hydrate, calcium hydroxide, by the following equation:[11]
-
- CaO (s) + H2O (l) ⇌ Ca(OH)2 (aq) (ΔHr = −63.7 kJ/mol of CaO)
- As it hydrates, an exothermic reaction results and the solid puffs up. The hydrate can be reconverted to quicklime by removing the water by heating it to redness to reverse the hydration reaction. One litre of water combines with approximately 3.1 kilograms (6.8 lb) of quicklime to give calcium hydroxide plus 3.54 MJ of energy. This process can be used to provide a convenient portable source of heat, as for on-the-spot food warming in a self-heating can, cooking, and heating water without open flames. Several companies sell cooking kits using this heating method.[12]
- It is known as a food additive to the FAO as an acidity regulator, a flour treatment agent and as a leavener.[13] It has E number E529.
- Light: When quicklime is heated to 2,400 °C (4,350 °F), it emits an intense glow. This form of illumination is known as a limelight, and was used broadly in theatrical productions before the invention of electric lighting.[14]
- Cement: Calcium oxide is a key ingredient for the process of making cement.
- As a cheap and widely available alkali. About 50% of the total quicklime production is converted to calcium hydroxide before use. Both quick- and hydrated lime are used in the treatment of drinking water.[10]
- Petroleum industry: Water detection pastes contain a mix of calcium oxide and phenolphthalein. Should this paste come into contact with water in a fuel storage tank, the CaO reacts with the water to form calcium hydroxide. Calcium hydroxide has a high enough pH to turn the phenolphthalein a vivid purplish-pink color, thus indicating the presence of water.
- Paper: Calcium oxide is used to regenerate sodium hydroxide from sodium carbonate in the chemical recovery at Kraft pulp mills.
- Plaster: There is archeological evidence that Pre-Pottery Neolithic B humans used limestone-based plaster for flooring and other uses.[15][16][17] Such Lime-ash floor remained in use until the late nineteenth century.
- Chemical or power production: Solid sprays or slurries of calcium oxide can be used to remove sulfur dioxide from exhaust streams in a process called flue-gas desulfurization.
- Mining: Compressed lime cartridges exploit the exothermic properties of quicklime to break rock. A shot hole is drilled into the rock in the usual way and a sealed cartridge of quicklime is placed within and tamped. A quantity of water is then injected into the cartridge and the resulting release of steam, together with the greater volume of the residual hydrated solid, breaks the rock apart. The method does not work if the rock is particularly hard.[18][19][20]
- Disposal of corpses: Historically, it was mistakenly believed that quicklime was efficacious in accelerating the decomposition of corpses. The application of quicklime can, in fact, promote preservation. Quicklime can aid in eradicating the stench of decomposition, which may have led people to the erroneous conclusion.[21]
Weapon[edit]
In 80 BC, the Roman general Sertorius deployed choking clouds of caustic lime powder to defeat the Characitani of Hispania, who had taken refuge in inaccessible caves.[22] A similar dust was used in China to quell an armed peasant revolt in 178 AD, when lime chariots equipped with bellows blew limestone powder into the crowds.[23]
Quicklime is also thought to have been a component of Greek fire. Upon contact with water, quicklime would increase its temperature above 150 °C (302 °F) and ignite the fuel.[24]
David Hume, in his History of England, recounts that early in the reign of Henry III, the English Navy destroyed an invading French fleet by blinding the enemy fleet with quicklime.[25] Quicklime may have been used in medieval naval warfare – up to the use of «lime-mortars» to throw it at the enemy ships.[26]
Substitutes[edit]
Limestone is a substitute for lime in many applications, which include agriculture, fluxing, and sulfur removal. Limestone, which contains less reactive material, is slower to react and may have other disadvantages compared with lime, depending on the application; however, limestone is considerably less expensive than lime. Calcined gypsum is an alternative material in industrial plasters and mortars. Cement, cement kiln dust, fly ash, and lime kiln dust are potential substitutes for some construction uses of lime. Magnesium hydroxide is a substitute for lime in pH control, and magnesium oxide is a substitute for dolomitic lime as a flux in steelmaking.[27]
Safety[edit]
Because of vigorous reaction of quicklime with water, quicklime causes severe irritation when inhaled or placed in contact with moist skin or eyes. Inhalation may cause coughing, sneezing, and labored breathing. It may then evolve into burns with perforation of the nasal septum, abdominal pain, nausea and vomiting. Although quicklime is not considered a fire hazard, its reaction with water can release enough heat to ignite combustible materials.[28]
Natural occurrence[edit]
It is noteworthy that CaO is also a separate mineral species, named lime. A pyrometamorphic mineral, it is rare, as it is unstable in moist air quickly turning into portlandite, Ca(OH)2.[29][30]
References[edit]
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.55. ISBN 1-4398-5511-0.
- ^ Calciumoxid Archived 2013-12-30 at the Wayback Machine. GESTIS database
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0093». National Institute for Occupational Safety and Health (NIOSH).
- ^ «free lime» Archived 2017-12-09 at the Wayback Machine. DictionaryOfConstruction.com.
- ^ Merck Index of Chemicals and Drugs, 9th edition monograph 1650
- ^ Kumar, Gupta Sudhir; Ramakrishnan, Anushuya; Hung, Yung-Tse (2007), Wang, Lawrence K.; Hung, Yung-Tse; Shammas, Nazih K. (eds.), «Lime Calcination», Advanced Physicochemical Treatment Technologies, Totowa, NJ: Humana Press, vol. 5, pp. 611–633, doi:10.1007/978-1-59745-173-4_14, ISBN 978-1-58829-860-7, retrieved 2022-07-26
- ^ «Lime throughout history | Lhoist — Minerals and lime producer». Lhoist.com. Retrieved 10 March 2022.
- ^ Miller, M. Michael (2007). «Lime». Minerals Yearbook (PDF). U.S. Geological Survey. p. 43.13.
- ^ a b c d e f Tony Oates (2007), «Lime and Limestone», Ullmann’s Encyclopedia of Industrial Chemistry (7th ed.), Wiley, pp. 1–32, doi:10.1002/14356007.a15_317, ISBN 978-3527306732
- ^ Collie, Robert L. «Solar heating system» U.S. Patent 3,955,554 issued May 11, 1976
- ^ Gretton, Lel. «Lime power for cooking — medieval pots to 21st century cans». Old & Interesting. Retrieved 13 February 2018.
- ^ «Compound Summary for CID 14778 — Calcium Oxide». PubChem.
- ^ Gray, Theodore (September 2007). «Limelight in the Limelight». Popular Science: 84. Archived from the original on 2008-10-13. Retrieved 2009-03-31.
- ^ Neolithic man: The first lumberjack?. Phys.org (August 9, 2012). Retrieved on 2013-01-22.
- ^ Karkanas, P.; Stratouli, G. (2011). «Neolithic Lime Plastered Floors in Drakaina Cave, Kephalonia Island, Western Greece: Evidence of the Significance of the Site». The Annual of the British School at Athens. 103: 27–41. doi:10.1017/S006824540000006X. S2CID 129562287.
- ^ Connelly, Ashley Nicole (May 2012) Analysis and Interpretation of Neolithic Near Eastern Mortuary Rituals from a Community-Based Perspective. Baylor University Thesis, Texas
- ^ Walker, Thomas A (1888). The Severn Tunnel Its Construction and Difficulties. London: Richard Bentley and Son. p. 92.
- ^ «Scientific and Industrial Notes». Manchester Times. Manchester, England: 8. 13 May 1882.
- ^ US Patent 255042, 14 March 1882
- ^
- ^ Plutarch, «Sertorius 17.1–7», Parallel Lives
- ^ Adrienne Mayor (2005), «Ancient Warfare and Toxicology», in Philip Wexler (ed.), Encyclopedia of Toxicology, vol. 4 (2nd ed.), Elsevier, pp. 117–121, ISBN 0-12-745354-7
- ^ Croddy, Eric (2002). Chemical and biological warfare: a comprehensive survey for the concerned citizen. Springer. p. 128. ISBN 0-387-95076-1.
- ^ David Hume (1756). History of England. Vol. I.
- ^ Sayers, W. (2006). «The Use of Quicklime in Medieval Naval Warfare». The Mariner’s Mirror. Volume 92. Issue 3. pp. 262–269.
- ^ «Lime» (PDF). Prd-wret.s3-us-west-2.amazonaws.com. p. 96. Retrieved 2022-03-10.
- ^ CaO MSDS Archived 2012-05-01 at the Wayback Machine. Hazard.com
- ^ «Lime». Mindat.org. Retrieved 10 March 2022.
- ^ «List of Minerals». Ima-mineralogy.org. 21 March 2011.
External links[edit]
- Lime Statistics & Information from the United States Geological Survey
- Factors Affecting the Quality of Quicklime
- American Scientist (discussion of 14C dating of mortar)
- Chemical of the Week – Lime
- Material Safety Data Sheet
- CDC – NIOSH Pocket Guide to Chemical Hazards
Оксид кальция

4.7
Средняя оценка: 4.7
Всего получено оценок: 146.
4.7
Средняя оценка: 4.7
Всего получено оценок: 146.
Негашёная известь – это оксид кальция. Его получают в лабораториях и промышленным путём из природных материалов. Вещество активно используется в строительстве и промышленности.
Физические свойства
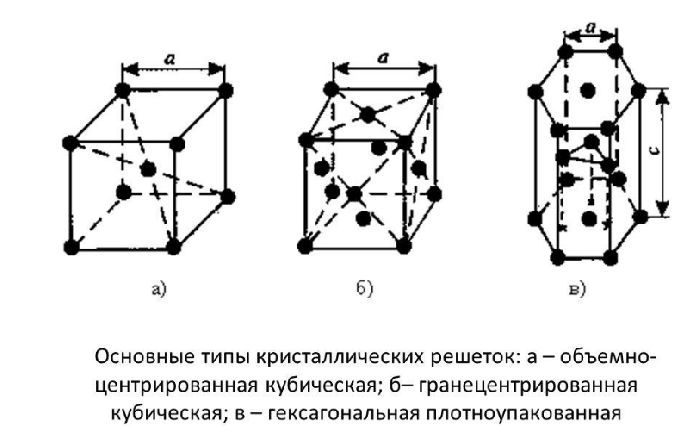
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
Общее описание вещества представлено в таблице.
|
Признак |
Значение |
|
Формула соединения оксид кальция |
CaO |
|
Температура плавления |
2627°C |
|
Температура кипения |
2850°C |
|
Растворимость |
В глицерине. В этаноле не растворяется, с водой образует гидроксид |
|
Молярная масса |
56,077 г/моль |
|
Плотность |
3,37 г/см3 |
|
Химическая связь в кристалле |
Ионная |
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.
Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3).
Это природное вещество, встречающееся в форме минералов – арагонита, ватерита, кальцита. Входит в состав мрамора, мела, известняка.
Реакция получения оксида кальция из известняка выглядит следующим образом:
CaCO3 → CaO + CO2.
Кроме того, негашёную известь можно получить двумя способами:
- из простых веществ, наращивая оксидный слой на металле –
2Ca + O2 → 2CaO;
- при термической обработке гидроксида или солей кальция –
Ca(OH)2 → CaO + H2O; 2Ca(NO3)2 → 2CaO + 4NO2 + O2.
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
|
Реакции |
Что образуется |
Молекулярное уравнение |
|
С водой |
Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла |
CaO + H2O → Ca(OH)2 |
|
С кислотами |
Растворяется, образуя соли |
CaO + 2HCl → CaCl2 +H2O |
|
С оксидами неметаллов (кислотными остатками) |
Образуются соли |
CaO + SO2 → CaSO3 |
|
С углеродом при нагревании |
Образуется карбид кальция |
CaO + 3С → СаС2 + CO |
|
С алюминием |
Восстанавливает кальций. Образуется оксид алюминия |
3CaO + 2Al → Са + Al2O3 |
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
- масел;
- стеарата кальция;
- солидола;
- огнеупорных материалов;
- гипса;
- высокоглиноземистого цемента;
- силикатного кирпича.
Что мы узнали?
Оксид кальция или негашёная известь – кристаллическое вещество, бурно реагирующее с водой и образующее гашёную известь. Широко используется в промышленности, в частности пищевой и строительной. Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Владимир Комаров
10/10
-
Сергей Ефремов
4/10
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 146.
А какая ваша оценка?
| Оксид кальция | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Молярная масса | 56.077 г/моль |
| Плотность | 3.37 г/см³ |
| Термические свойства | |
| Температура плавления | 2570 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -635,09 кДж/моль |
Окси́д ка́льция (окись кальция, негашёная и́звесть или «кипелка», «кираби́т») — белое кристаллическое вещество, формула CaO.
Негашёная известь и продукт её взаимодействия с водой — Ca(OH)2 (гашёная известь или «пушонка») находят обширное использование в строительном деле.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Источники и литература
- 6 Ссылки
Получение
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Физические свойства
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:
-
+ 63.7кДж/моль
Как основный оксид реагирует с кислотными оксидами и кислотами, образуя соли:
Применение
Основные объёмы используются в строительстве при производстве Силикатного кирпича. Раньше известь, так же использовали в качестве известкового цемента — при смешивании с водой, оксид кальция переходит в гидроксид, который далее, поглощая из воздуха углекислый газ, сильно твердеет, превращаясь в карбонат кальция. Однако в настоящее время известковый цемент при строительстве жилых домов стараются не применять, так как полученные строения обладают способностью впитывать и накапливать сырость.
Категорически недопустимо использование известкового цемента при кладке печей — из-за термического разложения и выделения в воздух удушливого диоксида углерода.
Некоторое применение также находит в качестве доступного и недорогого огнеупорного материала — плавленный оксид кальция имеет некоторую устойчивость к воздействию воды, что позволяет его использовать в качестве огнеупора там, где применение более дорогих материалов нецелесообразно.
В небольших количествах оксид кальция также используется в лабораторной практике для осушения веществ, которые не реагируют с ним.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E-529.
В промышленности для удаления диоксида серы из дымовых газов, как правило используют 15% водяной раствор. В результате реакции гашеной извести и диоксида серы получается гипс СaСO3 и СаSO4. В эксперементальных установках добивались показателя в 98% отчиски дымовых газов от диоксида серы.
Так же используется в «самогреющей» посуде. Контейнер с небольшим количеством оксида кальция помещается между двух стенок стакана, а при прокалывании капсулы с водой начинается реакция с выделением тепла.
Источники и литература
- Монастырев А. Производство цемента, извести. Москва, 2007.
- Штарк Йохан, Вихт Бернд. Цемент и известь (Пер. с нем.). Киев, 2008.
Ссылки
- http://www.allbeton.ru/library/78.html
- http://community.livejournal.com/kaduy/38246.html
|
Соединения кальция |
|---|
|
Алюминаты кальция (mCaO·nAl2O3) • Алюмогидрид кальция (Ca[AlH4]2) • Амид кальция (Ca(NH2)2) • Арсенат кальция (Ca3(AsO4)2) • Ацетат кальция ((CH3COO)2Ca) • Бисульфид кальция (Ca(HS)2) • Борат кальция (Ca3(BO3)2) • Бромид кальция (CaBr2) • Вольфрамат кальция (CaWO4) • Гексаборид кальция (CaB6) • Гексафторсиликат кальция (CaSiF6) • Гидрид кальция (CaH2) • Гидроксид кальция (Ca(OH)2) • Гидроортофосфат кальция (CaHPO4) • Гипофосфит кальция (Ca(PH2O2)) • Гипохлорит кальция (Ca(ClO)2) • Глицерофосфат кальция (C3H7CaO6P) • Глюконат кальция (C12H22CaO14) • Дигидрокарбонат кальция (Ca(HCO3)2) • 2,5-дигидроксибензолсульфонат кальция (C12H10CaO10S2) • Дигидроортофосфат кальция (Ca(H2PO4)2) • Иодат кальция (Ca(IO3)2) • Иодид кальция (CaI2) • Карбид кальция (CaC2) • Карбонат кальция (CaCO3) • Моносилицид кальция (CaSi) • Нитрат кальция (Са(NО3)2) • Нитрид кальция (Ca3N2) • Оксалат кальция (СаС2О4) • Оксид кальция (CaO) • Ортофосфат кальция (Ca3(PO4)2) • Перманганат кальция (Ca(MnO4)2) • Пероксид кальция (CaO2) • Пирофосфат кальция (Ca2P2O7) • Силикат кальция (CaSiO3) • Силицид дикальция (Ca2Si) • Силицид кальция (CaSi2) • Сульфат кальция (CaSO4) • Сульфид кальция (CaS) • Сульфит кальция (CaSO3) • Тетрагидроалюминат кальция (Ca(AlH4)2) • Титанат кальция (CaTiO3) • Триметафосфат кальция (Ca3(P3O9)2) • Флюорит (CaF2) • Формиат кальция (Ca(HCOO)2) • Фосфид кальция (Ca3P2) • Фторид кальция (CaF2) • Хлорат кальция (Ca(ClO3)2) • Хлорид кальция (CaCl2) • Хлорная известь (Ca(Cl)OCl) • Хромат кальция (CaCrO4) • Цианамид кальция (CaCN2) • Цианид кальция (Ca(CN)2) • Цитрат кальция (Ca3(C6H5O7)2) • |
Морфемный разбор слова:
Однокоренные слова к слову:
Оксид кальция: способы получения и химические свойства
Оксид кальция CaO — бинарное неорганическое вещество . Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Химические свойства
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
Источник
Оксид кальция
| Оксид кальция | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Молярная масса | 56.077 г/моль |
| Плотность | 3.37 г/см³ |
| Термические свойства | |
| Температура плавления | 2570 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -635,09 кДж/моль |
Окси́д ка́льция (окись кальция, негашёная и́звесть или «кипелка», «кираби́т») — белое кристаллическое вещество, формула CaO.
Негашёная известь и продукт её взаимодействия с водой — Ca(OH)2 (гашёная известь или «пушонка») находят обширное использование в строительном деле.
Содержание
Получение
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Физические свойства
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:

Как основный оксид реагирует с кислотными оксидами и кислотами, образуя соли:

Применение
Основные объёмы используются в строительстве при производстве Силикатного кирпича. Раньше известь, так же использовали в качестве известкового цемента — при смешивании с водой, оксид кальция переходит в гидроксид, который далее, поглощая из воздуха углекислый газ, сильно твердеет, превращаясь в карбонат кальция. Однако в настоящее время известковый цемент при строительстве жилых домов стараются не применять, так как полученные строения обладают способностью впитывать и накапливать сырость.
Категорически недопустимо использование известкового цемента при кладке печей — из-за термического разложения и выделения в воздух удушливого диоксида углерода.
Некоторое применение также находит в качестве доступного и недорогого огнеупорного материала — плавленный оксид кальция имеет некоторую устойчивость к воздействию воды, что позволяет его использовать в качестве огнеупора там, где применение более дорогих материалов нецелесообразно.
В небольших количествах оксид кальция также используется в лабораторной практике для осушения веществ, которые не реагируют с ним.
В промышленности для удаления диоксида серы из дымовых газов, как правило используют 15% водяной раствор. В результате реакции гашеной извести и диоксида серы получается гипс СaСO3 и СаSO4. В эксперементальных установках добивались показателя в 98% отчиски дымовых газов от диоксида серы.
Так же используется в «самогреющей» посуде. Контейнер с небольшим количеством оксида кальция помещается между двух стенок стакана, а при прокалывании капсулы с водой начинается реакция с выделением тепла.
Источник
Кальция оксид
Кальция оксид
| Оксид кальция | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Молярная масса | 56.077 г/моль |
| Физические свойства | |
| Плотность вещества | 3.37 г/см³ |
| Состояние (ст. усл.) | твердое |
| Термические свойства | |
| Температура плавления | 2627 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия (ст. усл.) | -635,09 кДж/моль |
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
И при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:
Как основной оксид реагирует с кислотными оксидами и кислотами, образуя соли:
Применение
Полезное
Смотреть что такое «Кальция оксид» в других словарях:
КАЛЬЦИЯ ОКСИД — СаО, бесцветные кристаллы. Технический продукт (известь негашеная) порошкообразный. Энергично реагирует с водой с выделением большого количества тепла (процесс гашения): СаО + Н2О = Са(ОН)2. Применяют в строительстве, в химической промышленности … Большой Энциклопедический словарь
кальция оксид — CaO, бесцветные кристаллы. Технический продукт (известь негашёная) порошкообразный. Энергично реагирует с водой с выделением большого количества тепла (процесс гашения): СаО+Н2О=Ca(ОН)2. Применяют в строительстве, в химической промышленности,… … Энциклопедический словарь
кальция оксид — kalcio oksidas statusas T sritis chemija formulė CaO atitikmenys: angl. burnt lime; calcium oxide; calx; caustic lime; lime; quicklime rus. жженая известь; кальция оксид; негашеная известь; обожженная известь ryšiai: sinonimas – degtos kalkės… … Chemijos terminų aiškinamasis žodynas
КАЛЬЦИЯ ОКСИД — СаО, бесцв. кристаллы с кубич. решеткой ( а =0,4812 нм, z = 4, пространств. группа Fm3m); т. пл. 2627 °С, т. кип. 2850 °С; плотн. 3,37 г/см 3; С° з 42,05 Дж/(моль. К); DH0 обр 635,09 кДж/моль, DH0 пл 52 кДж/моль; S0298 38,10 Дж/(моль … Химическая энциклопедия
КАЛЬЦИЯ ОКСИД — СаО, бесцв. кристаллы. Техн. продукт (известь негашёная) порошкообразный. Энергично реагирует с водой с выделением большого кол ва теплоты (процесс гашения): СаО+ Н2О = Са(ОН)2. Применяют в стр ве, в хим. пром сти, металлургии, с. х ве, при… … Естествознание. Энциклопедический словарь
Оксид кальция — Общие … Википедия
Оксид кальция(II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид кальция (II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Кальция окись — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
КАЛЬЦИЯ ГИДРОКСИД — см. Кальция оксид, Известь … Химическая энциклопедия
Источник
Окись кальция
Окись кальция
| Оксид кальция | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Молярная масса | 56.077 г/моль |
| Физические свойства | |
| Плотность вещества | 3.37 г/см³ |
| Состояние (ст. усл.) | твердое |
| Термические свойства | |
| Температура плавления | 2627 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия (ст. усл.) | -635,09 кДж/моль |
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
И при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:
Как основной оксид реагирует с кислотными оксидами и кислотами, образуя соли:
Применение
Полезное
Смотреть что такое «Окись кальция» в других словарях:
окись кальция — Регулятор кислотности пищевого продукта, получаемый обжигом извести в печах при температурах от 900 °С до 1200 °С, содержащий основного вещества СаО не менее 95,0 % по остатку от сжигания, фторидов не более 50 мг/кг, бария не более 300… … Справочник технического переводчика
Кальция окись — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Кальция оксид — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Окись этилена — Окись этилена … Википедия
Окись азота — Оксид азота(II) Общие Систематическое наименование Оксид азота(II) Химическая формула … Википедия
Кальция окись — негашёная известь, кипелка, CaO, соединение кальция с кислородом; бесцветные кристаллы, плотность 3,4 г/см3, tпл 2585 °С. Технический продукт белое пористое вещество. К. о. жадно реагирует с водой с выделением большого количества тепла и… … Большая советская энциклопедия
Окись дифенилена — (oxyde de biphénylène, Di[Bi]phenylenoxyd) находится (около 0,3%) в смоле (Stupp, Stuppfett,), получающейся при перегонке без доступа воздуха ртутной руды в Идрии (Гольдшмидт и Шмидт); образуется при перегонке трехфенильного эфира ортофосфорной… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ОКСИД КАЛЬЦИЯ — окись кальция, негашеная известь, кипелка СаО бесцветные кристаллы; плотность 3400 кг/м3; tпл=2585° С; обладает основными свойствами. Технический продукт белое пористое вещество. Оксид кальция жадно реагирует с водой с образованием… … Металлургический словарь
ГОСТ 21639.3-93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния — Терминология ГОСТ 21639.3 93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния оригинал документа: 8.2 Аппаратура, реактивы и растворы Спектрофотометр атомно абсорбционный любого типа с источником излучения… … Словарь-справочник терминов нормативно-технической документации
Оксид кальция — Общие … Википедия
Источник
Оксид кальция (II)
Оксид кальция (II)
| Оксид кальция | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Молярная масса | 56.077 г/моль |
| Физические свойства | |
| Плотность вещества | 3.37 г/см³ |
| Состояние (ст. усл.) | твердое |
| Термические свойства | |
| Температура плавления | 2627 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия (ст. усл.) | -635,09 кДж/моль |
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
И при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:
Как основной оксид реагирует с кислотными оксидами и кислотами, образуя соли:
Применение
Полезное
Смотреть что такое «Оксид кальция (II)» в других словарях:
Оксид кальция — Общие … Википедия
Оксид кальция(II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
ОКСИД КАЛЬЦИЯ — (негашеная известь, СаО), твердое вещество белого цвета, получаемое путем нагрева карбоната кальция (СаСО3) до высоких температур. Его применяют для обработки кислотных почв, для изготовления фарфора и стекла, отбеливателей, каустической соды,… … Научно-технический энциклопедический словарь
оксид кальция — (CaO) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN calcium oxide … Справочник технического переводчика
ОКСИД КАЛЬЦИЯ — окись кальция, негашеная известь, кипелка СаО бесцветные кристаллы; плотность 3400 кг/м3; tпл=2585° С; обладает основными свойствами. Технический продукт белое пористое вещество. Оксид кальция жадно реагирует с водой с образованием… … Металлургический словарь
Химически активный оксид кальция — (СаО) – фракция оксида кальция, которая при нормальных условиях затвердевания цемента может формировать гидраты силиката кальция или гидраты алюмината кальция. Примечание: Для оценки этой фракции общее содержание оксида кальция (см. EN 196 … Энциклопедия терминов, определений и пояснений строительных материалов
Кальция оксид — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Кальция окись — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Кальция гидроксид — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Кальция гидроокись — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется оксид кальция в химии, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется оксид кальция в химии», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
Содержание
- Получение
- Физические свойства
- Химические свойства
- Применение
- Безопасность
Оксид кальция — белое кристаллическое вещество, формула CaO.
| Оксид кальция | |
|---|---|
| Общие | |
| Систематическое наименование |
Оксид кальция, окись кальция |
| Хим. формула | CaO |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 56.077 г/моль |
| Плотность | 3.37 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 2570 °C |
| • кипения | 2850 °C |
| Мол. теплоёмк. | 42.05 Дж/(моль·К) |
| Энтальпия | |
| • образования | -635.09 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Классификация | |
| Рег. номер CAS | 1305-78-8 |
| PubChem | 14778 |
| Рег. номер EINECS | 215-138-9 |
| SMILES |
O=[Ca] |
| InChI |
1S/Ca.O ODINCKMPIJJUCX-UHFFFAOYSA-N |
| Кодекс Алиментариус | E529 |
| RTECS | EW3100000 |
| ChEBI | 31344 |
| Номер ООН | 1910 |
| ChemSpider | 14095 |
| Безопасность | |
| Пиктограммы ECB |  |
| NFPA 704 |
Негашёная известь и продукт её взаимодействия с водой — Ca(OH)2 (гашёная известь, или «пушонка») находят обширное использование в строительном деле.
Получение
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ, на практике в виде корки на металле:
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Физические свойства
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической кристаллической решётке, по типу хлорида натрия.
Химические свойства
Оксид кальция относится к основным оксидам. Энергично взаимодействует с водой с выделением тепла и образованием гидроксида кальция, насыщенный раствор которого является сильным основанием:
-
+ 63,7 кДж/моль.
При температуре выше 580 °C эта реакция обратима.
Как основный оксид реагирует с кислотными оксидами и кислотами, образуя соли:
При нагревании с углеродом в высокотемпературной печи или электрической дуге образует карбид кальция (используемый для получения ацетилена):
Несмотря на массовое промышленное производство ацетилена более эффективными способами, эта реакция сохраняет небольшое практическое значение, так как карбид кальция является удобным источником ацетилена в лабораторной практике и в аппаратах для сварочных работ.
Применение
В настоящее время в основном используются в производстве строительных материалов, высокоглиноземистого цемента, силикатного кирпича и т.д.
До второй половины XX века известь широко использовали в качестве строительной побелки — прокаленный мел или известняк (оксид кальция) при смешивании с водой образует ярко-белую гашеную известь (Ca(OH)2), обладающую хорошими адгезионными свойствами к различным поверхностям. Далее известь медленно поглощает из воздуха углекислый газ, покрываясь коркой карбоната кальция. В настоящее время известковый раствор при строительстве жилых домов практически не применяется в виду значительной гигроскопичности (склонности поддерживать высокую влажность, провоцирующую рост плесени) и сложности производства работ, уступив место более эффективным материалам.
В лабораторной практике оксид кальция используется как дешевый и эффективный агент для осушения растворителей и жидких веществ.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E-529.
В промышленности водный раствор используют в одном из способов удаления диоксида серы из дымовых газов. В результате реакции гашеной извести Са(OH)2 и диоксида серы получается осадок сульфита кальция СаSO3. В настоящее время вытеснен современными абсорберами на основе четвертичных аммонийных соединений, способных обратимо связывать SO2 и CO2.
Использовался в «саморазогревающейся» посуде. Оксид кальция, помещенный между двух стенок емкости, при прокалывании капсулы с водой реагирует с ней с выделением тепла.
Безопасность
Оксид кальция относится к высокоопасным веществам. (Класс опасности 2). Это едкое вещество, особенно опасен при смешивании с водой.
В виде пыли или капель взвеси раздражают слизистые, вызывая чихание и кашель.
Действие CaO, подобно действию щелочи, состоит в омылении жиров, поглощении из кожи влаги, растворении белков, раздражении и прижигании тканей.
Сильно действует на слизистую глаз. На слизистой рта и носа наблюдаются поверхностные изъязвления; иногда прободение носовой перегородки.
Страдают также глубокие дыхательные пути.
Оксид кальция, характеристика, свойства и получение, химические реакции.
Оксид кальция – неорганическое вещество, имеет химическую формулу CaO.
Краткая характеристика оксида кальция
Физические свойства оксида кальция Иные свойства оксида кальция
Получение оксида кальция
Химические свойства оксида кальция
Химические реакции оксида кальция
Применение и использование оксида кальция
Краткая характеристика оксида кальция:
Оксид кальция – неорганическое вещество, порошок от белого до бледно-жёлтого цвета либо бесцветные кристаллы. Не имет запаха.
Так как валентность кальция равна двум, то оксид кальция содержит один атом кислорода и один атом кальция.
Химическая формула оксида кальция CaO.
Оксид кальция широко известен как негашёная известь.
Оксид кальция в воде не растворяется, а вступает в реакцию с ней. Практически не растворяется в этаноле. Не растворяется в диэтиловом эфире.
Оксид кальция относится к высокотоксическим веществам. Класс опасности 2. Это едкое вещество, особенно опасен при смешивании с водой.
Препарат в виде пыли и капель взвеси раздражает слизистые оболочки органов дыхания, попадая на кожу, вызывает тяжелые ожоги, особенно сильно действует на слизистую оболочку глаз.
Предельно допустимая концентрация в воздухе рабочей зоны производственных помещений – 3 мг/м3.
При работе с препаратом следует применять индивидуальные средства защиты (респираторы, защитные очки, резиновые перчатки), а также соблюдать меры личной гигиены. Не допускать попадания препарата на слизистые оболочки и на кожу.
Помещения, в которых проводятся работы с препаратом, должны быть оборудованы общей приточно-вытяжной вентиляцией, а места наибольшего пыления – укрытиями с местной вытяжной вентиляцией. Испытания препарата в лабораториях следует проводить в вытяжном шкафу.
При проведении анализа окиси кальция с использованием горючего газа следует соблюдать меры противопожарной безопасности.
См. ГОСТ 8677-76 Реактивы. Кальция оксид. Технические условия (с Изменением N 1).
Физические свойства оксида кальция:
| Наименование параметра: | Значение: |
| Химическая формула | CaO |
| Синонимы и названия иностранном языке | calcium oxide (англ.) известь негашеная (рус.) кальция окись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | порошок от белого до бледно-жёлтого цвета либо бесцветные кристаллы, без запаха |
| Цвет | бесцветный, от белого до бледно-жёлтого |
| Вкус | —* |
| Запах | не имеет |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3370 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,37 |
| Температура кипения, °C | 2850 |
| Температура плавления, °C | 2570 |
| Температура возгонки (сублимации), °C | не имеет |
| Температура разложения, °C | не имеет |
| Молярная масса, г/моль | 56,0774 |
* Примечание:
— нет данных.
Получение оксида кальция:
Оксид кальция получается в результате следующих химических реакций:
- 1. путем термического разложения известняка:
Сa2СО3 → CaО + СО2 (t = 900-1200 oC).
Это промышленный способ получения оксида кальция. Технологически данный процесс в промышленности реализуют в специальных шахтных печах.
- 2. путем сжигания кальция на воздухе:
2Сa + О2 → 2CaО (t = 300 oC).
- 3. путем термического разложения гидроксида кальция:
Сa(OH)2 → СaO + H2О (t = 520-580 oC).
- 4. путем термического разложения нитрата кальция:
2Сa(NO3)2 → 2СaO + 4NO2 + O2 (t = 450-500 oC).
Химические свойства оксида кальция. Химические реакции оксида кальция:
Оксид кальция относится к основным оксидам.
Химические свойства оксида кальция аналогичны свойствам основных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида кальция с хлором:
2CaO + 2Cl2 → 2CaCl2 + O2 (t = 700 oC).
В результате реакции образуется хлорид кальция и кислород.
2. реакция оксида кальция с кремнием:
2CaO + 5Si → 2CaSi2 + SiO2 (t = 1300 oC).
В результате реакции образуется силицид кальция и оксид кремния.
3. реакция оксида кальция с углеродом:
CaО + 3С → CaС2 + СО (t = 1900-1950 oC);
2CaO + 5C → 2CaC2 + CO2 (t = 700 oC).
В результате реакции образуется карбид кальция и оксид углерода.
4. реакция оксида кальция с алюминием:
4CaО + 2Al → 2Ca + Ca(AlO2)2 (t = 1200 oC);
2Al + 6CaO → 3CaO•Al2O3 + 3Ca (to);
2Al + 6CaO → Ca3Al2O6 + 3Ca (to).
В результате реакции образуется кальций и соответственно алюминат кальция, оксид алюминия-кальция и алюмината трикальция.
5. реакция оксида кальция с водой:
CaО + Н2О → Ca(ОН)2.
Оксид кальция реагирует с водой, образуя гидроксид кальция. Процесс имеет название «гашение извести». Химическая реакция происходит с выделением энергии (тепла).
6. реакция оксида кальция с оксидом углерода (углекислым газом):
CaО + СО2 → CaСО3.
Оксид кальция реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат кальция.
7. реакция оксида кальция с оксидом серы:
CaО + SО2 → CaSО3;
CaО + SО3 → CaSО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит кальция, во втором случае – сульфат кальция.
8. реакция оксида кальция с оксидом кремния:
CaО + SiО2 → CaSiО3 (t = 1100-1200 oC).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат кальция.
9. реакция оксида кальция с оксидом фосфора:
CaO + P2O5 → Ca(PO3)2;
3CaO + P2O5 → Ca3(PO4)2 (to);
2CaO + P2O5 → Ca2P2O7.
Оксид фосфора также является кислотным оксидом. В результате реакции образуется соль соответственно: метафосфат кальция, фосфат кальция и дифосфата кальция.
Аналогично проходят реакции оксида кальция и с другими кислотными оксидами.
10. реакция оксида кальция с оксидом алюминия:
CaО + Al2O3 → Ca(AlО2)2 (t = 1200-1300 °C).
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – алюминат кальция.
11. реакция оксида кальция с оксидом марганца:
CaО + MnO2 → CaMnO3 (t°);
Mn2O3 + CaO → CaMn2O4 (t = 900 °C).
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соответственно: соль – манганит кальция либо оксид марганца-кальция.
Аналогично проходят реакции оксида кальция и с другими амфотерными оксидами.
12. реакция оксида кальция с оксидом свинца:
СaО + 2PbO2 → Сa2PbО4 (tо).
В результате реакции образуется соль – плюмбит кальция. Реакция протекает при сплавлении реакционной смеси.
Аналогично проходят реакции оксида кальция и с другими оксидами.
13. реакция оксида кальция с тетраоксидом диазота:
СaО + 2N2О4 → N2O3 + Сa(NO3)2 (t = 250 °C).
Реакция идет в жидком тетраоксиде диазота. В результате реакции образуются оксид азота (III) и соль – нитрат кальция.
14. реакция оксида кальция с плавиковой кислотой:
СaO + 2HF → СaF2 + H2O.
В результате химической реакции получается соль – фторид кальция и вода.
15. реакция оксида кальция с азотной кислотой:
СaO + 2HNO3 → 2Сa(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат кальция и вода.
Аналогично проходят реакции оксида кальция и с другими кислотами.
16. реакция оксида кальция с бромистым водородом (бромоводородом):
СaO + 2HBr → СaBr2 + H2O.
В результате химической реакции получается соль – бромид кальция и вода.
17. реакция оксида кальция с йодоводородом:
СaO + 2HI → СaI2 + H2O.
В результате химической реакции получается соль – йодид кальция и вода.
Применение и использование оксида кальция:
Оксид кальция используется в производстве строительных материалов, в качестве пищевой добавки E-529.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид кальция реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида кальция
реакции с оксидом кальция
Коэффициент востребованности
8 604
| Оксид кальция | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование (b) |
Оксид кальция, окись кальция |
| Традиционные названия | оксид кальция, негашёная известь, жжёная известь, кирабит; кипелка |
| Хим. формула (b) | Ca (b) O (b) |
| Рац. формула (b) | CaO |
| Физические свойства | |
| Состояние (b) | твёрдое |
| Молярная масса (b) | 56.077 г/моль (b) |
| Плотность (b) | 3.37 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления (b) | 2570 °C |
| • кипения (b) | 2850 °C |
| Мол. теплоёмк. (b) | 42.05 Дж/(моль·К) |
| Энтальпия | |
| • образования | -635.09 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Классификация | |
| Рег. номер CAS (b) | 1305-78-8 |
| PubChem (b) | 14778 |
| Рег. номер EINECS (b) | 215-138-9 |
| SMILES (b) |
O=[Ca] |
| InChI (b) |
InChI=1S/Ca.O ODINCKMPIJJUCX-UHFFFAOYSA-N |
| Кодекс Алиментариус (b) | E529 |
| RTECS (b) | EW3100000 |
| ChEBI | 31344 |
| Номер ООН (b) | 1910 |
| ChemSpider (b) | 14095 |
| Безопасность | |
| Предельная концентрация (b) | 1 мг/м³[2] |
| ЛД50 (b) | 100 мг/кг |
| Токсичность (b) | Зарегистрированные препараты оксида кальция относятся ко 2-му[3] классу опасности для человека, оказывают общетоксическое действие. |
| Пиктограммы ECB | |
| NFPA 704 (b) |
 0 3 2
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Oксид кальция (о́кись ка́льция, негашёная и́звесть, жжёная и́звесть, в просторечии — кираби́т, кипе́лка) — белое кристаллическое вещество, формула Ca (b) O (b) . Относится к классу основных оксидов (b) .
Негашёная известь и продукт её взаимодействия с водой — Ca(OH)2 (гашёная известь (b) , или «пушонка») находят обширное использование в строительном деле.
Получение
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция (b) ):
Также оксид кальция можно получить при взаимодействии простых веществ, на практике в виде корки на металле:
или при термическом разложении гидроксида кальция (b) и кальциевых солей некоторых кислородсодержащих кислот:
Физические свойства
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической кристаллической решётке (b) , по типу хлорида натрия (b) .
Химические свойства
Оксид кальция относится к основным оксидам (b) . Энергично взаимодействует с водой (b) с выделением тепла и образованием гидроксида кальция (b) , ненасыщенный раствор которого является сильным основанием:
- + 63,7 к (b) Дж (b) /моль (b) .
При температуре выше 580 °C [источник не указан 1762 дня] эта реакция обратима.
Как основный оксид реагирует с кислотными оксидами и кислотами, образуя соли:
При нагревании с углеродом в высокотемпературной печи или электрической дуге образует карбид кальция (b) (используемый для получения ацетилена (b) ):
Несмотря на массовое промышленное производство ацетилена более эффективными способами, эта реакция сохраняет небольшое практическое значение, так как карбид кальция является удобным источником ацетилена (b) в лабораторной практике и в аппаратах для сварочных работ.
Применение
В настоящее время в основном используется в производстве строительных материалов, высокоглиноземистого цемента, силикатного кирпича и т.д.
До второй половины XX века известь широко использовали в качестве строительной побелки — прокаленный мел или известняк (оксид кальция) при смешивании с водой (b) образует ярко-белую гашеную известь (Ca(OH)2), обладающую хорошими адгезионными свойствами к различным поверхностям. Далее известь медленно поглощает из воздуха (b) углекислый газ (b) , покрываясь коркой карбоната кальция (b) . В настоящее время известковый раствор при строительстве жилых домов практически не применяется в виду значительной гигроскопичности (склонности поддерживать высокую влажность, провоцирующую рост плесени) и сложности производства работ, уступив место более эффективным материалам.
В лабораторной практике оксид кальция используется как дешевый и эффективный агент для осушения (b) растворителей и жидких веществ.
В пищевой промышленности (b) зарегистрирован в качестве пищевой добавки (b) E-529.
В промышленности водный раствор используют в одном из способов удаления диоксида серы из дымовых (b) газов. В результате реакции гашеной извести Са(OH)2 и диоксида серы получается осадок сульфита кальция СаSO3. В настоящее время вытеснен современными абсорберами на основе четвертичных аммонийных соединений, способных обратимо связывать SO2 и CO2.
Использовался в «саморазогревающейся» посуде. Оксид кальция, помещенный между двух стенок емкости, при прокалывании капсулы с водой реагирует с ней с выделением тепла.
Безопасность
Оксид кальция относится к высокоопасным веществам. (Класс опасности 2). Это едкое вещество, особенно опасен при смешивании с водой.
В виде пыли или капель взвеси раздражают слизистые, вызывая чихание и кашель.
Оксид кальция относится к группе веществ, обладающих общетоксическим действием. Действие CaO, подобно действию щелочи (b) , состоит в омылении жиров, поглощении из кожи влаги, растворении белков, раздражении и прижигании тканей.
Сильно действует на слизистую глаз. На слизистой рта и носа наблюдаются поверхностные изъязвления; иногда прободение носовой перегородки.
Страдают также глубокие дыхательные пути.
Вдыхание высоких концентраций известковой пыли вызывает отёк лёгких.
Рекомендуемая ПДК (b) в воздухе рабочей зоны составляет 1 мг/м³.
Примечания
- ↑ http://www.cdc.gov/niosh/npg/npgd0093.html
- ↑ name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 12.1.005-76. Воздух рабочей зоны. Общие санитарно-гигиенические требования
- ↑ name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 12.1.007-76. Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
Литература
- Крупский А. К. (b) , Менделеев Д. И. (b) Известь, в технике // Энциклопедический словарь Брокгауза и Ефрона (b) : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Монастырев А. Производство цемента, извести. Москва, 2007.
- Штарк Йохан, Вихт Бернд. Цемент и известь (перевод с немецкого). Киев, 2008.
- Осин Б.В. Негашеная известь как новое вяжущее вещество. Москва, 1954
| п •о •рОксиды (b) | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O (b) | ||||||||||||||||
| Li2O (b) LiCoO2 (b) Li3PaO4 (b) Li5PuO6 (b) Ba2LiNpO6 (b) LiAlO2 (b) Li3NpO4 (b) Li2NpO4 (b) Li5NpO6 (b) LiNbO3 (b) |
BeO (b) | B2O3 (b) | С3О2 (b) C12O9 (b) CO (b) C12O12 (b) C4O6 (b) CO2 (b) |
N2O (b) NO (b) N2O3 (b) N4O6 (b) NO2 (b) N2O4 (b) N2O5 (b) |
O | F | ||||||||||
| Na2O (b) NaPaO3 (b) NaAlO2 (b) Na2PtO3 (b) |
MgO (b) | AlO (b) Al2O3 (b) NaAlO2 (b) LiAlO2 (b) AlO(OH) (b) |
SiO (b) SiO2 (b) |
P4O (b) P4O2 (b) P2O3 (b) P4O8 (b) P2O5 (b) |
S2O (b) SO (b) SO2 (b) SO3 (b) |
Cl2O (b) ClO2 (b) Cl2O6 (b) Cl2O7 (b) |
||||||||||
| K2O (b) K2PtO3 (b) KPaO3 (b) |
CaO (b) Ca3OSiO4 (b) CaTiO3 (b) |
Sc2O3 (b) | TiO (b) Ti2O3 (b) TiO2 (b) TiOSO4 (b) CaTiO3 (b) BaTiO3 (b) |
VO (b) V2O3 (b) V3O5 (b) VO2 (b) V2O5 (b) |
FeCr2O4 (b) CrO (b) Cr2O3 (b) CrO2 (b) CrO3 (b) MgCr2O4 (b) |
MnO (b) Mn3O4 (b) Mn2O3 (b) MnO(OH) (b) Mn5O8 (b) MnO2 (b) MnO3 (b) Mn2O7 (b) |
FeCr2O4 (b) FeO (b) Fe3O4 (b) Fe2O3 (b) |
CoFe2O4 (b) CoO (b) Co3O4 (b) CoO(OH) (b) Co2O3 (b) CoO2 (b) |
NiO (b) NiFe2O4 (b) Ni3O4 (b) NiO(OH) (b) Ni2O3 (b) |
Cu2O (b) CuO (b) CuFe2O4 (b) Cu2O3 (b) CuO2 (b) |
ZnO (b) | Ga2O (b) Ga2O3 (b) |
GeO (b) GeO2 (b) |
As2O3 (b) As2O4 (b) As2O5 (b) |
SeOCl2 (b) SeOBr2 (b) SeO2 (b) Se2O5 (b) SeO3 (b) |
Br2O (b) Br2O3 (b) BrO2 (b) |
| Rb2O (b) RbPaO3 (b) Rb4O6 (b) |
SrO (b) | Y2O3 (b) YOF (b) YOCl (b) |
ZrO(OH)2 (b) ZrO2 (b) ZrOS (b) Zr2О3Сl2 (b) |
NbO (b) Nb2O3 (b) NbO2 (b) Nb2O5 (b) Nb2O3(SO4)2 (b) LiNbO3 (b) |
Mo2O3 (b) Mo4O11 (b) MoO2 (b) Mo2O5 (b) MoO3 (b) |
TcO2 (b) Tc2O7 (b) |
Ru2O3 (b) RuO2 (b) Ru2O5 (b) RuO4 (b) |
RhO (b) Rh2O3 (b) RhO2 (b) |
PdO (b) Pd2O3 (b) PdO2 (b) |
Ag2O (b) Ag2O2 (b) |
Cd2O (b) CdO (b) |
In2O (b) InO (b) In2O3 (b) |
SnO (b) SnO2 (b) |
Sb2O3 (b) Sb2O4 (b) Hg2Sb2O7 (b) Sb2O5 (b) |
TeO2 (b) TeO3 (b) |
I2O4 (b) I4O9 (b) I2O5 (b) |
| Cs2O (b) Cs2ReCl5O (b) |
BaO (b) BaPaO3 (b) BaTiO3 (b) BaPtO3 (b) |
HfO(OH)2 (b) HfO2 (b) |
Ta2O (b) TaO (b) TaO2 (b) Ta2O5 (b) |
WO2Br2 (b) WO2 (b) WO2Cl2 (b) WOBr4 (b) WOF4 (b) WOCl4 (b) WO3 (b) |
Re2O (b) ReO (b) Re2O3 (b) ReO2 (b) Re2O5 (b) ReO3 (b) Re2O7 (b) |
OsO (b) Os2O3 (b) OsO2 (b) OsO4 (b) |
Ir2O3 (b) IrO2 (b) |
PtO (b) Pt3O4 (b) Pt2O3 (b) PtO2 (b) K2PtO3 (b) Na2PtO3 (b) PtO3 (b) |
Au2O (b) AuO (b) Au2O3 (b) |
Hg2O (b) HgO (b) (Hg3O2)SO4 (b) Hg2O(CN)2 (b) Hg2Sb2O7 (b) Hg3O2Cl2 (b) Hg5O4Cl2 (b) |
Tl2O (b) Tl2O3 (b) |
Pb2O (b) PbO (b) Pb3O4 (b) Pb2O3 (b) PbO2 (b) |
BiO (b) Bi2O3 (b) Bi2O4 (b) Bi2O5 (b) |
PoO (b) PoO2 (b) PoO3 (b) |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S (b) La2O3 (b) |
Ce2O3 (b) CeO2 (b) |
PrO (b) Pr2O2S (b) Pr2O3 (b) Pr6O11 (b) PrO2 (b) |
NdO (b) Nd2O2S (b) Nd2O3 (b) NdHO (b) |
Pm2O3 (b) | SmO (b) Sm2O3 (b) |
EuO (b) Eu3O4 (b) Eu2O3 (b) EuO(OH) (b) Eu2O2S (b) |
Gd2O3 (b) | Tb | Dy2O3 (b) | Ho2O3 (b) Ho2O2S (b) |
Er2O3 (b) | Tm2O3 (b) | YbO (b) Yb2O3 (b) |
Lu2O2S (b) Lu2O3 (b) LuO(OH) (b) |
||
| Ac2O3 (b) | UO2 (b) UO3 (b) U3O8 (b) |
PaO (b) PaO2 (b) Pa2O5 (b) PaOS (b) |
ThO2 (b) | NpO (b) NpO2 (b) Np2O5 (b) Np3O8 (b) NpO3 (b) |
PuO (b) Pu2O3 (b) PuO2 (b) PuO3 (b) PuO2F2 (b) |
AmO2 (b) | Cm2O3 (b) CmO2 (b) |
Bk2O3 (b) | Cf2O3 (b) | Es | Fm | Md | No | Lr |