This article is about the chemical element. For other uses, see Tin (disambiguation).
Not to be confused with Titanium.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tin | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allotropes | silvery-white, β (beta); gray, α (alpha) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Sn) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tin in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 14 (carbon group) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Kr] 4d10 5s2 5p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 505.08 K (231.93 °C, 449.47 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2875 K (2602 °C, 4716 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | white, β: 7.265 g/cm3 gray, α: 5.769 g/cm3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 6.99 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | white, β: 7.03 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | white, β: 296.1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | white, β: 27.112 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −4, −3, −2, −1, 0,[2] +1,[3] +2, +3,[4] +4 (an amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 139±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 217 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of tin |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered tetragonal
white (β) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered diamond-cubic
gray (α) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 2730 m/s (at r.t.) (rolled) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 22.0 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 66.8 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 115 nΩ⋅m (at 0 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | gray: diamagnetic[5] white (β): paramagnetic |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | (white) +3.1×10−6 cm3/mol (298 K)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 50 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 18 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 58 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 50–440 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-31-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | protohistoric, around 35th century BC | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «Sn»: from Latin stannum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of tin
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Tin is a chemical element with the symbol Sn (from Latin: stannum) and atomic number 50. Tin is a silvery-coloured metal.
Tin is soft enough to be cut with little force[7] and a bar of tin can be bent by hand with little effort. When bent, the so-called «tin cry» can be heard as a result of twinning in tin crystals;[8] this trait is shared by indium, cadmium, zinc, and mercury in the solid state.
Pure tin after solidifying presents a mirror-like appearance similar to most metals. In most tin alloys (such as pewter) the metal solidifies with a dull gray color.
Tin is a post-transition metal in group 14 of the periodic table of elements. It is obtained chiefly from the mineral cassiterite, which contains stannic oxide, SnO
2. Tin shows a chemical similarity to both of its neighbors in group 14, germanium and lead, and has two main oxidation states, +2 and the slightly more stable +4. Tin is the 49th most abundant element on Earth and has, with 10 stable isotopes, the largest number of stable isotopes in the periodic table, thanks to its magic number of protons.
It has two main allotropes: at room temperature, the stable allotrope is β-tin, a silvery-white, malleable metal; at low temperatures it is less dense grey α-tin, which has the diamond cubic structure. Metallic tin does not easily oxidize in air and water.
The first tin alloy used on a large scale was bronze, made of 1⁄8 tin and 7⁄8 copper, from as early as 3000 BC. After 600 BC, pure metallic tin was produced. Pewter, which is an alloy of 85–90% tin with the remainder commonly consisting of copper, antimony, bismuth, and sometimes lead and silver, has been used for flatware since the Bronze Age. In modern times, tin is used in many alloys, most notably tin / lead soft solders, which are typically 60% or more tin, and in the manufacture of transparent, electrically conducting films of indium tin oxide in optoelectronic applications. Another large application is corrosion-resistant tin plating of steel. Because of the low toxicity of inorganic tin, tin-plated steel is widely used for food packaging as tin cans. Some organotin compounds can be extremely toxic.
Characteristics[edit]
Physical[edit]
Tin is a soft, malleable, ductile and highly crystalline silvery-white metal. When a bar of tin is bent a crackling sound known as the «tin cry» can be heard from the twinning of the crystals.[8] Tin melts at about 232 °C (450 °F) the lowest in group 14. The melting point is further lowered to 177.3 °C (351.1 °F) for 11 nm particles.[9][10]
| External video |
|---|
β-tin, the metallic form or white tin, has BCT structure and is stable at and above room temperature and is malleable. α-tin, the nonmetallic form or gray tin, is stable below 13.2 °C (55.8 °F) and is brittle. α-tin has a diamond cubic crystal structure, similar to diamond, silicon or germanium. α-tin has no metallic properties, because its atoms form a covalent structure in which electrons cannot move freely. α-tin is a dull-gray powdery material with no common uses other than specialized semiconductor applications.[8] γ-tin and σ-tin exist at temperatures above 161 °C (322 °F) and pressures above several GPa.[11]
In cold conditions β-tin tends to transform spontaneously into α-tin, a phenomenon known as «tin pest» or «tin disease».[12] Some unverifiable sources also say that, during Napoleon’s Russian campaign of 1812, the temperatures became so cold that the tin buttons on the soldiers’ uniforms disintegrated over time, contributing to the defeat of the Grande Armée,[13] a persistent legend.[14][15][16]
The α-β transformation temperature is 13.2 °C (55.8 °F), but impurities (e.g. Al, Zn, etc.) lower it well below 0 °C (32 °F). With the addition of antimony or bismuth the transformation might not occur at all, increasing durability.[17]
Commercial grades of tin (99.8% tin content) resist transformation because of the inhibiting effect of small amounts of bismuth, antimony, lead, and silver present as impurities. Alloying elements such as copper, antimony, bismuth, cadmium, and silver increase the hardness of tin.[18] Tin easily forms hard, brittle intermetallic phases that are typically undesirable. It does not mix into a solution with most metals and elements so tin does not have much solid solubility. Tin mixes well with bismuth, gallium, lead, thallium and zinc forming simple eutectic systems.[17]
Tin becomes a superconductor below 3.72 K[19] and was one of the first superconductors to be studied.[20] The Meissner effect, one of the characteristic features of superconductors, was first discovered in superconducting tin crystals.[20]
Chemical[edit]
Tin resists corrosion from water, but can be corroded by acids and alkalis. Tin can be highly polished and is used as a protective coat for other metals,[8] a protective oxide (passivation) layer prevents further oxidation.[21] Tin acts as a catalyst triggering a chemical reaction of a solution containing oxygen and helps to increase the speed of the chemical reaction that results.[22]
Isotopes[edit]
Tin has ten stable isotopes, the greatest number of any element. The isotopes of tin have atomic masses of 112, 114, 115, 116, 117, 118, 119, 120, 122, and 124. 120Sn makes up almost a third of all tin; 118Sn, and 116Sn are also common, while 115Sn is the least common stable isotope. The isotopes with even mass numbers have no nuclear spin, while those with odd mass numbers have a spin of 1/2. Tin is among the easiest elements to detect and analyze by NMR spectroscopy which relies on molecular weight and its chemical shifts are referenced against SnMe
4.[notes 1][23] The large number of stable isotopes is thought to be a direct result of tin having the atomic number 50, a «magic number» in nuclear physics. Of the stable isotopes Tin-115 has a high capture cross section for fast neutron energies at 30 Barns. Two other isotopes Tin-117 ranks next with a cross section of 2.3 Barn while isotope Tin-119 has a slightly smaller cross section of 2.2 Barn. [24] Before these cross sections were well known it was proposed to use Tin-Lead solder as a reactor coolant for fast reactors because of its low melting point. Current studies are for Lead or Lead-Bismuth reactor coolants because both heavy metals are nearly transparent to fast neutrons with very low capture cross sections. [25] In order to use a Tin or Tin-Lead coolant the Tin would first have to go through isotopes separation to remove the 115, 117 and 119 isotopes from the material. Combined these three isotopes make up about 17% of the entire mass of natural Tin but represent nearly all of the capture cross section. Of the remaining seven isotopes Tin-112 has a capture cross section of 1 Barn. The other six isotopes forming 82.7% of all Tin have capture cross sections of 0.3 Barn or less making them effectively transparent to neutrons like Lead and Bismuth.
Tin has 31 unstable isotopes, ranging in mass number from 99 to 139. The unstable tin isotopes have a half-life of less than a year except 126Sn which has a half-life of 230,000 years.
100Sn and 132Sn are two of the few nuclides with a «doubly magic» nucleus which despite being unstable, as they have very uneven neutron–proton ratios, are the endpoints beyond which tin isotopes lighter than 100Sn and heavier than 132Sn are much less stable.[26] Another 30 metastable isomers have been identified for tin isotopes between 111 and 131, the most stable being 121mSn, with a half-life of 43.9 years.[27]
The relative differences in the number of tin’s stable isotopes can be explained by how they are formed during stellar nucleosynthesis. 116Sn through 120Sn are formed in the s-process (slow neutron capture) in most stars which leads to them being the most common tin isotopes, while 122Sn and 124Sn are only formed in the r-process (rapid neutron capture) in supernovae and are less common. Tin isotopes 117Sn through 120Sn are also produced in the r-process.[citation needed] 112Sn, 114Sn, and 115Sn, cannot be made in significant amounts in the s— or r-processes and are among the p-nuclei whose origins are not well understood. Some ideas about for their formation include proton capture and photodisintegration, 115Sn might be partially produced in the s-process both directly and as the daughter of long-lived 115In.[28]
Etymology[edit]
The word tin is shared among Germanic languages and can be traced back to reconstructed Proto-Germanic *tin-om; cognates include German Zinn, Swedish tenn and Dutch tin. It is not found in other branches of Indo-European, except by borrowing from Germanic (e.g., Irish tinne from English).[29][30]
The Latin name for tin, stannum, originally meant an alloy of silver and lead, and came to mean ‘tin’ in the fourth century[31]—the earlier Latin word for it was plumbum candidum, or «white lead». Stannum apparently came from an earlier stāgnum (meaning the same substance),[29] the origin of the Romance and Celtic terms for tin, such as French étain, Spanish estaño, Italian stagno, and Irish stán.[29][32] The origin of stannum/stāgnum is unknown; it may be pre-Indo-European.[33]
The Meyers Konversations-Lexikon suggests instead that stannum came from Cornish stean, and is evidence that Cornwall in the first centuries AD was the main source of tin.[citation needed]
History[edit]
Ceremonial giant bronze dirk of the Plougrescant-Ommerschans type, Plougrescant, France, 1500–1300 BC.
Tin extraction and use can be dated to the beginnings of the Bronze Age around 3000 BC, when it was observed that copper objects formed of polymetallic ores with different metal contents had different physical properties.[34] The earliest bronze objects had a tin or arsenic content of less than 2% and are believed to be the result of unintentional alloying due to trace metal content in the copper ore.[35] The addition of a second metal to copper increases its hardness, lowers the melting temperature, and improves the casting process by producing a more fluid melt that cools to a denser, less spongy metal.[35] This was an important innovation that allowed for the much more complex shapes cast in closed molds of the Bronze Age. Arsenical bronze objects appear first in the Near East where arsenic is commonly found with copper ore, but the health risks were quickly realized and the quest for sources of the much less hazardous tin ores began early in the Bronze Age.[36] This created the demand for rare tin metal and formed a trade network that linked the distant sources of tin to the markets of Bronze Age cultures.[citation needed]
Cassiterite (SnO
2), the oxide form of tin, was most likely the original source of tin. Other tin ores are less common sulfides such as stannite that require a more involved smelting process. Cassiterite often accumulates in alluvial channels as placer deposits because it is harder, heavier, and more chemically resistant than the accompanying granite.[35] Cassiterite is usually black or dark in color, and these deposits can be easily seen in river banks. Alluvial (placer) deposits may incidentally have been collected and separated by methods similar to gold panning.[37]
Compounds and chemistry[edit]
In the great majority of its compounds, tin has the oxidation state II or IV. Compounds containing bivalent tin are called stannous while those containing tetravalent tin are termed stannic.
Inorganic compounds[edit]
Halide compounds are known for both oxidation states. For Sn(IV), all four halides are well known: SnF4, SnCl4, SnBr4, and SnI4. The three heavier members are volatile molecular compounds, whereas the tetrafluoride is polymeric. All four halides are known for Sn(II) also: SnF2, SnCl
2, SnBr2, and SnI2. All are polymeric solids. Of these eight compounds, only the iodides are colored.[38]
Tin(II) chloride (also known as stannous chloride) is the most important commercial tin halide. Illustrating the routes to such compounds, chlorine reacts with tin metal to give SnCl4 whereas the reaction of hydrochloric acid and tin produces SnCl
2 and hydrogen gas. Alternatively SnCl4 and Sn combine to stannous chloride by a process called comproportionation:[39]
- SnCl4 + Sn → 2 SnCl
2
Tin can form many oxides, sulfides, and other chalcogenide derivatives. The dioxide SnO
2 (cassiterite) forms when tin is heated in the presence of air.[38] Sn)
2 is amphoteric, which means that it dissolves in both acidic and basic solutions.[40] Stannates with the structure [Sn(OH)
6]2−, like K
2[Sn(OH)
6], are also known, though the free stannic acid H
2[Sn(OH)
6] is unknown.
Sulfides of tin exist in both the +2 and +4 oxidation states: tin(II) sulfide and tin(IV) sulfide (mosaic gold).
Hydrides[edit]
Stannane (SnH
4), with tin in the +4 oxidation state, is unstable. Organotin hydrides are however well known, e.g. tributyltin hydride (Sn(C4H9)3H).[8] These compound release transient tributyl tin radicals, which are rare examples of compounds of tin(III).[42]
Organotin compounds[edit]
Organotin compounds, sometimes called stannanes, are chemical compounds with tin–carbon bonds.[43] Of the tin compounds, the organic derivatives are commercially the most useful.[44] Some organotin compounds are highly toxic and have been used as biocides. The first organotin compound to be reported was diethyltin diiodide ((C2H5)2SnI2), reported by Edward Frankland in 1849.[45]
Most organotin compounds are colorless liquids or solids that are stable to air and water. They adopt tetrahedral geometry. Tetraalkyl- and tetraaryltin compounds can be prepared using Grignard reagents:[44]
- SnCl
4 + 4 RMgBr → R
4Sn + 4 MgBrCl
The mixed halide-alkyls, which are more common and more important commercially than the tetraorgano derivatives, are prepared by redistribution reactions:
- SnCl
4 + R
4Sn → 2 SnCl
2R2
Divalent organotin compounds are uncommon, although more common than related divalent organogermanium and organosilicon compounds. The greater stabilization enjoyed by Sn(II) is attributed to the «inert pair effect». Organotin(II) compounds include both stannylenes (formula: R2Sn, as seen for singlet carbenes) and distannylenes (R4Sn2), which are roughly equivalent to alkenes. Both classes exhibit unusual reactions.[46]
Occurrence[edit]
Sample of cassiterite, the main ore of tin
Tin is generated via the long s-process in low-to-medium mass stars (with masses of 0.6 to 10 times that of the Sun), and finally by beta decay of the heavy isotopes of indium.[47]
Tin is the 49th most abundant element in Earth’s crust, representing 2 ppm compared with 75 ppm for zinc, 50 ppm for copper, and 14 ppm for lead.[48]
Tin does not occur as the native element but must be extracted from various ores. Cassiterite (SnO
2) is the only commercially important source of tin, although small quantities of tin are recovered from complex sulfides such as stannite, cylindrite, franckeite, canfieldite, and teallite. Minerals with tin are almost always associated with granite rock, usually at a level of 1% tin oxide content.[49]
Because of the higher specific gravity of tin dioxide, about 80% of mined tin is from secondary deposits found downstream from the primary lodes. Tin is often recovered from granules washed downstream in the past and deposited in valleys or the sea. The most economical ways of mining tin are by dredging, hydraulicking, or open pits. Most of the world’s tin is produced from placer deposits, which can contain as little as 0.015% tin.[50]
| Country | Reserves |
|---|---|
| 1,500,000 | |
| 250,000 | |
| 310,000 | |
| 800,000 | |
| 590,000 | |
| 400,000 | |
| 350,000 | |
| 180,000 | |
| 170,000 | |
| Other | 180,000 |
| Total | 4,800,000 |
| Year | Million tonnes |
|---|---|
| 1965 | 4,265 |
| 1970 | 3,930 |
| 1975 | 9,060 |
| 1980 | 9,100 |
| 1985 | 3,060 |
| 1990 | 7,100 |
| 2000 | 7,100[51] |
| 2010 | 5,200[51] |
About 253,000 tonnes of tin were mined in 2011, mostly in China (110,000 t), Indonesia (51,000 t), Peru (34,600 t), Bolivia (20,700 t) and Brazil (12,000 t).[51] Estimates of tin production have historically varied with the market and mining technology. It is estimated that, at current consumption rates and technologies, the Earth will run out of mine-able tin in 40 years.[52] In 2006 Lester Brown suggested tin could run out within 20 years based on conservative estimates of 2% annual growth.[53]
Scrap tin is an important source of the metal. Recovery of tin through recycling is increasing rapidly. Whereas the United States has neither mined (since 1993) nor smelted (since 1989) tin, it was the largest secondary producer, recycling nearly 14,000 tonnes in 2006.[51]
New deposits are reported in Mongolia,[54] and in 2009, new deposits of tin were discovered in Colombia.[55]
Production[edit]
Tin is produced by carbothermic reduction of the oxide ore with carbon or coke. Both reverberatory furnace and electric furnace can be used.[56][57][58]
Mining and smelting[edit]
Industry[edit]
The ten largest companies produced most of the world’s tin in 2007.
Most of the world’s tin is traded on LME, from 8 countries, under 17 brands.[59]
| Company | Polity | 2006 | 2007 | 2017[61] | 2006-2017 % change |
|---|---|---|---|---|---|
| Yunnan Tin | China | 52,339 | 61,129 | 74,500 | 42.3 |
| PT Timah | Indonesia | 44,689 | 58,325 | 30,200 | -32.4 |
| Malaysia Smelting Corp | Malaysia | 22,850 | 25,471 | 27,200 | 19.0 |
| Yunnan Chengfeng | China | 21,765 | 18,000 | 26,800 | 23.1 |
| Minsur | Peru | 40,977 | 35,940 | 18,000 | -56.1 |
| EM Vinto | Bolivia | 11,804 | 9,448 | 12,600 | 6.7 |
| Guangxi China Tin | China | / | / | 11,500 | / |
| Thaisarco | Thailand | 27,828 | 19,826 | 10,600 | -61.9 |
| Metallo-Chimique | Belgium | 8,049 | 8,372 | 9,700 | 20.5 |
| Gejiu Zi Li | China | / | / | 8,700 | / |
International Tin Council was established in 1947 to control the price of tin. It collapsed in 1985. In 1984, Association of Tin Producing Countries was created, with Australia, Bolivia, Indonesia, Malaysia, Nigeria, Thailand, and Zaire as members.[62]
Price and exchanges[edit]
World production and price (US exchange) of tin.
Tin is unique among mineral commodities because of the complex agreements between producer countries and consumer countries dating back to 1921. Earlier agreements tended to be somewhat informal and led to the «First International Tin Agreement» in 1956, the first of a series that effectively collapsed in 1985. Through these agreements, the International Tin Council (ITC) had a considerable effect on tin prices. ITC supported the price of tin during periods of low prices by buying tin for its buffer stockpile and was able to restrain the price during periods of high prices by selling from the stockpile. This was an anti-free-market approach, designed to assure a sufficient flow of tin to consumer countries and a profit for producer countries. However, the buffer stockpile was not sufficiently large, and during most of those 29 years tin prices rose, sometimes sharply, especially from 1973 through 1980 when rampant inflation plagued many world economies.[63]
During the late 1970s and early 1980s, the U.S. reduced its strategic tin stockpile, partly to take advantage of historically high tin prices. The 1981–82 recession damaged the tin industry. Tin consumption declined dramatically. ITC was able to avoid truly steep declines through accelerated buying for its buffer stockpile; this activity required extensive borrowing. ITC continued to borrow until late 1985 when it reached its credit limit. Immediately, a major «tin crisis» ensued — tin was delisted from trading on the London Metal Exchange for about three years. ITC dissolved soon afterward, and the price of tin, now in a free-market environment, fell to $4 per pound and remained around that level through the 1990s.[63] The price increased again by 2010 with a rebound in consumption following the 2007–2008 economic crisis, accompanying restocking and continued growth in consumption.[51]
London Metal Exchange (LME) is tin’s principal trading site.[51] Other tin contract markets are Kuala Lumpur Tin Market (KLTM) and Indonesia Tin Exchange (INATIN).[64]
Due to factors involved in the 2021 global supply chain crisis, tin prices almost doubled between 2020—21 and have had their largest annual rise in over 30 years. The International Tin Association estimated that global refined tin consumption will grow 7.2 percent in 2021, after losing 1.6 percent in 2020 as the COVID-19 pandemic disrupted global manufacturing industries.[65]
Applications[edit]
World consumption of refined tin by end-use, 2006
In 2018, just under half of all tin produced was used in solder. The rest was divided between tin plating, tin chemicals, brass and bronze alloys, and niche uses.[66]
Solder[edit]
A coil of lead-free solder wire
Tin has long been used in alloys with lead as solder, in amounts of 5 to 70% w/w. Tin with lead forms a eutectic mixture at the weight proportion of 61.9% tin and 38.1% lead (the atomic proportion: 73.9% tin and 26.1% lead), with melting temperature of 183 °C (361.4 °F). Such solders are primarily used for joining pipes or electric circuits. Since the European Union Waste Electrical and Electronic Equipment Directive (WEEE Directive) and Restriction of Hazardous Substances Directive came into effect on 1 July 2006, the lead content in such alloys has decreased. While lead exposure is associated with serious health problems, lead-free solder is not without its challenges, including a higher melting point, and the formation of tin whiskers that cause electrical problems. Tin pest can occur in lead-free solders, leading to loss of the soldered joint. Replacement alloys are being found, but the problems of joint integrity remain.[67]
Tin plating[edit]
Tin plated metal from a can.
Tin bonds readily to iron and is used for coating lead, zinc, and steel to prevent corrosion. Tin-plated (or tinning) steel containers is widely used for food preservation, and this forms a large part of the market for metallic tin. A tinplate canister for preserving food was first manufactured in London in 1812.[68] Speakers of British English call such containers «tins», while speakers of American English call them «cans» or «tin cans». One derivation of such use is the slang term «tinnie» or «tinny», meaning «can of beer» in Australia. The tin whistle is so called because it was mass-produced first in tin-plated steel.[69][70]
Copper cooking vessels such as saucepans and frying pans are frequently lined with a thin plating of tin, by electroplating or by traditional chemical methods, since use of copper cookware with acidic foods can be toxic.
Specialized alloys[edit]
Artisans working with tin sheets.
Tin in combination with other elements forms a wide variety of useful alloys. Tin is most commonly alloyed with copper. Pewter is 85–99% tin;[71] bearing metal has a high percentage of tin as well.[72][73] Bronze is mostly copper with 12% tin, while the addition of phosphorus yields phosphor bronze. Bell metal is also a copper–tin alloy, containing 22% tin. Tin has sometimes been used in coinage; it once formed a single-digit percentage (usually five percent or less) of American[74] and Canadian[75] pennies. Because copper is often the major metal in such coins, sometimes including zinc, these could be called bronze, or brass alloys.
The niobium–tin compound Nb3Sn is commercially used in coils of superconducting magnets for its high critical temperature (18 K) and critical magnetic field (25 T). A superconducting magnet weighing as little as two kilograms is capable of producing the magnetic field of a conventional electromagnet weighing tons.[76]
A small percentage of tin is added to zirconium alloys for the cladding of nuclear fuel.[77]
Most metal pipes in a pipe organ are of a tin/lead alloy, with 50/50 as the most common composition. The proportion of tin in the pipe defines the pipe’s tone, since tin has a desirable tonal resonance. When a tin/lead alloy cools, the lead phase solidifies first, then when the eutectic temperature is reached, the remaining liquid forms the layered tin/lead eutectic structure, which is shiny; contrast with the lead phase produces a mottled or spotted effect. This metal alloy is referred to as spotted metal. Major advantages of using tin for pipes include its appearance, workability, and resistance to corrosion.[78][79]
Optoelectronics[edit]
The oxides of indium and tin are electrically conductive and transparent, and are used to make transparent electrically conducting films with applications in optoelectronics devices such as liquid crystal displays.[80]
Other applications[edit]
A 21st-century reproduction barn lantern made of punched tin.
Punched tin-plated steel, also called pierced tin, is an artisan technique originating in central Europe for creating functional and decorative housewares. Decorative piercing designs exist in a wide variety, based on local tradition and the artisan. Punched tin lanterns are the most common application of this artisan technique. The light of a candle shining through the pierced design creates a decorative light pattern in the room where it sits. Lanterns and other punched tin articles were created in the New World from the earliest European settlement. A well-known example is the Revere lantern, named after Paul Revere.[81]
Before the modern era, in some areas of the Alps, a goat or sheep’s horn would be sharpened and a tin panel would be punched out using the alphabet and numbers from one to nine. This learning tool was known appropriately as «the horn». Modern reproductions are decorated with such motifs as hearts and tulips.
In America, pie safes and food safes were in use in the days before refrigeration. These were wooden cupboards of various styles and sizes – either floor standing or hanging cupboards meant to discourage vermin and insects and to keep dust from perishable foodstuffs. These cabinets had tinplate inserts in the doors and sometimes in the sides, punched out by the homeowner, cabinetmaker, or a tinsmith in varying designs to allow for air circulation while excluding flies. Modern reproductions of these articles remain popular in North America.[82]
Window glass is most often made by floating molten glass on molten tin (float glass), resulting in a flat and flawless surface. This is also called the «Pilkington process».[83]
Tin is used as a negative electrode in advanced Li-ion batteries. Its application is somewhat limited by the fact that some tin surfaces[which?] catalyze decomposition of carbonate-based electrolytes used in Li-ion batteries.[84]
Tin(II) fluoride is added to some dental care products[85] as stannous fluoride (SnF2). Tin(II) fluoride can be mixed with calcium abrasives while the more common sodium fluoride gradually becomes biologically inactive in the presence of calcium compounds.[86] It has also been shown to be more effective than sodium fluoride in controlling gingivitis.[87]
Tin is used as a target to create laser-induced plasmas that act as the light source for extreme ultraviolet lithography.
Organotin compounds[edit]
The organotin compounds are most heavily used. Worldwide industrial production probably exceeds 50,000 tonnes.[88]
PVC stabilizers[edit]
The major commercial application of organotin compounds is in the stabilization of PVC plastics. In the absence of such stabilizers, PVC would rapidly degrade under heat, light, and atmospheric oxygen, resulting in discolored, brittle products. Tin scavenges labile chloride ions (Cl−), which would otherwise strip HCl from the plastic material.[89] Typical tin compounds are carboxylic acid derivatives of dibutyltin dichloride, such as the dilaurate.[90]
Biocides[edit]
Some organotin compounds are relatively toxic, with both advantages and problems. They are used for biocidal properties as fungicides, pesticides, algaecides, wood preservatives, and antifouling agents.[89] Tributyltin oxide is used as a wood preservative.[91] Tributyltin is also used for various industrial purposes such as slime control in paper mills and disinfection of circulating industrial cooling waters.[92] Tributyltin was used as additive for ship paint to prevent growth of fouling organisms on ships, with use declining after organotin compounds were recognized as persistent organic pollutants with high toxicity for some marine organisms (the dog whelk, for example).[93] The EU banned the use of organotin compounds in 2003,[94] while concerns over the toxicity of these compounds to marine life and damage to the reproduction and growth of some marine species[89] (some reports describe biological effects to marine life at a concentration of 1 nanogram per liter) have led to a worldwide ban by the International Maritime Organization.[95] Many nations now restrict the use of organotin compounds to vessels greater than 25 m (82 ft) long.[89] The persistence of tributyltin in the aquatic environment is dependent upon the nature of the ecosystem.[96] Because of this persistence and its use as an additive in ship paint, high concentrations of tributyltin have been found in marine sediments located near naval docks.[97] Tributyltin has been used as a biomarker for imposex in neograstropods, with at least 82 known species.[98] With the high levels of TBT in the local inshore areas, due to shipping activities, the shellfish had an adverse effect.[96] Imposex is the imposition of male sexual characteristics on female specimens where they grow a penis and a pallial vas deferens.[98][99] A high level of TBT can damage mammalian endocrine glands, reproductive and central nervous systems, bone structure and gastrointestinal tract.[99] Not only does tributyltin affect mammals, it affects sea otters, whales, dolphins, and humans.[99]
Organic chemistry[edit]
Some tin reagents are useful in organic chemistry. In the largest application, stannous chloride is a common reducing agent for the conversion of nitro and oxime groups to amines. The Stille reaction couples organotin compounds with organic halides or pseudohalides.[100]
Li-ion batteries[edit]
Tin forms several inter-metallic phases with lithium metal, making it a potentially attractive material for battery applications. Large volumetric expansion of tin upon alloying with lithium and instability of the tin-organic electrolyte interface at low electrochemical potentials are the greatest challenges to employment in commercial cells.[101] Tin inter-metallic compound with cobalt and carbon was implemented by Sony in its Nexelion cells released in the late 2000s. The composition of the active material is approximately Sn0.3Co0.4C0.3. Research showed that only some crystalline facets of tetragonal (beta) Sn are responsible for undesirable electrochemical activity.[102]
Precautions[edit]
Cases of poisoning from tin metal, its oxides, and its salts are almost unknown. On the other hand, certain organotin compounds are almost as toxic as cyanide.[44]
Exposure to tin in the workplace can occur by inhalation, skin contact, and eye contact. The US Occupational Safety and Health Administration (OSHA) set the permissible exposure limit for tin exposure in the workplace as 2 mg/m3 over an 8-hour workday. The National Institute for Occupational Safety and Health (NIOSH) determined a recommended exposure limit (REL) of 2 mg/m3 over an 8-hour workday. At levels of 100 mg/m3, tin is immediately dangerous to life and health.[103]
See also[edit]
- Cassiterides (the mythical Tin Islands)
- List of countries by tin production
- Stannary
- Terne
- Tin pest
- Tin mining in Britain
- Tinning
- Whisker (metallurgy) (tin whiskers)
Notes[edit]
- ^ Only H, F, P, Tl and Xe are easier to use NMR analysis with for samples containing isotopes at their natural abundance.
References[edit]
- ^ «Standard Atomic Weights: Tin». CIAAW. 1983.
- ^ «New Type of Zero-Valent Tin Compound». Chemistry Europe. 27 August 2016.
- ^ «HSn». NIST Chemistry WebBook. National Institute of Standards and Technology. Retrieved 2013-01-23.
- ^ «SnH3». NIST Chemistry WebBook. National Institure of Standards and Technology. Retrieved 2013-01-23.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Gray, Theodore (2007). «Tin images». The Elements. Black Dog & Leventhal.
- ^ a b c d e Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). «Tin». Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 793–800. ISBN 978-3-11-007511-3.
- ^ «Ink with tin nanoparticles could print future circuit boards». Phys.org. 12 April 2011. Archived from the original on 16 September 2011.
- ^ Jo, Yun Hwan; Jung, Inyu; Choi, Chung Seok; Kim, Inyoung; Lee, Hyuck Mo (2011). «Synthesis and characterization of low temperature Sn nanoparticles for the fabrication of highly conductive ink». Nanotechnology. 22 (22): 225701. Bibcode:2011Nanot..22v5701J. doi:10.1088/0957-4484/22/22/225701. PMID 21454937. S2CID 25202674.
- ^ Molodets, A.M.; Nabatov, S.S. (2000). «Thermodynamic potentials, diagram of state, and phase transitions of tin on shock compression». High Temperature. 38 (5): 715–721. doi:10.1007/BF02755923. S2CID 120417927.
- ^ «Tin Pests | Center for Advanced Life Cycle Engineering». calce.umd.edu. Retrieved 2022-11-04.
- ^ Le Coureur, Penny; Burreson, Jay (2004). Napoleon’s Buttons: 17 molecules that changed history. New York: Penguin Group, USA.
- ^ Öhrström, Lars (2013). The Last Alchemist in Paris. Oxford: Oxford University Press. ISBN 978-0-19-966109-1.
- ^ Cotton, Simon (29 April 2014). «Book review: The last alchemist in Pari». Chemistry World. Royal Society of Chemistry. Archived from the original on 10 August 2014. Retrieved 22 November 2019.
- ^ Emsley, John (1 October 2011) [2001]. Nature’s Building Blocks: an A-Z Guide to the Elements (New ed.). New York, United States: Oxford University Press. p. 552. ISBN 978-0-19-960563-7.
Only officers had metal buttons, and those were made of brass.
- ^ a b Schwartz, Mel (2002). «Tin and alloys, properties». Encyclopedia of Materials, Parts and Finishes (2nd ed.). CRC Press. ISBN 978-1-56676-661-6.
- ^ «Tin Alloys — Characteristics and Uses». Nuclear Power. Retrieved 2022-11-04.
- ^ Dehaas, W.; Deboer, J.; Vandenberg, G. (1935). «The electrical resistance of cadmium, thallium and tin at low temperatures». Physica. 2 (1–12): 453. Bibcode:1935Phy…..2..453D. doi:10.1016/S0031-8914(35)90114-8.
- ^ a b Meissner, W.; R. Ochsenfeld (1933). «Ein neuer effekt bei eintritt der Supraleitfähigkeit». Naturwissenschaften. 21 (44): 787–788. Bibcode:1933NW…..21..787M. doi:10.1007/BF01504252. S2CID 37842752.
- ^ Craig, Bruce D.; Anderson, David S.; International, A. S. M. (January 1995). Handbook of corrosion data. p. 126. ISBN 978-0-87170-518-1. Archived from the original on 2016-05-11.
- ^ Crutchlow, Charlotte (25 June 2021). «Tin-Formation About the Element Tin | Periodic Table». ChemTalk. Retrieved 2022-11-04.
- ^ «Interactive NMR Frequency Map». Archived from the original on 2011-06-04. Retrieved 2009-05-05.
- ^ «Neutron Scattering Lengths and cross sections».
- ^ «Westinghouse Nuclear > Energy Systems > Lead-cooled Fast Reactor».
- ^ Walker, Phil (1994). «Doubly Magic Discovery of Tin-100». Physics World. 7 (June): 28. doi:10.1088/2058-7058/7/6/24.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Cameron, A. G. W. (1973). «Abundance of the Elements in the Solar System» (PDF). Space Science Reviews. 15 (1): 121–146. Bibcode:1973SSRv…15..121C. doi:10.1007/BF00172440. S2CID 120201972. Archived from the original (PDF) on 2011-10-21.
- ^ a b c «tin». Oxford English Dictionary (Online ed.). Oxford University Press. (Subscription or participating institution membership required.)
- ^ Harper, Douglas. «tin». Online Etymology Dictionary.
- ^ Encyclopædia Britannica, 11th Edition, 1911, s.v. ‘tin’, citing H. Kopp
- ^ «The Ancient Mining of Tin». oxleigh.freeserve.co.uk. Archived from the original on 2009-04-03. Retrieved 2009-07-07.
- ^ American Heritage Dictionary
- ^ Cierny, J.; Weisgerber, G. (2003). «The «Bronze Age tin mines in Central Asia». In Giumlia-Mair, A.; Lo Schiavo, F. (eds.). The Problem of Early Tin. Oxford: Archaeopress. pp. 23–31. ISBN 978-1-84171-564-3.
- ^ a b c Penhallurick, R. D. (1986). Tin in Antiquity: its Mining and Trade Throughout the Ancient World with Particular Reference to Cornwall. London: The Institute of Metals. ISBN 978-0-904357-81-3.
- ^ Lamberg-Karlovsky, C. C.; Franklin, Alan D.; Olin, Jacqueline S.; Wertime, Theodore A., eds. (July 1980). «The development of the usage of tin and tin-bronze: some problems». The Search for Ancient Tin. Technology and Culture. Vol. 21. Washington D.C.: A seminar organized by Theodore A. Wertime and held at the Smithsonian Institution and the National Bureau of Standards, Washington D.C. March 14–15, 1977. p. 474. doi:10.2307/3103162. ISSN 0040-165X. JSTOR 3103162.
- ^ Dube, RK (September 2006). «Interrelation between gold and tin: A historical perspective». Gold Bulletin. 39 (3): 103–113. doi:10.1007/BF03215537.
- ^ a b Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.[page needed]
- ^ Taylor, F. Sherwood (1942). Inorganic & Theoretical Chemistry (6th ed.). Heineman.
- ^ J. M. Leger; J. Haines; A. Atouf (1996). «The high pressure behaviour of the cotunnite and post-cotunnite phases of PbCl2 and SnCl
2«. J. Phys. Chem. Solids. 57 (1): 7–16. Bibcode:1996JPCS…57….7L. doi:10.1016/0022-3697(95)00060-7. - ^ Gaur, D. P.; Srivastava, G.; Mehrotra, R. C. (1973). «Organic Derivatives of Tin. III. Reactions of Trialkyltin Ethoxide with Alkanolamines». Zeitschrift für Anorganische und Allgemeine Chemie. 398: 72. doi:10.1002/zaac.19733980109.
- ^ Elschenbroich, Christoph (2006). Organometallics (3rd, completely rev. and extended ed.). Weinheim: Wiley-VCH. ISBN 3-527-29390-6. OCLC 64305455.
- ^ a b c Graf, G. G. (2000) «Tin, Tin Alloys, and Tin Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH, Weinheim doi:10.1002/14356007.a27_049
- ^ Thoonen, Sander H. L.; Deelman, Berth-Jan; van Koten, Gerard (2004). «Synthetic aspects of tetraorganotins and organotin(IV) halides» (PDF). Journal of Organometallic Chemistry. 689 (13): 2145–2157. doi:10.1016/j.jorganchem.2004.03.027. hdl:1874/6594. S2CID 100214292. Archived from the original (PDF) on 2011-08-07. Retrieved 2009-07-31.
- ^ Peng, Yang; Ellis, Bobby D.; Wang, Xinping; Fettinger, James C.; Power, P. P. (2009). «Reversible Reactions of Ethylene with Distannynes Under Ambient Conditions». Science. 325 (5948): 1668–1670. Bibcode:2009Sci…325.1668P. doi:10.1126/science.1176443. PMID 19779193. S2CID 3011002.
- ^ Shu, Frank H. (1982). The physical universe: An introduction to astronomy. University Science Books. pp. 119–121. ISBN 978-0-935702-05-7.
- ^ Emsley 2001, pp. 124, 231, 449 and 503.
- ^ a b «Tin: From Ore to Ingot». International Tin Research Institute. 1991. Archived from the original on 2009-03-22. Retrieved 2009-03-21.
- ^ Sutphin, David M.; Sabin, Andrew E.; Reed, Bruce L. (1 June 1992). Tin – International Strategic Minerals Inventory Summary Report. p. 9. ISBN 978-0-941375-62-7. Archived from the original on 2016-04-28.
- ^ a b c d e f g Carlin, James F. Jr. «Tin: Statistics and Information» (PDF). United States Geological Survey. Archived from the original on 2008-12-06. Retrieved 2008-11-23.
- ^ Reilly, Michael (26 May 2007). «How Long Will it Last?». New Scientist. 194 (2605): 38–39. Bibcode:2007NewSc.194…38R. doi:10.1016/S0262-4079(07)61508-5. ISSN 0262-4079.
- ^ Brown, Lester (2006). Plan B 2.0. New York: W.W. Norton. p. 109. ISBN 978-0-393-32831-8.
- ^ Kovalenko, V. I.; Yarmolyuk, V. V. (1995). «Endogenous rare metal ore formations and rare metal metallogeny of Mongolia». Economic Geology. 90 (3): 520. doi:10.2113/gsecongeo.90.3.520. Archived from the original on 2008-09-05.
- ^ «Seminole Group Colombia Discovers High Grade Tin Ore in the Amazon Jungle». FreePR101 PressRelease. Archived from the original on 2014-08-26.
- ^ Schrader, George F.; Elshennawy, Ahmad K.; Doyle, Lawrence E. (July 2000). Manufacturing processes and materials. ISBN 978-0-87263-517-3. Archived from the original on 2016-05-11.
- ^ Louis, Henry (1911). Metallurgy of tin. McGraw-Hill book Company.
- ^ Knorr, Klaus (1945). Tin Under Control. Stanford University Press. ISBN 978-0-8047-2136-3. Archived from the original on 2016-05-19.
- ^ «LME Tin Brands». ITRI.co.uk. International Tin Research Institute. Archived from the original on 2008-12-07. Retrieved 2009-05-05.
- ^ «Top Ten Tin Producing Companies». itri.co.uk. International Tin Research Institute. Archived from the original on 2008-12-07. Retrieved 2009-05-05.
- ^ «The World’s Biggest Tin Producers». The Balance. 13 January 2019.
- ^ «Agreement establishing the Association of Tin Producing Countries [1984] ATS 10». Australasian Legal Information Institute, Australian Treaties Library.
- ^ a b Carlin, James F. Jr. (1998). «Significant events affecting tin prices since 1958» (PDF). USGS. Archived from the original (PDF) on 2011-10-28.
- ^ «12 Januari Pemasaran Perdana INATIN». 15 December 2011. Archived from the original on 2012-04-26.
- ^ Daly, Tom (5 December 2021). «Tin surge worsens supply chain woes for electronics, solar and auto firms». Reuters. Retrieved 2021-12-07.
- ^ «Tin demand to decline – International Tin Association». Mining.com. 18 October 2019. Retrieved 2021-07-03.
- ^ Black, Harvey (2005). «Getting the Lead Out of Electronics». Environmental Health Perspectives. 113 (10): A682–5. doi:10.1289/ehp.113-a682. PMC 1281311. PMID 16203230.
- ^ Childs, Peter (July 1995). «The tin-man’s tale». Education in Chemistry. Vol. 32, no. 4. Royal Society of Chemistry. p. 92. Retrieved 2018-06-19.
- ^ Control, Tin Under (1945). Tin Under Control. pp. 10–15. ISBN 978-0-8047-2136-3. Archived from the original on 2016-05-31.
- ^ Panel On Tin, National Research Council (U.S.). Committee on Technical Aspects of Critical and Strategic Materials (1970). Trends in the use of tin. pp. 10–22. Archived from the original on 2016-05-22.
- ^ Hull, Charles (1992). Pewter. Osprey Publishing. pp. 1–5. ISBN 978-0-7478-0152-8.
- ^ Brakes, James (2009). «Introduction». Analysis of Babbit. BiblioBazaar, LLC. pp. 1–2. ISBN 978-1-110-11092-6.
- ^ Williams, Robert S. (2007). Principles of Metallography. Read books. pp. 46–47. ISBN 978-1-4067-4671-6.
- ^ «The Composition of the Cent». US Mint. Archived from the original on 2011-10-25. Retrieved 2011-10-28.
- ^ «Composition of canadian coins» (PDF). Canadian Mint. Archived (PDF) from the original on 2012-01-13. Retrieved 2011-10-28.
- ^ Geballe, Theodore H. (October 1993). «Superconductivity: From Physics to Technology». Physics Today. 46 (10): 52–56. Bibcode:1993PhT….46j..52G. doi:10.1063/1.881384.
- ^ Campbell, Flake C. (2008). «Zirconium». Elements of Metallurgy and Engineering Alloys. p. 597. ISBN 978-0-87170-867-0. Archived from the original on 2016-05-28.
- ^ Robert Palmieri, ed. (2006). «Pipe Metal». Encyclopedia of keyboard instruments. New York: Garland. p. 411. ISBN 978-0-415-94174-7.
- ^ George Ashdown Audsley (1988). «Metal Pipes: And the Materials used in their Construction». The Art of Organ Building Audsley, George Ashdown. Courier Dover Publications. p. 501. ISBN 978-0-486-21315-6.
- ^ Kim, H.; Gilmore, C.; Pique, A.; Horwitz, J.; Mattoussi, H.; Murata, H.; Kafafi, Z.; Chrisey, D. (1999). «Electrical, optical, and structural properties of indium tin oxide thin films for organic light-emitting devices». Journal of Applied Physics. 86 (11): 6451. Bibcode:1999JAP….86.6451K. doi:10.1063/1.371708.
- ^ Bridge, Janet (September 1996). Making & decorating picture frames. North Light Books. ISBN 978-0-89134-739-2.
- ^ «Tin punching». Archived from the original on 2011-08-11. Retrieved 2011-08-15.
- ^ Pilkington, L. A. B. (1969). «Review Lecture. The Float Glass Process». Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences. 314 (1516): 1–25. Bibcode:1969RSPSA.314….1P. doi:10.1098/rspa.1969.0212. JSTOR 2416528. S2CID 109981215.
- ^ Lucas, Ivan T.; Syzdek, Jarosław; Kostecki, Robert (2011). «Interfacial processes at single-crystal β-Sn electrodes in organic carbonate electrolytes». Electrochemistry Communications. 13 (11): 1271–1275. doi:10.1016/j.elecom.2011.08.026.
- ^ «Colgate Gel-Kam». Archived from the original on 2009-04-27. Retrieved 2009-05-05.
- ^ Hattab, F. (April 1989). «The State of Fluorides in Toothpastes». Journal of Dentistry. 17 (2): 47–54. doi:10.1016/0300-5712(89)90129-2. PMID 2732364.
- ^ Perlich, M. A.; Bacca, L. A.; Bollmer, B. W.; Lanzalaco, A. C.; McClanahan, S. F.; Sewak, L. K.; Beiswanger, B. B.; Eichold, W. A.; Hull, J. R.; et al. (1995). «The clinical effect of a stabilized stannous fluoride dentifrice on plaque formation, gingivitis and gingival bleeding: a six-month study». The Journal of Clinical Dentistry. 6 (Special Issue): 54–58. PMID 8593194.
- ^ Ebdon, L.; Britain), Royal Society of Chemistry (Great (2001). «Organotin in Industrial and Domestic Products». Trace element speciation for environment, food and health. p. 144. ISBN 978-0-85404-459-7. Archived from the original on 2016-05-21.
- ^ a b c d Atkins, Peter; Shriver, Duward F.; Overton, Tina & Rourke, Jonathan (2006). Inorganic chemistry (4th ed.). W.H. Freeman. pp. 343, 345. ISBN 978-0-7167-4878-6.
- ^ Wilkes, Charles E.; Summers, James W.; Daniels, Charles Anthony; Berard, Mark T. (August 2005). PVC handbook. p. 108. ISBN 978-1-56990-379-7. Archived from the original on 2016-05-09.
- ^ David N.-S. Hon; Nobuo Shiraishi, eds. (2001). «Preservation of Wood». Wood and cellulosic chemistry. New York, NY: Dekker. p. 799. ISBN 978-0-8247-0024-9.
- ^ Antizar-Ladislao, Blanca (1 February 2008). «Environmental levels, toxicity and human exposure to tributyltin (TBT)-contaminated marine environment. A review». Environment International. 34 (2): 292–308. doi:10.1016/j.envint.2007.09.005. ISSN 0160-4120. PMID 17959247.
- ^ Eisler, Ronald. «Tin Hazards To Fish, Wildlife, and Invertebrates: A Synoptic Review» (PDF). U.S. Fish and Wildlife Service Patuxent Wildlife Research Center. Archived (PDF) from the original on 2012-01-18.
- ^ «Regulation (EC) No 782/2003 of the European Parliament and of the Council of 14 April 2003 on the prohibition of organotin compounds on ships». europa.eu. Retrieved 2009-05-05.
- ^ Dürr, Simone; Thomason, Jeremy, eds. (2008). «Fouling on Shipping». Biofouling. Oxford: Blackwell. p. 227. ISBN 978-1-4051-6926-4.
- ^ a b Maguire, R. James (1987). «Environmental aspects of tributyltin». Applied Organometallic Chemistry. 1 (6): 475–498. doi:10.1002/aoc.590010602. ISSN 1099-0739.
- ^ de Mora, S. J.; Stewart, C.; Phillips, D. (1 January 1995). «Sources and rate of degradation of tri(n-butyl)tin in marine sediments near Auckland, New Zealand». Marine Pollution Bulletin. 30 (1): 50–57. doi:10.1016/0025-326X(94)00178-C. ISSN 0025-326X.
- ^ a b Axiak, Victor; Micallef, Diane; Muscat, Joanne; Vella, Alfred; Mintoff, Bernardette (1 March 2003). «Imposex as a biomonitoring tool for marine pollution by tributyltin: some further observations». Environment International. Secotox S.I. 28 (8): 743–749. doi:10.1016/S0160-4120(02)00119-8. ISSN 0160-4120. PMID 12605923.
- ^ a b c «The Effects of Tributyltin on the Marine Environment». ScienceBuzz. 17 November 2018. Retrieved 2020-11-17.
- ^ Farina, Vittorio; Krishnamurthy, Venkat; Scott, William J. (1997). «The Stille Reaction». Organic Reactions. pp. 1–652. doi:10.1002/0471264180.or050.01. ISBN 0-471-26418-0.
- ^ Mou, Haoyi; Xiao, Wei; Miao, Chang; Li, Rui; Yu, Liming (19 March 2020). «Tin and Tin Compound Materials as Anodes in Lithium-Ion and Sodium-Ion Batteries: A Review». Frontiers in Chemistry. 8: 141. Bibcode:2020FrCh….8..141M. doi:10.3389/fchem.2020.00141. ISSN 2296-2646. PMC 7096543. PMID 32266205.
- ^ Lucas, Ivan; Syzdek, Jaroslaw (2011). «Interfacial processes at single-crystal β-Sn electrodes in organic carbonate electrolytes». Electrochemistry Communications. 13 (11): 1271. doi:10.1016/j.elecom.2011.08.026.
- ^ «CDC — NIOSH Pocket Guide to Chemical Hazards — Tin». www.cdc.gov. Archived from the original on 2015-11-25. Retrieved 2015-11-24.
Bibliography[edit]
This article incorporates text from this source, which is in the public domain: Carlin, James F., Jr. (1998). «Significant events affecting tin prices since 1958». U.S. National Geodetic Survey
- CRC contributors (2006). David R. Lide (ed.). Handbook of Chemistry and Physics (87th ed.). Boca Raton, Florida: CRC Press, Taylor & Francis Group. ISBN 978-0-8493-0487-3.
- Emsley, John (2001). «Tin». Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 445–450. ISBN 978-0-19-850340-8.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Heiserman, David L. (1992). «Element 50: Tin». Exploring Chemical Elements and their Compounds. New York: TAB Books. ISBN 978-0-8306-3018-9.
- MacIntosh, Robert M. (1968). «Tin». In Clifford A. Hampel (ed.). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. pp. 722–732. LCCN 68-29938.
- Stwertka, Albert (1998). «Tin». Guide to the Elements (Revised ed.). Oxford University Press. ISBN 978-0-19-508083-4.
External links[edit]
- Tin at The Periodic Table of Videos (University of Nottingham)
- Theodore Gray’s Wooden Periodic Table Table: Tin samples and castings
- Base Metals: Tin
- CDC — NIOSH Pocket Guide to Chemical Hazards
- Tin (USD cents per kg)
This article is about the chemical element. For other uses, see Tin (disambiguation).
Not to be confused with Titanium.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tin | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allotropes | silvery-white, β (beta); gray, α (alpha) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Sn) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tin in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 14 (carbon group) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Kr] 4d10 5s2 5p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 505.08 K (231.93 °C, 449.47 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2875 K (2602 °C, 4716 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | white, β: 7.265 g/cm3 gray, α: 5.769 g/cm3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 6.99 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | white, β: 7.03 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | white, β: 296.1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | white, β: 27.112 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −4, −3, −2, −1, 0,[2] +1,[3] +2, +3,[4] +4 (an amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 139±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 217 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of tin |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered tetragonal
white (β) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered diamond-cubic
gray (α) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 2730 m/s (at r.t.) (rolled) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 22.0 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 66.8 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 115 nΩ⋅m (at 0 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | gray: diamagnetic[5] white (β): paramagnetic |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | (white) +3.1×10−6 cm3/mol (298 K)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 50 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 18 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 58 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 50–440 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-31-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | protohistoric, around 35th century BC | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «Sn»: from Latin stannum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of tin
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Tin is a chemical element with the symbol Sn (from Latin: stannum) and atomic number 50. Tin is a silvery-coloured metal.
Tin is soft enough to be cut with little force[7] and a bar of tin can be bent by hand with little effort. When bent, the so-called «tin cry» can be heard as a result of twinning in tin crystals;[8] this trait is shared by indium, cadmium, zinc, and mercury in the solid state.
Pure tin after solidifying presents a mirror-like appearance similar to most metals. In most tin alloys (such as pewter) the metal solidifies with a dull gray color.
Tin is a post-transition metal in group 14 of the periodic table of elements. It is obtained chiefly from the mineral cassiterite, which contains stannic oxide, SnO
2. Tin shows a chemical similarity to both of its neighbors in group 14, germanium and lead, and has two main oxidation states, +2 and the slightly more stable +4. Tin is the 49th most abundant element on Earth and has, with 10 stable isotopes, the largest number of stable isotopes in the periodic table, thanks to its magic number of protons.
It has two main allotropes: at room temperature, the stable allotrope is β-tin, a silvery-white, malleable metal; at low temperatures it is less dense grey α-tin, which has the diamond cubic structure. Metallic tin does not easily oxidize in air and water.
The first tin alloy used on a large scale was bronze, made of 1⁄8 tin and 7⁄8 copper, from as early as 3000 BC. After 600 BC, pure metallic tin was produced. Pewter, which is an alloy of 85–90% tin with the remainder commonly consisting of copper, antimony, bismuth, and sometimes lead and silver, has been used for flatware since the Bronze Age. In modern times, tin is used in many alloys, most notably tin / lead soft solders, which are typically 60% or more tin, and in the manufacture of transparent, electrically conducting films of indium tin oxide in optoelectronic applications. Another large application is corrosion-resistant tin plating of steel. Because of the low toxicity of inorganic tin, tin-plated steel is widely used for food packaging as tin cans. Some organotin compounds can be extremely toxic.
Characteristics[edit]
Physical[edit]
Tin is a soft, malleable, ductile and highly crystalline silvery-white metal. When a bar of tin is bent a crackling sound known as the «tin cry» can be heard from the twinning of the crystals.[8] Tin melts at about 232 °C (450 °F) the lowest in group 14. The melting point is further lowered to 177.3 °C (351.1 °F) for 11 nm particles.[9][10]
| External video |
|---|
β-tin, the metallic form or white tin, has BCT structure and is stable at and above room temperature and is malleable. α-tin, the nonmetallic form or gray tin, is stable below 13.2 °C (55.8 °F) and is brittle. α-tin has a diamond cubic crystal structure, similar to diamond, silicon or germanium. α-tin has no metallic properties, because its atoms form a covalent structure in which electrons cannot move freely. α-tin is a dull-gray powdery material with no common uses other than specialized semiconductor applications.[8] γ-tin and σ-tin exist at temperatures above 161 °C (322 °F) and pressures above several GPa.[11]
In cold conditions β-tin tends to transform spontaneously into α-tin, a phenomenon known as «tin pest» or «tin disease».[12] Some unverifiable sources also say that, during Napoleon’s Russian campaign of 1812, the temperatures became so cold that the tin buttons on the soldiers’ uniforms disintegrated over time, contributing to the defeat of the Grande Armée,[13] a persistent legend.[14][15][16]
The α-β transformation temperature is 13.2 °C (55.8 °F), but impurities (e.g. Al, Zn, etc.) lower it well below 0 °C (32 °F). With the addition of antimony or bismuth the transformation might not occur at all, increasing durability.[17]
Commercial grades of tin (99.8% tin content) resist transformation because of the inhibiting effect of small amounts of bismuth, antimony, lead, and silver present as impurities. Alloying elements such as copper, antimony, bismuth, cadmium, and silver increase the hardness of tin.[18] Tin easily forms hard, brittle intermetallic phases that are typically undesirable. It does not mix into a solution with most metals and elements so tin does not have much solid solubility. Tin mixes well with bismuth, gallium, lead, thallium and zinc forming simple eutectic systems.[17]
Tin becomes a superconductor below 3.72 K[19] and was one of the first superconductors to be studied.[20] The Meissner effect, one of the characteristic features of superconductors, was first discovered in superconducting tin crystals.[20]
Chemical[edit]
Tin resists corrosion from water, but can be corroded by acids and alkalis. Tin can be highly polished and is used as a protective coat for other metals,[8] a protective oxide (passivation) layer prevents further oxidation.[21] Tin acts as a catalyst triggering a chemical reaction of a solution containing oxygen and helps to increase the speed of the chemical reaction that results.[22]
Isotopes[edit]
Tin has ten stable isotopes, the greatest number of any element. The isotopes of tin have atomic masses of 112, 114, 115, 116, 117, 118, 119, 120, 122, and 124. 120Sn makes up almost a third of all tin; 118Sn, and 116Sn are also common, while 115Sn is the least common stable isotope. The isotopes with even mass numbers have no nuclear spin, while those with odd mass numbers have a spin of 1/2. Tin is among the easiest elements to detect and analyze by NMR spectroscopy which relies on molecular weight and its chemical shifts are referenced against SnMe
4.[notes 1][23] The large number of stable isotopes is thought to be a direct result of tin having the atomic number 50, a «magic number» in nuclear physics. Of the stable isotopes Tin-115 has a high capture cross section for fast neutron energies at 30 Barns. Two other isotopes Tin-117 ranks next with a cross section of 2.3 Barn while isotope Tin-119 has a slightly smaller cross section of 2.2 Barn. [24] Before these cross sections were well known it was proposed to use Tin-Lead solder as a reactor coolant for fast reactors because of its low melting point. Current studies are for Lead or Lead-Bismuth reactor coolants because both heavy metals are nearly transparent to fast neutrons with very low capture cross sections. [25] In order to use a Tin or Tin-Lead coolant the Tin would first have to go through isotopes separation to remove the 115, 117 and 119 isotopes from the material. Combined these three isotopes make up about 17% of the entire mass of natural Tin but represent nearly all of the capture cross section. Of the remaining seven isotopes Tin-112 has a capture cross section of 1 Barn. The other six isotopes forming 82.7% of all Tin have capture cross sections of 0.3 Barn or less making them effectively transparent to neutrons like Lead and Bismuth.
Tin has 31 unstable isotopes, ranging in mass number from 99 to 139. The unstable tin isotopes have a half-life of less than a year except 126Sn which has a half-life of 230,000 years.
100Sn and 132Sn are two of the few nuclides with a «doubly magic» nucleus which despite being unstable, as they have very uneven neutron–proton ratios, are the endpoints beyond which tin isotopes lighter than 100Sn and heavier than 132Sn are much less stable.[26] Another 30 metastable isomers have been identified for tin isotopes between 111 and 131, the most stable being 121mSn, with a half-life of 43.9 years.[27]
The relative differences in the number of tin’s stable isotopes can be explained by how they are formed during stellar nucleosynthesis. 116Sn through 120Sn are formed in the s-process (slow neutron capture) in most stars which leads to them being the most common tin isotopes, while 122Sn and 124Sn are only formed in the r-process (rapid neutron capture) in supernovae and are less common. Tin isotopes 117Sn through 120Sn are also produced in the r-process.[citation needed] 112Sn, 114Sn, and 115Sn, cannot be made in significant amounts in the s— or r-processes and are among the p-nuclei whose origins are not well understood. Some ideas about for their formation include proton capture and photodisintegration, 115Sn might be partially produced in the s-process both directly and as the daughter of long-lived 115In.[28]
Etymology[edit]
The word tin is shared among Germanic languages and can be traced back to reconstructed Proto-Germanic *tin-om; cognates include German Zinn, Swedish tenn and Dutch tin. It is not found in other branches of Indo-European, except by borrowing from Germanic (e.g., Irish tinne from English).[29][30]
The Latin name for tin, stannum, originally meant an alloy of silver and lead, and came to mean ‘tin’ in the fourth century[31]—the earlier Latin word for it was plumbum candidum, or «white lead». Stannum apparently came from an earlier stāgnum (meaning the same substance),[29] the origin of the Romance and Celtic terms for tin, such as French étain, Spanish estaño, Italian stagno, and Irish stán.[29][32] The origin of stannum/stāgnum is unknown; it may be pre-Indo-European.[33]
The Meyers Konversations-Lexikon suggests instead that stannum came from Cornish stean, and is evidence that Cornwall in the first centuries AD was the main source of tin.[citation needed]
History[edit]
Ceremonial giant bronze dirk of the Plougrescant-Ommerschans type, Plougrescant, France, 1500–1300 BC.
Tin extraction and use can be dated to the beginnings of the Bronze Age around 3000 BC, when it was observed that copper objects formed of polymetallic ores with different metal contents had different physical properties.[34] The earliest bronze objects had a tin or arsenic content of less than 2% and are believed to be the result of unintentional alloying due to trace metal content in the copper ore.[35] The addition of a second metal to copper increases its hardness, lowers the melting temperature, and improves the casting process by producing a more fluid melt that cools to a denser, less spongy metal.[35] This was an important innovation that allowed for the much more complex shapes cast in closed molds of the Bronze Age. Arsenical bronze objects appear first in the Near East where arsenic is commonly found with copper ore, but the health risks were quickly realized and the quest for sources of the much less hazardous tin ores began early in the Bronze Age.[36] This created the demand for rare tin metal and formed a trade network that linked the distant sources of tin to the markets of Bronze Age cultures.[citation needed]
Cassiterite (SnO
2), the oxide form of tin, was most likely the original source of tin. Other tin ores are less common sulfides such as stannite that require a more involved smelting process. Cassiterite often accumulates in alluvial channels as placer deposits because it is harder, heavier, and more chemically resistant than the accompanying granite.[35] Cassiterite is usually black or dark in color, and these deposits can be easily seen in river banks. Alluvial (placer) deposits may incidentally have been collected and separated by methods similar to gold panning.[37]
Compounds and chemistry[edit]
In the great majority of its compounds, tin has the oxidation state II or IV. Compounds containing bivalent tin are called stannous while those containing tetravalent tin are termed stannic.
Inorganic compounds[edit]
Halide compounds are known for both oxidation states. For Sn(IV), all four halides are well known: SnF4, SnCl4, SnBr4, and SnI4. The three heavier members are volatile molecular compounds, whereas the tetrafluoride is polymeric. All four halides are known for Sn(II) also: SnF2, SnCl
2, SnBr2, and SnI2. All are polymeric solids. Of these eight compounds, only the iodides are colored.[38]
Tin(II) chloride (also known as stannous chloride) is the most important commercial tin halide. Illustrating the routes to such compounds, chlorine reacts with tin metal to give SnCl4 whereas the reaction of hydrochloric acid and tin produces SnCl
2 and hydrogen gas. Alternatively SnCl4 and Sn combine to stannous chloride by a process called comproportionation:[39]
- SnCl4 + Sn → 2 SnCl
2
Tin can form many oxides, sulfides, and other chalcogenide derivatives. The dioxide SnO
2 (cassiterite) forms when tin is heated in the presence of air.[38] Sn)
2 is amphoteric, which means that it dissolves in both acidic and basic solutions.[40] Stannates with the structure [Sn(OH)
6]2−, like K
2[Sn(OH)
6], are also known, though the free stannic acid H
2[Sn(OH)
6] is unknown.
Sulfides of tin exist in both the +2 and +4 oxidation states: tin(II) sulfide and tin(IV) sulfide (mosaic gold).
Hydrides[edit]
Stannane (SnH
4), with tin in the +4 oxidation state, is unstable. Organotin hydrides are however well known, e.g. tributyltin hydride (Sn(C4H9)3H).[8] These compound release transient tributyl tin radicals, which are rare examples of compounds of tin(III).[42]
Organotin compounds[edit]
Organotin compounds, sometimes called stannanes, are chemical compounds with tin–carbon bonds.[43] Of the tin compounds, the organic derivatives are commercially the most useful.[44] Some organotin compounds are highly toxic and have been used as biocides. The first organotin compound to be reported was diethyltin diiodide ((C2H5)2SnI2), reported by Edward Frankland in 1849.[45]
Most organotin compounds are colorless liquids or solids that are stable to air and water. They adopt tetrahedral geometry. Tetraalkyl- and tetraaryltin compounds can be prepared using Grignard reagents:[44]
- SnCl
4 + 4 RMgBr → R
4Sn + 4 MgBrCl
The mixed halide-alkyls, which are more common and more important commercially than the tetraorgano derivatives, are prepared by redistribution reactions:
- SnCl
4 + R
4Sn → 2 SnCl
2R2
Divalent organotin compounds are uncommon, although more common than related divalent organogermanium and organosilicon compounds. The greater stabilization enjoyed by Sn(II) is attributed to the «inert pair effect». Organotin(II) compounds include both stannylenes (formula: R2Sn, as seen for singlet carbenes) and distannylenes (R4Sn2), which are roughly equivalent to alkenes. Both classes exhibit unusual reactions.[46]
Occurrence[edit]
Sample of cassiterite, the main ore of tin
Tin is generated via the long s-process in low-to-medium mass stars (with masses of 0.6 to 10 times that of the Sun), and finally by beta decay of the heavy isotopes of indium.[47]
Tin is the 49th most abundant element in Earth’s crust, representing 2 ppm compared with 75 ppm for zinc, 50 ppm for copper, and 14 ppm for lead.[48]
Tin does not occur as the native element but must be extracted from various ores. Cassiterite (SnO
2) is the only commercially important source of tin, although small quantities of tin are recovered from complex sulfides such as stannite, cylindrite, franckeite, canfieldite, and teallite. Minerals with tin are almost always associated with granite rock, usually at a level of 1% tin oxide content.[49]
Because of the higher specific gravity of tin dioxide, about 80% of mined tin is from secondary deposits found downstream from the primary lodes. Tin is often recovered from granules washed downstream in the past and deposited in valleys or the sea. The most economical ways of mining tin are by dredging, hydraulicking, or open pits. Most of the world’s tin is produced from placer deposits, which can contain as little as 0.015% tin.[50]
| Country | Reserves |
|---|---|
| 1,500,000 | |
| 250,000 | |
| 310,000 | |
| 800,000 | |
| 590,000 | |
| 400,000 | |
| 350,000 | |
| 180,000 | |
| 170,000 | |
| Other | 180,000 |
| Total | 4,800,000 |
| Year | Million tonnes |
|---|---|
| 1965 | 4,265 |
| 1970 | 3,930 |
| 1975 | 9,060 |
| 1980 | 9,100 |
| 1985 | 3,060 |
| 1990 | 7,100 |
| 2000 | 7,100[51] |
| 2010 | 5,200[51] |
About 253,000 tonnes of tin were mined in 2011, mostly in China (110,000 t), Indonesia (51,000 t), Peru (34,600 t), Bolivia (20,700 t) and Brazil (12,000 t).[51] Estimates of tin production have historically varied with the market and mining technology. It is estimated that, at current consumption rates and technologies, the Earth will run out of mine-able tin in 40 years.[52] In 2006 Lester Brown suggested tin could run out within 20 years based on conservative estimates of 2% annual growth.[53]
Scrap tin is an important source of the metal. Recovery of tin through recycling is increasing rapidly. Whereas the United States has neither mined (since 1993) nor smelted (since 1989) tin, it was the largest secondary producer, recycling nearly 14,000 tonnes in 2006.[51]
New deposits are reported in Mongolia,[54] and in 2009, new deposits of tin were discovered in Colombia.[55]
Production[edit]
Tin is produced by carbothermic reduction of the oxide ore with carbon or coke. Both reverberatory furnace and electric furnace can be used.[56][57][58]
Mining and smelting[edit]
Industry[edit]
The ten largest companies produced most of the world’s tin in 2007.
Most of the world’s tin is traded on LME, from 8 countries, under 17 brands.[59]
| Company | Polity | 2006 | 2007 | 2017[61] | 2006-2017 % change |
|---|---|---|---|---|---|
| Yunnan Tin | China | 52,339 | 61,129 | 74,500 | 42.3 |
| PT Timah | Indonesia | 44,689 | 58,325 | 30,200 | -32.4 |
| Malaysia Smelting Corp | Malaysia | 22,850 | 25,471 | 27,200 | 19.0 |
| Yunnan Chengfeng | China | 21,765 | 18,000 | 26,800 | 23.1 |
| Minsur | Peru | 40,977 | 35,940 | 18,000 | -56.1 |
| EM Vinto | Bolivia | 11,804 | 9,448 | 12,600 | 6.7 |
| Guangxi China Tin | China | / | / | 11,500 | / |
| Thaisarco | Thailand | 27,828 | 19,826 | 10,600 | -61.9 |
| Metallo-Chimique | Belgium | 8,049 | 8,372 | 9,700 | 20.5 |
| Gejiu Zi Li | China | / | / | 8,700 | / |
International Tin Council was established in 1947 to control the price of tin. It collapsed in 1985. In 1984, Association of Tin Producing Countries was created, with Australia, Bolivia, Indonesia, Malaysia, Nigeria, Thailand, and Zaire as members.[62]
Price and exchanges[edit]
World production and price (US exchange) of tin.
Tin is unique among mineral commodities because of the complex agreements between producer countries and consumer countries dating back to 1921. Earlier agreements tended to be somewhat informal and led to the «First International Tin Agreement» in 1956, the first of a series that effectively collapsed in 1985. Through these agreements, the International Tin Council (ITC) had a considerable effect on tin prices. ITC supported the price of tin during periods of low prices by buying tin for its buffer stockpile and was able to restrain the price during periods of high prices by selling from the stockpile. This was an anti-free-market approach, designed to assure a sufficient flow of tin to consumer countries and a profit for producer countries. However, the buffer stockpile was not sufficiently large, and during most of those 29 years tin prices rose, sometimes sharply, especially from 1973 through 1980 when rampant inflation plagued many world economies.[63]
During the late 1970s and early 1980s, the U.S. reduced its strategic tin stockpile, partly to take advantage of historically high tin prices. The 1981–82 recession damaged the tin industry. Tin consumption declined dramatically. ITC was able to avoid truly steep declines through accelerated buying for its buffer stockpile; this activity required extensive borrowing. ITC continued to borrow until late 1985 when it reached its credit limit. Immediately, a major «tin crisis» ensued — tin was delisted from trading on the London Metal Exchange for about three years. ITC dissolved soon afterward, and the price of tin, now in a free-market environment, fell to $4 per pound and remained around that level through the 1990s.[63] The price increased again by 2010 with a rebound in consumption following the 2007–2008 economic crisis, accompanying restocking and continued growth in consumption.[51]
London Metal Exchange (LME) is tin’s principal trading site.[51] Other tin contract markets are Kuala Lumpur Tin Market (KLTM) and Indonesia Tin Exchange (INATIN).[64]
Due to factors involved in the 2021 global supply chain crisis, tin prices almost doubled between 2020—21 and have had their largest annual rise in over 30 years. The International Tin Association estimated that global refined tin consumption will grow 7.2 percent in 2021, after losing 1.6 percent in 2020 as the COVID-19 pandemic disrupted global manufacturing industries.[65]
Applications[edit]
World consumption of refined tin by end-use, 2006
In 2018, just under half of all tin produced was used in solder. The rest was divided between tin plating, tin chemicals, brass and bronze alloys, and niche uses.[66]
Solder[edit]
A coil of lead-free solder wire
Tin has long been used in alloys with lead as solder, in amounts of 5 to 70% w/w. Tin with lead forms a eutectic mixture at the weight proportion of 61.9% tin and 38.1% lead (the atomic proportion: 73.9% tin and 26.1% lead), with melting temperature of 183 °C (361.4 °F). Such solders are primarily used for joining pipes or electric circuits. Since the European Union Waste Electrical and Electronic Equipment Directive (WEEE Directive) and Restriction of Hazardous Substances Directive came into effect on 1 July 2006, the lead content in such alloys has decreased. While lead exposure is associated with serious health problems, lead-free solder is not without its challenges, including a higher melting point, and the formation of tin whiskers that cause electrical problems. Tin pest can occur in lead-free solders, leading to loss of the soldered joint. Replacement alloys are being found, but the problems of joint integrity remain.[67]
Tin plating[edit]
Tin plated metal from a can.
Tin bonds readily to iron and is used for coating lead, zinc, and steel to prevent corrosion. Tin-plated (or tinning) steel containers is widely used for food preservation, and this forms a large part of the market for metallic tin. A tinplate canister for preserving food was first manufactured in London in 1812.[68] Speakers of British English call such containers «tins», while speakers of American English call them «cans» or «tin cans». One derivation of such use is the slang term «tinnie» or «tinny», meaning «can of beer» in Australia. The tin whistle is so called because it was mass-produced first in tin-plated steel.[69][70]
Copper cooking vessels such as saucepans and frying pans are frequently lined with a thin plating of tin, by electroplating or by traditional chemical methods, since use of copper cookware with acidic foods can be toxic.
Specialized alloys[edit]
Artisans working with tin sheets.
Tin in combination with other elements forms a wide variety of useful alloys. Tin is most commonly alloyed with copper. Pewter is 85–99% tin;[71] bearing metal has a high percentage of tin as well.[72][73] Bronze is mostly copper with 12% tin, while the addition of phosphorus yields phosphor bronze. Bell metal is also a copper–tin alloy, containing 22% tin. Tin has sometimes been used in coinage; it once formed a single-digit percentage (usually five percent or less) of American[74] and Canadian[75] pennies. Because copper is often the major metal in such coins, sometimes including zinc, these could be called bronze, or brass alloys.
The niobium–tin compound Nb3Sn is commercially used in coils of superconducting magnets for its high critical temperature (18 K) and critical magnetic field (25 T). A superconducting magnet weighing as little as two kilograms is capable of producing the magnetic field of a conventional electromagnet weighing tons.[76]
A small percentage of tin is added to zirconium alloys for the cladding of nuclear fuel.[77]
Most metal pipes in a pipe organ are of a tin/lead alloy, with 50/50 as the most common composition. The proportion of tin in the pipe defines the pipe’s tone, since tin has a desirable tonal resonance. When a tin/lead alloy cools, the lead phase solidifies first, then when the eutectic temperature is reached, the remaining liquid forms the layered tin/lead eutectic structure, which is shiny; contrast with the lead phase produces a mottled or spotted effect. This metal alloy is referred to as spotted metal. Major advantages of using tin for pipes include its appearance, workability, and resistance to corrosion.[78][79]
Optoelectronics[edit]
The oxides of indium and tin are electrically conductive and transparent, and are used to make transparent electrically conducting films with applications in optoelectronics devices such as liquid crystal displays.[80]
Other applications[edit]
A 21st-century reproduction barn lantern made of punched tin.
Punched tin-plated steel, also called pierced tin, is an artisan technique originating in central Europe for creating functional and decorative housewares. Decorative piercing designs exist in a wide variety, based on local tradition and the artisan. Punched tin lanterns are the most common application of this artisan technique. The light of a candle shining through the pierced design creates a decorative light pattern in the room where it sits. Lanterns and other punched tin articles were created in the New World from the earliest European settlement. A well-known example is the Revere lantern, named after Paul Revere.[81]
Before the modern era, in some areas of the Alps, a goat or sheep’s horn would be sharpened and a tin panel would be punched out using the alphabet and numbers from one to nine. This learning tool was known appropriately as «the horn». Modern reproductions are decorated with such motifs as hearts and tulips.
In America, pie safes and food safes were in use in the days before refrigeration. These were wooden cupboards of various styles and sizes – either floor standing or hanging cupboards meant to discourage vermin and insects and to keep dust from perishable foodstuffs. These cabinets had tinplate inserts in the doors and sometimes in the sides, punched out by the homeowner, cabinetmaker, or a tinsmith in varying designs to allow for air circulation while excluding flies. Modern reproductions of these articles remain popular in North America.[82]
Window glass is most often made by floating molten glass on molten tin (float glass), resulting in a flat and flawless surface. This is also called the «Pilkington process».[83]
Tin is used as a negative electrode in advanced Li-ion batteries. Its application is somewhat limited by the fact that some tin surfaces[which?] catalyze decomposition of carbonate-based electrolytes used in Li-ion batteries.[84]
Tin(II) fluoride is added to some dental care products[85] as stannous fluoride (SnF2). Tin(II) fluoride can be mixed with calcium abrasives while the more common sodium fluoride gradually becomes biologically inactive in the presence of calcium compounds.[86] It has also been shown to be more effective than sodium fluoride in controlling gingivitis.[87]
Tin is used as a target to create laser-induced plasmas that act as the light source for extreme ultraviolet lithography.
Organotin compounds[edit]
The organotin compounds are most heavily used. Worldwide industrial production probably exceeds 50,000 tonnes.[88]
PVC stabilizers[edit]
The major commercial application of organotin compounds is in the stabilization of PVC plastics. In the absence of such stabilizers, PVC would rapidly degrade under heat, light, and atmospheric oxygen, resulting in discolored, brittle products. Tin scavenges labile chloride ions (Cl−), which would otherwise strip HCl from the plastic material.[89] Typical tin compounds are carboxylic acid derivatives of dibutyltin dichloride, such as the dilaurate.[90]
Biocides[edit]
Some organotin compounds are relatively toxic, with both advantages and problems. They are used for biocidal properties as fungicides, pesticides, algaecides, wood preservatives, and antifouling agents.[89] Tributyltin oxide is used as a wood preservative.[91] Tributyltin is also used for various industrial purposes such as slime control in paper mills and disinfection of circulating industrial cooling waters.[92] Tributyltin was used as additive for ship paint to prevent growth of fouling organisms on ships, with use declining after organotin compounds were recognized as persistent organic pollutants with high toxicity for some marine organisms (the dog whelk, for example).[93] The EU banned the use of organotin compounds in 2003,[94] while concerns over the toxicity of these compounds to marine life and damage to the reproduction and growth of some marine species[89] (some reports describe biological effects to marine life at a concentration of 1 nanogram per liter) have led to a worldwide ban by the International Maritime Organization.[95] Many nations now restrict the use of organotin compounds to vessels greater than 25 m (82 ft) long.[89] The persistence of tributyltin in the aquatic environment is dependent upon the nature of the ecosystem.[96] Because of this persistence and its use as an additive in ship paint, high concentrations of tributyltin have been found in marine sediments located near naval docks.[97] Tributyltin has been used as a biomarker for imposex in neograstropods, with at least 82 known species.[98] With the high levels of TBT in the local inshore areas, due to shipping activities, the shellfish had an adverse effect.[96] Imposex is the imposition of male sexual characteristics on female specimens where they grow a penis and a pallial vas deferens.[98][99] A high level of TBT can damage mammalian endocrine glands, reproductive and central nervous systems, bone structure and gastrointestinal tract.[99] Not only does tributyltin affect mammals, it affects sea otters, whales, dolphins, and humans.[99]
Organic chemistry[edit]
Some tin reagents are useful in organic chemistry. In the largest application, stannous chloride is a common reducing agent for the conversion of nitro and oxime groups to amines. The Stille reaction couples organotin compounds with organic halides or pseudohalides.[100]
Li-ion batteries[edit]
Tin forms several inter-metallic phases with lithium metal, making it a potentially attractive material for battery applications. Large volumetric expansion of tin upon alloying with lithium and instability of the tin-organic electrolyte interface at low electrochemical potentials are the greatest challenges to employment in commercial cells.[101] Tin inter-metallic compound with cobalt and carbon was implemented by Sony in its Nexelion cells released in the late 2000s. The composition of the active material is approximately Sn0.3Co0.4C0.3. Research showed that only some crystalline facets of tetragonal (beta) Sn are responsible for undesirable electrochemical activity.[102]
Precautions[edit]
Cases of poisoning from tin metal, its oxides, and its salts are almost unknown. On the other hand, certain organotin compounds are almost as toxic as cyanide.[44]
Exposure to tin in the workplace can occur by inhalation, skin contact, and eye contact. The US Occupational Safety and Health Administration (OSHA) set the permissible exposure limit for tin exposure in the workplace as 2 mg/m3 over an 8-hour workday. The National Institute for Occupational Safety and Health (NIOSH) determined a recommended exposure limit (REL) of 2 mg/m3 over an 8-hour workday. At levels of 100 mg/m3, tin is immediately dangerous to life and health.[103]
See also[edit]
- Cassiterides (the mythical Tin Islands)
- List of countries by tin production
- Stannary
- Terne
- Tin pest
- Tin mining in Britain
- Tinning
- Whisker (metallurgy) (tin whiskers)
Notes[edit]
- ^ Only H, F, P, Tl and Xe are easier to use NMR analysis with for samples containing isotopes at their natural abundance.
References[edit]
- ^ «Standard Atomic Weights: Tin». CIAAW. 1983.
- ^ «New Type of Zero-Valent Tin Compound». Chemistry Europe. 27 August 2016.
- ^ «HSn». NIST Chemistry WebBook. National Institute of Standards and Technology. Retrieved 2013-01-23.
- ^ «SnH3». NIST Chemistry WebBook. National Institure of Standards and Technology. Retrieved 2013-01-23.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Gray, Theodore (2007). «Tin images». The Elements. Black Dog & Leventhal.
- ^ a b c d e Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). «Tin». Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 793–800. ISBN 978-3-11-007511-3.
- ^ «Ink with tin nanoparticles could print future circuit boards». Phys.org. 12 April 2011. Archived from the original on 16 September 2011.
- ^ Jo, Yun Hwan; Jung, Inyu; Choi, Chung Seok; Kim, Inyoung; Lee, Hyuck Mo (2011). «Synthesis and characterization of low temperature Sn nanoparticles for the fabrication of highly conductive ink». Nanotechnology. 22 (22): 225701. Bibcode:2011Nanot..22v5701J. doi:10.1088/0957-4484/22/22/225701. PMID 21454937. S2CID 25202674.
- ^ Molodets, A.M.; Nabatov, S.S. (2000). «Thermodynamic potentials, diagram of state, and phase transitions of tin on shock compression». High Temperature. 38 (5): 715–721. doi:10.1007/BF02755923. S2CID 120417927.
- ^ «Tin Pests | Center for Advanced Life Cycle Engineering». calce.umd.edu. Retrieved 2022-11-04.
- ^ Le Coureur, Penny; Burreson, Jay (2004). Napoleon’s Buttons: 17 molecules that changed history. New York: Penguin Group, USA.
- ^ Öhrström, Lars (2013). The Last Alchemist in Paris. Oxford: Oxford University Press. ISBN 978-0-19-966109-1.
- ^ Cotton, Simon (29 April 2014). «Book review: The last alchemist in Pari». Chemistry World. Royal Society of Chemistry. Archived from the original on 10 August 2014. Retrieved 22 November 2019.
- ^ Emsley, John (1 October 2011) [2001]. Nature’s Building Blocks: an A-Z Guide to the Elements (New ed.). New York, United States: Oxford University Press. p. 552. ISBN 978-0-19-960563-7.
Only officers had metal buttons, and those were made of brass.
- ^ a b Schwartz, Mel (2002). «Tin and alloys, properties». Encyclopedia of Materials, Parts and Finishes (2nd ed.). CRC Press. ISBN 978-1-56676-661-6.
- ^ «Tin Alloys — Characteristics and Uses». Nuclear Power. Retrieved 2022-11-04.
- ^ Dehaas, W.; Deboer, J.; Vandenberg, G. (1935). «The electrical resistance of cadmium, thallium and tin at low temperatures». Physica. 2 (1–12): 453. Bibcode:1935Phy…..2..453D. doi:10.1016/S0031-8914(35)90114-8.
- ^ a b Meissner, W.; R. Ochsenfeld (1933). «Ein neuer effekt bei eintritt der Supraleitfähigkeit». Naturwissenschaften. 21 (44): 787–788. Bibcode:1933NW…..21..787M. doi:10.1007/BF01504252. S2CID 37842752.
- ^ Craig, Bruce D.; Anderson, David S.; International, A. S. M. (January 1995). Handbook of corrosion data. p. 126. ISBN 978-0-87170-518-1. Archived from the original on 2016-05-11.
- ^ Crutchlow, Charlotte (25 June 2021). «Tin-Formation About the Element Tin | Periodic Table». ChemTalk. Retrieved 2022-11-04.
- ^ «Interactive NMR Frequency Map». Archived from the original on 2011-06-04. Retrieved 2009-05-05.
- ^ «Neutron Scattering Lengths and cross sections».
- ^ «Westinghouse Nuclear > Energy Systems > Lead-cooled Fast Reactor».
- ^ Walker, Phil (1994). «Doubly Magic Discovery of Tin-100». Physics World. 7 (June): 28. doi:10.1088/2058-7058/7/6/24.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Cameron, A. G. W. (1973). «Abundance of the Elements in the Solar System» (PDF). Space Science Reviews. 15 (1): 121–146. Bibcode:1973SSRv…15..121C. doi:10.1007/BF00172440. S2CID 120201972. Archived from the original (PDF) on 2011-10-21.
- ^ a b c «tin». Oxford English Dictionary (Online ed.). Oxford University Press. (Subscription or participating institution membership required.)
- ^ Harper, Douglas. «tin». Online Etymology Dictionary.
- ^ Encyclopædia Britannica, 11th Edition, 1911, s.v. ‘tin’, citing H. Kopp
- ^ «The Ancient Mining of Tin». oxleigh.freeserve.co.uk. Archived from the original on 2009-04-03. Retrieved 2009-07-07.
- ^ American Heritage Dictionary
- ^ Cierny, J.; Weisgerber, G. (2003). «The «Bronze Age tin mines in Central Asia». In Giumlia-Mair, A.; Lo Schiavo, F. (eds.). The Problem of Early Tin. Oxford: Archaeopress. pp. 23–31. ISBN 978-1-84171-564-3.
- ^ a b c Penhallurick, R. D. (1986). Tin in Antiquity: its Mining and Trade Throughout the Ancient World with Particular Reference to Cornwall. London: The Institute of Metals. ISBN 978-0-904357-81-3.
- ^ Lamberg-Karlovsky, C. C.; Franklin, Alan D.; Olin, Jacqueline S.; Wertime, Theodore A., eds. (July 1980). «The development of the usage of tin and tin-bronze: some problems». The Search for Ancient Tin. Technology and Culture. Vol. 21. Washington D.C.: A seminar organized by Theodore A. Wertime and held at the Smithsonian Institution and the National Bureau of Standards, Washington D.C. March 14–15, 1977. p. 474. doi:10.2307/3103162. ISSN 0040-165X. JSTOR 3103162.
- ^ Dube, RK (September 2006). «Interrelation between gold and tin: A historical perspective». Gold Bulletin. 39 (3): 103–113. doi:10.1007/BF03215537.
- ^ a b Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.[page needed]
- ^ Taylor, F. Sherwood (1942). Inorganic & Theoretical Chemistry (6th ed.). Heineman.
- ^ J. M. Leger; J. Haines; A. Atouf (1996). «The high pressure behaviour of the cotunnite and post-cotunnite phases of PbCl2 and SnCl
2«. J. Phys. Chem. Solids. 57 (1): 7–16. Bibcode:1996JPCS…57….7L. doi:10.1016/0022-3697(95)00060-7. - ^ Gaur, D. P.; Srivastava, G.; Mehrotra, R. C. (1973). «Organic Derivatives of Tin. III. Reactions of Trialkyltin Ethoxide with Alkanolamines». Zeitschrift für Anorganische und Allgemeine Chemie. 398: 72. doi:10.1002/zaac.19733980109.
- ^ Elschenbroich, Christoph (2006). Organometallics (3rd, completely rev. and extended ed.). Weinheim: Wiley-VCH. ISBN 3-527-29390-6. OCLC 64305455.
- ^ a b c Graf, G. G. (2000) «Tin, Tin Alloys, and Tin Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH, Weinheim doi:10.1002/14356007.a27_049
- ^ Thoonen, Sander H. L.; Deelman, Berth-Jan; van Koten, Gerard (2004). «Synthetic aspects of tetraorganotins and organotin(IV) halides» (PDF). Journal of Organometallic Chemistry. 689 (13): 2145–2157. doi:10.1016/j.jorganchem.2004.03.027. hdl:1874/6594. S2CID 100214292. Archived from the original (PDF) on 2011-08-07. Retrieved 2009-07-31.
- ^ Peng, Yang; Ellis, Bobby D.; Wang, Xinping; Fettinger, James C.; Power, P. P. (2009). «Reversible Reactions of Ethylene with Distannynes Under Ambient Conditions». Science. 325 (5948): 1668–1670. Bibcode:2009Sci…325.1668P. doi:10.1126/science.1176443. PMID 19779193. S2CID 3011002.
- ^ Shu, Frank H. (1982). The physical universe: An introduction to astronomy. University Science Books. pp. 119–121. ISBN 978-0-935702-05-7.
- ^ Emsley 2001, pp. 124, 231, 449 and 503.
- ^ a b «Tin: From Ore to Ingot». International Tin Research Institute. 1991. Archived from the original on 2009-03-22. Retrieved 2009-03-21.
- ^ Sutphin, David M.; Sabin, Andrew E.; Reed, Bruce L. (1 June 1992). Tin – International Strategic Minerals Inventory Summary Report. p. 9. ISBN 978-0-941375-62-7. Archived from the original on 2016-04-28.
- ^ a b c d e f g Carlin, James F. Jr. «Tin: Statistics and Information» (PDF). United States Geological Survey. Archived from the original on 2008-12-06. Retrieved 2008-11-23.
- ^ Reilly, Michael (26 May 2007). «How Long Will it Last?». New Scientist. 194 (2605): 38–39. Bibcode:2007NewSc.194…38R. doi:10.1016/S0262-4079(07)61508-5. ISSN 0262-4079.
- ^ Brown, Lester (2006). Plan B 2.0. New York: W.W. Norton. p. 109. ISBN 978-0-393-32831-8.
- ^ Kovalenko, V. I.; Yarmolyuk, V. V. (1995). «Endogenous rare metal ore formations and rare metal metallogeny of Mongolia». Economic Geology. 90 (3): 520. doi:10.2113/gsecongeo.90.3.520. Archived from the original on 2008-09-05.
- ^ «Seminole Group Colombia Discovers High Grade Tin Ore in the Amazon Jungle». FreePR101 PressRelease. Archived from the original on 2014-08-26.
- ^ Schrader, George F.; Elshennawy, Ahmad K.; Doyle, Lawrence E. (July 2000). Manufacturing processes and materials. ISBN 978-0-87263-517-3. Archived from the original on 2016-05-11.
- ^ Louis, Henry (1911). Metallurgy of tin. McGraw-Hill book Company.
- ^ Knorr, Klaus (1945). Tin Under Control. Stanford University Press. ISBN 978-0-8047-2136-3. Archived from the original on 2016-05-19.
- ^ «LME Tin Brands». ITRI.co.uk. International Tin Research Institute. Archived from the original on 2008-12-07. Retrieved 2009-05-05.
- ^ «Top Ten Tin Producing Companies». itri.co.uk. International Tin Research Institute. Archived from the original on 2008-12-07. Retrieved 2009-05-05.
- ^ «The World’s Biggest Tin Producers». The Balance. 13 January 2019.
- ^ «Agreement establishing the Association of Tin Producing Countries [1984] ATS 10». Australasian Legal Information Institute, Australian Treaties Library.
- ^ a b Carlin, James F. Jr. (1998). «Significant events affecting tin prices since 1958» (PDF). USGS. Archived from the original (PDF) on 2011-10-28.
- ^ «12 Januari Pemasaran Perdana INATIN». 15 December 2011. Archived from the original on 2012-04-26.
- ^ Daly, Tom (5 December 2021). «Tin surge worsens supply chain woes for electronics, solar and auto firms». Reuters. Retrieved 2021-12-07.
- ^ «Tin demand to decline – International Tin Association». Mining.com. 18 October 2019. Retrieved 2021-07-03.
- ^ Black, Harvey (2005). «Getting the Lead Out of Electronics». Environmental Health Perspectives. 113 (10): A682–5. doi:10.1289/ehp.113-a682. PMC 1281311. PMID 16203230.
- ^ Childs, Peter (July 1995). «The tin-man’s tale». Education in Chemistry. Vol. 32, no. 4. Royal Society of Chemistry. p. 92. Retrieved 2018-06-19.
- ^ Control, Tin Under (1945). Tin Under Control. pp. 10–15. ISBN 978-0-8047-2136-3. Archived from the original on 2016-05-31.
- ^ Panel On Tin, National Research Council (U.S.). Committee on Technical Aspects of Critical and Strategic Materials (1970). Trends in the use of tin. pp. 10–22. Archived from the original on 2016-05-22.
- ^ Hull, Charles (1992). Pewter. Osprey Publishing. pp. 1–5. ISBN 978-0-7478-0152-8.
- ^ Brakes, James (2009). «Introduction». Analysis of Babbit. BiblioBazaar, LLC. pp. 1–2. ISBN 978-1-110-11092-6.
- ^ Williams, Robert S. (2007). Principles of Metallography. Read books. pp. 46–47. ISBN 978-1-4067-4671-6.
- ^ «The Composition of the Cent». US Mint. Archived from the original on 2011-10-25. Retrieved 2011-10-28.
- ^ «Composition of canadian coins» (PDF). Canadian Mint. Archived (PDF) from the original on 2012-01-13. Retrieved 2011-10-28.
- ^ Geballe, Theodore H. (October 1993). «Superconductivity: From Physics to Technology». Physics Today. 46 (10): 52–56. Bibcode:1993PhT….46j..52G. doi:10.1063/1.881384.
- ^ Campbell, Flake C. (2008). «Zirconium». Elements of Metallurgy and Engineering Alloys. p. 597. ISBN 978-0-87170-867-0. Archived from the original on 2016-05-28.
- ^ Robert Palmieri, ed. (2006). «Pipe Metal». Encyclopedia of keyboard instruments. New York: Garland. p. 411. ISBN 978-0-415-94174-7.
- ^ George Ashdown Audsley (1988). «Metal Pipes: And the Materials used in their Construction». The Art of Organ Building Audsley, George Ashdown. Courier Dover Publications. p. 501. ISBN 978-0-486-21315-6.
- ^ Kim, H.; Gilmore, C.; Pique, A.; Horwitz, J.; Mattoussi, H.; Murata, H.; Kafafi, Z.; Chrisey, D. (1999). «Electrical, optical, and structural properties of indium tin oxide thin films for organic light-emitting devices». Journal of Applied Physics. 86 (11): 6451. Bibcode:1999JAP….86.6451K. doi:10.1063/1.371708.
- ^ Bridge, Janet (September 1996). Making & decorating picture frames. North Light Books. ISBN 978-0-89134-739-2.
- ^ «Tin punching». Archived from the original on 2011-08-11. Retrieved 2011-08-15.
- ^ Pilkington, L. A. B. (1969). «Review Lecture. The Float Glass Process». Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences. 314 (1516): 1–25. Bibcode:1969RSPSA.314….1P. doi:10.1098/rspa.1969.0212. JSTOR 2416528. S2CID 109981215.
- ^ Lucas, Ivan T.; Syzdek, Jarosław; Kostecki, Robert (2011). «Interfacial processes at single-crystal β-Sn electrodes in organic carbonate electrolytes». Electrochemistry Communications. 13 (11): 1271–1275. doi:10.1016/j.elecom.2011.08.026.
- ^ «Colgate Gel-Kam». Archived from the original on 2009-04-27. Retrieved 2009-05-05.
- ^ Hattab, F. (April 1989). «The State of Fluorides in Toothpastes». Journal of Dentistry. 17 (2): 47–54. doi:10.1016/0300-5712(89)90129-2. PMID 2732364.
- ^ Perlich, M. A.; Bacca, L. A.; Bollmer, B. W.; Lanzalaco, A. C.; McClanahan, S. F.; Sewak, L. K.; Beiswanger, B. B.; Eichold, W. A.; Hull, J. R.; et al. (1995). «The clinical effect of a stabilized stannous fluoride dentifrice on plaque formation, gingivitis and gingival bleeding: a six-month study». The Journal of Clinical Dentistry. 6 (Special Issue): 54–58. PMID 8593194.
- ^ Ebdon, L.; Britain), Royal Society of Chemistry (Great (2001). «Organotin in Industrial and Domestic Products». Trace element speciation for environment, food and health. p. 144. ISBN 978-0-85404-459-7. Archived from the original on 2016-05-21.
- ^ a b c d Atkins, Peter; Shriver, Duward F.; Overton, Tina & Rourke, Jonathan (2006). Inorganic chemistry (4th ed.). W.H. Freeman. pp. 343, 345. ISBN 978-0-7167-4878-6.
- ^ Wilkes, Charles E.; Summers, James W.; Daniels, Charles Anthony; Berard, Mark T. (August 2005). PVC handbook. p. 108. ISBN 978-1-56990-379-7. Archived from the original on 2016-05-09.
- ^ David N.-S. Hon; Nobuo Shiraishi, eds. (2001). «Preservation of Wood». Wood and cellulosic chemistry. New York, NY: Dekker. p. 799. ISBN 978-0-8247-0024-9.
- ^ Antizar-Ladislao, Blanca (1 February 2008). «Environmental levels, toxicity and human exposure to tributyltin (TBT)-contaminated marine environment. A review». Environment International. 34 (2): 292–308. doi:10.1016/j.envint.2007.09.005. ISSN 0160-4120. PMID 17959247.
- ^ Eisler, Ronald. «Tin Hazards To Fish, Wildlife, and Invertebrates: A Synoptic Review» (PDF). U.S. Fish and Wildlife Service Patuxent Wildlife Research Center. Archived (PDF) from the original on 2012-01-18.
- ^ «Regulation (EC) No 782/2003 of the European Parliament and of the Council of 14 April 2003 on the prohibition of organotin compounds on ships». europa.eu. Retrieved 2009-05-05.
- ^ Dürr, Simone; Thomason, Jeremy, eds. (2008). «Fouling on Shipping». Biofouling. Oxford: Blackwell. p. 227. ISBN 978-1-4051-6926-4.
- ^ a b Maguire, R. James (1987). «Environmental aspects of tributyltin». Applied Organometallic Chemistry. 1 (6): 475–498. doi:10.1002/aoc.590010602. ISSN 1099-0739.
- ^ de Mora, S. J.; Stewart, C.; Phillips, D. (1 January 1995). «Sources and rate of degradation of tri(n-butyl)tin in marine sediments near Auckland, New Zealand». Marine Pollution Bulletin. 30 (1): 50–57. doi:10.1016/0025-326X(94)00178-C. ISSN 0025-326X.
- ^ a b Axiak, Victor; Micallef, Diane; Muscat, Joanne; Vella, Alfred; Mintoff, Bernardette (1 March 2003). «Imposex as a biomonitoring tool for marine pollution by tributyltin: some further observations». Environment International. Secotox S.I. 28 (8): 743–749. doi:10.1016/S0160-4120(02)00119-8. ISSN 0160-4120. PMID 12605923.
- ^ a b c «The Effects of Tributyltin on the Marine Environment». ScienceBuzz. 17 November 2018. Retrieved 2020-11-17.
- ^ Farina, Vittorio; Krishnamurthy, Venkat; Scott, William J. (1997). «The Stille Reaction». Organic Reactions. pp. 1–652. doi:10.1002/0471264180.or050.01. ISBN 0-471-26418-0.
- ^ Mou, Haoyi; Xiao, Wei; Miao, Chang; Li, Rui; Yu, Liming (19 March 2020). «Tin and Tin Compound Materials as Anodes in Lithium-Ion and Sodium-Ion Batteries: A Review». Frontiers in Chemistry. 8: 141. Bibcode:2020FrCh….8..141M. doi:10.3389/fchem.2020.00141. ISSN 2296-2646. PMC 7096543. PMID 32266205.
- ^ Lucas, Ivan; Syzdek, Jaroslaw (2011). «Interfacial processes at single-crystal β-Sn electrodes in organic carbonate electrolytes». Electrochemistry Communications. 13 (11): 1271. doi:10.1016/j.elecom.2011.08.026.
- ^ «CDC — NIOSH Pocket Guide to Chemical Hazards — Tin». www.cdc.gov. Archived from the original on 2015-11-25. Retrieved 2015-11-24.
Bibliography[edit]
This article incorporates text from this source, which is in the public domain: Carlin, James F., Jr. (1998). «Significant events affecting tin prices since 1958». U.S. National Geodetic Survey
- CRC contributors (2006). David R. Lide (ed.). Handbook of Chemistry and Physics (87th ed.). Boca Raton, Florida: CRC Press, Taylor & Francis Group. ISBN 978-0-8493-0487-3.
- Emsley, John (2001). «Tin». Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 445–450. ISBN 978-0-19-850340-8.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Heiserman, David L. (1992). «Element 50: Tin». Exploring Chemical Elements and their Compounds. New York: TAB Books. ISBN 978-0-8306-3018-9.
- MacIntosh, Robert M. (1968). «Tin». In Clifford A. Hampel (ed.). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. pp. 722–732. LCCN 68-29938.
- Stwertka, Albert (1998). «Tin». Guide to the Elements (Revised ed.). Oxford University Press. ISBN 978-0-19-508083-4.
External links[edit]
- Tin at The Periodic Table of Videos (University of Nottingham)
- Theodore Gray’s Wooden Periodic Table Table: Tin samples and castings
- Base Metals: Tin
- CDC — NIOSH Pocket Guide to Chemical Hazards
- Tin (USD cents per kg)
|
|||
| Внешний вид простого вещества | |||
|---|---|---|---|
|
|
|||
| Свойства атома | |||
| Имя, символ, номер |
О́лово / Stannum (Sn), 50 |
||
| Атомная масса (молярная масса) |
118,71 а. е. м. (г/моль) |
||
| Электронная конфигурация |
[Kr] 4d10 5s2 5p2 |
||
| Радиус атома |
162 пм |
||
| Химические свойства | |||
| Ковалентный радиус |
141 пм |
||
| Радиус иона |
(+4e) 71 (+2) 93 пм |
||
| Электроотрицательность |
1,96 (шкала Полинга) |
||
| Электродный потенциал |
-0,136 |
||
| Степени окисления |
+4, +2 |
||
| Энергия ионизации (первый электрон) |
708,2 (7,34) кДж/моль (эВ) |
||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) |
7,31 г/см³ |
||
| Температура плавления |
231,9 °C |
||
| Температура кипения |
2543 K |
||
| Теплота плавления |
7,07 кДж/моль |
||
| Теплота испарения |
296 кДж/моль |
||
| Молярная теплоёмкость |
27,11[1] Дж/(K·моль) |
||
| Молярный объём |
16,3 см³/моль |
||
| Кристаллическая решётка простого вещества | |||
| Структура решётки |
тетрагональная |
||
| Параметры решётки |
a=5,831;c=3,181 Å |
||
| Отношение c/a |
0,546 |
||
| Температура Дебая |
170,00 K |
||
| Прочие характеристики | |||
| Теплопроводность |
(300 K) 66,8 Вт/(м·К) |
О́лово (лат. Stannum; обозначается символом Sn) — элемент главной подгруппы четвёртой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 50. Относится к группе лёгких металлов. При нормальных условиях простое вещество олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета. Олово образует две аллотропические модификации: ниже 13,2 °C устойчиво α-олово (серое олово) с кубической решёткой типа алмаза, выше 13,2 °C устойчиво β-олово (белое олово) с тетрагональной кристаллической решеткой[1].
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 3.1 Месторождения
- 3.2 Распространённость в природе
- 3.3 Формы нахождения
- 3.3.1 Твёрдая фаза. Минералы
- 3.3.2 Собственно минеральные формы
- 3.3.2.1 Самородные элементы, сплавы и интерметаллические соединения
- 3.3.2.2 Окисные соединения олова
- 3.3.2.3 Сульфидные соединения олова
- 3.3.3 Коллоидная форма
- 3.3.4 Формы нахождения олова в жидкой фазе
- 3.4 Промышленные типы месторождений олова
- 4 Производство
- 5 Физические и химические свойства
- 6 Оловянная чума
- 7 Применение
- 8 Изотопы
- 9 Физиологическое действие
- 10 Галерея изображений
- 11 Примечания
- 12 Ссылки
История
Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был малодоступен и дорог, поэтому изделия из него редко встречаются среди римских и греческих древностей. Об олове есть упоминания в Библии, Четвёртой Книге Моисеевой. Олово является (наряду с медью) одним из компонентов бронзы (см. История меди и бронзы), изобретённой в конце или середине III тысячелетия до н. э.. Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было «стратегическим металлом» в течение всего «бронзового века», более 2000 лет (очень приблизительно: 35—11 века до н. э.).
Капля расплавленного олова
Происхождение названия
Латинское название stannum, связанное с санскритским словом, означающим «стойкий, прочный», первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67 % олова; к IV веку этим словом стали называть собственно олово.
Слово олово — общеславянское, имеющее соответствия в балтийских языках (ср. лит. alavas, alvas — «олово», прусск. alwis — «свинец»). Оно является суффиксальным образованием от корня ol- (ср. древневерхненемецкое elo — «жёлтый», лат. albus — «белый» и пр.), так что металл назван по цвету[2].
Нахождение в природе
Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2·10−4 до 8·10−3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Природное олово состоит из девяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %), и одного слабо радиоактивного олова-124 (5,94 %). 124Sn — бета-излучатель, его период полураспада очень велик и составляет T1/2 = 1016−1017 лет[3].
Месторождения
Мировые месторождения олова находятся в Юго-Восточной Азии, в основном в Китае, Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Чукотском автономном округе (рудник/посёлок Валькумей, разработка месторождения закрыта в начале 90-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
Распространённость в природе
Распространённость в природе отражена в следующей таблице[4]:
| Геол. объект | Камен. метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Гранитоиды | Глины и др. | Вода океанов | Живое вещество(% на живой вес) | Почва | Зола растений |
|---|---|---|---|---|---|---|---|---|---|---|
| Содержание, вес. % | 001·10−4 | 05·10−5 | 01,5·10−4 | 0000− | 0003·10−4 | 1·10−3 | 07·10−7 | 00005·10−5 | 1·10−3 | 005·10−4 |
В незагрязнённых поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограмм на дм³, увеличиваясь в районе оловорудных месторождений, оно попадает в воды за счёт разрушения в первую очередь сульфидных минералов, неустойчивых в зоне окисления. ПДКSn = 2 мг/дм³.
Олово является амфотерным элементом, то есть элементом, способным проявлять кислотные и основные свойства. Это свойство олова определяет и особенности его распространения в природе. Благодаря этой двойственности олово проявляет литофильные, халькофильные и сидерофильные свойства. Олово по своим свойствам проявляет близость к кварцу, вследствие чего известна тесная связь олова в виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащёнными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Щелочной характер поведения олова определяется в образовании довольно разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Формы нахождения
Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах[5].
Твёрдая фаза. Минералы
Кристаллы касситерита
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма; конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe+2: биотиты, гранаты, пироксены, магнетиты, турмалины и т. д. Эта связь обусловлена изоморфизмом, например по схеме Sn+4 + Fe+2 → 2Fe+3. В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес.%) (особенно в андрадитах), эпидотах (до 2,84 вес.%) и т. д.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2+1Fe+2SnS4 или тиллита PbSnS2 и других минералов.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Хотя концентрации этих минералов в породах очень низки, однако распространены они в широком круге генетических образований. Среди самородных форм вместе с Sn выявлены Fe, Al, Cu, Ti, Cd и т. д., не считая уже известные самородные платиноиды, золото и серебро. Эти же элементы образуют между собой и различные сплавы: (Cu + Sn + Sb), (Pb + Sn + Sb) и др., а также твёрдые растворы. Среди интерметаллических соединений установлены стистаит SnSb, атакит (Pd,Pt)3Sn, штумырлит Pt(Sn,Bi), звягинцевит (Pd,Pt)3(Pb,Sn), таймырит (Pd,Cu,Pt)3Sn и другие[6][7].
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях[7]:
- Группа интрузивных и эффузивных магматических пород: траппы, пикриты Сибирской платформы, гипербазиты и габброиды Камчатки, кимберлиты Якутии, лампроиты Алдана и т. д.; гранитоиды Приморья, Дальнего Востока, Тянь-Шаня.
- Группа метасоматически и гидротермально изменённых пород: медно-никелевые руды Сибирской платформы, золоторудные объекты Урала, Кавказа, Узбекистана и т. д.[8]
- Группа современного рудообразования: пелагические осадки Тихого океана, продукты Большого Трещинного Толбачинского извержения, гидротермальная система Узон на Камчатке и пр.
- Группа осадочных пород различного происхождения.
Окисные соединения олова
Наиболее известной формой является главный минерал олова — касситерит SnO2, представляющий собой соединение олова с кислородом. В минерале по данным ядерной гамма-резонансной спектроскопии присутствует Sn+4.
Касситерит
Касситерит (от греч. kassiteros — олово) — главный рудный минерал для получения олова. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зерна минерала достигают в размере 3 — 4 мм и даже больше.
- Плотность 6040-7120 кг/м³ (наиболее низкая у светлоокрашенных касситеритов).
- Твердость 6½.
- Блеск — матовый, на гранях — алмазный.
- Спайность несовершенная.
- Излом раковистый.
Основные формы выделения касситерита:
- микровключения в других минералах;
- акцессорные выделения минерала в породах и рудах;
- сплошные или вкрапленные руды: игольчатые радиально-лучистые агрегаты (Приморье), коломорфные и криптокристаллические выделения и скопления (Приморье); кристаллическая форма — главная форма выделения касситерита. В России месторождения касситерита имеются на Северо-Востоке, в Приморье, Якутии, Забайкалье; за рубежом — в Малайзии, Таиланде, Индонезии, КНР, Боливии, Нигерии и др.
Гидроокисные соединения
Второстепенное место занимают гидроокисные соединения олова, которые можно рассматривать как соли полиоловянных кислот. К ним можно отнести минерал сукулаит Ta2Sn2+2O[9]; твёрдый раствор олова в магнетите вида Fe2SnO4 или Fe3SnO3 (Бретштейн Ю. С., 1974;Воронина Л. Б. 1979); «варламовит» — продукт окисления станнина; считается, что он представляет собой смесь аморфных и полуаморфных соединений Sn, метаоловянной кислоты, поликонденсированной фазы и гидрокасситеритовой фазы. Известны также гидратированные продукты окисления — гидромартит 3SnOxH2O; мушистонит (Cu,Zn,Fe)Sn(OH)6; гидростаннат меди CuSn(OH)6 и др.
Силикаты
Известна многочисленная группа силикатов олова, представленная малаяитом CaSn[SiO5][10]; пабститом Ba(Sn, Ti)Si3O9[11], стоказитом Ca2Sn2Si6O18x4H2O и др. Малаяит образует даже промышленные скопления.
Шпинелиды
Из других окисных соединений известны также шпинелиды, например, минерал нигерит Sn2Fe4Al16О32 (Peterson E.U., 1986).
Сульфидные соединения олова
Включает различные соединения олова с серой. Это вторая по промышленному значению группа минеральных форм нахождения олова. Наиболее важным из них является станнин, второй по значению минерал. Кроме этого отмечаются франкеит Pb5Sn3Sb2S14, герценбергит SnS, берндтит SnS2, тиллит PbSnS2 и кестерит Cu2ZnSnS4. Выявлены и более сложные сульфидные соединения олова со свинцом, серебром, медью, имеющие в основном минералогическое значение. Тесная связь олова с медью обусловливает частое присутствие на оловорудных месторождения халькопирита CuFeS2 с образованием парагенезиса касситерит — халькопирит.
Станнин
Станнин (от лат. stannum — олово), оловянный колчедан, минерал из класса сульфидов с общей формулой вида Cu2FeSnS4. Она следует из формулы халькопирита путём замены одного атома Fe на Sn. Содержит 29,58 % Cu, 12,99 % Fe, 27,5 % Sn и 29,8 S, а также примеси Zn, Sb, Cd, Pb и Ag. Широко распространённый минерал в оловорудных месторождениях России. На ряде местрождений России (Приморье, Якутия) и Средней Азии (Таджикистан) он является существенным элементов сульфидных минералов и часто вместе с варламовитом составляет 10—40 % общего олова. Часто образует вкрапленность в сфалерите ZnS, халькопирите. Во многих случаях наблюдаются явления распада станнина с выделением касситерита.
Коллоидная форма
Коллоидные и олово-кремнистые соединения играют значительную роль в геохимии олова, хотя детально она не изучена. Значительное место в геологии элемента играют коломорфные соединения и продукты его кристаллических превращений в скрытокристаллические разности. Коломорфный касситерит рассматривается как форма выражения вязких гелеобразных растворов.
Независимые исследования выявили аномально высокую растворимость SnO2 в хлор-кремниевых растворах. Максимальная растворимость достигается при отношении 
Анализ свойств соединения Sn(OH)4 и близость их к соединению Si(OH)4 выявляет способность его к полимеризации с образованием в конечном счёте соединений H2SnkO2k+1, SnkO2k−1(OH)2. В обоих случаях возможно замещение группы (ОН) на анионы F и Cl.
Таким образом, полимеризация молекул Sn(OH)4 и соединение их с молекулами Si(OH)4 ведёт к образованию геля (коллоида) и появлению цепочек HmSn2nSinOp, причём m ≤ 8[12], или Hs[SiO2n(SnOm)d] (Некрасов И. Я. и др., 1973).
Имеющиеся данные говорят о том, что коллоидная форма является естественным промежуточным звеном при осаждении олова из гидротермальных растворов.
Формы нахождения олова в жидкой фазе
Наименее изученная часть геохимии олова, хотя в газово-жидких включениях установлены касситериты в виде минералов-узников (Кокорин А. М. и др., 1975). Работ по анализу конкретных оловосодержащих природных растворов нет. В основном вся информация основана на результатах экспериментальных исследований, которые говорят только о вероятных формах нахождения олова в растворах. Существенную роль в разработке методики этих исследований принадлежит академику В. Л. Барсукову[5]
Вся совокупность экспериментально установленных форм нахождения олова в растворах разбивается на группы:
- Ионные соединения. Эти соединения и их структура описываются с позиций классических валентных и стереохимических представлений. Выделяюся подгруппы:
- Простые ионы Sn+2 и Sn+4 в основном обнаружены в магматических расплавах, а также в гидротермальных растворах, обладающими низкими значениями рН. Однако в существующих гидротермальных системах, отражаемых составом газово-жидких включений, такие условия не установлены.
- Соли галлоидных кислот — SnF2, SnF40, SnCl40. Считается, что роль хлора в переносе и отложении олова и сопутствующих металлов более значительна, чем роль фтора.
- Гидроксильные соединения олова. В щелочных условиях исходными являются соединения H2SnO2, H2SnO4, H2SnO3. Эти формы часто устанавливаются на основе известных минеральных форм. Часть этих форм имеет как искусственное (CaSnO3, Ca2SnO4), так и природное (FeSnO2, Fe2SnO4) происхождение. В кислых средах эти соединения ведут себя как слабые основания типа Sn(OH)2, Sn(OH)4. Считается, что одной из форм проявления подобных соединений является варламовит. Согласно экспериментальным данным Sn(OH)4 отлагается только при Т< 280 °C в слабокислых или нейтральных условиях при рН = 7 — 9. Соединения Sn(OH)4 и Sn(OH)3+ устойчивы при рН= 7 — 9, тогда как Sn(OH)2+2 и Sn(OH)+2 — при рН < 7.
Довольно часто группы (ОН)−1 замещаются на F и Cl, создавая галогенозамещённые модификации гидросоединений олова. В общем виде эти формы представлены соединениями Sn(OH)4-kFk или Sn(OH)4-kFk-nn. В целом соединение Sn(OH)3F устойчиво при Т = 25 — 50 °C, а Sn(OH)2F² при Т = 200 °C. - Сульфидные соединения. По экспериментальным данным в растворе присутствуют соединения SnS4−4 или SnS3−2 при рН > 9; SnS2O−2 (pH = 8 — 9) и Sn(SH)4 (pH = 6). Имеется упоминание о существовании соединения типа Na2SnS3, неустойчивого в кислой среде.
- Комплексные соединения олова изучены при растворении касситерита во фторированных средах. Эти соединения отличаются высокой растворимостью. Этими же свойствами обладают соединения, полученные в хлоридных растворах. В качестве основных форм комплексных соединений, известных из экспериментов, можно назвать Na2[Sn(OH)6], Na2[SnF6], Na2[Sn(OH)2F4] и пр. Эксперименты показали, что комплекс Sn(OH)4F2−2 будет преобладать при Т = 200 °C.
- Коллоидные и олово-кремнистые соединения. Об их существовании говорит присутствие на многих месторождениях коломорфных выделений касситерита. Смотреть выше.
Промышленные типы месторождений олова
Описанные выше геохимические особенности олова находят косвенное отражение в формационной классификации оловорудных месторождений, предложенной Е. А. Радкевич с последующими дополнениями.
- А. Формация оловоносных гранитов. Касситерит установлено в акцессорной части гранитов.
- Б. Формация редкометальных гранитов. Это граниты литионит-амазонит-альбитового типа (апограниты по А. А. Беусу). Касситерит в акцессорной части вместе колумбит-татнатлитом, микролитом и пр.
- В. Формация оловоносных пегматитов. Оловянная минерализация характерна для Be-Li-, Be-Ta-, F-Li- типов.
- Г. Формация полевошпат-кварц-касситеритовая. Выделена Ив. Ф. Григорьевым. Это кварц-полевошпатовые жилы с касситеритом и др. минералами.
- Д.Формация кварц-касстеритовая. Распространена на СВ России. Это жильные зоны, грейзены с кварцем, мусковитом, вольфрамитом, касситеритом и др.
- Е.Формация касситерит-силикатно-сульфидная с турмалиновым и хлоритовым типами. Одна из основных продуктивных формаций Приморья России.
- Ж.Формация касситерит-сульфидная. Также основная оловопродуктивная формация. В ней выделяют основные типы:
-
- штокверковое олово-вольфрамовое оруденение;
- рудные тела квар-касситерит-арсенопиритового типа;
- продуктивные кварцевые жилы сульфидно-касситерит-хлоритового типа;
-
- З.Формация оловянно-скарновая.
- И.Формация деревянистого олова (риолитовая формация).
- К.Формация основных и ультраосновных пород (по И. Я. Некрасову)[11][12]
- Л.Формация щелочных пород Украины(по В. С. Металлиди, 1988).
Производство
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационном методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40-70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановления древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки[13].
Физические и химические свойства
- Плотность, г/см : в твердом состоянии при 20°С — 7,3; в жидком состоянии при температуре плавления — 6.98
- Температура, °С: плавления — 231,9; кипения — 2200
- Коэффициент линейного расширения при температуре 20-100°С, К-1 — 22,4.10-6
- Удельная теплоемкость, Дж/(кг. К): в твердом состоянии при 20°С — 226; в жидком состоянии при температуре плавления — 268
- Теплопроводность при 20°С, Вт/(м. К) — 65,8
- Удельное электросопротивление при 20°С, мк Ом м — 0,115
- Удельная электропроводность при 20°С, МСм/м — 8,69
- Механические и технологические свойства олова:
- Временное сопротивление разрыву , МПа — 20
- Относительное удлинение, % — 80
- Твердость по Бринеллю,НВ — 5
- Температура литья, °С — 260—300
Простое вещество олово полиморфно. В обычных условиях оно существует в виде β-модификации (белое олово), устойчивой выше 13,2 °C. Белое олово — это серебристо-белый, мягкий, пластичный металл, обладающий тетрагональной элементарной ячейкой, параметры a = 0.5831, c = 0.3181 нм. Координационное окружение каждого атома олова в нём — октаэдр. Плотность β-Sn 7,228 г/см3.
При охлаждении, например, при морозе на улице, белое олово переходит в α-модификацию (серое олово). Серое олово имеет структуру алмаза (кубическая кристаллическая решетка с параметром а = 0,6491 нм). В сером олове координационный полиэдр каждого атома — тетраэдр, координационное число 4. Фазовый переход β-Sn в α-Sn сопровождается увеличением удельного объёма на 25,6 % (плотность α-Sn составляет 5,75 г/см3), что приводит к рассыпанию олова в порошок. В старые времена наблюдавшееся во время сильных холодов рассыпание оловянных изделий называли «оловянной чумой». В результате этой «чумы» пуговицы на обмундировании солдат, их пряжки, кружки, ложки рассыпались, и армия могла потерять боеспособность. (Подробнее об «оловянной чуме» см. интересные факты об олове, ссылка внизу этой страницы).
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, β-Sn — металл, а α-Sn относится к числу полупроводников. Ниже 3,72 К 
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150 °C:
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
Олово медленно реагирует c концентрированной соляной кислотой:
В разбавленной серной кислоте олово не растворяется, а с концентрированной — реагирует очень медленно.
Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте образуется оловянная кислота 
При взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. В результате реакции образуется соль нитрат олова (II):
При нагревании олово, подобно свинцу, может реагировать с водными растворами щелочей. При этом выделяется водород и образуется гидроксокомплекс Sn (II), например:
Гидрид олова — станнан SnH4 — можно получить по реакции:
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0 °C.
Олову отвечают два оксида SnO2 (образующийся при обезвоживании оловянных кислот) и SnO. Последний можно получить при слабом нагревании гидроксида олова (II) Sn(OH)2 в вакууме:
При сильном нагреве оксид олова (II) диспропорционирует:
При хранении на воздухе монооксид SnO постепенно окисляется:
При гидролизе растворов солей олова (IV) образуется белый осадок — так называемая 
Свежеполученная 
При хранении 

При действии на раствор соли Sn(II) растворами сульфидов выпадает осадок сульфида олова(II):
Этот сульфид может быть легко окислен до SnS2 раствором полисульфида аммония:
Образующийся дисульфид SnS2 растворяется в растворе сульфида аммония (NH4)2S:
Четырёхвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и других.
Оловянная чума
Серое и белое олово
|
|
Проверить информацию.
Необходимо проверить точность фактов и достоверность сведений, изложенных в этой статье. |
При температуре ниже 13,2 °C происходит увеличение удельного объёма чистого олова на 25,6 %, и оно спонтанно переходит в другое фазовое состояние — серое олово (α-Sn), в кристаллической решётке которого атомы располагаются менее плотно. Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Олово трескается и превращается в порошок. Причём соприкосновение серого олова и белого приводит к «заражению» последнего. Совокупность этих явлений называется «оловянной чумой». Начало научного изучения этого фазового перехода было положено в 1870 г. работами петербургского учёного Ю. Фрицше. Установлено, что это есть процесс аллотропического превращения белого олова в серое со структурой типа алмаза. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии».
Белое олово — серебристо-белый, блестящий металл со специфической тетрагональной структурой и электронным s2p2-состоянием — β-фазой. Серое олово — ковалентный кристалл со структурой алмаза и электронным sp3-состоянием — α-фазой. Фазовые переходы олова из белого в серое и обратно сопровождаются перестройкой электронной структуры и сильным (26,6 %) объёмным эффектом. Белое олово можно переохладить до гелиевых температур (температура фазового α-β-равновесия около +13,2 °C).
Одним из средств предотвращения «оловянной чумы» является добавление в олово стабилизатора, например висмута.
Любопытные факты:
- «Оловянная чума» — одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 г. Она осталась без горючего из-за того, что топливо просочилось через запаянные оловом баки, поражённые «оловянной чумой». Нынешнее название этому процессу в 1911 году дал Г. Коэн.
- Некоторые историки[кто?] указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 г. — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок.
- «Оловянная чума» погубила многие ценнейшие коллекции оловянных солдатиков. Например, в запасниках петербургского музея Александра Суворова превратились в труху десятки фигурок — в подвале, где они хранились, лопнули зимой батареи отопления.
Применение
- Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. Для этих целей расходуется около 33 % всего добываемого олова. До 60 % производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
- Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
- Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
- Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
- Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
- Цены на металлическое олово в 2006 году составили в среднем 12—18 долл/кг, двуокись олова высокой чистоты около 25 долл/кг, монокристаллическое олово особой чистоты около 210 долл/кг.
Изотопы
Природное олово состоит из десяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) и 124 (5,94 %). Этот элемент обладает наибольшим числом стабильных изотопов, что связано с фактом, что 50 (число протонов в ядрах олова) является магическим числом — оно составлет заполненную протонную оболочку в ядре и повышает тем самым энергию связи и стабильность ядра.
Изотопы олова 117Sn и 119Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Физиологическое действие
О роли олова в живых организмах практически ничего не известно. В теле человека содержится примерно (1-2)• 10−4% олова, а его ежедневное поступление с пищей составляет 0,2-3,5 мг. Металлическое олово не токсично, что позволяет применять его в пищевой промышленности. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз — поражение легких. Очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках — 100 мг/кг. Токсическая доза олова для человека — 2 г.
Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 °C, не выделяются в воздух рабочей зоны в объёмах, превышающих предельно допустимую концентрацию в соответствии с ГОСТ. Длительное (в течение 15—20 лет) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом.
Галерея изображений
-
α и β олово
-
Оловянный куб
-
Оловянная руда
-
Консервная банка с оловянным покрытием
-
Мелкие вкрапления касситерита на разрезе кварц-топаза в поляризованном свете. Ширина изображения 3,3 мм.
-
Кристаллы касситерита (тёмные)
Примечания
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1992. — Т. 3. — С. 382. — 639 с. — 50 000 экз. — ISBN 5—85270—039—8
- ↑ Л. А. Введенская, Н. П. Колесников. Этимология: Учебное пособие // СПб.: Питер, 2004, стр. 122.
- ↑ Спиваковский В. Б. Аналитическая химия олова. М., 1975
- ↑ Войткевич Г. В., Мирошников А. Е., Поваренных А. С. Краткий справочник по геохимии. М.: Недра, 1970
- ↑ 1 2 Барсуков В. Л. и др. Основные черты геохимии олова. М.: Наука, 1974.
- ↑ Еремеев Н. В. и др. Самородные элементы в лампроидах Центрального Алдана.//Доклады АН СССР, 1988, 303, 6, С.1464 — 1467
- ↑ 1 2 Самородное минералообразование в магматических процессах. Часть I и II. Якутск, 1981
- ↑ Крылова В. В. и др. Олово, свинец и интерметаллические соединения в рудах золото-серебряной формации./Труды ЦНИГРИ, 1979, Т.142, С.22 — 28
- ↑ Некрасов И. Я. Фазовые соотношения в олово-содержащих системах. М.: Наука, 1976
- ↑ Говоров И. Н. Геохимия рудных районов Приморья. М.: Наука, 1977
- ↑ 1 2 Некрасов И. Я. Фазовые соотношения в олово-содержащих системах М.: Наука, 1976
- ↑ 1 2 Некрасов И. Я. Олово в магматических и постмагматических процессах. М.: Наука, 1874.
- ↑ Большаков К. А., Федоров П. И. Химия и технология малых металлов. М., 1984.
Ссылки
| Олово на Викискладе? |
- Олово на Webelements
- Олово в Популярной библиотеке химических элементов
- Б. Я. Розен. Соперник серебра. М., «Металлургия», 1984
- Олово — иллюстрированная научно-популярная статья на periodictable.ru
- Демонстрационные ролики: «Оловянная чума» на PeriodicTable.ru
- Горение олова, видео
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
| |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au Элементы расположены в порядке возрастания стандартного электродного потенциала. |
| |
|
|---|---|
| Металлы | Алюминий (Al) | Железо (Fe) | Золото (Au) | Медь (Cu) | Никель (Ni) | Олово (Sn) | Палладий (Pd) | Платина (Pt) | Серебро (Ag) | Свинец (Pb) | Хром (Cr) | Цинк (Zn) |
| Сплавы | Акмонитал | Алюминиевая бронза (CuAl) | Биллон (CuAg) | Бронза (CuSn) | Колыванская медь (CuAuAg) | Латунь (CuZn) | Медно-никелевый сплав (CuNi) | Мельхиор (CuNiFeMn) | Нейзильбер, нойзильбер (CuZnNi) | Нержавеющая сталь (FeCrNi) | Никелевая бронза (CuSnNi) | Никелево-железный сплав (NiFe) | Никелево-цинковый сплав (NiZn) | Потин | Северное золото (CuAlZnSn) | Сталь (Fe) | Стерлинг (AgCu) | Томпак (CuZn) | Хромированная сталь (FeCr) | Чугун (Fe) | Электр, электрон, электрум (AuAg) |
| Группы монет | Биметаллические монеты | Бронзовые монеты | Медные монеты | Железные монеты | Золотые монеты | Палладиевые монеты | Платиновые монеты | Серебряные монеты | Сибирская монета |
| Группы металлов | Монетная группа (подгруппа меди) | Благородные металлы | Платиновая группа |
| См. также | Безмонетный период | Бумажные деньги | Денежная бумага | Кожаные рубли | Марки-деньги | Монетное дело | Нотгельд | Символы благородных металлов |
Как пишется олово?
Хотите спросить как пишется олово? Олово в химии обозначается Sn. Латинское название «stannum» означает «прочность».
Применение олова
Имеет серебристо-белый цвет, но на воздухе постепенно окисляется и темнеет. Олово используется очень широко:
- При сгорании образуется белый порошок.Его используют, как средство для полировки поверхностей.
- Большая часть добываемого в мире олова идет на изготовление консервных банок. В России около ста промышленных установок для переработки олова. В переработку идут отходы белой жести, ее обрабатывают хлором. Олово с ним соединяется легко.
- Многие из оловянных соединений токсичны, поэтому они входят в состав инсектицидов и противогельминтных средств. Олово стимулирует рост и развитие растений. В тех концентрациях, в которых оно содержится в данных средствах, олово неопасно для человека.
- Оксид олова используют при получении рубинового стекла.
- Двуокись олова используется, как абразив.
- Дисульфид олова используют для имитации позолоты.
- Из смеси солей олова изготовляют краситель для шерсти.
- Олово известно человеку с древности, как и золото, серебро, медь и железо. Посуду изготовляли в древности из чистого олова, как и украшения.
- Тетрахлорид олова используют, как растворитель фосфора и йода.
- Олово – основной компонент для получения титана. Титан – отличный биосовместимый материал. Из него изготовляются протезы, медицинские спицы, брекеты для коррекции прикуса, коронки.
- Тонкая оловянная фольга используется для электроконденсаторов.
- Припои олова нетоксичны, поэтому могут служить, как припой для посуды. Припои используют для прочного соединения металлических деталей.
- Конечно, из олова также изготовляют произведения искусства. В том же Эрмитаже вы можете полюбоваться на эту красоту и даже попробовать изготовить фигурки самостоятельно. Это не очень сложно, но требует усердия, терпения и художественного вкуса. Без таланта тут не обойтись.
Олово в природе встречается редко, в составе оловянной руды чистого олова – не более 1%. Современное получение олова трудоемко.
Несколько интересных фактов об олове
Древние римляне употребляли вино, которое изготовлялось в оловянных котлах. Металл проникал в вино и понемногу отравлял римлян. Конечно, никто тогда не занимался химией, поэтому этот феномен древние никак не могли объяснить.
В жилых помещениях, расположенных ближе, чем за километр от автострады, в воздухе фиксируют избыток олова. Олово создает условия для появления злокачественных опухолей в организме.
Оценка статьи:
Загрузка…
| Олово | |
|---|---|
| Серебристо-белый мягкий, пластичный металл (β-олово) или серый порошок (α-олово) | |

Β-олово |
|
| Название, символ, номер | Олово / Stannum (Sn), 50 |
| Атомная масса (молярная масса) |
118,710(7) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p2 |
| Радиус атома | 162 пм |
| Ковалентный радиус | 141 пм |
| Радиус иона | (+4e) 71 (+2) 93 пм |
| Электроотрицательность | 1,96 (шкала Полинга) |
| Электродный потенциал | −0,136 |
| Степени окисления | +4, +2 |
| Энергия ионизации (первый электрон) |
708,2 (7,34) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,31 г/см³ |
| Температура плавления | 231,91 °C |
| Температура кипения | 2893 K, 2620 °C |
| Уд. теплота плавления | 7,19; кДж/моль |
| Уд. теплота испарения | 296 кДж/моль |
| Молярная теплоёмкость | 27,11 Дж/(K·моль) |
| Молярный объём | 16,3 см³/моль |
| Структура решётки | тетрагональная |
| Параметры решётки | a=5,831; c=3,181 Å |
| Отношение c/a | 0,546 |
| Температура Дебая | 170,00 K |
| Теплопроводность | (300 K) 66,8 Вт/(м·К) |
| Номер CAS | 7440-31-5 |
Олово (химический символ — Sn; лат. Stannum) — элемент 14-й группы периодической системы химических элементов (по устаревшей классификации — элемент главной подгруппы IV группы), пятого периода, с атомным номером 50. Относится к группе лёгких металлов. При нормальных условиях простое вещество олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета. Известны четыре аллотропические модификации олова: ниже +13,2 °C устойчиво α-олово (серое олово) с кубической решёткой типа алмаза, выше +13,2 °C устойчиво β-олово (белое олово) с тетрагональной кристаллической решёткой. При высоких давлениях обнаружены также γ-олово и σ-олово.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Физические свойства
- 3.1 Серое и белое олово
- 3.2 Изотопы
- 4 Химические свойства
- 4.1 Металлическое олово
- 4.2 Олово (II)
- 4.3 Олово (IV)
- 5 Нахождение в природе
- 5.1 Месторождения
- 5.2 Распространённость в природе
- 5.3 Формы нахождения
- 5.3.1 Твёрдая фаза. Минералы
- 5.3.2 Собственно минеральные формы
- 5.3.2.1 Самородные элементы, сплавы и интерметаллические соединения
- 5.3.2.2 Окисные соединения олова
- 5.3.2.2.1 Касситерит
- 5.3.2.2.2 Гидроокисные соединения
- 5.3.2.2.3 Силикаты
- 5.3.2.2.4 Шпинелиды
- 5.3.2.3 Сульфидные соединения олова
- 5.3.2.3.1 Станнин
- 5.3.3 Коллоидная форма
- 5.3.4 Формы нахождения олова в жидкой фазе
- 5.4 Промышленные типы месторождений олова
- 6 Производство
- 7 Применение
- 8 Физиологическое действие
- 9 Галерея изображений
История
Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был малодоступен и дорог, поэтому изделия из него редко встречаются среди римских и греческих древностей. Об олове есть упоминания в Библии, Четвёртой Книге Моисея. Олово является (наряду с медью) одним из компонентов оловяннистой бронзы, изобретённой в конце или середине III тысячелетия до н. э. Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было «стратегическим металлом» в течение всего «бронзового века», более 2000 лет (очень приблизительно: XXXV—XI века до н. э.).
Чистое олово получено не ранее XII в., о нем упоминает в своих трудах Р. Бэкон. До этого олово всегда содержало переменное количество свинца. Хлорид SnCl4 впервые получил А. Либавий в 1597 г. Аллотропию олова и явление «оловянной чумы» объяснил Э. Кохен в 1899 г.
Происхождение названия
Латинское название stannum, связанное с санскритским словом, означающим «стойкий, прочный», первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67 % олова; к IV веку н. э. этим словом стали называть собственно олово.
Слово олово — общеславянское, однако в некоторых славянских языках такое же или однокоренное слово (польск. ołów, чеш. olovo, серб. олово и др.) используется для обозначения другого, внешне похожего металла — свинца. Слово олово имеет соответствия в балтийских языках (ср. лит. alavas, alvas, латыш. alva — «олово», прусск. alwis — «свинец»). Оно является суффиксальным образованием от корня ol- (ср. древневерхненемецкое elo — «жёлтый», лат. albus — «белый» и пр.), так что металл назван по цвету.
Физические свойства
- Плотность: в твёрдом состоянии при +20 °С — 7,3 г/см³; в жидком состоянии при температуре плавления — 6,98 г/см³.
- Температура: плавления — 231,91 °С; кипения — 2620 °С.
- Коэффициент линейного расширения:
- при температуре 0 °С равен 1,99·10−5 К−1;
- при +100 °С равен 2,38·10−5 К−1;
- средний в диапазоне 0—100 °C равен 2,62·10−5 К−1.
- Удельная теплоёмкость: в твёрдом состоянии при +20 °С — 226 Дж/(кг·К); в жидком состоянии при температуре плавления — 268 Дж/(кг·К).
- Молярная теплоёмкость при постоянном давлении: при 0 °C равна 27,11 Дж/(моль·К) (белое олово), 25,79 Дж/(моль·К) (серое олово).
- Теплота плавления равна 7,19 кДж/моль.
- Теплота испарения равна 296 кДж/моль.
- Теплопроводность при +20 °С — 65,26 Вт/(м·К).
- Удельное электрическое сопротивление при +20 °С — 0,115 мкОм·м (по другим данным 0,128 мкОм·м при +25 °С).
- Термический коэффициент сопротивления равен 4,5·10−3 К−1.
- Удельная электропроводность при +20 °С — 8,69 МСм/м.
- Температура Дебая равна 200 К (белое олово), 212 К (серое олово).
Механические и технологические свойства:
- модуль упругости 55 ГПа при 0 °С и 48 ГПа при 100 °С;
- модуль сдвига 16,8—8,1 ГПа;
- временное сопротивление разрыву — 20 МПа;
- относительное удлинение — 40 %;
- твёрдость по Бринеллю — 152 МПа (белое олово), 62 МПа (серое олово);
- температура литья — 260—300 °С.
При температуре немного выше 170 °С олово становится хрупким.
Стандартный электродный потенциал E °Sn2+/Sn равен −0,136 В, а E пары °Sn4+/Sn2+ около 0,151 В.
Серое и белое олово
Простое вещество олово полиморфно. В обычных условиях оно существует в виде β-модификации (белое олово), устойчивой выше +13,2 °C. Белое олово — серебристо-белый, мягкий, пластичный металл, образующий кристаллы тетрагональной сингонии, пространственная группа I4/amd, параметры ячейки a = 0,58197 нм, c = 0,3175 нм, Z = 4. Координационное окружение каждого атома олова в нём — октаэдр. Плотность β-Sn равна 7,228 г/см3. При сгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов.
При охлаждении белое олово переходит в α-модификацию (серое олово). Серое олово образует кристаллы кубической сингонии, пространственная группа Fd3m, параметры ячейки a = 0,646 нм, Z = 8 со структурой типа алмаза. В сером олове координационный полиэдр каждого атома — тетраэдр, координационное число 4. Фазовый переход β-Sn в α-Sn сопровождается увеличением удельного объёма на 25,6 % (плотность α-Sn составляет 5,75 г/см3), что приводит к рассыпанию олова в порошок. Энтальпия перехода α → β ΔH = 2,08 кДж/моль. Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Тем не менее белое олово можно переохладить до гелиевых температур. Белое олово превращается в серое также под действием ионизирующего излучения.
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, β-Sn — металл, а α-Sn относится к числу полупроводников. Ниже 3,72 К α-Sn переходит в сверхпроводящее состояние. Атомы в кристаллической решётке белого олова находятся в электронном s2p2-состоянии. Серое олово — ковалентный кристалл со структурой алмаза и электронным sp3-состоянием. Белое олово слабо парамагнитно, атомная магнитная восприимчивость χ = +4,5·10−6 (при 303 К), при температуре плавления становится диамагнитным, χ = −5,1·10−6. Серое олово диамагнитно, χ = −3,7·10−5 (при 293 К).
Соприкосновение серого олова и белого приводит к «заражению» последнего, то есть к ускорению фазового перехода по сравнению со спонтанным процессом из-за появления зародышей новой кристаллической фазы. Совокупность этих явлений называется «оловянной чумой». Нынешнее название этому процессу в 1911 году дал Г. Коэн. Начало научного изучения этого фазового перехода было положено в 1870 году работами петербургского учёного, академика Ю. Фрицше. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии».
Одним из средств предотвращения «оловянной чумы» является добавление в олово стабилизатора, например висмута. С другой стороны, ускоряет процесс перехода белого олова в серое при не очень низких температурах катализатор хлорстаннат аммония (NH4)2SnCl6.
«Оловянная чума» — одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 году. Она осталась без горючего из-за того, что топливо просочилось из запаянных оловом баков, поражённых «оловянной чумой».
Некоторые историки указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 году — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок.
«Оловянная чума» погубила многие коллекции оловянных солдатиков. Например, в запасниках петербургского музея Александра Суворова превратились в труху десятки фигурок — в подвале, где они хранились, лопнули зимой батареи отопления.
При высоких давлениях обнаружены ещё две модификации олова: γ-олово (переход при температуре 161 °C и давлении около 4 ГПа, при комнатной температуре и давлении 10 ГПа) и σ-олово (переход при температуре около 1000 °C и давлении выше 21 ГПа).
Изотопы
Основная статья: Изотопы олова
Природное олово состоит из десяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) и 124 (5,94 %). Для некоторых из них энергетически возможен двойной бета-распад, однако экспериментально он пока (2018 г.) не наблюдался, поскольку предсказываемый период полураспада очень велик (более 1020 лет).
Олово обладает наибольшим среди всех элементов числом стабильных изотопов, что связано с тем, что 50 (число протонов в ядрах олова) является магическим числом — оно составляет заполненную протонную оболочку в ядре и повышает тем самым энергию связи и стабильность ядра. Известны два дважды магических изотопа олова, оба они радиоактивны, так как удалены от полосы бета-стабильности: нейтронодефицитное 100Sn (Z = N = 50) и нейтроноизбыточное 132Sn (Z = 50, N = 82).
Изотопы олова 117Sn и 119Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Химические свойства
Металлическое олово
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной плёнки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150 °C:
-
- Sn + O2 → SnO2
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
-
- Sn + 2Cl2 → SnCl4
Растворяется в разбавленных кислотах (HCl, H2SO4):
-
- Sn + 2HCl → SnCl2 + H2↑
Олово реагирует c концентрированной соляной кислотой. При этом белое олово (α-Sn) образует раствор хлорида олова (II), а серое (β-Sn) хлорида олова (IV):
-
- Sn + 3HCl → H[SnCl3 ] + H2↑
- Sn + 4HCl → H2[SnCl6] + H2↑
Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте (60%) образуется оловянная кислота β-SnO2·nH2O (иногда её формулу записывают как H2SnO3). При этом олово ведёт себя как неметалл:
-
- Sn + 4HNO3 → SnO2 ⋅ H2O + 4NO2 + H2O
При взаимодействии с разбавленной азотной кислотой (3-5%) образуется нитрат олова (II):
-
- 4Sn + 10HNO3 → 4Sn(NO3)2 + NH4NO3 + 3H2O
Окисляется растворами щелочей до гидроксостанната (II), который в горячих расстворах склонен к диспропорцианированию:
-
- Sn + NaOH + 3H2O → Na[Sn(OH)3] + H2↑
- 2Na[Sn(OH)3] → Sn + Na2[Sn(OH)6]
- Sn + 2NaOH + 4H2O → Na2[Sn(OH)6] + 2H2↑
Олово (II)
Менее устойчивая степень окисления чем (IV). Вещества имеют высокую восстановительную активность и легко диспропорцианируют:
-
- 2SnO →to SnO2 + Sn
На воздухе соединения быстро окисляются кислородом, как в твердом виде, так и в растворах:
-
- 2SnO + O2 → 2SnO2
- 2Sn2+ + O2 + 4H+ → 2Sn4+ + 2H2O
Сильным восстановителем является «оловянная соль» SnCl2 ⋅ 2H2O
Оксид можно получить действием аммиака на горячий раствор хлорида олова в атмосфере СO2:
-
- SnCl2 + 2NH3 + H2O → SnO + 2NH4Cl
Также при слабом нагревании гидроксида олова (II) Sn(OH)2 в вакууме или осторожном нагревании некоторых солей:
-
- Sn(OH)2 → SnO + H2O
- SnC2O4 → SnO + CO↑ + CO2↑
В растворах солей олова идёт сильный гидролиз:
-
- [Sn(H2O)3]2+ + H2O → [Sn(H2O)2OH]+ + H3O+
При действии на раствор соли Sn(II) растворами сульфидов выпадает осадок сульфида олова (II):
-
- Sn2+ + S2− → SnS↓
Этот сульфид может быть легко окислен до сульфидного комплекса раствором полисульфида натрия, при подкислении превращающегося в осадок сульфида олова (IV):
-
- SnS + Na2S2 → Na2SnS3
- Na2SnS3 + 2HCl → SnS2 + 2NaCl + H2S↑
Олово (IV)
Оксид олова(IV) (SnO2) образуется прямым окислением кислородом. При сплавлении с щелочами образует станнаты, при обработке водой образующие гидроксостаннаты:
-
- SnO2 + 2NaOH →to Na2SnO3 + H2O
При гидролизе растворов солей олова (IV) образуется белый осадок — так называемая α-оловянная кислота:
-
- SnCl4 + 4NH3 + 6H2O → H2[Sn(OH)6] + 4NH4Cl
- H2[Sn(OH)6] → SnO2 ⋅ nH2O + 3H2O
Свежеполученная α-оловянная кислота растворяется в кислотах и щелочах:
-
- SnO2 ⋅ nH2O + 2KOH → K2[Sn(OH)6]
- SnO2 ⋅ nH2O + 4HNO3 → Sn(NO3)4 + (n+2)H2O
При хранении α-оловянная кислота стареет, теряет воду и переходит в β-оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HO-Sn группировок при стоянии и замене их на более инертные мостиковые -Sn-O-Sn- связи.
Гидрид олова — станнан SnH4 — можно получить по реакции:
-
- SnCl4 + Li[AlH4] → SnH4↑ + LiCl + AlCl3
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0 °C.
Четырёхвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и др.
Нахождение в природе
Олово — редкий рассеянный элемент, по распространённости в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2⋅10−4 до 8⋅10−3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Месторождения
Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Хабаровском крае (Солнечный район — месторождения Фестивальное и Соболиное; Верхнебуреинский район — Правоурмийское месторождение), в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин — разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Якутии (месторождение Депутатское) и других районах.
Распространённость в природе
Распространённость в природе отражена в следующей таблице:
| Геол. объект | Камен. метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Гранитоиды | Глины и др. | Вода океанов | Живое вещество(% на живой вес) | Почва | Зола растений |
|---|---|---|---|---|---|---|---|---|---|---|
| Содержание, вес. % | 001⋅10−4 | 05⋅10−5 | 01,5⋅10−4 | 0000− | 0003⋅10−4 | 1⋅10−3 | 07⋅10−7 | 00005⋅10−5 | 1⋅10−3 | 005⋅10−4 |
В незагрязнённых поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограмм на литр, увеличиваясь в районе оловорудных месторождений, оно попадает в воды за счёт разрушения в первую очередь сульфидных минералов, неустойчивых в зоне окисления. ПДКSn = 2 мг/дм³.
Кристаллы касситерита — оловянная руда
Олово является амфотерным элементом, то есть элементом, способным проявлять кислотные и основные свойства. Это свойство олова определяет и особенности его распространения в природе. Благодаря этой двойственности олово проявляет литофильные, халькофильные и сидерофильные свойства. Олово по своим свойствам проявляет близость к кварцу, вследствие чего известна тесная связь олова в виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащёнными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Щелочной характер поведения олова определяется в образовании довольно разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Формы нахождения
Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах.
Твёрдая фаза. Минералы
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма; конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe+2: биотиты, гранаты, пироксены, магнетиты, турмалины и так далее. Эта связь обусловлена изоморфизмом, например, по схеме Sn+4 + Fe+2 → 2Fe+3. В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес. %) (особенно в андрадитах), эпидотах (до 2,84 вес. %) и так далее.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2+1Fe+2SnS4 или тиллита PbSnS2 и других минералов.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Хотя концентрации этих минералов в породах очень низки, однако распространены они в широком круге генетических образований. Среди самородных форм вместе с Sn выявлены Fe, Al, Cu, Ti, Cd и так далее, не считая уже известные самородные платиноиды, золото и серебро. Эти же элементы образуют между собой и различные сплавы: (Cu + Sn + Sb), (Pb + Sn + Sb) и другие, а также твёрдые растворы. Среди интерметаллических соединений установлены стистаит SnSb, атакит (Pd,Pt)3Sn, штумырлит Pt(Sn,Bi), звягинцевит (Pd,Pt)3(Pb,Sn), таймырит (Pd,Cu,Pt)3Sn и другие.
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях:
- Группа интрузивных и эффузивных магматических пород: траппы, пикриты Сибирской платформы, гипербазиты и габброиды Камчатки, кимберлиты Якутии, лампроиты Алдана и так далее; гранитоиды Приморья, Дальнего Востока, Тянь-Шаня.
- Группа метасоматически и гидротермально изменённых пород: медно-никелевые руды Сибирской платформы, золоторудные объекты Урала, Кавказа, Узбекистана и так далее.
- Группа современного рудообразования: пелагические осадки Тихого океана, продукты Большого Трещинного Толбачинского извержения, гидротермальная система Узон на Камчатке и прочие.
- Группа осадочных пород различного происхождения.
Окисные соединения олова
Наиболее известной формой является главный минерал олова — касситерит SnO2, представляющий собой соединение олова с кислородом. В минерале по данным ядерной гамма-резонансной спектроскопии присутствует Sn+4.
Касситерит
Основная статья: Касситерит
Касситерит (от греч. kassiteros — олово) — главный рудный минерал для получения олова, химическая формула SnO2. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зёрна минерала достигают в размере 3—4 мм и даже больше. В чистом виде бесцветные кристаллы, примеси придают минералу самые различные цвета.
- Плотность 6040—7120 кг/м³ (наиболее низкая у светлоокрашенных касситеритов).
- Твёрдость по Моосу 6,5.
- Блеск — матовый, на гранях — алмазный.
- Спайность несовершенная.
- Излом раковистый.
Основные формы выделения касситерита:
- микровключения в других минералах;
- акцессорные выделения минерала в породах и рудах;
- сплошные или вкрапленные руды: игольчатые радиально-лучистые агрегаты (месторождения Приморья), коломорфные и криптокристаллические выделения и скопления (месторождения Приморья); кристаллическая форма — главная форма выделения касситерита.
В России месторождения касситерита имеются на Северо-Востоке, в Приморье, Якутии, Забайкалье; за рубежом — в Малайзии, Таиланде, Индонезии, КНР, Боливии, Нигерии и других странах.
Гидроокисные соединения
Второстепенное место занимают гидроокисные соединения олова, которые можно рассматривать как соли полиоловянных кислот. К ним можно отнести минерал сукулаит Ta2Sn2+2O; твёрдый раствор олова в магнетите вида Fe2SnO4 или Fe3SnO3 (Бретштейн Ю. С., 1974; Воронина Л. Б., 1979); «варламовит» — продукт окисления станнина; считается, что он представляет собой смесь аморфных и полуаморфных соединений Sn, метаоловянной кислоты, поликонденсированной фазы и гидрокасситеритовой фазы. Известны также гидратированные продукты окисления — гидромартит 3SnO·H2O; мушистонит (Cu,Zn,Fe)Sn(OH)6; гидростаннат меди CuSn(OH)6 и другие.
Силикаты
Известна многочисленная группа силикатов олова, представленная малаяитом CaSn[SiO5]; пабститом Ba(Sn, Ti)Si3O9, стоказитом Ca2Sn2Si6O18·4H2O и др. Малаяит образует даже промышленные скопления.
Шпинелиды
Из других окисных соединений известны также шпинелиды, например, минерал нигерит Sn2Fe4Al16O32 (Peterson E. U., 1986).
Сульфидные соединения олова
Включает различные соединения олова с серой. Это вторая по промышленному значению группа минеральных форм нахождения олова. Наиболее важным из них является станнин, второй по значению минерал. Кроме этого, отмечаются франкеит Pb5Sn3Sb2S14, герценбергит SnS, берндтит SnS2, тиллит PbSnS2 и кестерит Cu2ZnSnS4. Выявлены и более сложные сульфидные соединения олова со свинцом, серебром, медью, имеющие в основном минералогическое значение. Тесная связь олова с медью обусловливает частое присутствие на оловорудных месторождениях халькопирита CuFeS2 с образованием парагенезиса касситерит — халькопирит.
Станнин
Основная статья: Станнин
Станнин (от лат. stannum — олово), оловянный колчедан, минерал из класса сульфидов с общей формулой вида Cu2FeSnS4. Она следует из формулы халькопирита путём замены одного атома Fe на Sn. Содержит 29,58 % Cu, 12,99 % Fe, 27,5 % Sn и 29,8 S, а также примеси Zn, Sb, Cd, Pb и Ag. Широко распространённый минерал в оловорудных месторождениях России. На ряде месторождений России (Приморье, Якутия) и Средней Азии (Таджикистан) он является существенным элементов сульфидных минералов и часто вместе с варламовитом составляет 10—40 % общего олова. Часто образует вкрапленность в сфалерите ZnS, халькопирите. Во многих случаях наблюдаются явления распада станнина с выделением касситерита.
Коллоидная форма
Коллоидные и олово-кремнистые соединения играют значительную роль в геохимии олова, хотя детально она не изучена. Значительное место в геологии элемента играют коломорфные соединения и продукты его кристаллических превращений в скрытокристаллические разности. Коломорфный касситерит рассматривается как форма выражения вязких гелеобразных растворов.
Независимые исследования выявили аномально высокую растворимость SnO2 в хлор-кремниевых растворах. Максимальная растворимость достигается при отношении SnO2SiO2 = 1,5.
Анализ свойств соединения Sn(OH)4 и близость их к соединению Si(OH)4 выявляет способность его к полимеризации с образованием в конечном счёте соединений H2SnkO2k+1, SnkO2k−1(OH)2. В обоих случаях возможно замещение группы (ОН) на анионы F и Cl.
Таким образом, полимеризация молекул Sn(OH)4 и соединение их с молекулами Si(OH)4 ведёт к образованию геля (коллоида) и появлению цепочек HmSn2nSinOp, причём m ≤ 8, или Hs[SiO2n(SnOm)d] (Некрасов И. Я. и др., 1973).
Имеющиеся данные говорят о том, что коллоидная форма является естественным промежуточным звеном при осаждении олова из гидротермальных растворов.
Формы нахождения олова в жидкой фазе
Наименее изученная часть геохимии олова, хотя в газово-жидких включениях установлены касситериты в виде минералов-узников (Кокорин А. М. и др., 1975). Работ по анализу конкретных оловосодержащих природных растворов нет. В основном вся информация основана на результатах экспериментальных исследований, которые говорят только о вероятных формах нахождения олова в растворах. Существенную роль в разработке методики этих исследований принадлежит академику В. Л. Барсукову.
Вся совокупность экспериментально установленных форм нахождения олова в растворах разбивается на группы:
- Ионные соединения. Эти соединения и их структура описываются с позиций классических валентных и стереохимических представлений. Выделяются подгруппы:
- Простые ионы Sn+2 и Sn+4 в основном обнаружены в магматических расплавах, а также в гидротермальных растворах, обладающих низкими значениями pH. Однако в существующих гидротермальных системах, отражаемых составом газово-жидких включений, такие условия не установлены.
- Галогениды — SnF2, SnF40, SnCl40. Считается, что роль хлора в переносе и отложении олова и сопутствующих металлов более значительна, чем роль фтора.
- Гидроксильные соединения. В щелочных условиях исходными являются соединения H2SnO2, H2SnO4, H2SnO3. Эти формы часто устанавливаются на основе известных минеральных форм. Часть этих форм имеет как искусственное (CaSnO3, Ca2SnO4), так и природное (FeSnO2, Fe2SnO4) происхождение. В кислых средах эти соединения ведут себя как слабые основания типа Sn(OH)2, Sn(OH)4. Считается, что одной из форм проявления подобных соединений является варламовит. Согласно экспериментальным данным Sn(OH)4 отлагается только при Т < 280 °C в слабокислых или нейтральных условиях при pH = 7—9. Соединения Sn(OH)4 и Sn(OH)3+ устойчивы при pH= 7—9, тогда как Sn(OH)2+2 и Sn(OH)+2 — при pH < 7. Довольно часто группы (ОН)−1 замещаются на F и Cl, создавая галогенозамещённые модификации гидросоединений олова. В общем виде эти формы представлены соединениями Sn(OH)4-kFk или Sn(OH)4−kFk-nCln. В целом соединение Sn(OH)3F устойчиво при Т = +25…+50 °C, а Sn(OH)2F2 — при Т = 200 °C.
- Сульфидные соединения. По экспериментальным данным в растворе присутствуют соединения SnS4−4 или SnS3−2 при pH > 9; SnS2O−2 (pH = 8—9) и Sn(SH)4 (pH = 6). Имеется упоминание о существовании соединения типа Na2SnS3, неустойчивого в кислой среде.
- Комплексные соединения олова изучены при растворении касситерита во фторированных средах. Эти соединения отличаются высокой растворимостью. Этими же свойствами обладают соединения, полученные в хлоридных растворах. В качестве основных форм комплексных соединений, известных из экспериментов, можно назвать Na2[Sn(OH)6], Na2[SnF6], Na2[Sn(OH)2F4] и пр. Эксперименты показали, что комплекс Sn(OH)4F2−2 будет преобладать при Т = 200 °C.
- Коллоидные и олово-кремнистые соединения. Об их существовании говорит присутствие на многих месторождениях коломорфных выделений касситерита.
Промышленные типы месторождений олова
Описанные выше геохимические особенности олова находят косвенное отражение в формационной классификации оловорудных месторождений, предложенной Е. А. Радкевич с последующими дополнениями.
- А. Формация оловоносных гранитов. Касситерит установлен в акцессорной части гранитов.
- Б. Формация редкометальных гранитов. Это граниты литионит-амазонит-альбитового типа (апограниты по А. А. Беусу). Касситерит в акцессорной части вместе колумбит-татнатлитом, микролитом и прочими.
- В. Формация оловоносных пегматитов. Оловянная минерализация характерна для Be-Li-, Be-Ta-, F-Li- типов.
- Г. Формация полевошпат-кварц-касситеритовая. Выделена Ив. Ф. Григорьевым. Это кварц-полевошпатовые жилы с касситеритом и другими минералами.
- Д. Формация кварц-касситеритовая. Распространена на северо-востоке России. Это жильные зоны, грейзены с кварцем, мусковитом, вольфрамитом, касситеритом и другим.
- Е. Формация касситерит-силикатно-сульфидная с турмалиновым и хлоритовым типами. Одна из основных продуктивных формаций Приморья России.
- Ж. Формация касситерит-сульфидная. Также основная оловопродуктивная формация. В ней выделяют основные типы:
- 1) штокверковое олово-вольфрамовое оруденение;
- 2) рудные тела квар-касситерит-арсенопиритового типа;
- 3) продуктивные кварцевые жилы сульфидно-касситерит-хлоритового типа.
- З. Формация оловянно-скарновая.
- И. Формация деревянистого олова (риолитовая формация).
- К. Формация основных и ультраосновных пород (по И. Я. Некрасову).
- Л. Формация щелочных пород Украины (по В. С. Металлиди, 1988).
Производство
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40—70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Применение
- Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. Для этих целей расходуется около 33 % всего добываемого олова. До 60 % производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb3Sn.
- Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («поталь»).
- Искусственные радиоактивные ядерные изомеры олова 117mSn и 119mSn — источники гамма-излучения, являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
- Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
- Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
- Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
- Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
- Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей ёмкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
- Исследуются изолированные двумерные слои олова (станен), созданные по аналогии с графеном.
Физиологическое действие
О роли олова в живых организмах практически ничего не известно. Ежедневное поступление олова с пищей составляет 0,2—3,5 мг, при регулярном потреблении консервированной пищи — до 38 мг. В теле человека содержится примерно (1—2)·10−4 % олова, наибольшая концентрация наблюдается в кишечнике.
Металлическое олово не токсично, что позволяет применять его в пищевой промышленности. Олово представляет опасность для человека в виде паров, различных аэрозольных частиц и пыли. При воздействии паров или пыли олова может развиться станноз — поражение лёгких. Станнан (оловянистый водород) — сильнейший яд. Также очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках — 100 мг/кг. Токсическая доза олова для человека — 2 г, интоксикация организма начинается при содержании в организме 250 мг/кг.
Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 °C, не выделяются в воздух в объёмах, превышающих предельно допустимую концентрацию (в частности, определенную по ГОСТ 12.1.005—76. Длительное (в течение 15—20 лет) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом.
Галерея изображений
-
Оловянный кубок из г. Гданьска (Польша)
-
Консервная банка с оловянным покрытием
-
Оловянный солдатик в форме после литья
-
Зональный кристалл касситерита в шлифе (поляризованный свет, ширина изображения — 3,3 мм)
-
Кристаллы касситерита (тёмные)
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Электрохимический ряд активности металлов |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
Общее описание
Люди начали добывать руду металла еще в IV веке до нашей эры. Древние греческие и римские предметы изготавливались из оловянистой бронзы, которая была в обиходе в те времена. Сплавы содержали также примесь свинца и меди, а чистый металл научились получать только в VII веке.
Редкий элемент занимает 46-е место по распространенности в коре земли. Он залегает в виде касситерита, в массе которого содержится до 78% олова. Реже встречается оловянный колчедан с примесью меди и железа. Олово относится к группе амфотерных веществ. Элемент способен к проявлению основных и кислотных характеристик.
Металл образует отдельные кварц-касситеритовые жилы благодаря тесной связи кислородных соединений олова с ангидритами гранита. Щелочные свойства проявляются в образовании различных соединений сульфидов, вплоть до возникновения интерметаллических слияний и самородного сплава олова в основных породах.
Белое и серое олово
Различают несколько аллотропных модификаций олова. В обычных условиях существует белое олово, которое является устойчивым при температуре свыше +13,3˚С. Это мягкий металл, образующий кристаллы с элементарными ячейками, где два одинаковых вектора и третий отличный от них располагаются строго перпендикулярно друг другу. Характерный хруст слышится при сгибании прутка. Звук возникает при трении кристаллов.
Охлаждение вещества ведет к образованию серого олова. При этом возникают кубические кристаллы, отличающиеся алмазной структурой. Ионизирующее излучение также способствует переходу из одной модификации в другую и кристаллизации по карбонатному типу.
Трансформация структуры ведет к следующим изменениям:
- удельный объем увеличивается;
- плотность олова уменьшается;
- металл становится порошкообразным.
Электрофизические свойства двух вариаций разнятся из-за отличия структурных решеток и валентности. Белое олово относится к группе металлов, а серое получает характеристики ковалентного кристалла алмазной структуры. Соприкосновение двух модификаций ведет к ускорению электронного фазового перехода, так как зарождаются новые формы кристаллов. Такое явление получило наименование оловянной чумы. Используется стабилизатор (например, висмут) для предотвращения этого процесса. Катализатор гексахлорстаннат аммония, наоборот, ускоряет переход.
Изотопы элемента
Олово в природе содержит 10 неизменных нуклидов с определенным суммарным числом нейтронов, протонов и электронов в молекуле. Атомный заряд также является постоянным и соответствует порядковому номеру элемента в таблице Менделеева в химии.
Массовые числа нуклидов с изменением содержания в массе:
- 112 — 0,96% в смеси.
- 114 — 0,66%.
- 115 — 0,35%.
- 116 — 14,3%.
- 117 — 7,61%.
- 118 — 24,03%.
- 119 — 8,58%.
- 120 — 32,85%.
- 122 — 4,72%.
- 124 — 5,94%.
Некоторые элементы могут подвергаться энергетическому двойному распаду, но такое явление до сегодняшнего дня не наблюдалось из-за величины теоретического времени распада, равного 1020 лет. У олова выделяется самое большее количество стабильных изотопов. Они заполняют протонную капсулу и увеличивают устойчивость ядра.
Олово относится к безопасным для человека веществам. В организм человека оно ежедневно попадает с пищей в минимальных пропорциях (0,25−3,4 мг). В теле содержится около (1−2).10-4% металла. Самая высокая концентрация выявляется в кишечнике. Регулярное вдыхание паров или воздушных частиц может нанести вред и привести к легочным заболеваниям. Людям, работающим с органическими сплавами олова, рекомендуется надевать защитные костюмы.
Причиной отравления может стать употребление старых консервов, в которых органические продукты реагируют с внутренним покрытием из олова, происходит окисление, при этом выделяется оловянистый водород. Роль вещества в организме человека практически не изучена. Металлическое олово считается нетоксичным для человека, поэтому применяется для покрытия жестяных тар для продуктов.
Физические характеристики
Плотность металла в твердой фракции при обычной температуре (+ 20−22˚С) составляет 7,3 г/см3, повышение показателей до температуры плавления олова (+231,8˚С) снижает плотность жидкого металла до 6,97 г/см3. Процесс кипения начинается в условиях температуры +2615˚С.
Другие факты:
- Показатель линейного расширения составляет 1,99.10-5 К-1 (при 0˚С), а при температуре +100˚С равняется 2,38.10-5 К-1.
- Удельная теплоемкость твердого вещества в обычном состоянии — 225 Дж/кг.К, а в жидком —в пределах 269 Дж/кг.К.
- Молярная теплоемкость белого олова — 27,1Дж/моль.К, серой модификации — 25,8 Дж/моль.К.
- Показатель плавления составляет 7,2 кДж/моль.
- Для испарения требуется 296 кДж/моль.
- Удельное сопротивление электричеству — 0,115−0,128 мкОм.м в условиях температуры +25˚С.
Упругость материала снижается при повышении температуры, при 0˚С модуль равен 55 Гпа, а при +100˚С — 48 Гпа. Временное сопротивление на разрыв равняется 20 Мпа, относительное удлинение при этом составляет 40%. Модуль сдвига находится в пределах 16,9−8,2 Гпа.
Химические показатели
Металл проявляет устойчивость к действию окружающего воздуха или влаги в условиях комнатной температуры. Инертность материала объясняется появлением оксидной пленки на поверхности. Олово начинает окисляться на воздухе при увеличении температуры свыше +150˚С. Металл обладает двумя окислительными степенями, +2 и +4. Первая имеет меньшую устойчивость.
Формулы характерных химических реакций:
- Холодная азотистая кислота реагирует с оловом, формула следующая: 4 Sn + 10 HNO 3 = NH 4 NO 3 + 4 Sn (NO 3) 2 + 3 H 2 O).
- В случае нагревания с концентрированной формой HN О 3 используется свойство окисления олова, при этом выделяется осадок с переменной гидратацией — 3 Sn + n H 2 O + 4 HNO 3 = 4 NO + 3 H 2 S n O 3 . n H 2 O.
- Нагревание олова в насыщенном щелочном растворе имеет обозначение по формуле 2 KOH + Sn + 4 H 2 O = 2 H 2 + K 2 (Sn (OH) 6).
Галогенные металлы дают сплавы с содержанием SnX 2 и SnX 4. Первые представляют собой солеобразные растворы с ионами, вторые подлежат водной гидролизации, но могут растворяться в органических жидкостях неполярного типа. При соединении с сухим хлором продуцируется тетрахлорид, который представляет собой жидкость без цвета, растворяющую йод, серу.
Этапы производства
При получении олова рудная порода касситерит дробится в мельницах до появления частиц размером около 1 см. Следующий этап — отделение вещества от пустой породы путем вибрации на гравитационных столах. Затем используется метод очистки и обогащения руды для повышения олова в составе до 45−72%.
Последующий обжиг удаляет мышьяк и серу, а полученный концентрат поступает на обжиг в печи. В жерле древесный уголь укладывается вперемежку с образцами руды и алюминием. Чистый металл полупроводниковой чистоты получают способом расплавления твердых веществ или методом очистки под действием электролиза.
Основные месторождения находятся на юго-востоке Азии и Китае, крупные добычи находятся в Австралии и Америке. Россия славится залежами олова в Хабаровском и Приморском крае, Чукотском АО, Якутии и других регионах.
Нахождение в природе
Чаще всего олово содержится в горных породах в виде рассеянных форм. Но в кислых образованиях руда встречается в виде минеральных вкраплений и залежей касситерита, который является интересным для производства в промышленных масштабах.
Формы содержания вещества в природе:
- минеральные вкрапления;
- окисные соединения;
- коллоидные формы;
- жидкие фазы.
Рассеянные залежи не отличаются конкретной формой содержания. Наблюдается изоморфно разбросанные сульфидные и кислородные сращения. На месторождениях первого вида олово представлено сфалеритами, халькопиритами, пиритами. В результате распада возникают элементы тилита и других минеральных веществ. В России изоморфные рассеивания обнаруживаются в Приморье, например, в Дубровском и Смирновском месторождении.
Минеральные формы
В группу входят самородки и сплавы интерметаллических образований. Концентрации в почве являются низкими, но такие залежи сконцентрированы на широких площадях. Вместе с оловом обнаруживается руда меди, алюминия, железа, не считая характерных самородков серебра, золота и платиноидов.
Эти же элементы участвуют в образовании сплавов олова:
- атакит;
- стистаит;
- звягинцевит;
- штурмылит.
Приведенные образования встречаются в интрузивных породах магния, например, пикритах и траппах в области Сибирской платформы. Габброиды и гипербазиты располагаются в грунтах Камчатки. Гидротермальные и метасоматические породы находятся в составе никелевых и медных руд в бассейнах Урала, Узбекистана, Кавказа. Пелагические осадочные соединения являются результатом Большого Толбачинского извержения.
Окисные соединения
Наиболее распространены в природе в форме касситеритов (Sn O 2), являющихся оксидами олова. Гамма-резонансное исследование показывает присутствие Sn+4. Соединения включают до 78% олова в форме сплошных вкраплений с отдельными зернами минерала величиной 3−5 мм.
Встречаются формы касситеритов:
- Гидроокисные сплавы представлены в природе осадками полиоловянной кислоты. К ним относят сукулаиты, варламовиты, гидромартиты, гидростаннаты.
- Силикаты находятся в форме малаяитов, стоказитов, пабститов. Первый вид минералов встречается в больших масштабах.
- Сульфидные образования металла представлены серой в сочетании с оловом и являются второй по значению группой для промышленных разработок. Более сложные соединения имеют в составе медь, свинец. В породах чаще других встречаются халькопириты.
- Станнины имеют второе название оловянного колчедана. Минералы широко добываются в Якутии и Приморье. Во многих случаях представляет основу для образования халькопирита.
Касситериты являются отличным материалом для получения чистого олова. В России добываются в Забайкалье, разрабатываются в районах Средней Азии. Мировые бассейны располагаются в Таиланде, Боливии, Малайзии, Китае, Индонезии, Нигерии.
Коллоидные формирования
Кремниево-коллоидные виды играют большую роль в геохимических процессах, хотя их детальное изучение не проводилось. Соединения относятся к вязкой форме выражения коломорфных касситеритов, которые подвергаются кристаллическим преобразованиям. Обнаружена сильная растворимость олова в кремниево-хлористых составах.
Анализ характеристик соединений и их похожесть на Si (OH) 4 показывает способность к получению высокомолекулярного материала (полимера) методом присоединения олигомеров и мономеров к активным молекулам. В результате возникает соединение с замещением анионами хлора и фтора группы ОН. Полимеризация вызывает образование дисперсного геля. Такая форма относится к промежуточным этапам при выделении осадка из гидротермальных веществ.
Жидкая фаза
В газовых и жидких образованиях горных пород выявляются касситериты в категории заключенных минералов. Природные растворы с включением олова почти не анализировались, информация получена после экспериментальных методов исследования.
Виды содержания олова в природных жидкостях делятся на категории:
- Ионные соединения. Их строение изучалось с точки зрения валентных сцеплений и стереохимических сочетаний. Выделяются подкатегории ионов, галогенидов, гидроксильных и сульфидных образований.
- Комплексные формирования. Получаются в результате травления касситеритов в среде с высокой концентрацией фтора или хлора.
Редко встречаются олово — кремниевые и дисперсные гелевые вкрапления в жидкой природной среде. Фундаментом этих форм являются минеральные материалы. Соединения проявляют свойства слабых оснований в кислых породах.
Химические элементы: названия, символы и произношение символов
В таблице содержатся русские и латинские названия химических элементов, символы химических элементов и произношение символов. Для правильного произношения названий и символов в русских названиях и произношениях проставлены ударения.
| Русское название элемента | Латинское название элемента | Символ элемента | Произношение символа |
|---|---|---|---|
| Азо́т | Nitrogenium | N | эн |
| Акти́ний | Actinium | Ac | акти́ний |
| Алюми́ний | Aluminium | Al | алюми́ний |
| Амери́ций | Americium | Am | амери́ций |
| Арго́н | Argon | Ar | арго́н |
| Аста́т | Astatum | At | аста́т |
| Ба́рий | Barium | Ba | ба́рий |
| Бери́ллий | Beryllium | Be | бери́ллий |
| Бе́рклий | Berkelium | Bk | бе́рклий |
| Бор | Borum | B | бор |
| Бо́рий | Bohrium | Bh | бо́рий |
| Бром | Bromium | Br | бром |
| Вана́дий | Vanadium | V | вана́дий |
| Ви́смут | Bismuthum | Bi | ви́смут |
| Водоро́д | Hydrogenium | H | аш |
| Вольфра́м | Wolframium | W | вольфра́м |
| Гадоли́ний | Gadolinium | Gd | гадоли́ний |
| Га́ллий | Gallium | Ga | га́ллий |
| Га́фний | Hafnium | Hf | га́фний |
| Ге́лий | Helium | He | ге́лий |
| Герма́ний | Germanium | Ge | герма́ний |
| Го́льмий | Holmium | Ho | го́льмий |
| Дармшта́дтий | Darmstadtium | Ds | дармшта́дтий |
| Диспро́зий | Dysprosium | Dy | диспро́зий |
| Ду́бний | Dubnium | Db | ду́бний |
| Евро́пий | Europium | Eu | евро́пий |
| Желе́зо | Ferrum | Fe | фе́ррум |
| Зо́лото | Aurum | Au | а́урум |
| И́ндий | Indium | In | и́ндий |
| Йод | Iodium | I | йод |
| Ири́дий | Iridium | Ir | ири́дий |
| Итте́рбий | Ytterbium | Yb | итте́рбий |
| И́ттрий | Yttrium | Y | и́ттрий |
| Ка́дмий | Cadmium | Cd | ка́дмий |
| Ка́лий | Kalium | K | ка́лий |
| Калифо́рний | Californium | Cf | калифо́рний |
| Ка́льций | Calcium | Ca | ка́льций |
| Кислоро́д | Oxygenium | O | о |
| Ко́бальт | Cobaltum | Co | ко́бальт |
| Коперни́ций | Copernicium | Cn | коперни́ций |
| Кре́мний | Silicium | Si | сили́циум |
| Крипто́н | Krypton | Kr | крипто́н |
| Ксено́н | Xenon | Xe | ксено́н |
| Кю́рий | Curium | Cm | кю́рий |
| Ланта́н | Lanthanum | La | ланта́н |
| Ливермо́рий | Livermorium | Lv | ливермо́рий |
| Ли́тий | Lithium | Li | ли́тий |
| Лоуре́нсий | Lawrencium | Lr | лоуре́нсий |
| Люте́ций | Lutetium | Lu | люте́ций |
| Ма́гний | Magnesium | Mg | ма́гний |
| Ма́рганец | Manganum | Mn | ма́рганец |
| Медь | Cuprum | Cu | ку́прум |
| Мейтне́рий | Meitnerium | Mt | мейтне́рий |
| Менделе́вий | Mendelevium | Md | менделе́вий |
| Молибде́н | Molybdaenum | Mo | молибде́н |
| Моско́вий | Moscovium | Mc | моско́вий |
| Мышья́к | Arsenicum | As | арсе́никум |
| На́трий | Natrium | Na | на́трий |
| Неоди́м | Neodymium | Nd | неоди́м |
| Нео́н | Neon | Ne | нео́н |
| Непту́ний | Neptunium | Np | непту́ний |
| Ни́кель | Niccolum | Ni | ни́кель |
| Нио́бий | Niobium | Nb | нио́бий |
| Нихо́ний | Nihonium | Nh | нихо́ний |
| Нобе́лий | Nobelium | No | нобе́лий |
| Оганесо́н | Oganesson | Og | оганесо́н |
| О́лово | Stannum | Sn | ста́ннум |
| О́смий | Osmium | Os | о́смий |
| Палла́дий | Palladium | Pd | палла́дий |
| Пла́тина | Platinum | Pt | пла́тина |
| Плуто́ний | Plutonium | Pu | плуто́ний |
| Поло́ний | Polonium | Po | поло́ний |
| Празеоди́м | Praseodymium | Pr | празеоди́м |
| Проме́тий | Promethium | Pm | проме́тий |
| Протакти́ний | Protactinium | Pa | протакти́ний |
| Ра́дий | Radium | Ra | ра́дий |
| Радо́н | Radon | Rn | радо́н |
| Резерфо́рдий | Rutherfordium | Rf | резерфо́рдий |
| Ре́ний | Rhenium | Re | ре́ний |
| Рентге́ний | Roentgenium | Rg | рентге́ний |
| Ро́дий | Rhodium | Rh | ро́дий |
| Ртуть | Hydrargyrum | Hg | гидра́ргирум |
| Руби́дий | Rubidium | Rb | руби́дий |
| Руте́ний | Ruthenium | Ru | руте́ний |
| Сама́рий | Samarium | Sm | сама́рий |
| Свине́ц | Plumbum | Pb | плю́мбум |
| Селе́н | Selenium | Se | селе́н |
| Се́ра | Sulfur | S | эс |
| Серебро́ | Argentum | Ag | арге́нтум |
| Сибо́ргий | Seaborgium | Sg | сибо́ргий |
| Ска́ндий | Scandium | Sc | ска́ндий |
| Стро́нций | Strontium | Sr | стро́нций |
| Сурьма́ | Stibium | Sb | сти́биум |
| Та́ллий | Thallium | Tl | та́ллий |
| Танта́л | Tantalum | Ta | танта́л |
| Теллу́р | Tellurium | Te | теллу́р |
| Теннесси́н | Tennessium | Ts | теннесси́н |
| Те́рбий | Terbium | Tb | те́рбий |
| Техне́ций | Technetium | Tc | техне́ций |
| Тита́н | Titanium | Ti | тита́н |
| То́рий | Thorium | Th | то́рий |
| Ту́лий | Thulium | Tm | ту́лий |
| Углеро́д | Carboneum | C | цэ |
| Ура́н | Uranium | U | ура́н |
| Фе́рмий | Fermium | Fm | фе́рмий |
| Флеро́вий | Flerovium | Fl | флеро́вий |
| Фо́сфор | Phosphorus | P | пэ |
| Фра́нций | Francium | Fr | фра́нций |
| Фтор | Fluorum | F | фтор |
| Ха́ссий | Hassium | Hs | га́ссий |
| Хлор | Chlorum | Cl | хлор |
| Хром | Chromium | Cr | хром |
| Це́зий | Caesium | Cs | це́зий |
| Це́рий | Cerium | Ce | це́рий |
| Цинк | Zincum | Zn | цинк |
| Цирко́ний | Zirconium | Zr | цирко́ний |
| Эйнште́йний | Einsteinium | Es | эйнште́йний |
| Э́рбий | Erbium | Er | э́рбий |
У этого термина существуют и другие значения, см. Олово (значения).
| Олово | |||
|---|---|---|---|
| ← Индий | Сурьма → | |||
|
|||
| Внешний вид простого вещества | |||

Образцы β-олова |
|||
| Свойства атома | |||
| Название, символ, номер | О́лово / Stannum (Sn), 50 | ||
| Группа, период, блок |
14 (устар. 4), 5, p-элемент |
||
| Атомная масса (молярная масса) |
118,710(7)[1] а. е. м. (г/моль) | ||
| Электронная конфигурация | [Kr] 4d105s25p2 | ||
| Радиус атома | 162 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 141 пм | ||
| Радиус иона | (+4e) 71 (+2) 93 пм | ||
| Электроотрицательность | 1,96 (шкала Полинга) | ||
| Электродный потенциал | −0,136 | ||
| Степени окисления | +2, +4 | ||
| Энергия ионизации (первый электрон) |
708,2 (7,34) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 7,31 г/см³ | ||
| Температура плавления | 230,90 °C[2] | ||
| Температура кипения | 2893 K, 2620 °C[3] | ||
| Уд. теплота плавления | 7,19[2]; кДж/моль | ||
| Уд. теплота испарения | 296[4] кДж/моль | ||
| Молярная теплоёмкость | 27,11[4] Дж/(K·моль) | ||
| Молярный объём | 16,3 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | Тетрагональная | ||
| Параметры решётки | a=5,831; c=3,181 Å | ||
| Отношение c/a | 0,546 | ||
| Температура Дебая | 170,00 K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 66,8 Вт/(м·К) | ||
| Номер CAS | 7440-31-5 |
О́лово (химический символ — Sn, от лат. Stannum) — химический элемент 14-й группы (по устаревшей классификации — главной подгруппы четвёртой группы, IVA), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 50[5].
Относится к группе лёгких металлов.
Простое вещество олово (при нормальных условиях) — это пластичный, ковкий и легкоплавкий блестящий постпереходный металл серебристо-белого цвета. Известны четыре аллотропические модификации олова: ниже +13,2 °C устойчиво α-олово (серое олово) с кубической решёткой алмазного типа, выше +13,2 °C устойчиво β-олово (белое олово) с тетрагональной кристаллической решёткой[4]. При высоких давлениях обнаружены также γ-олово и σ-олово.
История
Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был малодоступен и дорог, поэтому изделия из него редко встречаются среди римских и греческих древностей. Об олове есть упоминания в Библии, Четвёртой Книге Моисея. Олово является (наряду с медью) одним из компонентов оловянистой бронзы, изобретённой в конце или середине III тысячелетия до н. э. Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было «стратегическим металлом» в течение всего «бронзового века», более 2000 лет (очень приблизительно: XXXV—XI века до н. э.).
Чистое олово получено не ранее XII века, о нем упоминает в своих трудах Р. Бэкон. До этого олово всегда содержало переменное количество свинца. Хлорид SnCl4 впервые получил А. Либавий в 1597 г. Аллотропию олова и явление «оловянной чумы» объяснил Э. Коген в 1911 г.

Расплавленное олово
Происхождение названия
Латинское название stannum, связанное с санскритским словом, означающим «стойкий, прочный», первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67 % олова; к IV веку н. э. этим словом стали называть собственно олово[6].
Слово олово — общеславянское, однако в некоторых славянских языках такое же или однокоренное слово (польск. ołów, чеш. olovo, серб. олово, белор. волава и др.) используется для обозначения другого, внешне похожего металла — свинца. Слово олово имеет соответствия в балтийских языках (ср. лит. alavas, alvas, латыш. alva — «олово», прусск. alwis — «свинец»). Оно является суффиксальным образованием от корня ol- (ср. древневерхненемецкое elo — «жёлтый», лат. albus — «белый» и пр.), так что металл назван по цвету[7].
Физические свойства
Полная электронная конфигурация атома олова: 1s22s22p63s23p63d104s24p64d105s25p2
- Плотность: в твёрдом состоянии при +20 °С — 7,3 г/см³; в жидком состоянии при температуре плавления — 6,98 г/см³.
- Температура: плавления — 231,91 °С[2]; кипения — 2620 °С.
- Коэффициент линейного расширения:
- при температуре 0 °С равен 1,99·10−5 К−1;
- при +100 °С равен 2,38·10−5 К−1[4];
- средний в диапазоне 0—100 °C равен 2,62·10−5 К−1[2].
- Удельная теплоёмкость: в твёрдом состоянии при +20 °С — 226 Дж/(кг·К); в жидком состоянии при температуре плавления — 268 Дж/(кг·К).
- Молярная теплоёмкость при постоянном давлении: при 0 °C равна 27,11 Дж/(моль·К) (белое олово), 25,79 Дж/(моль·К) (серое олово).[4]
- Теплота плавления равна 7,19 кДж/моль.[2]
- Теплота испарения равна 296 кДж/моль.[4]
- Теплопроводность при +20 °С — 65,26 Вт/(м·К)[4].
- Удельное электрическое сопротивление при +20 °С — 0,115 мкОм·м[4] (по другим данным 0,128 мкОм·м при +25 °С[2]).
- Термический коэффициент сопротивления равен 4,5·10−3 К−1[2].
- Удельная электропроводность при +20 °С — 8,69 МСм/м.
- Температура Дебая равна 200 К (белое олово), 212 К (серое олово)[2].
Механические и технологические свойства:
- модуль упругости 55 ГПа при 0 °С[4][2] и 48 ГПа при 100 °С;
- модуль сдвига 16,8—8,1 ГПа[2];
- временное сопротивление разрыву — 20 МПа;
- относительное удлинение — 40 %[4];
- твёрдость по Бринеллю — 152 МПа (белое олово), 62 МПа (серое олово)[4];
- температура литья — 260—300 °С.
При температуре немного выше 170 °С олово становится хрупким[2].
Стандартный электродный потенциал E °Sn2+/Sn равен −0,136 В, а E пары °Sn4+/Sn2+ около 0,151 В.
Серое и белое олово

Серое и белое олово
Простое вещество олово полиморфно. В обычных условиях оно существует в виде β-модификации (белое олово), устойчивой выше +13,2 °C. Белое олово — серебристо-белый, мягкий, пластичный металл, образующий кристаллы тетрагональной сингонии, пространственная группа I4/amd, параметры ячейки a = 0,58197 нм, c = 0,3175 нм, Z = 4. Координационное окружение каждого атома олова в нём — октаэдр. Плотность β-Sn равна 7,228 г/см3. При сгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов[8].
При охлаждении белое олово переходит в α-модификацию (серое олово). Серое олово образует кристаллы кубической сингонии, пространственная группа Fd3m, параметры ячейки a = 0,646 нм, Z = 8 со структурой типа алмаза. В сером олове координационный полиэдр каждого атома — тетраэдр, координационное число 4. Фазовый переход β-Sn в α-Sn сопровождается увеличением удельного объёма на 25,6 % (плотность α-Sn составляет 5,75 г/см3), что приводит к рассыпанию олова в порошок. Энтальпия перехода α → β ΔH = 2,08 кДж/моль. Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Тем не менее белое олово можно переохладить до гелиевых температур. Белое олово превращается в серое также под действием ионизирующего излучения[9].
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, β-Sn — металл, а α-Sn относится к числу полупроводников. Ниже 3,72 К α-Sn переходит в сверхпроводящее состояние. Атомы в кристаллической решётке белого олова находятся в электронном s2p2-состоянии. Серое олово — ковалентный кристалл со структурой алмаза и электронным sp3-состоянием. Белое олово слабо парамагнитно, атомная магнитная восприимчивость χ = +4,5·10−6 (при 303 К), при температуре плавления становится диамагнитным, χ = −5,1·10−6. Серое олово диамагнитно, χ = −3,7·10−5 (при 293 К).
Соприкосновение серого олова и белого приводит к «заражению» последнего, то есть к ускорению фазового перехода по сравнению со спонтанным процессом из-за появления зародышей новой кристаллической фазы. Совокупность этих явлений называется «оловянной чумой».[10] Нынешнее название этому процессу в 1911 году дал Э. Коген (он называл его также «музейной болезнью»[11]), однако это явление было известно ещё в античности, оно упоминается Аристотелем и Плутархом[11]. Начало научного изучения этого фазового перехода было положено в 1870 году работами петербургского учёного, академика Ю. Фрицше. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии».
Одним из средств предотвращения «оловянной чумы» является добавление в олово стабилизатора, например висмута. С другой стороны, ускоряет процесс перехода белого олова в серое при не очень низких температурах катализатор хлорстаннат аммония (NH4)2SnCl6[12].
«Оловянная чума» — одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 году. Она осталась без горючего из-за того, что топливо просочилось из запаянных оловом баков, поражённых «оловянной чумой»[13].
Некоторые историки указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 году — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок[14].
Оловянная чума погубила многие музейные экспонаты. В музейных собраниях России оловянные предметы большой древности отсутствуют, имеются лишь единичные предметы начиная с XIV века, существующие экспонаты относятся в основном к XVIII и последующим векам. Так, разрушился целый ряд блюд и мисок XVII века из казны царевны Татьяны Михайловны, сестры царя Алексея Михайловича, и из казны его дочерей Феодосии Алексеевны и Софья Алексеевны в ризнице Троицкого собора Успенского девичьего монастыря в Александрове, где во время послереволюционной разрухи после 1917 года надолго прекращалось отопление[11].
Олово, поражённое «чумой», после переплавки снова становится белым. Однако для превращения серого олова в белое достаточно выдержать его при повышенной температуре, по одним источникам, выше +40 °C, по другим — выше +59 °C[11]. Реставраторы для остановки разрушения предметов, поражённых «оловянной чумой», выдерживают их в кипящей воде в течение часа и более[11].
При высоких давлениях обнаружены ещё две модификации олова: γ-олово (переход при температуре 161 °C и давлении около 4 ГПа, при комнатной температуре и давлении 10 ГПа) и σ-олово (переход при температуре около 1000 °C и давлении выше 21 ГПа)[15].
Изотопы
Природное олово состоит из десяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) и 124 (5,94 %). Для некоторых из них энергетически возможен двойной бета-распад, однако экспериментально он пока (2018 г.) не наблюдался, поскольку предсказываемый период полураспада очень велик (более 1020 лет)[16].
Олово обладает наибольшим среди всех элементов числом стабильных изотопов, что связано с тем, что 50 (число протонов в ядрах олова) является магическим числом — оно составляет заполненную протонную оболочку в ядре и повышает тем самым энергию связи и стабильность ядра. Известны два дважды магических изотопа олова, оба они радиоактивны, так как удалены от полосы бета-стабильности: нейтронодефицитное 100Sn (Z = N = 50) и нейтроноизбыточное 132Sn (Z = 50, N = 82).
Изотопы олова 117Sn и 119Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Химические свойства
Металлическое олово
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной плёнки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150 °C:
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
Растворяется в разбавленных кислотах (HCl, H2SO4)[17]:
Олово реагирует c концентрированной соляной кислотой. При этом серое олово (α-Sn) образует раствор хлорида олова(II), а белое (β-Sn) — хлорида олова(IV)[18]:
Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте (60 %) образуется оловянная кислота β-SnO2·nH2O[17] (иногда её формулу записывают как H2SnO3). При этом олово ведёт себя как неметалл:
При взаимодействии с разбавленной азотной кислотой (3—5 %) образуется нитрат олова(II)[17]:
Окисляется растворами щелочей до гидроксостанната(II), который в горячих растворах склонен к диспропорционированию[17]:
Олово(II)
Менее устойчивая степень окисления, чем (IV). Соединения олова(II) имеют высокую восстановительную активность и легко диспропорционируют[17]:
На воздухе соединения быстро окисляются кислородом, как в твёрдом виде[17], так и в растворах[18]:
Сильным восстановителем является «оловянная соль» SnCl2·2H2O[17].
Оксид можно получить действием аммиака на горячий раствор хлорида олова(II) в атмосфере СO2[17]:
Также оксид получается при слабом нагревании гидроксида олова(II) Sn(OH)2 в вакууме или осторожном нагревании некоторых солей:
-
[17]
В растворах солей олова(II) идёт сильный гидролиз[17]:
При действии на раствор соли Sn(II) растворами сульфидов выпадает осадок сульфида олова(II):
Этот сульфид может быть легко окислен до сульфидного комплекса раствором полисульфида натрия, при подкислении превращающегося в осадок cульфида олова(IV)[17]:
Олово(IV)
Оксид олова(IV) (SnO2) образуется прямым окислением кислородом.
При сплавлении с щелочами образует станнаты, при обработке водой образующие гидроксостаннаты[17]:
При гидролизе растворов солей олова(IV) образуется белый осадок — так называемая α-оловянная кислота[17]:
Свежеполученная α-оловянная кислота растворяется в кислотах и щелочах[17]:
При хранении α-оловянная кислота стареет, теряет воду и переходит в β-оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HO-Sn группировок при стоянии и замене их на более инертные мостиковые -Sn-O-Sn- связи[17].
Гидрид олова — станнан SnH4 — можно получить по реакции:
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0 °C.
Четырёхвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и др.
Нахождение в природе
Олово — редкий рассеянный элемент, по распространённости в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2⋅10−4 до 8⋅10−3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Месторождения
Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Хабаровском крае (Солнечный район — месторождения Фестивальное, Солнечное, Лунное, Придорожное, Перевальное и Соболиное[19]; Верхнебуреинский район — Правоурмийское месторождение), в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин — разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Якутии (месторождение Депутатское) и других районах.
Распространённость в природе
Распространённость в природе отражена в следующей таблице[20]:
| Геол. объект | Камен. метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Гранитоиды | Глины и др. | Вода океанов | Живое вещество(% на живой вес) | Почва | Зола растений |
|---|---|---|---|---|---|---|---|---|---|---|
| Содержание, вес. % | 001⋅10−4 | 05⋅10−5 | 01,5⋅10−4 | 0000− | 0003⋅10−4 | 1⋅10−3 | 07⋅10−7 | 00005⋅10−5 | 1⋅10−3 | 005⋅10−4 |
В незагрязнённых поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограмм на литр, увеличиваясь в районе оловорудных месторождений, оно попадает в воды за счёт разрушения в первую очередь сульфидных минералов, неустойчивых в зоне окисления. ПДКSn = 2 мг/дм³.

Олово является амфотерным элементом, то есть элементом, способным проявлять кислотные и основные свойства. Это свойство олова определяет и особенности его распространения в природе. Благодаря этой двойственности олово проявляет литофильные, халькофильные и сидерофильные свойства. Олово по своим свойствам проявляет близость к кварцу, вследствие чего известна тесная связь олова в виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащёнными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Щелочной характер поведения олова определяется в образовании довольно разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Формы нахождения
Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах[21].
Твёрдая фаза. Минералы

Кристаллы касситерита
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма: конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe+2: биотиты, гранаты, пироксены, магнетиты, турмалины и так далее. Эта связь обусловлена изоморфизмом, например, по схеме Sn+4 + Fe+2 → 2Fe+3. В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес. %) (особенно в андрадитах), эпидотах (до 2,84 вес. %) и так далее.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2+1Fe+2SnS4 или тиллита PbSnS2 и других минералов.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Хотя концентрации этих минералов в породах очень низки, однако распространены они в широком круге генетических образований. Среди самородных форм вместе с Sn выявлены Fe, Al, Cu, Ti, Cd и так далее, не считая уже известные самородные платиноиды, золото и серебро. Эти же элементы образуют между собой и различные сплавы: (Cu + Sn + Sb), (Pb + Sn + Sb) и другие, а также твёрдые растворы. Среди интерметаллических соединений установлены стистаит SnSb, атакит (Pd,Pt)3Sn, штумырлит Pt(Sn,Bi), звягинцевит (Pd,Pt)3(Pb,Sn), таймырит (Pd,Cu,Pt)3Sn и другие[22][23].
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях[23]:
- Группа интрузивных и эффузивных магматических пород: траппы, пикриты Сибирской платформы, гипербазиты и габброиды Камчатки, кимберлиты Якутии, лампроиты Алдана и так далее; гранитоиды Приморья, Дальнего Востока, Тянь-Шаня.
- Группа метасоматически и гидротермально изменённых пород: медно-никелевые руды Сибирской платформы, золоторудные объекты Урала, Кавказа, Узбекистана и так далее.[24]
- Группа современного рудообразования: пелагические осадки Тихого океана, продукты Большого Трещинного Толбачинского извержения, гидротермальная система Узон на Камчатке и прочие.
- Группа осадочных пород различного происхождения.
Окисные соединения олова
Наиболее известной формой является главный минерал олова — касситерит SnO2, представляющий собой соединение олова с кислородом. В минерале по данным ядерной гамма-резонансной спектроскопии присутствует Sn+4.
Касситерит
Касситерит (от греч. kassiteros — олово) — главный рудный минерал для получения олова, химическая формула SnO2. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зёрна минерала достигают в размере 3—4 мм и даже больше. В чистом виде бесцветные кристаллы, примеси придают минералу самые различные цвета.
- Плотность 6040—7120 кг/м³ (наиболее низкая у светлоокрашенных касситеритов).
- Твёрдость по Моосу 6,5.
- Блеск — матовый, на гранях — алмазный.
- Спайность несовершенная.
- Излом раковистый.
Основные формы выделения касситерита:
- микровключения в других минералах;
- акцессорные выделения минерала в породах и рудах;
- сплошные или вкрапленные руды: игольчатые радиально-лучистые агрегаты (месторождения Приморья), коломорфные и криптокристаллические выделения и скопления (месторождения Приморья); кристаллическая форма — главная форма выделения касситерита.
В России месторождения касситерита имеются на Северо-Востоке, в Приморье, Якутии, Забайкалье; за рубежом — в Малайзии, Таиланде, Индонезии, КНР, Боливии, Нигерии и других странах.
Гидроокисные соединения
Второстепенное место занимают гидроокисные соединения олова, которые можно рассматривать как соли полиоловянных кислот. К ним можно отнести минерал сукулаит Ta2Sn2+2O[25]; твёрдый раствор олова в магнетите вида Fe2SnO4 или Fe3SnO3 (Бретштейн Ю. С., 1974; Воронина Л. Б., 1979); «варламовит» — продукт окисления станнина; считается, что он представляет собой смесь аморфных и полуаморфных соединений Sn, метаоловянной кислоты, поликонденсированной фазы и гидрокасситеритовой фазы. Известны также гидратированные продукты окисления — гидромартит 3SnO·H2O; мушистонит (Cu,Zn,Fe)Sn(OH)6; гидростаннат меди CuSn(OH)6 и другие.
Силикаты
Известна многочисленная группа силикатов олова, представленная малаяитом CaSn[SiO5][26]; пабститом Ba(Sn, Ti)Si3O9[25], стоказитом Ca2Sn2Si6O18·4H2O и др. Малаяит образует даже промышленные скопления.
Шпинелиды
Из других окисных соединений известны также шпинелиды, например, минерал нигерит Sn2Fe4Al16О32 (Peterson E. U., 1986).
Сульфидные соединения олова
Включает различные соединения олова с серой. Это вторая по промышленному значению группа минеральных форм нахождения олова. Наиболее важным из них является станнин, второй по значению минерал. Кроме этого, отмечаются франкеит Pb5Sn3Sb2S14, герценбергит SnS, берндтит SnS2, тиллит PbSnS2 и кестерит Cu2ZnSnS4. Выявлены и более сложные сульфидные соединения олова со свинцом, серебром, медью, имеющие в основном минералогическое значение. Тесная связь олова с медью обусловливает частое присутствие на оловорудных месторождениях халькопирита CuFeS2 с образованием парагенезиса касситерит — халькопирит.
Станнин
Станнин (от лат. stannum — олово), оловянный колчедан, минерал из класса сульфидов с общей формулой вида Cu2FeSnS4. Она следует из формулы халькопирита путём замены одного атома Fe на Sn. Содержит 29,58 % Cu, 12,99 % Fe, 27,5 % Sn и 29,8 S, а также примеси Zn, Sb, Cd, Pb и Ag. Широко распространённый минерал в оловорудных месторождениях России. На ряде месторождений России (Приморье, Якутия) и Средней Азии (Таджикистан) он является существенным элементов сульфидных минералов и часто вместе с варламовитом составляет 10—40 % общего олова. Часто образует вкрапленность в сфалерите ZnS, халькопирите. Во многих случаях наблюдаются явления распада станнина с выделением касситерита.
Коллоидная форма
Коллоидные и олово-кремнистые соединения играют значительную роль в геохимии олова, хотя детально она не изучена. Значительное место в геологии элемента играют коломорфные соединения и продукты его кристаллических превращений в скрытокристаллические разности. Коломорфный касситерит рассматривается как форма выражения вязких гелеобразных растворов.
Независимые исследования выявили аномально высокую растворимость SnO2 в хлор-кремниевых растворах. Максимальная растворимость достигается при отношении 
Анализ свойств соединения Sn(OH)4 и близость их к соединению Si(OH)4 выявляет способность его к полимеризации с образованием в конечном счёте соединений H2SnkO2k+1, SnkO2k−1(OH)2. В обоих случаях возможно замещение группы (ОН) на анионы F и Cl.
Таким образом, полимеризация молекул Sn(OH)4 и соединение их с молекулами Si(OH)4 ведёт к образованию геля (коллоида) и появлению цепочек HmSn2nSinOp, причём m ≤ 8[27], или Hs[SiO2n(SnOm)d] (Некрасов И. Я. и др., 1973).
Имеющиеся данные говорят о том, что коллоидная форма является естественным промежуточным звеном при осаждении олова из гидротермальных растворов.
Формы нахождения олова в жидкой фазе
Наименее изученная часть геохимии олова, хотя в газово-жидких включениях установлены касситериты в виде минералов-узников (Кокорин А. М. и др., 1975). Работ по анализу конкретных оловосодержащих природных растворов нет. В основном вся информация основана на результатах экспериментальных исследований, которые говорят только о вероятных формах нахождения олова в растворах. Существенную роль в разработке методики этих исследований принадлежит академику В. Л. Барсукову[21].
Вся совокупность экспериментально установленных форм нахождения олова в растворах разбивается на группы:
- Ионные соединения. Эти соединения и их структура описываются с позиций классических валентных и стереохимических представлений. Выделяются подгруппы:
- Простые ионы Sn+2 и Sn+4 в основном обнаружены в магматических расплавах, а также в гидротермальных растворах, обладающих низкими значениями рН. Однако в существующих гидротермальных системах, отражаемых составом газово-жидких включений, такие условия не установлены.
- Галогениды — SnF2, SnF40, SnCl40. Считается, что роль хлора в переносе и отложении олова и сопутствующих металлов более значительна, чем роль фтора.
- Гидроксильные соединения. В щелочных условиях исходными являются соединения H2SnO2, H2SnO4, H2SnO3. Эти формы часто устанавливаются на основе известных минеральных форм. Часть этих форм имеет как искусственное (CaSnO3, Ca2SnO4), так и природное (FeSnO2, Fe2SnO4) происхождение. В кислых средах эти соединения ведут себя как слабые основания типа Sn(OH)2, Sn(OH)4. Считается, что одной из форм проявления подобных соединений является варламовит. Согласно экспериментальным данным Sn(OH)4 отлагается только при Т < 280 °C в слабокислых или нейтральных условиях при рН = 7—9. Соединения Sn(OH)4 и Sn(OH)3+ устойчивы при рН= 7—9, тогда как Sn(OH)2+2 и Sn(OH)+2 — при рН < 7. Довольно часто группы (ОН)−1 замещаются на F и Cl, создавая галогенозамещённые модификации гидросоединений олова. В общем виде эти формы представлены соединениями Sn(OH)4-kFk или Sn(OH)4−kFk-nCln. В целом соединение Sn(OH)3F устойчиво при Т = +25…+50 °C, а Sn(OH)2F2 — при Т = 200 °C.
- Сульфидные соединения. По экспериментальным данным в растворе присутствуют соединения SnS4−4 или SnS3−2 при рН > 9; SnS2O−2 (pH = 8—9) и Sn(SH)4 (pH = 6). Имеется упоминание о существовании соединения типа Na2SnS3, неустойчивого в кислой среде.
- Комплексные соединения олова изучены при растворении касситерита во фторированных средах. Эти соединения отличаются высокой растворимостью. Этими же свойствами обладают соединения, полученные в хлоридных растворах. В качестве основных форм комплексных соединений, известных из экспериментов, можно назвать Na2[Sn(OH)6], Na2[SnF6], Na2[Sn(OH)2F4] и пр. Эксперименты показали, что комплекс Sn(OH)4F2−2 будет преобладать при Т = 200 °C.
- Коллоидные и олово-кремнистые соединения. Об их существовании говорит присутствие на многих месторождениях коломорфных выделений касситерита.
Промышленные типы месторождений олова
Описанные выше геохимические особенности олова находят косвенное отражение в формационной классификации оловорудных месторождений, предложенной Е. А. Радкевич с последующими дополнениями.
- А. Формация оловоносных гранитов. Касситерит установлен в акцессорной части гранитов.
- Б. Формация редкометальных гранитов. Это граниты литионит-амазонит-альбитового типа (апограниты по А. А. Беусу). Касситерит в акцессорной части вместе колумбит-татнатлитом, микролитом и прочими.
- В. Формация оловоносных пегматитов. Оловянная минерализация характерна для Be-Li-, Be-Ta-, F-Li- типов.
- Г. Формация полевошпат-кварц-касситеритовая. Выделена Ив. Ф. Григорьевым. Это кварц-полевошпатовые жилы с касситеритом и другими минералами.
- Д. Формация кварц-касситеритовая. Распространена на северо-востоке России. Это жильные зоны, грейзены с кварцем, мусковитом, вольфрамитом, касситеритом и другим.
- Е. Формация касситерит-силикатно-сульфидная с турмалиновым и хлоритовым типами. Одна из основных продуктивных формаций Приморья России.
- Ж. Формация касситерит-сульфидная. Также основная оловопродуктивная формация. В ней выделяют основные типы:
- 1) штокверковое олово-вольфрамовое оруденение;
- 2) рудные тела квар-касситерит-арсенопиритового типа;
- 3) продуктивные кварцевые жилы сульфидно-касситерит-хлоритового типа.
- З. Формация оловянно-скарновая.
- И. Формация деревянистого олова (риолитовая формация).
- К. Формация основных и ультраосновных пород (по И. Я. Некрасову)[27].
- Л. Формация щелочных пород Украины (по В. С. Металлиди, 1988).
Производство
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40—70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: 
В июле 2021 цена олова взлетела до почти 34000 доллтонну[29]
Применение
- Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. Для этих целей расходуется около 33 % всего добываемого олова. До 60 % производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb3Sn.
- Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («поталь»).
- Искусственные радиоактивные ядерные изомеры олова 117mSn и 119mSn — источники гамма-излучения, являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
- Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
- Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
- Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
- Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
- Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент.
- Исследуются изолированные двумерные слои олова (станен), созданные по аналогии с графеном[30][31].
Физиологическое действие
О роли олова в живых организмах практически ничего не известно. Ежедневное поступление олова с пищей составляет 0,2—3,5 мг, при регулярном потреблении консервированной пищи — до 38 мг. В теле человека содержится примерно (1—2)·10−4 % олова, наибольшая концентрация наблюдается в кишечнике.[32]
Металлическое олово не токсично, что позволяет применять его в пищевой промышленности. Олово представляет опасность для человека в виде паров, различных аэрозольных частиц и пыли. При воздействии паров или пыли олова может развиться станноз — поражение лёгких. Газообразное вещество станнан (оловянистый водород) — сильнейший яд, более того, он самовоспламеняется при контакте с воздухом. Также очень токсичны некоторые оловоорганические соединения, такие как тетраэтилолово. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках — 100 мг/кг. Токсическая доза олова для человека — 2 г, интоксикация организма начинается при содержании в организме 250 мг/кг.[32]
Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 °C, не выделяются в воздух в объёмах, превышающих предельно допустимую концентрацию (в частности, определенную по ГОСТ 12.1.005—76. Длительное (в течение 15—20 лет) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом[33].
Галерея изображений
-
Оловянный куб
-
Оловянная руда
-
Консервная банка с оловянным покрытием
-
Кристаллы касситерита (тёмные)
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Бердоносов С. С. Олово // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1992. — Т. 3: Магнитоплазменный — Пойнтинга теорема. — С. 404. — 672 с. — 48 000 экз. — ISBN 5-85270-019-3.
- ↑ Yiming Zhang, Julian R. G. Evans, Shoufeng Yang Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Дергачёва Н. П. Олово // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
- ↑ Таблица Менделеева Архивировано 17 мая 2008 года. (недоступная ссылка с 21-05-2013 [3517 дней] — история, копия) на сайте ИЮПАК.
- ↑ Encyclopædia Britannica, 11th Edition, 1911, s.v. ‘tin’, citing H. Kopp
- ↑ Введенская Л. А., Колесников Н. П. Этимология: Учебное пособие // СПб: Питер, 2004, стр. 122.
- ↑ Севрюков Н. Н. Олово // БСЭ (3-е изд.)
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ Спиваковский В. Б. Аналитическая химия олова / под ред. Виноградова А. П.. — М.: Наука, 1975. — С. 10—11. — 252 с. — 2400 экз.
- ↑ 1 2 3 4 5 Фармаковский М. В. Изделия из олова и оловянная чума // Очерки по методике технологического исследования реставрации и консервации древних металлических изделий. — М-Л.: ОГИЗ, 1935.
- ↑ Паравян Н. А. Оловянная чума // Химия и жизнь. — 1979. — № 7. — С. 69—70.
- ↑ Оловянная чума // БСЭ
- ↑ Оловянная чума погубила армию Наполеона (2 мая 2008). Дата обращения: 6 ноября 2014.
- ↑ Molodets A. M., Nabatov S. S. Thermodynamic potentials, diagram of state, and phase transitions of tin on shock compression (англ.) // High Temperature. — 2000. — September (vol. 38, no. 5). — P. 715—721. — doi:10.1007/BF02755923.
- ↑ Упоминавшееся в некоторых источниках (например, в «Химической энциклопедии») обнаружение бета-распада олова-124 впоследствии не подтвердилось.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Неорганическая химия. В 3-х томах / Под ред. Ю. Д. Третьякова. — М.: Издательский центр «Академия», 2004. — Т.2 : Химия непереходных элементов. — С. 105—153.
- ↑ 1 2 Шрайвер Д., Эткинс П. Неорганическая химия. В 2-х томах / Пер. с англ. М. Г. Розовой, С. Я. Истомина, М. Е. Тамм. — М.: Мир, 2004. — Т. 1. — С. 72, 495.
- ↑ Home. Tin Resources. Дата обращения: 11 декабря 2016.
- ↑ Войткевич Г. В., Мирошников А. Е., Поваренных А. С. Краткий справочник по геохимии. М.: Недра, 1970.
- ↑ 1 2 Барсуков В. Л. и др. Основные черты геохимии олова. М.: Наука, 1974.
- ↑ Еремеев Н. В. и др. Самородные элементы в лампроидах Центрального Алдана.//Доклады АН СССР, 1988, 303, 6, стр. 1464—1467
- ↑ 1 2 Самородное минералообразование в магматических процессах. Часть I и II. Якутск, 1981
- ↑ Крылова В. В. и др. Олово, свинец и интерметаллические соединения в рудах золото-серебряной формации./Труды ЦНИГРИ, 1979, Т. 142, стр. 22 — 28
- ↑ 1 2 Некрасов И. Я. Фазовые соотношения в олово-содержащих системах. М.: Наука, 1976.
- ↑ Говоров И. Н. Геохимия рудных районов Приморья. М.: Наука, 1977.
- ↑ 1 2 Некрасов И. Я. Олово в магматических и постмагматических процессах. М.: Наука, 1974.
- ↑ Большаков К. А., Федоров П. И. Химия и технология малых металлов. М., 1984.
- ↑ Олово подорожало до рекордного максимума
- ↑ Станен стал конкурентом графена, Lenta.ru (22 ноября 2013). Дата обращения: 24 ноября 2013.
- ↑ Will 2-D Tin be the Next Super Material? Theorists Predict New Single-Layer Material Could Go Beyond Graphene, Conducting Electricity with 100 Percent Efficiency at Room Temperature, SLAC (21 ноября 2013). Дата обращения: 24 ноября 2013., по материалам Yong Xu et al., Physical Review Letters, 27 Sept 2013 (doi:10.1103/PhysRevLett.111.136804)
- ↑ 1 2 Чертко, 2012, с. 21, 113-115.
- ↑ Требования безопасности// ГОСТ 860-75 ОЛОВО (ред. 2002)
Литература
- профессор М. П. Русаков. Олово // журнал «Наука и жизнь», № 1, 1940. стр.9-14
- Н. К. Чертко и др. Биологическая функция химических элементов. — Справочное пособие. — Минск, 2012. — 172 с. — ISBN 978-985-7026-39-5.
Ссылки
- Олово на Webelements
- Олово в Популярной библиотеке химических элементов
- Розен Б. Я. Соперник серебра. М., «Металлургия», 1984.
- Олово — иллюстрированная научно-популярная статья на periodictable.ru
- Демонстрационные ролики: «Оловянная чума» на PeriodicTable.ru
- Горение олова, видео
Эта страница в последний раз была отредактирована 6 января 2023 в 12:12.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Глоссарий. Химия
Олово
О́лово (лат. Stannum; обозначается символом Sn) — элемент главной подгруппы четвёртой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 50. Относится к группе лёгких металлов. При нормальных условиях простое вещество олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета. Олово образует две аллотропические модификации: ниже 13,2 °C устойчиво α-олово (серое олово) с кубической решёткой типа алмаза, выше 13,2 °C устойчиво β-олово (белое олово) с тетрагональной кристаллической решеткой.
История
Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был малодоступен и дорог, так как изделия из него редко встречаются среди римских и греческих древностей. Об олове есть упоминания в Библии, Четвёртой Книге Моисеевой. Олово является (наряду с медью) одним из компонентов бронзы (см. История меди и бронзы), изобретённой в конце или середине III тысячелетия до н. э.. Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было «стратегическим металлом» в течение всего «бронзового века», более 2000 лет (очень приблизительно: 35—11 века до н. э.).
Происхождение названия
Латинское название stannum, связанное с санскритским словом, означающим «стойкий, прочный», первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67 % олова; к IV веку этим словом стали называть собственно олово.
Слово олово — общеславянское, имеющее соответствия в балтийских языках (ср. лит. alavas, alvas — «олово», прусск. alwis — «свинец»). Оно является суффиксальным образованием от корня ol- (ср. древневерхненемецкое elo — «жёлтый», лат. albus — «белый» и пр.), так что металл назван по цвету.
Производство
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационном методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановления древесного угля, слои которого укладываются поочередно со слоями руды.
Применение
1. Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb3Sn.
2. Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
3. Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
4. Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
5. Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
6. Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
Источник: Википедия
Другие заметки по химии







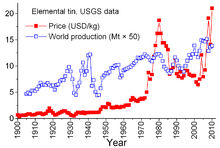

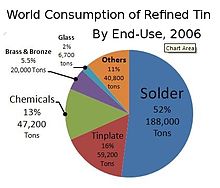












![mathsf{Sn + 4HCl rightarrow H_2[SnCl_4] + H_2}](https://dic.academic.ru/dic.nsf/ruwiki/690981770ce03a6c5621653c2e72f741.png)


![mathsf{Sn + 2KOH + 2H_2O rightarrow K_2[Sn(OH)_4] + H_2}](https://dic.academic.ru/dic.nsf/ruwiki/e524880cf7d90d49c3d2bc55b25ed9f8.png)
![mathsf{SnCl_4 + Li[AlH_4] rightarrow SnH_4 + LiCl + AlCl_3}](https://dic.academic.ru/dic.nsf/ruwiki/88076be0b68bff08c2a063c622862e2d.png)



![mathsf{SnCl_4 + 4NH_3 + 6H_2O rightarrow H_2[Sn(OH)_6] + 4NH_4Cl}](https://dic.academic.ru/dic.nsf/ruwiki/6f6ce9204b5fc5e912514beaf60ac53f.png)
![mathsf{H_2[Sn(OH)_6] rightarrow SnO_2cdot nH_2O + 3H_2O}](https://dic.academic.ru/dic.nsf/ruwiki/48ddafbb2033171364319a6a70c5f143.png)
![mathsf{SnO_2cdot nH_2O + 2KOH rightarrow K_2[Sn(OH)_6]}](https://dic.academic.ru/dic.nsf/ruwiki/b25834e3a2ddf9570edb403cc0d36a2a.png)



![mathsf{SnS_2 + 2(NH_4)_2S rightarrow (NH_4)_2[SnS_4]}](https://dic.academic.ru/dic.nsf/ruwiki/e3bd0bd1138fdd0e9ba1fb813332fe40.png)










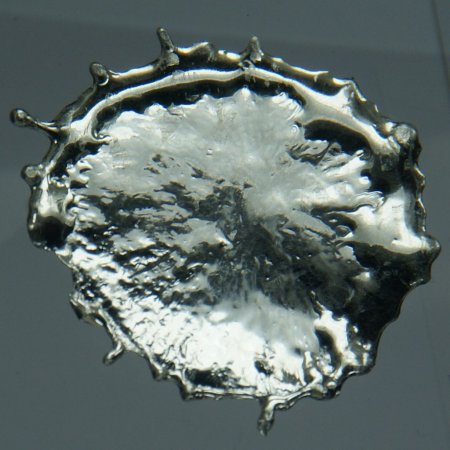










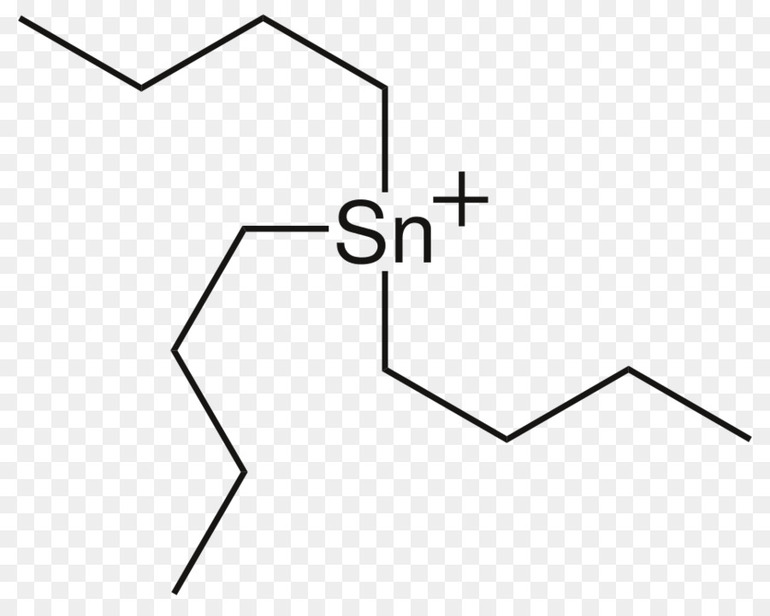



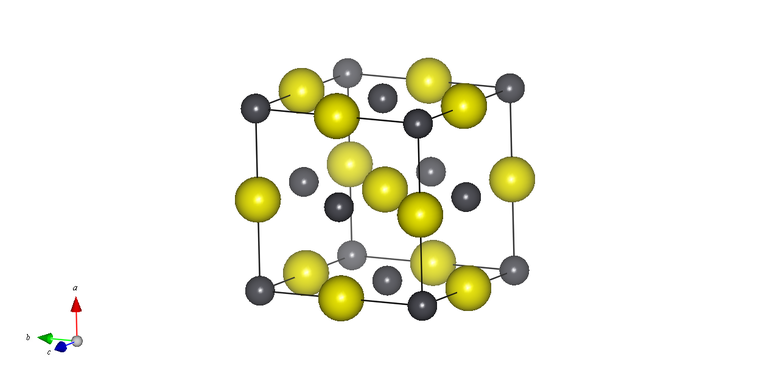




![{displaystyle {mathsf {Sn+3HClrightarrow H[SnCl_{3}]+H_{2}uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e918d553760e817e237f5b15d8240468327d0d51)
![{displaystyle {mathsf {Sn+6HClrightarrow H_{2}[SnCl_{6}]+2H_{2}uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4e6fcc4025b210b0224fd999eac15bf5da63be37)


![{displaystyle {mathsf {Sn+NaOH+2H_{2}Orightarrow Na[Sn(OH)_{3}]+H_{2}uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/efe387f42dbdee01b37b7ea17be4783abf221fe6)
![{displaystyle {mathsf {2Na[Sn(OH)_{3}]rightarrow Sn+Na_{2}[Sn(OH)_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d77d79789bf5537f0415f4df7ef22f3e37378ef7)
![{displaystyle {mathsf {Sn+2NaOH+4H_{2}Orightarrow Na_{2}[Sn(OH)_{6}]+2H_{2}uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0ccdb6420567d4a68f44f272b01fb3c9517c79c7)






![{displaystyle {mathsf {[Sn(H_{2}O)_{3}]^{2+}+H_{2}Orightarrow [Sn(H_{2}O)_{2}OH]^{+}+H_{3}O^{+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/290821ceeb118f74a61ccf4698bad56c7c9f7f59)




![{mathsf {SnCl_{4}+4NH_{3}+6H_{2}Orightarrow H_{2}[Sn(OH)_{6}]+4NH_{4}Cl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7df62a9dc3877365fd42d624cf48202589ebdbc8)
![{mathsf {H_{2}[Sn(OH)_{6}]rightarrow SnO_{2}cdot nH_{2}O+3H_{2}O}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/34c878ae687375e5cb9c529ad4970dda5730dcf1)
![{mathsf {SnO_{2}cdot nH_{2}O+2KOHrightarrow K_{2}[Sn(OH)_{6}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe15fb71c005d6cf9fabfb1aa6a042ff2ccfb713)

![{displaystyle {mathsf {SnCl_{4}+Li[AlH_{4}]rightarrow SnH_{4}uparrow +LiCl+AlCl_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/253d1dc9b52362529bd343d31a01e4e7ff1299c7)



