ball stick model of the hydrogen peroxide molecule |
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Hydrogen peroxide |
||
| Other names
Dioxidane |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.878 |
|
| EC Number |
|
|
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 2015 (>60% soln.) 2014 (20–60% soln.) 2984 (8–20% soln.) |
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
H2O2 | |
| Molar mass | 34.0147 g/mol | |
| Appearance | Very light blue liquid | |
| Odor | slightly sharp | |
| Density | 1.11 g/cm3 (20 °C, 30% (w/w) solution)[1] 1.450 g/cm3 (20 °C, pure) |
|
| Melting point | −0.43 °C (31.23 °F; 272.72 K) | |
| Boiling point | 150.2 °C (302.4 °F; 423.3 K) (decomposes) | |
|
Solubility in water |
Miscible | |
| Solubility | soluble in ether, alcohol insoluble in petroleum ether |
|
| log P | -0.43[2] | |
| Vapor pressure | 5 mmHg (30 °C)[3] | |
| Acidity (pKa) | 11.75 | |
|
Magnetic susceptibility (χ) |
−17.7·10−6 cm3/mol | |
|
Refractive index (nD) |
1.4061 | |
| Viscosity | 1.245 cP (20 °C) | |
|
Dipole moment |
2.26 D | |
| Thermochemistry | ||
|
Heat capacity (C) |
1.267 J/(g·K) (gas) 2.619 J/(g·K) (liquid) |
|
|
Std enthalpy of |
−187.80 kJ/mol | |
| Pharmacology | ||
|
ATC code |
A01AB02 (WHO) D08AX01 (WHO), D11AX25 (WHO), S02AA06 (WHO) | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
  
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H271, H302, H314, H332, H335, H412 | |
|
Precautionary statements |
P280, P305+P351+P338, P310 | |
| NFPA 704 (fire diamond) |
3 0 3 OX |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1518 mg/kg[citation needed] 2000 mg/kg (oral, mouse)[4] |
|
|
LC50 (median concentration) |
1418 ppm (rat, 4 hr)[4] | |
|
LCLo (lowest published) |
227 ppm (mouse)[4] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 ppm (1.4 mg/m3)[3] | |
|
REL (Recommended) |
TWA 1 ppm (1.4 mg/m3)[3] | |
|
IDLH (Immediate danger) |
75 ppm[3] | |
| Safety data sheet (SDS) | ICSC 0164 (>60% soln.) | |
| Related compounds | ||
|
Related compounds |
Water Ozone Hydrazine Hydrogen disulfide Dioxygen difluoride |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Hydrogen peroxide is a chemical compound with the formula H2O2. In its pure form, it is a very pale blue[5] liquid that is slightly more viscous than water. It is used as an oxidizer, bleaching agent, and antiseptic, usually as a dilute solution (3%–6% by weight) in water for consumer use, and in higher concentrations for industrial use. Concentrated hydrogen peroxide, or «high-test peroxide», decomposes explosively when heated and has been used as a propellant in rocketry.[6]
Hydrogen peroxide is a reactive oxygen species and the simplest peroxide, a compound having an oxygen–oxygen single bond. It decomposes slowly when exposed to light, and rapidly in the presence of organic or reactive compounds. It is typically stored with a stabilizer in a weakly acidic solution in a dark bottle to block light. Hydrogen peroxide is found in biological systems including the human body. Enzymes that use or decompose hydrogen peroxide are classified as peroxidases.
Properties[edit]
The boiling point of H2O2 has been extrapolated as being 150.2 °C (302.4 °F), approximately 50 °C (90 °F) higher than water. In practice, hydrogen peroxide will undergo potentially explosive thermal decomposition if heated to this temperature. It may be safely distilled at lower temperatures under reduced pressure.[7]
Structure[edit]
Structure and dimensions of
H2O2 in the gas phase
Structure and dimensions of
H2O2 in the solid (crystalline) phase
Hydrogen peroxide (H2O2) is a nonplanar molecule with (twisted) C2 symmetry; this was first shown by Paul-Antoine Giguère in 1950 using infrared spectroscopy.[8][9] Although the O−O bond is a single bond, the molecule has a relatively high rotational barrier of 386 cm−1 (4.62 kJ/mol) for rotation between enantiomers via the trans configuration, and 2460 cm−1 (29.4 kJ/mol) via the cis configuration.[10] These barriers are proposed to be due to repulsion between the lone pairs of the adjacent oxygen atoms and dipolar effects between the two O–H bonds. For comparison, the rotational barrier for ethane is 1040 cm−1 (12.4 kJ/mol).
The approximately 100° dihedral angle between the two O–H bonds makes the molecule chiral. It is the smallest and simplest molecule to exhibit enantiomerism. It has been proposed that the enantiospecific interactions of one rather than the other may have led to amplification of one enantiomeric form of ribonucleic acids and therefore an origin of homochirality in an RNA world.[11]
The molecular structures of gaseous and crystalline H2O2 are significantly different. This difference is attributed to the effects of hydrogen bonding, which is absent in the gaseous state.[12] Crystals of H2O2 are tetragonal with the space group D4
4 or P41212.[13]
Aqueous solutions[edit]
In aqueous solutions, hydrogen peroxide differs from the pure substance due to the effects of hydrogen bonding between water and hydrogen peroxide molecules. Hydrogen peroxide and water form a eutectic mixture, exhibiting freezing-point depression down as low as -56 °C; pure water has a freezing point of 0 °C and pure hydrogen peroxide of -0.43 °C. The boiling point of the same mixtures is also depressed in relation with the mean of both boiling points (125.1 °C). It occurs at 114 °C. This boiling point is 14 °C greater than that of pure water and 36.2 °C less than that of pure hydrogen peroxide.[14]
Phase diagram of
H2O2 and water: Area above blue line is liquid. Dotted lines separate solid–liquid phases from solid–solid phases.
| H2O2 (w/w) | Density (g/cm3) |
Temp. (°C) |
|---|---|---|
| 3% | 1.0095 | 15 |
| 27% | 1.10 | 20 |
| 35% | 1.13 | 20 |
| 50% | 1.20 | 20 |
| 70% | 1.29 | 20 |
| 75% | 1.33 | 20 |
| 96% | 1.42 | 20 |
| 98% | 1.43 | 20 |
| 100% | 1.45 | 20 |
Comparison with analogues[edit]
Hydrogen peroxide has several structural analogues with HmX−XHn bonding arrangements (water also shown for comparison). It has the highest (theoretical) boiling point of this series (X = O, S, N, P). Its melting point is also fairly high, being comparable to that of hydrazine and water, with only hydroxylamine crystallising significantly more readily, indicative of particularly strong hydrogen bonding. Diphosphane and hydrogen disulfide exhibit only weak hydrogen bonding and have little chemical similarity to hydrogen peroxide. Structurally, the analogues all adopt similar skewed structures, due to repulsion between adjacent lone pairs.
| Name | Formula | Molar mass (g/mol) |
Melting point (°C) |
Boiling point (°C) |
|---|---|---|---|---|
| Water | HOH | 18.02 | 0.00 | 99.98 |
| Hydrogen peroxide | HOOH | 34.01 | −0.43 | 150.2* |
| Hydrogen disulfide | HSSH | 66.15 | −89.6 | 70.7 |
| Hydrazine | H2NNH2 | 32.05 | 2 | 114 |
| Hydroxylamine | NH2OH | 33.03 | 33 | 58* |
| Diphosphane | H2PPH2 | 65.98 | −99 | 63.5* |
Discovery[edit]
Alexander von Humboldt is sometimes said to have been the first to report the first synthetic peroxide, barium peroxide, in 1799 as a by-product of his attempts to decompose air, although this is disputed due to von Humboldt’s ambiguous wording.[15] Nineteen years later Louis Jacques Thénard recognized that this compound could be used for the preparation of a previously unknown compound, which he described as eau oxygénée («oxygenated water») – subsequently known as hydrogen peroxide.[16][17][18] Today, the term «oxygenated water» may appear on retail packaging referring to mixtures containing either water and hydrogen peroxide or water and dissolved oxygen. This could cause personal injury if the difference is not properly understood by the user.[19]
An improved version of Thénard’s process used hydrochloric acid, followed by addition of sulfuric acid to precipitate the barium sulfate byproduct. This process was used from the end of the 19th century until the middle of the 20th century.[20]
The bleaching effect of peroxides and their salts on natural dyes had been known since Thénard’s experiments in the 1820s, but early attempts of industrial production of peroxides failed. The first plant producing hydrogen peroxide was built in 1873 in Berlin. The discovery of the synthesis of hydrogen peroxide by electrolysis with sulfuric acid introduced the more efficient electrochemical method. It was first commercialized in 1908 in Weißenstein, Carinthia, Austria. The anthraquinone process, which is still used, was developed during the 1930s by the German chemical manufacturer IG Farben in Ludwigshafen. The increased demand and improvements in the synthesis methods resulted in the rise of the annual production of hydrogen peroxide from 35,000 tonnes in 1950, to over 100,000 tonnes in 1960, to 300,000 tonnes by 1970; by 1998 it reached 2.7 million tonnes.[21]
Early attempts failed to produce neat hydrogen peroxide. Anhydrous hydrogen peroxide was first obtained by vacuum distillation.[22]
Determination of the molecular structure of hydrogen peroxide proved to be very difficult. In 1892, the Italian physical chemist Giacomo Carrara (1864–1925) determined its molecular mass by freezing-point depression, which confirmed that its molecular formula is H2O2.[23] At least half a dozen hypothetical molecular structures seemed to be consistent with the available evidence.[24] In 1934, the English mathematical physicist William Penney and the Scottish physicist Gordon Sutherland proposed a molecular structure for hydrogen peroxide that was very similar to the presently accepted one.[25][26]
Previously, hydrogen peroxide was prepared industrially by hydrolysis of ammonium persulfate:
which was itself obtained by the electrolysis of a solution of ammonium bisulfate ([NH4]HSO4) in sulfuric acid:[27]
Production[edit]
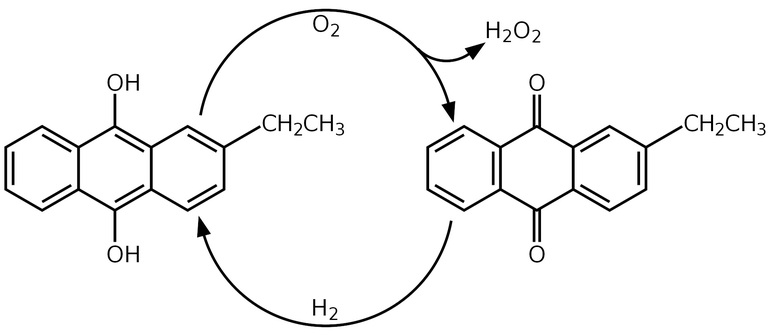
Catalytic cycle for the anthraquinone process to produce hydrogen peroxide: an anthraquinone (right) is reduced using hydrogen to produce the corresponding anthrahydroquinone (left). This is oxidized using oxygen to produce hydrogen peroxide and recover anthraquinone.
Today, hydrogen peroxide is manufactured almost exclusively by the anthraquinone process, which was originally developed by BASF in 1939. It begins with the reduction of an anthraquinone (such as 2-ethylanthraquinone or the 2-amyl derivative) to the corresponding anthrahydroquinone, typically by hydrogenation on a palladium catalyst. In the presence of oxygen, the anthrahydroquinone then undergoes autoxidation: the labile hydrogen atoms of the hydroxy groups transfer to the oxygen molecule, to give hydrogen peroxide and regenerating the anthraquinone. Most commercial processes achieve oxidation by bubbling compressed air through a solution of the anthrahydroquinone, with the hydrogen peroxide then extracted from the solution and the anthraquinone recycled back for successive cycles of hydrogenation and oxidation.[28][29]
The net reaction for the anthraquinone-catalyzed process is :[28]
- H2 + O2 → H2O2
The economics of the process depend heavily on effective recycling of the extraction solvents, the hydrogenation catalyst and the expensive quinone.
ISO tank container for hydrogen peroxide transportation
A tank car designed for transporting hydrogen peroxide by rail
Other sources[edit]
Small, but detectable, amounts of hydrogen peroxide can be formed by several methods. Small amounts are formed by electrolysis of dilute acid around the cathode where hydrogen evolves if oxygen is bubbled around it. It is also produced by exposing water to ultraviolet rays from a mercury lamp, or an electric arc while confining it in a UV transparent vessel (e.g. quartz). It is detectable in ice water after burning a hydrogen gas stream aimed towards it and is also detectable on floating ice. Rapidly cooling humid air blown through an approximately 2,000 °C spark gap results in detectable amounts.[30]
A commercially viable process to produce hydrogen peroxide directly from the environment has been of interest for many years. Efficient direct synthesis is difficult to achieve, as the reaction of hydrogen with oxygen thermodynamically favours production of water. Systems for direct synthesis have been developed, most of which employ finely dispersed metal catalysts similar to those used for hydrogenation of organic substrates.[31][32] One economic obstacle has been that direct processes give a dilute solution uneconomic for transportation. None of these has yet reached a point where it can be used for industrial-scale synthesis.
Availability[edit]
Hydrogen peroxide is most commonly available as a solution in water. For consumers, it is usually available from pharmacies at 3 and 6 wt% concentrations. The concentrations are sometimes described in terms of the volume of oxygen gas generated; one milliliter of a 20-volume solution generates twenty milliliters of oxygen gas when completely decomposed. For laboratory use, 30 wt% solutions are most common. Commercial grades from 70% to 98% are also available, but due to the potential of solutions of more than 68% hydrogen peroxide to be converted entirely to steam and oxygen (with the temperature of the steam increasing as the concentration increases above 68%) these grades are potentially far more hazardous and require special care in dedicated storage areas. Buyers must typically allow inspection by commercial manufacturers.
In 1994, world production of H2O2 was around 1.9 million tonnes and grew to 2.2 million in 2006,[33] most of which was at a concentration of 70% or less. In that year, bulk 30% H2O2 sold for around 0.54 USD/kg, equivalent to US$1.50/kg (US$0.68/lb) on a «100% basis»[clarification needed].[28]
Natural occurrence[edit]
Hydrogen peroxide occurs in surface water, in groundwater, and in the atmosphere. It forms upon illumination or natural catalytic action by substances contained in water. Sea water contains 0.5 to 14 μg/L of hydrogen peroxide, freshwater 1 to 30 μg/L, and air 0.1 to 1 parts per billion.[21]
Reactions[edit]
Decomposition[edit]
Hydrogen peroxide decomposes to form water and oxygen with a ΔHo of –2884.5 kJ/kg[34] and a ΔS of 70.5 J/(mol·K):
The rate of decomposition increases with rise in temperature, concentration, and pH (H2O2 being unstable under alkaline conditions), with cool, dilute, and acidic solutions showing the best stability. Decomposition is catalysed by various redox-active ions or compounds, including most transition metals and their compounds (e.g. manganese dioxide (MnO2), silver, and platinum).[35] Certain metal ions, such as Fe2+ or Ti3+, can cause the decomposition to take a different path, with free radicals such as the hydroxyl radical (HO•) and hydroperoxyl (HOO•) being formed. Non-metallic catalysts include potassium iodide (KI), which reacts particularly rapidly and forms the basis of the elephant toothpaste demonstration. Hydrogen peroxide can also be decomposed biologically by the enzyme catalase. The decomposition of hydrogen peroxide liberates oxygen and heat; this can be dangerous, as spilling high-concentration hydrogen peroxide on a flammable substance can cause an immediate fire.
Redox reactions[edit]
The redox properties of hydrogen peroxide depend on pH as acidic conditions exacerbate the power of oxidizing agents and basic conditions exacerbate the power of reducing agents. As hydrogen peroxide exhibits ambivalent redox properties, being simultaneously an oxidizer or a reductant, its redox behavior immediately depends on pH.
In acidic solutions, H2O2 is a powerful oxidizer, stronger than chlorine, chlorine dioxide, and potassium permanganate. When used for cleaning laboratory glassware, a solution of hydrogen peroxide and sulfuric acid is referred to as Piranha solution.
H2O2 is a source of hydroxyl radicals (•OH), which are highly reactive.
| Oxidizing reagent |
Reduced product |
Oxidation potential (V) |
|---|---|---|
| F2 | HF | 3.0 |
| O3 | O2 | 2.1 |
| H2O2 | H2O | 1.8 |
| KMnO4 | MnO2 | 1.7 |
| ClO2 | HClO | 1.5 |
| Cl2 | Cl− | 1.4 |
In acidic solutions, Fe2+ is oxidized to Fe3+ (hydrogen peroxide acting as an oxidizing agent):
and sulfite (SO2−3) is oxidized to sulfate (SO2−4). However, potassium permanganate is reduced to Mn2+ by acidic H2O2.
[36]
Under alkaline conditions, however, some of these reactions reverse; for example, Mn2+ is oxidized to Mn4+ (as MnO2).
In basic solutions, hydrogen peroxide is a strong reductant and can reduce a variety of inorganic ions. When H2O2 acts as a reducing agent, oxygen gas is also produced. For example, hydrogen peroxide will reduce sodium hypochlorite and potassium permanganate, which is a convenient method for preparing oxygen in the laboratory:
Organic reactions[edit]
Hydrogen peroxide is frequently used as an oxidizing agent. Illustrative is oxidation of thioethers to sulfoxides:[37][38]
Alkaline hydrogen peroxide is used for epoxidation of electron-deficient alkenes such as acrylic acid derivatives,[39] and for the oxidation of alkylboranes to alcohols, the second step of hydroboration-oxidation. It is also the principal reagent in the Dakin oxidation process.
Precursor to other peroxide compounds[edit]
Hydrogen peroxide is a weak acid, forming hydroperoxide or peroxide salts with many metals.
It also converts metal oxides into the corresponding peroxides. For example, upon treatment with hydrogen peroxide, chromic acid (CrO3 and H2SO4) forms a blue peroxide CrO(O2)2.
This kind of reaction is used industrially to produce peroxoanions. For example, reaction with borax leads to sodium perborate, a bleach used in laundry detergents:
H2O2 converts carboxylic acids (RCO2H) into peroxy acids (RC(O)O2H), which are themselves used as oxidizing agents. Hydrogen peroxide reacts with acetone to form acetone peroxide and with ozone to form trioxidane. Hydrogen peroxide forms stable adducts with urea (Hydrogen peroxide — urea), sodium carbonate (sodium percarbonate) and other compounds.[40] An acid-base adduct with triphenylphosphine oxide is a useful «carrier» for H2O2 in some reactions.
Hydrogen peroxide is both an oxidizing agent and reducing agent. The oxidation of hydrogen peroxide by sodium hypochlorite yields singlet oxygen. The net reaction of a ferric ion with hydrogen peroxide is a ferrous ion and oxygen. This proceeds via single electron oxidation and hydroxyl radicals. This is used in some organic chemistry oxidations, e.g. in the Fenton’s reagent. Only catalytic quantities of iron ion is needed since peroxide also oxidizes ferrous to ferric ion. The net reaction of hydrogen peroxide and permanganate or manganese dioxide is manganous ion; however, until the peroxide is spent some manganese ions are reoxidized to make the reaction catalytic. This forms the basis for common monopropellant rockets.
Biological function[edit]
Hydrogen peroxide is formed in humans and other animals as a short-lived product in biochemical processes and is toxic to cells. The toxicity is due to oxidation of proteins, membrane lipids and DNA by the peroxide ions.[41] The class of biological enzymes called superoxide dismutase (SOD) is developed in nearly all living cells as an important antioxidant agent. They promote the disproportionation of superoxide into oxygen and hydrogen peroxide, which is then rapidly decomposed by the enzyme catalase to oxygen and water.[42]
Peroxisomes are organelles found in virtually all eukaryotic cells.[43] They are involved in the catabolism of very long chain fatty acids, branched chain fatty acids, D-amino acids, polyamines, and biosynthesis of plasmalogens, ether phospholipids critical for the normal function of mammalian brains and lungs.[44] Upon oxidation, they produce hydrogen peroxide in the following process catalyzed by flavin adenine dinucleotide (FAD):[45]
Catalase, another peroxisomal enzyme, uses this H2O2 to oxidize other substrates, including phenols, formic acid, formaldehyde, and alcohol, by means of a peroxidation reaction:
thus eliminating the poisonous hydrogen peroxide in the process.
This reaction is important in liver and kidney cells, where the peroxisomes neutralize various toxic substances that enter the blood. Some of the ethanol humans drink is oxidized to acetaldehyde in this way.[46] In addition, when excess H2O2 accumulates in the cell, catalase converts it to H2O through this reaction:
Another origin of hydrogen peroxide is the degradation of adenosine monophosphate which yields hypoxanthine. Hypoxanthine is then oxidatively catabolized first to xanthine and then to uric acid, and the reaction is catalyzed by the enzyme xanthine oxidase:[47]
Degradation of hypoxanthine through xanthine to uric acid to form hydrogen peroxide.
The degradation of guanosine monophosphate yields xanthine as an intermediate product which is then converted in the same way to uric acid with the formation of hydrogen peroxide.[47]
Eggs of sea urchin, shortly after fertilization by a sperm, produce hydrogen peroxide. It is then quickly dissociated to HO• radicals. The radicals serve as initiator of radical polymerization, which surrounds the eggs with a protective layer of polymer.[48]
The bombardier beetle has a device which allows it to shoot corrosive and foul-smelling bubbles at its enemies. The beetle produces and stores hydroquinone and hydrogen peroxide, in two separate reservoirs in the rear tip of its abdomen. When threatened, the beetle contracts muscles that force the two reactants through valved tubes into a mixing chamber containing water and a mixture of catalytic enzymes. When combined, the reactants undergo a violent exothermic chemical reaction, raising the temperature to near the boiling point of water. The boiling, foul-smelling liquid partially becomes a gas (flash evaporation) and is expelled through an outlet valve with a loud popping sound.[49][50][51]
Hydrogen peroxide is a signaling molecule of plant defense against pathogens.[52]
Hydrogen peroxide has roles as a signalling molecule in the regulation of a wide variety of biological processes.[53] The compound is a major factor implicated in the free-radical theory of aging, based on how readily hydrogen peroxide can decompose into a hydroxyl radical and how superoxide radical byproducts of cellular metabolism can react with ambient water to form hydrogen peroxide.[54] These hydroxyl radicals in turn readily react with and damage vital cellular components, especially those of the mitochondria.[55][56][57] At least one study has also tried to link hydrogen peroxide production to cancer.[58] These studies have frequently been quoted in fraudulent treatment claims.[citation needed]
The amount of hydrogen peroxide in biological systems can be assayed using a fluorometric assay.[59]
Uses[edit]
Bleaching[edit]
About 60% of the world’s production of hydrogen peroxide is used for pulp- and paper-bleaching.[33] The second major industrial application is the manufacture of sodium percarbonate and sodium perborate, which are used as mild bleaches in laundry detergents. Sodium percarbonate, which is an adduct of sodium carbonate and hydrogen peroxide, is the active ingredient in such laundry products as OxiClean and Tide laundry detergent. When dissolved in water, it releases hydrogen peroxide and sodium carbonate,[20] By themselves these bleaching agents are only effective at wash temperatures of 60 °C (140 °F) or above and so, often are used in conjunction with bleach activators, which facilitate cleaning at lower temperatures.
It has also been used as a flour bleaching agent and a tooth whitening agent.
Production of organic compounds[edit]
It is used in the production of various organic peroxides with dibenzoyl peroxide being a high volume example. Peroxy acids, such as peracetic acid and meta-chloroperoxybenzoic acid also are produced using hydrogen peroxide. Hydrogen peroxide has been used for creating organic peroxide-based explosives, such as acetone peroxide. It is used as an initiator in polymerizations.
Sewage treatment[edit]
Hydrogen peroxide is used in certain waste-water treatment processes to remove organic impurities. In advanced oxidation processing, the Fenton reaction[60][61] gives the highly reactive hydroxyl radical (•OH). This degrades organic compounds, including those that are ordinarily robust, such as aromatic or halogenated compounds.[62] It can also oxidize sulfur-based compounds present in the waste; which is beneficial as it generally reduces their odour.[63]
Disinfectant[edit]
Hydrogen peroxide may be used for the sterilization of various surfaces,[64] including surgical tools,[65] and may be deployed as a vapour (VHP) for room sterilization.[66] H2O2 demonstrates broad-spectrum efficacy against viruses, bacteria, yeasts, and bacterial spores.[67][68] In general, greater activity is seen against Gram-positive than Gram-negative bacteria; however, the presence of catalase or other peroxidases in these organisms may increase tolerance in the presence of lower concentrations.[69] Lower levels of concentration (3%) will work against most spores; higher concentrations (7 to 30%) and longer contact times will improve sporicidal activity.[68][70]
Hydrogen peroxide is seen as an environmentally safe alternative to chlorine-based bleaches, as it degrades to form oxygen and water and it is generally recognized as safe as an antimicrobial agent by the U.S. Food and Drug Administration (FDA).[71]
Propellant[edit]
High-concentration H2O2 is referred to as «high-test peroxide» (HTP). It can be used either as a monopropellant (not mixed with fuel) or as the oxidizer component of a bipropellant rocket. Use as a monopropellant takes advantage of the decomposition of 70–98% concentration hydrogen peroxide into steam and oxygen. The propellant is pumped into a reaction chamber, where a catalyst, usually a silver or platinum screen, triggers decomposition, producing steam at over 600 °C (1,100 °F), which is expelled through a nozzle, generating thrust. H2O2 monopropellant produces a maximal specific impulse (Isp) of 161 s (1.6 kN·s/kg). Peroxide was the first major monopropellant adopted for use in rocket applications. Hydrazine eventually replaced hydrogen-peroxide monopropellant thruster applications primarily because of a 25% increase in the vacuum specific impulse.[72] Hydrazine (toxic) and hydrogen peroxide (less-toxic [ACGIH TLV 0.01 and 1 ppm respectively]) are the only two monopropellants (other than cold gases) to have been widely adopted and utilized for propulsion and power applications.[citation needed] The Bell Rocket Belt, reaction control systems for X-1, X-15, Centaur, Mercury, Little Joe, as well as the turbo-pump gas generators for X-1, X-15, Jupiter, Redstone and Viking used hydrogen peroxide as a monopropellant.[73]
As a bipropellant, H2O2 is decomposed to burn a fuel as an oxidizer. Specific impulses as high as 350 s (3.5 kN·s/kg) can be achieved, depending on the fuel. Peroxide used as an oxidizer gives a somewhat lower Isp than liquid oxygen, but is dense, storable, non-cryogenic and can be more easily used to drive gas turbines to give high pressures using an efficient closed cycle. It may also be used for regenerative cooling of rocket engines. Peroxide was used very successfully as an oxidizer in World War II German rocket motors (e.g. T-Stoff, containing oxyquinoline stabilizer, for both the Walter HWK 109-500 Starthilfe RATO externally podded monopropellant booster system, and for the Walter HWK 109-509 rocket motor series used for the Me 163B), most often used with C-Stoff in a self-igniting hypergolic combination, and for the low-cost British Black Knight and Black Arrow launchers. Presently, HTP is used on ILR-33 AMBER[74] and Nucleus[75] suborbital rockets.
In the 1940s and 1950s, the Hellmuth Walter KG–conceived turbine used hydrogen peroxide for use in submarines while submerged; it was found to be too noisy and require too much maintenance compared to diesel-electric power systems. Some torpedoes used hydrogen peroxide as oxidizer or propellant. Operator error in the use of hydrogen-peroxide torpedoes was named as possible causes for the sinking of HMS Sidon and the Russian submarine Kursk.[76] SAAB Underwater Systems is manufacturing the Torpedo 2000. This torpedo, used by the Swedish Navy, is powered by a piston engine propelled by HTP as an oxidizer and kerosene as a fuel in a bipropellant system.[77][78]
Household use[edit]
Contact lenses soaking in a 3% hydrogen peroxide-based solution. The case includes a catalytic disc which neutralises the hydrogen peroxide over time.
Hydrogen peroxide has various domestic uses, primarily as a cleaning and disinfecting agent.
- Hair bleaching
Diluted H2O2 (between 1.9% and 12%) mixed with aqueous ammonia has been used to bleach human hair. The chemical’s bleaching property lends its name to the phrase «peroxide blonde».[79]
Hydrogen peroxide is also used for tooth whitening. It may be found in most whitening toothpastes. Hydrogen peroxide has shown positive results involving teeth lightness and chroma shade parameters.[80] It works by oxidizing colored pigments onto the enamel where the shade of the tooth may become lighter.[further explanation needed] Hydrogen peroxide may be mixed with baking soda and salt to make a homemade toothpaste.[81]
- Removal of blood stains
Hydrogen peroxide reacts with blood as a bleaching agent, and so if a blood stain is fresh, or not too old, liberal application of hydrogen peroxide, if necessary in more than single application, will bleach the stain fully out. After about two minutes of the application, the blood should be firmly blotted out.[82][83]
- Acne treatment
Hydrogen peroxide may be used to treat acne,[84] although benzoyl peroxide is a more common treatment.
Niche uses[edit]
- Glow sticks
Hydrogen peroxide reacts with certain di-esters, such as phenyl oxalate ester (cyalume), to produce chemiluminescence; this application is most commonly encountered in the form of glow sticks.
- Horticulture
Some horticulturalists and users of hydroponics advocate the use of weak hydrogen peroxide solution in watering solutions. Its spontaneous decomposition releases oxygen that enhances a plant’s root development and helps to treat root rot (cellular root death due to lack of oxygen) and a variety of other pests.[85][86]
For general watering concentrations around 0.1% is in use and this can be increased up to one percent for anti-fungal actions.[87] Tests show that plant foliage can safely tolerate concentrations up to 3%.[88]
- Fishkeeping
Hydrogen peroxide is used in aquaculture for controlling mortality caused by various microbes. In 2019, the U.S. FDA approved it for control of Saprolegniasis in all coldwater finfish and all fingerling and adult coolwater and warmwater finfish, for control of external columnaris disease in warm-water finfish, and for control of Gyrodactylus spp. in freshwater-reared salmonids.[89] Laboratory tests conducted by fish culturists have demonstrated that common household hydrogen peroxide may be used safely to provide oxygen for small fish. The hydrogen peroxide releases oxygen by decomposition when it is exposed to catalysts such as manganese dioxide.
- Removing yellowing from aged plastics
Hydrogen peroxide may be used in combination with a UV-light source to remove yellowing from white or light grey acrylonitrile butadiene styrene (ABS) plastics to partially or fully restore the original color. In the retrocomputing scene, this process is commonly referred to as retr0bright.
Safety[edit]
Skin shortly after exposure to 35%
H2O2
Regulations vary, but low concentrations, such as 5%, are widely available and legal to buy for medical use. Most over-the-counter peroxide solutions are not suitable for ingestion. Higher concentrations may be considered hazardous and typically are accompanied by a safety data sheet (SDS). In high concentrations, hydrogen peroxide is an aggressive oxidizer and will corrode many materials, including human skin. In the presence of a reducing agent, high concentrations of H2O2 will react violently.[90]
While concentrations up to 35% produce only «white» oxygen bubbles in the skin (and some biting pain) that disappear with the blood within 30-45 minutes concentrations of 98% dissolve paper. However concentrations as low as 3% can be dangerous for the eye because of oxygen evolution within the eye.[91]
High-concentration hydrogen peroxide streams, typically above 40%, should be considered hazardous due to concentrated hydrogen peroxide’s meeting the definition of a DOT oxidizer according to U.S. regulations, if released into the environment. The EPA Reportable Quantity (RQ) for D001 hazardous wastes is 100 pounds (45 kg), or approximately 10 US gallons (38 L), of concentrated hydrogen peroxide.
Hydrogen peroxide should be stored in a cool, dry, well-ventilated area and away from any flammable or combustible substances. It should be stored in a container composed of non-reactive materials such as stainless steel or glass (other materials including some plastics and aluminium alloys may also be suitable).[92] Because it breaks down quickly when exposed to light, it should be stored in an opaque container, and pharmaceutical formulations typically come in brown bottles that block light.[93]
Hydrogen peroxide, either in pure or diluted form, may pose several risks, the main one being that it forms explosive mixtures upon contact with organic compounds.[94] Distillation of hydrogen peroxide at normal pressures is highly dangerous. It is also corrosive, especially when concentrated, but even domestic-strength solutions may cause irritation to the eyes, mucous membranes, and skin.[95] Swallowing hydrogen peroxide solutions is particularly dangerous, as decomposition in the stomach releases large quantities of gas (ten times the volume of a 3% solution), leading to internal bloating. Inhaling over 10% can cause severe pulmonary irritation.[96]
With a significant vapour pressure (1.2 kPa at 50 °C),[97] hydrogen-peroxide vapour is potentially hazardous. According to U.S. NIOSH, the immediately dangerous to life and health (IDLH) limit is only 75 ppm.[98] The U.S. Occupational Safety and Health Administration (OSHA) has established a permissible exposure limit of 1.0 ppm calculated as an 8-hour time-weighted average (29 CFR 1910.1000, Table Z-1).[94] Hydrogen peroxide also has been classified by the American Conference of Governmental Industrial Hygienists (ACGIH) as a «known animal carcinogen, with unknown relevance on humans».[99] For workplaces where there is a risk of exposure to the hazardous concentrations of the vapours, continuous monitors for hydrogen peroxide should be used. Information on the hazards of hydrogen peroxide is available from OSHA[94] and from the ATSDR.[100]
Wound healing[edit]
Historically, hydrogen peroxide was used for disinfecting wounds, partly because of its low cost and prompt availability compared to other antiseptics.[101]
There is conflicting evidence on hydrogen peroxide’s effect on wound healing. Some research finds benefit, while other research find delays and healing inhibition.[102] Its use for home treatment of wounds is generally contraindicated.[103]
1.5%-3% Hydrogen peroxide is used as a desinfectant in dentistry, especially in endodotic treatments together with hypochlorite and chlorhexidin and 1-1.5% is also useful for treatment of inflammation of third molars (wisdom teeth).[104]
Use in alternative medicine[edit]
Practitioners of alternative medicine have advocated the use of hydrogen peroxide for various conditions, including emphysema, influenza, AIDS, and in particular cancer.[105] There is no evidence of effectiveness and in some cases it has proved fatal.[106][107][108][109][110]
Both the effectiveness and safety of hydrogen peroxide therapy is scientifically questionable. Hydrogen peroxide is produced by the immune system, but in a carefully controlled manner. Cells called phagocytes engulf pathogens and then use hydrogen peroxide to destroy them. The peroxide is toxic to both the cell and the pathogen and so is kept within a special compartment, called a phagosome. Free hydrogen peroxide will damage any tissue it encounters via oxidative stress, a process that also has been proposed as a cause of cancer.[111]
Claims that hydrogen peroxide therapy increases cellular levels of oxygen have not been supported. The quantities administered would be expected to provide very little additional oxygen compared to that available from normal respiration. It is also difficult to raise the level of oxygen around cancer cells within a tumour, as the blood supply tends to be poor, a situation known as tumor hypoxia.
Large oral doses of hydrogen peroxide at a 3% concentration may cause irritation and blistering to the mouth, throat, and abdomen as well as abdominal pain, vomiting, and diarrhea.[106] Ingestion of hydrogen peroxide at concentrations of 35% or higher has been implicated as the cause of numerous gas embolism events resulting in hospitalisation. In these cases, hyperbaric oxygen therapy was used to treat the embolisms.[112]
Intravenous injection of hydrogen peroxide has been linked to several deaths.[108][109][110]
The American Cancer Society states that «there is no scientific evidence that hydrogen peroxide is a safe, effective, or useful cancer treatment.»[107] Furthermore, the therapy is not approved by the U.S. FDA.
Historical incidents[edit]
- On 16 July 1934, in Kummersdorf, Germany, a propellant tank containing an experimental monopropellant mixture consisting of hydrogen peroxide and ethanol exploded during a test, killing three people.[113]
- During the Second World War, doctors in German concentration camps experimented with the use of hydrogen peroxide injections in the killing of human subjects.[114]
- In April 1992, an explosion occurred at the hydrogen peroxide plant at Jarrie in France, due to technical failure of the computerised control system and resulting in one fatality and wide destruction of the plant.[115]
- Several people received minor injuries after a hydrogen peroxide spill on board a flight between the U.S. cities of Orlando and Memphis on 28 October 1998.[116]
- The Russian submarine K-141 Kursk sailed to perform an exercise of firing dummy torpedoes at the Pyotr Velikiy, a Kirov-class battlecruiser. On 12 August 2000, at 11:28 local time (07:28 UTC), there was an explosion while preparing to fire the torpedoes. The only credible report to date is that this was due to the failure and explosion of one of the Kursk’s hydrogen peroxide-fueled torpedoes. It is believed that HTP, a form of highly concentrated hydrogen peroxide used as propellant for the torpedo, seeped through its container, damaged either by rust or in the loading procedure back on land where an incident involving one of the torpedoes accidentally touching ground went unreported. The vessel was lost with all hands. A similar incident was responsible for the loss of HMS Sidon in 1955.[117]
- On 15 August 2010, a spill of about 30 US gallons (110 L) of cleaning fluid occurred on the 54th floor of 1515 Broadway, in Times Square, New York City. The spill, which a spokesperson for the New York City fire department said was of hydrogen peroxide, shut down Broadway between West 42nd and West 48th streets as fire engines responded to the hazmat situation. There were no reported injuries.[118]
See also[edit]
- FOX reagent, used to measure levels of hydrogen peroxide in biological systems
- Hydrogen chalcogenide
- Retrobright, a process using hydrogen peroxide to restore yellowed Acrylonitrile butadiene styrene plastic
References[edit]
Notes
- ^ Easton MF, Mitchell AG, Wynne-Jones WF (1952). «The behaviour of mixtures of hydrogen peroxide and water. Part 1.—Determination of the densities of mixtures of hydrogen peroxide and water». Transactions of the Faraday Society. 48: 796–801. doi:10.1039/TF9524800796. S2CID 96669623. Archived from the original on 15 February 2022. Retrieved 30 November 2019.
- ^ «Hydrogen peroxide». www.chemsrc.com. Archived from the original on 8 August 2017. Retrieved 3 May 2018.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0335». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c «Hydrogen peroxide». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Housecroft CE, Sharpe AG (2005). Inorganic Chemistry (2nd ed.). Pearson Prentice-Hall. p. 443. ISBN 0130-39913-2.
- ^ Hill CN (2001). A Vertical Empire: The History of the UK Rocket launch and Space Programme, 1950–1971. Imperial College Press. ISBN 978-1-86094-268-6. Archived from the original on 13 April 2021. Retrieved 24 August 2020.
- ^ Brauer G, ed. (1963). Handbook of preparative inorganic chemistry. Vol. 1. Translation editing by Reed F. (2nd ed.). New York: Academic Press. p. 140. ISBN 978-0-12-126601-1.
- ^ Giguère PA (1950). «The Infra‐Red Spectrum of Hydrogen Peroxide» (PDF). Journal of Chemical Physics. 18 (1): 88. Bibcode:1950JChPh..18…88G. doi:10.1063/1.1747464. Archived (PDF) from the original on 2 December 2017. Retrieved 31 December 2018.
- ^ Giguère PA (1983). «Molecular association and structure of hydrogen peroxide». Journal of Chemical Education. 60 (5): 399–401. Bibcode:1983JChEd..60..399G. doi:10.1021/ed060p399.
- ^ Hunt RH, Leacock RA, Peters CW, Hecht KT (1965). «Internal-Rotation in Hydrogen Peroxide: The Far-Infrared Spectrum and the Determination of the Hindering Potential» (PDF). The Journal of Chemical Physics. 42 (6): 1931. Bibcode:1965JChPh..42.1931H. doi:10.1063/1.1696228. hdl:2027.42/71115. Archived (PDF) from the original on 9 April 2014. Retrieved 9 April 2014.
- ^ Ball R, Brindley J (March 2016). «The Life Story of Hydrogen Peroxide III: Chirality and Physical Effects at the Dawn of Life». Origins of Life and Evolution of the Biosphere. 46 (1): 81–93. Bibcode:2016OLEB…46…81B. doi:10.1007/s11084-015-9465-y. PMID 26399407. S2CID 9564774.
- ^ Dougherty DA, Anslyn EV (2005). Modern Physical Organic Chemistry. University Science. p. 122. ISBN 978-1-891389-31-3.
- ^ Abrahams SC, Collin RL, Lipscomb WN (1 January 1951). «The crystal structure of hydrogen peroxide». Acta Crystallographica. 4 (1): 15–20. doi:10.1107/S0365110X51000039.
- ^ «Hydrogen Peroxide Technical Library» (PDF). Archived from the original (PDF) on 29 December 2009. Retrieved 3 March 2016.
- ^ Flohé L (December 2020). «Looking Back at the Early Stages of Redox Biology». Antioxidants. 9 (12): 1254. doi:10.3390/antiox9121254. PMC 7763103. PMID 33317108.
I checked Humboldt’s pertinent publication carefully, but was unable to find an unambiguous proof of this assumption; the description of the starting materials (“Alaun-Erden” or “schwere Erden”) were just too unprecise to understand what kind of chemical experiments he performed.
- ^ Gilbert LW (1820). «Der tropfbar flüssige Sauerstoff, oder das oxygenierte Wasser». Annals of Physics (in German). 65–66 (1): 3. Bibcode:1820AnP….64….1T. doi:10.1002/andp.18200640102.
- ^ Thénard LJ (1818). «Observations sur des nouvelles combinaisons entre l’oxigène et divers acides». Annales de chimie et de physique. 2nd series. 8: 306–312. Archived from the original on 3 September 2016. Retrieved 9 February 2016.
- ^ Giguère PA. «Hydrogen peroxide». Access Science. McGraw-Hill Education. doi:10.1036/1097-8542.329200. Archived from the original on 30 November 2018. Retrieved 28 November 2018.
Hydrogen peroxide was discovered in 1818 by the French chemist Louis-Jacques Thenard, who named it eau oxygénée (oxygenated water).
- ^ Preiato D (5 March 2020). «What is oxygenated water?». Healthline. Healthline Media. Archived from the original on 31 October 2020. Retrieved 23 September 2020.
- ^ a b Jones CW, Clark JH (1999). Applications of Hydrogen Peroxide and Derivatives. Royal Society of Chemistry. ISBN 978-0-85404-536-5.
- ^ a b Offermanns H, Dittrich G, Steiner N (2000). «Wasserstoffperoxid in Umweltschutz und Synthese». Chemie in unserer Zeit. 34 (3): 150. doi:10.1002/1521-3781(200006)34:3<150::AID-CIUZ150>3.0.CO;2-A.
- ^ Wolffenstein R (October 1894). «Concentration und Destillation von Wasserstoffsuperoxyd». Berichte der Deutschen Chemischen Gesellschaft (in German). 27 (3): 3307–3312. doi:10.1002/cber.189402703127. Archived from the original on 13 February 2016. Retrieved 29 June 2014.
- ^ Carrara G (1892). «Sul peso molecolare e sul potere rifrangente dell’ acqua ossigenata» [On the molecular weight and on the refracting power of hydrogen peroxide]. Atti della Reale Accademia dei Lincei. 1 (2): 19–24. Archived from the original on 4 September 2016.
Carrara’s findings were confirmed by: W. R. Orndorff and John White (1893) «The molecular weight of hydrogen peroxide and of benzoyl peroxide,» Archived 4 September 2016 at the Wayback Machine American Chemical Journal, 15 : 347–356. - ^ See, for example:
- In 1882, Kingzett proposed as a structure H2O=O. See: Kingzett T (29 September 1882). «On the activity of oxygen and the mode of formation of hydrogen dioxide». The Chemical News. 46 (1192): 141–142. Archived from the original on 3 September 2016. Retrieved 9 February 2016.
- In his 1922 textbook, Joseph Mellor considered three hypothetical molecular structures for hydrogen peroxide, admitting (p. 952): «… the constitution of this compound has not been yet established by unequivocal experiments». See: Joseph William Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry, vol. 1 (London, England: Longmans, Green and Co., 1922), p. 952–956. Archived 3 September 2016 at the Wayback Machine
- W. C. Schumb, C. N. Satterfield, and R. L. Wentworth (1 December 1953) «Report no. 43: Hydrogen peroxide, Part two» Archived 26 February 2015 at the Wayback Machine, Office of Naval Research, Contract No. N5ori-07819 On p. 178, the authors present six hypothetical models for hydrogen peroxide’s molecular structure. On p. 184, the present structure is considered almost certainly correct—although a small doubt remained. (Note: The report by Schumb et al. was reprinted as: W. C. Schumb, C. N. Satterfield, and R. L. Wentworth, Hydrogen Peroxide (New York, New York: Reinhold Publishing Corp. (American Chemical Society Monograph), 1955).)
- ^ Penney WG, Sutherland GB (1934). «The theory of the structure of hydrogen peroxide and hydrazine». Journal of Chemical Physics. 2 (8): 492–498. Bibcode:1934JChPh…2..492P. doi:10.1063/1.1749518.
- ^ Penney WG, Sutherland GB (1934). «A note on the structure of H2O2 and H4N2 with particular reference to electric moments and free rotation». Transactions of the Faraday Society. 30: 898–902. doi:10.1039/tf934300898b.
- ^ «Preparing to manufacture hydrogen peroxide» (PDF). IDC Technologies. Archived (PDF) from the original on 3 August 2021. Retrieved 14 February 2022.
- ^ a b c Campos-Martin JM, Blanco-Brieva G, Fierro JL (October 2006). «Hydrogen peroxide synthesis: an outlook beyond the anthraquinone process». Angewandte Chemie. 45 (42): 6962–6984. doi:10.1002/anie.200503779. PMID 17039551. S2CID 23286196.
- ^ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (2 October 1936 in USA, and 10 October 1935 in Germany) to I. G. Farbenindustrie, Germany
- ^ Mellor JW (1922). Modern Inorganic Chemistry. Longmans, Green and Co. pp. 192–195.
- ^ Noritaka Mizuno Gabriele Centi, Siglinda Perathoner, Salvatore Abate «Direct Synthesis of Hydrogen Peroxide: Recent Advances» in Modern Heterogeneous Oxidation Catalysis: Design, Reactions and Characterization 2009, Wiley-VCH. doi:10.1002/9783527627547.ch8
- ^ Edwards JK, Solsona B, N EN, Carley AF, Herzing AA, Kiely CJ, Hutchings GJ (February 2009). «Switching off hydrogen peroxide hydrogenation in the direct synthesis process». Science. 323 (5917): 1037–1041. Bibcode:2009Sci…323.1037E. doi:10.1126/science.1168980. PMID 19229032. S2CID 1828874. Archived from the original on 15 February 2022. Retrieved 30 November 2019.
- ^ a b Hage R, Lienke A (December 2005). «Applications of transition-metal catalysts to textile and wood-pulp bleaching». Angewandte Chemie. 45 (2): 206–222. doi:10.1002/anie.200500525. PMID 16342123. Archived from the original on 25 January 2022. Retrieved 14 February 2022.
- ^ «Decomposition of Hydrogen Peroxide — Kinetics and Review of Chosen Catalysts» (PDF). Archived (PDF) from the original on 22 December 2018. Retrieved 30 August 2019.
- ^ Petrucci RH (2007). General Chemistry: Principles & Modern Applications (9th ed.). Prentice Hall. p. 606. ISBN 978-0-13-149330-8.
- ^ Housecroft CE, Sharpe AG (2005). Inorganic Chemistry (2nd ed.). Pearson Prentice-Hall. p. 444. ISBN 0130-39913-2.
- ^ Ravikumar KS, Kesavan V, Crousse B, Bonnet-Delpon D, Bégué JP (2003). «Mild and Selective Oxidation of Sulfur Compounds in Trifluoroethanol: Diphenyldisulfide and Methyl phenyl Sulfoxide». Org. Synth. 80: 184. doi:10.15227/orgsyn.080.0184.
- ^ Xu WL, Li YZ, Zhang QS, Zhu HS (2004). «A Selective, Convenient, and Efficient Conversion of Sulfides to Sulfoxides». Synthesis (2): 227–232. doi:10.1055/s-2004-44387.
- ^ Mayer RJ, Ofial AR (May 2018). «Nucleophilic Reactivities of Bleach Reagents». Organic Letters. 20 (10): 2816–2820. doi:10.1021/acs.orglett.8b00645. PMID 29741385.
- ^ Chernyshov IY, Vener MV, Prikhodchenko PV, Medvedev AG, Lev O, Churakov AV (4 January 2017). «Peroxosolvates: Formation Criteria, H2O2 Hydrogen Bonding, and Isomorphism with the Corresponding Hydrates». Crystal Growth & Design. 17 (1): 214–220. doi:10.1021/acs.cgd.6b01449. ISSN 1528-7483.
- ^ Löffler G. and Petrides, P. E. Physiologische Chemie. 4 ed., p. 288, Springer, Berlin 1988, ISBN 3-540-18163-6 (in German)
- ^ Löffler G. and Petrides, P. E. Physiologische Chemie. 4 ed., pp. 321–322, Springer, Berlin 1988, ISBN 3-540-18163-6 (in German)
- ^ Gabaldón T (March 2010). «Peroxisome diversity and evolution». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 365 (1541): 765–773. doi:10.1098/rstb.2009.0240. PMC 2817229. PMID 20124343.
- ^ Wanders RJ, Waterham HR (2006). «Biochemistry of mammalian peroxisomes revisited». Annual Review of Biochemistry. 75 (1): 295–332. doi:10.1146/annurev.biochem.74.082803.133329. PMID 16756494.
- ^ Nelson D, Cox C, Lehninger AL, Cox MM (2001). Lehninger Biochemie (in German). Springer. pp. 663–664. ISBN 3-540-41813-X. Archived from the original on 28 February 2017.
- ^ Riley, Edward P. et al. (ed.) Fetal Alcoholspectrum Disorder Fasd: Management and Policy Perspectives Archived 28 February 2017 at the Wayback Machine, Wiley-VCH, 2010, ISBN 3-527-32839-4 p. 112
- ^ a b Nelson, David; Cox, Michael; Lehninger, Albert L. and Cox, Michael M. Lehninger Biochemie, p. 932, Springer, 2001, ISBN 3-540-41813-X (in German)
- ^ Kröger M (1989). «History». Chemie in unserer Zeit. 23: 34–35. doi:10.1002/ciuz.19890230106.
- ^ Schildknecht H, Holoubek K (1961). «The bombardier beetle and its chemical explosion». Angewandte Chemie. 73: 1–7. doi:10.1002/ange.19610730102.
- ^ Weber CG (Winter 1981). «The Bombadier Beetle Myth Exploded». Creation/Evolution. 2 (1): 1–5. Archived from the original on 29 September 2017. Retrieved 12 November 2017.
- ^ Isaak M (30 May 2003). «Bombardier Beetles and the Argument of Design». TalkOrigins Archive. Archived from the original on 16 November 2017. Retrieved 12 November 2017.
- ^ «Wie Pflanzen sich schützen, Helmholtz-Institute of Biochemical Plant Pathology (in German)» (PDF) (in German). Helmholtz-Institute of Biochemical Plant Pathology. Archived from the original (PDF) on 23 July 2011. Retrieved 14 February 2022.
- ^ Veal EA, Day AM, Morgan BA (April 2007). «Hydrogen peroxide sensing and signaling». Molecular Cell. 26 (1): 1–14. doi:10.1016/j.molcel.2007.03.016. PMID 17434122.
- ^ Weindruch R (1 December 2006). «Calorie Restriction and Aging». Scientific American. Archived from the original on 14 February 2022. Retrieved 14 February 2022.
- ^ Giorgio M, Trinei M, Migliaccio E, Pelicci PG (September 2007). «Hydrogen peroxide: a metabolic by-product or a common mediator of ageing signals?». Nature Reviews. Molecular Cell Biology. 8 (9): 722–728. doi:10.1038/nrm2240. PMID 17700625. S2CID 6407526. Archived from the original on 15 February 2022. Retrieved 7 February 2020.
- ^ Gonzalez D, Bejarano I, Barriga C, Rodriguez AB, Pariente JA (2010). «Oxidative Stress-Induced Caspases are Regulated in Human Myeloid HL-60 Cells by Calcium Signal». Current Signal Transduction Therapy. 5 (2): 181–186. doi:10.2174/157436210791112172.
- ^ Bejarano I, Espino J, González-Flores D, Casado JG, Redondo PC, Rosado JA, et al. (September 2009). «Role of Calcium Signals on Hydrogen Peroxide-Induced Apoptosis in Human Myeloid HL-60 Cells». International Journal of Biomedical Science. 5 (3): 246–256. PMC 3614781. PMID 23675144.
- ^ López-Lázaro M (July 2007). «Dual role of hydrogen peroxide in cancer: possible relevance to cancer chemoprevention and therapy». Cancer Letters. 252 (1): 1–8. doi:10.1016/j.canlet.2006.10.029. PMID 17150302.
- ^ Rapoport R, Hanukoglu I, Sklan D (May 1994). «A fluorimetric assay for hydrogen peroxide, suitable for NAD(P)H-dependent superoxide generating redox systems». Analytical Biochemistry. 218 (2): 309–313. doi:10.1006/abio.1994.1183. PMID 8074285. S2CID 40487242. Archived from the original on 18 March 2020. Retrieved 1 July 2019.
- ^ Tarr MA, ed. (2003). Chemical degradation methods for wastes and pollutants environmental and industrial applications. New York: M. Dekker. p. 165. ISBN 978-0-203-91255-3.
- ^ Pignatello JJ, Oliveros E, MacKay A (January 2006). «Advanced Oxidation Processes for Organic Contaminant Destruction Based on the Fenton Reaction and Related Chemistry». Critical Reviews in Environmental Science and Technology. 36 (1): 1–84. doi:10.1080/10643380500326564. S2CID 93052585.
- ^ Pera-Titus M, Garcıa-Molina V, Baños MA, Giménez J, Esplugas S (February 2004). «Degradation of chlorophenols by means of advanced oxidation processes: a general review». Applied Catalysis B: Environmental. 47 (4): 219–256. doi:10.1016/j.apcatb.2003.09.010.
- ^ Goor G, Glenneberg J, Jacobi S (2007). «Hydrogen Peroxide». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a13_443.pub2. ISBN 978-3-527-30673-2.
- ^ Ascenzi JM, ed. (1996). Handbook of disinfectants and antiseptics. New York: M. Dekker. p. 161. ISBN 978-0-8247-9524-5.
- ^ Rutala WA, Weber DJ (September 2004). «Disinfection and sterilization in health care facilities: what clinicians need to know». Clinical Infectious Diseases. 39 (5): 702–709. doi:10.1086/423182. PMID 15356786.
- ^ Falagas ME, Thomaidis PC, Kotsantis IK, Sgouros K, Samonis G, Karageorgopoulos DE (July 2011). «Airborne hydrogen peroxide for disinfection of the hospital environment and infection control: a systematic review». The Journal of Hospital Infection. 78 (3): 171–177. doi:10.1016/j.jhin.2010.12.006. PMID 21392848.
- ^ Block SS, ed. (2000). «Chapter 9: Peroxygen compounds». Disinfection, sterilization, and preservation (5th ed.). Philadelphia: Lea & Febiger. pp. 185–204. ISBN 978-0-683-30740-5.
- ^ a b «Chemical Disinfectants | Disinfection & Sterilization Guidelines | Guidelines Library | Infection Control | CDC». www.cdc.gov. 4 April 2019. Archived from the original on 1 July 2017. Retrieved 12 April 2020.
- ^ McDonnell G, Russell AD (January 1999). «Antiseptics and disinfectants: activity, action, and resistance». Clinical Microbiology Reviews. 12 (1): 147–179. doi:10.1128/cmr.12.1.147. PMC 88911. PMID 9880479.
- ^ Block SS, ed. (2000). «Chapter 27: Chemical Sporicidal and Sporostatic Agents». Disinfection, sterilization, and preservation (5th ed.). Philadelphia: Lea & Febiger. pp. 529–543. ISBN 978-0-683-30740-5.
- ^ «Sec. 184.1366 Hydrogen peroxide». U.S. Government Printing Office via GPO Access. 1 April 2001. Archived from the original on 3 July 2007. Retrieved 7 July 2007.
- ^ Wernimont EJ (9–12 July 2006). System Trade Parameter Comparison of Monopropellants: Hydrogen Peroxide vs Hydrazine and Others (PDF). 42nd AIAA/ASME/SAE/ASEE Joint Propulsion Conference & Exhibit. Sacramento, California. Archived from the original (PDF) on 10 December 2014.
- ^ Ventura M, Mullens P (19 June 1999). «The Use of Hydrogen Peroxide for Propulsion and Power» (PDF). General Kinetics, LLC. Archived from the original (PDF) on 10 December 2014. Retrieved 10 December 2014.
- ^ Cieśliński D (2021). «Polish civil rockets’ development overview». Archived from the original on 6 February 2022. Retrieved 15 February 2022.
- ^ «Nucleus: A Very Different Way to Launch into Space». Nammo. Archived from the original on 6 February 2022. Retrieved 6 February 2022.
- ^ «Peroxide Accident – Walter Web Site». Histarmar.com.ar. Archived from the original on 10 December 2014. Retrieved 14 February 2015.
- ^ Scott R (November 1997). «Homing Instincts». Jane’s Navy Steam Generated by Catalytic Decomposition of 80–90% Hydrogen Peroxide Was Used for Driving the Turbopump Turbines of the V-2 Rockets, the X-15 Rocketplanes, the Early Centaur RL-10 Engines and is Still Used on Soyuz for That Purpose Today. International. Archived from the original on 17 July 2011. Retrieved 12 May 2007.
- ^ «Soyuz using hydrogen peroxide propellant». NASA. Archived from the original on 5 August 2013.
- ^ Lane N (2003). Oxygen : the molecule that made the world (First issued in paperback, repr. ed.). Oxford: Oxford University Press. p. 117. ISBN 978-0-19-860783-0. Archived from the original on 13 April 2021. Retrieved 12 November 2020.
- ^ Sulieman M, Addy M, MacDonald E, Rees JS (May 2004). «The effect of hydrogen peroxide concentration on the outcome of tooth whitening: an in vitro study». Journal of Dentistry. Elsevier Ltd. 32 (4): 295–299. doi:10.1016/j.jdent.2004.01.003. PMID 15053912. Archived from the original on 15 February 2022. Retrieved 30 September 2021.
- ^ Shepherd S. «Brushing Up on Gum Disease». FDA Consumer. Archived from the original on 14 May 2007. Retrieved 7 July 2007.
- ^ Gibbs KB (14 November 2016). «How to remove blood stains from clothes and furniture». Today.com. Archived from the original on 20 May 2021. Retrieved 5 August 2021.
- ^ Mayntz M. «Dried Blood Stain Removal». Lovetoknow.com. Archived from the original on 17 August 2021. Retrieved 5 August 2021.
- ^ Capizzi R, Landi F, Milani M, Amerio P (August 2004). «Skin tolerability and efficacy of combination therapy with hydrogen peroxide stabilized cream and adapalene gel in comparison with benzoyl peroxide cream and adapalene gel in common acne. A randomized, investigator-masked, controlled trial». The British Journal of Dermatology. 151 (2): 481–484. doi:10.1111/j.1365-2133.2004.06067.x. PMID 15327558. S2CID 2611939.
- ^ «Ways to use Hydrogen Peroxide in the Garden». Using Hydrogen Peroxide. Archived from the original on 4 March 2016. Retrieved 3 March 2016.
- ^ Bhattarai SP, Su N, Midmore DJ (2005). Oxygation Unlocks Yield Potentials of Crops in Oxygen-Limited Soil Environments. Advances in Agronomy. Vol. 88. pp. 313–377. doi:10.1016/S0065-2113(05)88008-3. ISBN 978-0-12-000786-8.
- ^ «Hydrogen Peroxide for Plants and Garden». 7 September 2019. Archived from the original on 10 May 2021. Retrieved 10 May 2021.
- ^ «Effect of hydrogen peroxide spraying on Hydrocotyle ranunculoides». Archived from the original on 24 March 2020. Retrieved 10 May 2021.
- ^ «FDA Approves Additional Indications for 35% PEROX-AID (hydrogen peroxide) for Use in Certain Finfish». FDA. 26 July 2019. Archived from the original on 12 December 2019. Retrieved 19 December 2019.
- ^ Greene B, Baker D, Frazier W. «Hydrogen Peroxide Accidents and Incidents: What we can learn from history» (PDF). NASA. Archived (PDF) from the original on 6 April 2019. Retrieved 6 April 2019.
- ^ see Hans Marquardt, Lehrbuch der Toxikologie
- ^ «Material Compatibility with Hydrogen Peroxide». Archived from the original on 4 March 2016. Retrieved 3 March 2016.
- ^ «Hydrogen Peroxide Mouthwash is it Safe?». Archived from the original on 20 December 2013. Retrieved 30 October 2013.
- ^ a b c «Occupational Safety and Health Guideline for Hydrogen Peroxide». Archived from the original on 13 May 2013.
- ^ For example, see an MSDS for a 3% peroxide solution Archived 15 April 2012 at the Wayback Machine.
- ^ H2O2 toxicity and dangers Archived 5 June 2012 at the Wayback Machine Agency for Toxic Substances and Disease Registry website
- ^ CRC Handbook of Chemistry and Physics, 76th Ed, 1995–1996
- ^ «CDC – Immediately Dangerous to Life or Health Concentrations (IDLH): Chemical Listing and Documentation of Revised IDLH Values – NIOSH Publications and Products». 25 October 2017. Archived from the original on 17 November 2012. Retrieved 20 October 2018.
- ^ «Threshold Limit Values for Chemical Substances and Physical Agents & Biological Exposure Indices, ACGIH» (PDF). Archived from the original (PDF) on 2 June 2013.
- ^ «ATSDR – Redirect – MMG: Hydrogen Peroxide». Archived from the original on 3 March 2016. Retrieved 3 March 2016.
- ^ Wilgus TA, Bergdall VK, Dipietro LA, Oberyszyn TM (2005). «Hydrogen peroxide disrupts scarless fetal wound repair». Wound Repair and Regeneration. 13 (5): 513–519. doi:10.1111/j.1067-1927.2005.00072.x. PMID 16176460. S2CID 1028923.
- ^ Urban MV, Rath T, Radtke C (June 2019). «Hydrogen peroxide (H2O2): a review of its use in surgery». Wiener Medizinische Wochenschrift. 169 (9–10): 222–225. doi:10.1007/s10354-017-0610-2. PMID 29147868. S2CID 35739209.
- ^ «Cleveleand Clinic: What Is Hydrogen Peroxide Good For?». December 2021. Retrieved 25 August 2022.
{{cite web}}: CS1 maint: url-status (link) - ^ see e.g. Detlev Heidemann, Endodontie, Urban&Fischer 2001
- ^ Douglass WC (1995). Hydrogen peroxide : medical miracle. Atlanta, GA: Second Opinion Pub. ISBN 978-1-885236-07-4.
- ^ a b Hydrogen Peroxide, 3%. 3. Hazards Identification Southeast Fisheries Science Center, daughter agency of NOAA.
- ^ a b «Questionable methods of cancer management: hydrogen peroxide and other ‘hyperoxygenation’ therapies». CA: A Cancer Journal for Clinicians. 43 (1): 47–56. 1993. doi:10.3322/canjclin.43.1.47. PMID 8422605. S2CID 36911297.
- ^ a b Cooper A (12 January 2005). «A Prescription for Death?». CBS News. Archived from the original on 17 July 2007. Retrieved 7 July 2007.
- ^ a b Mikkelson B (30 April 2006). «Hydrogen Peroxide». Snopes.com. Archived from the original on 15 February 2022. Retrieved 7 July 2007.
- ^ a b «Naturopath Sentenced For Injecting Teen With Hydrogen Peroxide – 7NEWS Denver». Thedenverchannel.com. 27 March 2006. Archived from the original on 20 March 2014. Retrieved 14 February 2015.
- ^ Halliwell B (January 2007). «Oxidative stress and cancer: have we moved forward?». The Biochemical Journal. 401 (1): 1–11. doi:10.1042/BJ20061131. PMID 17150040. S2CID 850978. Archived from the original on 15 February 2022. Retrieved 30 November 2019.
- ^ French LK, Horowitz BZ, McKeown NJ (July 2010). «Hydrogen peroxide ingestion associated with portal venous gas and treatment with hyperbaric oxygen: a case series and review of the literature». Clinical Toxicology. 48 (6): 533–538. doi:10.3109/15563650.2010.492526. PMID 20575671. S2CID 25148041. Archived from the original on 4 January 2022. Retrieved 4 January 2022.
- ^ «Heeresversuchsstelle Kummersdorf». UrbEx | Forgotten & Abandoned. 23 March 2008. Archived from the original on 29 June 2018. Retrieved 1 June 2018.
- ^ «The Nazi Doctors: Medical Killing and the Psychology of Genocide». Robert Jay Lifton. Archived from the original on 27 June 2018. Retrieved 26 June 2018.
- ^ «Explosion and fire in a hydrogen peroxide plant». ARIA. November 2007. Archived from the original on 14 February 2022.
- ^ «Accident No: DCA-99-MZ-001» (PDF). U.S. National Transportation Safety Board. Archived (PDF) from the original on 3 November 2015. Retrieved 30 October 2015.
- ^ Mizokami K (28 September 2018). «The True Story of the Russian Kursk Submarine Disaster». Archived from the original on 14 February 2022.
- ^ Wheaton S (16 August 2010). «Bleach Spill Shuts Part of Times Square». The New York Times. Archived from the original on 1 December 2017. Retrieved 24 February 2017.
Bibliography
- DrabowiczJ, et al. (1994). Capozzi G, et al. (eds.). The Syntheses of Sulphones, Sulphoxides and Cyclic Sulphides. Chichester UK: John Wiley & Sons. pp. 112–6. ISBN 978-0-471-93970-2.
- Greenwood NN, Earnshaw A (1997). Chemistry of the Elements (2nd ed.). Oxford UK: Butterworth-Heinemann. A great description of properties & chemistry of H2O2.
- March J (1992). Advanced Organic Chemistry (4th ed.). New York: Wiley. p. 723.
- Hess WT (1995). «Hydrogen Peroxide». Kirk-Othmer Encyclopedia of Chemical Technology. Vol. 13 (4th ed.). New York: Wiley. pp. 961–995.
External links[edit]
- Hydrogen Peroxide at The Periodic Table of Videos (University of Nottingham)
- Material Safety Data Sheet
- ATSDR Agency for Toxic Substances and Disease Registry FAQ
- International Chemical Safety Card 0164
- NIOSH Pocket Guide to Chemical Hazards
- Process flow sheet of Hydrogen Peroxide Production by anthrahydroquinone autoxidation
- Hydrogen Peroxide Handbook by Rocketdyne
- IR spectroscopic study J. Phys. Chem.

ball stick model of the hydrogen peroxide molecule |
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Hydrogen peroxide |
||
| Other names
Dioxidane |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.878 |
|
| EC Number |
|
|
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 2015 (>60% soln.) 2014 (20–60% soln.) 2984 (8–20% soln.) |
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
H2O2 | |
| Molar mass | 34.0147 g/mol | |
| Appearance | Very light blue liquid | |
| Odor | slightly sharp | |
| Density | 1.11 g/cm3 (20 °C, 30% (w/w) solution)[1] 1.450 g/cm3 (20 °C, pure) |
|
| Melting point | −0.43 °C (31.23 °F; 272.72 K) | |
| Boiling point | 150.2 °C (302.4 °F; 423.3 K) (decomposes) | |
|
Solubility in water |
Miscible | |
| Solubility | soluble in ether, alcohol insoluble in petroleum ether |
|
| log P | -0.43[2] | |
| Vapor pressure | 5 mmHg (30 °C)[3] | |
| Acidity (pKa) | 11.75 | |
|
Magnetic susceptibility (χ) |
−17.7·10−6 cm3/mol | |
|
Refractive index (nD) |
1.4061 | |
| Viscosity | 1.245 cP (20 °C) | |
|
Dipole moment |
2.26 D | |
| Thermochemistry | ||
|
Heat capacity (C) |
1.267 J/(g·K) (gas) 2.619 J/(g·K) (liquid) |
|
|
Std enthalpy of |
−187.80 kJ/mol | |
| Pharmacology | ||
|
ATC code |
A01AB02 (WHO) D08AX01 (WHO), D11AX25 (WHO), S02AA06 (WHO) | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
  
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H271, H302, H314, H332, H335, H412 | |
|
Precautionary statements |
P280, P305+P351+P338, P310 | |
| NFPA 704 (fire diamond) |
3 0 3 OX |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1518 mg/kg[citation needed] 2000 mg/kg (oral, mouse)[4] |
|
|
LC50 (median concentration) |
1418 ppm (rat, 4 hr)[4] | |
|
LCLo (lowest published) |
227 ppm (mouse)[4] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 ppm (1.4 mg/m3)[3] | |
|
REL (Recommended) |
TWA 1 ppm (1.4 mg/m3)[3] | |
|
IDLH (Immediate danger) |
75 ppm[3] | |
| Safety data sheet (SDS) | ICSC 0164 (>60% soln.) | |
| Related compounds | ||
|
Related compounds |
Water Ozone Hydrazine Hydrogen disulfide Dioxygen difluoride |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Hydrogen peroxide is a chemical compound with the formula H2O2. In its pure form, it is a very pale blue[5] liquid that is slightly more viscous than water. It is used as an oxidizer, bleaching agent, and antiseptic, usually as a dilute solution (3%–6% by weight) in water for consumer use, and in higher concentrations for industrial use. Concentrated hydrogen peroxide, or «high-test peroxide», decomposes explosively when heated and has been used as a propellant in rocketry.[6]
Hydrogen peroxide is a reactive oxygen species and the simplest peroxide, a compound having an oxygen–oxygen single bond. It decomposes slowly when exposed to light, and rapidly in the presence of organic or reactive compounds. It is typically stored with a stabilizer in a weakly acidic solution in a dark bottle to block light. Hydrogen peroxide is found in biological systems including the human body. Enzymes that use or decompose hydrogen peroxide are classified as peroxidases.
Properties[edit]
The boiling point of H2O2 has been extrapolated as being 150.2 °C (302.4 °F), approximately 50 °C (90 °F) higher than water. In practice, hydrogen peroxide will undergo potentially explosive thermal decomposition if heated to this temperature. It may be safely distilled at lower temperatures under reduced pressure.[7]
Structure[edit]
Structure and dimensions of
H2O2 in the gas phase
Structure and dimensions of
H2O2 in the solid (crystalline) phase
Hydrogen peroxide (H2O2) is a nonplanar molecule with (twisted) C2 symmetry; this was first shown by Paul-Antoine Giguère in 1950 using infrared spectroscopy.[8][9] Although the O−O bond is a single bond, the molecule has a relatively high rotational barrier of 386 cm−1 (4.62 kJ/mol) for rotation between enantiomers via the trans configuration, and 2460 cm−1 (29.4 kJ/mol) via the cis configuration.[10] These barriers are proposed to be due to repulsion between the lone pairs of the adjacent oxygen atoms and dipolar effects between the two O–H bonds. For comparison, the rotational barrier for ethane is 1040 cm−1 (12.4 kJ/mol).
The approximately 100° dihedral angle between the two O–H bonds makes the molecule chiral. It is the smallest and simplest molecule to exhibit enantiomerism. It has been proposed that the enantiospecific interactions of one rather than the other may have led to amplification of one enantiomeric form of ribonucleic acids and therefore an origin of homochirality in an RNA world.[11]
The molecular structures of gaseous and crystalline H2O2 are significantly different. This difference is attributed to the effects of hydrogen bonding, which is absent in the gaseous state.[12] Crystals of H2O2 are tetragonal with the space group D4
4 or P41212.[13]
Aqueous solutions[edit]
In aqueous solutions, hydrogen peroxide differs from the pure substance due to the effects of hydrogen bonding between water and hydrogen peroxide molecules. Hydrogen peroxide and water form a eutectic mixture, exhibiting freezing-point depression down as low as -56 °C; pure water has a freezing point of 0 °C and pure hydrogen peroxide of -0.43 °C. The boiling point of the same mixtures is also depressed in relation with the mean of both boiling points (125.1 °C). It occurs at 114 °C. This boiling point is 14 °C greater than that of pure water and 36.2 °C less than that of pure hydrogen peroxide.[14]
Phase diagram of
H2O2 and water: Area above blue line is liquid. Dotted lines separate solid–liquid phases from solid–solid phases.
| H2O2 (w/w) | Density (g/cm3) |
Temp. (°C) |
|---|---|---|
| 3% | 1.0095 | 15 |
| 27% | 1.10 | 20 |
| 35% | 1.13 | 20 |
| 50% | 1.20 | 20 |
| 70% | 1.29 | 20 |
| 75% | 1.33 | 20 |
| 96% | 1.42 | 20 |
| 98% | 1.43 | 20 |
| 100% | 1.45 | 20 |
Comparison with analogues[edit]
Hydrogen peroxide has several structural analogues with HmX−XHn bonding arrangements (water also shown for comparison). It has the highest (theoretical) boiling point of this series (X = O, S, N, P). Its melting point is also fairly high, being comparable to that of hydrazine and water, with only hydroxylamine crystallising significantly more readily, indicative of particularly strong hydrogen bonding. Diphosphane and hydrogen disulfide exhibit only weak hydrogen bonding and have little chemical similarity to hydrogen peroxide. Structurally, the analogues all adopt similar skewed structures, due to repulsion between adjacent lone pairs.
| Name | Formula | Molar mass (g/mol) |
Melting point (°C) |
Boiling point (°C) |
|---|---|---|---|---|
| Water | HOH | 18.02 | 0.00 | 99.98 |
| Hydrogen peroxide | HOOH | 34.01 | −0.43 | 150.2* |
| Hydrogen disulfide | HSSH | 66.15 | −89.6 | 70.7 |
| Hydrazine | H2NNH2 | 32.05 | 2 | 114 |
| Hydroxylamine | NH2OH | 33.03 | 33 | 58* |
| Diphosphane | H2PPH2 | 65.98 | −99 | 63.5* |
Discovery[edit]
Alexander von Humboldt is sometimes said to have been the first to report the first synthetic peroxide, barium peroxide, in 1799 as a by-product of his attempts to decompose air, although this is disputed due to von Humboldt’s ambiguous wording.[15] Nineteen years later Louis Jacques Thénard recognized that this compound could be used for the preparation of a previously unknown compound, which he described as eau oxygénée («oxygenated water») – subsequently known as hydrogen peroxide.[16][17][18] Today, the term «oxygenated water» may appear on retail packaging referring to mixtures containing either water and hydrogen peroxide or water and dissolved oxygen. This could cause personal injury if the difference is not properly understood by the user.[19]
An improved version of Thénard’s process used hydrochloric acid, followed by addition of sulfuric acid to precipitate the barium sulfate byproduct. This process was used from the end of the 19th century until the middle of the 20th century.[20]
The bleaching effect of peroxides and their salts on natural dyes had been known since Thénard’s experiments in the 1820s, but early attempts of industrial production of peroxides failed. The first plant producing hydrogen peroxide was built in 1873 in Berlin. The discovery of the synthesis of hydrogen peroxide by electrolysis with sulfuric acid introduced the more efficient electrochemical method. It was first commercialized in 1908 in Weißenstein, Carinthia, Austria. The anthraquinone process, which is still used, was developed during the 1930s by the German chemical manufacturer IG Farben in Ludwigshafen. The increased demand and improvements in the synthesis methods resulted in the rise of the annual production of hydrogen peroxide from 35,000 tonnes in 1950, to over 100,000 tonnes in 1960, to 300,000 tonnes by 1970; by 1998 it reached 2.7 million tonnes.[21]
Early attempts failed to produce neat hydrogen peroxide. Anhydrous hydrogen peroxide was first obtained by vacuum distillation.[22]
Determination of the molecular structure of hydrogen peroxide proved to be very difficult. In 1892, the Italian physical chemist Giacomo Carrara (1864–1925) determined its molecular mass by freezing-point depression, which confirmed that its molecular formula is H2O2.[23] At least half a dozen hypothetical molecular structures seemed to be consistent with the available evidence.[24] In 1934, the English mathematical physicist William Penney and the Scottish physicist Gordon Sutherland proposed a molecular structure for hydrogen peroxide that was very similar to the presently accepted one.[25][26]
Previously, hydrogen peroxide was prepared industrially by hydrolysis of ammonium persulfate:
which was itself obtained by the electrolysis of a solution of ammonium bisulfate ([NH4]HSO4) in sulfuric acid:[27]
Production[edit]
Catalytic cycle for the anthraquinone process to produce hydrogen peroxide: an anthraquinone (right) is reduced using hydrogen to produce the corresponding anthrahydroquinone (left). This is oxidized using oxygen to produce hydrogen peroxide and recover anthraquinone.
Today, hydrogen peroxide is manufactured almost exclusively by the anthraquinone process, which was originally developed by BASF in 1939. It begins with the reduction of an anthraquinone (such as 2-ethylanthraquinone or the 2-amyl derivative) to the corresponding anthrahydroquinone, typically by hydrogenation on a palladium catalyst. In the presence of oxygen, the anthrahydroquinone then undergoes autoxidation: the labile hydrogen atoms of the hydroxy groups transfer to the oxygen molecule, to give hydrogen peroxide and regenerating the anthraquinone. Most commercial processes achieve oxidation by bubbling compressed air through a solution of the anthrahydroquinone, with the hydrogen peroxide then extracted from the solution and the anthraquinone recycled back for successive cycles of hydrogenation and oxidation.[28][29]
The net reaction for the anthraquinone-catalyzed process is :[28]
- H2 + O2 → H2O2
The economics of the process depend heavily on effective recycling of the extraction solvents, the hydrogenation catalyst and the expensive quinone.
ISO tank container for hydrogen peroxide transportation
A tank car designed for transporting hydrogen peroxide by rail
Other sources[edit]
Small, but detectable, amounts of hydrogen peroxide can be formed by several methods. Small amounts are formed by electrolysis of dilute acid around the cathode where hydrogen evolves if oxygen is bubbled around it. It is also produced by exposing water to ultraviolet rays from a mercury lamp, or an electric arc while confining it in a UV transparent vessel (e.g. quartz). It is detectable in ice water after burning a hydrogen gas stream aimed towards it and is also detectable on floating ice. Rapidly cooling humid air blown through an approximately 2,000 °C spark gap results in detectable amounts.[30]
A commercially viable process to produce hydrogen peroxide directly from the environment has been of interest for many years. Efficient direct synthesis is difficult to achieve, as the reaction of hydrogen with oxygen thermodynamically favours production of water. Systems for direct synthesis have been developed, most of which employ finely dispersed metal catalysts similar to those used for hydrogenation of organic substrates.[31][32] One economic obstacle has been that direct processes give a dilute solution uneconomic for transportation. None of these has yet reached a point where it can be used for industrial-scale synthesis.
Availability[edit]
Hydrogen peroxide is most commonly available as a solution in water. For consumers, it is usually available from pharmacies at 3 and 6 wt% concentrations. The concentrations are sometimes described in terms of the volume of oxygen gas generated; one milliliter of a 20-volume solution generates twenty milliliters of oxygen gas when completely decomposed. For laboratory use, 30 wt% solutions are most common. Commercial grades from 70% to 98% are also available, but due to the potential of solutions of more than 68% hydrogen peroxide to be converted entirely to steam and oxygen (with the temperature of the steam increasing as the concentration increases above 68%) these grades are potentially far more hazardous and require special care in dedicated storage areas. Buyers must typically allow inspection by commercial manufacturers.
In 1994, world production of H2O2 was around 1.9 million tonnes and grew to 2.2 million in 2006,[33] most of which was at a concentration of 70% or less. In that year, bulk 30% H2O2 sold for around 0.54 USD/kg, equivalent to US$1.50/kg (US$0.68/lb) on a «100% basis»[clarification needed].[28]
Natural occurrence[edit]
Hydrogen peroxide occurs in surface water, in groundwater, and in the atmosphere. It forms upon illumination or natural catalytic action by substances contained in water. Sea water contains 0.5 to 14 μg/L of hydrogen peroxide, freshwater 1 to 30 μg/L, and air 0.1 to 1 parts per billion.[21]
Reactions[edit]
Decomposition[edit]
Hydrogen peroxide decomposes to form water and oxygen with a ΔHo of –2884.5 kJ/kg[34] and a ΔS of 70.5 J/(mol·K):
The rate of decomposition increases with rise in temperature, concentration, and pH (H2O2 being unstable under alkaline conditions), with cool, dilute, and acidic solutions showing the best stability. Decomposition is catalysed by various redox-active ions or compounds, including most transition metals and their compounds (e.g. manganese dioxide (MnO2), silver, and platinum).[35] Certain metal ions, such as Fe2+ or Ti3+, can cause the decomposition to take a different path, with free radicals such as the hydroxyl radical (HO•) and hydroperoxyl (HOO•) being formed. Non-metallic catalysts include potassium iodide (KI), which reacts particularly rapidly and forms the basis of the elephant toothpaste demonstration. Hydrogen peroxide can also be decomposed biologically by the enzyme catalase. The decomposition of hydrogen peroxide liberates oxygen and heat; this can be dangerous, as spilling high-concentration hydrogen peroxide on a flammable substance can cause an immediate fire.
Redox reactions[edit]
The redox properties of hydrogen peroxide depend on pH as acidic conditions exacerbate the power of oxidizing agents and basic conditions exacerbate the power of reducing agents. As hydrogen peroxide exhibits ambivalent redox properties, being simultaneously an oxidizer or a reductant, its redox behavior immediately depends on pH.
In acidic solutions, H2O2 is a powerful oxidizer, stronger than chlorine, chlorine dioxide, and potassium permanganate. When used for cleaning laboratory glassware, a solution of hydrogen peroxide and sulfuric acid is referred to as Piranha solution.
H2O2 is a source of hydroxyl radicals (•OH), which are highly reactive.
| Oxidizing reagent |
Reduced product |
Oxidation potential (V) |
|---|---|---|
| F2 | HF | 3.0 |
| O3 | O2 | 2.1 |
| H2O2 | H2O | 1.8 |
| KMnO4 | MnO2 | 1.7 |
| ClO2 | HClO | 1.5 |
| Cl2 | Cl− | 1.4 |
In acidic solutions, Fe2+ is oxidized to Fe3+ (hydrogen peroxide acting as an oxidizing agent):
and sulfite (SO2−3) is oxidized to sulfate (SO2−4). However, potassium permanganate is reduced to Mn2+ by acidic H2O2.
[36]
Under alkaline conditions, however, some of these reactions reverse; for example, Mn2+ is oxidized to Mn4+ (as MnO2).
In basic solutions, hydrogen peroxide is a strong reductant and can reduce a variety of inorganic ions. When H2O2 acts as a reducing agent, oxygen gas is also produced. For example, hydrogen peroxide will reduce sodium hypochlorite and potassium permanganate, which is a convenient method for preparing oxygen in the laboratory:
Organic reactions[edit]
Hydrogen peroxide is frequently used as an oxidizing agent. Illustrative is oxidation of thioethers to sulfoxides:[37][38]
Alkaline hydrogen peroxide is used for epoxidation of electron-deficient alkenes such as acrylic acid derivatives,[39] and for the oxidation of alkylboranes to alcohols, the second step of hydroboration-oxidation. It is also the principal reagent in the Dakin oxidation process.
Precursor to other peroxide compounds[edit]
Hydrogen peroxide is a weak acid, forming hydroperoxide or peroxide salts with many metals.
It also converts metal oxides into the corresponding peroxides. For example, upon treatment with hydrogen peroxide, chromic acid (CrO3 and H2SO4) forms a blue peroxide CrO(O2)2.
This kind of reaction is used industrially to produce peroxoanions. For example, reaction with borax leads to sodium perborate, a bleach used in laundry detergents:
H2O2 converts carboxylic acids (RCO2H) into peroxy acids (RC(O)O2H), which are themselves used as oxidizing agents. Hydrogen peroxide reacts with acetone to form acetone peroxide and with ozone to form trioxidane. Hydrogen peroxide forms stable adducts with urea (Hydrogen peroxide — urea), sodium carbonate (sodium percarbonate) and other compounds.[40] An acid-base adduct with triphenylphosphine oxide is a useful «carrier» for H2O2 in some reactions.
Hydrogen peroxide is both an oxidizing agent and reducing agent. The oxidation of hydrogen peroxide by sodium hypochlorite yields singlet oxygen. The net reaction of a ferric ion with hydrogen peroxide is a ferrous ion and oxygen. This proceeds via single electron oxidation and hydroxyl radicals. This is used in some organic chemistry oxidations, e.g. in the Fenton’s reagent. Only catalytic quantities of iron ion is needed since peroxide also oxidizes ferrous to ferric ion. The net reaction of hydrogen peroxide and permanganate or manganese dioxide is manganous ion; however, until the peroxide is spent some manganese ions are reoxidized to make the reaction catalytic. This forms the basis for common monopropellant rockets.
Biological function[edit]
Hydrogen peroxide is formed in humans and other animals as a short-lived product in biochemical processes and is toxic to cells. The toxicity is due to oxidation of proteins, membrane lipids and DNA by the peroxide ions.[41] The class of biological enzymes called superoxide dismutase (SOD) is developed in nearly all living cells as an important antioxidant agent. They promote the disproportionation of superoxide into oxygen and hydrogen peroxide, which is then rapidly decomposed by the enzyme catalase to oxygen and water.[42]
Peroxisomes are organelles found in virtually all eukaryotic cells.[43] They are involved in the catabolism of very long chain fatty acids, branched chain fatty acids, D-amino acids, polyamines, and biosynthesis of plasmalogens, ether phospholipids critical for the normal function of mammalian brains and lungs.[44] Upon oxidation, they produce hydrogen peroxide in the following process catalyzed by flavin adenine dinucleotide (FAD):[45]
Catalase, another peroxisomal enzyme, uses this H2O2 to oxidize other substrates, including phenols, formic acid, formaldehyde, and alcohol, by means of a peroxidation reaction:
thus eliminating the poisonous hydrogen peroxide in the process.
This reaction is important in liver and kidney cells, where the peroxisomes neutralize various toxic substances that enter the blood. Some of the ethanol humans drink is oxidized to acetaldehyde in this way.[46] In addition, when excess H2O2 accumulates in the cell, catalase converts it to H2O through this reaction:
Another origin of hydrogen peroxide is the degradation of adenosine monophosphate which yields hypoxanthine. Hypoxanthine is then oxidatively catabolized first to xanthine and then to uric acid, and the reaction is catalyzed by the enzyme xanthine oxidase:[47]
Degradation of hypoxanthine through xanthine to uric acid to form hydrogen peroxide.
The degradation of guanosine monophosphate yields xanthine as an intermediate product which is then converted in the same way to uric acid with the formation of hydrogen peroxide.[47]
Eggs of sea urchin, shortly after fertilization by a sperm, produce hydrogen peroxide. It is then quickly dissociated to HO• radicals. The radicals serve as initiator of radical polymerization, which surrounds the eggs with a protective layer of polymer.[48]
The bombardier beetle has a device which allows it to shoot corrosive and foul-smelling bubbles at its enemies. The beetle produces and stores hydroquinone and hydrogen peroxide, in two separate reservoirs in the rear tip of its abdomen. When threatened, the beetle contracts muscles that force the two reactants through valved tubes into a mixing chamber containing water and a mixture of catalytic enzymes. When combined, the reactants undergo a violent exothermic chemical reaction, raising the temperature to near the boiling point of water. The boiling, foul-smelling liquid partially becomes a gas (flash evaporation) and is expelled through an outlet valve with a loud popping sound.[49][50][51]
Hydrogen peroxide is a signaling molecule of plant defense against pathogens.[52]
Hydrogen peroxide has roles as a signalling molecule in the regulation of a wide variety of biological processes.[53] The compound is a major factor implicated in the free-radical theory of aging, based on how readily hydrogen peroxide can decompose into a hydroxyl radical and how superoxide radical byproducts of cellular metabolism can react with ambient water to form hydrogen peroxide.[54] These hydroxyl radicals in turn readily react with and damage vital cellular components, especially those of the mitochondria.[55][56][57] At least one study has also tried to link hydrogen peroxide production to cancer.[58] These studies have frequently been quoted in fraudulent treatment claims.[citation needed]
The amount of hydrogen peroxide in biological systems can be assayed using a fluorometric assay.[59]
Uses[edit]
Bleaching[edit]
About 60% of the world’s production of hydrogen peroxide is used for pulp- and paper-bleaching.[33] The second major industrial application is the manufacture of sodium percarbonate and sodium perborate, which are used as mild bleaches in laundry detergents. Sodium percarbonate, which is an adduct of sodium carbonate and hydrogen peroxide, is the active ingredient in such laundry products as OxiClean and Tide laundry detergent. When dissolved in water, it releases hydrogen peroxide and sodium carbonate,[20] By themselves these bleaching agents are only effective at wash temperatures of 60 °C (140 °F) or above and so, often are used in conjunction with bleach activators, which facilitate cleaning at lower temperatures.
It has also been used as a flour bleaching agent and a tooth whitening agent.
Production of organic compounds[edit]
It is used in the production of various organic peroxides with dibenzoyl peroxide being a high volume example. Peroxy acids, such as peracetic acid and meta-chloroperoxybenzoic acid also are produced using hydrogen peroxide. Hydrogen peroxide has been used for creating organic peroxide-based explosives, such as acetone peroxide. It is used as an initiator in polymerizations.
Sewage treatment[edit]
Hydrogen peroxide is used in certain waste-water treatment processes to remove organic impurities. In advanced oxidation processing, the Fenton reaction[60][61] gives the highly reactive hydroxyl radical (•OH). This degrades organic compounds, including those that are ordinarily robust, such as aromatic or halogenated compounds.[62] It can also oxidize sulfur-based compounds present in the waste; which is beneficial as it generally reduces their odour.[63]
Disinfectant[edit]
Hydrogen peroxide may be used for the sterilization of various surfaces,[64] including surgical tools,[65] and may be deployed as a vapour (VHP) for room sterilization.[66] H2O2 demonstrates broad-spectrum efficacy against viruses, bacteria, yeasts, and bacterial spores.[67][68] In general, greater activity is seen against Gram-positive than Gram-negative bacteria; however, the presence of catalase or other peroxidases in these organisms may increase tolerance in the presence of lower concentrations.[69] Lower levels of concentration (3%) will work against most spores; higher concentrations (7 to 30%) and longer contact times will improve sporicidal activity.[68][70]
Hydrogen peroxide is seen as an environmentally safe alternative to chlorine-based bleaches, as it degrades to form oxygen and water and it is generally recognized as safe as an antimicrobial agent by the U.S. Food and Drug Administration (FDA).[71]
Propellant[edit]
High-concentration H2O2 is referred to as «high-test peroxide» (HTP). It can be used either as a monopropellant (not mixed with fuel) or as the oxidizer component of a bipropellant rocket. Use as a monopropellant takes advantage of the decomposition of 70–98% concentration hydrogen peroxide into steam and oxygen. The propellant is pumped into a reaction chamber, where a catalyst, usually a silver or platinum screen, triggers decomposition, producing steam at over 600 °C (1,100 °F), which is expelled through a nozzle, generating thrust. H2O2 monopropellant produces a maximal specific impulse (Isp) of 161 s (1.6 kN·s/kg). Peroxide was the first major monopropellant adopted for use in rocket applications. Hydrazine eventually replaced hydrogen-peroxide monopropellant thruster applications primarily because of a 25% increase in the vacuum specific impulse.[72] Hydrazine (toxic) and hydrogen peroxide (less-toxic [ACGIH TLV 0.01 and 1 ppm respectively]) are the only two monopropellants (other than cold gases) to have been widely adopted and utilized for propulsion and power applications.[citation needed] The Bell Rocket Belt, reaction control systems for X-1, X-15, Centaur, Mercury, Little Joe, as well as the turbo-pump gas generators for X-1, X-15, Jupiter, Redstone and Viking used hydrogen peroxide as a monopropellant.[73]
As a bipropellant, H2O2 is decomposed to burn a fuel as an oxidizer. Specific impulses as high as 350 s (3.5 kN·s/kg) can be achieved, depending on the fuel. Peroxide used as an oxidizer gives a somewhat lower Isp than liquid oxygen, but is dense, storable, non-cryogenic and can be more easily used to drive gas turbines to give high pressures using an efficient closed cycle. It may also be used for regenerative cooling of rocket engines. Peroxide was used very successfully as an oxidizer in World War II German rocket motors (e.g. T-Stoff, containing oxyquinoline stabilizer, for both the Walter HWK 109-500 Starthilfe RATO externally podded monopropellant booster system, and for the Walter HWK 109-509 rocket motor series used for the Me 163B), most often used with C-Stoff in a self-igniting hypergolic combination, and for the low-cost British Black Knight and Black Arrow launchers. Presently, HTP is used on ILR-33 AMBER[74] and Nucleus[75] suborbital rockets.
In the 1940s and 1950s, the Hellmuth Walter KG–conceived turbine used hydrogen peroxide for use in submarines while submerged; it was found to be too noisy and require too much maintenance compared to diesel-electric power systems. Some torpedoes used hydrogen peroxide as oxidizer or propellant. Operator error in the use of hydrogen-peroxide torpedoes was named as possible causes for the sinking of HMS Sidon and the Russian submarine Kursk.[76] SAAB Underwater Systems is manufacturing the Torpedo 2000. This torpedo, used by the Swedish Navy, is powered by a piston engine propelled by HTP as an oxidizer and kerosene as a fuel in a bipropellant system.[77][78]
Household use[edit]
Contact lenses soaking in a 3% hydrogen peroxide-based solution. The case includes a catalytic disc which neutralises the hydrogen peroxide over time.
Hydrogen peroxide has various domestic uses, primarily as a cleaning and disinfecting agent.
- Hair bleaching
Diluted H2O2 (between 1.9% and 12%) mixed with aqueous ammonia has been used to bleach human hair. The chemical’s bleaching property lends its name to the phrase «peroxide blonde».[79]
Hydrogen peroxide is also used for tooth whitening. It may be found in most whitening toothpastes. Hydrogen peroxide has shown positive results involving teeth lightness and chroma shade parameters.[80] It works by oxidizing colored pigments onto the enamel where the shade of the tooth may become lighter.[further explanation needed] Hydrogen peroxide may be mixed with baking soda and salt to make a homemade toothpaste.[81]
- Removal of blood stains
Hydrogen peroxide reacts with blood as a bleaching agent, and so if a blood stain is fresh, or not too old, liberal application of hydrogen peroxide, if necessary in more than single application, will bleach the stain fully out. After about two minutes of the application, the blood should be firmly blotted out.[82][83]
- Acne treatment
Hydrogen peroxide may be used to treat acne,[84] although benzoyl peroxide is a more common treatment.
Niche uses[edit]
- Glow sticks
Hydrogen peroxide reacts with certain di-esters, such as phenyl oxalate ester (cyalume), to produce chemiluminescence; this application is most commonly encountered in the form of glow sticks.
- Horticulture
Some horticulturalists and users of hydroponics advocate the use of weak hydrogen peroxide solution in watering solutions. Its spontaneous decomposition releases oxygen that enhances a plant’s root development and helps to treat root rot (cellular root death due to lack of oxygen) and a variety of other pests.[85][86]
For general watering concentrations around 0.1% is in use and this can be increased up to one percent for anti-fungal actions.[87] Tests show that plant foliage can safely tolerate concentrations up to 3%.[88]
- Fishkeeping
Hydrogen peroxide is used in aquaculture for controlling mortality caused by various microbes. In 2019, the U.S. FDA approved it for control of Saprolegniasis in all coldwater finfish and all fingerling and adult coolwater and warmwater finfish, for control of external columnaris disease in warm-water finfish, and for control of Gyrodactylus spp. in freshwater-reared salmonids.[89] Laboratory tests conducted by fish culturists have demonstrated that common household hydrogen peroxide may be used safely to provide oxygen for small fish. The hydrogen peroxide releases oxygen by decomposition when it is exposed to catalysts such as manganese dioxide.
- Removing yellowing from aged plastics
Hydrogen peroxide may be used in combination with a UV-light source to remove yellowing from white or light grey acrylonitrile butadiene styrene (ABS) plastics to partially or fully restore the original color. In the retrocomputing scene, this process is commonly referred to as retr0bright.
Safety[edit]
Skin shortly after exposure to 35%
H2O2
Regulations vary, but low concentrations, such as 5%, are widely available and legal to buy for medical use. Most over-the-counter peroxide solutions are not suitable for ingestion. Higher concentrations may be considered hazardous and typically are accompanied by a safety data sheet (SDS). In high concentrations, hydrogen peroxide is an aggressive oxidizer and will corrode many materials, including human skin. In the presence of a reducing agent, high concentrations of H2O2 will react violently.[90]
While concentrations up to 35% produce only «white» oxygen bubbles in the skin (and some biting pain) that disappear with the blood within 30-45 minutes concentrations of 98% dissolve paper. However concentrations as low as 3% can be dangerous for the eye because of oxygen evolution within the eye.[91]
High-concentration hydrogen peroxide streams, typically above 40%, should be considered hazardous due to concentrated hydrogen peroxide’s meeting the definition of a DOT oxidizer according to U.S. regulations, if released into the environment. The EPA Reportable Quantity (RQ) for D001 hazardous wastes is 100 pounds (45 kg), or approximately 10 US gallons (38 L), of concentrated hydrogen peroxide.
Hydrogen peroxide should be stored in a cool, dry, well-ventilated area and away from any flammable or combustible substances. It should be stored in a container composed of non-reactive materials such as stainless steel or glass (other materials including some plastics and aluminium alloys may also be suitable).[92] Because it breaks down quickly when exposed to light, it should be stored in an opaque container, and pharmaceutical formulations typically come in brown bottles that block light.[93]
Hydrogen peroxide, either in pure or diluted form, may pose several risks, the main one being that it forms explosive mixtures upon contact with organic compounds.[94] Distillation of hydrogen peroxide at normal pressures is highly dangerous. It is also corrosive, especially when concentrated, but even domestic-strength solutions may cause irritation to the eyes, mucous membranes, and skin.[95] Swallowing hydrogen peroxide solutions is particularly dangerous, as decomposition in the stomach releases large quantities of gas (ten times the volume of a 3% solution), leading to internal bloating. Inhaling over 10% can cause severe pulmonary irritation.[96]
With a significant vapour pressure (1.2 kPa at 50 °C),[97] hydrogen-peroxide vapour is potentially hazardous. According to U.S. NIOSH, the immediately dangerous to life and health (IDLH) limit is only 75 ppm.[98] The U.S. Occupational Safety and Health Administration (OSHA) has established a permissible exposure limit of 1.0 ppm calculated as an 8-hour time-weighted average (29 CFR 1910.1000, Table Z-1).[94] Hydrogen peroxide also has been classified by the American Conference of Governmental Industrial Hygienists (ACGIH) as a «known animal carcinogen, with unknown relevance on humans».[99] For workplaces where there is a risk of exposure to the hazardous concentrations of the vapours, continuous monitors for hydrogen peroxide should be used. Information on the hazards of hydrogen peroxide is available from OSHA[94] and from the ATSDR.[100]
Wound healing[edit]
Historically, hydrogen peroxide was used for disinfecting wounds, partly because of its low cost and prompt availability compared to other antiseptics.[101]
There is conflicting evidence on hydrogen peroxide’s effect on wound healing. Some research finds benefit, while other research find delays and healing inhibition.[102] Its use for home treatment of wounds is generally contraindicated.[103]
1.5%-3% Hydrogen peroxide is used as a desinfectant in dentistry, especially in endodotic treatments together with hypochlorite and chlorhexidin and 1-1.5% is also useful for treatment of inflammation of third molars (wisdom teeth).[104]
Use in alternative medicine[edit]
Practitioners of alternative medicine have advocated the use of hydrogen peroxide for various conditions, including emphysema, influenza, AIDS, and in particular cancer.[105] There is no evidence of effectiveness and in some cases it has proved fatal.[106][107][108][109][110]
Both the effectiveness and safety of hydrogen peroxide therapy is scientifically questionable. Hydrogen peroxide is produced by the immune system, but in a carefully controlled manner. Cells called phagocytes engulf pathogens and then use hydrogen peroxide to destroy them. The peroxide is toxic to both the cell and the pathogen and so is kept within a special compartment, called a phagosome. Free hydrogen peroxide will damage any tissue it encounters via oxidative stress, a process that also has been proposed as a cause of cancer.[111]
Claims that hydrogen peroxide therapy increases cellular levels of oxygen have not been supported. The quantities administered would be expected to provide very little additional oxygen compared to that available from normal respiration. It is also difficult to raise the level of oxygen around cancer cells within a tumour, as the blood supply tends to be poor, a situation known as tumor hypoxia.
Large oral doses of hydrogen peroxide at a 3% concentration may cause irritation and blistering to the mouth, throat, and abdomen as well as abdominal pain, vomiting, and diarrhea.[106] Ingestion of hydrogen peroxide at concentrations of 35% or higher has been implicated as the cause of numerous gas embolism events resulting in hospitalisation. In these cases, hyperbaric oxygen therapy was used to treat the embolisms.[112]
Intravenous injection of hydrogen peroxide has been linked to several deaths.[108][109][110]
The American Cancer Society states that «there is no scientific evidence that hydrogen peroxide is a safe, effective, or useful cancer treatment.»[107] Furthermore, the therapy is not approved by the U.S. FDA.
Historical incidents[edit]
- On 16 July 1934, in Kummersdorf, Germany, a propellant tank containing an experimental monopropellant mixture consisting of hydrogen peroxide and ethanol exploded during a test, killing three people.[113]
- During the Second World War, doctors in German concentration camps experimented with the use of hydrogen peroxide injections in the killing of human subjects.[114]
- In April 1992, an explosion occurred at the hydrogen peroxide plant at Jarrie in France, due to technical failure of the computerised control system and resulting in one fatality and wide destruction of the plant.[115]
- Several people received minor injuries after a hydrogen peroxide spill on board a flight between the U.S. cities of Orlando and Memphis on 28 October 1998.[116]
- The Russian submarine K-141 Kursk sailed to perform an exercise of firing dummy torpedoes at the Pyotr Velikiy, a Kirov-class battlecruiser. On 12 August 2000, at 11:28 local time (07:28 UTC), there was an explosion while preparing to fire the torpedoes. The only credible report to date is that this was due to the failure and explosion of one of the Kursk’s hydrogen peroxide-fueled torpedoes. It is believed that HTP, a form of highly concentrated hydrogen peroxide used as propellant for the torpedo, seeped through its container, damaged either by rust or in the loading procedure back on land where an incident involving one of the torpedoes accidentally touching ground went unreported. The vessel was lost with all hands. A similar incident was responsible for the loss of HMS Sidon in 1955.[117]
- On 15 August 2010, a spill of about 30 US gallons (110 L) of cleaning fluid occurred on the 54th floor of 1515 Broadway, in Times Square, New York City. The spill, which a spokesperson for the New York City fire department said was of hydrogen peroxide, shut down Broadway between West 42nd and West 48th streets as fire engines responded to the hazmat situation. There were no reported injuries.[118]
See also[edit]
- FOX reagent, used to measure levels of hydrogen peroxide in biological systems
- Hydrogen chalcogenide
- Retrobright, a process using hydrogen peroxide to restore yellowed Acrylonitrile butadiene styrene plastic
References[edit]
Notes
- ^ Easton MF, Mitchell AG, Wynne-Jones WF (1952). «The behaviour of mixtures of hydrogen peroxide and water. Part 1.—Determination of the densities of mixtures of hydrogen peroxide and water». Transactions of the Faraday Society. 48: 796–801. doi:10.1039/TF9524800796. S2CID 96669623. Archived from the original on 15 February 2022. Retrieved 30 November 2019.
- ^ «Hydrogen peroxide». www.chemsrc.com. Archived from the original on 8 August 2017. Retrieved 3 May 2018.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0335». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c «Hydrogen peroxide». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Housecroft CE, Sharpe AG (2005). Inorganic Chemistry (2nd ed.). Pearson Prentice-Hall. p. 443. ISBN 0130-39913-2.
- ^ Hill CN (2001). A Vertical Empire: The History of the UK Rocket launch and Space Programme, 1950–1971. Imperial College Press. ISBN 978-1-86094-268-6. Archived from the original on 13 April 2021. Retrieved 24 August 2020.
- ^ Brauer G, ed. (1963). Handbook of preparative inorganic chemistry. Vol. 1. Translation editing by Reed F. (2nd ed.). New York: Academic Press. p. 140. ISBN 978-0-12-126601-1.
- ^ Giguère PA (1950). «The Infra‐Red Spectrum of Hydrogen Peroxide» (PDF). Journal of Chemical Physics. 18 (1): 88. Bibcode:1950JChPh..18…88G. doi:10.1063/1.1747464. Archived (PDF) from the original on 2 December 2017. Retrieved 31 December 2018.
- ^ Giguère PA (1983). «Molecular association and structure of hydrogen peroxide». Journal of Chemical Education. 60 (5): 399–401. Bibcode:1983JChEd..60..399G. doi:10.1021/ed060p399.
- ^ Hunt RH, Leacock RA, Peters CW, Hecht KT (1965). «Internal-Rotation in Hydrogen Peroxide: The Far-Infrared Spectrum and the Determination of the Hindering Potential» (PDF). The Journal of Chemical Physics. 42 (6): 1931. Bibcode:1965JChPh..42.1931H. doi:10.1063/1.1696228. hdl:2027.42/71115. Archived (PDF) from the original on 9 April 2014. Retrieved 9 April 2014.
- ^ Ball R, Brindley J (March 2016). «The Life Story of Hydrogen Peroxide III: Chirality and Physical Effects at the Dawn of Life». Origins of Life and Evolution of the Biosphere. 46 (1): 81–93. Bibcode:2016OLEB…46…81B. doi:10.1007/s11084-015-9465-y. PMID 26399407. S2CID 9564774.
- ^ Dougherty DA, Anslyn EV (2005). Modern Physical Organic Chemistry. University Science. p. 122. ISBN 978-1-891389-31-3.
- ^ Abrahams SC, Collin RL, Lipscomb WN (1 January 1951). «The crystal structure of hydrogen peroxide». Acta Crystallographica. 4 (1): 15–20. doi:10.1107/S0365110X51000039.
- ^ «Hydrogen Peroxide Technical Library» (PDF). Archived from the original (PDF) on 29 December 2009. Retrieved 3 March 2016.
- ^ Flohé L (December 2020). «Looking Back at the Early Stages of Redox Biology». Antioxidants. 9 (12): 1254. doi:10.3390/antiox9121254. PMC 7763103. PMID 33317108.
I checked Humboldt’s pertinent publication carefully, but was unable to find an unambiguous proof of this assumption; the description of the starting materials (“Alaun-Erden” or “schwere Erden”) were just too unprecise to understand what kind of chemical experiments he performed.
- ^ Gilbert LW (1820). «Der tropfbar flüssige Sauerstoff, oder das oxygenierte Wasser». Annals of Physics (in German). 65–66 (1): 3. Bibcode:1820AnP….64….1T. doi:10.1002/andp.18200640102.
- ^ Thénard LJ (1818). «Observations sur des nouvelles combinaisons entre l’oxigène et divers acides». Annales de chimie et de physique. 2nd series. 8: 306–312. Archived from the original on 3 September 2016. Retrieved 9 February 2016.
- ^ Giguère PA. «Hydrogen peroxide». Access Science. McGraw-Hill Education. doi:10.1036/1097-8542.329200. Archived from the original on 30 November 2018. Retrieved 28 November 2018.
Hydrogen peroxide was discovered in 1818 by the French chemist Louis-Jacques Thenard, who named it eau oxygénée (oxygenated water).
- ^ Preiato D (5 March 2020). «What is oxygenated water?». Healthline. Healthline Media. Archived from the original on 31 October 2020. Retrieved 23 September 2020.
- ^ a b Jones CW, Clark JH (1999). Applications of Hydrogen Peroxide and Derivatives. Royal Society of Chemistry. ISBN 978-0-85404-536-5.
- ^ a b Offermanns H, Dittrich G, Steiner N (2000). «Wasserstoffperoxid in Umweltschutz und Synthese». Chemie in unserer Zeit. 34 (3): 150. doi:10.1002/1521-3781(200006)34:3<150::AID-CIUZ150>3.0.CO;2-A.
- ^ Wolffenstein R (October 1894). «Concentration und Destillation von Wasserstoffsuperoxyd». Berichte der Deutschen Chemischen Gesellschaft (in German). 27 (3): 3307–3312. doi:10.1002/cber.189402703127. Archived from the original on 13 February 2016. Retrieved 29 June 2014.
- ^ Carrara G (1892). «Sul peso molecolare e sul potere rifrangente dell’ acqua ossigenata» [On the molecular weight and on the refracting power of hydrogen peroxide]. Atti della Reale Accademia dei Lincei. 1 (2): 19–24. Archived from the original on 4 September 2016.
Carrara’s findings were confirmed by: W. R. Orndorff and John White (1893) «The molecular weight of hydrogen peroxide and of benzoyl peroxide,» Archived 4 September 2016 at the Wayback Machine American Chemical Journal, 15 : 347–356. - ^ See, for example:
- In 1882, Kingzett proposed as a structure H2O=O. See: Kingzett T (29 September 1882). «On the activity of oxygen and the mode of formation of hydrogen dioxide». The Chemical News. 46 (1192): 141–142. Archived from the original on 3 September 2016. Retrieved 9 February 2016.
- In his 1922 textbook, Joseph Mellor considered three hypothetical molecular structures for hydrogen peroxide, admitting (p. 952): «… the constitution of this compound has not been yet established by unequivocal experiments». See: Joseph William Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry, vol. 1 (London, England: Longmans, Green and Co., 1922), p. 952–956. Archived 3 September 2016 at the Wayback Machine
- W. C. Schumb, C. N. Satterfield, and R. L. Wentworth (1 December 1953) «Report no. 43: Hydrogen peroxide, Part two» Archived 26 February 2015 at the Wayback Machine, Office of Naval Research, Contract No. N5ori-07819 On p. 178, the authors present six hypothetical models for hydrogen peroxide’s molecular structure. On p. 184, the present structure is considered almost certainly correct—although a small doubt remained. (Note: The report by Schumb et al. was reprinted as: W. C. Schumb, C. N. Satterfield, and R. L. Wentworth, Hydrogen Peroxide (New York, New York: Reinhold Publishing Corp. (American Chemical Society Monograph), 1955).)
- ^ Penney WG, Sutherland GB (1934). «The theory of the structure of hydrogen peroxide and hydrazine». Journal of Chemical Physics. 2 (8): 492–498. Bibcode:1934JChPh…2..492P. doi:10.1063/1.1749518.
- ^ Penney WG, Sutherland GB (1934). «A note on the structure of H2O2 and H4N2 with particular reference to electric moments and free rotation». Transactions of the Faraday Society. 30: 898–902. doi:10.1039/tf934300898b.
- ^ «Preparing to manufacture hydrogen peroxide» (PDF). IDC Technologies. Archived (PDF) from the original on 3 August 2021. Retrieved 14 February 2022.
- ^ a b c Campos-Martin JM, Blanco-Brieva G, Fierro JL (October 2006). «Hydrogen peroxide synthesis: an outlook beyond the anthraquinone process». Angewandte Chemie. 45 (42): 6962–6984. doi:10.1002/anie.200503779. PMID 17039551. S2CID 23286196.
- ^ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (2 October 1936 in USA, and 10 October 1935 in Germany) to I. G. Farbenindustrie, Germany
- ^ Mellor JW (1922). Modern Inorganic Chemistry. Longmans, Green and Co. pp. 192–195.
- ^ Noritaka Mizuno Gabriele Centi, Siglinda Perathoner, Salvatore Abate «Direct Synthesis of Hydrogen Peroxide: Recent Advances» in Modern Heterogeneous Oxidation Catalysis: Design, Reactions and Characterization 2009, Wiley-VCH. doi:10.1002/9783527627547.ch8
- ^ Edwards JK, Solsona B, N EN, Carley AF, Herzing AA, Kiely CJ, Hutchings GJ (February 2009). «Switching off hydrogen peroxide hydrogenation in the direct synthesis process». Science. 323 (5917): 1037–1041. Bibcode:2009Sci…323.1037E. doi:10.1126/science.1168980. PMID 19229032. S2CID 1828874. Archived from the original on 15 February 2022. Retrieved 30 November 2019.
- ^ a b Hage R, Lienke A (December 2005). «Applications of transition-metal catalysts to textile and wood-pulp bleaching». Angewandte Chemie. 45 (2): 206–222. doi:10.1002/anie.200500525. PMID 16342123. Archived from the original on 25 January 2022. Retrieved 14 February 2022.
- ^ «Decomposition of Hydrogen Peroxide — Kinetics and Review of Chosen Catalysts» (PDF). Archived (PDF) from the original on 22 December 2018. Retrieved 30 August 2019.
- ^ Petrucci RH (2007). General Chemistry: Principles & Modern Applications (9th ed.). Prentice Hall. p. 606. ISBN 978-0-13-149330-8.
- ^ Housecroft CE, Sharpe AG (2005). Inorganic Chemistry (2nd ed.). Pearson Prentice-Hall. p. 444. ISBN 0130-39913-2.
- ^ Ravikumar KS, Kesavan V, Crousse B, Bonnet-Delpon D, Bégué JP (2003). «Mild and Selective Oxidation of Sulfur Compounds in Trifluoroethanol: Diphenyldisulfide and Methyl phenyl Sulfoxide». Org. Synth. 80: 184. doi:10.15227/orgsyn.080.0184.
- ^ Xu WL, Li YZ, Zhang QS, Zhu HS (2004). «A Selective, Convenient, and Efficient Conversion of Sulfides to Sulfoxides». Synthesis (2): 227–232. doi:10.1055/s-2004-44387.
- ^ Mayer RJ, Ofial AR (May 2018). «Nucleophilic Reactivities of Bleach Reagents». Organic Letters. 20 (10): 2816–2820. doi:10.1021/acs.orglett.8b00645. PMID 29741385.
- ^ Chernyshov IY, Vener MV, Prikhodchenko PV, Medvedev AG, Lev O, Churakov AV (4 January 2017). «Peroxosolvates: Formation Criteria, H2O2 Hydrogen Bonding, and Isomorphism with the Corresponding Hydrates». Crystal Growth & Design. 17 (1): 214–220. doi:10.1021/acs.cgd.6b01449. ISSN 1528-7483.
- ^ Löffler G. and Petrides, P. E. Physiologische Chemie. 4 ed., p. 288, Springer, Berlin 1988, ISBN 3-540-18163-6 (in German)
- ^ Löffler G. and Petrides, P. E. Physiologische Chemie. 4 ed., pp. 321–322, Springer, Berlin 1988, ISBN 3-540-18163-6 (in German)
- ^ Gabaldón T (March 2010). «Peroxisome diversity and evolution». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 365 (1541): 765–773. doi:10.1098/rstb.2009.0240. PMC 2817229. PMID 20124343.
- ^ Wanders RJ, Waterham HR (2006). «Biochemistry of mammalian peroxisomes revisited». Annual Review of Biochemistry. 75 (1): 295–332. doi:10.1146/annurev.biochem.74.082803.133329. PMID 16756494.
- ^ Nelson D, Cox C, Lehninger AL, Cox MM (2001). Lehninger Biochemie (in German). Springer. pp. 663–664. ISBN 3-540-41813-X. Archived from the original on 28 February 2017.
- ^ Riley, Edward P. et al. (ed.) Fetal Alcoholspectrum Disorder Fasd: Management and Policy Perspectives Archived 28 February 2017 at the Wayback Machine, Wiley-VCH, 2010, ISBN 3-527-32839-4 p. 112
- ^ a b Nelson, David; Cox, Michael; Lehninger, Albert L. and Cox, Michael M. Lehninger Biochemie, p. 932, Springer, 2001, ISBN 3-540-41813-X (in German)
- ^ Kröger M (1989). «History». Chemie in unserer Zeit. 23: 34–35. doi:10.1002/ciuz.19890230106.
- ^ Schildknecht H, Holoubek K (1961). «The bombardier beetle and its chemical explosion». Angewandte Chemie. 73: 1–7. doi:10.1002/ange.19610730102.
- ^ Weber CG (Winter 1981). «The Bombadier Beetle Myth Exploded». Creation/Evolution. 2 (1): 1–5. Archived from the original on 29 September 2017. Retrieved 12 November 2017.
- ^ Isaak M (30 May 2003). «Bombardier Beetles and the Argument of Design». TalkOrigins Archive. Archived from the original on 16 November 2017. Retrieved 12 November 2017.
- ^ «Wie Pflanzen sich schützen, Helmholtz-Institute of Biochemical Plant Pathology (in German)» (PDF) (in German). Helmholtz-Institute of Biochemical Plant Pathology. Archived from the original (PDF) on 23 July 2011. Retrieved 14 February 2022.
- ^ Veal EA, Day AM, Morgan BA (April 2007). «Hydrogen peroxide sensing and signaling». Molecular Cell. 26 (1): 1–14. doi:10.1016/j.molcel.2007.03.016. PMID 17434122.
- ^ Weindruch R (1 December 2006). «Calorie Restriction and Aging». Scientific American. Archived from the original on 14 February 2022. Retrieved 14 February 2022.
- ^ Giorgio M, Trinei M, Migliaccio E, Pelicci PG (September 2007). «Hydrogen peroxide: a metabolic by-product or a common mediator of ageing signals?». Nature Reviews. Molecular Cell Biology. 8 (9): 722–728. doi:10.1038/nrm2240. PMID 17700625. S2CID 6407526. Archived from the original on 15 February 2022. Retrieved 7 February 2020.
- ^ Gonzalez D, Bejarano I, Barriga C, Rodriguez AB, Pariente JA (2010). «Oxidative Stress-Induced Caspases are Regulated in Human Myeloid HL-60 Cells by Calcium Signal». Current Signal Transduction Therapy. 5 (2): 181–186. doi:10.2174/157436210791112172.
- ^ Bejarano I, Espino J, González-Flores D, Casado JG, Redondo PC, Rosado JA, et al. (September 2009). «Role of Calcium Signals on Hydrogen Peroxide-Induced Apoptosis in Human Myeloid HL-60 Cells». International Journal of Biomedical Science. 5 (3): 246–256. PMC 3614781. PMID 23675144.
- ^ López-Lázaro M (July 2007). «Dual role of hydrogen peroxide in cancer: possible relevance to cancer chemoprevention and therapy». Cancer Letters. 252 (1): 1–8. doi:10.1016/j.canlet.2006.10.029. PMID 17150302.
- ^ Rapoport R, Hanukoglu I, Sklan D (May 1994). «A fluorimetric assay for hydrogen peroxide, suitable for NAD(P)H-dependent superoxide generating redox systems». Analytical Biochemistry. 218 (2): 309–313. doi:10.1006/abio.1994.1183. PMID 8074285. S2CID 40487242. Archived from the original on 18 March 2020. Retrieved 1 July 2019.
- ^ Tarr MA, ed. (2003). Chemical degradation methods for wastes and pollutants environmental and industrial applications. New York: M. Dekker. p. 165. ISBN 978-0-203-91255-3.
- ^ Pignatello JJ, Oliveros E, MacKay A (January 2006). «Advanced Oxidation Processes for Organic Contaminant Destruction Based on the Fenton Reaction and Related Chemistry». Critical Reviews in Environmental Science and Technology. 36 (1): 1–84. doi:10.1080/10643380500326564. S2CID 93052585.
- ^ Pera-Titus M, Garcıa-Molina V, Baños MA, Giménez J, Esplugas S (February 2004). «Degradation of chlorophenols by means of advanced oxidation processes: a general review». Applied Catalysis B: Environmental. 47 (4): 219–256. doi:10.1016/j.apcatb.2003.09.010.
- ^ Goor G, Glenneberg J, Jacobi S (2007). «Hydrogen Peroxide». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a13_443.pub2. ISBN 978-3-527-30673-2.
- ^ Ascenzi JM, ed. (1996). Handbook of disinfectants and antiseptics. New York: M. Dekker. p. 161. ISBN 978-0-8247-9524-5.
- ^ Rutala WA, Weber DJ (September 2004). «Disinfection and sterilization in health care facilities: what clinicians need to know». Clinical Infectious Diseases. 39 (5): 702–709. doi:10.1086/423182. PMID 15356786.
- ^ Falagas ME, Thomaidis PC, Kotsantis IK, Sgouros K, Samonis G, Karageorgopoulos DE (July 2011). «Airborne hydrogen peroxide for disinfection of the hospital environment and infection control: a systematic review». The Journal of Hospital Infection. 78 (3): 171–177. doi:10.1016/j.jhin.2010.12.006. PMID 21392848.
- ^ Block SS, ed. (2000). «Chapter 9: Peroxygen compounds». Disinfection, sterilization, and preservation (5th ed.). Philadelphia: Lea & Febiger. pp. 185–204. ISBN 978-0-683-30740-5.
- ^ a b «Chemical Disinfectants | Disinfection & Sterilization Guidelines | Guidelines Library | Infection Control | CDC». www.cdc.gov. 4 April 2019. Archived from the original on 1 July 2017. Retrieved 12 April 2020.
- ^ McDonnell G, Russell AD (January 1999). «Antiseptics and disinfectants: activity, action, and resistance». Clinical Microbiology Reviews. 12 (1): 147–179. doi:10.1128/cmr.12.1.147. PMC 88911. PMID 9880479.
- ^ Block SS, ed. (2000). «Chapter 27: Chemical Sporicidal and Sporostatic Agents». Disinfection, sterilization, and preservation (5th ed.). Philadelphia: Lea & Febiger. pp. 529–543. ISBN 978-0-683-30740-5.
- ^ «Sec. 184.1366 Hydrogen peroxide». U.S. Government Printing Office via GPO Access. 1 April 2001. Archived from the original on 3 July 2007. Retrieved 7 July 2007.
- ^ Wernimont EJ (9–12 July 2006). System Trade Parameter Comparison of Monopropellants: Hydrogen Peroxide vs Hydrazine and Others (PDF). 42nd AIAA/ASME/SAE/ASEE Joint Propulsion Conference & Exhibit. Sacramento, California. Archived from the original (PDF) on 10 December 2014.
- ^ Ventura M, Mullens P (19 June 1999). «The Use of Hydrogen Peroxide for Propulsion and Power» (PDF). General Kinetics, LLC. Archived from the original (PDF) on 10 December 2014. Retrieved 10 December 2014.
- ^ Cieśliński D (2021). «Polish civil rockets’ development overview». Archived from the original on 6 February 2022. Retrieved 15 February 2022.
- ^ «Nucleus: A Very Different Way to Launch into Space». Nammo. Archived from the original on 6 February 2022. Retrieved 6 February 2022.
- ^ «Peroxide Accident – Walter Web Site». Histarmar.com.ar. Archived from the original on 10 December 2014. Retrieved 14 February 2015.
- ^ Scott R (November 1997). «Homing Instincts». Jane’s Navy Steam Generated by Catalytic Decomposition of 80–90% Hydrogen Peroxide Was Used for Driving the Turbopump Turbines of the V-2 Rockets, the X-15 Rocketplanes, the Early Centaur RL-10 Engines and is Still Used on Soyuz for That Purpose Today. International. Archived from the original on 17 July 2011. Retrieved 12 May 2007.
- ^ «Soyuz using hydrogen peroxide propellant». NASA. Archived from the original on 5 August 2013.
- ^ Lane N (2003). Oxygen : the molecule that made the world (First issued in paperback, repr. ed.). Oxford: Oxford University Press. p. 117. ISBN 978-0-19-860783-0. Archived from the original on 13 April 2021. Retrieved 12 November 2020.
- ^ Sulieman M, Addy M, MacDonald E, Rees JS (May 2004). «The effect of hydrogen peroxide concentration on the outcome of tooth whitening: an in vitro study». Journal of Dentistry. Elsevier Ltd. 32 (4): 295–299. doi:10.1016/j.jdent.2004.01.003. PMID 15053912. Archived from the original on 15 February 2022. Retrieved 30 September 2021.
- ^ Shepherd S. «Brushing Up on Gum Disease». FDA Consumer. Archived from the original on 14 May 2007. Retrieved 7 July 2007.
- ^ Gibbs KB (14 November 2016). «How to remove blood stains from clothes and furniture». Today.com. Archived from the original on 20 May 2021. Retrieved 5 August 2021.
- ^ Mayntz M. «Dried Blood Stain Removal». Lovetoknow.com. Archived from the original on 17 August 2021. Retrieved 5 August 2021.
- ^ Capizzi R, Landi F, Milani M, Amerio P (August 2004). «Skin tolerability and efficacy of combination therapy with hydrogen peroxide stabilized cream and adapalene gel in comparison with benzoyl peroxide cream and adapalene gel in common acne. A randomized, investigator-masked, controlled trial». The British Journal of Dermatology. 151 (2): 481–484. doi:10.1111/j.1365-2133.2004.06067.x. PMID 15327558. S2CID 2611939.
- ^ «Ways to use Hydrogen Peroxide in the Garden». Using Hydrogen Peroxide. Archived from the original on 4 March 2016. Retrieved 3 March 2016.
- ^ Bhattarai SP, Su N, Midmore DJ (2005). Oxygation Unlocks Yield Potentials of Crops in Oxygen-Limited Soil Environments. Advances in Agronomy. Vol. 88. pp. 313–377. doi:10.1016/S0065-2113(05)88008-3. ISBN 978-0-12-000786-8.
- ^ «Hydrogen Peroxide for Plants and Garden». 7 September 2019. Archived from the original on 10 May 2021. Retrieved 10 May 2021.
- ^ «Effect of hydrogen peroxide spraying on Hydrocotyle ranunculoides». Archived from the original on 24 March 2020. Retrieved 10 May 2021.
- ^ «FDA Approves Additional Indications for 35% PEROX-AID (hydrogen peroxide) for Use in Certain Finfish». FDA. 26 July 2019. Archived from the original on 12 December 2019. Retrieved 19 December 2019.
- ^ Greene B, Baker D, Frazier W. «Hydrogen Peroxide Accidents and Incidents: What we can learn from history» (PDF). NASA. Archived (PDF) from the original on 6 April 2019. Retrieved 6 April 2019.
- ^ see Hans Marquardt, Lehrbuch der Toxikologie
- ^ «Material Compatibility with Hydrogen Peroxide». Archived from the original on 4 March 2016. Retrieved 3 March 2016.
- ^ «Hydrogen Peroxide Mouthwash is it Safe?». Archived from the original on 20 December 2013. Retrieved 30 October 2013.
- ^ a b c «Occupational Safety and Health Guideline for Hydrogen Peroxide». Archived from the original on 13 May 2013.
- ^ For example, see an MSDS for a 3% peroxide solution Archived 15 April 2012 at the Wayback Machine.
- ^ H2O2 toxicity and dangers Archived 5 June 2012 at the Wayback Machine Agency for Toxic Substances and Disease Registry website
- ^ CRC Handbook of Chemistry and Physics, 76th Ed, 1995–1996
- ^ «CDC – Immediately Dangerous to Life or Health Concentrations (IDLH): Chemical Listing and Documentation of Revised IDLH Values – NIOSH Publications and Products». 25 October 2017. Archived from the original on 17 November 2012. Retrieved 20 October 2018.
- ^ «Threshold Limit Values for Chemical Substances and Physical Agents & Biological Exposure Indices, ACGIH» (PDF). Archived from the original (PDF) on 2 June 2013.
- ^ «ATSDR – Redirect – MMG: Hydrogen Peroxide». Archived from the original on 3 March 2016. Retrieved 3 March 2016.
- ^ Wilgus TA, Bergdall VK, Dipietro LA, Oberyszyn TM (2005). «Hydrogen peroxide disrupts scarless fetal wound repair». Wound Repair and Regeneration. 13 (5): 513–519. doi:10.1111/j.1067-1927.2005.00072.x. PMID 16176460. S2CID 1028923.
- ^ Urban MV, Rath T, Radtke C (June 2019). «Hydrogen peroxide (H2O2): a review of its use in surgery». Wiener Medizinische Wochenschrift. 169 (9–10): 222–225. doi:10.1007/s10354-017-0610-2. PMID 29147868. S2CID 35739209.
- ^ «Cleveleand Clinic: What Is Hydrogen Peroxide Good For?». December 2021. Retrieved 25 August 2022.
{{cite web}}: CS1 maint: url-status (link) - ^ see e.g. Detlev Heidemann, Endodontie, Urban&Fischer 2001
- ^ Douglass WC (1995). Hydrogen peroxide : medical miracle. Atlanta, GA: Second Opinion Pub. ISBN 978-1-885236-07-4.
- ^ a b Hydrogen Peroxide, 3%. 3. Hazards Identification Southeast Fisheries Science Center, daughter agency of NOAA.
- ^ a b «Questionable methods of cancer management: hydrogen peroxide and other ‘hyperoxygenation’ therapies». CA: A Cancer Journal for Clinicians. 43 (1): 47–56. 1993. doi:10.3322/canjclin.43.1.47. PMID 8422605. S2CID 36911297.
- ^ a b Cooper A (12 January 2005). «A Prescription for Death?». CBS News. Archived from the original on 17 July 2007. Retrieved 7 July 2007.
- ^ a b Mikkelson B (30 April 2006). «Hydrogen Peroxide». Snopes.com. Archived from the original on 15 February 2022. Retrieved 7 July 2007.
- ^ a b «Naturopath Sentenced For Injecting Teen With Hydrogen Peroxide – 7NEWS Denver». Thedenverchannel.com. 27 March 2006. Archived from the original on 20 March 2014. Retrieved 14 February 2015.
- ^ Halliwell B (January 2007). «Oxidative stress and cancer: have we moved forward?». The Biochemical Journal. 401 (1): 1–11. doi:10.1042/BJ20061131. PMID 17150040. S2CID 850978. Archived from the original on 15 February 2022. Retrieved 30 November 2019.
- ^ French LK, Horowitz BZ, McKeown NJ (July 2010). «Hydrogen peroxide ingestion associated with portal venous gas and treatment with hyperbaric oxygen: a case series and review of the literature». Clinical Toxicology. 48 (6): 533–538. doi:10.3109/15563650.2010.492526. PMID 20575671. S2CID 25148041. Archived from the original on 4 January 2022. Retrieved 4 January 2022.
- ^ «Heeresversuchsstelle Kummersdorf». UrbEx | Forgotten & Abandoned. 23 March 2008. Archived from the original on 29 June 2018. Retrieved 1 June 2018.
- ^ «The Nazi Doctors: Medical Killing and the Psychology of Genocide». Robert Jay Lifton. Archived from the original on 27 June 2018. Retrieved 26 June 2018.
- ^ «Explosion and fire in a hydrogen peroxide plant». ARIA. November 2007. Archived from the original on 14 February 2022.
- ^ «Accident No: DCA-99-MZ-001» (PDF). U.S. National Transportation Safety Board. Archived (PDF) from the original on 3 November 2015. Retrieved 30 October 2015.
- ^ Mizokami K (28 September 2018). «The True Story of the Russian Kursk Submarine Disaster». Archived from the original on 14 February 2022.
- ^ Wheaton S (16 August 2010). «Bleach Spill Shuts Part of Times Square». The New York Times. Archived from the original on 1 December 2017. Retrieved 24 February 2017.
Bibliography
- DrabowiczJ, et al. (1994). Capozzi G, et al. (eds.). The Syntheses of Sulphones, Sulphoxides and Cyclic Sulphides. Chichester UK: John Wiley & Sons. pp. 112–6. ISBN 978-0-471-93970-2.
- Greenwood NN, Earnshaw A (1997). Chemistry of the Elements (2nd ed.). Oxford UK: Butterworth-Heinemann. A great description of properties & chemistry of H2O2.
- March J (1992). Advanced Organic Chemistry (4th ed.). New York: Wiley. p. 723.
- Hess WT (1995). «Hydrogen Peroxide». Kirk-Othmer Encyclopedia of Chemical Technology. Vol. 13 (4th ed.). New York: Wiley. pp. 961–995.
External links[edit]
- Hydrogen Peroxide at The Periodic Table of Videos (University of Nottingham)
- Material Safety Data Sheet
- ATSDR Agency for Toxic Substances and Disease Registry FAQ
- International Chemical Safety Card 0164
- NIOSH Pocket Guide to Chemical Hazards
- Process flow sheet of Hydrogen Peroxide Production by anthrahydroquinone autoxidation
- Hydrogen Peroxide Handbook by Rocketdyne
- IR spectroscopic study J. Phys. Chem.
Склонение существительного «перекись»
Существительное «пе́рекись» (неод.)
| Падеж | Единственное число | Множественное число |
|---|---|---|
| Именительный Кто? Что? |
пе́рекись | пе́рекиси |
| Родительный Кого? Чего? |
пе́рекиси | пе́рекисей |
| Дательный Кому? Чему? |
пе́рекиси | пе́рекисям |
| Винительный (неод.) Кого? Что? |
пе́рекись | пе́рекиси |
| Творительный Кем? Чем? |
пе́рекисью | пе́рекисями |
| Предложный О ком? О чём? |
пе́рекиси | пе́рекисях |
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: бисексуалка — это что-то нейтральное, положительное или отрицательное?
Ассоциации к слову «перекись»
Синонимы к слову «перекись»
Предложения со словом «перекись»
- Лучше всего промыть ссадину 3%-ным раствором перекиси водорода.
- Её руки умело орудовали пинцетом, протирая рану перекисью и смывая запёкшуюся кровь.
- Впитавшиеся в структуру ногтя частички никотина можно удалить с помощью 2 %-ного раствора перекиси водорода.
- (все предложения)
Цитаты из русской классики со словом «перекись»
- Около нее появился мистер Лионель Крэйтон, человек неопределенного возраста, но как будто не старше сорока лет, крепкий, стройный, краснощекий; густые, волнистые волосы на высоколобом черепе серого цвета — точно обесцвечены перекисью водорода, глаза тоже серые и смотрят на все так напряженно, как это свойственно людям слабого зрения, когда они не решаются надеть очки.
- Затем из нагретой перекиси марганца, смешанного с песком, был добыт при помощи аптекарского пузырька, гуттаперчивого конца от эсмарховой кружки, таза, наполненного водой, и банки из-под варенья — кислород. Разожженная пробка, уголь и проволока горели в банке так ослепительно, что глазам становилось больно. Любка хлопала в ладоши и визжала в восторге:
- (все
цитаты из русской классики)
Значение слова «перекись»
-
ПЕ́РЕКИСЬ, -и, ж. Хим. Высшая степень окисления химического элемента. Перекись водорода. Перекись марганца. (Малый академический словарь, МАС)
Все значения слова ПЕРЕКИСЬ
Отправить комментарий
Дополнительно
перекись водорода
- перекись водорода
- пе́рекись водоро́да
* * *
ПЕРЕКИСЬ ВОДОРОДА
ПЕ́РЕКИСЬ ВОДОРО́ДА, то же, что водорода пероксид (см. ВОДОРОДА ПЕРОКСИД).
Энциклопедический словарь.
2009.
Смотреть что такое «перекись водорода» в других словарях:
-
ПЕРЕКИСЬ ВОДОРОДА — (Hydrogenium hy peroxy datum, Hydrogenium peroxy datum), H202, сиропообразная жидкость, прозрачная, в тонких слоях бесцветная, в толстых голубого цвета, в 1х/2 раза тяжелее воды, металлического острого вкуса, растворяется в любых отношениях в… … Большая медицинская энциклопедия
-
ПЕРЕКИСЬ ВОДОРОДА — бесцветная жидкость; хорошо смешивается с водой; применяется как дезинфицирующее (для полоскания горла, при мелких порезах и т. п.) и отбеливающее средство. Используется для отбелки хлопчатобумажных, льняных, шерстяных и шёлковых тканей, перьев и … Краткая энциклопедия домашнего хозяйства
-
ПЕРЕКИСЬ ВОДОРОДА — (Н2О2), жидкость, состоящая из водорода и кислорода, обычно продается в водных растворах. Перекись получают электролитическим ОКИСЛЕНИЕМ серной кислоты и методами, основанными на ВОССТАНОВЛЕНИИ кислорода. Раствор перекиси водорода используется… … Научно-технический энциклопедический словарь
-
ПЕРЕКИСЬ ВОДОРОДА — ПЕРЕКИСЬ ВОДОРОДА, то же, что водорода пероксид … Современная энциклопедия
-
ПЕРЕКИСЬ ВОДОРОДА — то же, что водорода пероксид … Большой Энциклопедический словарь
-
Перекись водорода — Действующее вещество ›› Водорода пероксид (Hydrogen peroxide) … Словарь медицинских препаратов
-
Перекись водорода — ПЕРЕКИСЬ ВОДОРОДА, то же, что водорода пероксид. … Иллюстрированный энциклопедический словарь
-
перекись водорода — Неорганическое вещество, быстро разлагающееся в организме (под действием фермента каталазы) с образованием молекулярного кислорода: H2O2. [Арефьев В.А., Лисовенко Л.А. Англо русский толковый словарь генетических терминов 1995 407с.] Тематики… … Справочник технического переводчика
-
Перекись водорода — I (техн.) находит в последнее время применение в довольно широких размерах для беления шелковых и шерстяных изделий, а также перьев. По сравнению с сернистой кислотой, которая издавна употребляется для этой цели, перекись водорода отбеливает… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
Перекись водорода — Пероксид водорода Общие Систематическое наименование Пероксид водорода Химическая формула … Википедия
Толковый словарь русского языка. Поиск по слову, типу, синониму, антониму и описанию. Словарь ударений.
Найдено определений: 3
водорода пероксид
ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
Водоро́да перокси́д (перекись водорода), Н2О2, бесцветная вязкая жидкость; плотность 1,45 г/см3, tпл -0,41°C, tкип 150,2°C. Легко разлагается на воду и кислород. Применяют как окислитель, инициатор полимеризации, для отбеливания волос, меха, шёлка, в медицине как антисептическое, кровоостанавливающее и дезодорирующее средство. Выпускается в виде 30-90%-ных водных растворов (30%-ный раствор называют пергидролем).
* * *
ВОДОРОДА ПЕРОКСИД — ВОДОРО́ДА ПЕРОКСИ́Д (перекись водорода), Н2О2, бесцветная вязкая жидкость; плотность 1,45 г/см3, tпл = 0,41 °С, tкип = 150,2 °С. Легко разлагается на воду и кислород. Применяют как окислитель, инициатор полимеризации, для отбеливания волос, меха, шелка, в медицине как антисептическое, кровоостанавливающее и дезодорирующее средство. Выпускается в виде 30 — 90%-ных водных растворов (30%-ный раствор называют пергидролем).
БОЛЬШОЙ ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
ВОДОРОДА ПЕРОКСИД (перекись водорода) — Н2О2, бесцветная вязкая жидкость; плотность 1,45 г/см³, tпл = 0,41 .С, tкип = 150,2 .С. Легко разлагается на воду и кислород. Применяют как окислитель, инициатор полимеризации, для отбеливания волос, меха, шелка, в медицине как антисептическое, кровоостанавливающее и дезодорирующее средство. Выпускается в виде 30 — 90%-ных водных растворов (30%-ный раствор называют пергидролем).
ИЛЛЮСТРИРОВАННЫЙ ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
ВОДОРОДА ПЕРОКСИД (перекись водорода),H2O2, жидкость, tкип 150,2°C. 30%-й водородный раствор — пергидроль. Концентрированные водные растворы пероксида водорода взрывоопасны. Пероксид водорода применяют как окислитель в ракетных топливах, при получении различных химических веществ, для отбеливания масел, жиров, меха, кожи, тканей, бумаги, при извлечении металлов из руд, для обезвреживания сточных вод, как антисептик в медицине; гидроперит (соединение мочевины с пероксидом водорода) — для обесцвечивания волос. Пероксид водорода и его растворы обжигают кожу и слизистые оболочки.
ПОЛЕЗНЫЕ СЕРВИСЫ
Строение молекулы и физические свойства
Перекись водорода относится к простейшим представителям группы пероксидов. Её получают в промышленности и лаборатории несколькими способами. Структурная формула перекиси водорода обозначается H2O2. Степень окисления у атомов кислорода -1.
Молекула вещества представлена двумя OH-группами, которые связаны пероксидным -О-О-мостиком и лежат в разных плоскостях. Угол между ними меняется в зависимости от температуры, концентрации раствора и других условий.
Пероксид представлен в виде бесцветной жидкости с «металлическим» вкусом и специфическим запахом. Вязкая консистенция обусловлена развитой системой водородных связей в молекулярной структуре.
Основные физические свойства перекиси водорода:
- Температура кипения: 150,2°C.
- Температура замерзания: -0,432°C.
- Плотность: 1,46 г/см3.
Молекула вещества является полярной, поскольку её строение несимметричное. Соединение может неограниченно растворяться в воде, эфире и спирте. Чистое вещество неустойчиво и способно самопроизвольно разлагаться со взрывом.
Химические особенности
Поскольку оба атома кислорода находятся в промежуточной степени окисления -1, антисептическое средство может проявлять как окислительные, так и восстановительные свойства. Оно участвует в реакциях окисления нитритов до нитратов и выделении иодов из иодидов металлов. Также вещество может расщеплять ненасыщенные соединения.
Перекись обладает слабыми кислотными свойствами, поэтому она диссоциирует по двум ступеням:
- H2O2↔H++OOH−
- OOH−↔H++O22−
Вещество по степени кислотности немного сильнее H2O. Некоторые пероксиды металлов можно рассматривать как его соли. В кислой среде перекись служит окислителем, а в щелочной — восстановителем.
Реагируя с более сильными окислителями, например, с солями серебра и золота, водород служит восстановителем и окисляется до атомарного кислорода. В реакции с нитритом калия вещество выступает окислителем. Если молекула принимает электрон на внешний уровень, тогда степень окисления кислорода меняется на -2; если она его отдаёт, тогда соединение становится восстановителем. Окисление органических веществ пероксидом обычно проводят в уксусной кислоте.
Способы получения вещества
Сначала пероксид водорода получали в промышленности с помощью электролиза серной кислоты или раствора сульфата аммония в H2SO4. В результате реакции получалась надсерная кислота. После гидролиза вещества образовывались пероксид и серная кислота.
В середине XX века открыли новый способ получения перекиси водорода. Антрахиноновый процесс был разработан компанией BASF. При этом методе водород окисляется кислородом воздуха, после чего образуются антрахиноны и пероксид водорода. Реакцию проводят в растворе алкилантрагидрохинонов в бензоле, который служит катализатором. В него также добавляют вторичные спирты. На завершительной стадии процесса катализатор убирают, а из получившейся смеси продуктов выделяют пероксид водорода путём перегонки при сниженном давлении.
В лабораторных условиях вещество получают с помощью пероксида бария и соляной кислоты. Уравнение взаимодействия соединений: BaO2+2HCl → BaCl2+H2O2. Получившийся хлорид бария осаждают в виде сульфата. Пероксид водорода также можно извлечь при помощи каталитического окисления изопропилового спирта.
В некоторых источниках есть информация, что нужное вещество может образоваться при взаимодействии пероксида бария с серной кислотой, однако такую технологию обычно не используют. Поскольку осадок сульфата бария формируется на зёрнах его пероксида, реагент покрывается нерастворимой оболочкой, которая замедляет реакцию и выход нужного продукта.
Меры предосторожности
Во время работы с концентрированным раствором перекиси необходимо соблюдать меры безопасности. Хотя вещество нетоксично, при попадании в дыхательные пути или на кожный покров и слизистые оно вызывает сильные ожоги. Недостаточно чистый пероксид высокой концентрации может быть взрывоопасен. Всю работу с веществом нужно проводить в «беспылевых» условиях и при отсутствии ионов металлов.
Растворы перекиси водорода относятся к 3-му классу опасности. Вещество может вызывать деструктивные изменения, которые схожи с действием щелочей. Летальная доза пергидроля (название раствора концентрации 30%) составляет 50−100 мл.
Упаковку с аптечным средством необходимо хранить в тёмном месте. При транспортировке нужно избегать встряхивания вещества и других механических воздействий, которые могут привести к его разложению.
Сферы использования
Пероксид водорода может быть разной концентрации. Поскольку растворы обладают различными свойствами, их часто используют в промышленности и быту:
- Вещество применяется при создании бумаги, дезинфицирующих средств и в текстильном производстве в качестве отбеливателя.
- За окислительные свойства пероксид водорода используют как ракетное топливо.
- В аналитической химии при изготовлении пористых материалов средство применяют в качестве пенообразователя.
- В промышленности простейший представитель пероксидов зарекомендовал себя как катализатор и гидрирующий агент.
- В аквариумистике 3%-й раствор помогает очистить резервуары для воды, бороться с паразитами, а также способен оживить задохнувшихся рыб.
- В пищевой промышленности пероксид используется для дезинфекции упаковок для различных напитков и поверхностей оборудования, с которым контактируют продукты.
- В сфере быта средство помогает вывести пятна марганцовки на предметах мебели и текстиле, а также в качестве домашнего антисептика.
Перекись широко используется в области косметологии. Ею обесцвечивают волосы и отбеливают зубы. Поскольку процесс основан на окислении, локоны часто портятся, поэтому вещество не советуют применять обладателям тонких и повреждённых прядей. С зубами не наблюдается дефектов, поскольку с прозрачной эмалью эффект отбеливания достигается за счёт разницы в отражении света дентином.
Применение в области медицины
Широкое применение перекиси водорода нашли в медицине. Средство с бактерицидным механизмом действия предназначено для внешнего использования. Перед применением необходимо тщательно изучить инструкцию к лекарству.
Формы выпуска пероксида водорода:
- Раствор разведённый 1−3%. Применяется для полоскания полости рта и в качестве препарата местного действия.
- Раствор концентрированный 27−31%. Это средство используется редко и только по назначению специалиста. Обычно для обработок его разводят до 3%-го раствора. Лекарство предназначено для лечения заболеваний кожного покрова.
- Гидроперит. Лекарство представлено соединением 35%-го раствора пероксида с карбамидом. Выпускается в форме таблеток. В таком виде препарат легче перевозить и хранить. Чтобы сделать раствор, необходимо растворить в воде 2 таблетки на 100 мл жидкости.
Препаратом лечат гнойные раны и воспалённые слизистые оболочки. Средство используется при носовых и капиллярных кровотечениях, а также для промывки и глубокой очистки ран. Медицинским раствором обрабатывают ротовую полость и горло при ангине, стоматите или тонзиллите. Средство также избавляет кожный покров от пигментных пятен. С помощью лекарства убирают серные пробки при чистке ушей. Препарат применяется в гинекологии для лечения различных женских патологий.
При лёгкой механической очистке ватный тампон смачивают в 3%-м растворе и обрабатывают им поражённые участки кожи. Для компрессов применяют перекись с концентрацией 1 процент. Продолжительность процедуры не должна превышать 30 мин. Для обработки участков кожи с пигментными пятнами используют пергидроль. Ротовую полость или органы половой системы обрабатывают 0,25%-м раствором.
Применение перекиси водорода противопоказано при индивидуальной непереносимости вещества. В редких случаях негативные последствия могут проявиться в жжении во время процедуры и аллергии в виде красных пятен на коже. При длительной терапии после обработок ротовой полости может возникнуть гипертрофия сосочков языка. Если соблюдать дозировку и схему применения перекиси водорода в соответствии с инструкцией, тогда получится избежать побочных действий.
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Водорода пероксид
- Химическое название
- Брутто формула
- Фармакологическая группа вещества Водорода пероксид
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Водорода пероксид
- Противопоказания
- Побочные действия вещества Водорода пероксид
- Взаимодействие
- Способ применения и дозы
- Меры предосторожности
- Особые указания
- Торговые названия с действующим веществом Водорода пероксид
Структурная формула
Русское название
Водорода пероксид
Английское название
Hydrogen peroxide
Латинское название вещества Водорода пероксид
Hydrogenii peroxydum (род. Hydrogenii peroxydi)
Химическое название
Гидрогенпероксид
Фармакологическая группа вещества Водорода пероксид
Фармакологическое действие
—
антисептическое, гемостатическое, дезинфицирующее, дезодорирующее.
Характеристика
Прозрачная бесцветная жидкость без запаха или со слабым своеобразным запахом, слабокислой реакции; быстро разлагается под действием света, при нагревании или соприкосновении со щелочью, окисляющими или восстанавливающими веществами, с выделением кислорода.
Фармакология
Антисептическое действие обусловлено оксидантным эффектом — при контакте с поврежденной кожей и слизистыми водорода пероксид под влиянием каталазы (главным образом) и пероксидазы распадается с выделением кислорода (в т.ч. и активных форм), что создает неблагоприятные условия для развития микроорганизмов, особенно анаэробной и гнилостной флоры; вместе с тем оно характеризуется малой продолжительностью и слабой выраженностью эффекта. При попадании раствора в рану происходит разрушение (окисление) протеинов, крови, гноя, и механическое ее очищение вследствие обильного пенообразования (за счет пузырьков газа, поднимающихся со стенок) от загрязняющих частиц, мелких инородных тел, сгустков крови. Это вспенивание способствует тромбообразованию и остановке кровотечений из мелких сосудов.
Применение вещества Водорода пероксид
Первичная обработка поверхностных загрязненных ран, очищение раны от гноя и сгустков крови, остановка капиллярных кровотечений из поверхностных ран, лунки зуба и носовых кровотечений.
Противопоказания
Гиперчувствительность.
Побочные действия вещества Водорода пероксид
Аллергические реакции (редко), ощущение жжения в области раны.
Взаимодействие
Разрушается и теряет эффективность при взаимодействии с щелочами и солями тяжелых металлов.
Способ применения и дозы
Наружно. Поврежденные участки (кожи, слизистой) обрабатывают ватным или марлевым тампоном, смоченным раствором или аэрозолем.
Меры предосторожности
Следует избегать попадания препарата в глаза; не рекомендуется использовать для орошения полостей и под окклюзионные повязки.
Особые указания
Помимо наружного применения 3% раствор применяют также внутрь в токсикологической практике в качестве антидота (в комбинации с 3% раствором уксусной кислоты) при отравлении перманганатом калия.
Торговые названия с действующим веществом Водорода пероксид
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Перекись водорода |
от 11.50 до 84.00 |
| Перекись водорода буфус |
от 12.00 до 100.00 |
ПЕРЕКИСЬ ВОДОРОДА, пероксид водорода,
Н2О2, простейший и важнейший представитель перекисей;
прозрачная жидкость без цвета и запаха, с «металлич.» привкусом; tпл
— 0,43 оС, легко переохлаждается без затвердевания; tкип
150,2 °С, плотность при О °С 1,47 г/см3. С водой смешивается
в любых отношениях, образует кристаллогидрат n2О2·2n2О.
Подобно воде, хорошо растворяет мн. соли; образует с ними кристаллич. пероксигидраты.
Открыта
в 1818 Л. Ж. Тенаром.
Очень чистая П. в. достаточно устойчива,
но в присутствии тяжёлых металлов и их ионов разлагается на Н2О
и О2. Особенно эффективные катализаторы разложения — соли и
комплексные соединения Fe, Сu, Mn, а также фермент каталаза. Разложение
П. в.- экзотермич. процесс и может проходить со взрывом. В разных условиях
П. в. может играть роль как окислителя (что более характерно), так и восстановителя.
Как окислитель П. в. выделяет, напр., иод из иодидов:
Как восстановитель — переводит Mn(VII)
в Мn(II):
Эти реакции используются для количеств.
определения П. в. в растворе.
Механизм окисления различных веществ П,
в. сложен; в реакциях в качестве промежуточных веществ образуются активные
частицы (НО2, ОН), обладающие более сильными, чем сама П. в.,
окислительными свойствами. Таково, напр., взаимодействие П. в. с ионами
2-валентного железа в растворе:
Смесь растворов Н2О2
и соли Fe(II), известная как реактив Фентона, широко используется для окисления
различных органич. веществ.
В лаборатории П. в. получают, действуя
на холоду разбавленными к-тами на перекиси металлов-ВаО2, Na2O2,
в пром-сти — электролизом серной к-ты и гидролизом образующейся надсерной
к-ты H2S2O8:
а также самоокислением производных антрахинонового
ряда и окислением изопропилового спирта.
В природе П. в. образуется как промежуточный
или побочный продукт при окислении мн. веществ кислородом воздуха; следы
её содержатся в атм. осадках. П. в. образуется в растительных и животных
клетках, но концентрация её очень мала, т. к. под действием ферментов каталазы
и пероксидазы протекают быстрые реакции разложения П. в. и окисления ею
органич. веществ.
Высококонцентрированная П. в., разлагающаяся
на окисном катализаторе, даёт нагретую до высоких темп-р (700 оС)
водно-кислородную газовую смесь («парогаз») — топливо в реактивных двигателях.
В хим. пром-сти П. в. применяется как окислитель, как сырьё для получения
мн. перекисных соединений, как инициатор полимеризации; для отбеливания
шёлка, шерсти, пера, мехов.
В связи с проблемами загрязнения окружающей
среды отходами хим. произ-в П. в. приобретает особое значение как «чистый»
окислитель, не образующий токсич. продуктов. Произ-во высококонцентриррванной
П. в. (90-98% ) неуклонно растёт. Для её хранения используют ёмкости из
алюминия, а в качестве стабилизаторов обычно пирофосфат натрия Na4P2O7.
П. в. не токсична, но её концентрированные растворы при попадании на кожу,
слизистую оболочку и в дыхательные пути вызывают ожоги.
В медицине П. в.- препарат из группы антисептических
средств, оказывающий дезинфицирующее и дезодорирующее действие. 3%
-ный раствор П. в. применяют для промываний и полосканий при стоматите,
ангине, гинекологич. заболеваниях, иногда- для остановки носовых кровотечений.
Когда требуются растворы более высоких концентраций, для их изготовления
используют пергидроль. Растворы и мази, содержащие П. в., применяют
также в качестве депигментирующих средств.
Лит.: Шамб У., Сеттерфильд Ч., Вентворс
Р., Перекись водорода, пер. с англ., М., 1958. А. П. Пурмалъ.
ВОДОРОДА ПЕРОКСИД – (старое название – перекись водорода), соединение водорода и кислорода Н2О2, содержащее рекордное количество кислорода – 94% по массе. В молекулах Н2О2 содержатся пероксидные группы –О–О– (см. ПЕРОКСИДЫ), которые во многом определяют свойства этого соединения.
Впервые пероксид водорода получил в 1818 французский химик Луи Жак Тенар (1777 – 1857), действуя сильно охлажденной соляной кислотой на пероксид бария:
BaO2 + 2HCl ® BaCl2 + H2O2. Пероксид бария, в свою очередь, получали сжиганием металлического бария. Для выделения из раствора Н2О2 Тенар удалил из него образовавшийся хлорид бария: BaCl2 + Ag2SO4 ® 2AgCl + BaSO4. Чтобы не использовать дорогую соль серебра в последующем для получения Н2О2 использовали серную кислоту: BaO2 + H2SO4 ® BaSO4 + H2O2, поскольку при этом сульфат бария остается в осадке. Иногда применяли другой способ: пропускали углекислый газ во взвесь ВаО2 в воде: BaO2 + H2O + CO2 ® BaCO3 + H2O2, поскольку карбонат бария также нерастворим. Этот способ предложил французский химик Антуан Жером Балар (1802–1876), прославившийся открытием нового химического элемента брома (1826). Применяли и более экзотические методы, например, действие электрического разряда на смесь 97% кислорода и 3% водорода при температуре жидкого воздуха (около –190° С), так был получен 87%-ный раствор Н2О2.
Концентрировали Н2О2 путем осторожного упаривания очень чистых растворов на водяной бане при температуре не выше 70–75° С; так можно получить примерно 50%-ный раствор. Сильнее нагревать нельзя – происходит разложение Н2О2, поэтому отгонку воды проводили при пониженном давлении, используя сильное различие в давлении паров (и, следовательно, в температуре кипения) Н2О и Н2О2. Так, при давлении 15 мм рт.ст. сначала отгоняется в основном вода, а при 28 мм рт.ст. и температуре 69,7° С, отгоняется чистый пероксид водорода. Другой способ концентрирования – вымораживание, так как при замерзании слабых растворов лед почти не содержит Н2О2. Окончательно можно обезводить поглощением паров воды серной кислотой на холоде под стеклянным колоколом.
Многие исследователи 19 в., получавшие чистый пероксид водорода, отмечали опасность этого соединения. Так, когда пытались отделить Н2О2 от воды путем экстракции из разбавленных растворов диэтиловым эфиром с последующей отгонкой летучего эфира, полученное вещество иногда без видимых причин взрывалось. В одном из таких опытов немецкий химик Ю.В.Брюль получил безводный Н2О2, который обладал запахом озона и взорвался от прикосновения неоплавленной стеклянной палочки. Несмотря на малые количества Н2О2 (всего 1–2 мл) взрыв был такой силы, что пробил круглую дыру в доске стола, разрушил содержимое его ящика, а также стоящие на столе и поблизости склянки и приборы.
Физические свойства.
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3). Замерзает Н2О2 при температурой немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30° С, а 60%-ный – при минус 53° С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2° С. Смачивает стекло Н2О2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
В статье, посвященной получению пероксида водорода, Тенар не очень удачно сравнил это вещество с сиропом, возможно, он имел в виду, что чистый Н2О2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н2О2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп.
Реакция разложения.
Чистый пероксид водорода – вещество очень опасное, так как при некоторых условиях возможно его взрывное разложение: Н2О2 ® Н2О + 1/2 О2 с выделением 98 кДж на моль Н2О2 (34 г). Это очень большая энергия: она больше, чем та, которая выделяется при образовании 1 моля HCl при взрыве смеси водорода и хлора; ее достаточно, чтобы полностью испарить в 2,5 раза больше воды, чем образуется в этой реакции. Опасны и концентрированные водные растворы Н2О2, в их присутствии легко самовоспламеняются многие органические соединения, а при ударе такие смеси могут взрываться. Для хранения концентрированных растворов используют сосуды из особо чистого алюминия или парафинированные стеклянные сосуды.
Чаще приходится встречаться с менее концентрированным 30%-ным раствором Н2О2, который называется пергидролем, но и такой раствор опасен: вызывает ожоги на коже (при его действии кожа сразу же белеет из-за обесцвечивания красящих веществ), при попадании примесей возможно взрывное вскипание. Разложение Н2О2 и его растворов, в том числе и взрывное, вызывают многие вещества, например, ионы тяжелых металлов, которые при этом играют роль катализатора, и даже пылинки.
Взрывы Н2О2 объясняются сильной экзотермичностью реакции, цепным характером процесса и значительным снижением энергии активации разложения Н2О2 в присутствии различных веществ, о чем можно судить по следующим данным:
| Катализатор | Энергия активации, кДж/моль | Относительная скорость реакции при 25° С |
| Без катализатора | 73 | 1 |
| Ионы I– | 56 | 1,1·103 |
| Платина | 48 | 2,3·104 |
| Ионы Fe2+ | 42 | 2,5·105 |
| Каталаза | 7 | 3·1011 |
Фермент каталаза содержится в крови; именно благодаря ей «вскипает» от выделения кислорода аптечная «перекись водорода», когда ее используют для дезинфекции порезанного пальца. Реакцию разложения концентрированного раствора Н2О2 под действием каталазы использует не только человек; именно эта реакция помогает жуку-бомбардиру бороться с врагами, выпуская в них горячую струю (см. ВЗРЫВЧАТЫЕ ВЕЩЕСТВА). Другой фермент – пероксидаза действует иначе: он не разлагает Н2О2, но в его присутствии происходит окисление других веществ пероксидом водорода.
Ферменты, влияющие на реакции пероксида водорода, играют большую роль в жизнедеятельности клетки. Энергию организму поставляют реакции окисления с участием поступающего из легких кислорода. В этих реакциях промежуточно образуется Н2О2, который вреден для клетки, так как вызывает необратимое повреждение различных биомолекул. Каталаза и пероксидаза совместно превращают Н2О2 в воду и кислород.
Реакция разложения Н2О2 часто протекает по радикально-цепному механизму (см. ЦЕПНЫЕ РЕАКЦИИ), при этом роль катализатора заключается в инициировании свободных радикалов. Так, в смеси водных растворов Н2О2 и Fe2+ (так называемый реактив Фентона) идет реакция переноса электрона с иона Fe2+ на молекулу H2O2 с образованием иона Fe3+ и очень неустойчивого анион-радикала [H2O2]. –, который сразу же распадается на анион ОН– и свободный гидроксильный радикал ОН. (см. СВОБОДНЫЕ РАДИКАЛЫ). Радикал ОН. очень активен. Если в системе есть органические соединения, то возможны их разнообразные реакции с гидроксильными радикалами. Так, ароматические соединения и оксикислоты окисляются (бензол, например, превращается в фенол), непредельные соединения могут присоединить гидроксильные группы по двойной связи: СН2=СН–СН2ОН + 2ОН. ® НОСН2–СН(ОН)–СН2–ОН, а могут вступить в реакцию полимеризации. В отсутствие же подходящих реагентов ОН. реагирует с Н2О2 с образованием менее активного радикала НО2., который способен восстанавливать ионы Fe2+, что замыкает каталитический цикл:
H2O2 + Fe2+ ® Fe3+ + OH. + OH–
ОН. + Н2О2 ® H2O + HO2.
HO2. + Fe3+ ® Fe2+ + O2 + H+
H+ + OH– ® H2O.
При определенных условиях возможно цепное разложение Н2О2, упрощенный механизм которого можно представить схемой
ОН. + Н2О2 ® H2O + HO2.2. + H2O2 ® H2O + O2 + OH. и т.д.
Реакции разложения Н2О2 идут в присутствии различных металлов переменной валентности. Связанные в комплексные соединения, они часто значительно усиливают свою активность. Например, ионы меди менее активны, чем ионы железа, но связанные в аммиачные комплексы [Cu(NH3)4]2+, они вызывают быстрое разложение Н2О2. Аналогичное действие оказывают ионы Mn2+ связанные в комплексы с некоторыми органическими соединениями. В присутствии этих ионов удалось измерить длину цепи реакции. Для этого сначала измерили скорость реакции по скорости выделения из раствора кислорода. Затем в раствор ввели в очень малой концентрации (около 10–5 моль/л) ингибитор – вещество, эффективно реагирующее со свободными радикалами и обрывающее таким образом цепь. Выделение кислорода сразу же прекратилось, но примерно через 10 минут, когда весь ингибитор израсходовался, снова возобновилось с прежней скоростью. Зная скорость реакции и скорость обрыва цепей, нетрудно рассчитать длину цепи, которая оказалась равной 103 звеньев. Большая длина цепи обусловливает высокую эффективность разложения Н2О2 в присутствии наиболее эффективных катализаторов, которые с высокой скоростью генерируют свободные радикалы. При указанной длине цепи скорость разложения Н2О2 фактически увеличивается в тысячу раз.
Иногда заметное разложение Н2О2 вызывают даже следы примесей, которые почти не обнаруживаются аналитически. Так, одним из самых эффективных катализаторов оказался золь металлического осмия: сильное каталитическое действие его наблюдалось даже при разведении 1:109, т.е. 1 г Os на 1000 т воды. Активными катализаторами являются коллоидные растворы палладия, платины, иридия, золота, серебра, а также твердые оксиды некоторых металлов – MnO2, Co2O3, PbO2 и др., которые сами при этом не изменяются. Разложение может идти очень бурно. Так, если маленькую щепотку MnO2 бросить в пробирку с 30%-ным раствором Н2О2, из пробирки вырывается столб пара с брызгами жидкости. С более концентрированными растворами происходит взрыв. Более спокойно протекает разложение на поверхности платины. При этом на скорость реакции сильное влияние оказывает состояние поверхности. Немецкий химик Вальтер Шпринг провел в конце 19 в. такой опыт. В тщательно очищенной и отполированной платиновой чашке реакция разложения 38%-ного раствора Н2О2 не шла даже при нагревании до 60° С. Если же сделать иглой на дне чашки еле заметную царапину, то уже холодный (при 12° С) раствор начинает выделять на месте царапины пузырьки кислорода, а при нагревании разложение вдоль этого места заметно усиливается. Если же в такой раствор ввести губчатую платину, обладающую очень большой поверхностью, то возможно взрывное разложение.
Быстрое разложение Н2О2 можно использовать для эффектного лекционного опыта, если до внесения катализатора добавить к раствору поверхностно-активное вещество (мыло, шампунь). Выделяющийся кислород создает обильную белую пену, которую назвали «зубной пастой для слона».
Некоторые катализаторы инициируют нецепное разложение Н2О2, например:
H2O2 + 2I– + 2H+ ® 2H2O + I2
I2 + H2O2 ® 2I– + 2H+ + O2.
Нецепная реакция идет и в случае окисления ионов Fe2+ в кислых растворах: 2FeSO4 + H2O2 + H2SO4 ® Fe2(SO4)3 + 2H2O.
Поскольку в водных растворах почти всегда есть следы различных катализаторов (катализировать разложение могут и ионы металлов, содержащихся в стекле), к растворам Н2О2, даже разбавленным, при их длительном хранении добавляют ингибиторы и стабилизаторы, связывающие ионы металлов. При этом растворы слегка подкисляют, так как при действии чистой воды на стекло получается слабощелочной раствор, что способствует разложению Н2О2.
Все эти особенности разложения Н2О2 позволяют разрешить противоречие. Для получения чистого Н2О2 необходимо проводить перегонку при пониженном давлении, поскольку вещество разлагается при нагревании выше 70° С и даже, хотя очень медленно, при комнатной температуре (как сказано в Химической энциклопедии, со скоростью 0,5% в год). В таком случае, как же получена фигурирующая в той же энциклопедии температура кипения при атмосферном давлении, равная 150,2° С? Обычно в таких случаях используют физико-химическую закономерность: логарифм давления пара жидкости линейно зависит от обратной температуры (по шкале Кельвина), поэтому если точно измерить давление пара Н2О2 при нескольких (невысоких) температурах, то легко можно рассчитать, при какой температуре это давление достигнет 760 мм рт.ст. А это и есть температура кипения при обычных условиях.
Теоретически радикалы ОН. могут образоваться и в отсутствие инициаторов, в результате разрыва более слабой связи О–О, но для этого нужна довольно высокая температура. Несмотря на относительно небольшую энергию разрыва этой связи в молекуле Н2О2 (она равна 214 кДж/моль, что в 2,3 раза меньше, чем для связи Н–ОН в молекуле воды), связь О–О все же достаточно прочная, чтобы пероксид водорода был абсолютно устойчив при комнатной температуре. И даже при температуре кипения (150° С) он должен разлагаться очень медленно. Расчет показывает, что при этой температуре разложение на 0,5% должно происходить тоже достаточно медленно, даже если длина цепи равна 1000 звеньев. Несоответствие расчетов и опытных данных объясняется каталитическим разложением, вызванным и мельчайшими примесями в жидкости и стенками реакционного сосуда. Поэтому измеренная многими авторами энергия активации разложения Н2О2 всегда значительно меньше, чем 214 кДж/моль даже «в отсутствие катализатора». На самом деле катализатор разложения всегда есть – и в виде ничтожных примесей в растворе, и в виде стенок сосуда, именно поэтому нагревание безводного Н2О2 до кипения при атмосферном давлении неоднократно вызывало взрывы.
В некоторых условиях разложение Н2О2 происходит очень необычно, например, если нагреть подкисленный серной кислотой раствор Н2О2 в присутствии иодата калия KIO3, то при определенных концентрациях реагентов наблюдается колебательная реакция, при этом выделение кислорода периодически прекращается, а потом возобновляется с периодом от 40 до 800 секунд.
Химические свойства Н2О2.
Пероксид водорода – кислота, но очень слабая. Константа диссоциации H2O2
Растворы Н2О2, особенно концентрированные, обладают сильным окислительным действием. Так, при действии 65%-ного раствора Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются. Менее концентрированные растворы обесцвечивают многие органические соединения, например, индиго. Необычно идет окисление формальдегида: Н2О2 восстанавливается не до воды (как обычно), а до свободного водорода: 2НСНО + Н2О2 ® 2НСООН + Н2. Если взять 30%-ный раствор Н2О2 и 40%-ный раствор НСНО, то после небольшого подогрева начинается бурная реакция, жидкость вскипает и пенится. Окислительное действие разбавленных растворов Н2О2 больше всего проявляется в кислой среде, например, H2O2 + H2C2O4 ® 2H2O + 2CO2, но возможно окисление и в щелочной среде:
Na[Sn(OH)3] + H2O2 + NaOH ® Na2[Sn(OH)6]; 2K3[Cr(OH)6] + 3H2O2 ® 2KCrO4 + 2KOH + 8H2O.
Окисление черного сульфида свинца до белого сульфата PbS + 4H2O2 ® PbSO4 + 4H2O можно использовать для восстановления потемневших свинцовых белил на старых картинах. Под действием света идет окисление и соляной кислоты:
H2O2 + 2HCl ® 2H2O + Cl2. Добавление Н2О2 к кислотам сильно увеличивает их действие на металлы. Так, в смеси H2O2 и разбавленной H2SO4 растворяются медь, серебро и ртуть; иод в кислой среде окисляется до иодной кислоты HIO3, сернистый газ – до серной кислоты и т.д.
Необычно происходит окисление калий-натриевой соли винной кислоты (сегнетовой соли) в присутствии хлорида кобальта в качестве катализатора. В ходе реакции KOOC(CHOH)2COONa + 5H2O2 ® KHCO3 + NaHCO3 + 6H2O + 2CO2 розовый CoCl2 изменяет цвет на зеленый из-за образования комплексного соединения с тартратом – анионом винной кислоты. По мере протекания реакции и окисления тартрата комплекс разрушается и катализатор снова розовеет. Если вместо хлорида кобальта использовать в качестве катализатора медный купорос, то промежуточное соединение, в зависимости от соотношения исходных реагентов, будет окрашено в оранжевый или зеленый цвет. После окончания реакции восстанавливается синий цвет медного купороса.
Совершенно иначе реагирует пероксид водорода в присутствии сильных окислителей, а также веществ, легко отдающих кислород. В таких случаях Н2О2 может выступать и как восстановитель с одновременным выделением кислорода (так называемый восстановительный распад Н2О2), например:
2KMnO4 + 5H2O2 + 3H2SO4 ® K2SO4 + 2MnSO4 + 5O2 + 8H2O;
Ag2O + H2O2 ® 2Ag + H2O + O2;
О3 + Н2О2 ® H2O + 2O2;
NaOCl + H2O2 ® NaCl + H2O + O2.
Последняя реакция интересна тем, что в ней образуются возбужденные молекулы кислорода, которые испускают оранжевую флуоресценцию (см. ХЛОР АКТИВНЫЙ). Аналогично из растворов солей золота выделяется металлическое золото, из оксида ртути получается металлическая ртуть и т.д. Такое необычное свойство Н2О2 позволяет, например, провести окисление гексацианоферрата(II) калия, а затем, изменив условия, восстановить продукт реакции в исходное соединение с помощью того же реактива. Первая реакция идет в кислой среде, вторая – в щелочной:
2K4[Fe(CN)6] + H2O2 + H2SO4 ® 2K3[Fe(CN)6] + K2SO4 + 2H2O;
2K3[Fe(CN)6] + H2O2 + 2KOH ® 2K4[Fe(CN)6] + 2H2O + O2.
(«Двойственный характер» Н2О2 позволил одному преподавателю химии сравнить пероксид водорода с героем повести известного английского писателя Стивенсона Странная история доктора Джекила и мистера Хайда, под влиянием придуманного им состава он мог резко изменять свой характер, превращаясь из добропорядочного джентльмена в кровожадного маньяка.)
Получение Н2О2.
Молекулы Н2О2 всегда получаются в небольших количествах при горении и окислении различных соединений. При горении Н2О2 образуется либо при отрыве атомов водорода от исходных соединений промежуточными гидропероксидными радикалами, например: HO2. + CH4 ® H2O2 + CH3., либо в результате рекомбинации активных свободных радикалов: 2ОН. ® Н2О2, Н. + НО2. ® Н2О2. Например, если кислородно-водородное пламя направить на кусок льда, то растаявшая вода будет содержать в заметных количествах Н2О2, образовавшийся в результате рекомбинации свободных радикалов (в пламени молекулы Н2О2 немедленно распадаются). Аналогичный результат получается и при горении других газов. Образование Н2О2 может происходить и при невысокой температуре в результате различных окислительно-восстановительных процессов.
В промышленности пероксид водорода уже давно не получают способом Тенара – из пероксида бария, а используют более современные методы. Один из них – электролиз растворов серной кислоты. При этом на аноде сульфат-ионы окисляются до надсульфат-ионов: 2SO42– – 2e ® S2O82–. Надсерная кислота затем гидролизуется:
H2S2O8 + 2H2O ® H2O2 + 2H2SO4.
На катоде, как обычно, идет выделение водорода, так что суммарная реакция описывается уравнением 2H2O ® H2O2 + H2. Но основной современный способ (свыше 80% мирового производства) – окисление некоторых органических соединений, например, этилантрагидрохинона, кислородом воздуха в органическом растворителе, при этом из антрагидрохинона образуются Н2О2 и соответствующий антрахинон, который потом снова восстанавливают водородом на катализаторе в антрагидрохинон. Пероксид водорода извлекают из смеси водой и концентрируют перегонкой. Аналогичная реакция протекает и при использовании изопропилового спирта (она идет с промежуточным образованием гидропероксида): (СН3)2СНОН + О2 ® (СН3)2С(ООН)ОН ® (СН3)2СО + Н2О2. При необходимости образовавшийся ацетон также можно восстановить до изопропилового спирта.
Применение Н2О2.
Пероксид водорода находит широкое применение, а его мировое производство исчисляется сотнями тысяч тонн в год. Его используют для получения неорганических пероксидов, как окислитель ракетных топлив, в органических синтезах, для отбеливания масел, жиров, тканей, бумаги, для очистки полупроводниковых материалов, для извлечения из руд ценных металлов (например, урана путем перевода его нерастворимой формы в растворимую), для обезвреживания сточных вод. В медицине растворы Н2О2 применяют для полоскания и смазывания при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина), для лечения гнойных ран. В пеналах для хранения контактных линз в крышку иногда помещают очень небольшое количество платинового катализатора. Линзы для их дезинфекции заливают в пенале 3%-ным раствором Н2О2, но так как этот раствор вреден для глаз, пенал через некоторое время переворачивают. При этом катализатор в крышке быстро разлагает Н2О2 на чистую воду и кислород.
Когда-то модно было обесцвечивать волосы «перекисью», сейчас для окраски волос существуют более безопасные составы.
В присутствии некоторых солей пероксид водорода образует как бы твердый «концентрат», который удобнее перевозить и использовать. Так, если к сильно охлажденному насыщенному раствору борнокислого натрия (буры) добавить Н2О2 в присутствии, постепенно образуются большие прозрачные кристаллы пероксобората натрия Na2[(BO2)2(OH)4]. Это вещество широко используется для отбеливания тканей и как компонент моющих средств. Молекулы Н2О2, как и молекулы воды, способны внедряться в кристаллическую структуру солей, образуя подобие кристаллогидратов – пероксогидраты, например, К2СО3·3Н2О2, Na2CO3·1,5H2O; последнее соединение широко известное под названием «персоль». Так называемый «гидроперит» CO(NH2)2·H2O2 представляет собой клатрат – соединение включения молекул Н2О2 в пустоты кристаллической решетки мочевины.
В аналитической химии с помощью пероксида водорода можно определять некоторые металлы. Например, если к раствору соли титана(IV) – сульфата титанила добавить пероксид водорода, раствор приобретает ярко-оранжевый цвет вследствие образования надтитановой кислоты:
TiOSO4 + H2SO4 + H2O2 ® H2[TiO2(SO4)2] + H2O. Бесцветный молибдат-ион MoO42– окисляется Н2О2 в интенсивно окрашенный в оранжевый цвет пероксидный анион. Подкисленный раствор дихромата калия в присутствии Н2О2 образует надхромовую кислоту: K2Cr2O7 + H2SO4 + 5H2O2 ® H2Cr2O12 + K2SO4 + 5H2O, которая довольно быстро разлагается: H2Cr2O12 + 3H2SO4 ® Cr2(SO4)3 + 4H2O + 4O2. Если сложить эти два уравнения, получится реакция восстановления пероксидом водорода дихромата калия:
K2Cr2O7 + 4H2SO4 + 5H2O2 ® Cr2(SO4)3 + K2SO4 + 9H2O + 4O2.
Надхромовую кислоту можно извлечь из водного раствора эфиром (в растворе эфира она значительно более устойчива, чем в воде). Эфирный слой при этом окрашивается в интенсивный синий цвет.
Илья Леенсон







![{displaystyle {ce {[NH4]2S2O8 + 2 H2O -> 2 [NH4]HSO4 + H2O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/540ac1415a894b716e562ad9cae286dae3786482)
![{displaystyle {ce {2 [NH4]HSO4 -> [NH4]2S2O8 + H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/07b33cca8404ebfd6870f015c443c68bb17a3995)













![{displaystyle {ce {R-CH2-CH2-CO-SCoA + O2 ->[{ce {FAD}}] R-CH=CH-CO-SCoA + H2O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c81784a048a5c7ac9b29e369eaef884fdf03642f)

![{displaystyle {ce {H2O2 ->[{ce {CAT}}] {1/2O2}+ H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df4f002a0680eb6c0668474a565b44dd6b1f7ff9)