МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КУЗБАССКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра иностранных языков факультета гуманитарного образования
СБОРНИК ТЕКСТОВ
для студентов II курса химических специальностей
(английский язык)
Составитель Л.И. Иваницкая
Утверждены на заседании кафедры Протокол № 8 от 11.05.2000 Рекомендованы к печати учебно-методической комиссией специальности 170500 Протокол № 7 от 17.05.2000
Электронная копия находится в библиотеке главного корпуса КузГТУ
Кемерово 2000
5. Химические реакции и электриче-
ский ток _________________________22 6. Витамины и химия_________________25 7. Эксперименты и лекарства _________29
ний ____________________________ 16
2. Почему резина эластичная? _________ 6
3. Наша пища _______________________ 9
превращениях _____________________ 4
1
1. Chemistry: the Science of Molecu- 1. Химия: Наука о молекулярных lar Transformations
2. Why is Rubber Elastic?
3. Our Food
4. The Rate of Chemical Transforma- 4. Скорость химических превращеtions
5. Chemical Reactions and Electric Current
6. Vitamins and Chemistry
7. Experiments and Medicines
2
Предисловие
Настоящий сборник предназначен для студентов 2-го курса химико-технологических специальностей, изучающих английский язык.
Тексты, включенные в него, построены на уже известном для них лексическом материале, что облегчает процесс извлечения информации и смысловой их обработки самостоятельно. Характерной чертой этого сборника является то, что каждый текст сопровождается описанием простых опытов.
Сборник затрагивает многие области химии, такие как неорганическая, органическая, аналитическая и др. Отдельные разделы его посвящены важным химическим соединениям.
Некоторые виды химических реакций, проиллюстрированных в сборнике, включают в себя последние достижения в области химии.
Основной задачей данного сборника, предназначенного для завершающего этапа обучения иностранному языку, является овладение основами технического перевода и аннотирования англоязычной литературы по специальности, умением вести несложную беседу по данной тематике. По этому на первое место выдвигается просмотровое чтение, которое находит выход в аннотировании иноязычного материала.
Ведущим компонентом этой деятельности является ее информативная сторона. Такой подход оправдан для будущего специалиста. Тексты сборника информативны, доступны для понимания, т.е. отвечают данным требованиям. В связи с этим можно порекомендовать для просмотрового чтения с последующей аннотацией следующие тексты: “Why is Rubber Elastic?”, “Our Food”, «The Rate of Chemical Transformations”.
Для подготовки студентов к экзаменационному вопросу по
3
письменному переводу текста по специальности можно использо-
вать: “Chemical Reactions and Electric Current”, “Vitamins and Chemistry”, “Experiments and Medicines” с последующим анализом некото-
рых предложений, представляющих определённые грамматические явления. Для ознакомительного чтения, за которым следует устный перевод и пересказ, можно порекомендовать текст: “ Chemistry: the Science of Molecular Transformations”.
Работа с материалом данного сборника рассчитана как на аудиторные занятия, так и на самостоятельную работу студентов, а также может использоваться для подготовки будущих специалистов на ОЗО.
Сборник состоит из текстов, взятых из специальных журналов и монографии: “G. B. Shul’pin ”Learning about Chemistry”; “ Chemistry and Life”.
4
Chemistry: the Science of Molecular Transformations
What is the focus of modem chemistry? At first glance, the answer to this question seems quite simple. Indeed, chemistry deals with substances and their transformations. But let us analyze this statement. First, a few words about substances that are encountered. Take, for example, aluminium hydroxide and basic copper carbonate. These substances are of interest to geologists, because they are the main components of the minerals bauxite and malachite, respectively. Bauxite is used to obtain aluminium, while malachite is a good material for masonry work. Substances such as penicillin and haemoglobin are of interest not only to chemists but also to physicians and biologists. Second, what kind of transformations do substances undergo? Ice transforms into water, helium I transforms into superfluid helium H. These transformations have nothing to do with chemistry: they are the focus of physics, because the melting point of a substance is a physical property.
So what is then a chemical property? It is the ability of a substance to react with another substance. A chemical reaction is the transformation of one molecule into another. During chemical transformations, only molecules (which consist of atoms) are destroyed, while the atoms themselves remain unchanged. Transformations of atoms are studied by physics, or, more precisely, atomic and nuclear physics. We have already mentioned that physics also studies transformations in which neither atoms nor molecules are destroyed. So, it looks like physics borders chemistry on two sides, i.e. «below» (atomic level) and «above» (permolecular level).
Two comments should be made. The first concerns the fact that modem chemists are becoming less and less interested in the nonexcited state of a substance, in its composition and structure. Of course, unsolved problems in this field still remain, but their solution is within the physicist’s scope of interest. And second, branches intermediate to physics and chemistry exist: when chemical processes are studied by physicists, and, conversely, when chemists investigate physical phenomena. For instance, a chemical process, i.e. interaction of two or several molecules, can be interpreted from the physical viewpoint. A branch of science that studies the physical parameters of chemical transformations is called chemical physics. On the other hand, the physical properties of molecular clusters in a solution called a colloidal solution are investigated in colloid chemistry, a branch of physical chemistry.
Both chemical physics and physical chemistry deal with the properties of all types of substances. These sciences are classified according to me
5
techniques used to initiate chemical reactions (e.g. electrochemistry, photochemistry, and radiation chemistry), or according to the investigation methods employed (e.g. magnetic or optical spec-troscopy, and kinetic methods).
There is also another classification of the chemical sciences, which distinguishes between types of substances. All substances are divided into either inorganic or organic ones. Organic compounds are various hydrocarbon derivatives, all of them containing carbon atoms. Molecules of inorganic compounds may include any other elements in different combinations. Carbon atoms possess the peculiar feature of combining into chains, rings, and other configurations, so that one molecule may contain a hundred carbon atoms. It is therefore not surprising that the number of compounds comprising carbon atoms is much greater than the number of inorganic compounds. Organic compounds form the basis of living organisms, and a science that deals with the substances and processes occurring in organisms is called biochemistry. Recent years have seen the appearance of one more new branchof chemistry, i.e. bioorganic chemistry, which deals with the organic reactions pro- ‘ ceeding in a cell. |Ions of various metals can bind to orgatrtc molecules in a living organism to form enzymes (biological catalysts), haemoglobin (the carrier of oxygen), and other important substances. These are the compounds studied in bioinorganic chemistry, a science which appeared a few years ago. There are also other branches of chemistry related to biology, medicine, and agriculture, e.g. pharmaceutical, tox-icological, and agricultural chemistries. It is also necessary to mention here a chemistry of high-molecular compounds (polymers). Molecules of these compounds, both organic and inorganic, consist of a large and indefinite number of identical units.
We have briefly informed the reader about the focus of chemistry and the relationship between chemistry and physics. It should be noted, however, that scientists have not yet arrived at a general conclusion on what should be considered the focus of chemistry. Only a few (far from all) branches of modem chemistry were mentioned here; other chemical branches, and the most important chemical concepts, substances and techniques employed in chemistry will be discussed former on.
Why Is Rubber Elastic?
Try to bend or stretch out an iron nail with your hands and you will see that your attempts will fail. But when you take a rubber band and repeat your test, the results will be quite different. Indeed, in order to stretch a rubber
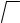
6
band by only a one-hundredth fraction of its length, a force must be applied that is 100 000 times less than that required to stretch an iron nail by the same amount. However, the force that must be applied is not the only thing that makes these materials different. The rubber band can be stretched to ten times its original length, and the band will not break. The ability of rubber to experience tension is 1000 times greater than the extensibility of solids under normal conditions. What is responsible for this remarkable property? Surely, the answer must lie in the molecular structure of the substance. People began to use rubber articles a long time ago, but the theory that could explain its elasticity was only developed in 1932 by the Swiss scientist Mayer. Rubber is formed from caoutchouc (crude rubber), which had formerly been cured over a fire into a solid, dark mass. This substance consists of long polymer molecules, in which certain carbon atoms are connected by double bonds. Each molecule of caoutchouc includes several thousands of units, and therefore the molecular mass. of the substance reaches hundreds of thousands. What is the length of the polymer molecule? If the polymer molecule is stretched out to form a thread, its length will equal about a micron. A silk thread that is one-half metre long can be a «model» of such a molecule because it reflects the relationship between the width of the molecule and its length. We used the expression «stretch out» most appropriately because in reality the molecules of solid or liquid polymers are shaped like a zigzag. When placed on the surface of water, the thread, i.e. the model of the molecule, will acquire the form of an unusual curve. The form of the molecule can be predicted theoretically. Run an experiment that resembles blind man’s buff. Cover your friend’s eyes with a kerchief, turn him around several times and then ask him to take a step. Plot the direction of his motion on paper. Then, repeat everything once more and you will obtain a broken curve — a mathematical model of a polymer molecule. The more times the experiment is run, the more the form of the sketch will approach an average statistical molecule. One can determine the dimensions of such a ball. It should be mentioned, however, that real molecules occupy a threedimensionalspace, while the experiment was run in a plane. Nevertheless, the principle of analysis is the same. The distance between the ends of the
molecule r, as well as the distance between the start and uhe end of your friend’s path, can be expressed by the formula
r = l
where l is the length of a step and n is me number of steps. Of course,
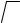
7
this doesn’t mean that if you measure the distance r with a ruler (in metres), the result will coincide with the value calculated from the formula. But the more times you repeat the game, me closer r will approach the calculated value. Therefore, r is called an average statistical quantity. The length of a molecule, i.e. the path covered by your friend, is expressed by h = ln. The ratio h/r shows the degree of «convolution» of the molecule or the degree of «futility» of your friend’s wanderings. It is equal to
h / r = 
i.e. the longer the molecule, the more it is coiled up.
One can assume that the reason for the elasticity of rubber is that when it is stretched out, the coiled molecules become straightened. The assumption is correct, except for one «but». Let us model the following process: place several threads on a water surface so that they do not contact. Take the ends of two threads and move the threads apart. The threads will not return to the initial positions, and reversible elasticity will not be observed. We have thus created a model soft plastic paraffin, rather than rubber. Now, tie nine threads together into a regular network and place mis chain on the water surface. Carefully pull on one end of the network, while holding the other end. When you release the ends of the network, it will return to its initial position. This is a model of rubber. The «ties» that bind together separate caoutchouc molecules in the rubber are the bridges of sulphur atoms. These bridges are introduced during the vulcanization of caoutchouc when it is treated with sulphur at elevated temperatures.
Several questions may have arisen during this explanation.
What makes the stretched network return to the initial state after the tensile force is removed? The fact is that molecules possess kinetic energy and therefore they are always in motion. In rubber, cross-links do not permit large molecules to move relative to one another under the action of heat. However, thermal motion «pushes apart» separate parts of the molecules and coils up long molecules. It is precisely this thermal motion that returns the network to its initial position. If a piece of rubber is stretched and then freezed at a very low temperature, its molecules lose a considerable part of their kinetic energy, and me stretched rubber cannot return to its initial state. But when heated to room temperature, it shrinks again. Rubber has another remarkable property. It is known that all «normal» bodies and liquids expand when they are heated. Rubber, on the contrary, shrinks when heated. You can check this by running the following experiment. Hammer two nails into a stick and connect them with a metallic spring and a rubber band. If the
8
rubber band is placed in hot water, it shrinks, which can be seen from the extension of the spring. When the temperature is raised, the kinetic energy of the molecules is increased, and the network tends to shrink.
Caoutchouc does not contain sulphur cross-links and therefore separate molecules are not connected to each other. Nevertheless, caoutchouc can be reversibly extended (though it resembles paraffin). This occurs because there are «ties» in the caoutchouc that connect long molecules together. The «ties» are formed when these molecules are entangled or interwoven like separate fibres in a piece of cotton wool. Since there are no strong «ties» that can bind separate caoutchouc molecules, the latter is less elastic than rubber, and can dissolve in benzene, while rubber only swells (you can check this experimentally). Why can many polymers, such as polyethylene, be extended irreversibly, i.e. why don’t they shrink when the tensile force is removed? The point is that unlike caoutchouc molecules, the molecules of polyethylene are arranged as in a crystal. Such molecules can only slide relative to one another.
We mentioned that the molecular masses of polymers are very large and have been determined for all polymers; we also noted that the real length of the polymer molecule is smaller than the length of the stretched molecule. How do scientists determine these quantities? — Since even large, long polymer molecules cannot be seen under a microscope, indirect methods, are used. The simplest way to determine the molecular mass of a substance is to measure the increase in the boiling point of a solution. Dissolve some table salt in water and heat the solution to boiling. Heat the same volume of pure water under the same conditions, and you will see that the solution boils at a higher temperature than the pure water. In the same way, a salt solution freezes at a lower temperature than pure water. This can be verified by placing two liquids in a refrigerator. The difference between the boiling and freezing points of solution and pure solvent depends on the concentration of solute and its molecular mass. How can the shape of molecules be determined? The shape of molecules in solution can be established by measuring the viscosity of the solution. The longer the molecules and the more they are stretched into a chain, the easier they become entangled and the greater the resistance they exert against the «flowing» water molecules. The following rough analogy can be drawn: the sand from the bottom of a river, which consists of fine particles, can easily be passed through a conical funnel. A piece of cotton wool, however, is drawn through the funnel with difficulty because the wool consists of long entangled fibres.

9
In concluding this discussion, let us express an idea from the realm of science fiction. The principle of rubber elasticity can be expressed as follows
And now imagine that a substance is synthesized, whose molecules consist of a variety of rings coupled together to form a chain. Scientists already know how to connect two or three rings into a chain. But if a molecule consists of hundreds or even thousands of such rings, the stretched
Our Food molecule will be represented as
Thus, it becomes obvious that the extensibility of such a polymer should be thousands of times greater than the extensibility of common rubber.
Our Food
A human organism can, in a sense, be compared to an internalcombustion engine, because it converts the chemical energy of substances taken in with the food into motion and heat. The components of food — proteins, carbohydrates, fats, vitamins, salts, and water — are vitally important and necessary for an organism, and each of them has a specific function. Carbohydrates are a «fuel» for humans and animals. These substances have tlie general formula Cx (H2O)y and this is why they are called carbohydrates. For example, the formula of the most well-known and important carbohydrate, glucose, is C6H12O6 or C6(H2O)6. The structure of a glucose molecule reveals that this substance can be simultaneously regarded as an alcohol with five hydroxyl groups OH and an aldehyde that contains a CHO group. Glucose molecules can exist in three forms that are in a dynamic equilibrium, i.e. two cyclic and one opened forms. Hydroxyl and aldehyde groups in the glucose can be identified by the following test. Add 2 or 3 drops of sodium hydroxide to a few drops of an aqueous glucose solution in a glass, and then add a copper sulphate solution dropwise until a persistent turbidity forms.
Представлено сочинение на английском языке Химия/ Chemistry с переводом на русский язык.
| Chemistry | Химия |
| My name is Egor. I’m 15 years old and I study at a local state school. Chemistry is one of my favourite subjects at school. It is not a separate discipline. It is connected with such subjects as Biology or Physics, which I also enjoy. | Меня зовут Егор. Мне 15 лет и я учусь в местной общеобразовательной школе. Химия является одним из моих любимых предметов в школе. Это не отдельная дисциплина. Она связано с такими предметами, как биология или физика, которые мне также нравятся. |
| I think it’s important to know the basics of chemistry in order to understand the world around us. Everything that we see, hear, smell, taste, and touch involves chemistry, chemicals and certain reactions. In more formal words, chemistry is the study of matter and changes it can undergo. Matter is anything that has mass and occupies space, anything we can touch or hold. | Я думаю, что важно знать основы химии, чтобы понять мир вокруг нас. Все, что мы видим, слышим, обоняем, пробуем на вкус и осязаем, имеет в основе своей химию, химические вещества и реакции. В более официальной формулировке, химия является наукой изучающей материю и изменения, которым она может подвергаться. Материя – всё, что имеет массу и занимает место, все, чего можно касаться и держать. |
| Many pupils in my class think that chemistry is just a mixture of strange explosive substances in laboratories. However, I know that it’s not true. Everything around us is made of chemicals. | Многие ученики в моем классе думают, что химия это просто странная смесь взрывчатых веществ в лабораториях. Однако, я знаю, что это неправда. Все вокруг нас состоит из химических веществ. |
| To understand better how chemicals work together, it’s necessary to know the periodic table of elements. This table of chemicals was created by a famous Russian chemist and inventor Dmitri Ivanovich Mendeleev in the 19th century. All in all, there are approximately 118 chemical elements, among them calcium, hydrogen, silver, barium, lead, platinum, copper and many others. All things around us are made of various combinations of these elements. The wonder of chemistry is that when these basic particles are combined, we get something new and unique. | Чтобы лучше понять, как сочетаются химические вещества, необходимо знать периодическую таблицу элементов. Эта таблица химических веществ была создана знаменитым русским химиком и изобретателем Дмитрием Ивановичем Менделеевым в 19 веке. В общей совокупности существует приблизительно 118 химических элементов, среди которых кальций, водород, серебро, барий, свинец, платина, медь и многие другие. Все окружающие нас вещи сделаны из различных комбинаций этих элементов. Чудо химии состоит в том, что, когда эти основные частицы объединяются, мы получаем что-то новое и уникальное. |
| The only drawback of chemistry is that some people use certain elements to create chemical weapon and explosive substances, which are then used by terrorists. In my opinion, chemistry should be explored only for positive changes in the world. | Единственным недостатком химии является то, что некоторые люди используют определенные элементы для создания химического оружия и взрывчатых веществ, которые затем используются террористами. На мой взгляд, химия должна изучаться только для положительных изменений в мире. |
Для начала проигрывания записи нажмите PLAY
Your browser does not support the audio element.
Nitrogen
Nitrogen was discovered by Rutherford and by Priesuey, working independently, in 1772. When free from moisture and carbon dioxide, air contains approximately 78 per cent of nitrogen by volume. Most of the nitrogen used commercially is produced by the fractional distillation of liquid air. This commercial nitrogen is usually supplied with a guaranteed purity of 99.7 per cent. The small amount of oxygen remaining may be removed by passing the gas through a tube containing copper turnings at bright red heat or by washing in chromous chloride solution.
Preparation from compounds
There are various ways of preparing nitrogen gas in the laboratory. In small quantities, extremely pure nitrogen may be evolved by thermal decomposition of sodium or barium azide in a vacuum. Usually it is prepared by the removal of hydrogen from ammonia or its compounds in one or other of the following ways:
1. Ammonia or a mixture of ammonia and nitric oxide is passed over cupric oxide at high temperature.
2. Ammonia is passed into a solution of bromine and caustic soda in water. The resultant oxidation of the ammonia releases nitrogen.
3. The decomposition by heat of a solution of ammonium nitrite, or of a mixture of sodium nitrite and ammonium chloride, yields nitrogen.
4. Ammonium dichromate decomposes violently on heating, giving off nitrogen and leaving a residue of chromic oxide.
Pure nitrogen gas is colourless, odourless and tasteless. It has slight solubility in water, has no action on litmus and does not turn lime water milky.
It does not support combustion or respiration, although it is non-poisonous.
If nitrogen gas at a pressure of approximately 0.1 mm. is subjected to an electric discharge a yellowish-orange glow is emitted. The gas continues to give off a glow for several minutes after the discharge is switched off. It was suggested by Strutt that this «active nitrogen», as it is called, consisted of the gas in its atomic state, and it has since been demonstrated experimentally that active nitrogen consists mainly of normal molecular nitrogen with an admixture of ground-state atoms. The afterglow is a product of the emission-band spectra of excited nitrogen molecules formed as the result of recombination of single atoms of nitrogen.
Nitrogen compounds: Ammonia
Ammonia is a colourless gas, lighter than air, with a pungent smell. It is easily converted into its liquid state, either by refrigeration or by compression.
The solubility of ammonia in water is greater than that of any other gas, 1148 volumes of ammonia being dissolved by I volume of water at 0°, and 739 volumes at 20°. The solution is made by passing ammonia gas into cooled distilled water. All the gas is liberated on boiling.
The Haber process is now most usually used for the production of ammonia. In this process, the constituent elements, hydrogen and nitrogen, in the ratio of 3 volumes to I, are brought together at high temperature and pressure in the presence of a catalyst, generally pure iron mixed with molybdenum or potassium and aluminium oxides. Commercial ammonia prepared by the Haber process contains a small amount of water. This cannot be removed by the usual drying agents, such as sulphuric acid, calcium chloride and phosphorus pentoxide, which all react with ammonia. Drying may be effected, however, by condensing the ammonia in a vessel containing metallic sodium.
The sodium dissolves, forming a blue liquid, and reacts with any water present.
The blue liquid may then be distilled to yield ammonia of a high degree of purity.
Азот
Азот был открыт в 1772 году независимо работавшими учеными резерфордом и Пристли. Воздух, освобожденный от воды и двуокиси углерода, содержит приблизительно 78 объемных % азота. Большая часть промышленно используемого азота производится путем фрактальной перегонки сжиженного воздуха. Этот промышленный азот обычно поставляется с гарантированной чистотой 99,7%. Небольшое количество остающегося кислорода может быть удалено пропусканием газа через трубку с раскаленной докрасна медной стружкой или промыванием в растворе хлорида хрома.
Получение азота из азотсодержащих соединений
Существует множество способов получения газообразного азота в лабораторных условиях. В небольших количествах особо чистый азот выделяется при термическом разложении азотистого бария или натрия в вакууме. Обычно его приготовляют удалением водорода из аммиака или аммиакосодержащих соединений одним из следующих способов:
1. Аммиак или смесь аммиака с окисью азота пропускают через окись меди при высокой температуре.
2. Аммиак пропускают через раствор брома или каустической соды в воде. Происходит процесс окисления аммиака, в результате которого высвобождается азот.
3. Разложение раствора нитрита аммония или смеси нитрита натрия с хлоридом аммиака при нагревании дает азот.
4. При нагревании дихромат аммония начинает интенсивно разлагаться, выделяя азот; в осадок выпадает оксид хрома. Чистый газ азот не имеет цвета, запаха и вкуса. Он слабо растворим в воде, не реагирует с лакмусовой бумагой и не замутняет раствор негашеной извести. Не поддерживает горения или дыхания, хотя и не ядовит.
Если через газ азот под давлением приблизительно 0,1 мм рт.ст. пропустить электрический разряд, то происходит желтовато-оранжевая вспышка. Вспышка продолжает светиться в течении нескольких минут досле пропускания разряда. По предположению Стратта этот «активный азот», как его назвали, состоит из газа в атомарном состоянии, и с тех пор экспериментально доказано, что активный азот состоит главным образом з нормального молекулярного азота с примесью атомов в основном состоянии. Вспышка — это продукт излучаемого спектра возбужденных молекул азота, образующихся в результате рекомбинации одиночных атомов азота.
Азотсодержащие соединения: Аммиак
Аммиак это бесцветный газ, легче воздуха с едким запахом. Он легко обращается в жидкое состояние путем замораживания или под давлением. Растворимость аммиака в воде больше, чем любого другого газа: 1148 частей аммиака на 1 часть воды при температуре 0 градусов Цельсия, и 739 частей при 20 градусах. Раствор получается пропусканием газообразного аммиака через охлажденную дистиллированную воду. Весь газ высвобождается при кипячении.
Для производства аммиака сейчас наиболее часто используется процесс Хейбера. При этом процессе составляющие элементы, водород и азот в соотношении 3:1, смешиваются вместе при высокой температуре и давлении в присутствии катализатора — обычно это смесь чистого железа с молибденом или калия с оксидом алюминия. Промышленный аммиак получают процессом Хейбера при малом количестве воды. Она не удаляется обычными абсорбентами, такими как серная кислота, хлорид кальция и оксид фосфора (V), поскольку все они вступают в реакцию с аммиаком.
Однако, вода может быть эффективно выпарена при конденсации аммиака в сосуде, содержащем металлизированный натрий. Натрий растворяется, образуя голубую жидкость, и вступает в реакцию с любой наличествующей водой. Для получения аммиака с высокой степенью очистки голубую жидкость дистиллируют.
My favorite school subject: Chemistry
My favorite subject is chemistry. Thanks to our teacher, we will learn many interesting facts. For instance, why cooking changes raw, tough food into a tasty meal? The answer is simple: cooking is just one example of a chemical reaction that converts raw materials into new substances.
Scientists use chemical reactions to make plastics, medicines, dyes, and many other materials that are important in everyday life. They also study what substances are made of and how they can be combined to make new materials. Chemicals are the materials used by a chemist.
More than four million different chemicals have been made by chemists; there are about thirty-five thousand chemicals in current use. These chemicals can be made by combining simple substances, called elements, into more complicated substances called compounds.
Early chemists considered four elements — fire, water, air, and earth. The most common element in the universe is hydrogen, which is the main component of stars.
Elements are substances that are made of a single kind of atom. When different elements combine, their atoms join to produce a new substance, which is called a compound. For example, common salt is a compound called sodium chloride. It is made by combining the element sodium and the element chlorine. When the two elements combine, they form a compound that is entirely different from either of the elements used to produce it.
When different substances combine to form new materials, a chemical reaction occurs. Some reactions need heat to start them off; others produce heat as the reaction proceeds.
Перевод
Мой любимый предмет ‒ химия. Благодаря нашему учителю мы узнаем много интересных фактов. Например, почему приготовление пищи превращает сырую, жесткую пищу во вкусную еду? Ответ прост: готовкой является лишь одним из примеров химической реакции, которая превращает сырье в новые вещества.
Ученые используют химические реакции для производства пластмасс, лекарств, красителей и многих других материалов, которые важны в повседневной жизни. Они также изучают, из чего состоят вещества и как их можно комбинировать для создания новых материалов. Химические вещества — это материалы, используемые химиком.
Более четырех миллионов различных химических веществ было сделано химиками; в настоящее время используется около тридцати пяти тысяч химических веществ. Эти химические вещества могут быть получены путем объединения простых веществ, называемых элементами, в более сложные вещества, называемые соединениями.
Ранние химики рассматривали четыре элемента ‒ огонь, воду, воздух и землю. Наиболее распространенным элементом во вселенной является водород, который является основным компонентом звезд.
Элементы ‒ это вещества, которые состоят из одного вида атома. Когда различные элементы объединяются, их атомы также объединяются, чтобы произвести новое вещество, которое называется соединением. Например, обычная соль представляет собой соединение, называемое хлоридом натрия. Её получают, комбинируя элемент натрий и хлор элемента. Когда два элемента объединяются, они образуют соединение, которое полностью отличается от любого из элементов, используемых для его создания.
Когда различные вещества объединяются, чтобы сформировать новые материалы, происходит химическая реакция. Некоторые реакции нуждаются в тепле, чтобы начать их; другие выделяют тепло по мере протекания реакции.
Мой любимый школьный предмет: Химия — 3.7 out of
5
based on
3 votes
- Текст
- Веб-страница
Dmitry Ivanovich Mendeleyev is a famous Russian chemist. He is best known
for his development of the periodic table of the properties of the chemical elements.
This table displays that elements’ properties are changed periodically when they are
arranged according to atomic weight.
Mendeleyev was born in 1834 in Tobolsk, Siberia. He studied chemistry at the
University of St. Petersburg, and in 1859 he was sent to study at the University of
Heidelberg. Mendeleyev returned to St. Petersburg and became Professor of
Chemistry at the Technical Institute in 1863. He became Professor of General
Chemistry at the University of St. Petersburg in 1866. Mendeleyev was a well-
known teacher, and, because there was no good textbook in chemistry at that time,
he wrote the two-volume “Principles of Chemistry” which became a classic
textbook in chemistry.
In this book Mendeleyev tried to classify the elements according to their
chemical properties. In 1869 he published his first version of his periodic table of
elements. In 1871 he published an improved version of the periodic table, in which
he left gaps for elements that were not known at that time. His table and theories
were proved later when three predicted elements: gallium, germanium, and
scandium were discovered.
Mendeleyev investigated the chemical theory of solution. He found that the
best proportion of alcohol and water in vodka is 40%. He also investigated the
thermal expansion of liquids and the nature of petroleum.
In 1893 he became director of the Bureau of Weights and Measures in St.
Petersburg and held this position until his death in 1907.
0/5000
Результаты (русский) 1: [копия]
Скопировано!
Дмитрий Иванович Менделеев — знаменитый русский химик. Он является самым известным для его развития свойств химических элементов таблицы Менделеева. Эта таблица показывает, что элементы свойства изменяются периодически, когда они упорядоченные атомный вес. Менделеев родился в 1834 году в Тобольск, Сибирь. Он изучал химию в Университет Санкт-Петербурга и в 1859 году он был направлен на учебу в университете Гейдельберг. Менделеев возвращается в Петербург и стал профессором Химия в техническом институте в 1863 году. Он стал профессором общего Химии в университете Санкт-Петербурге в 1866 году. Менделеев был хорошо-известный учитель, и, потому, что там был не хороший учебник по химии в то время, Он написал в двух томах» принципы химии» ставший классическим Учебник по химии. В этой книге Менделеев пытался классифицировать элементы согласно их химические свойства. В 1869 году он опубликовал свою первую версию его периодической таблицы элементы. В 1871 году он опубликовал усовершенствованный вариант периодической таблицы, в которой Он оставил пробелы для элементов, которые не были известны в то время. Его таблица и теории позже подтвердились, когда три предсказал элементы: галлий, германий, и были обнаружены скандия. Менделеев исследовал химические теории решения. Он обнаружил, что Лучшие пропорции спирта и воды в водке-40%. Он также исследовал тепловое расширение жидкостей и характер нефти. В 1893 году он стал директором бюро мер и весов в Св. Петербург и занимал этот пост до своей смерти в 1907 году.
переводится, пожалуйста, подождите..
Результаты (русский) 2:[копия]
Скопировано!
Дмитрий Иванович Менделеев является известный русский химик. Он является самым известным
за его развитие периодической таблицы свойств химических элементов.
Эта таблица показывает, что свойства элементов »меняются периодически, когда они
расположены в соответствии с атомным весом.
Менделеев родился в 1834 году в Тобольске, Сибири. Он изучал химию в
университете Санкт-Петербурга, а в 1859 году он был направлен на учебу в университете
Гейдельберга. Менделеев вернулся в Санкт-Петербурге и стал профессором
химии в Техническом институте в 1863 году он стал профессором Генеральной
химии в университете Санкт-Петербурга в 1866 году Менделеев хорошо
учитель известно, и, поскольку не было никакого хороший учебник в области химии в то время,
он написал двухтомный «Основы химии», которая стала классикой
учебник по химии.
В этой книге Менделеев пытался классифицировать элементы в соответствии с их
химическими свойствами. В 1869 году он опубликовал свою первую версию своего периодической таблицы
элементов. В 1871 году он опубликовал улучшенную версию периодической таблицы, в которой
он оставил пробелы для элементов, которые не были известны в то время. Его стол и теории
были доказаны позже, когда три предсказал элементы: галлий, германий, и
скандия были обнаружены.
Менделеева исследовали химический теорию решения. Он обнаружил, что
лучшее соотношение спирта и воды в водке составляет 40%. Он также исследовал
тепловое расширение жидкостей и характер нефти.
В 1893 году он стал директором Бюро мер и весов в Санкт-
Петербурге и занимал эту должность до своей смерти в 1907.
переводится, пожалуйста, подождите..
Результаты (русский) 3:[копия]
Скопировано!
Дмитрий Иванович Московский химико — всемирно известный химик. Он лучше всего известна
для его развития в периодической таблицы свойства химических элементов.
Данная таблица показывает, что элементы» свойства, периодически меняться при их
расположены в соответствии с атомной вес.
Московский химико родился в 1834 году в городе Тобольске, Сибири. Родился на
Университет Санкт-Петербург,И в 1859 году он был отправлен в исследования в университете
Хайдельберга. Термохимические исследования вернулось в Санкт-Петербург и стал профессор
химии в технический институт в 1863 году. Он стал профессор общие
химии в Санкт-Петербурге в 1866 году. Московский химико —
известный учитель, и, поскольку не было учебника по химии в это время,
Он писал в «Принципы химии», который стал классическим
учебник по химии.
В этой книге Николай Кисленко попытался классифицировать элементы в соответствии с их
химические свойства. В 1869 году он опубликовал свою первую версию его периодической таблицы
элементы. В 1871 году он опубликовал усовершенствованный вариант периодической таблицы, в которой
Он оставил для элементов, которые не были известны в то время. Его стола и теории
было доказано позднее, когда три предсказать элементы: галлия, наноструктур и
скандия были обнаружены.
Московский химико расследование химической теории решения. Он пришел к выводу, что
оптимальной доли спирта и воды в водки — 40 %. Он также изучал
температурного расширения жидкостей и характера нефти.
В 1893 году он был назначен директором Бюро Мер и Весов в Сент-
Санкт-Петербург и занимал этот пост до своей смерти в 1907 году.
переводится, пожалуйста, подождите..
Другие языки
- English
- Français
- Deutsch
- 中文(简体)
- 中文(繁体)
- 日本語
- 한국어
- Español
- Português
- Русский
- Italiano
- Nederlands
- Ελληνικά
- العربية
- Polski
- Català
- ภาษาไทย
- Svenska
- Dansk
- Suomi
- Indonesia
- Tiếng Việt
- Melayu
- Norsk
- Čeština
- فارسی
Поддержка инструмент перевода: Клингонский (pIqaD), Определить язык, азербайджанский, албанский, амхарский, английский, арабский, армянский, африкаанс, баскский, белорусский, бенгальский, бирманский, болгарский, боснийский, валлийский, венгерский, вьетнамский, гавайский, галисийский, греческий, грузинский, гуджарати, датский, зулу, иврит, игбо, идиш, индонезийский, ирландский, исландский, испанский, итальянский, йоруба, казахский, каннада, каталанский, киргизский, китайский, китайский традиционный, корейский, корсиканский, креольский (Гаити), курманджи, кхмерский, кхоса, лаосский, латинский, латышский, литовский, люксембургский, македонский, малагасийский, малайский, малаялам, мальтийский, маори, маратхи, монгольский, немецкий, непальский, нидерландский, норвежский, ория, панджаби, персидский, польский, португальский, пушту, руанда, румынский, русский, самоанский, себуанский, сербский, сесото, сингальский, синдхи, словацкий, словенский, сомалийский, суахили, суданский, таджикский, тайский, тамильский, татарский, телугу, турецкий, туркменский, узбекский, уйгурский, украинский, урду, филиппинский, финский, французский, фризский, хауса, хинди, хмонг, хорватский, чева, чешский, шведский, шона, шотландский (гэльский), эсперанто, эстонский, яванский, японский, Язык перевода.
- I hope tomorrow everything will be fine
- and you have good shape.you can be a mod
- Честно говоря я хочу жить в Корее. Это д
- 힝
- pulvus solubilis
- How do you use this word
- Я очень очень очень хочу тебя видеть. sk
- i am going to read
- CINE ESTI?
- Можешь бросить меня ?
- я проснулся,
- ДЛЯ МЕНЯ ГЛАВНОЕ ЛЮБОВЬ ВЕРНОСТЬ ЗАБОТА
- Да, для того чтобы поблагодарить за приг
- i am about to read
- когда ты ложишься спать
- Куда их отправить
- Павел тоже не имеет времени потому что о
- мне нравятся
- Leeren Sie das Gehäuse in regelmä-ßige
- pulvus sterilis
- 힝 ㅠㅠ
- Start a game between 8PM and midnight
- Leeren Sie das Gehäuse in regelmäßigen
- actually i think you might have to verif



