Атомы — это маленькие частицы, из которых состоит вещество. Невозможно даже представить себе, насколько они малы. Если сложить в цепочку сто миллионов атомов, у нас получится ниточка длиной всего лишь в 1 см. В тонком листе бумаги, наверное, не меньше миллиона слоев атомов. Науке известно более ста видов атомов; соединяясь друг с другом, они образуют все окружающие нас вещества.
 Представление об атомах
Представление об атомах
Мысль о том, что всё в природе состоит из атомов, возникла давно. Еще 2500 лет назад древнегреческие философы полагали, что вещество состоит из таких частиц, которые нельзя разделить. Само слово «атом» восходит к греческому слову «атомос», что значит «неделимый». В Древней Греции (см. статью «Загадочные жители Греции«) философы обсуждали гипотезу о том, что всё вещество в мире состоит из неделимых частиц. Правда, Аристотель в этом сомневался.
Термин «атом» был впервые использован английским химиком Джоном Дальтоном (1766- 1844). В 1807 г. Дальтон выдвинул свою атомную теорию. Атомами он назвал составляющие всякое вещество малые частицы, которые не изменяются входе химических реакций. Согласно Дальтону, химическая реакция — это процесс, при котором атомы соединяются вместе или отделяются друг от друга. Атомная теория Дальтона лежит в основе представлений современных ученых.
В начале нашего столетия ученые начали строить модели атомов. Эрнест Резерфорд (1871 — 1937) показал, что отрицательно заряженные электроны обращаются вокруг положительно заряженного ядра. Нильс Бор (1885 — 1962) утверждал, что электроны обращаются по определенным орбитам. В 1932 г. Джеймс Чедвик (1891 — 1974) установил, что ядро атома состоит из частиц, которые он назвал протонами и нейтронами.
![Структура атома строение и структура атома]() Структура атома
Структура атома
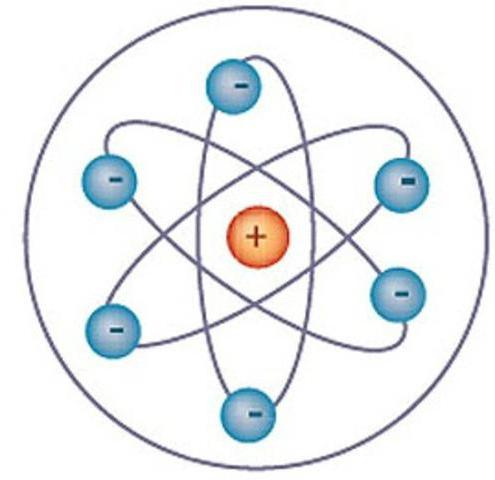
Атомы состоят из еще меньших, чем они сами, частиц, называемых элементарными. Центром атома является его ядро. Оно состоит из элементарных частиц двух видов — протонов и нейтронов. Есть в атоме также другие элементарные частицы — электроны; они вращаются вокруг ядра. Существует множество разных элементарных частиц. Ученые считают, что протоны и нейтроны состоят из кварков. Элементарные частицы, входящие в состав атома, удерживаются вместе благодаря своим электрическим зарядам. Протоны заряжены положительно, а электроны — отрицательно. Нейтроны заряда не имеют, т.е. являются электрически нейтральными. Частицы, несущие противоположные электрические заряды, притягиваются друг к другу. Притяжение отрицательно заряженных электронов к положительно заряженным протонам, находящимся в атомном ядре, удерживает электроны на орбитах около этого ядра. В состав атома входит одинаковое число положительно заряженных протонов и отрицательно заряженных электронов, и атом электрически нейтрален.
Электроны в атоме находятся на разных энергетических уровнях, или оболочках. Каждая оболочка состоит из определенного числа электронов. Когда очередная оболочка заполняется, новые электроны попадают на следующую оболочку. Большую часть объема атома занимает пустое пространство между элементарными частицами. Отрицательно заряженные электроны удерживаются на своих энергетических уровнях силой притяжения к положительно заряженным протонам ядра.
Строение атома часто описывают строгой диаграммой, однако сегодня ученые полагают, что электроны существуют на своих орбитах в размытом состоянии. Это представление отражено на рисунке, где электронные орбиты представлены в виде «облаков». Так вы бы увидели молекулу под электронным микроскопом. Равными цветами показаны разные уровни плотности электронов. Бирюзовым цветом отмечена область наибольшей плотности.
Атомный номер и атомная масса
Атомный номер — это число протонов в атомном ядре. Как правило, в состав атома входит одинаковое число протонов и электронов, поэтому по атомному номеру можно судить и о том, сколько в атоме электронов. В разных атомах содержится разное количество протонов. В ядре атома фосфора 15 протонов и 16 нейтронов, значит, его атомный номер 15. В ядре атома золота 79 протонов и 118 нейтронов: следовательно, атомный номер золота 79.
Чем больше протонов и нейтронов имеет атом, тем больше его масса (величина, показывающая количество вещества в составе атома). Сумму числа протонов и числа нейтронов мы называем атомной массой. Атомная масса фосфора — 31. При исчислении атомной массы электроны в расчет не принимаются, так как их масса ничтожно мала по сравнению с массой атома. Существует особый прибор — масс-спектрометр. Он позволяет определить для каждого данного атома его массу.
![три изотопа углерода три изотопа углерода]() Изотопы
Изотопы
У большинства элементов существуют изотопы, атомы которых имеют несколько отличное строение. Количество протонов и электронов в атомах изотопов одного элемента всегда неизменно. Атомы изотопов различаются числом нейтронов в ядре. Следовательно, у всех изотопов одного элемента один и тот же атомный номер, но разная атомная масса. На этом рисунке вы видите три изотопа углерода. У изотопа С12 есть 6 нейтронов и 6 протонов. С13 имеет 7 нейтронов. В ядре изотопа С12 восемь нейтронов и 6 протонов.
Физические свойства изотопов различны, но они обладают одинаковыми химическими свойствами. Обычно большая часть атомов элемента (вещества, состоящего из атомов одного вида) принадлежит к одному изотопу, а другие изотопы встречаются в меньших количествах.
Молекулы
Атомы редко встречаются и свободном состоянии. Как правило, они связываются друг с другом и образуют молекулы либо другие, более массивные структуры. Молекула — это мельчайшая частица вещества, которая может существовать самостоятельно. Она состоит из атомов, удерживающихся вместе при помощи связей. Например, у молекулы воды два атома водорода связанны с атомом кислорода. Атомы удерживаются вместе благодаря электрическим зарядам частиц, из которых они состоят. Описывая строение молекул, ученые прибегают к помощи моделей. Как правило, они пользуются структурными и пространственными моделями. Структурные модели представляют связи, удерживающие атомы вместе, в виде палочек. В пространственных моделях атомы плотно соединены друг с другом. Конечно, модель не похожа на настоящую молекулу. Модели строятся для того, чтобы показать, из каких атомов та или иная молекула состоит.
Химические формулы
Химическая формула вещества показывает, сколько атомов каких элементов входит в состав одной молекулы. Каждый атом обозначается символом. Как правило, в качестве символа выбирается первая буква английского, латинского или арабского названия элемента. Например, молекула углекислою газа состоит из двух атомов кислорода и одного атома углерода, поэтому формула углекислого газа СО2. Двойка Атомы обозначает число атомов кислорода в молекуле.
Этот опыт продемонстрирует вам, что молекулы вещества удерживаются вместе силами притяжения. Наполните стакан водой до краев. Осторожно опустите в стакан несколько монет. Вы увидите, что над краями стакана приподнялся водяной купол. Сила, притягивающая молекулы воды друг к другу, может удержать некоторое количество воды над краями стакана. Эта сила называется силой поверхностного натяжения.
«Атомы, молекулы и ионы»
Ключевые слова конспекта: Атомно-молекулярное учение, атомы, молекулы и ионы, элементарные частицы, ядро, электрон, протон, нейтрон.
Древнегреческий философ Демокрит 2500 лет назад предположил, что все тела состоят из мельчайших, невидимых, неделимых, вечно движущихся частиц — атомов. В переводе «атом» означает «неделимый».
Учение о молекулах и атомах в основном было разработано в XVIII— XIX вв. Великий русский учёный М. В. Ломоносов утверждал, что тела в природе состоят из корпускул (молекул), в состав которых входят элементы (атомы). Многообразие веществ учёный объяснял соединением разных атомов в молекулах и различным расположением атомов в них.
Основоположником атомно-молекулярного учения принято считать известного английского учёного Джона Дальтона. Тем не менее некоторые представления об атомах и молекулах, высказанные Ломоносовым за полвека до Дальтона, оказались более достоверными, научными. Например, английский учёный отрицал возможность существования молекул, образованных одинаковыми атомами.
Атомно-молекулярное учение получило окончательное признание только в 1860 г. на Всемирном съезде химиков в Карлсруэ.
Молекулы
Каждое отдельно взятое вещество состоит из одинаковых молекул. Например, вещество вода состоит из молекул воды. Но размеры молекул воды очень малы, поэтому даже маленькая капелька воды содержит огромное количество молекул, которые имеют одинаковые состав и свойства.
Молекулы — это мельчайшие частицы многих веществ, состав и химические свойства которых такие же, как у данного вещества. При химических реакциях молекулы распадаются, то есть они являются химически делимыми частицами. Молекулы состоят из атомов.
Атомы
Следует иметь в виду, что существуют также вещества, состоящие из отдельных одинаковых атомов. Мельчайшими частицами, сохраняющими характерные химические свойства таких веществ, являются атомы. Так, из отдельных атомов состоят благородные газы — гелий, неон, аргон и др. Атомы в отличие от молекул в ходе химических реакций не делятся на более мелкие части.
Атомы — это мельчайшие химически неделимые частицы вещества.
Элементарные частицы
В конце XIX—начале XX в. было обнаружено, что атомы состоят из ешё более мелких частиц. Эти частицы были названы элементарными частицами. В центре атома находится положительно заряженное ядро, вокруг которого находятся отрицательно заряженные частицы — электроны. Заряд электрона принято считать равным —1.
Ядро атома, в свою очередь, также состоит из элементарных частиц. В состав ядер атомов входят положительно заряженные частицы — протоны и частицы, имеющие почти такую же массу, как протоны, но не имеющие заряда,— нейтроны. Заряд протона численно равен заряду электрона, но имеет противоположный знак (+1).
Например, атом водорода состоит из ядра, в котором находится только один протон и один электрон. Атом гелия состоит из ядра, в котором находятся 2 протона и 2 нейтрона, а также 2 электрона. Атом лития состоит из ядра, в котором находятся 3 протона, 4 нейтрона, а также 3 электрона.
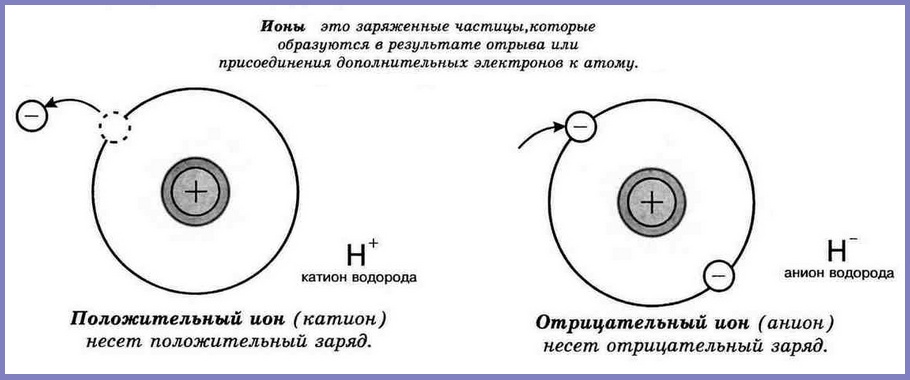
Ионы
Одни атомы, взаимодействуя с другими атомами, могут терять или, наоборот, приобретать один или более электронов. В результате электрически нейтральный атом превращается в заряженную частицу — ион. Если атом теряет один или несколько электронов, его называют положительно заряженным ионом. Атом, дополнительно присоединивший один или несколько электронов, называют отрицательно заряженным ионом. Противоположно заряженные ионы притягиваются друг к другу. Подробнее электронно-ионная теория рассматривается в курсе физики (читать Конспект «Электронно-ионная теория»)
Конспект урока «Атомы, молекулы и ионы».
Следующая тема: «Простые и сложные вещества».
Прочитав заголовок статьи, вы можете удивиться: как и зачем придумывать сказки о молекуле? 7 класс — это примерное время, когда среднестатистический школьник знакомится с наукой физикой. Однако начать объяснять ребенку устройство мира можно с самого детства, ведь именно в маленьком возрасте у малыша формируется мировоззрение и складывается картина мира. Если вовремя заложить в ребенке основные фундаментальные знания, то в будущем он будет воспринимать серьезную информацию легче, чем сверстники. Как придумать сказку про молекулу, чтобы тема стала понятной малышу?
Основные правила сочинения сказок
В первую очередь ваш рассказ должен отражать саму суть молекул. Значит, за основу можно взять частицы одного из самых распространенных элементов нашей планеты и дополнить ее яркими приключениями выбранной молекулы.
Во-вторых, для малыша очень важна визуальная информация, поэтому рекомендуется нарисовать несколько интересных тематических картинок. На рисунках можно изобразить несколько разноцветных молекул и главные принципы их устройства. С их помощью малыш лучше усвоит материал. Также во время чтения придуманной сказки про молекулу очень важно вести с малышом диалог, пытаться вовлечь его в обсуждение, попутно задавая вопросы. Вы удивитесь, когда увидите, насколько ребенок может быть смышленым и догадливым. Многие законы мироустройства дети понимают на интуитивном уровне, вот почему можно смело начать изучать окружающий мир в раннем возрасте.
Немного из теории
Прежде чем рассказывать сказку про атомы и молекулы, стоит подробно разузнать, как вообще происходят молекулярные процессы в действительности, чтобы ответить малышу на любой его вопрос. Итак, все живое и неживое на нашей планете состоит из атомов, каждый из которых, объединяясь с другим атомом, образовывает одну молекулу вещества. Строение атома объяснить весьма просто: в центре находится атомное ядро, а вокруг него движутся несколько электронов. Та сила, с которой молекулы притягиваются друг к другу, называется электромагнитной. Молекулы бывают самых разных видов и могут обладать различными свойствами (например, магнитными или электрическими). А взаимодействие молекул различных веществ изучает наука химия.
Факты из истории
Изучение атомов началось еще в Древней Греции, а в 17-м веке химикам удалось доказать, что атом — это наименьшая неделимая частица. Современные же физики провели ряд опытов, которые показывают, что на самом деле атом может делиться на меньшие субчастицы. В 1860 году на Всемирном съезде химиков в Германии (Карлсруэ) были приняты определения атома и молекулы.
Э. Резерфорд является создателем планетарной модели атома, он доказал свою теорию с помощью опыта по рассеиванию альфа-частиц. В сказке про молекулу можно использовать исторические справки, чтобы пополнить энциклопедические знания ребенка.
Первая волшебная история
Для самых маленьких любознательных малышей можно придумать сказку о том, как молекулы переживают интересные приключения. Например, написать об увлекательном путешествии молекулы воды. Сказка должна содержать детали, близкие интересам малыша. Допустим, если ребенок любит спорт и активные игры, то можно начать историю с того, что молекула воды оказывается на футбольном поле. Ниже приведен пример рассказа, который обязательно понравится малышу.
Можно для начала спросить у ребенка: «А ты слышал уже сказку про молекулу воды? Хочешь расскажу тебе эту волшебную историю? Итак, слушай внимательно».
«Когда-то давно жила на свете маленькая молекула воды по имени Милли, она очень любила путешествовать. У человека есть голова, руки и ноги, а вот у Милли был один атом кислорода и два атома водорода. Однажды, оказавшись высоко-высоко на небе, она попала в облака и там встретила много своих друзей. Вместе они взялись за руки и стали водить хороводы. Но вдруг сильный поток ветра унес их вниз. Пока они летели, они превратились в капельки воды. На землю они выпали в виде дождя, Милли оказалась вместе со своими подружками на стадионе, где намокшие ребята уже собирались идти домой. Милли как раз таки попала на футболку одного мальчишки. Пока он шел домой, на небе снова засияло солнце, и стало очень жарко. Футболка начала потихоньку сохнуть. Вдруг Милли начала испаряться. Она присоединилась к молекулам кислорода, которые летают в нашем воздухе, а затем превратилась в невидимый газ и улетела. До сих пор она путешествует по всему миру, изучая разных птиц в небе, рыб в море и животных на суше».
Сказка про молекулы
По физике не у всех могут быть отличные оценки, так как это весьма сложная наука. Многие темы могут оказаться для ребенка более понятными, если объяснять их простым языком. Лучший вариант — это рассказать интересную историю или даже сказку. Вот один увлекательный рассказ о свойстве молекул видоизменяться.
«Давным-давно на швейной фабрике жили-были молекулы железа. Они выглядели как маленькие кристаллики, но, несмотря на это, считали себя самыми сильными, ничего не боялись. Однажды пошел сильный дождь, который просочился через крышу здания и намочил машинку, где обитали наши молекулы. Тут-то и началась настоящая битва с молекулами воды, которые атаковали молекулы железа. Целых три дня продолжался бой, пока наконец молекулы воды не пробили их защиту. Молекулы железа ослабли, стали терять свой цвет, а потом и вовсе превратились в ржавчину. Бедняжки не знали, что молекулы воды очень сильные, что от них нужно прятаться, поэтому они и погибли».
Сказка про молекулу, способную менять цвет
«Привет, я молекула белой краски, зовут меня Белла. Я живу со своей семьей в небольшой баночке. Однажды я играла с подругами и тут увидела, как большой дядя взял кисточку, опустил прямо в мой домик и снова поднял в воздух. Я не успела убежать, моих друзей, как и меня, поместили на стену. Тут сверху на нас нарисовали красной краской. Молекулы другого цвета сначала не хотели с нами играть, но потом им стало скучно, они заговорили со мной и моими подругами. Мы взялись за руки и стали водить хоровод. Когда мы подружились, наш цвет изменился, мы стали розового цвета. Вся стена в детской комнате покрасилась в наш нежный розовый оттенок. До сих пор мы живем здесь и каждый день видимся с маленькой дочкой нашего хозяина дома. Она нам читает книжки и показывает свои рисунки».
Рекомендации
После прочтения сказок про молекулы обязательно стоит обсудить с ребенком некоторые вопросы. Например, спросить его, какими свойствами обладают различные молекулы и как они вообще выглядят. Если ребенок не понял что-то, необходимо объяснить ему. И затем снова задать вопросы по теме, чтобы закрепить знания.
Для творческих натур предлагаем изготовить модели настоящих молекул. Их можно соорудить из небольших мячиков или шариков, соединив их проволокой. Или вырезать из цветного картона.
Также рекомендуется попросить ребенка придумать собственную сказку. Данный процесс развивает творческое и логическое мышление. Выслушав рассказ ребенка, обязательно похвалите его, ведь именно благодаря похвале у детей появляется желание и мотивация заниматься творчеством.
Содержание
- 1 Общие понятия
- 2 Теория об атомно-молекулярном строении
- 3 Описание атома
- 3.1 Изотопы
- 3.2 Об электронах
- 4 Как заряжен атом?
- 5 Элемент в химии
- 5.1 Основная характеристика химического элемента
- 5.2 Обозначения элементов
- 6 Применение знаний
Все, что окружает нас в мире, состоит из веществ различного химического состава. Они представляют собой совокупность молекул, которые складываются из атомов. Атом – основное понятие в химии, позволяющее понять строение химических элементов и их свойства.
Общие понятия
Атомы и молекулы часто путают, но, оба понятия имеют строгие определения, объясняющие отличия. Молекула – это минимальная частица вещества, которая обладает его свойствами и существует самостоятельно. Например, если от литра воды отлить несколько миллилитров, то это все равно будет одна и та же молекула воды. Она сохраняет известные нам свойства – текучесть, способность растворять сахар и др.
Атом – это частица, которую невозможно разъединить химически. Вместе, они формируют молекулы. В молекуле воды (Н2О) содержится три атома: два атома водорода и один кислорода. При соединении друг с другом они и образуют знакомое нам вещество.
Теория об атомно-молекулярном строении
Атомно-молекулярная теория основывается на нескольких положениях:
- все вещества состоят из молекул. Они, являются наименьшими частицами вещества, обладающими всеми его свойствами;
- при химической реакции молекулы разрушаются и образуют новые вещества;
- у молекул наблюдается постоянное и хаотичное движение;
- вещества с одними и теми же атомами в составе имеют схожие свойства;
- атомы не обладают каким-либо зарядом;
- в составе атома выделяется ядро, имеющее положительный заряд, и отрицательно заряженная электронная оболочка.
Химическая и физическая активность веществ определяется положениями атомно-молекулярной теории
Описание атома
Основной способ показать его строение – использовать модель атома Резерфорда. Согласно теории, в центре атома располагается ядро, которое окружено электронным облаком. Ядро включает в себя два класса элементарных частиц: протона и нейтрона. Электронное облако представлено электронами.
Нейтрон – тяжелая частица, которая не имеет заряда и располагается в ядре, Протон обладает положительным зарядом. Он – одна из основных элементарных частиц. Электрон участвует в формировании электронного облака с отрицательным зарядом. Атом не имеет какого-либо заряда, благодаря одинаковому числу электронов и протонов в составе.
Размер атома не имеет четкой границы. Это связано с тем, что они постоянно взаимодействуют друг с другом, размывая ее. Известно, что размер атома зависит от положения элемента в периодической системе – чем он ближе к началу периодической системы Менделеева, тем меньше.
Ядро составляет 99,9% массы атома. Оно состоит из двух типов частиц – протоны (положительные заряды) и нейтроны (незаряженные частицы). Они соединяются сильным взаимодействием. Число протонов в атоме можно узнать по Периодической системе Д.И. Менделеева – оно соответствует порядковому номеру элемента в таблице. Для определения числа нейтронов из массового числа элемента вычитают количество протонов.
Электронная оболочка сформирована орбитами электронов. Орбиталь – это место, где с наибольшей вероятностью располагаются электроны атома. Ее описывают математически. Орбиталь может быть сферической (s-облако) или гантелеобразной (p-облако) — это зависит от числа электронов.
Изотопы
Изотопы – это разновидности атома, которые имеют одинаковое число протонов и электронов, но отличаются количеством нейтронов. Они имеются у каждого элемента. Например, углерод представлен тремя изотопами с массой 12, 13 и 14. Химические свойства остаются прежними.
Об электронах
Для того, чтобы узнать сколько электронов в конкретном атоме, надо узнать его порядковый номер в таблице Менделеева. Например, атом фосфора занимает 15 положение. Поэтому, его число электронов – 15.
Как заряжен атом?
Суммарный заряд атома нейтральный. Это связано с тем, что протоны (частицы с зарядом «+») и электроны (частицы с зарядом «–») уравновешивают друг друга. Состоящее из нейтронов и протонов ядро заряжено положительно. Сила заряда определяется номером элемента в таблице Менделеева. Чем он выше, тем больше заряд.
Элемент в химии
Под понятием «химический элемент» понимают совокупность атомов, которые имеют одинаковый заряд ядра. На сегодняшний день известно 118 элементов. 24 из них получены синтетическим путем. Они обозначаются определенными символами. Например, кислород – О, сера – S и т.д.
Основная характеристика химического элемента
Заряд ядра характеризует химический элемент. Он определяется числом положительно заряженных протонов. От этого зависят химические и физические свойства молекул элемента.
Обозначения элементов
Для обозначения химических элементов используют символы. Они образуются из названия элемента и чаще представлены начальными буквами. Например, медь – это Сu (cuprum), кислород – O (oxygenium) и т.д. В периодической системе рядом с символом элемента указывают его атомную массу, порядковый номер, заряд иона и число атомов в молекуле.
Применение знаний
- Требуется охарактеризовать кислород. Кислород занимает в таблице Менделеева 8 положение. Молярная масса – 16. Число протонов равняется 8. Число электронов также 8, так как атом должен быть электрически нейтральным. Для подсчета количества нейтронов, из молярной массы вычесть число протонов: 16–8= 8 нейтронов.
- Дайте характеристику хлору как атому. Хлор имеет 17 порядковый номер. Молярная масса – 34. Число протонов – 17. Число электронов также 17. Количество нейтронов равняется разнице между молярной массой и числом протонов – 17.
Знание основных сведений о строении атомов позволяет понять строение и взаимодействие химических веществ в окружающем мире.
Химический язык
Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все — от песчинок малых до планет —
из элементов состоит единых.
С. П. Щипачев, «Читая Менделеева»
Древнегреческий философ Демокрит 2500 лет назад высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов. Слово “атом” в переводе означает “неделимый”. Позднее, в средние века, учение об атомах преследовалось религией, которая тормозила развитие науки в целом, и химии в частности.
Учение о молекулах и атомах было разработано в середине 18 века великим русским ученым Михаилом Васильевичем Ломоносовым (1711 – 1765 гг.) Он утверждал, что тела в природе состоят из корпускл (молекул), в состав которых входят элементы (атомы). Многообразие веществ ученый прозорливо объяснял соединением разных атомов в молекулах и различным расположением атомов в них. Удивительно верной и смелой для того времени была мысль М. В. Ломоносова о том, что некоторые корпускулы (молекулы) могут состоять из одинаковых элементов (атомов).
Термин «атом» предложил Дж. Дальтон в начале 19 века. Он назвал атомами мельчайшие частицы, не изменяющиеся в химических реакциях.
Атомы — мельчайшие химически неделимые частицы, из которых состоят вещества.
Атомно-молекулярное учение
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
На сегодняшний день известно 118 видов атомов. Более 90 из них существуют в природе, а остальные получены искусственно.
Атомы характеризуются:
-
определёнными очень малыми размерами;
-
определённой, тоже очень малой, массой;
-
определённым строением.
Размеры атомов настолько малы, что увидеть их невозможно даже в самый мощный микроскоп. Радиусы атомов составляют 0,046–0,25 нм (1 нм = 10−9 м). Самый маленький — атом гелия, а самый большой — франция.
Атомы редко встречаются в изолированном виде. Обычно они соединяются друг с другом в молекулы или более крупные структуры. Число вариантов соединения атомов практически бесконечно, и их относительно небольшое число приводит к образованию огромного количества разнообразных веществ.
Пример:
атомы кислорода образуют два вещества. Когда они соединяются попарно, то образуется кислород. Если же три атома кислорода образуют молекулу, то образуется озон.
Молекула — мельчайшая частица вещества, способная существовать самостоятельно, сохраняющая его состав и химические свойства.
Молекулы характеризуются качественным и количественным составом.
Качественный состав показывает, из каких атомов состоит молекула.
Пример:
молекулы воды и пероксида водорода состоят из атомов водорода и кислорода, а молекула углекислого газа — из атомов углерода и кислорода.
Количественный состав показывает, сколько атомов каждого вида содержится в молекуле.
Пример:
молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула пероксида водорода — из двух атомов водорода и двух атомов кислорода. В молекулах может быть разное число атомов.
Химические формулы
Химическая формула — условная запись, отражающая качественный и количественный состав вещества.
Качественный состав показывают с помощью символов химических элементов, а количественный — с помощью индексов.
Индекс — цифра в химической формуле, которая ставится справа внизу от химического знака и обозначает число атомов данного элемента.
Обрати внимание!
Индекс «1» в химической формуле опускается.
Если в формуле записан знак химического элемента без индекса, значит, в частице вещества содержится один атом данного элемента.
Химические формулы веществ молекулярного строения показывают состав молекул. Это молекулярные формулы.
Пример:
O2 («о-два») — молекулярная формула кислорода. В молекуле кислорода содержатся два атома химического элемента кислорода.
He («гелий») — молекулярная формула инертного (благородного) газа гелия. Молекулы благородных газов одноатомные.
H2SO4 («аш-два-эс-о-четыре») — молекулярная формула серной кислоты. Молекула серной кислоты содержит два атома водорода, один атом серы и четыре атома кислорода.
Химические формулы веществ немолекулярного строения показывают простейшее соотношение числа атомов химических элементов в веществе. Такие формулы называют простейшими формулами.
Группа атомов, состав которой соответствует простейшей формуле вещества, называется формульной единицей.
Для простых веществ немолекулярного строения формульной единицей является атом, поэтому их формулы записывают просто знаками химических элементов без индексов.
Пример:
Cu («купрум»)— формула меди, которая показывает, что её формульной единицей является атом.
Fe2O3 («феррум-два-о-три») — простейшая формула оксида железа(III). В этом веществе на два атома железа приходится три атома кислорода.
Обрати внимание!
Повторяющиеся группы атомов в формуле заключают в скобки.
Пример:
Mg(OH)2 («магний-о-аш-дважды»)— в гидроксиде магния на один атом магния приходится два атома кислорода и два атома водорода.
Ca3(PO4)2 («кальций-три-пэ-о-четыре-дважды»)— в фосфате кальция на три атома кальция приходится два атома фосфора и восемь атомов кислорода.
В химических записях используются коэффициенты.
Коэффициент — цифра в химической записи, которая ставится перед формулой и показывает число отдельных атомов, молекул или формульных единиц.
Обрати внимание!
Коэффициент «1» не записывается.
Пример:
O — один атом кислорода.
3H2 — три молекулы водорода, каждая из которых состоит из двух атомов химического элемента водорода.
10H2SO4 — десять молекул серной кислоты, содержащих по два атома водорода, одному атому серы и по четыре атома кислорода.
2Mg(OH)2 — две формульные единицы гидроксида магния, состоящие из одного атома магния, двух атомов кислорода и двух атомов водорода.
екст. Нажмите, чтобы отредактировать и добавить что-нибудь интересное.
Простые и сложные вещества
По элементному составу различают:
Простые вещества, состоят из атомов одного элемента (H2, O2,Cl2, P4, Na, Cu, Au).
Сложные вещества, состоят из атомов разных элементов (H2O,NH3, OF2, H2SO4, MgCl2,K2SO4).
Атомы химических элементов различаются своими массами. Масса атома обозначается символом ma и выражается в единицах массы кг или г.
Массы атомов малы. Так, масса атома водорода равна ma(H)=1,67⋅10−24 г, а масса атома углерода — ma(C)=19,94⋅10−24 г.
Использовать такие числа неудобно. Поэтому в химии применяется относительная атомная масса Ar.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
За атомную единицу массы выбрана 1/12 часть массы атома углерода.
Относительные атомные массы химических элементов приведены в периодической таблице. В расчётах обычно используют их значения, округлённые до целых. Исключение — Ar(Cl)= 35,5.
Для изучения химических элементов, разработано не мало приложений. Мы их протестировали и выбрали вот эти:
Тренажёр №1 Химические элементы и Периодическая таблица — Тест (приложение для Android)
Тренажёр №2 Игра «Таблица Менделеева» ( можно играть в браузере)
Видео YouTube
I. Новый материал
Эта лекция
будет посвящена следующим понятиям: «атом», «молекула»,
«вещества молекулярного и немолекулярного строения»,
«атомно-молекулярное учение».
Возникновение представлений об атомах и молекулах
Атомы и молекулы
Как Вы уже знаете из курса физики, весь материальный мир состоит из атомов. Всего на Земле и в космосе обнаружено 89 видов атомов, отличающихся друг от друга строением, а также размером и массой. Еще более 20 видов атомов получены искусственно — они неустойчивы и распадаются на другие атомы. Синтез новых веществ продолжается и в настоящее время.
Предположение о существовании атомов — мельчайших неделимых частиц материального мира — сформировалось еще в Древней Греции. Об этом свидетельствуют высказывания греческого философа Демокрита ( V в. до н.э.) «Начала вселенной — атомы и пустота» «Атомы это всевозможные маленькие тела» Он высказал мысль о том, что все тела в природе состоят из мельчайших
невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов. Слово
“атом” в переводе означает “неделимый”. Позднее, в средние века, учение об
атомах преследовалось религией, которая тормозила развитие науки в целом, и
химии в частности.
Историческая справка — Демокрит
Атомы определенного вида принято называть химическим элементом. Каждый химический элемент имеет название и символ- условное обозначение в виде одной или двух букв, взятых из его латинского названия.
Историческая справка происхождения названий химических элементов
В течении нескольких столетий средневековые ученые-алхимики пытаюсь с помощью химических превращений получить золото из доступных веществ. Проводя многочисленные опыты, они заложили основы химии- изучили важные вещества, разработали технику проведения различных операций, но получить золота им так и не удалось. Современная наука установила, что превращения одних аров в другие в некоторых случаях возможны. Их изучает ядерная физика. С их помощью, например, удалось превратить ртуть в золото. Правда, такое золото во много раз дороже самородного.
Атомы 89 ХЭ, встречающихся природе, распределены в ней неравномерно. В космосе самый распространенный элемент — водород (93%), за ним следует гелий. В земной коре больше всего кислорода, кремния, железа и алюминия.
Число веществ, найденных в природе или полученных искуственно, во много раз превышает число известных элементов. Это объясняется тем, что атомы объединяются с образованием более сложных частиц — молекул. [1]
Учение о молекулах и атомах было разработано в
середине 18 века великим русским ученым Михаилом
Васильевичем Ломоносовым (1711 – 1765 гг.) Он утверждал, что тела в природе состоят из корпускл (молекул),
в состав которых входят элементы (атомы). Многообразие веществ ученый
прозорливо объяснял соединением разных атомов в молекулах и различным
расположением атомов в них. Удивительно верной и смелой для того времени была
мысль М. В. Ломоносова о том, что некоторые корпускулы (молекулы) могут
состоять из одинаковых элементов (атомов). Учение об атомах получило дальнейшее
развитие в трудах известного английского ученого Джона
Дальтона (1766 –
1844 гг.).
Сейчас известно, что все вещества состоят из атомов, но не все- из молекул. В некоторых веществах атомы связаны друг с другом в бесконечные слои и каркасы. в таком случае можно выделить лишь отдельно повторяющийся фрагмент. Веществ немолекулярного строения достаточно много — металлы, алмаз, графит, кварц, слюда, полевой шпат, мрамор, поваренная соль.
МОЛЕКУЛЫ И АТОМЫ
Можно ли опытным путем доказать, что молекулы
состоят из атомов?
То, что атомы действительно существуют,
подтверждают многие химические реакции. Так, например, при пропускании
постоянного тока через воду в одной из трубок прибора собирается газ, в котором
тлеющая лучинка ярко вспыхивает. Это кислород. В другой трубке собирается вдвое
больше газа, который от зажженной лучинки загорается — это водород.
Схема аппарата для разложения воды
(аппарат
Гофмана)
Объяснить это явление можно так: мельчайшая
частица воды – молекула состоит из 2 атомов водорода и одного атома кислорода.
При пропускании постоянного тока через воду ее молекулы распадаются и
образуются химически неделимые частицы – атомы кислорода и водорода. Затем
атомы соединяются по два, и из двух молекул воды образуется одна – двухатомная
молекула кислорода и две водорода.
Электролиз воды.wmv
Некоторые представления об атомах и молекулах,
высказанные М. В. Ломоносовым за полвека до Д. Дальтона, оказались более
достоверными и научными. Например, английский ученый категорически отрицал
возможность существования молекул, состоящих из одинаковых атомов. Его взгляды
отрицательно сказались на развитие химии. Учение о молекулах и атомах окончательно
было принято только в 1860 г. на Всемирном съезде химиков в Карлеруэ.
Итак, что такое молекулы и атомы?
Молекулы – мельчайшие частицы вещества, состав
которых и химические свойства такие же, как у данного вещества.
Молекулы –
предельный результат механического дробления вещества.
Атомы – это мельчайшие химически неделимые
частицы, из которых состоят молекулы.
Молекулы, в отличие от атомов, являются
химически делимыми частицами.
Молекулярные вещества
Молекулярные вещества — это вещества, мельчайшими
структурными частицами которых являются молекулы
Молекулы — наименьшая частица молекулярного вещества,
способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулярные вещества имеют низкие температуры
плавления и кипения и находятся в стандартных условиях в твердом, жидком или
газообразном состоянии.
Вещества с молекулярным строением
Немолекулярные вещества
— это вещества, мельчайшими
структурными частицами которых являются атомы или ионы.
Веществ немолекулярного строения достаточно много — металлы, алмаз, графит, кварц, слюда, полевой шпат, мрамор, поваренная соль.
Ион — это атом или группа атомов, обладающих
положительным или отрицательным зарядом. Например: Na+, Cl—.
Немолекулярные вещества находятся в стандартных
условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и
кипения.
Например: Поваренная соль — твердое вещество, tпл=801°С;
tкип=1465°С; Железо, как и другие металлы, состоит из атомов. Наименьший повторяющийся фрагмент ( структурная единица) этого вещества -атом. Следовательно формула железа — Fe
Атомно-молекулярное
учение
Атомно-молекулярное
учение развил и впервые применил в химии великий русский ученый Ломоносов.
Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2.
Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3.
Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое
состояние тел есть результат движения их частиц.
4.
Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ
— из различных атомов.
Атомистическое учение в химии применил английский ученый Джон Дальтон. В своей
основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает
его дальше, поскольку Дальтон впервые пытался установить атомные массы
известных тогда элементов. Однако Дальтон отрицал существование молекул у
простых веществ, что по сравнению с учением Ломоносова является шагом назад. По
Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества —
из «сложных атомов» (в современном понимании — молекул). Отрицание Дальтоном
существования молекул простых веществ мешало дальнейшему развитию химии.
Атомно-молекулярное учение в химии окончательно утвердилось лишь в середине
XIX в. Молекула — это наименьшая частица данного вещества, обладающая его
химическими свойствами. Химические свойства молекулы определяются ее составом и
химическим строением. Атом — наименьшая частица химического элемента, входящая
в состав молекул простых и сложных веществ. Химические свойства элемента
определяются строением его атома. Отсюда следует определение атома,
соответствующее современным представлениям: атом — это электронейтральная
частица, состоящая из положительно заряженного атомного ядра и отрицательно
заряженных электронов. Согласно современным представлениям из молекул состоят
вещества в газообразном и парообразном состоянии. В твердом состоянии из
молекул состоят лишь вещества, кристаллическая решетка которых имеет
молекулярную структуру.
Основные положения атомно-молекулярного учения можно сформулировать так:
- Существуют
вещества с молекулярным и немолекулярным строением. - Между
молекулами имеются промежутки, размеры которых зависят от агрегатного
состояния вещества и температуры. Наибольшие расстояния имеются между
молекулами газов. Этим объясняется их легкая сжимаемость. Труднее
сжимаются жидкости, где промежутки между молекулами значительно меньше. В
твердых веществах промежутки между молекулами еще меньше, поэтому они
почти не сжимаются. - Молекулы
находятся в непрерывном движении. Скорость движения молекул зависит от
температуры. С повышением температуры скорость движения молекул
возрастает. - Между
молекулами существуют силы взаимного притяжения и отталкивания. В
наибольшей степени эти силы выражены в твердых веществах, в наименьшей — в
газах. - Молекулы
состоят из атомов, которые, как и молекулы, находятся в непрерывном
движении. - Атомы
одного вида отличаются от атомов другого вида массой и свойствами. - При
физических явлениях молекулы сохраняются, при химических, как правило,
разрушаются. - У веществ
с молекулярным строением в твердом состоянии в узлах кристаллических
решето находятся молекулы. Связи между молекулами, расположенными в узлах
кристаллической решетки, слабые и при нагревании разрываются. Поэтому
вещества с молекулярным строением, как правило, имеют низкие температуры
плавления. - У веществ
с немолекулярным строением в узлах кристаллических решеток находятся атомы
или другие частицы. Между этими частицами существуют сильные химические
связи, для разрушения которых требуется много энергии. Поэтому вещества с
немолекулярным строением имеют высокие температуры плавления.
Объяснение
физических и химических явлений с точки зрения атомно-молекулярного учения.
Физические и химические явления получают объяснение с позиций
атомно-молекулярного учения. Так, например, процесс диффузии объясняется
способность молекул (атомов, частиц) одного вещества проникать между молекулами
(атомами, частицами) другого вещества. Это происходит потому, что молекулы
(атомы, частицы) находятся в непрерывном движении и между ними имеются
промежутки. Сущность химических реакций заключается в разрушении химических
связей между атомами одних веществ и в перегруппировке атомов с образованием
других веществ.
II. Закрепление
Дайте ответы на следующие вопросы:
- ПРОСМОТРИТЕ ПРЕЗЕНТАЦИЮ: СТРОЕНИЕ АТОМОВ
- Назовите имя древнегреческого философа, который высказал
мысль о том, что все тела в природе состоят из мельчайших невидимых,
непроницаемых, неделимых, вечно движущихся частиц – атомов. - Назовите имя великого русского учёного, основоположника учения о молекулах и атомах.
- Дайте определение молекуле.
- Дайте определение атому.
- Какие вещества относят к веществам молекулярного и немолекулярного строения. Приведите примеры веществ.
[1] В.В.Еремин,А.АДроздов,Н.ЕКузьменко,В.В.Лунин Химия 8 М. 2004
Нас окружает огромное количество самых разнообразных предметов. В физике мы называем их физическими телами. Физические тела, состоят из вещества, а вещество из мельчайших частиц.
Что же это за частицы? На данном уроке вы узнаете ответ на этот вопрос — мы будем говорить о молекулах и атомах.
Молекулы
Что будет, если вещество начать делить на мельчайшие составляющие? Мы дойдем до частицы, разделив которую, вещество утратит свои свойства.
Рассмотрим это на примере воды. 1 грамм воды составляют $3.35 cdot 10^{22}$ равных частиц, каждая из которых обладает свойствами воды. Они и называются молекулами.
Что такое молекула?
Молекула – это самая мелкая частица вещества, которая сохраняет все химические свойства вещества
Вода образовывается в процессе сжигания некоторых веществ: газа, бензина, древесины и пр. Ее также выделяет водородный двигатель, но не в том виде, что мы привыкли, а в молекулярном, но это все же вода.
Размеры молекул
Каковы же размеры молекул? Если бы мы смогли уложить в один ряд 10 000 000 молекул воды, то получилась бы нить длиной в $2 space мм$. А в $1 см^3$ воздуха содержится около $27 cdot 10^{18}$ молекул.
Если представить, что маленькое отверстие пропускают по миллиону молекул в секунду, тогда указанное количество молекул пройдет только через 840 000 лет.
Еще интересный факт: если размер молекулы увеличить до размера точки в конце предложения в книге, то толщина человеческого волоса стала бы равна 40 м, а человек, стоя на поверхности Земли, упирался бы головою в Луну.
Современная наука позволяет нам увидеть эти малейшие составляющие нашего мира с помощью электронного микроскопа. На рисунке 1 представлены фотографии молекул, полученные с помощью электронного микроскопа, и их графическая интерпретация.

Помните, что все тела, окружающие нас и похожие друг на друга, всегда будут различны. В природе вы не встретите ни двух одинаковых снежинок, ни людей, ни песчинок, ни животных, но молекулы одного и то же вещества всегда будут одинаковы.
Атомы
Будем ли мы считать молекулы самыми мельчайшими частицами? Например, если мы разделим молекулы воды, то свойства воды потеряются. Мы получим атомы двух химических элементов: 1 атом кислорода (O) и 2 атома водорода (H).
Термин «атом» переводится с греческого, как «неделимый», хотя современная наука уже опровергла данный факт, и вы узнаете об этом в следующих курсах физики.
Дадим определение.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств
Каждый атом — это химический элемент. Все химические элементы перечислены в таблице Менделеева (рисунок 2).

Мы можем сравнить атомы с буквами, при помощи которых собирается бесконечное количество слов — молекул. Таким образом, из атомов водорода и кислорода (взятые в разных количествах) мы получим молекулы разных веществ.
Например, если взять 2 атома водорода (H) и 1 атом кислорода(O), то получим молекулу воды $H_2 O$ (рисунок 3).
А если взять 2 атома водорода (H) и 2 атома кислорода (O), то получим перекись водорода $H_2O_2$ (рисунок 4).
Итак, физические тела состоят из вещества, вещество состоит из молекул, а молекулы состоят из атомов (рисунок 5).
Сложные и простые вещества
У сложных веществ молекулы состоят из атомов нескольких химических элементов. Например, молекула воды состоит из атомов кислорода и водорода, поэтому вода — сложное вещество.
У простых веществ молекулы состоят только из одного химического элемента. Например — кислород. Наглядное изображение приведено на рисунке 6.

 Представление об атомах
Представление об атомах