Морские ежи
Это донные животные, относящиеся к классу иглокожих. Они обитают практически во всех морях и океанах. Главное условие их существования — это очень соленая вода, поэтому в морях с невысоким содержанием соли, таких как Черное, Каспийское и Балтийское, их практически нет. Самые опасные виды ядовитых морских ежей встречаются в тропических водах Атлантического, Индийского и Тихого океанов.
Внешний вид
Пурпурный морской еж обитает вдоль Тихоокеанского побережья Северной Америки. Название получил за фиолетовый оттенок окраски тела. Диаметр его панциря составляет от 5 до 10 см
В настоящее время известно более 900 различных видов морских ежей, объединенных в 2 подкласса: правильные и неправильные. Правильные имеют круглый симметричный панцирь, а неправильные — уплощенный. К панцирю крепятся иглы, способные двигаться в различных направлениях и выполняющие сразу несколько функций: с их помощью ежи перемещаются, защищаются от хищников и добывают пищу. У одних видов иглы почти незаметные — не больше 2 мм, у других — длинные, около 30 см, иногда ядовитые. В основном морские ежи бывают пурпурными и розовыми, реже встречаются коричневые, зеленые, черные, белые, красные.
Ножки-трубочки
Зеленый морской еж обитает в морях Атлантического и Тихого океанов. Поверхность его панциря покрыта многочисленными подвижными иглами и педицелляриями
Панцирь морского ежа пронизывают сотни цилиндрических трубочек с присосками на конце. Наполняясь водой, эти ножки-трубочки растягиваются и крепятся к ближайшей поверхности, затем за счет изменения давления снова сокращаются, так животное передвигается. При помощи нижних ножек морские ежи зарываются в песок или очищают панцирь от остатков пищи, а верхние служат в качестве органов осязания и дыхания.
Огненный морской еж
Один из самых опасных ежей на нашей планете. Это агрессивный охотник, обладающий ядовитыми иглами и клешнями на кончиках педицеллярий. Стоит человеку наступить на такого ежа, шипы и челюсти тут же выпустят сильнодействующий парализующий яд.
Педицеллярии
Это особые органы, разбросанные среди игл морских ежей. Они находятся на гибких стебельках или непосредственно на поверхности тела и, словно клешни, снабжены несколькими хватательными створками. У некоторых морских ежей педицеллярии наполнены еще и ядовитыми железами.
Как и чем питаются морские ежи
Коричневый мирской еж. Такие в изобилии водятся в Адриатическом море у берегов Хорватии
Рот морского ежа расположен на нижней стороне туловища. Он снабжен сразу 5 челюстями, каждая из которых увенчана прочным острым зубом, растущим в течение всей жизни морского ежа. Свои уникальные челюсти эти животные используют в качестве скребка, отслаивая водоросли от камней, для размельчения добычи или рытья нор. Морские ежи всеядны. Они едят водоросли, моллюсков, губок, разнообразную падаль, а также мелких морских ежей и морских звезд.
Враги морских ежей
Морской бобр, или калан, — главный враг морских ежей. Большую части жизни он проводит в воде, на сушу выходит только для отдыха
Морских ежей поедают некоторые виды рыб, птиц, а также крабы и омары. Но самый главный охотник на этих колючих животных — морской бобр. Чтобы не пораниться острыми иглами, он заворачивает ежа в водоросли и разбивает его камнем прямо у себя на груди. Прячась от хищников, морские ежи забираются в узкие щели между камнями, увеличивая их до нужной глубины при помощи игл и зубов.
Опасность для человека
Черный морской еж с длинными иглами. Такие встречаются на побережье Таиланда
Яд многих морских ежей очень токсичен: даже сильно разведенный в воде он может оказать на человека губительное, в худшем случае даже смертельное воздействие. Кроме того, ежи вооружены длинными и очень тонкими иглами. Протыкая кожу человека, иглы ломаются и оставляют в теле кончики. Обычно возникает сильная боль, которая может продлиться несколько часов.
Красивые, но ядовитые
Гигантские красные морские ежи являются обладателями яркой окраски и острых ядовитых игл. Размер этих ежей достигает в диаметре до 20 см, а с иглами — до 45 см. Обитают они возле восточного побережья Африки, в водах Индонезии и Океании. Встречаются в больших количествах на глубине от 10 до 40 м.
Поделиться ссылкой
Изобретательность природы безгранична. Внешний облик каждой группы родственных видов живых существ — чаще всего вариация на какую-либо одну тему. Морских ежей можно назвать «вариацией на тему шара с иглами».
Возможно, именно из-за трудностей варьирования столь простой формы видов ежей сравнительно немного — всего около 850. Но если видовое разнообразие этих животных и не очень велико, зато численность их на многих участках дна поистине огромна.
В тех морях, где они обитают (морским ежам, как и другим иглокожим, необходима высокая соленость воды), это всегда одна из наиболее обычных групп донных животных. Можно было бы даже сказать, что их почти перестаешь замечать, если бы они не относились к таким существам, которые довольно энергично напоминают о своем присутствии. Живут морские ежи как у самого уреза воды, так и на больших глубинах. Недавно научно-исследовательским судном «Витязь» в желобе Банда с глубины 7340 м был поднят их новый вид, названный Пурталезия хептнери,— наиболее глубоководный из известных науке видов.
2. Пурталезия указана стрелкой.
Морских ежей делят на две основные группы — правильных и неправильных (заметим, кстати, что эти же термины использовал небезызвестный Винни-пух для классификации пчел, когда пытался полакомиться медом с помощью воздушного шарика). Форма тела правильных ежей наиболее близка к шару, у неправильных она может довольно значительно отклоняться от нее. Морские ежи достигают очень крупных размеров — до 16 сантиметров в диаметре тела, а учитывая длину игл — до 50 сантиметров и больше.
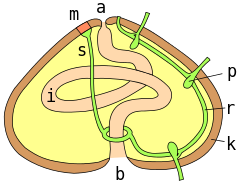
3. Все тело ежей заключено в панцирь (или скорлупу) из известковых пластинок.
У подавляющего большинства видов пластинки скреплены неподвижно и тело имеет постоянную форму. Только у представителей одного отряда скорлупа состоит из отдельных, не скрепленных друг с другом пластин; тело таких ежей, шарообразное в естественной обстановке, сплющивается при извлечении животных на поверхность. Даже у самых «правильных» ежей скорлупа не вполне шарообразна, а имеет уплощенную нижнюю сторону и куполообразную вершину. Именно такая форма обеспечивает наибольшую прочность панцирю при надавливании сверху. У разных видов пластинки панциря значительно различаются по толщине. У ежей, обитающих на небольших глубинах, особенно в тропических морях, панцирь чрезвычайно прочен, тогда как глубоководные виды и закапывающиеся ежи имеют обычно очень тонкую скорлупу, легко повреждаемую даже пальцами при неосторожном обращении.
4. Если очистить панцирь ежа от игл, обнаруживается, что пластинки располагаются двадцатью меридиональными рядами.
Пластинки пяти двойных рядов пронизаны несколькими парами отверстий; эти пластинки называются амбулакральными. Через отверстия в них проходят каналы амбулакральных ножек. Если посадить морского ежа в аквариум, видно, что ножки его очень длинные, тонкие и подвижные, в вытянутом состоянии их длина может превышать поперечник панциря. Этим амбулакральные ножки ежей отличаются от ножек морских звезд и голотурий, обычно довольно коротких. Вообще может создаться впечатление, что общий план строения морских ежей и звезд имеет очень мало общего. Но если представить звезду, лучи которой загнуты на спинную сторону (кстати, при действии некоторых химических веществ морские звезды действительно могут принимать такую позу), то она по форме тела и расположению амбулакральных ножек будет очень похожа на ежа.
5.
6.
Ножек у ежей очень много, иногда больше тысячи. Они имеют на конце хорошо развитую присоску и играют большую роль при движении по вертикальным поверхностям. При движении по горизонтали многие ежи пользуются иглами, переставляя которые, они двигаются, как на ходулях. К пластинкам панциря прикрепляются иглы, количество, форма и размер которых чрезвычайно разнообразны. Иглы соединены с пластинками не неподвижно, а с помощью шарового шарнира. Мышцы, окружающие этот шарнир, позволяют ему менять направление иглы. Некоторые ежи способны на очень энергичные движения иглами. Между иглами на пластинках размещаются особые хватательные органы — педицеллярии,— представляющие собой сильно видоизмененные иглы. Они делятся на несколько типов и могут быть похожи на клешни, пинцеты и др. Педицеллярии играют чрезвычайно важную роль в жизни ежей. Они очищают тело от попавших на него инородных частиц, участвуют в питании, защищают ежа от врагов. Педицеллярии — очень совершенные устройства для захвата и удерживания. Еще издавна внимание ученых привлекал вопрос, каким образом ежи, несмотря на небольшие размеры и слабые приводные мышцы, способны удерживать очень крупных животных, например рыб. Недавно проведенные исследования «челюстных» педицеллярий одного из видов ежей с помощью сканирующего электронного микроскопа показали, что конструкция их шарнирного механизма и зубчатого сочленения створок обеспечивает очень точное их смыкание.
Конфигурация створок такова, что чем сильнее вырывается жертва, тем сильнее сжимаются створки. Таким образом, удерживание добычи осуществляется за счет ее собственных мышечных усилий! Створки педицеллярий имеют острые зубцы и снабжены ядовитыми железами. Педицеллярии при удалении их с тела ежа способны автономно функционировать в течение многих часов, поэтому удалось изучить их реакцию на присутствие злейших врагов морских ежей — морских звезд. Если прикоснуться к педицеллярии или добавить в воду экстракт из ножек морской звезды (но не любой, а относящейся к виду, с которым еж может столкнуться в реальной обстановке), створки приоткроются на 90 градусов. Чтобы они разошлись еще больше, нужно воздействовать на нервные окончания у наружного края створок; при полном раскрытии (створки располагаются в одной плоскости, под углом 180 градусов друг к другу) в их основании открывается чувствительный бугорок. Прикосновение к бугорку каким-нибудь предметом, например пинцетом, вызывает смыкание створок, но яд при этом не выпрыскивается. А вот если прикоснуться к бугорку ножкой морской звезды, то действие произойдет по «полной программе» — створки захлопнутся и в жертву впрыснется яд из железы. После этого педицеллярия отмирает и заменяется новой.
7. Наиболее примечательной особенностью внутреннего строения ежей является их жевательный аппарат, так называемый Аристотелев фонарь (название это очень древнее, его употреблял еще Плиний).
Аристотелев фонарь (он действительно похож на подвесной фонарь, применявшийся в старину) — геометрически правильное и чрезвычайно рационально сконструированное устройство, состоящее из двадцати пяти известковых «косточек» сложной конфигурации и соединяющих их мышц. Его основная часть — пять дугообразных двойных пирамидок, служащих как бы держателями для зубов.
8. Зубы имеют вид длинного стержня, в сечении обычно грибовидного, один конец зуба (плюмула) виден в верхней части фонаря, второй торчит из ротового отверстия.
С помощью сканирующего электронного микроскопа удалось установить, что зубы ежей имеют уникальное по своей сложности строение и представляют собой как бы пакет, набранный из огромного числа тонких, изогнутых особым образом пластинок. При питании ежа крайние пластинки стираются, а на их место выдвигаются новые. Таким образом, зубы ежей самозатачиваются и растут в течение всей жизни (подобное же явление мы встречаем на суше у мышей, белок и других грызунов, но способ достижения самозатачивания там совсем иной). Зубы морских ежей чрезвычайно прочны, ими они сокрушают известняк, скалы и даже стальные конструкции. Некоторые ежи используют зубы не только по прямому назначению, но и для передвижения — резко смыкая и размыкая их, они отталкиваются от дна. Как уже говорилось, ежи очень различаются по строению и образу жизни. В морях нашей страны на доступных спортсмену-подводнику глубинах живут представители только одного рода правильных ежей — Стронгилоцентротус.
9. Очень много ежей в Японском море.
10. Наиболее обычный вид здесь — Стронгилоцентротус нудус, или невооруженный морской еж.
Научное название «невооруженный» этого шара с многочисленными длинными и прочными иглами может вызвать недоумение, но назван он так потому, что лишен ядовитых глобиферных педицеллярий. Нудусов не спутаешь с другими видами ежей как из-за большой длины игл, так и из-за окраски — темнофиолетовой, почти черной. Живут они как у самого уреза воды, иногда даже обсыхая, так и на глубинах до 180 метров. Невооруженные ежи медленно двигаются по камням и песку, соскребая своими долотообразными зубами слой обрастаний. Эти ежи поедают и мелких животных, встречающихся на камнях, но основная их пища — водоросли. Пока водорослей много, ежи живут рассредоточенно. При нехватке пищи они могут собираться огромными скоплениями. Мне приходилось встречать на скалах у самой поверхности воды полосы нудусов шириной около метра, в которых животные, располагаясь в два-три слоя, доедали остатки водорослей ламинарий и костарий. Ежи едят не все водоросли без разбора: некоторые виды привлекают их очень сильно, на другие они почти не обращают внимания.
11. Другой наиболее обычный на Дальнем Востоке вид ежей — промежуточный еж.
Он достигает размера 8 сантиметров. Тело ежа покрыто многочисленными, но короткими и довольно тонкими иглами. Цвет значительно варьирует, но обычно — сероватый или зеленоватый. Если невооруженные ежи живут совершенно открыто, то промежуточные всегда покрыты камешками, кусочками водорослей, створками раковин, которые прочно удерживают амбулакральными ножками. Такое «украшение» широко распространено у разных видов ежей. О его значении ученые до сих пор спорят. Одно из предположений, что таким образом ежи защищают себя от излишнего света (органов зрения у этих животных нет, но они ощущают свет всей поверхностью тела). Это в какой-то степени подтверждается тем, что большинство видов, применяющих «украшения», сбрасывают их на ночь и вновь «одеваются» с рассветом. В то же время встречаются и виды, которые не сбрасывают маскировочное покрытие даже ночью.
12. Обычные обитатели самой прибрежной полосы — ежи эхинометры.
Это относительно небольшие ежики с короткими конусообразными и довольно тупыми иглами, светлыми на концах, Эхинометры живут везде, где есть твердый известковый или скальный грунт. Один из широко распространенных типов берега в тропических районах — полого уходящая в воду известковая плита. Начиная с уреза воды такая плита бывает сплошь источена овальными ямками, в каждой из которых сидит эхинометра.
13. Ежи могут использовать уже готовые углубления, а могут высверливать гнезда и на гладком грунте.
При этом вначале они выгрызают породу зубами, а по мере углублении норы все большую роль начинают играть иглы. Ежи постоянно поворачиваются вокруг своей оси и многочисленные иглы, работая как фреза, постепенно углубляют и расширяют норку. Ежи не покидают своих гнезд в течение всей жизни, питаясь тем, что принесет с собой вода. Основная функция норы — не защита ежа от врагов, как иногда полагают, а предохранение от действия прибоя и высыхания в отлив. Эхинометры, поселившись в тихих бухтах, нор не строят.
14. Мест, пригодных для поселения эхинометр, не так уж много, поэтому каждый еж энергично защищает свою нору.
При попытках захватить чужое жилище между ежами происходят настоящие сражения, в ходе которого соперники толкают друг друга и иногда пускают в ход зубы Продолжительность схватки — от нескольких минут до 5 часов. При этом хозяин норы имеет как бы моральное преимущество перед чужаком и при прочих равных условиях наверняка выигрывает схватку. Если хозяина удалить из норы и поместить туда другого ежа такого же размера, то хозяин обязательно вернет себе законное убежище. Эхинометры и многие другие виды сверлящих ежей живут в местах, где прибой не достигает максимальной силы. Там, где на открытый берег обрушиваются огромные океанские волны, им не выстоять. Но ежи живут и здесь, правда, совсем другие — крупные коричневые «грифельные ежи» — гетероцентротусы.
15.
Иглы этих ежей вообще трудно назвать иглами — это толстые стержни до 1—1,5 сантиметра в поперечнике круглого или треугольного сечения с закругленными концами. По размерам и форме иглы гетероцентротусов больше всего напоминают авторучку. Конечно, использовать такие иглы для защиты — дело безнадежное. Но гетероцентротусам это и не к чему — в тех местах, где они обитают, никакие хищники жить не могут.
16.
Зато иглы прекрасно выполняют ту функцию, для которой они и предназначены — расклинивать тело ежа в глубокой пещерке. Еж благодаря им сидит в норе настолько прочно, что вытащить его, не повредив, очень трудно. Как и эхинометры, гетероцентротусы — добровольные узники и живут в норе всю жизнь, расширяя и углубляя ее по мере своего роста.
Самые заметные тропические ежи — несомненно диадемы. Это очень красивые животные с бархатистым на вид панцирем иссиня-черного цвета, на котором переливаются и как бы светятся пять ярко-синих треугольных пятен, иногда отороченных белой каймой.
17.
Самое интересное у диадем — их иглы. Они чрезвычайно длинные (до 30 сантиметров и более) и тонкие и острые настолько, что так и хочется сказать: «как иголка», но это сравнение здесь не подходит — иглы диадем значительно тоньше и острей швейной иглы. Иглы диадем очень подвижны. Когда подплываешь к такому ежу, он еще на расстоянии начинает шевелить ими, направляя их в сторону источника беспокойства.
18.
Диадемы живут обычно группами, часто образуя настоящие ежиные «поселки», и когда проплываешь над ними, внизу шевелится целый лес черных, серых или полосатых игл и сверкают голубые пятна — очень красивое зрелище. Диадемы отправляются на кормежку в заросли водорослей и морских трав ночью, а целый день отсиживаются в углублениях и пещерках коралловых рифов, выставив наружу иглы. Казалось бы, с их мощным оружием бояться некого, но это не так. Несколько видов рыб из спинороговых приспособились охотиться на этих ежей. Схватив ежа за иглы, рыба вытаскивает его на ровное место, несколькими толчками переворачивает на спину, и затем пробивает нижнюю, незащищенную длинными иголками, часть панциря. Но у диадем есть и друзья, постоянно живущие вместе с ними. Разные ежиные сожители принимают среди игл разные позы. Креветки располагаются головой вверх, рыбки кривохвостки — головой вниз, рыбки сифамии — горизонтально. Немецкий ученый X. Фрике провел на рифах Красного моря подводные наблюдения, чтобы выяснить, какие стимулы привлекают рыб и креветок к ежам. Для этого ежиным спутникам под водой предлагали пластмассовые шары с воткнутыми в них штырями или спицами. Оказалось, что и креветки, и рыбы предпочитали черный цвет белому, толстые иглы — тонким, многочисленные — редким, стоящие вертикально и параллельно — беспорядочно разбросанным. Не все морские ежи вегетарианцы. Так, копьеносные ежи (названные так из-за немногочисленных, но мощных игл, напоминающих копья) питаются в основном губками, мягкими кораллами и другими прикрепленными животными.
19.
20.
Большинство правильных морских ежей, относящихся к «мирным» видам, поедают мертвых животных, а многие при случае ловят и подвижных животных, даже креветок и рыб. Жертва чаще всего схватывается педицелляриями, но иногда в ее захвате и удерживании принимают участие и иглы. Убитая ядом добыча передается, как по эстафете, от одной педицеллярии к другой, пока не достигнет ротового отверстия. После этого еж, придерживая околоротовыми иглами, отрывает от нее кусочки зубами. Сами ежи также служат пищей разнообразным животным, их поедают и рыбы, и птицы, и млекопитающие, но чаще всего они становятся жертвами своих родственников — морских звезд.
До сих пор речь шла преимущественно о правильных или шаровидных ежах. Неправильные ежи значительно отличаются от них как строением, так и образом жизни. Наиболее сильно уклонилась от шара форма панциря представителей отряда плоских ежей. Многие виды этого отряда действительно совершенно плоские — как монета. Недаром американцы называют их «долларами» и «центами».
21.
Плоские ежи не всегда дисковидные, среди них встречаются виды, панцирь которых имеет глубокие боковые вырезы и даже сквозные отверстия; они чрезвычайно напоминают печенье, вырезанное фигурной формой изобретательной хозяйкой.
22.
Конечно, такая форма не для красоты. Большинство видов плоских ежей — закапывающиеся животные, а вырезы и прорези помогают ежу «тонуть» в песке. Конечно, природа могла бы поступить проще — просто уменьшить диаметр тела ежа, но это невыгодно — чем относительно шире поперечник панциря, тем волнам труднее перевернуть ежа — а это для ежей равносильно гибели, так как большинство видов не способны потом самостоятельно перевернуться «на живот».
23.
Тело плоских ежей сплошь покрыто короткими иголочками, которые правильнее бы назвать щетинками — уколоться такими иглами нельзя. Панцирь их сверху не гладкий, а имеет рисунок, обычно в виде пятилепесткового цветка.
Среди плоских ежей есть и не совсем плоские. В наших дальневосточных морях у открытых песчаных пляжей, начиная с глубины 1—1,5 метра, можно встретить целые поля крупных темно-малиновых ежей Скафехинус необыкновенный. Здесь же обычно живут и вдвое меньшие, величиной с металлический полтинник ежи — Скафехинус серый.
24.
Заметить их труднее, так как они закапываются в песок, правда, неглубоко. Закапывающиеся плоские ежи питаются органическими частицами, содержащимися в грунте, а живущие на поверхности — приносимыми водой. Форма панциря плоских ежей и степень его выпуклости имеет большое значение при их питании. Панцирь плоского ежа — гидродинамическое устройство, воздействующее на характер обтекающего его водного потока.
25.
Панцирь действует подобно крылу самолета, только с другой целью. За счет разницы в давлениях воды у выпуклой верхней и плоской нижней стороны происходит оседание взвешенных пищевых частиц, которые затем по пищевым желобкам направляются ко рту. Поселение плоских ежей — в целом единая гидродинамическая система, чутко реагирующая на скорость и направление преобладающих течений. Подводные фотографии, сделанные на значительных глубинах, показали, что на некоторых участках дна плоские ежи образуют сплошные «мостовые», а иногда даже располагаются в несколько слоев. Это не случайно — расстояние между особями выбирается таким образом, чтобы животные могли использовать токи воды, отклоняемые соседями. Пространственная решетка, образованная лежащими друг на друге дисками ежей, и обеспечивает максимально полное использование ресурсов придонных течений. Некоторые виды плоских ежей, например дендрастеры, для лучшего улавливания взвеси располагаются на дне в вертикальном положении, как бы воткнутыми ребром в песок. При этом угол наклона тела ежа к горизонту и положение в плане соответствуют направлению и силе течений.
Плавая в зарослях зостеры в Японском море, на песчаных полянках можно увидеть круглые отверстия, как будто проколотые спицей; они не сопровождаются ни воронками, ни конусами, характерными для закапывающихся червей и моллюсков. Если рукой копнуть рыхлый песок, на поверхности окажется симпатичное яйцевидное существо, покрытое как бы шерсткой белесоватожелтоватого цвета — сердцевидный еж, представитель второго отряда неправильных ежей.
26.
Сердцевидные ежи живут, закопавшись на 5—10 сантиметров в песок. Они медленно движутся, раскапывая перед собой грунт и отталкиваясь уплощенными веслообразными иглами на нижней стороне тела.
27. Скелеты сердцевидных ежей.
28.
29. Пищу эти ежи получают с поверхности грунта, высовывая через уже виденный нами круглый вертикальный ход чрезвычайно длинные ножки с кисточкой на конце.
По мере продвижения в грунте вертикальный ход разрушается, и еж строит новый. Морские ежи имеют большое значение как в жизнедеятельности донных сообществ, так и в жизни человека.
О неприятностях, доставляемых ежами человеку. С возможностью наступить или столкнуться с ежами все время приходится считаться, когда работаешь в прибрежной зоне морей с океанической соленостью. Иглы ежей, водящихся в морях нашей страны, не ядовиты, но, проникнув в кожу, обычно обламываются и могут вызвать нагноение. Ласты, даже с закрытой подошвой, к сожалению, не предохраняют от уколов черными ежами. В тропиках постоянно приходится сталкиваться с уколами игл диадем, от которых не защищает ни гидрокостюм, ни даже толстые кожаные перчатки.
30.
В литературе можно встретить рекомендации извлекать иглы после укола диадемой хирургическим путем, но их явно разрабатывали люди, видевшие этих ежей только на картинках. Мне пришлось несколько раз «познакомиться вплотную» с диадемами. Нога или рука после этого похожа на фиолетовую подушку, сплошь нашпигованную обломками игл. О том, чтобы извлекать их, не может быть и речи, кажется проще просто отрезать поврежденную конечность. К счастью, этого делать не приходится, так как, вопреки распространенному мнению, иглы диадем не ядовиты и без всякого вмешательства обычно за сутки-двое полностью рассасываются (чего, к сожалению, нельзя сказать о толстых иглах других ежей, в том числе и живущих в наших морях). Конечно, уколы диадемами очень болезненны, пораженное место сильно опухает, иногда теряет чувствительность. Как и во всех случаях, когда в тело попадают нестерильные инородные тела, возможна вторичная инфекция. В то же время несколько видов ежей, и в первую очередь живущие в прибрежных водах Японии короткоиглые ежи, имеют иглы, снабженные ядовитыми железами. Очень опасен яд, содержащийся в глобиферных педицелляриях многих видов морских ежей. Укус педицеллярии вызывает сильную боль, расстройство речи и дыхания; известны случаи со смертельным исходом. К счастью, из-за того что педицелпярии имеют небольшие размеры и располагаются в гуще игл, укусы ими очень редки. Если все же такой случай произошел, необходимо прежде всего удалить из ранки оторванную педицеллярию, чтобы прекратить поступление новых порций яда, и обратиться за медицинской помощью.
Ещё несколько красавцев:
31.
32.
33.
34.
35.
36.
Как уже говорилось, численность ежей в прибрежной зоне может быть очень велика и соответственно велико их влияние на другие организмы. Особенно значительна роль ежей как регуляторов роста водорослей. Выедая огромные количества водорослей, в том числе и промысловых, ежи являются во многих районах одним из основных факторов, влияющих на их количество. Сами ежи также служат пищей для некоторых ценных промысловых организмов — птиц, рыб, крабов, омаров. Очень важную роль играют ежи в питании ценнейшего пушного зверя — калана, или морской выдры. Поведение каланов при питании очень интересно. Нырнув (иногда на несколько десятков метров), калан схватывает передними лапами и зубами несколько ежей и, прижав их к груди, поднимается на поверхность.
37. Здесь он переворачивается на спину и укладывает добычу в обширные складки шкуры на животе.
Затем зверь по очереди извлекает ежей, зубами и лапами обламывает иглы, прогрызает панцирь и съедает внутренности. Калифорнийские каланы для разбивания панцирей ежей и раковин моллюсков используют камни. Захватив такой камень (весом иногда более трех килограммов), калан укладывает его на груди и, ударяя по нему как по наковальне добычей, разбивает ее твердые покровы. Интересно, что хищническое истребление каланов у калифорнийского побережья привело к массовому размножению ежей, которые уничтожили на больших пространствах заросли самых крупных в мире водорослей макроцистис. Сейчас, после успешного проведения мероприятий по охране и переселению каланов, численность ежей вновь снизилась и равновесие восстанавливается.
38. Человек довольно широко использует ежей в пищу. Едят у них только зрелые половые продукты — икру и молоки.
39.
Вот как описывает один гурман это не совсем обычное блюдо: «Какой восхитительный аромат! Это гораздо вкуснее, чем лучшие устрицы, чувствуется неповторимое своеобразие океана, каждый кусок словно освежает рот, в памяти встает чистое, волшебное существо, проведшее жизнь в коралловых заводях, в прозрачной и искрящейся морской воде. Это блюдо можно есть лишь с чувством искреннего восхищения и благодарности за доставленные им новые, совершенно необычные ощущения». Действительно, морские ежи очень вкусны, но обязательно свежие и умело приготовленные.
Не следует думать, что ежей ловят только для удовлетворения прихоти небольшой кучки гурманов. Цифры говорят о другом — по данным ФАО (продовольственной и сельскохозяйственной организации ООН), ежегодно в мире добывается от 40 до 50 тысяч тонн этих животных. Наиболее широко развит промысел ежей в Японии, Чили и США. Но икра ежей имеет и другое, гораздо более важное значение. Морской еж стал и остается до сих пор одним из важнейших лабораторных животных. Половые продукты и зародыши ежей широко используются для решения различных проблем биологии развития, молекулярной биологии и цитологии. Ежи являются уникальным объектом для проведения таких работ и в этом качестве их ничем нельзя заменить. Морские ежи обладают очень важными достоинствами — от них возможно получать большие партии половых продуктов, у них строго синхронное развитие зародышей, проста инкубация в контролируемых условиях. Поэтому делящиеся яйца морских ежей все шире используются для массовых токсикологических и фармакологических испытаний новых медицинских препаратов. Человек очень многим обязан своему колючему «меньшому брату» — благодаря ему постигнуты многие тайны живого, созданы и создаются ценнейшие лекарственные препараты.
В.С. ЛЕВИН, кандидат биологических наук.
Это копия статьи, находящейся по адресу https://masterokblog.ru/?p=63176.
| Sea Urchin
Temporal range: Ordovician–Present PreꞒ Ꞓ O S D C P T J K Pg N |
|
|---|---|

|
|
| Tripneustes ventricosus and Echinometra viridis | |
| Scientific classification |
|
| Kingdom: | Animalia |
| Phylum: | Echinodermata |
| Subphylum: | Echinozoa |
| Class: | Echinoidea Leske, 1778 |
| Subclasses | |
|
Sea urchins () are spiny, globular echinoderms in the class Echinoidea. About 950 species of sea urchin live on the seabed of every ocean and inhabit every depth zone from the intertidal seashore down to 5,000 meters (16,000 ft; 2,700 fathoms).[1] The spherical, hard shells (tests) of sea urchins are round and covered in spines, ranging in length from 3 to 10 cm (1 to 4 in), though the black sea urchin can have spines as long as 30 cm (12 in). Sea urchins move slowly, crawling with tube feet, and also propel themselves with their spines. Although algae are the primary diet, sea urchins also eat slow-moving (sessile) animals. Predators that eat sea urchins include a wide variety of fish, starfish, crabs, marine mammals. Sea urchins are also used as food especially in Japan.
Like all echinoderms, adult sea urchins have fivefold symmetry, but their pluteus larvae feature bilateral (mirror) symmetry, indicating that the sea urchin belongs to the Bilateria group of animal phyla, which also comprises the chordates and the arthropods, the annelids and the molluscs, and are found in every ocean and in every climate, from the tropics to the polar regions, and inhabit marine benthic (sea bed) habitats, from rocky shores to hadal zone depths. The fossil record of the Echinoids dates from the Ordovician period, some 450 million years ago. The closest echinoderm relatives of the sea urchin are the sea cucumbers (Holothuroidea), both of which are deuterostomes, a clade that includes the chordates. (Sand dollars are a separate order in the sea urchin class Echinoidea.)
The animals have been studied since the 19th century as model organisms in developmental biology, as their embryos were easy to observe. That has continued with studies of their genomes because of their unusual fivefold symmetry and relationship to chordates. Species such as the slate pencil urchin are popular in aquariums, where they are useful for controlling algae. Fossil urchins have been used as protective amulets.
Diversity[edit]
Sea urchins are members of the phylum Echinodermata, which also includes sea stars, sea cucumbers, sand dollars, brittle stars, and crinoids. Like other echinoderms, they have five-fold symmetry (called pentamerism) and move by means of hundreds of tiny, transparent, adhesive «tube feet». The symmetry is not obvious in the living animal, but is easily visible in the dried test.[2]
Specifically, the term «sea urchin» refers to the «regular echinoids», which are symmetrical and globular, and includes several different taxonomic groups, with two subclasses : Euechinoidea («modern» sea urchins, including irregular ones) and Cidaroidea or «slate-pencil urchins», which have very thick, blunt spines, with algae and sponges growing on them. The «irregular» sea urchins are an infra-class inside the Euechinoidea, called Irregularia, and include Atelostomata and Neognathostomata. Irregular echinoids include: flattened sand dollars, sea biscuits, and heart urchins.[3]
Together with sea cucumbers (Holothuroidea), they make up the subphylum Echinozoa, which is characterized by a globoid shape without arms or projecting rays. Sea cucumbers and the irregular echinoids have secondarily evolved diverse shapes. Although many sea cucumbers have branched tentacles surrounding their oral openings, these have originated from modified tube feet and are not homologous to the arms of the crinoids, sea stars, and brittle stars.[2]
Description[edit]
Sea urchin anatomy based on Arbacia sp.
Urchins typically range in size from 3 to 10 cm (1 to 4 in), although the largest species can reach up to 36 cm (14 in).[4] They have a rigid, usually spherical body bearing moveable spines, which gives the class the name Echinoidea (from the Greek ἐχῖνος ekhinos ‘spine’).[5] The name urchin is an old word for hedgehog, which sea urchins resemble; they have archaically been called sea hedgehogs.[6][7] The name is derived from Old French herichun, from Latin ericius (‘hedgehog’).[8]
Like other echinoderms, sea urchin early larvae have bilateral symmetry,[9] but they develop five-fold symmetry as they mature. This is most apparent in the «regular» sea urchins, which have roughly spherical bodies with five equally sized parts radiating out from their central axes. The mouth is at the base of the animal and the anus at the top; the lower surface is described as «oral» and the upper surface as «aboral».[a][2]
Several sea urchins, however, including the sand dollars, are oval in shape, with distinct front and rear ends, giving them a degree of bilateral symmetry. In these urchins, the upper surface of the body is slightly domed, but the underside is flat, while the sides are devoid of tube feet. This «irregular» body form has evolved to allow the animals to burrow through sand or other soft materials.[4]
Systems[edit]
Musculoskeletal[edit]
The internal organs are enclosed in a hard shell or test composed of fused plates of calcium carbonate covered by a thin dermis and epidermis. The test is referred to as an endoskeleton rather than exoskeleton even though it encloses almost all of the urchin. This is because it is covered with a thin layer of muscle and skin; sea urchins also do not need to molt the way invertebrates with true exoskeletons do, instead the plates forming the test grow as the animal does.
The test is rigid, and divides into five ambulacral grooves separated by five wider interambulacral areas. Each of these ten longitudinal columns consists of two sets of plates (thus comprising 20 columns in total). The ambulacral plates have pairs of tiny holes through which the tube feet extend.[10]
All of the plates are covered in rounded tubercles to which the spines are attached. The spines are used for defence and for locomotion and come in a variety of forms.[11] The inner surface of the test is lined by peritoneum.[4] Sea urchins convert aqueous carbon dioxide using a catalytic process involving nickel into the calcium carbonate portion of the test.[12]
Most species have two series of spines, primary (long) and secondary (short), distributed over the surface of the body, with the shortest at the poles and the longest at the equator. The spines are usually hollow and cylindrical. Contraction of the muscular sheath that covers the test causes the spines to lean in one direction or another, while an inner sheath of collagen fibres can reversibly change from soft to rigid which can lock the spine in one position. Located among the spines are several types of pedicellaria, moveable stalked structures with jaws.[2]
Sea urchins move by walking, using their many flexible tube feet in a way similar to that of starfish; regular sea urchins do not have any favourite walking direction.[13] The tube feet protrude through pairs of pores in the test, and are operated by a water vascular system; this works through hydraulic pressure, allowing the sea urchin to pump water into and out of the tube feet. During locomotion, the tube feet are assisted by the spines which can be used for pushing the body along or to lift the test off the substrate. Movement is generally related to feeding, with the red sea urchin (Mesocentrotus franciscanus) managing about 7.5 cm (3 in) a day when there is ample food, and up to 50 cm (20 in) a day where there is not. An inverted sea urchin can right itself by progressively attaching and detaching its tube feet and manipulating its spines to roll its body upright.[2] Some species bury themselves in soft sediment using their spines, and Paracentrotus lividus uses its jaws to burrow into soft rocks.[14]
-
Test of black sea urchin, showing tubercles and ambulacral plates (on right)
-
Inner surface of test, showing pentagonal interambulacral plates on right, and holes for tube feet on left.
-
-
Close-up of the test showing an ambulacral groove with its two rows of pore-pairs, between two interambulacra areas (green). The tubercles are non-perforated.
-
Close-up of a cidaroid sea urchin apical disc: the 5 holes are the gonopores, and the central one is the anus («periproct»). The biggest genital plate is the madreporite.[15]
Feeding and digestion[edit]
Dentition of a sea urchin
The mouth lies in the centre of the oral surface in regular urchins, or towards one end in irregular urchins. It is surrounded by lips of softer tissue, with numerous small, embedded bony pieces. This area, called the peristome, also includes five pairs of modified tube feet and, in many species, five pairs of gills.[4] The jaw apparatus consists of five strong arrow-shaped plates known as pyramids, the ventral surface of each of which has a toothband with a hard tooth pointing towards the centre of the mouth. Specialised muscles control the protrusion of the apparatus and the action of the teeth, and the animal can grasp, scrape, pull and tear.[2] The structure of the mouth and teeth have been found to be so efficient at grasping and grinding that similar structures have been tested for use in real-world applications.[16]
On the upper surface of the test at the aboral pole is a membrane, the periproct, which surrounds the anus. The periproct contains a variable number of hard plates, five of which, the genital plates, contain the gonopores, and one is modified to contain the madreporite, which is used to balance the water vascular system.[2]
Aristotle’s lantern in a sea urchin, viewed in lateral section
The mouth of most sea urchins is made up of five calcium carbonate teeth or plates, with a fleshy, tongue-like structure within. The entire chewing organ is known as Aristotle’s lantern from Aristotle’s description in his History of Animals (translated by D’Arcy Thompson):
… the urchin has what we mainly call its head and mouth down below, and a place for the issue of the residuum up above. The urchin has, also, five hollow teeth inside, and in the middle of these teeth a fleshy substance serving the office of a tongue. Next to this comes the esophagus, and then the stomach, divided into five parts, and filled with excretion, all the five parts uniting at the anal vent, where the shell is perforated for an outlet … In reality the mouth-apparatus of the urchin is continuous from one end to the other, but to outward appearance it is not so, but looks like a horn lantern with the panes of horn left out.
However, this has recently been proven to be a mistranslation. Aristotle’s lantern is actually referring to the whole shape of sea urchins, which look like the ancient lamps of Aristotle’s time.[17][18]
Heart urchins are unusual in not having a lantern. Instead, the mouth is surrounded by cilia that pull strings of mucus containing food particles towards a series of grooves around the mouth.[4]
Digestive and circulatory systems of a regular sea urchin:
a = anus ; m = madreporite ; s = aquifer canal ; r = radial canal ; p = podial ampulla ; k = test wall ; i = intestine ; b = mouth
The lantern, where present, surrounds both the mouth cavity and the pharynx. At the top of the lantern, the pharynx opens into the esophagus, which runs back down the outside of the lantern, to join the small intestine and a single caecum. The small intestine runs in a full circle around the inside of the test, before joining the large intestine, which completes another circuit in the opposite direction. From the large intestine, a rectum ascends towards the anus. Despite the names, the small and large intestines of sea urchins are in no way homologous to the similarly named structures in vertebrates.[4]
Digestion occurs in the intestine, with the caecum producing further digestive enzymes. An additional tube, called the siphon, runs beside much of the intestine, opening into it at both ends. It may be involved in resorption of water from food.[4]
Circulation and respiration[edit]
The water vascular system leads downwards from the madreporite through the slender stone canal to the ring canal, which encircles the oesophagus. Radial canals lead from here through each ambulacral area to terminate in a small tentacle that passes through the ambulacral plate near the aboral pole. Lateral canals lead from these radial canals, ending in ampullae. From here, two tubes pass through a pair of pores on the plate to terminate in the tube feet.[2]
Sea urchins possess a hemal system with a complex network of vessels in the mesenteries around the gut, but little is known of the functioning of this system.[2] However, the main circulatory fluid fills the general body cavity, or coelom. This coelomic fluid contains phagocytic coelomocytes, which move through the vascular and hemal systems and are involved in internal transport and gas exchange. The coelomocytes are an essential part of blood clotting, but also collect waste products and actively remove them from the body through the gills and tube feet.[4]
Most sea urchins possess five pairs of external gills attached to the peristomial membrane around their mouths. These thin-walled projections of the body cavity are the main organs of respiration in those urchins that possess them. Fluid can be pumped through the gills’ interiors by muscles associated with the lantern, but this does not provide a continuous flow, and occurs only when the animal is low in oxygen. Tube feet can also act as respiratory organs, and are the primary sites of gas exchange in heart urchins and sand dollars, both of which lack gills. The inside of each tube foot is divided by a septum which reduces diffusion between the incoming and outgoing streams of fluid.[2]
Nervous system and senses[edit]
The nervous system of sea urchins has a relatively simple layout. With no true brain, the neural center is a large nerve ring encircling the mouth just inside the lantern. From the nerve ring, five nerves radiate underneath the radial canals of the water vascular system, and branch into numerous finer nerves to innervate the tube feet, spines, and pedicellariae.[4]
Sea urchins are sensitive to touch, light, and chemicals. There are numerous sensitive cells in the epithelium, especially in the spines, pedicellaria and tube feet, and around the mouth.[2] Although they do not have eyes or eye spots (except for diadematids, which can follow a threat with their spines), the entire body of most regular sea urchins might function as a compound eye.[19] In general, sea urchins are negatively attracted to light, and seek to hide themselves in crevices or under objects. Most species, apart from pencil urchins, have statocysts in globular organs called spheridia. These are stalked structures and are located within the ambulacral areas; their function is to help in gravitational orientation.[4]
Life history[edit]
Reproduction[edit]
Male flower urchin (Toxopneustes roseus) releasing milt, November 1, 2011, Lalo Cove, Sea of Cortez
Sea urchins are dioecious, having separate male and female sexes, although no distinguishing features are visible externally. In addition to their role in reproduction, the gonads are also nutrient storing organs, and are made up of two main type of cells: germ cells, and somatic cells called nutritive phagocytes.[20] Regular sea urchins have five gonads, lying underneath the interambulacral regions of the test, while the irregular forms mostly have four, with the hindmost gonad being absent; heart urchins have three or two. Each gonad has a single duct rising from the upper pole to open at a gonopore lying in one of the genital plates surrounding the anus. Some burrowing sand dollars have an elongated papilla that enables the liberation of gametes above the surface of the sediment.[2] The gonads are lined with muscles underneath the peritoneum, and these allow the animal to squeeze its gametes through the duct and into the surrounding sea water, where fertilization takes place.[4]
Development[edit]
During early development, the sea urchin embryo undergoes 10 cycles of cell division,[21] resulting in a single epithelial layer enveloping the blastocoel. The embryo then begins gastrulation, a multipart process which dramatically rearranges its structure by invagination to produce the three germ layers, involving an epithelial-mesenchymal transition; primary mesenchyme cells move into the blastocoel[22] and become mesoderm.[23] It has been suggested that epithelial polarity together with planar cell polarity might be sufficient to drive gastrulation in sea urchins.[24]
The development of a regular sea urchin
An unusual feature of sea urchin development is the replacement of the larva’s bilateral symmetry by the adult’s broadly fivefold symmetry. During cleavage, mesoderm and small micromeres are specified. At the end of gastrulation, cells of these two types form coelomic pouches. In the larval stages, the adult rudiment grows from the left coelomic pouch; after metamorphosis, that rudiment grows to become the adult. The animal-vegetal axis is established before the egg is fertilized. The oral-aboral axis is specified early in cleavage, and the left-right axis appears at the late gastrula stage.[25]
Life cycle and development[edit]
In most cases, the female’s eggs float freely in the sea, but some species hold onto them with their spines, affording them a greater degree of protection. The unfertilized egg meets with the free-floating sperm released by males, and develops into a free-swimming blastula embryo in as few as 12 hours. Initially a simple ball of cells, the blastula soon transforms into a cone-shaped echinopluteus larva. In most species, this larva has 12 elongated arms lined with bands of cilia that capture food particles and transport them to the mouth. In a few species, the blastula contains supplies of nutrient yolk and lacks arms, since it has no need to feed.[4]
Several months are needed for the larva to complete its development, the change into the adult form beginning with the formation of test plates in a juvenile rudiment which develops on the left side of the larva, its axis being perpendicular to that of the larva. Soon, the larva sinks to the bottom and metamorphoses into a juvenile urchin in as little as one hour.[2] In some species, adults reach their maximum size in about five years.[4] The purple urchin becomes sexually mature in two years and may live for twenty.[26]
Ecology[edit]
Trophic level[edit]
Sea urchin in natural habitat
Sea urchins feed mainly on algae, so they are primarily herbivores, but can feed on sea cucumbers and a wide range of invertebrates, such as mussels, polychaetes, sponges, brittle stars, and crinoids, making them omnivores, consumers at a range of trophic levels.[27]
Predators, parasites, and diseases[edit]
Mass mortality of sea urchins was first reported in the 1970s, but diseases in sea urchins had been little studied before the advent of aquaculture. In 1981, bacterial «spotting disease» caused almost complete mortality in juvenile Pseudocentrotus depressus and Hemicentrotus pulcherrimus, both cultivated in Japan; the disease recurred in succeeding years. It was divided into a cool-water «spring» disease and a hot-water «summer» form.[28] Another condition, bald sea urchin disease, causes loss of spines and skin lesions and is believed to be bacterial in origin.[29]
Adult sea urchins are usually well protected against most predators by their strong and sharp spines, which can be venomous in some species.[30] The small urchin clingfish lives among the spines of urchins such as Diadema; juveniles feed on the pedicellariae and sphaeridia, adult males choose the tube feet and adult females move away to feed on shrimp eggs and molluscs.[31]
Sea urchins are one of the favourite foods of many lobsters, crabs, triggerfish, California sheephead, sea otter and wolf eels (which specialise in sea urchins). All these animals carry particular adaptations (teeth, pincers, claws) and a strength that allow them to overcome the excellent protective features of sea urchins. Left unchecked by predators, urchins devastate their environments, creating what biologists call an urchin barren, devoid of macroalgae and associated fauna.[32] Sea urchins graze on the lower stems of kelp, causing the kelp to drift away and die. Loss of the habitat and nutrients provided by kelp forests leads to profound cascade effects on the marine ecosystem. Sea otters have re-entered British Columbia, dramatically improving coastal ecosystem health.[33]
-
Wolf eel, a highly specialized predator of sea urchins
-
Anti-predator defences[edit]
The flower urchin is a dangerous, potentially lethally venomous species.
The spines, long and sharp in some species, protect the urchin from predators. Some tropical sea urchins like Diadematidae, Echinothuriidae and Toxopneustidae have venomous spines. Other creatures also make use of these defences; crabs, shrimps and other organisms shelter among the spines, and often adopt the colouring of their host. Some crabs in the Dorippidae family carry sea urchins, starfish, sharp shells or other protective objects in their claws.[34]
Pedicellaria[35] are a good means of defense against ectoparasites, but not a panacea as some of them actually feed on it.[36] The hemal system defends against endoparasites.[37]
Range and habitat[edit]
Sea urchins are established in most seabed habitats from the intertidal downwards, at an extremely wide range of depths.[38] Some species, such as Cidaris abyssicola, can live at depths of several kilometres. Many genera are found in only the abyssal zone, including many cidaroids, most of the genera in the Echinothuriidae family, and the «cactus urchins» Dermechinus. One of the deepest-living families is the Pourtalesiidae,[39] strange bottle-shaped irregular sea urchins that live in only the hadal zone and have been collected as deep as 6850 metres beneath the surface in the Sunda Trench.[40] Nevertheless, this makes sea urchin the class of echinoderms living the least deep, compared to brittle stars, starfish and crinoids that remain abundant below 8,000 m (26,250 ft) and sea cucumbers which have been recorded from 10,687 m (35,100 ft).[40]
Population densities vary by habitat, with more dense populations in barren areas as compared to kelp stands.[41][42] Even in these barren areas, greatest densities are found in shallow water. Populations are generally found in deeper water if wave action is present.[42] Densities decrease in winter when storms cause them to seek protection in cracks and around larger underwater structures.[42]
The shingle urchin (Colobocentrotus atratus), which lives on exposed shorelines, is particularly resistant to wave action. It is one of the few sea urchin that can survive many hours out of water.[43]
Sea urchins can be found in all climates, from warm seas to polar oceans.[38] The larvae of the polar sea urchin Sterechinus neumayeri have been found to use energy in metabolic processes twenty-five times more efficiently than do most other organisms.[44] Despite their presence in nearly all the marine ecosystems, most species are found on temperate and tropical coasts, between the surface and some tens of meters deep, close to photosynthetic food sources.[38]
-
The shape of the shingle urchin allows it to stay on wave-beaten cliffs.
Evolution[edit]
Fossil history[edit]
The thick spines (radiola) of Cidaridae were used for walking on the soft seabed.
The earliest echinoid fossils date to the Middle Ordovician period (circa 465 Mya).[45][46][47] There is a rich fossil record, their hard tests made of calcite plates surviving in rocks from every period since then.[48]
Spines are present in some well-preserved specimens, but usually only the test remains. Isolated spines are common as fossils. Some Jurassic and Cretaceous Cidaroida had very heavy, club-shaped spines.[49]
Most fossil echinoids from the Paleozoic era are incomplete, consisting of isolated spines and small clusters of scattered plates from crushed individuals, mostly in Devonian and Carboniferous rocks. The shallow-water limestones from the Ordovician and Silurian periods of Estonia are famous for echinoids.[50] Paleozoic echinoids probably inhabited relatively quiet waters. Because of their thin tests, they would certainly not have survived in the wave-battered coastal waters inhabited by many modern echinoids.[50] Echinoids declined to near extinction at the end of the Paleozoic era, with just six species known from the Permian period. Only two lineages survived this period’s massive extinction and into the Triassic: the genus Miocidaris, which gave rise to modern cidaroida (pencil urchins), and the ancestor that gave rise to the euechinoids. By the upper Triassic, their numbers increased again. Cidaroids have changed very little since the Late Triassic, and are the only Paleozoic echinoid group to have survived.[50]
The euechinoids diversified into new lineages in the Jurassic and Cretaceous periods, and from them emerged the first irregular echinoids (the Atelostomata) during the early Jurassic.[51]
Some echinoids, such as Micraster in the chalk of the Cretaceous period, serve as zone or index fossils. Because they are abundant and evolved rapidly, they enable geologists to date the surrounding rocks.[52]
In the Paleogene and Neogene periods (circa 66 to 1.8 Mya), sand dollars (Clypeasteroida) arose. Their distinctive, flattened tests and tiny spines were adapted to life on or under loose sand in shallow water, and they are abundant as fossils in southern European limestones and sandstones.[50]
Phylogeny[edit]
External[edit]
Echinoids are deuterostome animals, like the chordates. A 2014 analysis of 219 genes from all classes of echinoderms gives the following phylogenetic tree.[53] Approximate dates of branching of major clades are shown in millions of years ago (mya).
Internal[edit]
The phylogeny of the sea urchins is as follows:[54][55]
The phylogenetic study from 2022 presents a different topology of the Euechinoidea phylogenetic tree. Irregularia are sister group of Echinacea (including Salenioida) forming a common clade Carinacea, basal groups Aspidodiadematoida, Diadematoida, Echinothurioida, Micropygoida, and Pedinoida are comprised in a common basal clade Aulodonta.[56]
Relation to humans[edit]
Injuries[edit]
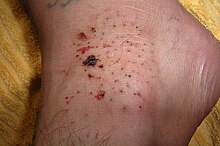
Sea urchin injury on the top side of the foot. This injury resulted in some skin staining from the natural purple-black dye of the urchin.
Sea urchin injuries are puncture wounds inflicted by the animal’s brittle, fragile spines.[57]
These are a common source of injury to ocean swimmers, especially along coastal surfaces where coral with stationary sea urchins are present. Their stings vary in severity depending on the species. Their spines can be venomous or cause infection. Granuloma and staining of the skin from the natural dye inside the sea urchin can also occur. Breathing problems may indicate a serious reaction to toxins in the sea urchin.[58] They inflict a painful wound when they penetrate human skin, but are not themselves dangerous if fully removed promptly; if left in the skin, further problems may occur.[59]
Science[edit]
Sea urchins are traditional model organisms in developmental biology. This use originated in the 1800s, when their embryonic development became easily viewed by microscopy. The transparency of the urchin’s eggs enabled them to be used to observe that sperm cells actually fertilize ova.[60] They continue to be used for embryonic studies, as prenatal development continues to seek testing for fatal diseases. Sea urchins are being used in longevity studies for comparison between the young and old of the species, particularly for their ability to regenerate tissue as needed.[61] Scientists at the University of St Andrews have discovered a genetic sequence, the ‘2A’ region, in sea urchins previously thought to have belonged only to viruses that afflict humans like foot-and-mouth disease virus.[62]
More recently, Eric H. Davidson and Roy John Britten argued for the use of urchins as a model organism due to their easy availability, high fecundity, and long lifespan. Beyond embryology, urchins provide an opportunity to research cis-regulatory elements.[63]
Oceanography has taken an interest in monitoring the health of urchins and their populations as a way to assess overall ocean acidification,[64] temperatures, and ecological impacts.
The organism’s evolutionary placement and unique embryology with five-fold symmetry were the major arguments in the proposal to seek the sequencing of its genome. Importantly, urchins act as the closest living relative to chordates and thus are of interest for the light they can shed on the evolution of vertebrates.[65] The genome of Strongylocentrotus purpuratus was completed in 2006 and established homology between sea urchin and vertebrate immune system-related genes. Sea urchins code for at least 222 Toll-like receptor genes and over 200 genes related to the Nod-like-receptor family found in vertebrates.[66] This increases its usefulness as a valuable model organism for studying the evolution of innate immunity. The sequencing also revealed that while some genes were thought to be limited to vertebrates, there were also innovations that have previously never been seen outside the chordate classification, such as immune transcription factors PU.1 and SPIB.[65]
As food[edit]
The gonads of both male and female sea urchins, usually called sea urchin roe or corals,[67] are culinary delicacies in many parts of the world, especially Japan.[68][69][70] In Japan, sea urchin is known as uni (うに), and its roe can retail for as much as ¥40,000 ($360) per kilogram;[71] it is served raw as sashimi or in sushi, with soy sauce and wasabi. Japan imports large quantities from the United States, South Korea, and other producers. Japan consumes 50,000 tons annually, amounting to over 80% of global production.[72] Japanese demand for sea urchins has raised concerns about overfishing.[73]
In Mediterranean cuisines, Paracentrotus lividus is often eaten raw, or with lemon,[74] and known as ricci on Italian menus where it is sometimes used in pasta sauces. It can also flavour omelettes, scrambled eggs, fish soup,[75] mayonnaise, béchamel sauce for tartlets,[76] the boullie for a soufflé,[77] or Hollandaise sauce to make a fish sauce.[78] In Chilean cuisine, it is served raw with lemon, onions, and olive oil. Though the edible Strongylocentrotus droebachiensis is found in the North Atlantic, it is not widely eaten. However, sea urchins (called uutuk in Alutiiq) are commonly eaten by the Alaska Native population around Kodiak Island. It is commonly exported, mostly to Japan.[79]
In the West Indies, slate pencil urchins are eaten.[68]
On the Pacific Coast of North America, Strongylocentrotus franciscanus was praised by Euell Gibbons; Strongylocentrotus purpuratus is also eaten.[68]
Native Americans in California are also known to eat sea urchins.[80] The coast of Southern California is known as a source of high quality uni, with divers picking sea urchin from kelp beds in depths as deep as 24 m/80 ft.[81] As of 2013, the state was limiting the practice to 300 sea urchin diver licenses.[81]
In New Zealand, Evechinus chloroticus, known as kina in Māori, is a delicacy, traditionally eaten raw. Though New Zealand fishermen would like to export them to Japan, their quality is too variable.[82]
-
Japanese uni-ikura don, sea urchin egg and salmon egg donburi
-
Open sea urchins in Sicily
Aquaria[edit]
A fossil sea urchin found on a Middle Saxon site in Lincolnshire, thought to have been used as an amulet[83]
Some species of sea urchins, such as the slate pencil urchin (Eucidaris tribuloides), are commonly sold in aquarium stores. Some species are effective at controlling filamentous algae, and they make good additions to an invertebrate tank.[84]
Folklore[edit]
A folk tradition in Denmark and southern England imagined sea urchin fossils to be thunderbolts, able to ward off harm by lightning or by witchcraft, as an apotropaic symbol.[85] Another version supposed they were petrified eggs of snakes, able to protect against heart and liver disease, poisons, and injury in battle, and accordingly they were carried as amulets. These were, according to the legend, created by magic from foam made by the snakes at midsummer.[86]
Explanatory notes[edit]
- ^ The tube feet are present in all parts of the animal except around the anus, so technically, the whole surface of the body should be considered to be the oral surface, with the aboral (non-mouth) surface limited to the immediate vicinity of the anus.[2]
References[edit]
- ^ «Animal Diversity Web – Echinoidea». University of Michigan Museum of Zoology. Retrieved 26 August 2012.
- ^ a b c d e f g h i j k l m n Ruppert, Edward E.; Fox, Richard, S.; Barnes, Robert D. (2004). Invertebrate Zoology, 7th edition. Cengage Learning. pp. 896–906. ISBN 978-81-315-0104-7.
- ^ Kroh, A.; Hansson, H. (2013). «Echinoidea (Leske, 1778)». WoRMS. World Register of Marine Species. Retrieved 2014-01-04.
- ^ a b c d e f g h i j k l m Barnes, Robert D. (1982). Invertebrate Zoology. Philadelphia, PA: Holt-Saunders International. pp. 961–981. ISBN 0-03-056747-5.
- ^ Guill, Michael. «Taxonomic Etymologies EEOB 111». Retrieved 13 March 2018.
- ^ Wright, Anne. 1851. The Observing Eye, Or, Letters to Children on the Three Lowest Divisions of Animal Life. London: Jarrold and Sons, p. 107.
- ^ Soyer, Alexis. 1853. The Pantropheon Or History of Food, And Its Preparation: From The Earliest Ages Of The World. Boston: Ticknor, Reed, and Fields,, p. 245.
- ^ «urchin (n.)». Online Etymology Dictionary. Retrieved 13 March 2018.
- ^ Stachan and Read, Human Molecular Genetics, p. 381: «What Makes Us Human»
- ^ «The Echinoid Directory — Natural History Museum». www.nhm.ac.uk. Natural History Museum, UK. Retrieved 28 December 2022.
- ^ «The Echinoid Directory — Natural History Museum». www.nhm.ac.uk. Natural History Museum, UK. Retrieved 28 December 2022.
- ^ «Sea urchins reveal promising carbon capture alternative». Gizmag. 4 February 2013. Retrieved 2013-02-05.
- ^ Kazuya Yoshimura, Tomoaki Iketani et Tatsuo Motokawa, «Do regular sea urchins show preference in which part of the body they orient forward in their walk ?», Marine Biology, vol. 159, no 5, 2012, p. 959–965.
- ^ Boudouresque, Charles F.; Verlaque, Marc (2006). «13: Ecology of Paracentrotus lividus«. In Lawrence, John, M. (ed.). Edible Sea Urchins: Biology and Ecology. Elsevier. p. 243. ISBN 978-0-08-046558-6.
- ^ «Apical disc and periproct». Natural History Museum, London. Retrieved 2 November 2019.
- ^ Claw inspired by sea urchins’ mouth can scoop up Martian soil
- ^ Voultsiadou, Eleni; Chintiroglou, Chariton (2008). «Aristotle’s lantern in echinoderms: an ancient riddle» (PDF). Cahiers de Biologie Marine. Station Biologique de Roscoff. 49 (3): 299–302.
- ^ Choi, Charles Q. (29 December 2010). «Rock-Chewing Sea Urchins Have Self-Sharpening Teeth». National Geographic News. Retrieved 2017-11-12.
- ^ Knight, K. (2009). «Sea Urchins Use Whole Body As Eye». Journal of Experimental Biology. 213 (2): i–ii. doi:10.1242/jeb.041715.
- Charles Q. Choi (December 28, 2009). «Body of Sea Urchin is One Big Eye». LiveScience (Press release).
- ^ Gaitán-Espitia, J. D.; Sánchez, R.; Bruning, P.; Cárdenas, L. (2016). «Functional insights into the testis transcriptome of the edible sea urchin Loxechinus albus». Scientific Reports. 6: 36516. Bibcode:2016NatSR…636516G. doi:10.1038/srep36516. PMC 5090362. PMID 27805042.
- ^ A. Gaion, A. Scuderi; D. Pellegrini; D. Sartori (2013). «Arsenic Exposure Affects Embryo Development of Sea Urchin, Paracentrotus lividus (Lamarck, 1816)». Bulletin of Environmental Contamination and Toxicology. 39 (2): 124–8. doi:10.3109/01480545.2015.1041602. PMID 25945412. S2CID 207437380.
- ^ Kominami, Tetsuya; Takata, Hiromi (2004). «Gastrulation in the sea urchin embryo: a model system for analyzing the morphogenesis of a monolayered epithelium». Development, Growth & Differentiation. 46 (4): 309–26. doi:10.1111/j.1440-169x.2004.00755.x. PMID 15367199. S2CID 23988213.
- ^ Shook, D; Keller, R (2003). «Mechanisms, mechanics and function of epithelial-mesenchymal transitions in early development». Mechanisms of Development. 120 (11): 1351–83. doi:10.1016/j.mod.2003.06.005. PMID 14623443. S2CID 15509972.; Katow, Hideki; Solursh, Michael (1980). «Ultrastructure of primary mesenchyme cell ingression in the sea urchinLytechinus pictus». Journal of Experimental Zoology. 213 (2): 231–246. doi:10.1002/jez.1402130211.; Balinsky, BI (1959). «An electro microscopic investigation of the mechanisms of adhesion of the cells in a sea urchin blastula and gastrula». Experimental Cell Research. 16 (2): 429–33. doi:10.1016/0014-4827(59)90275-7. PMID 13653007.; Hertzler, PL; McClay, DR (1999). «alphaSU2, an epithelial integrin that binds laminin in the sea urchin embryo». Developmental Biology. 207 (1): 1–13. doi:10.1006/dbio.1998.9165. PMID 10049560.; Fink, RD; McClay, DR (1985). «Three cell recognition changes accompany the ingression of sea urchin primary mesenchyme cells». Developmental Biology. 107 (1): 66–74. doi:10.1016/0012-1606(85)90376-8. PMID 2578117.; Burdsal, CA; Alliegro, MC; McClay, DR (1991). «Tissue-specific, temporal changes in cell adhesion to echinonectin in the sea urchin embryo». Developmental Biology. 144 (2): 327–34. doi:10.1016/0012-1606(91)90425-3. PMID 1707016.; Miller, JR; McClay, DR (1997). «Characterization of the Role of Cadherin in Regulating Cell Adhesion during Sea Urchin Development». Developmental Biology. 192 (2): 323–39. doi:10.1006/dbio.1997.8740. PMID 9441671.; Miller, JR; McClay, DR (1997). «Changes in the pattern of adherens junction-associated beta-catenin accompany morphogenesis in the sea urchin embryo». Developmental Biology. 192 (2): 310–22. doi:10.1006/dbio.1997.8739. PMID 9441670.; Anstrom, JA (1989). «Sea urchin primary mesenchyme cells: ingression occurs independent of microtubules». Developmental Biology. 131 (1): 269–75. doi:10.1016/S0012-1606(89)80058-2. PMID 2562830.; Anstrom, JA (1992). «Microfilaments, cell shape changes, and the formation of primary mesenchyme in sea urchin embryos». The Journal of Experimental Zoology. 264 (3): 312–22. doi:10.1002/jez.1402640310. PMID 1358997.
- ^ Nissen, Silas Boye; Rønhild, Steven; Trusina, Ala; Sneppen, Kim (November 27, 2018). «Theoretical tool bridging cell polarities with development of robust morphologies». eLife. 7: e38407. doi:10.7554/eLife.38407. PMC 6286147. PMID 30477635.
- ^ Warner, Jacob F.; Lyons, Deirdre C.; McClay, David R. (2012). «Left-Right Asymmetry in the Sea Urchin Embryo: BMP and the Asymmetrical Origins of the Adult». PLOS Biology. 10 (10): e1001404. doi:10.1371/journal.pbio.1001404. PMC 3467244. PMID 23055829.
- ^ Worley, Alisa (2001). «Strongylocentrotus purpuratus«. Animal Diversity Web. Retrieved 2016-12-05.
- ^ Baumiller, Tomasz K. (2008). «Crinoid Ecological Morphology». Annual Review of Earth and Planetary Sciences. 36: 221–49. Bibcode:2008AREPS..36..221B. doi:10.1146/annurev.earth.36.031207.124116.
- ^ Lawrence, John M. (2006). Edible Sea Urchins: Biology and Ecology. Elsevier. pp. 167–168. ISBN 978-0-08-046558-6.
- ^ Jangoux, Michel (1987). «Diseases of Echinodermata. I. Agents microorganisms and protistans». Diseases of Aquatic Organisms. 2: 147–162. doi:10.3354/dao002147.
- ^ «Defence – spines». Echinoid Directory. Natural History Museum.
- ^ Sakashita, Hiroko (1992). «Sexual dimorphism and food habits of the clingfish, Diademichthys lineatus, and its dependence on host sea urchin». Environmental Biology of Fishes. 34 (1): 95–101. doi:10.1007/BF00004787. S2CID 32656986.
- ^ Terborgh, John; Estes, James A (2013). Trophic Cascades: Predators, Prey, and the Changing Dynamics of Nature. Island Press. p. 38. ISBN 978-1-59726-819-6.
- ^ «Aquatic Species at Risk – Species Profile – Sea Otter». Fisheries and Oceans Canada. Archived from the original on 2008-01-23. Retrieved 2007-11-29.
- ^ Thiel, Martin; Watling, Les (2015). Lifestyles and Feeding Biology. Oxford University Press. pp. 200–202. ISBN 978-0-19-979702-8.
- ^ «Defence – pedicellariae». Echinoid Directory. Natural History Museum.
- ^ Hiroko Sakashita, » Sexual dimorphism and food habits of the clingfish, Diademichthys lineatus, and its dependence on host sea urchin «, Environmental Biology of Fishes, vol. 34, no 1, 1994, p. 95–101
- ^ Jangoux, M. (1984). «Diseases of echinoderms» (PDF). Helgoländer Meeresuntersuchungen. 37 (1–4): 207–216. Bibcode:1984HM…..37..207J. doi:10.1007/BF01989305. S2CID 21863649. Retrieved 23 March 2018.
- ^ a b c Kroh, Andreas (2010). «The phylogeny and classification of post-Palaeozoic echinoids». Journal of Systematic Palaeontology. 8 (2): 147–212. doi:10.1080/14772011003603556..
- ^ Mah, Christopher (April 12, 2011). «Sizes and Species in the Strangest of the Strange : Deep-Sea Pourtalesiid Urchins». The Echinoblog..
- ^ a b Mah, Christopher (8 April 2014). «What are the Deepest known echinoderms?». The Echinoblog. Retrieved 22 March 2018..
- ^ Mattison, J.E.; Trent, J.D.; Shanks, AL; Akin, T.B.; Pearse, J.S. (1977). «Movement and feeding activity of red sea urchins (Strongylocentrotus franciscanus) adjacent to a kelp forest». Marine Biology. 39 (1): 25–30. doi:10.1007/BF00395589. S2CID 84338735.
- ^ a b c Konar, Brenda (2000). «Habitat influences on sea urchin populations». In: Hallock and French (Eds). Diving for Science…2000. Proceedings of the 20th Annual Scientific Diving Symposium. American Academy of Underwater Sciences. Archived from the original on April 15, 2013. Retrieved 7 January 2011.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ ChrisM (2008-04-21). «The Echinoblog». echinoblog.blogspot.com.
- ^ Antarctic Sea Urchin Shows Amazing Energy-Efficiency in Nature’s Deep Freeze 15 March 2001 University of Delaware. Retrieved 22 March 2018
- ^ Botting, Joseph P.; Muir, Lucy A. (March 2012). «Fauna and ecology of the holothurian bed, Llandrindod, Wales, UK (Darriwilian, Middle Ordovician), and the oldest articulated holothurian» (PDF). Palaeontologia Electronica. 15 (1): 1–28. doi:10.26879/272. S2CID 55716313. Retrieved 29 October 2022.
- ^ Thompson, Jeffrey R.; Cotton, Laura J.; Candela, Yves; Kutscher, Manfred; Reich, Mike; Bottjer, David J. (14 April 2022). «The Ordovician diversification of sea urchins: systematics of the Bothriocidaroida (Echinodermata: Echinoidea)». Journal of Systematic Palaeontology. 19 (20): 1395–1448. doi:10.1080/14772019.2022.2042408. S2CID 248192052. Retrieved 29 October 2022.
- ^ «Echinoids». British Geological Survey. 2017. Retrieved 14 March 2018.
- ^ «The Echinoid Directory | Introduction». Natural History Museum. Retrieved 16 March 2018.
- ^ «The Echinoid Directory | Spines». Natural History Museum. Retrieved 16 March 2018.
- ^ a b c d Kirkaldy, J. F. (1967). Fossils in Colour. London: Blandford Press. pp. 161–163.
- ^ Schultz, Heinke A.G. (2015). Echinoidea: with pentameral symmetry. Walter de Gruyter. pp. 36 ff, section 2.4. ISBN 978-3-11-038601-1.
- ^ Wells, H. G.; Huxley, Julian; Wells, G. P. (1931). The Science of life. pp. 346–348.
- ^ Telford, M. J.; Lowe, C. J.; Cameron, C. B.; Ortega-Martinez, O.; Aronowicz, J.; Oliveri, P.; Copley, R. R. (2014). «Phylogenomic analysis of echinoderm class relationships supports Asterozoa». Proceedings of the Royal Society B: Biological Sciences. 281 (1786): 20140479. doi:10.1098/rspb.2014.0479. PMC 4046411. PMID 24850925.
- ^ Planet, Paul J.; Ziegler, Alexander; Schröder, Leif; Ogurreck, Malte; Faber, Cornelius; Stach, Thomas (2012). «Evolution of a Novel Muscle Design in Sea Urchins (Echinodermata: Echinoidea)». PLOS ONE. 7 (5): e37520. Bibcode:2012PLoSO…737520Z. doi:10.1371/journal.pone.0037520. PMC 3356314. PMID 22624043.
- ^ Kroh, Andreas; Smith, Andrew B. (2010). «The phylogeny and classification of post-Palaeozoic echinoids». Journal of Systematic Palaeontology. 8 (2): 147–212. doi:10.1080/14772011003603556.
- ^ Koch, Nicolás Mongiardino; Thompson, Jeffrey R; Hiley, Avery S; McCowin, Marina F; Armstrong, A Frances; Coppard, Simon E; Aguilera, Felipe; Bronstein, Omri; Kroh, Andreas; Mooi, Rich; Rouse, Greg W (Mar 22, 2022). «Phylogenomic analyses of echinoid diversification prompt a re-evaluation of their fossil record». eLife. 11: e72460. doi:10.7554/eLife.72460. PMC 8940180. PMID 35315317.
- ^ James, William D.; Berger, Timothy G.; et al. (2006). Andrews’ Diseases of the Skin: clinical Dermatology. Saunders Elsevier. p. 431. ISBN 0-7216-2921-0.
- ^ Gallagher, Scott A. «Echinoderm Envenomation». eMedicine. Retrieved 12 October 2010.
- ^ Matthew D. Gargus; David K. Morohashi (2012). «A sea-urchin spine chilling remedy». New England Journal of Medicine. 30 (19): 1867–1868. doi:10.1056/NEJMc1209382. PMID 23134402.
- ^ «Insight from the Sea Urchin». Microscope Imaging Station. Exploratorium. Archived from the original on 2017-03-12. Retrieved 2018-03-07.
- ^ Bodnar, Andrea G.; Coffman, James A. (2016-08-01). «Maintenance of somatic tissue regeneration with age in short- and long-lived species of sea urchins». Aging Cell. 15 (4): 778–787. doi:10.1111/acel.12487. ISSN 1474-9726. PMC 4933669. PMID 27095483.
- ^ Roulston, C.; Luke, G.A.; de Felipe, P.; Ruan, L.; Cope, J.; Nicholson, J.; Sukhodub, A.; Tilsner, J.; Ryan, M.D. (2016). «‘2A‐Like’ Signal Sequences Mediating Translational Recoding: A Novel Form of Dual Protein Targeting» (PDF). Traffic. 17 (8): 923–39. doi:10.1111/tra.12411. PMC 4981915. PMID 27161495.
- ^ «Sea Urchin Genome Project». sugp.caltech.edu. Archived from the original on 2016-12-20. Retrieved 2016-12-05.
- ^ «Stanford seeks sea urchin’s secret to surviving ocean acidification | Stanford News Release». news.stanford.edu. 2013-04-08. Retrieved 2016-12-05.
- ^ a b Sodergren, E; Weinstock, GM; Davidson, EH; et al. (2006-11-10). «The Genome of the Sea Urchin Strongylocentrotus purpuratus». Science. 314 (5801): 941–952. Bibcode:2006Sci…314..941S. doi:10.1126/science.1133609. PMC 3159423. PMID 17095691.
- ^ Rast, JP; Smith, LC; Loza-Coll, M; Hibino, T; Litman, GW (2006). «Genomic Insights into the Immune System of the Sea Urchin». Science. 314 (5801): 952–6. Bibcode:2006Sci…314..952R. doi:10.1126/science.1134301. PMC 3707132. PMID 17095692.
- ^ Laura Rogers-Bennett, «The Ecology of Strongylocentrotus franciscanus and Strongylocentrotus purpuratus» in John M. Lawrence, Edible sea urchins: biology and ecology, p. 410
- ^ a b c Davidson, Alan (2014) Oxford Companion to Food. Oxford University Press, 3rd edition. pp. 730–731.
- ^ John M. Lawrence, «Sea Urchin Roe Cuisine» in John M. Lawrence, Edible sea urchins: biology and ecology
- ^ «The Rise of the Sea Urchin», Franz Lidz July 2014, Smithsonian
- ^ Macey, Richard (November 9, 2004). «The little urchins that can command a princely price». The Sydney Morning Herald.
- ^ Zatylny, Jane (6 September 2018). «Searchin’ for Urchin: A Culinary Quest». Hakai Magazine. Retrieved 10 September 2018.
- ^ «Sea Urchin Fishery and Overfishing», TED Case Studies 296, American University full text
- ^ for Puglia, Italy: Touring Club Italiano, Guida all’Italia gastronomica, 1984, p. 314; for Alexandria, Egypt: Claudia Roden, A Book of Middle Eastern Food, p. 183
- ^ Alan Davidson, Mediterranean Seafood, p. 270
- ^ Larousse Gastronomique[page needed]
- ^ Curnonsky, Cuisine et vins de France, nouvelle édition, 1974, p. 248
- ^ Davidson, Alan (2014) Oxford Companion to Food. Oxford University Press, 3rd edition. p. 280
- ^ Kleiman, Dena (October 3, 1990). «Scorned at Home, Maine Sea Urchin Is a Star in Japan». The New York Times. p. C1.
- ^ Martin, R.E.; Carter, E.P.; Flick, G.J.; Davis, L.M. (2000). Marine and Freshwater Products Handbook. Taylor & Francis. p. 268. ISBN 978-1-56676-889-4. Retrieved 2014-12-03.
- ^ a b Lam, Francis (2014-03-14). «California Sea Urchin Divers, Interviewed by Francis Lam». Bon Appetit. Retrieved 2017-03-26.
- ^ Wassilieff, Maggy (March 2, 2009). «sea urchins». Te Ara: The Encyclopedia of New Zealand.
- ^ «Amulet | LIN-B37563». Portable Antiquities Scheme. Retrieved 14 March 2018.
- ^ Tullock, John H. (2008). Your First Marine Aquarium: Everything about Setting Up a Marine Aquarium, Including Conditioning, Maintenance, Selecting Fish and Invertebrates, and More. Barron’s Educational Series. p. 63. ISBN 978-0-7641-3675-7.
- ^ McNamara, Ken (2012). «Prehistoric fossil collectors». The Geological Society. Retrieved 14 March 2018.
- ^ Marren, Peter; Mabey, Richard (2010). Bugs Britannica. Chatto & Windus. pp. 469–470. ISBN 978-0-7011-8180-2.
External links[edit]
Wikimedia Commons has media related to Echinoidea.
- World Register of Marine Species link: Echinoidea Leske, 1778 (+species list)
- The sea urchin genome project
- Sea Urchin Harvesters Association – California Also, (604) 524-0322.
- The Echinoid Directory from the Natural History Museum.
- Virtual Urchin at Stanford
- California Sea Urchin commission
- Introduction to the Echinoidea at UCMP Berkeley
| Sea Urchin
Temporal range: Ordovician–Present PreꞒ Ꞓ O S D C P T J K Pg N |
|
|---|---|

|
|
| Tripneustes ventricosus and Echinometra viridis | |
| Scientific classification |
|
| Kingdom: | Animalia |
| Phylum: | Echinodermata |
| Subphylum: | Echinozoa |
| Class: | Echinoidea Leske, 1778 |
| Subclasses | |
|
Sea urchins () are spiny, globular echinoderms in the class Echinoidea. About 950 species of sea urchin live on the seabed of every ocean and inhabit every depth zone from the intertidal seashore down to 5,000 meters (16,000 ft; 2,700 fathoms).[1] The spherical, hard shells (tests) of sea urchins are round and covered in spines, ranging in length from 3 to 10 cm (1 to 4 in), though the black sea urchin can have spines as long as 30 cm (12 in). Sea urchins move slowly, crawling with tube feet, and also propel themselves with their spines. Although algae are the primary diet, sea urchins also eat slow-moving (sessile) animals. Predators that eat sea urchins include a wide variety of fish, starfish, crabs, marine mammals. Sea urchins are also used as food especially in Japan.
Like all echinoderms, adult sea urchins have fivefold symmetry, but their pluteus larvae feature bilateral (mirror) symmetry, indicating that the sea urchin belongs to the Bilateria group of animal phyla, which also comprises the chordates and the arthropods, the annelids and the molluscs, and are found in every ocean and in every climate, from the tropics to the polar regions, and inhabit marine benthic (sea bed) habitats, from rocky shores to hadal zone depths. The fossil record of the Echinoids dates from the Ordovician period, some 450 million years ago. The closest echinoderm relatives of the sea urchin are the sea cucumbers (Holothuroidea), both of which are deuterostomes, a clade that includes the chordates. (Sand dollars are a separate order in the sea urchin class Echinoidea.)
The animals have been studied since the 19th century as model organisms in developmental biology, as their embryos were easy to observe. That has continued with studies of their genomes because of their unusual fivefold symmetry and relationship to chordates. Species such as the slate pencil urchin are popular in aquariums, where they are useful for controlling algae. Fossil urchins have been used as protective amulets.
Diversity[edit]
Sea urchins are members of the phylum Echinodermata, which also includes sea stars, sea cucumbers, sand dollars, brittle stars, and crinoids. Like other echinoderms, they have five-fold symmetry (called pentamerism) and move by means of hundreds of tiny, transparent, adhesive «tube feet». The symmetry is not obvious in the living animal, but is easily visible in the dried test.[2]
Specifically, the term «sea urchin» refers to the «regular echinoids», which are symmetrical and globular, and includes several different taxonomic groups, with two subclasses : Euechinoidea («modern» sea urchins, including irregular ones) and Cidaroidea or «slate-pencil urchins», which have very thick, blunt spines, with algae and sponges growing on them. The «irregular» sea urchins are an infra-class inside the Euechinoidea, called Irregularia, and include Atelostomata and Neognathostomata. Irregular echinoids include: flattened sand dollars, sea biscuits, and heart urchins.[3]
Together with sea cucumbers (Holothuroidea), they make up the subphylum Echinozoa, which is characterized by a globoid shape without arms or projecting rays. Sea cucumbers and the irregular echinoids have secondarily evolved diverse shapes. Although many sea cucumbers have branched tentacles surrounding their oral openings, these have originated from modified tube feet and are not homologous to the arms of the crinoids, sea stars, and brittle stars.[2]
Description[edit]
Sea urchin anatomy based on Arbacia sp.
Urchins typically range in size from 3 to 10 cm (1 to 4 in), although the largest species can reach up to 36 cm (14 in).[4] They have a rigid, usually spherical body bearing moveable spines, which gives the class the name Echinoidea (from the Greek ἐχῖνος ekhinos ‘spine’).[5] The name urchin is an old word for hedgehog, which sea urchins resemble; they have archaically been called sea hedgehogs.[6][7] The name is derived from Old French herichun, from Latin ericius (‘hedgehog’).[8]
Like other echinoderms, sea urchin early larvae have bilateral symmetry,[9] but they develop five-fold symmetry as they mature. This is most apparent in the «regular» sea urchins, which have roughly spherical bodies with five equally sized parts radiating out from their central axes. The mouth is at the base of the animal and the anus at the top; the lower surface is described as «oral» and the upper surface as «aboral».[a][2]
Several sea urchins, however, including the sand dollars, are oval in shape, with distinct front and rear ends, giving them a degree of bilateral symmetry. In these urchins, the upper surface of the body is slightly domed, but the underside is flat, while the sides are devoid of tube feet. This «irregular» body form has evolved to allow the animals to burrow through sand or other soft materials.[4]
Systems[edit]
Musculoskeletal[edit]
The internal organs are enclosed in a hard shell or test composed of fused plates of calcium carbonate covered by a thin dermis and epidermis. The test is referred to as an endoskeleton rather than exoskeleton even though it encloses almost all of the urchin. This is because it is covered with a thin layer of muscle and skin; sea urchins also do not need to molt the way invertebrates with true exoskeletons do, instead the plates forming the test grow as the animal does.
The test is rigid, and divides into five ambulacral grooves separated by five wider interambulacral areas. Each of these ten longitudinal columns consists of two sets of plates (thus comprising 20 columns in total). The ambulacral plates have pairs of tiny holes through which the tube feet extend.[10]
All of the plates are covered in rounded tubercles to which the spines are attached. The spines are used for defence and for locomotion and come in a variety of forms.[11] The inner surface of the test is lined by peritoneum.[4] Sea urchins convert aqueous carbon dioxide using a catalytic process involving nickel into the calcium carbonate portion of the test.[12]
Most species have two series of spines, primary (long) and secondary (short), distributed over the surface of the body, with the shortest at the poles and the longest at the equator. The spines are usually hollow and cylindrical. Contraction of the muscular sheath that covers the test causes the spines to lean in one direction or another, while an inner sheath of collagen fibres can reversibly change from soft to rigid which can lock the spine in one position. Located among the spines are several types of pedicellaria, moveable stalked structures with jaws.[2]
Sea urchins move by walking, using their many flexible tube feet in a way similar to that of starfish; regular sea urchins do not have any favourite walking direction.[13] The tube feet protrude through pairs of pores in the test, and are operated by a water vascular system; this works through hydraulic pressure, allowing the sea urchin to pump water into and out of the tube feet. During locomotion, the tube feet are assisted by the spines which can be used for pushing the body along or to lift the test off the substrate. Movement is generally related to feeding, with the red sea urchin (Mesocentrotus franciscanus) managing about 7.5 cm (3 in) a day when there is ample food, and up to 50 cm (20 in) a day where there is not. An inverted sea urchin can right itself by progressively attaching and detaching its tube feet and manipulating its spines to roll its body upright.[2] Some species bury themselves in soft sediment using their spines, and Paracentrotus lividus uses its jaws to burrow into soft rocks.[14]
-
Test of black sea urchin, showing tubercles and ambulacral plates (on right)
-
Inner surface of test, showing pentagonal interambulacral plates on right, and holes for tube feet on left.
-
-
Close-up of the test showing an ambulacral groove with its two rows of pore-pairs, between two interambulacra areas (green). The tubercles are non-perforated.
-
Close-up of a cidaroid sea urchin apical disc: the 5 holes are the gonopores, and the central one is the anus («periproct»). The biggest genital plate is the madreporite.[15]
Feeding and digestion[edit]
Dentition of a sea urchin
The mouth lies in the centre of the oral surface in regular urchins, or towards one end in irregular urchins. It is surrounded by lips of softer tissue, with numerous small, embedded bony pieces. This area, called the peristome, also includes five pairs of modified tube feet and, in many species, five pairs of gills.[4] The jaw apparatus consists of five strong arrow-shaped plates known as pyramids, the ventral surface of each of which has a toothband with a hard tooth pointing towards the centre of the mouth. Specialised muscles control the protrusion of the apparatus and the action of the teeth, and the animal can grasp, scrape, pull and tear.[2] The structure of the mouth and teeth have been found to be so efficient at grasping and grinding that similar structures have been tested for use in real-world applications.[16]
On the upper surface of the test at the aboral pole is a membrane, the periproct, which surrounds the anus. The periproct contains a variable number of hard plates, five of which, the genital plates, contain the gonopores, and one is modified to contain the madreporite, which is used to balance the water vascular system.[2]
Aristotle’s lantern in a sea urchin, viewed in lateral section
The mouth of most sea urchins is made up of five calcium carbonate teeth or plates, with a fleshy, tongue-like structure within. The entire chewing organ is known as Aristotle’s lantern from Aristotle’s description in his History of Animals (translated by D’Arcy Thompson):
… the urchin has what we mainly call its head and mouth down below, and a place for the issue of the residuum up above. The urchin has, also, five hollow teeth inside, and in the middle of these teeth a fleshy substance serving the office of a tongue. Next to this comes the esophagus, and then the stomach, divided into five parts, and filled with excretion, all the five parts uniting at the anal vent, where the shell is perforated for an outlet … In reality the mouth-apparatus of the urchin is continuous from one end to the other, but to outward appearance it is not so, but looks like a horn lantern with the panes of horn left out.
However, this has recently been proven to be a mistranslation. Aristotle’s lantern is actually referring to the whole shape of sea urchins, which look like the ancient lamps of Aristotle’s time.[17][18]
Heart urchins are unusual in not having a lantern. Instead, the mouth is surrounded by cilia that pull strings of mucus containing food particles towards a series of grooves around the mouth.[4]
Digestive and circulatory systems of a regular sea urchin:
a = anus ; m = madreporite ; s = aquifer canal ; r = radial canal ; p = podial ampulla ; k = test wall ; i = intestine ; b = mouth
The lantern, where present, surrounds both the mouth cavity and the pharynx. At the top of the lantern, the pharynx opens into the esophagus, which runs back down the outside of the lantern, to join the small intestine and a single caecum. The small intestine runs in a full circle around the inside of the test, before joining the large intestine, which completes another circuit in the opposite direction. From the large intestine, a rectum ascends towards the anus. Despite the names, the small and large intestines of sea urchins are in no way homologous to the similarly named structures in vertebrates.[4]
Digestion occurs in the intestine, with the caecum producing further digestive enzymes. An additional tube, called the siphon, runs beside much of the intestine, opening into it at both ends. It may be involved in resorption of water from food.[4]
Circulation and respiration[edit]
The water vascular system leads downwards from the madreporite through the slender stone canal to the ring canal, which encircles the oesophagus. Radial canals lead from here through each ambulacral area to terminate in a small tentacle that passes through the ambulacral plate near the aboral pole. Lateral canals lead from these radial canals, ending in ampullae. From here, two tubes pass through a pair of pores on the plate to terminate in the tube feet.[2]
Sea urchins possess a hemal system with a complex network of vessels in the mesenteries around the gut, but little is known of the functioning of this system.[2] However, the main circulatory fluid fills the general body cavity, or coelom. This coelomic fluid contains phagocytic coelomocytes, which move through the vascular and hemal systems and are involved in internal transport and gas exchange. The coelomocytes are an essential part of blood clotting, but also collect waste products and actively remove them from the body through the gills and tube feet.[4]
Most sea urchins possess five pairs of external gills attached to the peristomial membrane around their mouths. These thin-walled projections of the body cavity are the main organs of respiration in those urchins that possess them. Fluid can be pumped through the gills’ interiors by muscles associated with the lantern, but this does not provide a continuous flow, and occurs only when the animal is low in oxygen. Tube feet can also act as respiratory organs, and are the primary sites of gas exchange in heart urchins and sand dollars, both of which lack gills. The inside of each tube foot is divided by a septum which reduces diffusion between the incoming and outgoing streams of fluid.[2]
Nervous system and senses[edit]
The nervous system of sea urchins has a relatively simple layout. With no true brain, the neural center is a large nerve ring encircling the mouth just inside the lantern. From the nerve ring, five nerves radiate underneath the radial canals of the water vascular system, and branch into numerous finer nerves to innervate the tube feet, spines, and pedicellariae.[4]
Sea urchins are sensitive to touch, light, and chemicals. There are numerous sensitive cells in the epithelium, especially in the spines, pedicellaria and tube feet, and around the mouth.[2] Although they do not have eyes or eye spots (except for diadematids, which can follow a threat with their spines), the entire body of most regular sea urchins might function as a compound eye.[19] In general, sea urchins are negatively attracted to light, and seek to hide themselves in crevices or under objects. Most species, apart from pencil urchins, have statocysts in globular organs called spheridia. These are stalked structures and are located within the ambulacral areas; their function is to help in gravitational orientation.[4]
Life history[edit]
Reproduction[edit]
Male flower urchin (Toxopneustes roseus) releasing milt, November 1, 2011, Lalo Cove, Sea of Cortez
Sea urchins are dioecious, having separate male and female sexes, although no distinguishing features are visible externally. In addition to their role in reproduction, the gonads are also nutrient storing organs, and are made up of two main type of cells: germ cells, and somatic cells called nutritive phagocytes.[20] Regular sea urchins have five gonads, lying underneath the interambulacral regions of the test, while the irregular forms mostly have four, with the hindmost gonad being absent; heart urchins have three or two. Each gonad has a single duct rising from the upper pole to open at a gonopore lying in one of the genital plates surrounding the anus. Some burrowing sand dollars have an elongated papilla that enables the liberation of gametes above the surface of the sediment.[2] The gonads are lined with muscles underneath the peritoneum, and these allow the animal to squeeze its gametes through the duct and into the surrounding sea water, where fertilization takes place.[4]
Development[edit]
During early development, the sea urchin embryo undergoes 10 cycles of cell division,[21] resulting in a single epithelial layer enveloping the blastocoel. The embryo then begins gastrulation, a multipart process which dramatically rearranges its structure by invagination to produce the three germ layers, involving an epithelial-mesenchymal transition; primary mesenchyme cells move into the blastocoel[22] and become mesoderm.[23] It has been suggested that epithelial polarity together with planar cell polarity might be sufficient to drive gastrulation in sea urchins.[24]
The development of a regular sea urchin
An unusual feature of sea urchin development is the replacement of the larva’s bilateral symmetry by the adult’s broadly fivefold symmetry. During cleavage, mesoderm and small micromeres are specified. At the end of gastrulation, cells of these two types form coelomic pouches. In the larval stages, the adult rudiment grows from the left coelomic pouch; after metamorphosis, that rudiment grows to become the adult. The animal-vegetal axis is established before the egg is fertilized. The oral-aboral axis is specified early in cleavage, and the left-right axis appears at the late gastrula stage.[25]
Life cycle and development[edit]
In most cases, the female’s eggs float freely in the sea, but some species hold onto them with their spines, affording them a greater degree of protection. The unfertilized egg meets with the free-floating sperm released by males, and develops into a free-swimming blastula embryo in as few as 12 hours. Initially a simple ball of cells, the blastula soon transforms into a cone-shaped echinopluteus larva. In most species, this larva has 12 elongated arms lined with bands of cilia that capture food particles and transport them to the mouth. In a few species, the blastula contains supplies of nutrient yolk and lacks arms, since it has no need to feed.[4]
Several months are needed for the larva to complete its development, the change into the adult form beginning with the formation of test plates in a juvenile rudiment which develops on the left side of the larva, its axis being perpendicular to that of the larva. Soon, the larva sinks to the bottom and metamorphoses into a juvenile urchin in as little as one hour.[2] In some species, adults reach their maximum size in about five years.[4] The purple urchin becomes sexually mature in two years and may live for twenty.[26]
Ecology[edit]
Trophic level[edit]
Sea urchin in natural habitat
Sea urchins feed mainly on algae, so they are primarily herbivores, but can feed on sea cucumbers and a wide range of invertebrates, such as mussels, polychaetes, sponges, brittle stars, and crinoids, making them omnivores, consumers at a range of trophic levels.[27]
Predators, parasites, and diseases[edit]
Mass mortality of sea urchins was first reported in the 1970s, but diseases in sea urchins had been little studied before the advent of aquaculture. In 1981, bacterial «spotting disease» caused almost complete mortality in juvenile Pseudocentrotus depressus and Hemicentrotus pulcherrimus, both cultivated in Japan; the disease recurred in succeeding years. It was divided into a cool-water «spring» disease and a hot-water «summer» form.[28] Another condition, bald sea urchin disease, causes loss of spines and skin lesions and is believed to be bacterial in origin.[29]
Adult sea urchins are usually well protected against most predators by their strong and sharp spines, which can be venomous in some species.[30] The small urchin clingfish lives among the spines of urchins such as Diadema; juveniles feed on the pedicellariae and sphaeridia, adult males choose the tube feet and adult females move away to feed on shrimp eggs and molluscs.[31]
Sea urchins are one of the favourite foods of many lobsters, crabs, triggerfish, California sheephead, sea otter and wolf eels (which specialise in sea urchins). All these animals carry particular adaptations (teeth, pincers, claws) and a strength that allow them to overcome the excellent protective features of sea urchins. Left unchecked by predators, urchins devastate their environments, creating what biologists call an urchin barren, devoid of macroalgae and associated fauna.[32] Sea urchins graze on the lower stems of kelp, causing the kelp to drift away and die. Loss of the habitat and nutrients provided by kelp forests leads to profound cascade effects on the marine ecosystem. Sea otters have re-entered British Columbia, dramatically improving coastal ecosystem health.[33]
-
Wolf eel, a highly specialized predator of sea urchins
-
Anti-predator defences[edit]
The flower urchin is a dangerous, potentially lethally venomous species.
The spines, long and sharp in some species, protect the urchin from predators. Some tropical sea urchins like Diadematidae, Echinothuriidae and Toxopneustidae have venomous spines. Other creatures also make use of these defences; crabs, shrimps and other organisms shelter among the spines, and often adopt the colouring of their host. Some crabs in the Dorippidae family carry sea urchins, starfish, sharp shells or other protective objects in their claws.[34]
Pedicellaria[35] are a good means of defense against ectoparasites, but not a panacea as some of them actually feed on it.[36] The hemal system defends against endoparasites.[37]
Range and habitat[edit]
Sea urchins are established in most seabed habitats from the intertidal downwards, at an extremely wide range of depths.[38] Some species, such as Cidaris abyssicola, can live at depths of several kilometres. Many genera are found in only the abyssal zone, including many cidaroids, most of the genera in the Echinothuriidae family, and the «cactus urchins» Dermechinus. One of the deepest-living families is the Pourtalesiidae,[39] strange bottle-shaped irregular sea urchins that live in only the hadal zone and have been collected as deep as 6850 metres beneath the surface in the Sunda Trench.[40] Nevertheless, this makes sea urchin the class of echinoderms living the least deep, compared to brittle stars, starfish and crinoids that remain abundant below 8,000 m (26,250 ft) and sea cucumbers which have been recorded from 10,687 m (35,100 ft).[40]
Population densities vary by habitat, with more dense populations in barren areas as compared to kelp stands.[41][42] Even in these barren areas, greatest densities are found in shallow water. Populations are generally found in deeper water if wave action is present.[42] Densities decrease in winter when storms cause them to seek protection in cracks and around larger underwater structures.[42]
The shingle urchin (Colobocentrotus atratus), which lives on exposed shorelines, is particularly resistant to wave action. It is one of the few sea urchin that can survive many hours out of water.[43]
Sea urchins can be found in all climates, from warm seas to polar oceans.[38] The larvae of the polar sea urchin Sterechinus neumayeri have been found to use energy in metabolic processes twenty-five times more efficiently than do most other organisms.[44] Despite their presence in nearly all the marine ecosystems, most species are found on temperate and tropical coasts, between the surface and some tens of meters deep, close to photosynthetic food sources.[38]
-
The shape of the shingle urchin allows it to stay on wave-beaten cliffs.
Evolution[edit]
Fossil history[edit]
The thick spines (radiola) of Cidaridae were used for walking on the soft seabed.
The earliest echinoid fossils date to the Middle Ordovician period (circa 465 Mya).[45][46][47] There is a rich fossil record, their hard tests made of calcite plates surviving in rocks from every period since then.[48]
Spines are present in some well-preserved specimens, but usually only the test remains. Isolated spines are common as fossils. Some Jurassic and Cretaceous Cidaroida had very heavy, club-shaped spines.[49]
Most fossil echinoids from the Paleozoic era are incomplete, consisting of isolated spines and small clusters of scattered plates from crushed individuals, mostly in Devonian and Carboniferous rocks. The shallow-water limestones from the Ordovician and Silurian periods of Estonia are famous for echinoids.[50] Paleozoic echinoids probably inhabited relatively quiet waters. Because of their thin tests, they would certainly not have survived in the wave-battered coastal waters inhabited by many modern echinoids.[50] Echinoids declined to near extinction at the end of the Paleozoic era, with just six species known from the Permian period. Only two lineages survived this period’s massive extinction and into the Triassic: the genus Miocidaris, which gave rise to modern cidaroida (pencil urchins), and the ancestor that gave rise to the euechinoids. By the upper Triassic, their numbers increased again. Cidaroids have changed very little since the Late Triassic, and are the only Paleozoic echinoid group to have survived.[50]
The euechinoids diversified into new lineages in the Jurassic and Cretaceous periods, and from them emerged the first irregular echinoids (the Atelostomata) during the early Jurassic.[51]
Some echinoids, such as Micraster in the chalk of the Cretaceous period, serve as zone or index fossils. Because they are abundant and evolved rapidly, they enable geologists to date the surrounding rocks.[52]
In the Paleogene and Neogene periods (circa 66 to 1.8 Mya), sand dollars (Clypeasteroida) arose. Their distinctive, flattened tests and tiny spines were adapted to life on or under loose sand in shallow water, and they are abundant as fossils in southern European limestones and sandstones.[50]
Phylogeny[edit]
External[edit]
Echinoids are deuterostome animals, like the chordates. A 2014 analysis of 219 genes from all classes of echinoderms gives the following phylogenetic tree.[53] Approximate dates of branching of major clades are shown in millions of years ago (mya).
Internal[edit]
The phylogeny of the sea urchins is as follows:[54][55]
The phylogenetic study from 2022 presents a different topology of the Euechinoidea phylogenetic tree. Irregularia are sister group of Echinacea (including Salenioida) forming a common clade Carinacea, basal groups Aspidodiadematoida, Diadematoida, Echinothurioida, Micropygoida, and Pedinoida are comprised in a common basal clade Aulodonta.[56]
Relation to humans[edit]
Injuries[edit]
Sea urchin injury on the top side of the foot. This injury resulted in some skin staining from the natural purple-black dye of the urchin.
Sea urchin injuries are puncture wounds inflicted by the animal’s brittle, fragile spines.[57]
These are a common source of injury to ocean swimmers, especially along coastal surfaces where coral with stationary sea urchins are present. Their stings vary in severity depending on the species. Their spines can be venomous or cause infection. Granuloma and staining of the skin from the natural dye inside the sea urchin can also occur. Breathing problems may indicate a serious reaction to toxins in the sea urchin.[58] They inflict a painful wound when they penetrate human skin, but are not themselves dangerous if fully removed promptly; if left in the skin, further problems may occur.[59]
Science[edit]
Sea urchins are traditional model organisms in developmental biology. This use originated in the 1800s, when their embryonic development became easily viewed by microscopy. The transparency of the urchin’s eggs enabled them to be used to observe that sperm cells actually fertilize ova.[60] They continue to be used for embryonic studies, as prenatal development continues to seek testing for fatal diseases. Sea urchins are being used in longevity studies for comparison between the young and old of the species, particularly for their ability to regenerate tissue as needed.[61] Scientists at the University of St Andrews have discovered a genetic sequence, the ‘2A’ region, in sea urchins previously thought to have belonged only to viruses that afflict humans like foot-and-mouth disease virus.[62]
More recently, Eric H. Davidson and Roy John Britten argued for the use of urchins as a model organism due to their easy availability, high fecundity, and long lifespan. Beyond embryology, urchins provide an opportunity to research cis-regulatory elements.[63]
Oceanography has taken an interest in monitoring the health of urchins and their populations as a way to assess overall ocean acidification,[64] temperatures, and ecological impacts.
The organism’s evolutionary placement and unique embryology with five-fold symmetry were the major arguments in the proposal to seek the sequencing of its genome. Importantly, urchins act as the closest living relative to chordates and thus are of interest for the light they can shed on the evolution of vertebrates.[65] The genome of Strongylocentrotus purpuratus was completed in 2006 and established homology between sea urchin and vertebrate immune system-related genes. Sea urchins code for at least 222 Toll-like receptor genes and over 200 genes related to the Nod-like-receptor family found in vertebrates.[66] This increases its usefulness as a valuable model organism for studying the evolution of innate immunity. The sequencing also revealed that while some genes were thought to be limited to vertebrates, there were also innovations that have previously never been seen outside the chordate classification, such as immune transcription factors PU.1 and SPIB.[65]
As food[edit]
The gonads of both male and female sea urchins, usually called sea urchin roe or corals,[67] are culinary delicacies in many parts of the world, especially Japan.[68][69][70] In Japan, sea urchin is known as uni (うに), and its roe can retail for as much as ¥40,000 ($360) per kilogram;[71] it is served raw as sashimi or in sushi, with soy sauce and wasabi. Japan imports large quantities from the United States, South Korea, and other producers. Japan consumes 50,000 tons annually, amounting to over 80% of global production.[72] Japanese demand for sea urchins has raised concerns about overfishing.[73]
In Mediterranean cuisines, Paracentrotus lividus is often eaten raw, or with lemon,[74] and known as ricci on Italian menus where it is sometimes used in pasta sauces. It can also flavour omelettes, scrambled eggs, fish soup,[75] mayonnaise, béchamel sauce for tartlets,[76] the boullie for a soufflé,[77] or Hollandaise sauce to make a fish sauce.[78] In Chilean cuisine, it is served raw with lemon, onions, and olive oil. Though the edible Strongylocentrotus droebachiensis is found in the North Atlantic, it is not widely eaten. However, sea urchins (called uutuk in Alutiiq) are commonly eaten by the Alaska Native population around Kodiak Island. It is commonly exported, mostly to Japan.[79]
In the West Indies, slate pencil urchins are eaten.[68]
On the Pacific Coast of North America, Strongylocentrotus franciscanus was praised by Euell Gibbons; Strongylocentrotus purpuratus is also eaten.[68]
Native Americans in California are also known to eat sea urchins.[80] The coast of Southern California is known as a source of high quality uni, with divers picking sea urchin from kelp beds in depths as deep as 24 m/80 ft.[81] As of 2013, the state was limiting the practice to 300 sea urchin diver licenses.[81]
In New Zealand, Evechinus chloroticus, known as kina in Māori, is a delicacy, traditionally eaten raw. Though New Zealand fishermen would like to export them to Japan, their quality is too variable.[82]
-
Japanese uni-ikura don, sea urchin egg and salmon egg donburi
-
Open sea urchins in Sicily
Aquaria[edit]
A fossil sea urchin found on a Middle Saxon site in Lincolnshire, thought to have been used as an amulet[83]
Some species of sea urchins, such as the slate pencil urchin (Eucidaris tribuloides), are commonly sold in aquarium stores. Some species are effective at controlling filamentous algae, and they make good additions to an invertebrate tank.[84]
Folklore[edit]
A folk tradition in Denmark and southern England imagined sea urchin fossils to be thunderbolts, able to ward off harm by lightning or by witchcraft, as an apotropaic symbol.[85] Another version supposed they were petrified eggs of snakes, able to protect against heart and liver disease, poisons, and injury in battle, and accordingly they were carried as amulets. These were, according to the legend, created by magic from foam made by the snakes at midsummer.[86]
Explanatory notes[edit]
- ^ The tube feet are present in all parts of the animal except around the anus, so technically, the whole surface of the body should be considered to be the oral surface, with the aboral (non-mouth) surface limited to the immediate vicinity of the anus.[2]
References[edit]
- ^ «Animal Diversity Web – Echinoidea». University of Michigan Museum of Zoology. Retrieved 26 August 2012.
- ^ a b c d e f g h i j k l m n Ruppert, Edward E.; Fox, Richard, S.; Barnes, Robert D. (2004). Invertebrate Zoology, 7th edition. Cengage Learning. pp. 896–906. ISBN 978-81-315-0104-7.
- ^ Kroh, A.; Hansson, H. (2013). «Echinoidea (Leske, 1778)». WoRMS. World Register of Marine Species. Retrieved 2014-01-04.
- ^ a b c d e f g h i j k l m Barnes, Robert D. (1982). Invertebrate Zoology. Philadelphia, PA: Holt-Saunders International. pp. 961–981. ISBN 0-03-056747-5.
- ^ Guill, Michael. «Taxonomic Etymologies EEOB 111». Retrieved 13 March 2018.
- ^ Wright, Anne. 1851. The Observing Eye, Or, Letters to Children on the Three Lowest Divisions of Animal Life. London: Jarrold and Sons, p. 107.
- ^ Soyer, Alexis. 1853. The Pantropheon Or History of Food, And Its Preparation: From The Earliest Ages Of The World. Boston: Ticknor, Reed, and Fields,, p. 245.
- ^ «urchin (n.)». Online Etymology Dictionary. Retrieved 13 March 2018.
- ^ Stachan and Read, Human Molecular Genetics, p. 381: «What Makes Us Human»
- ^ «The Echinoid Directory — Natural History Museum». www.nhm.ac.uk. Natural History Museum, UK. Retrieved 28 December 2022.
- ^ «The Echinoid Directory — Natural History Museum». www.nhm.ac.uk. Natural History Museum, UK. Retrieved 28 December 2022.
- ^ «Sea urchins reveal promising carbon capture alternative». Gizmag. 4 February 2013. Retrieved 2013-02-05.
- ^ Kazuya Yoshimura, Tomoaki Iketani et Tatsuo Motokawa, «Do regular sea urchins show preference in which part of the body they orient forward in their walk ?», Marine Biology, vol. 159, no 5, 2012, p. 959–965.
- ^ Boudouresque, Charles F.; Verlaque, Marc (2006). «13: Ecology of Paracentrotus lividus«. In Lawrence, John, M. (ed.). Edible Sea Urchins: Biology and Ecology. Elsevier. p. 243. ISBN 978-0-08-046558-6.
- ^ «Apical disc and periproct». Natural History Museum, London. Retrieved 2 November 2019.
- ^ Claw inspired by sea urchins’ mouth can scoop up Martian soil
- ^ Voultsiadou, Eleni; Chintiroglou, Chariton (2008). «Aristotle’s lantern in echinoderms: an ancient riddle» (PDF). Cahiers de Biologie Marine. Station Biologique de Roscoff. 49 (3): 299–302.
- ^ Choi, Charles Q. (29 December 2010). «Rock-Chewing Sea Urchins Have Self-Sharpening Teeth». National Geographic News. Retrieved 2017-11-12.
- ^ Knight, K. (2009). «Sea Urchins Use Whole Body As Eye». Journal of Experimental Biology. 213 (2): i–ii. doi:10.1242/jeb.041715.
- Charles Q. Choi (December 28, 2009). «Body of Sea Urchin is One Big Eye». LiveScience (Press release).
- ^ Gaitán-Espitia, J. D.; Sánchez, R.; Bruning, P.; Cárdenas, L. (2016). «Functional insights into the testis transcriptome of the edible sea urchin Loxechinus albus». Scientific Reports. 6: 36516. Bibcode:2016NatSR…636516G. doi:10.1038/srep36516. PMC 5090362. PMID 27805042.
- ^ A. Gaion, A. Scuderi; D. Pellegrini; D. Sartori (2013). «Arsenic Exposure Affects Embryo Development of Sea Urchin, Paracentrotus lividus (Lamarck, 1816)». Bulletin of Environmental Contamination and Toxicology. 39 (2): 124–8. doi:10.3109/01480545.2015.1041602. PMID 25945412. S2CID 207437380.
- ^ Kominami, Tetsuya; Takata, Hiromi (2004). «Gastrulation in the sea urchin embryo: a model system for analyzing the morphogenesis of a monolayered epithelium». Development, Growth & Differentiation. 46 (4): 309–26. doi:10.1111/j.1440-169x.2004.00755.x. PMID 15367199. S2CID 23988213.
- ^ Shook, D; Keller, R (2003). «Mechanisms, mechanics and function of epithelial-mesenchymal transitions in early development». Mechanisms of Development. 120 (11): 1351–83. doi:10.1016/j.mod.2003.06.005. PMID 14623443. S2CID 15509972.; Katow, Hideki; Solursh, Michael (1980). «Ultrastructure of primary mesenchyme cell ingression in the sea urchinLytechinus pictus». Journal of Experimental Zoology. 213 (2): 231–246. doi:10.1002/jez.1402130211.; Balinsky, BI (1959). «An electro microscopic investigation of the mechanisms of adhesion of the cells in a sea urchin blastula and gastrula». Experimental Cell Research. 16 (2): 429–33. doi:10.1016/0014-4827(59)90275-7. PMID 13653007.; Hertzler, PL; McClay, DR (1999). «alphaSU2, an epithelial integrin that binds laminin in the sea urchin embryo». Developmental Biology. 207 (1): 1–13. doi:10.1006/dbio.1998.9165. PMID 10049560.; Fink, RD; McClay, DR (1985). «Three cell recognition changes accompany the ingression of sea urchin primary mesenchyme cells». Developmental Biology. 107 (1): 66–74. doi:10.1016/0012-1606(85)90376-8. PMID 2578117.; Burdsal, CA; Alliegro, MC; McClay, DR (1991). «Tissue-specific, temporal changes in cell adhesion to echinonectin in the sea urchin embryo». Developmental Biology. 144 (2): 327–34. doi:10.1016/0012-1606(91)90425-3. PMID 1707016.; Miller, JR; McClay, DR (1997). «Characterization of the Role of Cadherin in Regulating Cell Adhesion during Sea Urchin Development». Developmental Biology. 192 (2): 323–39. doi:10.1006/dbio.1997.8740. PMID 9441671.; Miller, JR; McClay, DR (1997). «Changes in the pattern of adherens junction-associated beta-catenin accompany morphogenesis in the sea urchin embryo». Developmental Biology. 192 (2): 310–22. doi:10.1006/dbio.1997.8739. PMID 9441670.; Anstrom, JA (1989). «Sea urchin primary mesenchyme cells: ingression occurs independent of microtubules». Developmental Biology. 131 (1): 269–75. doi:10.1016/S0012-1606(89)80058-2. PMID 2562830.; Anstrom, JA (1992). «Microfilaments, cell shape changes, and the formation of primary mesenchyme in sea urchin embryos». The Journal of Experimental Zoology. 264 (3): 312–22. doi:10.1002/jez.1402640310. PMID 1358997.
- ^ Nissen, Silas Boye; Rønhild, Steven; Trusina, Ala; Sneppen, Kim (November 27, 2018). «Theoretical tool bridging cell polarities with development of robust morphologies». eLife. 7: e38407. doi:10.7554/eLife.38407. PMC 6286147. PMID 30477635.
- ^ Warner, Jacob F.; Lyons, Deirdre C.; McClay, David R. (2012). «Left-Right Asymmetry in the Sea Urchin Embryo: BMP and the Asymmetrical Origins of the Adult». PLOS Biology. 10 (10): e1001404. doi:10.1371/journal.pbio.1001404. PMC 3467244. PMID 23055829.
- ^ Worley, Alisa (2001). «Strongylocentrotus purpuratus«. Animal Diversity Web. Retrieved 2016-12-05.
- ^ Baumiller, Tomasz K. (2008). «Crinoid Ecological Morphology». Annual Review of Earth and Planetary Sciences. 36: 221–49. Bibcode:2008AREPS..36..221B. doi:10.1146/annurev.earth.36.031207.124116.
- ^ Lawrence, John M. (2006). Edible Sea Urchins: Biology and Ecology. Elsevier. pp. 167–168. ISBN 978-0-08-046558-6.
- ^ Jangoux, Michel (1987). «Diseases of Echinodermata. I. Agents microorganisms and protistans». Diseases of Aquatic Organisms. 2: 147–162. doi:10.3354/dao002147.
- ^ «Defence – spines». Echinoid Directory. Natural History Museum.
- ^ Sakashita, Hiroko (1992). «Sexual dimorphism and food habits of the clingfish, Diademichthys lineatus, and its dependence on host sea urchin». Environmental Biology of Fishes. 34 (1): 95–101. doi:10.1007/BF00004787. S2CID 32656986.
- ^ Terborgh, John; Estes, James A (2013). Trophic Cascades: Predators, Prey, and the Changing Dynamics of Nature. Island Press. p. 38. ISBN 978-1-59726-819-6.
- ^ «Aquatic Species at Risk – Species Profile – Sea Otter». Fisheries and Oceans Canada. Archived from the original on 2008-01-23. Retrieved 2007-11-29.
- ^ Thiel, Martin; Watling, Les (2015). Lifestyles and Feeding Biology. Oxford University Press. pp. 200–202. ISBN 978-0-19-979702-8.
- ^ «Defence – pedicellariae». Echinoid Directory. Natural History Museum.
- ^ Hiroko Sakashita, » Sexual dimorphism and food habits of the clingfish, Diademichthys lineatus, and its dependence on host sea urchin «, Environmental Biology of Fishes, vol. 34, no 1, 1994, p. 95–101
- ^ Jangoux, M. (1984). «Diseases of echinoderms» (PDF). Helgoländer Meeresuntersuchungen. 37 (1–4): 207–216. Bibcode:1984HM…..37..207J. doi:10.1007/BF01989305. S2CID 21863649. Retrieved 23 March 2018.
- ^ a b c Kroh, Andreas (2010). «The phylogeny and classification of post-Palaeozoic echinoids». Journal of Systematic Palaeontology. 8 (2): 147–212. doi:10.1080/14772011003603556..
- ^ Mah, Christopher (April 12, 2011). «Sizes and Species in the Strangest of the Strange : Deep-Sea Pourtalesiid Urchins». The Echinoblog..
- ^ a b Mah, Christopher (8 April 2014). «What are the Deepest known echinoderms?». The Echinoblog. Retrieved 22 March 2018..
- ^ Mattison, J.E.; Trent, J.D.; Shanks, AL; Akin, T.B.; Pearse, J.S. (1977). «Movement and feeding activity of red sea urchins (Strongylocentrotus franciscanus) adjacent to a kelp forest». Marine Biology. 39 (1): 25–30. doi:10.1007/BF00395589. S2CID 84338735.
- ^ a b c Konar, Brenda (2000). «Habitat influences on sea urchin populations». In: Hallock and French (Eds). Diving for Science…2000. Proceedings of the 20th Annual Scientific Diving Symposium. American Academy of Underwater Sciences. Archived from the original on April 15, 2013. Retrieved 7 January 2011.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ ChrisM (2008-04-21). «The Echinoblog». echinoblog.blogspot.com.
- ^ Antarctic Sea Urchin Shows Amazing Energy-Efficiency in Nature’s Deep Freeze 15 March 2001 University of Delaware. Retrieved 22 March 2018
- ^ Botting, Joseph P.; Muir, Lucy A. (March 2012). «Fauna and ecology of the holothurian bed, Llandrindod, Wales, UK (Darriwilian, Middle Ordovician), and the oldest articulated holothurian» (PDF). Palaeontologia Electronica. 15 (1): 1–28. doi:10.26879/272. S2CID 55716313. Retrieved 29 October 2022.
- ^ Thompson, Jeffrey R.; Cotton, Laura J.; Candela, Yves; Kutscher, Manfred; Reich, Mike; Bottjer, David J. (14 April 2022). «The Ordovician diversification of sea urchins: systematics of the Bothriocidaroida (Echinodermata: Echinoidea)». Journal of Systematic Palaeontology. 19 (20): 1395–1448. doi:10.1080/14772019.2022.2042408. S2CID 248192052. Retrieved 29 October 2022.
- ^ «Echinoids». British Geological Survey. 2017. Retrieved 14 March 2018.
- ^ «The Echinoid Directory | Introduction». Natural History Museum. Retrieved 16 March 2018.
- ^ «The Echinoid Directory | Spines». Natural History Museum. Retrieved 16 March 2018.
- ^ a b c d Kirkaldy, J. F. (1967). Fossils in Colour. London: Blandford Press. pp. 161–163.
- ^ Schultz, Heinke A.G. (2015). Echinoidea: with pentameral symmetry. Walter de Gruyter. pp. 36 ff, section 2.4. ISBN 978-3-11-038601-1.
- ^ Wells, H. G.; Huxley, Julian; Wells, G. P. (1931). The Science of life. pp. 346–348.
- ^ Telford, M. J.; Lowe, C. J.; Cameron, C. B.; Ortega-Martinez, O.; Aronowicz, J.; Oliveri, P.; Copley, R. R. (2014). «Phylogenomic analysis of echinoderm class relationships supports Asterozoa». Proceedings of the Royal Society B: Biological Sciences. 281 (1786): 20140479. doi:10.1098/rspb.2014.0479. PMC 4046411. PMID 24850925.
- ^ Planet, Paul J.; Ziegler, Alexander; Schröder, Leif; Ogurreck, Malte; Faber, Cornelius; Stach, Thomas (2012). «Evolution of a Novel Muscle Design in Sea Urchins (Echinodermata: Echinoidea)». PLOS ONE. 7 (5): e37520. Bibcode:2012PLoSO…737520Z. doi:10.1371/journal.pone.0037520. PMC 3356314. PMID 22624043.
- ^ Kroh, Andreas; Smith, Andrew B. (2010). «The phylogeny and classification of post-Palaeozoic echinoids». Journal of Systematic Palaeontology. 8 (2): 147–212. doi:10.1080/14772011003603556.
- ^ Koch, Nicolás Mongiardino; Thompson, Jeffrey R; Hiley, Avery S; McCowin, Marina F; Armstrong, A Frances; Coppard, Simon E; Aguilera, Felipe; Bronstein, Omri; Kroh, Andreas; Mooi, Rich; Rouse, Greg W (Mar 22, 2022). «Phylogenomic analyses of echinoid diversification prompt a re-evaluation of their fossil record». eLife. 11: e72460. doi:10.7554/eLife.72460. PMC 8940180. PMID 35315317.
- ^ James, William D.; Berger, Timothy G.; et al. (2006). Andrews’ Diseases of the Skin: clinical Dermatology. Saunders Elsevier. p. 431. ISBN 0-7216-2921-0.
- ^ Gallagher, Scott A. «Echinoderm Envenomation». eMedicine. Retrieved 12 October 2010.
- ^ Matthew D. Gargus; David K. Morohashi (2012). «A sea-urchin spine chilling remedy». New England Journal of Medicine. 30 (19): 1867–1868. doi:10.1056/NEJMc1209382. PMID 23134402.
- ^ «Insight from the Sea Urchin». Microscope Imaging Station. Exploratorium. Archived from the original on 2017-03-12. Retrieved 2018-03-07.
- ^ Bodnar, Andrea G.; Coffman, James A. (2016-08-01). «Maintenance of somatic tissue regeneration with age in short- and long-lived species of sea urchins». Aging Cell. 15 (4): 778–787. doi:10.1111/acel.12487. ISSN 1474-9726. PMC 4933669. PMID 27095483.
- ^ Roulston, C.; Luke, G.A.; de Felipe, P.; Ruan, L.; Cope, J.; Nicholson, J.; Sukhodub, A.; Tilsner, J.; Ryan, M.D. (2016). «‘2A‐Like’ Signal Sequences Mediating Translational Recoding: A Novel Form of Dual Protein Targeting» (PDF). Traffic. 17 (8): 923–39. doi:10.1111/tra.12411. PMC 4981915. PMID 27161495.
- ^ «Sea Urchin Genome Project». sugp.caltech.edu. Archived from the original on 2016-12-20. Retrieved 2016-12-05.
- ^ «Stanford seeks sea urchin’s secret to surviving ocean acidification | Stanford News Release». news.stanford.edu. 2013-04-08. Retrieved 2016-12-05.
- ^ a b Sodergren, E; Weinstock, GM; Davidson, EH; et al. (2006-11-10). «The Genome of the Sea Urchin Strongylocentrotus purpuratus». Science. 314 (5801): 941–952. Bibcode:2006Sci…314..941S. doi:10.1126/science.1133609. PMC 3159423. PMID 17095691.
- ^ Rast, JP; Smith, LC; Loza-Coll, M; Hibino, T; Litman, GW (2006). «Genomic Insights into the Immune System of the Sea Urchin». Science. 314 (5801): 952–6. Bibcode:2006Sci…314..952R. doi:10.1126/science.1134301. PMC 3707132. PMID 17095692.
- ^ Laura Rogers-Bennett, «The Ecology of Strongylocentrotus franciscanus and Strongylocentrotus purpuratus» in John M. Lawrence, Edible sea urchins: biology and ecology, p. 410
- ^ a b c Davidson, Alan (2014) Oxford Companion to Food. Oxford University Press, 3rd edition. pp. 730–731.
- ^ John M. Lawrence, «Sea Urchin Roe Cuisine» in John M. Lawrence, Edible sea urchins: biology and ecology
- ^ «The Rise of the Sea Urchin», Franz Lidz July 2014, Smithsonian
- ^ Macey, Richard (November 9, 2004). «The little urchins that can command a princely price». The Sydney Morning Herald.
- ^ Zatylny, Jane (6 September 2018). «Searchin’ for Urchin: A Culinary Quest». Hakai Magazine. Retrieved 10 September 2018.
- ^ «Sea Urchin Fishery and Overfishing», TED Case Studies 296, American University full text
- ^ for Puglia, Italy: Touring Club Italiano, Guida all’Italia gastronomica, 1984, p. 314; for Alexandria, Egypt: Claudia Roden, A Book of Middle Eastern Food, p. 183
- ^ Alan Davidson, Mediterranean Seafood, p. 270
- ^ Larousse Gastronomique[page needed]
- ^ Curnonsky, Cuisine et vins de France, nouvelle édition, 1974, p. 248
- ^ Davidson, Alan (2014) Oxford Companion to Food. Oxford University Press, 3rd edition. p. 280
- ^ Kleiman, Dena (October 3, 1990). «Scorned at Home, Maine Sea Urchin Is a Star in Japan». The New York Times. p. C1.
- ^ Martin, R.E.; Carter, E.P.; Flick, G.J.; Davis, L.M. (2000). Marine and Freshwater Products Handbook. Taylor & Francis. p. 268. ISBN 978-1-56676-889-4. Retrieved 2014-12-03.
- ^ a b Lam, Francis (2014-03-14). «California Sea Urchin Divers, Interviewed by Francis Lam». Bon Appetit. Retrieved 2017-03-26.
- ^ Wassilieff, Maggy (March 2, 2009). «sea urchins». Te Ara: The Encyclopedia of New Zealand.
- ^ «Amulet | LIN-B37563». Portable Antiquities Scheme. Retrieved 14 March 2018.
- ^ Tullock, John H. (2008). Your First Marine Aquarium: Everything about Setting Up a Marine Aquarium, Including Conditioning, Maintenance, Selecting Fish and Invertebrates, and More. Barron’s Educational Series. p. 63. ISBN 978-0-7641-3675-7.
- ^ McNamara, Ken (2012). «Prehistoric fossil collectors». The Geological Society. Retrieved 14 March 2018.
- ^ Marren, Peter; Mabey, Richard (2010). Bugs Britannica. Chatto & Windus. pp. 469–470. ISBN 978-0-7011-8180-2.
External links[edit]
Wikimedia Commons has media related to Echinoidea.
- World Register of Marine Species link: Echinoidea Leske, 1778 (+species list)
- The sea urchin genome project
- Sea Urchin Harvesters Association – California Also, (604) 524-0322.
- The Echinoid Directory from the Natural History Museum.
- Virtual Urchin at Stanford
- California Sea Urchin commission
- Introduction to the Echinoidea at UCMP Berkeley

Описание и среда обитания
Морские ежи имеют округлое тело, достигающее в размерах до 30 см. Сверху оно покрыто известковым панцирем или скорлупой, которая позволяет изменять форму тела [2]. По своему строению морские ежи делятся на правильных и неправильных. Правильные имеют почти идеально круглое тело и пятилучевую симметрию, а неправильные – более плоское тело с различимыми передними и задними концами [3].
Содержание:
- Описание и среда обитания
- Питание и образ жизни
- Состав и полезные свойства
- Применение в медицине
- Применение в кулинарии
- Как выбрать и хранить
- Использование в косметологии
- Вред и опасные свойства морских ежей
- Выводы
С панцирем морского ежа подвижно соединены разнообразной длины иглы, что и делает его похожим на сухопутного родственника или дикобраза. Иглы в основном служат для защиты, передвижения и питания [4]. Также на поверхности панциря ежей находятся педицеллярии и специальные органы необходимые для равновесия – сферидии.
Некоторые виды иглокожих снабжены ядовитыми железами, и встреча с такими представителями может закончиться плачевно. Обитают они в основном в тропических и субтропических районах Тихого, Индийского и Атлантического океанов.
Рот морского ежа находится в верхней части туловища. Он имеет специальный жевательный аппарат, позволяющий соскребать водоросли с камней, а также служащий опорой для передвижения животного. Такое строение характерно для правильных морских ежей, а неправильные, питающиеся детритом, такого аппарата не имеют.
Кишечник представляет собой спиральную трубку, проходящую внутри тела. Для дыхания еж использует наружные жабры, амбулакральную систему и придаточную кишку. Органы осязания и обоняния развиты слабо. Помимо сферидий и амбулакральных ножек, у ежа на верхней стороне туловища имеются маленькие глазки.
Морские ежи широко распространены в довольно соленых морях и океанах. Обитают они на глубине до 7 км. Часто можно встретить их на коралловых рифах и отмелях, а также в прибрежной зоне. Они селятся в скалах и глубоких расщелинах, вырывая себе норы даже в твердом граните. Неправильные ежи предпочитают мягкий песчаный грунт, в который они также с успехом зарываются. Не встретишь морских ежей в слабосоленых водах Черного, Каспийского и Балтийского морей.
Питание и образ жизни

Прячась в иглах морских ежей, некоторые морские микроорганизмы тем самым создают себе уютную защиту от хищников. Является еж и легкой добычей для паразитирующих моллюсков, которые просверливают его скорлупу и питаются нежными тканями.
Страшным врагом морского ежа считается калан – хищная морская выдра. Он настолько увлекается поеданием этих животных, что даже их кости окрашиваются в фиолетовый цвет пигментами ежей. Калан либо разбивает ежей камнями, либо сначала долго вертит в лапах, обернув водорослями, чтобы примять иголки, а потом впивается в него зубами. Также небезопасны для ежей омары, морские звезды, рыбы, птицы и морские котики.
Ежи раздельнополые животные, которые размножаются икрой, откладывая ее на мелководье или прибрежных скалах.
Средняя продолжительность жизни морских ежей составляет примерно 15 лет. Существуют легенды, повествующие о бессмертии ежей, согласно которым у взрослых особей не возникало никаких изменений и признаков старения.
Состав и полезные свойства
Морской еж ценится своим богатым витаминным и минеральным составом. Он питается полезными морскими водорослями, тем самым накапливая в себе все ценные вещества и микроэлементы, которые присутствуют в его икре.
В икре морского ежа содержатся такие полезные минералы, как:
- калий;
- кальций;
- магний;
- цинк;
- железо;
- фосфор;
- йод.

Калорийность продукта составляет порядка 86 ккал на 100 грамм. Содержание белков составляет примерно 13,8 грамм, на долю жиров приходится 4,3 грамма, а углеводов – 2,5 грамм [6].
Регулярное употребление икры морских ежей принесет неоценимую пользу для организма человека. Входящий в ее состав лецитин оказывает положительное влияние на работу печени, головного мозга, помогает избавиться от вредных и опасных токсинов, шлаков, снижает уровень холестерина [7]. Содержащиеся в ней омега жирные кислоты зарядят энергией и бодростью, помогут справиться с депрессией, вернут жизнерадостность и оптимизм. Большое содержание йода способствует стабильной работе эндокринной системы и является профилактикой заболеваний щитовидной железы. Икра морских ежей обладает свойством выводить из организма токсины, радионуклиды и вредные вещества, способствует восстановлению организма после химиотерапии и лучевой болезни. Этот продукт довольно часто входил в рацион японцев после бомбардировок Хиросимы и Нагасаки.
Применение в медицине
Лечебные свойства икры морских ежей были замечены и оценены довольно давно. Этот продукт содержит в себе столько полезных веществ, витаминов и минералов, что часто используется для лечения и профилактики различных заболеваний [8]. Исследования ученых в области онкологических заболеваний показали, что некоторые вещества, содержащиеся в икре морских ежей, способны поражать раковые клетки, при этом здоровые клетки проходят своеобразную очистку [9], [10].
Регулярное употребление икры этих животных способствует:
- нормализации кровяного давления;
- повышению потенции;
- выведению вредных веществ, радионуклидов и токсинов из организма;
- повышению иммунитета и улучшению защитной функции организма;
- улучшению работы щитовидной железы и половой функции;
- нормализации работы сердечно-сосудистой системы;
- восстановлению организма после лучевой и химиотерапии;
- профилактике гастритов, язв, болезней желудочно-кишечного тракта [11], [12].

Ученые-диетологи Приморского края создали крепкую настойку на спирту на основе икры морского ежа. Этот продукт широко применяется в медицине в качестве гомеопатического общеукрепляющего средства. Лекарство способствует повышению сексуального влечения, улучшает иммунитет и повышает защитные свойства организма. Настойка может помочь избежать алкогольной интоксикации. Для этого нужно принимать ее до и после распития спиртных напитков.
Рецепт настойки из икры морских ежей
Рецепт приготовления этой настойки предельно прост. Следует отсортировать икру, хорошо промыть ее теплой морской водой и залить подогретым спиртовым раствором крепостью до 70% в соотношении 1:25. Полученный продукт оставляют настаиваться в темном месте в течение 4 дней при комнатной температуре. Затем раствор фильтруют и отстаивают. В такой настойке все полезные свойства икры сохраняются, и целебный напиток приобретает их в полном объеме.
Применение в кулинарии
Икру морских ежей используют для приготовления суши, салатов и других холодных блюд. Часто в пищу ее употребляют в свежем виде. Если икра горькая, в нее можно добавить несколько капель лимонного сока или соевого соуса. В европейской кухне икра проходит тепловую обработку: ее жарят и запекают. Из нее можно приготовить:
- итальянскую пасту или спагетти;
- паштеты;
- различные соусы;
- специи.
В Италии морских ежей подают и к десертным блюдам. Большим спросом пользуется мороженое граните, которое готовят из фруктового сока смешанного с алкоголем. Часто для этого используют шампанское, которое хорошо сочетается с икрой этих морских обитателей.
Как выбрать и хранить
- Коронавирусы: SARS-CoV-2 (COVID-19)
- Антибиотики для профилактики и лечения COVID-19: на сколько эффективны
- Самые распространенные «офисные» болезни
- Убивает ли водка коронавирус
- Как остаться живым на наших дорогах?
При выборе деликатеса нужно обращать внимание на цвет, запах и внешний вид продукта. Иголки у свежего ежа должны торчать в разные стороны, а не прилегать к телу. Цвет икры должен быть оранжевым и не иметь неприятного запаха.
Хранить икру лучше всего в консервированном виде. Свежий продукт лучше не подвергать хранению, а съедать сразу. В холодильнике или при замораживании продукт теряет свои полезные свойства, приобретает горький привкус, теряет упругость и качество.
Использование в косметологии
Именно с употреблением в пищу икры морских ежей связывают большую продолжительность жизни японцев. В Японии есть национальный праздник, который проводится один раз в год. В этот день обязательно нужно купить морского ежа и, вскрыв его панцирь, выпить содержащуюся в нем жидкость и съесть кусочек икры. Такой ритуал позволяет полностью омолодить и освежить организм.
Икра морского ежа считается эликсиром молодости и красоты. Сходные с ним по действию свойства имеют также кунжут, шафран, нони, трепанг, перга и ярсагумба.
Иммунная система этих морских представителей способствует их долголетию и бессмертию [13]. Они могут прожить до 35 лет (иногда 200 лет) не старея и не теряя способности к продолжению рода [14]. Недавно американские ученые установили, что их ДНК на 70% совпадает с ДНК человека, поэтому употребление этого продукта дарит возможность омолаживать организм, повышать физические и умственные способности.
Вред и опасные свойства морских ежей
Тонкие и острые иглы ежей таят в себе опасность для человека. Наступив на них можно серьезно травмироваться, так как иглы обычно ломаются, оставляя в стопе мелкие элементы. Некоторые из ежей бывают сильно ядовитыми. Попав в организм человека, яд негативно воздействует на нервную систему, вызывает паралич, замедляет работу сердца и затрудняет дыхание.

Даже без яда, попадание иглы под кожу чревато неприятными последствиями, так как бактерии, находящиеся на концах игл, вызывают нагноение раны.
Выводы
Морской еж считается изысканным деликатесом в Японии и некоторых восточных странах. Полезные и лечебные свойства обусловлены тем, что в его ежедневный рацион входят водоросли, благодаря чему его икра имеет исключительный состав минералов, витаминов и других веществ необходимых для организма человека. На ее основе готовят медицинские препараты, используют как источник молодости и красоты в косметологии, готовят утонченные блюда, но больше всего любят употреблять в сыром виде. В Японии считают, что именно такое применение этого продукта способно продлевать жизнь, и улучшать самочувствие. Последние исследования ученых доказали исключительную пользу морских ежей в борьбе с раковыми клетками. Ежедневное употребление икры способно восстановить организм после лучевой терапии и химиотерапии и вывести опасные токсины, шлаки и радионуклиды. Противопоказаний против употребления морских ежей в пищу нет, кроме индивидуальной непереносимости или аллергических реакций на рыбу и морепродукты.
- Источники
- ↑ California Sea Urchin Commission. – About sea urchin.
- ↑ FoodPrint public project. – Real Food Encyclopedia. Sea Urchin.
- ↑ Интернет-ресурс Sciencedirect. – Sea urchin.
- ↑ Arizona State University website. – Ask a biologist: sea urchin research.
- ↑ Интернет-ресурс Sciencedirect. – Gonadal traits and nutrient compositions of novel sea urchin hybrids of Hemicentrotus pulcherrimus and Strongylocentrotus intermedius.
- ↑ SeaFoodSource. – Sea urchin.
- ↑ U.S. National Library of Medicine. – Nutritive value of protein from sea urchin, and its effects on intestinal leucine aminopeptidase and intestinal and hepatic gamma-glutamyltranspeptidase.
- ↑ Science, research, and technology news service Science X. – Sea urchins could contain the genetic key to curing some diseases.
- ↑ U.S. National Library of Medicine. – Inspired by Sea Urchins: Warburg Effect Mediated Selectivity of Novel Synthetic Non-Glycoside 1,4-Naphthoquinone-6S-Glucose Conjugates in Prostate Cancer.
- ↑ Royal Society of Chemistry. – Base excision DNA repair in the embryonic development of the sea urchin.
- ↑ Cоциальная сеть для ученых ResearchGate. – Traditional Chinese medicine – Sea urchin.
- ↑ Institute for the promotion and preservation of the diversity of chemical compounds, Molecular Diversity Preservation International (MDPI). – Polysaccharide constituents of three types of sea urchin shells and their anti-inflammatory activities.
- ↑ SpringerLink website. – Dead urchin walking: resilience of an arctic Strongylocentrotus to severe skeletal damage.
- ↑ Wiley online library. – Maintenance of somatic tissue regeneration with age in short- and long-lived species of sea urchins.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Бут Ирина Алексеевна
Специальность: переводчик, преподаватель английского, немецкого языков и зарубежной литературы.
Общий стаж: 18 лет.
Образование: Горловский государственный педагогический институт иностранных языков.
1. Животные морские ежи относятся к иглокожим моллюскам.
2.Эти удивительные создания уже давно находятся под пристальным вниманием зоологов, так как морские ежи очень интересны с биологической точки зрения.
3.Эти подводные животные привлекают своим необычным внешним видом и особенностями физиологии.
4. Всего в природе насчитывается около 940 видов морских ежей, и в наше время продолжают зоологи открывать всё новые их виды.
5. Морские ежи одни из самых долгоживущих животных на Земле. Они древнее динозавров. Первые их виды появились на нашей планете ещё около 450 миллионов лет назад.
6.В российских морях и прибрежных океанских водах обитает около 20 видов морских ежей.
7. Эти животные обитают только в очень солёных водах, поэтому там, где крупные реки частично опресняют моря и океаны, в которые впадают, морские ежи не встречаются.
8.Размер самых крупных морских ежей достигает 30 сантиметров в диаметре, а у самых маленьких он не превышает и 2 сантиметров.
9.Условия, в которых некоторые из видов морских ежей обитают, кажутся по-настоящему экстремальными. Эти животные способны легко выдерживать чудовищное давление водной толщи. Исследовательские зонды обнаруживали их на глубинах до 7 километров.
10. Также водятся они не только в тёплых водах. Некоторые морские ежи живут даже в антарктическом климате.
11. Морские ежи могут просверливать себе норы даже в крепких гранитных скалах.
МОРСКОЙ ЁЖ-ДИАДЕМА
12. Рекордсменом по длине игл среди всех морских ежей являются ежи-диадемы (длина их иголок до 70 см при диаметре панциря в 10 раз меньше), а у плоских ежей их длина не превышает 2 миллиметров.
13. Также диадемовые морские ежи светятся в темноте.
14. Большинство морских ежей откладывает яйца, но некоторые рождают живое потомство, как млекопитающие.
15. Морские ежи не просто так получили свое название. Все их тело покрыто подвижными острыми иглами, хотя встречается небольшое количество видов, лишенных этой особенности. В основном иглы служат для защиты от хищников. Их длинные иглы – грозное и эффективное оружие. Но иглы служат им не только для защиты, но и для и передвижения, а также для добычи еды.
16. На теле морских ежей находится свыше 1000 крошечных ножек с присосками на них. Тонкие ножки проходят сквозь панцирь. На их ступнях находятся присоски, с помощью которых эти животные передвигаются.
17.Кроме того, у них ножки приспособлены для рытья нор. Ножки у морских ежей также расположены на спине, они служат для осязания окружающей среды. А некоторые виды приспособили свои необычные конечности для добычи пропитания и очищения своего панциря от загрязнений.
18. Морские ежи не имеют костей. Их тело покрыто прочными кальциевыми пластинами, которые покрывают тело, подобно апельсиновой кожуре. Эти пластины симметричны друг другу, они достаточно прочные и защищают внутренние органы от механических повреждений.
19. По годичным кольцам на панцире этих животных можно определить их возраст так же, как по годичным кольцам деревьев.
20.У морских ежей есть сразу пять челюстей, в каждой из которых расположен один зуб. Эти зубы могут двигаться независимо друг от друга. Их зубы растут всю жизнь. Благодаря трению друг об друга они стачиваются и всегда остаются достаточно острыми. Рот этих животных чем-то напоминает клюв.
21. Глазки у морских ежей располагаются в верхней части тела, а рот — в нижней.
22. Половая зрелость у морских ежей наступает лишь спустя 2-3 года после рождения.
23. А у некоторых их видов — и вовсе через 5 лет. Поэтому они так медленно размножаются.
24. Морские ежи размножаются с помощью внешнего оплодотворения – они выделяют сперму и икру прямо в воду.
25.Вначале животное проходит через личиночную стадию. До своего окончательного превращения, оно передвигается по дну вместе с другим планктоном.
26. В еде морские ежи совершенно неразборчивы. Питаются они в основном водорослями, но также не прочь употребить в пищу мелких беспозвоночных, остатки погибший рыбы и прочую мелкую живность.
27. Для большого выводка нужно очень много пищи. Ежи буквально объедают все коралловые рифы. Некоторые из них даже поедают друг друга.
28. Они продолжают расти на протяжении всей жизни.
29.Большинство видов морских ежей ведёт ночной образ жизни.
30. Один из видов морских ежей не умеет переворачиваться обратно, если их опрокинуть. В таком случае эти животные погибают.
31.Удивительные морские ежи всегда являются пристальным объектом внимания у любителей поплавать с маской или аквалангом.
32. Эти странные создания выглядят очень необычно, и многим людям хочется их потрогать, но делать это категорически не следует.
33.Уколоться о колючки морского ежа можно запросто, а подобные уколы являются очень болезненными.
34. Если на морского ежа наступить, его иглы, похожие на хрупкое стекло, ломаются на множество осколков, впиваясь в тело. Их извлечение — очень сложная и болезненная операция, которая под силу только опытным врачам.
35.А некоторые виды морских ежей ядовиты, а потому очень опасны.
36.Яд содержится в слизи на их колючках.
37.Во время отлива морские ежи не рискуют оставаться на берегу, где могут стать лёгкой добычей. Обычно они или прячутся в норах, или зарываются в песок.
МОРСКОЙ ОГУРЕЦ
38. Близкими родственниками морских ежей, по утверждению учёных, являются морские огурцы.
39. Некоторые мелкие рыбки научились вести взаимовыгодное сосуществование с морскими ежами.
40.Они прячутся между его иголок в случае опасности, а в ответ поедают облепивших его паразитов, от которых ёж избавиться самостоятельно не может.
41. В среднем морские ежи живут около 30 лет. Но некоторые виды морских ежей являются настоящими долгожителями. В дикой природе они доживают до 200 лет.
42.Несмотря на собственную колючесть, они часто становятся жертвами хищников. Большое количество различных животных охотится на этих иглокожих. Ими охотно питаются морские котики, птицы, рыбы, омары и морские звёзды.
43.Один из самых грозных врагов морских ежей – калан. Он разбивает иголки своей добычи камнем, а потом поедает её внутренности. Каланы ежедневно поедают так много морских ежей, что все их внутренности окрашиваются в фиолетовый цвет из-за пигмента, содержащегося в этих иглокожих.
44.Немалую опасность для разнообразия видов данного класса несут и люди. Морские ежи во многих странах являются частью национальной кухни. В пищу в основном употребляется их икра.
45.Многие охотно собирают морских ежей, особенно на мелководье, так как морские ежи в некоторых странах являются деликатесной едой. Но большинство туристов, которым доводилось их пробовать, не разделяют этого мнения.
46.Существует целый промысел по их разведению и отлову. Из-за хозяйственной деятельности человека и активного вылова многие виды находятся под угрозой исчезновения.
47. Хотя морские ежи распространены по всему миру. Они встречаются во всех океанах и практически во всех морях, включая самые холодные.
48. Есть только три моря, в которых не обитает ни один вид морских ежей — Каспийское, Чёрное, и, конечно, Мёртвое море.
49. Эти животные очень полезные создания. Они поглощают углекислоту, как растения. А ещё морские ежи снижают уровень радиации в Мировом океане.
50.Морские ежи являются важнейшей частью экосистемы океана.
фото из открытого доступа
Морские ежи относятся к классу иглокожих и их насчитывается до 940 видов. Они бывают очень разные по размеру, цвету и внешнему виду. Их размер варьируется от 2 до 30 см. Тело морских ежей покрыто известковыми пластинками, которые плотно соединены между собой и образуют панцирь, т.е. скорлупу, благодаря чему морской еж не может менять свою форму. Вообще, морские ежи бывают самых разных форм, и в зависимости от этого различают ежей с правильной и неправильной формы. Морские ежи правильной формы всегда круглые и симметричные, а у морских ежей неправильной формы четко видно переднюю и заднюю часть тела.
Для чего морским ежам нужны такие длинные и острые иглы? Для передвижения, питания и защиты. Встречаются некоторые виды морских ежей, у которых эти иголки ядовиты, но в целом большинство морских ежей не представляют опасности.
Если хорошо разглядеть морского ежа, то можно увидеть на его теле рот и сферидии, т.е. органы равновесия. Также у них есть органы дыхания и осязания. Рот расположен в нижней части тела, в центре, анальное отверстие и половое отверстие – в центре верхней стороны. У ежей правильной формы есть жевательный аппарат. Еще морских ежей имеют острые зубы, которые не только участвуют в переработке еды, но и для передвижения и рытья нор. У ежей неправильной формы нет жевательного аппарата, они питаются детритом (это вещество, состоящее из останков беспозвоночных животных, выделений и костей позвоночных животных и т.д.).
Морские ежи любят жить в морях и океанах с нормальным средним содержанием соли, на глубине до 7 км. Больше всего они распространены на коралловых рифах, недалеко от берегов. Они любят селиться в трещинах скал, возле камней и рифов. Морские ежи правильной формы выбирают для жизни скалистые поверхности, а ежи неправильной формы – мягкую песчаную поверхность. Морские ежи и ползают по поверхности и зарываются, а передвигаются они при помощи ножек. Некоторые морские организмы прячутся среди иголок морских ежей, тем самым защищаясь от других морских существ.
Кто же питается морскими ежами? Их едят рыбы, морские звезды, омары, морские котики, каланы и даже птицы.
В среднем морские ежи живут 10-15 лет, но иногда их возраст достигает 35 лет. Размножаться они начинают на 3-ем году жизни.
Жители побережий Средиземного моря, Северной и Южной Америки, Новой Зеландии и Японии употребляют в пищу морских ежей. Я сама не раз видела как филиппинцы вылавливали их и готовили, зачастую предлагали попробовать. Но в основном морских ежей едят в сыром виде, а именно их икру и молоки, что по вкусу напоминает соленые грибы, по рассказам моих родителей, которые недавно попробовали их в сыром виде.
Морские ежи редко живут по одному, обычно они объединяются ‘компанией’.
Если вы наступили на морского ежа и его иголки остались у вас в ноге, нужно намазать это место соком лимона или лайма. На следующий день все пройдет. Доставать иголки нет смысла, т.к. вы только расковыряете ногу, а иголки сломаются.
Вот так ежи прячутся, видны лишь иголки:
Вот что едят в морских ежах:




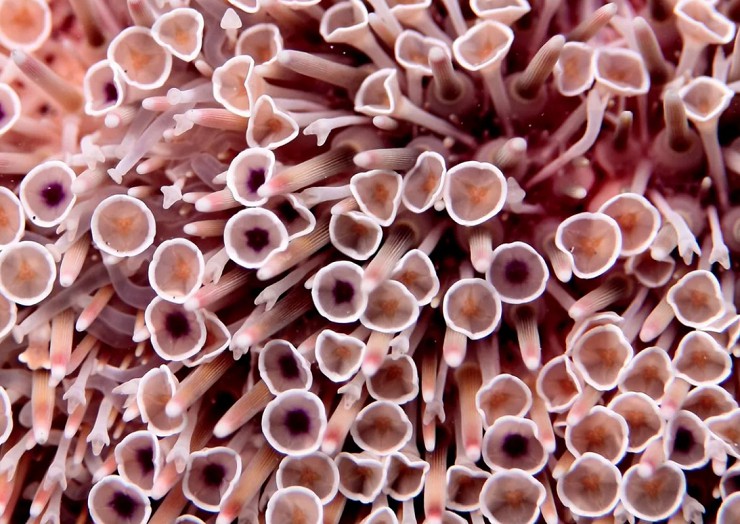












![Close-up of a cidaroid sea urchin apical disc: the 5 holes are the gonopores, and the central one is the anus ("periproct"). The biggest genital plate is the madreporite.[15]](https://upload.wikimedia.org/wikipedia/commons/thumb/9/9e/Sea_Urchin_Shell_detail.jpg/270px-Sea_Urchin_Shell_detail.jpg)