Sublimating dry ice pellet, with white frost on the surface
Dry ice is the solid form of carbon dioxide. It is commonly used for temporary refrigeration as CO2 does not have a liquid state at normal atmospheric pressure and sublimates directly from the solid state to the gas state. It is used primarily as a cooling agent, but is also used in fog machines at theatres for dramatic effects. Its advantages include lower temperature than that of water ice and not leaving any residue (other than incidental frost from moisture in the atmosphere). It is useful for preserving frozen foods (such as ice cream) where mechanical cooling is unavailable.
Dry ice sublimates at 194.7 K (−78.5 °C; −109.2 °F) at Earth atmospheric pressure. This extreme cold makes the solid dangerous to handle without protection from frostbite injury. While generally not very toxic, the outgassing from it can cause hypercapnia (abnormally elevated carbon dioxide levels in the blood) due to buildup in confined locations.
Properties[edit]
Comparison of phase diagrams of carbon dioxide (red) and water (blue) as a log-lin chart with phase transitions points at 1 atmosphere pressure
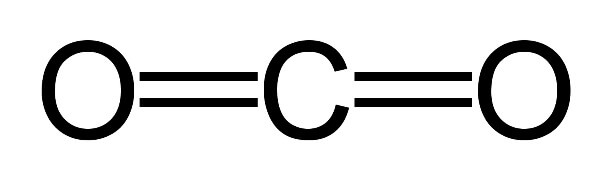
Dry ice is the solid form of carbon dioxide (CO2), a molecule consisting of a single carbon atom bonded to two oxygen atoms. Dry ice is colorless, odorless, and non-flammable, and can lower the pH of a solution when dissolved in water, forming carbonic acid (H2CO3).[1]
At pressures below 5.13 atm and temperatures above −56.4 °C (216.8 K; −69.5 °F) (the triple point), CO2 changes from a solid to a gas with no intervening liquid form, through a process called sublimation.[a] The opposite process is called deposition, where CO2 changes from the gas to solid phase (dry ice). At atmospheric pressure, sublimation/deposition occurs at 194.7 K (−78.5 °C; −109.2 °F).[2]
The density of dry ice increases with decreasing temperature and ranges between about 1.55 and 1.7 g/cm3 (97 and 106 lb/cu ft) below 195 K (−78 °C; −109 °F).[3] The low temperature and direct sublimation to a gas makes dry ice an effective coolant, since it is colder than water ice and leaves no residue as it changes state.[4] Its enthalpy of sublimation is 571 kJ/kg (25.2 kJ/mol).
Dry ice is non-polar, with a dipole moment of zero, so attractive intermolecular van der Waals forces operate.[5] The composition results in low thermal and electrical conductivity.[6]
History[edit]
It is generally accepted that dry ice was first observed in 1835 by French inventor Adrien-Jean-Pierre Thilorier (1790–1844), who published the first account of the substance.[7][8] In his experiments, it was noted that when opening the lid of a large cylinder containing liquid carbon dioxide, most of the liquid carbon dioxide quickly evaporated. This left only solid dry ice in the container. In 1924, Thomas B. Slate applied for a US patent to sell dry ice commercially. Subsequently, he became the first to make dry ice successful as an industry.[9] In 1925, this solid form of CO2 was trademarked by the DryIce Corporation of America as «Dry ice», leading to its common name.[10] That same year the DryIce Co. sold the substance commercially for the first time, marketing it for refrigeration purposes.[9]
Manufacture[edit]
Sublimation of dry ice when placed on water at room temperature
Dry ice is easily manufactured.[11][12] The most common industrial method of manufacturing dry ice first involves the production gases with a high concentration of carbon dioxide. Such gases can be a byproduct of another process, such as producing ammonia from nitrogen and natural gas, oil refinery activities or large-scale fermentation.[12] Second, the carbon dioxide-rich gas is pressurized and refrigerated until it liquefies. Next, the pressure is reduced. When this occurs some liquid carbon dioxide vaporizes, causing a rapid lowering of temperature of the remaining liquid. As a result, the extreme cold causes the liquid to solidify into a snow-like consistency. Finally, the snow-like solid carbon dioxide is compressed into small pellets or larger blocks of dry ice.[13][14]
Dry ice is typically produced in three standard forms: large blocks, small (1⁄2 or 5⁄8 in [13 or 16 mm] diameter) cylindrical pellets and tiny (1⁄8 inch [3.2 mm] diameter) cylindrical, high surface to volume pellets that float on oil or water and do not stick to skin because of their high radii of curvature. Tiny dry ice pellets are used primarily for dry ice blasting, quick freezing, fire fighting, oil solidifying and have been found to be safe for experimentation by middle school students wearing appropriate personal protective equipment such as gloves and safety glasses. A standard block weighing approximately 30 kg (66 lb)[citation needed] covered in a taped paper wrapping is most common. These are commonly used in shipping, because they sublime relatively slowly due to a low ratio of surface area to volume. Pellets are around 1 cm (0.4 in) in diameter and can be bagged easily. This form is suited to small scale use, for example at grocery stores and laboratories where it is stored in a thickly insulated chest.[15] Density of pellets is 60-70% of the density of blocks.[16]
Dry ice is also produced as a byproduct of cryogenic air separation, an industry primarily concerned with manufacturing extremely cold liquids such as liquid nitrogen and liquid oxygen. In this process, carbon dioxide liquefies and/or freezes at a far higher temperature compared to that needed to liquefy nitrogen and oxygen. The carbon dioxide must be removed during the process to prevent dry ice from fouling the equipment, and once separated can be processed into commercial dry ice in a manner similar to that described above.
Applications[edit]
Commercial[edit]
The most common use of dry ice is to preserve food,[1] using non-cyclic refrigeration.
It is frequently used to package items that must remain cold or frozen, such as ice cream or biological samples, in the absence of availability or practicality of mechanical cooling.
Dry ice is critical in the deployment of some vaccines, which require storage at ultra-cold temperatures along their supply line.[17]
Dry ice can be used to flash-freeze food[18] or laboratory biological samples,[19] carbonate beverages,[18] make ice cream,[20] solidify oil spills[21] and stop ice sculptures and ice walls from melting.
Dry ice can be used to arrest and prevent insect activity in closed containers of grains and grain products, as it displaces oxygen, but does not alter the taste or quality of foods. For the same reason, it can prevent or retard food oils and fats from becoming rancid.
When dry ice is placed in water, sublimation is accelerated, and low-sinking, dense clouds of smoke-like fog are created. This is used in fog machines, at theatres, haunted house attractions, and nightclubs for dramatic effects. Unlike most artificial fog machines, in which fog rises like smoke, fog from dry ice hovers near the ground.[14] Dry ice is useful in theatre productions that require dense fog effects.[22] The fog originates from the bulk water into which the dry ice is placed, and not from atmospheric water vapor (as is commonly assumed).[23]
It is occasionally used to freeze and remove warts.[24] However, liquid nitrogen performs better in this role, since it is colder so requires less time to act, and less pressure.[25] Dry ice has fewer problems with storage, since it can be generated from compressed carbon dioxide gas as needed.[25]
In plumbing, dry ice is used to cut off water flow to pipes to allow repairs to be made without shutting off water mains. Pressurised liquid CO2 is forced into a jacket wrapped around a pipe, which in turn causes the water inside to freeze and block the pipe. When the repairs are done, the jacket is removed and the ice plug melts, allowing the flow to resume. This technique can be used on pipes up to 4 inches or 100 mm in diameter.[26]
Dry ice can be used as bait to trap mosquitoes, bedbugs, and other insects, due to their attraction to carbon dioxide.[27]
It can be used to exterminate rodents. This is done by dropping pellets into rodent tunnels in the ground and then sealing off the entrance, thus suffocating the animals as the dry ice sublimates.[28]
Tiny dry ice pellets can be used to fight fire by both cooling fuel and suffocating the fire by excluding oxygen.[29]
The extreme temperature of dry ice can cause viscoelastic materials to change to glass phase. Thus, it is useful for removing many types of pressure sensitive adhesives.
Industrial[edit]
Dry ice blasting used for cleaning a rubber mold
Dry ice blasting used for cleaning electrical installations
Dry ice can be used for loosening asphalt floor tiles or car sound deadening material, making them easy to prise off,[30] as well as freezing water in valveless pipes to enable repair.[31]
One of the largest mechanical uses of dry ice is blast cleaning. Dry ice pellets are shot from a nozzle with compressed air, combining the power of the speed of the pellets with the action of the sublimation. This can remove residues from industrial equipment. Examples of materials removed include ink, glue, oil, paint, mold and rubber. Dry ice blasting can replace sandblasting, steam blasting, water blasting or solvent blasting. The primary environmental residue of dry ice blasting is the sublimed CO2, thus making it a useful technique where residues from other blasting techniques are undesirable.[32] Recently, blast cleaning has been introduced as a method of removing smoke damage from structures after fires.
Dry ice is also useful for the de-gassing of flammable vapours from storage tanks — the sublimation of dry ice pellets inside an emptied and vented tank causes an outrush of CO2 that carries with it the flammable vapours.[33]
The removal and fitting of cylinder liners in large engines requires the use of dry ice to chill and thus shrink the liner so that it freely slides into the engine block. When the liner then warms up, it expands, and the resulting interference fit holds it tightly in place. Similar procedures may be used in fabricating mechanical assemblies with a high resultant strength, replacing the need for pins, keys or welds.[34]
It is also useful as a cutting fluid.
Scientific[edit]
In laboratories, a slurry of dry ice in an organic solvent is a useful freezing mixture for cold chemical reactions and for condensing solvents in rotary evaporators.[35] Dry ice and acetone forms a cold bath of −78 °C (−108 °F; 195 K), which can be used for instance to prevent thermal runaway in a Swern oxidation.
The process of altering cloud precipitation can be done with the use of dry ice.[36] It was widely used in experiments in the US in the 1950s and early 1960s before it was replaced by silver iodide.[36] Dry ice has the advantage of being relatively cheap and completely non-toxic.[36] Its main drawback is the need to be delivered directly into the supercooled region of clouds being seeded.[36]
Dry ice bombs[edit]
A «dry ice bomb» is a balloon-like device using dry ice in a sealed container such as a plastic bottle. Water is usually added to accelerate the sublimation of the dry ice. As the dry ice sublimes, pressure increases, causing the bottle to burst causing a loud noise that can be avoided by replacing the screw cap with a rubber stopper to make a water rocket with a two-liter bottle.
The dry ice bomb device was featured on MythBusters, episode 57 Mentos and Soda, which first aired on August 9, 2006.[37] It was also featured in an episode of Time Warp, as well as in an episode of Archer.
[edit]
Following the Mars flyby of the Mariner 4 spacecraft in 1966, scientists concluded that Mars’ polar caps consist entirely of dry ice.[38] However, findings made in 2003 by researchers at the California Institute of Technology have shown that Mars’ polar caps are almost completely made of water ice, and that dry ice only forms a thin surface layer that thickens and thins seasonally.[38][39] A phenomenon named dry ice storms was proposed to occur over the polar regions of Mars. They are comparable to Earth’s thunderstorms, with crystalline CO2 taking the place of water in the clouds.[40] Dry ice is also proposed as a mechanism for Geysers on Mars.[41]
In 2012, the European Space Agency’s Venus Express probe detected a cold layer in the atmosphere of Venus where temperatures are close to the triple point of carbon dioxide and it is possible that flakes of dry ice precipitate.[42]
Observations from the Uranus flyby by Voyager 2 indicates that dry ice is present on the surface of its large moons Ariel,[43] Umbriel[43] and Titania.[43] Scientists speculate that the magnetic field of Uranus contributes to the generation of CO2 ice on the surfaces of its moons.[44] Voyager 2 observations of Neptune’s moon Triton suggested the presence of dry ice on the surface, though follow up observations indicate that the carbon ices on the surface are carbon monoxide but that the moon’s crust is composed of a significant quantity of dry ice.[45]
Safety[edit]
| Hazards | |
|---|---|
| GHS labelling:[46] | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H280 |
|
Precautionary statements |
P403 |
Prolonged exposure to dry ice can cause severe skin damage through frostbite, and the fog produced may also hinder attempts to withdraw from contact in a safe manner. Because it sublimes into large quantities of carbon dioxide gas, which could pose a danger of hypercapnia, dry ice should only be exposed to open air in a well-ventilated environment.[30] For this reason, in the context of laboratory safety dry ice is assigned label precaution P403: «Store in a well ventilated place.». Industrial dry ice may contain contaminants that make it unsafe for direct contact with food.[47][failed verification] Tiny dry ice pellets used in dry ice blast cleaning do not contain oily residues.
Dry ice is assigned a UN number, a code for hazardous substances: UN 1845.[48] Dry ice is not classified as a dangerous substance by the European Union, or as a hazardous material by the United States Department of Transportation for ground transportation.[49][48] However, in the US, it is regulated as a dangerous good when shipped by air or water. International Air Transport Association (IATA) regulations require specific diamond-shaped black-and white labelling to be placed on the package. The package must have adequate ventilation so that it will not rupture from pressure in the event that it begins to sublimate in the packaging.[48] The Federal Aviation Administration in the US allows airline passengers to carry up to 2.5 kg (5.5 lb) per person either as checked baggage or carry-on baggage, when used to refrigerate perishables.[50]
At least one person has been killed by carbon dioxide gas sublimating off dry ice in coolers placed in a car.[51]
In 2020, three people were killed at a party in Moscow after 25 kg of dry ice was dumped in a pool; carbon dioxide is heavier than air, and so can linger near the ground, just above water level.[52]
-
Dry ice pellet subliming in water, releasing thick white fog.
Drink[edit]
Dry ice is sometimes used to give a fog effect to cocktails. One bar patron who accidentally ingested pellets from a drink suffered severe burns to his esophagus, stomach, and duodenum, causing permanent problems with eating.[53][54] Rapid sublimation could cause gas buildup that ruptures digestive organs or suffocation. Products that contain dry ice and prevent it from being accidentally ingested eliminate these risks while producing the desired fog effect.[55]
Explanatory notes[edit]
- ^ Above the triple point, CO2 goes through the more familiar transitions via a liquid phase.
Citations[edit]
- ^ a b Yaws 2001, p. 125
- ^ Barber, C R (March 1966). «The sublimation temperature of carbon dioxide». British Journal of Applied Physics. 17 (3): 391–397. Bibcode:1966BJAP…17..391B. doi:10.1088/0508-3443/17/3/312. ISSN 0508-3443. Archived from the original on 2021-06-29. Retrieved 2020-11-15.
- ^ Mangan, T.P.; Salzmann, C.G.; Plane, J.M.C.; Murray, B.J. (September 2017). «CO2 ice structure and density under Martian atmospheric conditions». Icarus. 294: 201–208. Bibcode:2017Icar..294..201M. doi:10.1016/j.icarus.2017.03.012.
- ^ Yaws 2001, p. 124
- ^ Khanna & Kapila 2008, p. 161
- ^ Khanna & Kapila 2008, p. 163
- ^ Thilorier (1835). «Solidification de l’Acide carbonique». Comptes Rendus (in French). 1: 194–196. Archived from the original on 2010-09-05. Retrieved 2007-07-12. See also: «Solidification of carbonic acid,» Archived 2016-05-02 at the Wayback Machine The London and Edinburgh Philosophical Magazine, 8 : 446–447 (1836).
- ^ Note:
- The Bulletin des Lois du Royaume de France (Bulletin of the laws of the kingdom of France), 9th series, part ii, no. 92, page 74 (February 1832) lists: «24° M. Thilorier (Adrien-Jean-Pierre) employé à l’administration des postes, demeurant à Paris, place Vendôme, no 21, auquel il a été délivré le 16 mai dernier, le certificat de sa demande d’un brevet d’invention de dix ans pour le perfectionnement d’une machine à comprimer le gaz; …» (24th Mr. Thilorier (Adrien-Jean-Pierre) employed at the Post Office, residing in Paris, Place Vendôme, no. 21, where was delivered May 16th last, the certificate, by his request, for a patent of invention for ten years for the improvement of a machine to compress gas; … )
- In a patent (no. 2896) which was filed on May 16, 1831 and which was published in 1836, Adrien-Jean-Pierre Thilorier, an employee of the French «Administration des postes» (i.e., Post Office) in Paris is identified explicitly as the inventor of a machine for compressing gases which in 1829 won the French Academy of Sciences’ Montyon prize for mechanics. The patent describes the machine and its performance in detail. See: (French Ministry of Commerce), «Pour le perfectionnement d’une machine à comprimer le gaz, …» Archived 2013-12-31 at the Wayback Machine (For the improvement of a machine to compress gas, …), Description des Machines et Procédés consignés dans les brevets d’invention, 30 : 251–267 (1836).
- ^ a b Killeffer, D.H. (October 1930). «The Growing Industry-Dry-Ice». Industrial & Engineering Chemistry. 22 (10): 1087. doi:10.1021/ie50250a022.
- ^ The Trade-mark Reporter. United States Trademark Association. 1930. ISBN 978-1-59888-091-5.
- ^ «What is Dry Ice?». Continental Carbonic Products, Inc. Archived from the original on 2009-07-27. Retrieved 2009-07-26.
- ^ a b «Carbon Dioxide (CO2) Properties, Uses, Applications: CO2 Gas and Liquid Carbon Dioxide». Universal Industrial Gases, Inc. Archived from the original on 2021-02-13. Retrieved 2009-07-26.
- ^ Good plant design and operation for onshore carbon capture installations and onshore pipelines Archived June 24, 2012, at the Wayback Machine. The Energy Institute. London. September 2010. p. 10
- ^ a b «How does dry ice work?». HowStuffWorks. April 2000. Archived from the original on 2009-07-17. Retrieved 2009-07-26.
- ^ «Dry Ice Sales – How to sell Dry Ice». dryiceinfo.com. Archived from the original on 13 July 2015. Retrieved 6 July 2015.
- ^ «The Polar® Insulated Container System» (PDF). dacocorp.com. Archived (PDF) from the original on 29 June 2021. Retrieved 11 Jan 2020.
- ^ Newman, Jessie (3 December 2020). «Dry Ice Demand Swells as Covid-19 Vaccines Prepare for Deployment». The Wall Street Journal. Archived from the original on 4 December 2020. Retrieved 3 December 2020.
- ^ a b «Cool Uses for Dry Ice». Airgas.com. Archived from the original on 2010-12-01. Retrieved 2009-07-25.
- ^ «Preparing Competent E. coli with RF1/RF2 solutions». Personal.psu.edu. Archived from the original on 2021-09-23. Retrieved 2009-07-25.
- ^ Blumenthal, Heston (2006-10-29). «How to make the best treacle tart and ice cream in the world». The Sunday Times. London. Archived from the original on 2011-06-29. Retrieved 2007-06-12.
- ^ «Zapping Oil Spills with Dry Ice and Ingenuity» by Gordon Dillow Los Angeles Times South Bay section page 1 2/24/1994
- ^ McCarthy 1992
- ^ Kuntzleman, Thomas S.; Ford, Nathan; No, Jin-Hwan; Ott, Mark E. (2015-04-14). «A Molecular Explanation of How the Fog Is Produced when Dry Ice Is Placed in Water». Journal of Chemical Education. 92 (4): 643–648. Bibcode:2015JChEd..92..643K. doi:10.1021/ed400754n. ISSN 0021-9584.
- ^ Lyell A. (1966). «Management of warts». British Medical Journal. 2 (5529): 1576–9. doi:10.1136/bmj.2.5529.1576. PMC 1944935. PMID 5926267.
- ^ a b Goroll & Mulley 2009, p. 1317
- ^ Treloar 2003, p. 528
- ^ Reisen WK, Boyce K, Cummings RC, Delgado O, Gutierrez A, Meyer RP, Scott TW (1999). «Comparative effectiveness of three adult mosquito sampling methods in habitats representative of four different biomes of California». J Am Mosq Control Assoc. 15 (1): 24–31. PMID 10342265.
- ^ «City Deploys Dry Ice To Exterminate Rats». New York Daily News. Archived from the original on 2018-03-06. Retrieved 2018-03-06.
- ^ «Could a Freeze Gun Put Flames on Ice» by Zantos Peabody Los Angeles Times local section B3 9/3/2002
- ^ a b Horrell, Bill (February 1961). «Dry ice pops off Asphalt Tile». Popular Mechanics. 115 (2): 169. Archived from the original on 2013-06-06. Retrieved 2016-09-23.
- ^ Mundis, Warren J. (July 1960). «Dry Ice as a Plumbing Aid». Popular Science. 177 (1): 159. Archived from the original on 2013-06-04. Retrieved 2016-09-23.
- ^ Wolcott, John (January 2008). «Ice-blasting firm offers a cool way to clean up». The Daily Herald. Archived from the original on January 9, 2008. Retrieved 2008-01-20.
- ^ «All About Ice – Ice Carvings, Vodka Luges, Crushed and Dry Ice». allaboutice.com. Archived from the original on 18 July 2015. Retrieved 6 July 2015.
- ^ «Bushing and Plain Bearings Press or Shrink Fit Design and Application – Engineers Edge». engineersedge.com. Archived from the original on 7 July 2015. Retrieved 6 July 2015.
- ^ Housecroft 2001, p. 410
- ^ a b c d Keyes 2006, p. 83
- ^ «Mythbusters episode 57». mythbustersresults.com. Archived from the original on 2009-06-27. Retrieved 2009-07-31.
- ^ a b Mars Poles Covered by Water Ice, Research Shows. National Geographic. 13 February 2003. Archived from the original on 2009-07-01. Retrieved 2009-07-26.
- ^ Byrne, S.; Ingersoll, AP (2003-02-14). «A Sublimation Model for Martian South Polar Ice Features». Science. 299 (5609): 1051–3. Bibcode:2003Sci…299.1051B. doi:10.1126/science.1080148. PMID 12586939. S2CID 7819614.
- ^ Dry Ice Storms May Pelt Martian Poles, Experts Say. National Geographic. 19 December 2005. Archived from the original on 2010-09-04. Retrieved 2009-07-26.
- ^ J. J. Jian; W. H. Ip, eds. (2006). «Lunar and Planetary Science XXXVII (2006) — Observation of the Martian Cryptic Region from Mars Orbiter Camera» (PDF). Archived (PDF) from the original on 4 August 2020. Retrieved 4 September 2009.
- ^ A curious cold layer in the atmosphere of Venus Archived 2015-12-23 at the Wayback Machine. European Space Agency (1 October 2012).
- ^ a b c Grundy, W. M.; Young, L. A.; Spencer, J. R.; Johnson, R. E.; Young, E. F.; Buie, M. W. (October 2006). «Distributions of H2O and CO2 ices on Ariel, Umbriel, Titania, and Oberon from IRTF/SpeX observations». Icarus. 184 (2): 543–555. arXiv:0704.1525. Bibcode:2006Icar..184..543G. doi:10.1016/j.icarus.2006.04.016. S2CID 12105236.
- ^ Cartwright, R.J.; Emery, J.P.; Rivkin, A.S.; Trilling, D.E.; Pinilla-Alonso, N. (2015). «Distribution of CO2 ice on the large moons of Uranus and evidence for compositional stratification of their near-surfaces». Icarus. 257: 428–456. arXiv:1506.04673. Bibcode:2015Icar..257..428C. doi:10.1016/j.icarus.2015.05.020. ISSN 0019-1035. S2CID 117850580.
- ^ Lellouch, E.; de Bergh, C.; Sicardy, B.; Ferron, S.; Käufl, H.-U. (2010). «Detection of CO in Triton’s atmosphere and the nature of surface-atmosphere interactions». Astronomy and Astrophysics. 512: L8. arXiv:1003.2866. Bibcode:2010A&A…512L…8L. doi:10.1051/0004-6361/201014339. ISSN 0004-6361. S2CID 58889896.
- ^ GHS: GESTIS 001120 Archived 2021-12-26 at the Wayback Machine
- ^ Nelson, Lewis (2000). «Carbon Dioxide Poisoning». Emergency Medicine. Archived from the original on 2007-07-18. Retrieved 2009-07-28.
- ^ a b c «How to Ship Dry Ice by Air». Lion.com. Lion Technology Inc. 2019-10-08. Retrieved 2022-11-30.
{{cite web}}: CS1 maint: url-status (link) - ^ «Regulation (EC) No 1272/2008 of the European Parliament». Archived from the original on 2009-08-05. Retrieved 2009-07-31.
- ^ «Hazardous Materials Information for Passengers». faa.gov. Archived from the original on 2013-12-20. Retrieved 2009-07-26.
- ^ A Woman Died from Dry Ice Fumes. Here’s How It Can Happen
- ^ Three die in dry-ice incident at Moscow pool party
- ^ Specialist Public Health Lawyers Instructed After Dry Ice Cocktail Drank at The Alchemist ‘Leaves Man With Severe Stomach Burns’
- ^ Gastric hypothermic injury caused by accidental ingestion of dry ice: endoscopic features
- ^ Chillistick — Frequently Asked Questions
General bibliography[edit]
- Duane, H. D. Roller; Thilorier, M. (1952). «Thilyorier and the First Solidification of a «Permanent» Gas (1835)». Isis. 43 (2): 109–113. doi:10.1086/349402. JSTOR 227174. S2CID 144091865.
- Goroll, Allan H; Mulley, Albert G (2009). Primary Care Medicine: Office evaluation and management of the adult patient. Lippincott Williams & Wilkins. ISBN 978-0-7817-7513-7.
- Häring, Heinz-Wolfgang (2008). Industrial Gases Processing. Christine Ahner. Wiley-VCH. ISBN 978-3-527-31685-4. Retrieved 2009-07-31.
- Housecroft, Catherine; Sharpe, Alan G (2001). Inorganic chemistry. Harlow: Prentice Hall. p. 410. ISBN 978-0-582-31080-3. Retrieved 2009-07-31.
- Keyes, Conrad G (2006). Guidelines for Cloud Seeding to Augment Precipitation. American Society of Civil Engineers. ASCE Publications. ISBN 978-0-7844-0819-3.
- Verma, N. K.; Khanna, S. K.; Kapila, B. (2008). Comprehensive Chemistry for Class XI. New Delhi: Laxmi Publications. ISBN 978-81-7008-596-6. Retrieved 2009-07-31.
- McCarthy, Robert E. (1992). Secrets of Hollywood Special Effects. Boston: Focal Press. ISBN 978-0-240-80108-7.
- Mitra, Somenath (April 2004). Sample Preparation Techniques in Analytical Chemistry. Wiley-IEEE. ISBN 978-0-471-32845-2. Retrieved 2009-07-31.
- Treloar, Roy D. (2003). Plumbing Encyclopaedia (3rd ed.). Wiley-Blackwell. p. 175. ISBN 978-1-4051-0613-9. Retrieved 2009-07-31.
- Yaws, Carl (2001). Matheson Gas Data Book (7th ed.). McGraw-Hill Professional. ISBN 978-0-07-135854-5. 982 pages. Retrieved 2009-07-27.
External links[edit]
Wikimedia Commons has media related to Dry ice.
Sublimating dry ice pellet, with white frost on the surface
Dry ice is the solid form of carbon dioxide. It is commonly used for temporary refrigeration as CO2 does not have a liquid state at normal atmospheric pressure and sublimates directly from the solid state to the gas state. It is used primarily as a cooling agent, but is also used in fog machines at theatres for dramatic effects. Its advantages include lower temperature than that of water ice and not leaving any residue (other than incidental frost from moisture in the atmosphere). It is useful for preserving frozen foods (such as ice cream) where mechanical cooling is unavailable.
Dry ice sublimates at 194.7 K (−78.5 °C; −109.2 °F) at Earth atmospheric pressure. This extreme cold makes the solid dangerous to handle without protection from frostbite injury. While generally not very toxic, the outgassing from it can cause hypercapnia (abnormally elevated carbon dioxide levels in the blood) due to buildup in confined locations.
Properties[edit]
Comparison of phase diagrams of carbon dioxide (red) and water (blue) as a log-lin chart with phase transitions points at 1 atmosphere pressure
Dry ice is the solid form of carbon dioxide (CO2), a molecule consisting of a single carbon atom bonded to two oxygen atoms. Dry ice is colorless, odorless, and non-flammable, and can lower the pH of a solution when dissolved in water, forming carbonic acid (H2CO3).[1]
At pressures below 5.13 atm and temperatures above −56.4 °C (216.8 K; −69.5 °F) (the triple point), CO2 changes from a solid to a gas with no intervening liquid form, through a process called sublimation.[a] The opposite process is called deposition, where CO2 changes from the gas to solid phase (dry ice). At atmospheric pressure, sublimation/deposition occurs at 194.7 K (−78.5 °C; −109.2 °F).[2]
The density of dry ice increases with decreasing temperature and ranges between about 1.55 and 1.7 g/cm3 (97 and 106 lb/cu ft) below 195 K (−78 °C; −109 °F).[3] The low temperature and direct sublimation to a gas makes dry ice an effective coolant, since it is colder than water ice and leaves no residue as it changes state.[4] Its enthalpy of sublimation is 571 kJ/kg (25.2 kJ/mol).
Dry ice is non-polar, with a dipole moment of zero, so attractive intermolecular van der Waals forces operate.[5] The composition results in low thermal and electrical conductivity.[6]
History[edit]
It is generally accepted that dry ice was first observed in 1835 by French inventor Adrien-Jean-Pierre Thilorier (1790–1844), who published the first account of the substance.[7][8] In his experiments, it was noted that when opening the lid of a large cylinder containing liquid carbon dioxide, most of the liquid carbon dioxide quickly evaporated. This left only solid dry ice in the container. In 1924, Thomas B. Slate applied for a US patent to sell dry ice commercially. Subsequently, he became the first to make dry ice successful as an industry.[9] In 1925, this solid form of CO2 was trademarked by the DryIce Corporation of America as «Dry ice», leading to its common name.[10] That same year the DryIce Co. sold the substance commercially for the first time, marketing it for refrigeration purposes.[9]
Manufacture[edit]
Sublimation of dry ice when placed on water at room temperature
Dry ice is easily manufactured.[11][12] The most common industrial method of manufacturing dry ice first involves the production gases with a high concentration of carbon dioxide. Such gases can be a byproduct of another process, such as producing ammonia from nitrogen and natural gas, oil refinery activities or large-scale fermentation.[12] Second, the carbon dioxide-rich gas is pressurized and refrigerated until it liquefies. Next, the pressure is reduced. When this occurs some liquid carbon dioxide vaporizes, causing a rapid lowering of temperature of the remaining liquid. As a result, the extreme cold causes the liquid to solidify into a snow-like consistency. Finally, the snow-like solid carbon dioxide is compressed into small pellets or larger blocks of dry ice.[13][14]
Dry ice is typically produced in three standard forms: large blocks, small (1⁄2 or 5⁄8 in [13 or 16 mm] diameter) cylindrical pellets and tiny (1⁄8 inch [3.2 mm] diameter) cylindrical, high surface to volume pellets that float on oil or water and do not stick to skin because of their high radii of curvature. Tiny dry ice pellets are used primarily for dry ice blasting, quick freezing, fire fighting, oil solidifying and have been found to be safe for experimentation by middle school students wearing appropriate personal protective equipment such as gloves and safety glasses. A standard block weighing approximately 30 kg (66 lb)[citation needed] covered in a taped paper wrapping is most common. These are commonly used in shipping, because they sublime relatively slowly due to a low ratio of surface area to volume. Pellets are around 1 cm (0.4 in) in diameter and can be bagged easily. This form is suited to small scale use, for example at grocery stores and laboratories where it is stored in a thickly insulated chest.[15] Density of pellets is 60-70% of the density of blocks.[16]
Dry ice is also produced as a byproduct of cryogenic air separation, an industry primarily concerned with manufacturing extremely cold liquids such as liquid nitrogen and liquid oxygen. In this process, carbon dioxide liquefies and/or freezes at a far higher temperature compared to that needed to liquefy nitrogen and oxygen. The carbon dioxide must be removed during the process to prevent dry ice from fouling the equipment, and once separated can be processed into commercial dry ice in a manner similar to that described above.
Applications[edit]
Commercial[edit]
The most common use of dry ice is to preserve food,[1] using non-cyclic refrigeration.
It is frequently used to package items that must remain cold or frozen, such as ice cream or biological samples, in the absence of availability or practicality of mechanical cooling.
Dry ice is critical in the deployment of some vaccines, which require storage at ultra-cold temperatures along their supply line.[17]
Dry ice can be used to flash-freeze food[18] or laboratory biological samples,[19] carbonate beverages,[18] make ice cream,[20] solidify oil spills[21] and stop ice sculptures and ice walls from melting.
Dry ice can be used to arrest and prevent insect activity in closed containers of grains and grain products, as it displaces oxygen, but does not alter the taste or quality of foods. For the same reason, it can prevent or retard food oils and fats from becoming rancid.
When dry ice is placed in water, sublimation is accelerated, and low-sinking, dense clouds of smoke-like fog are created. This is used in fog machines, at theatres, haunted house attractions, and nightclubs for dramatic effects. Unlike most artificial fog machines, in which fog rises like smoke, fog from dry ice hovers near the ground.[14] Dry ice is useful in theatre productions that require dense fog effects.[22] The fog originates from the bulk water into which the dry ice is placed, and not from atmospheric water vapor (as is commonly assumed).[23]
It is occasionally used to freeze and remove warts.[24] However, liquid nitrogen performs better in this role, since it is colder so requires less time to act, and less pressure.[25] Dry ice has fewer problems with storage, since it can be generated from compressed carbon dioxide gas as needed.[25]
In plumbing, dry ice is used to cut off water flow to pipes to allow repairs to be made without shutting off water mains. Pressurised liquid CO2 is forced into a jacket wrapped around a pipe, which in turn causes the water inside to freeze and block the pipe. When the repairs are done, the jacket is removed and the ice plug melts, allowing the flow to resume. This technique can be used on pipes up to 4 inches or 100 mm in diameter.[26]
Dry ice can be used as bait to trap mosquitoes, bedbugs, and other insects, due to their attraction to carbon dioxide.[27]
It can be used to exterminate rodents. This is done by dropping pellets into rodent tunnels in the ground and then sealing off the entrance, thus suffocating the animals as the dry ice sublimates.[28]
Tiny dry ice pellets can be used to fight fire by both cooling fuel and suffocating the fire by excluding oxygen.[29]
The extreme temperature of dry ice can cause viscoelastic materials to change to glass phase. Thus, it is useful for removing many types of pressure sensitive adhesives.
Industrial[edit]
Dry ice blasting used for cleaning a rubber mold
Dry ice blasting used for cleaning electrical installations
Dry ice can be used for loosening asphalt floor tiles or car sound deadening material, making them easy to prise off,[30] as well as freezing water in valveless pipes to enable repair.[31]
One of the largest mechanical uses of dry ice is blast cleaning. Dry ice pellets are shot from a nozzle with compressed air, combining the power of the speed of the pellets with the action of the sublimation. This can remove residues from industrial equipment. Examples of materials removed include ink, glue, oil, paint, mold and rubber. Dry ice blasting can replace sandblasting, steam blasting, water blasting or solvent blasting. The primary environmental residue of dry ice blasting is the sublimed CO2, thus making it a useful technique where residues from other blasting techniques are undesirable.[32] Recently, blast cleaning has been introduced as a method of removing smoke damage from structures after fires.
Dry ice is also useful for the de-gassing of flammable vapours from storage tanks — the sublimation of dry ice pellets inside an emptied and vented tank causes an outrush of CO2 that carries with it the flammable vapours.[33]
The removal and fitting of cylinder liners in large engines requires the use of dry ice to chill and thus shrink the liner so that it freely slides into the engine block. When the liner then warms up, it expands, and the resulting interference fit holds it tightly in place. Similar procedures may be used in fabricating mechanical assemblies with a high resultant strength, replacing the need for pins, keys or welds.[34]
It is also useful as a cutting fluid.
Scientific[edit]
In laboratories, a slurry of dry ice in an organic solvent is a useful freezing mixture for cold chemical reactions and for condensing solvents in rotary evaporators.[35] Dry ice and acetone forms a cold bath of −78 °C (−108 °F; 195 K), which can be used for instance to prevent thermal runaway in a Swern oxidation.
The process of altering cloud precipitation can be done with the use of dry ice.[36] It was widely used in experiments in the US in the 1950s and early 1960s before it was replaced by silver iodide.[36] Dry ice has the advantage of being relatively cheap and completely non-toxic.[36] Its main drawback is the need to be delivered directly into the supercooled region of clouds being seeded.[36]
Dry ice bombs[edit]
A «dry ice bomb» is a balloon-like device using dry ice in a sealed container such as a plastic bottle. Water is usually added to accelerate the sublimation of the dry ice. As the dry ice sublimes, pressure increases, causing the bottle to burst causing a loud noise that can be avoided by replacing the screw cap with a rubber stopper to make a water rocket with a two-liter bottle.
The dry ice bomb device was featured on MythBusters, episode 57 Mentos and Soda, which first aired on August 9, 2006.[37] It was also featured in an episode of Time Warp, as well as in an episode of Archer.
[edit]
Following the Mars flyby of the Mariner 4 spacecraft in 1966, scientists concluded that Mars’ polar caps consist entirely of dry ice.[38] However, findings made in 2003 by researchers at the California Institute of Technology have shown that Mars’ polar caps are almost completely made of water ice, and that dry ice only forms a thin surface layer that thickens and thins seasonally.[38][39] A phenomenon named dry ice storms was proposed to occur over the polar regions of Mars. They are comparable to Earth’s thunderstorms, with crystalline CO2 taking the place of water in the clouds.[40] Dry ice is also proposed as a mechanism for Geysers on Mars.[41]
In 2012, the European Space Agency’s Venus Express probe detected a cold layer in the atmosphere of Venus where temperatures are close to the triple point of carbon dioxide and it is possible that flakes of dry ice precipitate.[42]
Observations from the Uranus flyby by Voyager 2 indicates that dry ice is present on the surface of its large moons Ariel,[43] Umbriel[43] and Titania.[43] Scientists speculate that the magnetic field of Uranus contributes to the generation of CO2 ice on the surfaces of its moons.[44] Voyager 2 observations of Neptune’s moon Triton suggested the presence of dry ice on the surface, though follow up observations indicate that the carbon ices on the surface are carbon monoxide but that the moon’s crust is composed of a significant quantity of dry ice.[45]
Safety[edit]
| Hazards | |
|---|---|
| GHS labelling:[46] | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H280 |
|
Precautionary statements |
P403 |
Prolonged exposure to dry ice can cause severe skin damage through frostbite, and the fog produced may also hinder attempts to withdraw from contact in a safe manner. Because it sublimes into large quantities of carbon dioxide gas, which could pose a danger of hypercapnia, dry ice should only be exposed to open air in a well-ventilated environment.[30] For this reason, in the context of laboratory safety dry ice is assigned label precaution P403: «Store in a well ventilated place.». Industrial dry ice may contain contaminants that make it unsafe for direct contact with food.[47][failed verification] Tiny dry ice pellets used in dry ice blast cleaning do not contain oily residues.
Dry ice is assigned a UN number, a code for hazardous substances: UN 1845.[48] Dry ice is not classified as a dangerous substance by the European Union, or as a hazardous material by the United States Department of Transportation for ground transportation.[49][48] However, in the US, it is regulated as a dangerous good when shipped by air or water. International Air Transport Association (IATA) regulations require specific diamond-shaped black-and white labelling to be placed on the package. The package must have adequate ventilation so that it will not rupture from pressure in the event that it begins to sublimate in the packaging.[48] The Federal Aviation Administration in the US allows airline passengers to carry up to 2.5 kg (5.5 lb) per person either as checked baggage or carry-on baggage, when used to refrigerate perishables.[50]
At least one person has been killed by carbon dioxide gas sublimating off dry ice in coolers placed in a car.[51]
In 2020, three people were killed at a party in Moscow after 25 kg of dry ice was dumped in a pool; carbon dioxide is heavier than air, and so can linger near the ground, just above water level.[52]
-
Dry ice pellet subliming in water, releasing thick white fog.
Drink[edit]
Dry ice is sometimes used to give a fog effect to cocktails. One bar patron who accidentally ingested pellets from a drink suffered severe burns to his esophagus, stomach, and duodenum, causing permanent problems with eating.[53][54] Rapid sublimation could cause gas buildup that ruptures digestive organs or suffocation. Products that contain dry ice and prevent it from being accidentally ingested eliminate these risks while producing the desired fog effect.[55]
Explanatory notes[edit]
- ^ Above the triple point, CO2 goes through the more familiar transitions via a liquid phase.
Citations[edit]
- ^ a b Yaws 2001, p. 125
- ^ Barber, C R (March 1966). «The sublimation temperature of carbon dioxide». British Journal of Applied Physics. 17 (3): 391–397. Bibcode:1966BJAP…17..391B. doi:10.1088/0508-3443/17/3/312. ISSN 0508-3443. Archived from the original on 2021-06-29. Retrieved 2020-11-15.
- ^ Mangan, T.P.; Salzmann, C.G.; Plane, J.M.C.; Murray, B.J. (September 2017). «CO2 ice structure and density under Martian atmospheric conditions». Icarus. 294: 201–208. Bibcode:2017Icar..294..201M. doi:10.1016/j.icarus.2017.03.012.
- ^ Yaws 2001, p. 124
- ^ Khanna & Kapila 2008, p. 161
- ^ Khanna & Kapila 2008, p. 163
- ^ Thilorier (1835). «Solidification de l’Acide carbonique». Comptes Rendus (in French). 1: 194–196. Archived from the original on 2010-09-05. Retrieved 2007-07-12. See also: «Solidification of carbonic acid,» Archived 2016-05-02 at the Wayback Machine The London and Edinburgh Philosophical Magazine, 8 : 446–447 (1836).
- ^ Note:
- The Bulletin des Lois du Royaume de France (Bulletin of the laws of the kingdom of France), 9th series, part ii, no. 92, page 74 (February 1832) lists: «24° M. Thilorier (Adrien-Jean-Pierre) employé à l’administration des postes, demeurant à Paris, place Vendôme, no 21, auquel il a été délivré le 16 mai dernier, le certificat de sa demande d’un brevet d’invention de dix ans pour le perfectionnement d’une machine à comprimer le gaz; …» (24th Mr. Thilorier (Adrien-Jean-Pierre) employed at the Post Office, residing in Paris, Place Vendôme, no. 21, where was delivered May 16th last, the certificate, by his request, for a patent of invention for ten years for the improvement of a machine to compress gas; … )
- In a patent (no. 2896) which was filed on May 16, 1831 and which was published in 1836, Adrien-Jean-Pierre Thilorier, an employee of the French «Administration des postes» (i.e., Post Office) in Paris is identified explicitly as the inventor of a machine for compressing gases which in 1829 won the French Academy of Sciences’ Montyon prize for mechanics. The patent describes the machine and its performance in detail. See: (French Ministry of Commerce), «Pour le perfectionnement d’une machine à comprimer le gaz, …» Archived 2013-12-31 at the Wayback Machine (For the improvement of a machine to compress gas, …), Description des Machines et Procédés consignés dans les brevets d’invention, 30 : 251–267 (1836).
- ^ a b Killeffer, D.H. (October 1930). «The Growing Industry-Dry-Ice». Industrial & Engineering Chemistry. 22 (10): 1087. doi:10.1021/ie50250a022.
- ^ The Trade-mark Reporter. United States Trademark Association. 1930. ISBN 978-1-59888-091-5.
- ^ «What is Dry Ice?». Continental Carbonic Products, Inc. Archived from the original on 2009-07-27. Retrieved 2009-07-26.
- ^ a b «Carbon Dioxide (CO2) Properties, Uses, Applications: CO2 Gas and Liquid Carbon Dioxide». Universal Industrial Gases, Inc. Archived from the original on 2021-02-13. Retrieved 2009-07-26.
- ^ Good plant design and operation for onshore carbon capture installations and onshore pipelines Archived June 24, 2012, at the Wayback Machine. The Energy Institute. London. September 2010. p. 10
- ^ a b «How does dry ice work?». HowStuffWorks. April 2000. Archived from the original on 2009-07-17. Retrieved 2009-07-26.
- ^ «Dry Ice Sales – How to sell Dry Ice». dryiceinfo.com. Archived from the original on 13 July 2015. Retrieved 6 July 2015.
- ^ «The Polar® Insulated Container System» (PDF). dacocorp.com. Archived (PDF) from the original on 29 June 2021. Retrieved 11 Jan 2020.
- ^ Newman, Jessie (3 December 2020). «Dry Ice Demand Swells as Covid-19 Vaccines Prepare for Deployment». The Wall Street Journal. Archived from the original on 4 December 2020. Retrieved 3 December 2020.
- ^ a b «Cool Uses for Dry Ice». Airgas.com. Archived from the original on 2010-12-01. Retrieved 2009-07-25.
- ^ «Preparing Competent E. coli with RF1/RF2 solutions». Personal.psu.edu. Archived from the original on 2021-09-23. Retrieved 2009-07-25.
- ^ Blumenthal, Heston (2006-10-29). «How to make the best treacle tart and ice cream in the world». The Sunday Times. London. Archived from the original on 2011-06-29. Retrieved 2007-06-12.
- ^ «Zapping Oil Spills with Dry Ice and Ingenuity» by Gordon Dillow Los Angeles Times South Bay section page 1 2/24/1994
- ^ McCarthy 1992
- ^ Kuntzleman, Thomas S.; Ford, Nathan; No, Jin-Hwan; Ott, Mark E. (2015-04-14). «A Molecular Explanation of How the Fog Is Produced when Dry Ice Is Placed in Water». Journal of Chemical Education. 92 (4): 643–648. Bibcode:2015JChEd..92..643K. doi:10.1021/ed400754n. ISSN 0021-9584.
- ^ Lyell A. (1966). «Management of warts». British Medical Journal. 2 (5529): 1576–9. doi:10.1136/bmj.2.5529.1576. PMC 1944935. PMID 5926267.
- ^ a b Goroll & Mulley 2009, p. 1317
- ^ Treloar 2003, p. 528
- ^ Reisen WK, Boyce K, Cummings RC, Delgado O, Gutierrez A, Meyer RP, Scott TW (1999). «Comparative effectiveness of three adult mosquito sampling methods in habitats representative of four different biomes of California». J Am Mosq Control Assoc. 15 (1): 24–31. PMID 10342265.
- ^ «City Deploys Dry Ice To Exterminate Rats». New York Daily News. Archived from the original on 2018-03-06. Retrieved 2018-03-06.
- ^ «Could a Freeze Gun Put Flames on Ice» by Zantos Peabody Los Angeles Times local section B3 9/3/2002
- ^ a b Horrell, Bill (February 1961). «Dry ice pops off Asphalt Tile». Popular Mechanics. 115 (2): 169. Archived from the original on 2013-06-06. Retrieved 2016-09-23.
- ^ Mundis, Warren J. (July 1960). «Dry Ice as a Plumbing Aid». Popular Science. 177 (1): 159. Archived from the original on 2013-06-04. Retrieved 2016-09-23.
- ^ Wolcott, John (January 2008). «Ice-blasting firm offers a cool way to clean up». The Daily Herald. Archived from the original on January 9, 2008. Retrieved 2008-01-20.
- ^ «All About Ice – Ice Carvings, Vodka Luges, Crushed and Dry Ice». allaboutice.com. Archived from the original on 18 July 2015. Retrieved 6 July 2015.
- ^ «Bushing and Plain Bearings Press or Shrink Fit Design and Application – Engineers Edge». engineersedge.com. Archived from the original on 7 July 2015. Retrieved 6 July 2015.
- ^ Housecroft 2001, p. 410
- ^ a b c d Keyes 2006, p. 83
- ^ «Mythbusters episode 57». mythbustersresults.com. Archived from the original on 2009-06-27. Retrieved 2009-07-31.
- ^ a b Mars Poles Covered by Water Ice, Research Shows. National Geographic. 13 February 2003. Archived from the original on 2009-07-01. Retrieved 2009-07-26.
- ^ Byrne, S.; Ingersoll, AP (2003-02-14). «A Sublimation Model for Martian South Polar Ice Features». Science. 299 (5609): 1051–3. Bibcode:2003Sci…299.1051B. doi:10.1126/science.1080148. PMID 12586939. S2CID 7819614.
- ^ Dry Ice Storms May Pelt Martian Poles, Experts Say. National Geographic. 19 December 2005. Archived from the original on 2010-09-04. Retrieved 2009-07-26.
- ^ J. J. Jian; W. H. Ip, eds. (2006). «Lunar and Planetary Science XXXVII (2006) — Observation of the Martian Cryptic Region from Mars Orbiter Camera» (PDF). Archived (PDF) from the original on 4 August 2020. Retrieved 4 September 2009.
- ^ A curious cold layer in the atmosphere of Venus Archived 2015-12-23 at the Wayback Machine. European Space Agency (1 October 2012).
- ^ a b c Grundy, W. M.; Young, L. A.; Spencer, J. R.; Johnson, R. E.; Young, E. F.; Buie, M. W. (October 2006). «Distributions of H2O and CO2 ices on Ariel, Umbriel, Titania, and Oberon from IRTF/SpeX observations». Icarus. 184 (2): 543–555. arXiv:0704.1525. Bibcode:2006Icar..184..543G. doi:10.1016/j.icarus.2006.04.016. S2CID 12105236.
- ^ Cartwright, R.J.; Emery, J.P.; Rivkin, A.S.; Trilling, D.E.; Pinilla-Alonso, N. (2015). «Distribution of CO2 ice on the large moons of Uranus and evidence for compositional stratification of their near-surfaces». Icarus. 257: 428–456. arXiv:1506.04673. Bibcode:2015Icar..257..428C. doi:10.1016/j.icarus.2015.05.020. ISSN 0019-1035. S2CID 117850580.
- ^ Lellouch, E.; de Bergh, C.; Sicardy, B.; Ferron, S.; Käufl, H.-U. (2010). «Detection of CO in Triton’s atmosphere and the nature of surface-atmosphere interactions». Astronomy and Astrophysics. 512: L8. arXiv:1003.2866. Bibcode:2010A&A…512L…8L. doi:10.1051/0004-6361/201014339. ISSN 0004-6361. S2CID 58889896.
- ^ GHS: GESTIS 001120 Archived 2021-12-26 at the Wayback Machine
- ^ Nelson, Lewis (2000). «Carbon Dioxide Poisoning». Emergency Medicine. Archived from the original on 2007-07-18. Retrieved 2009-07-28.
- ^ a b c «How to Ship Dry Ice by Air». Lion.com. Lion Technology Inc. 2019-10-08. Retrieved 2022-11-30.
{{cite web}}: CS1 maint: url-status (link) - ^ «Regulation (EC) No 1272/2008 of the European Parliament». Archived from the original on 2009-08-05. Retrieved 2009-07-31.
- ^ «Hazardous Materials Information for Passengers». faa.gov. Archived from the original on 2013-12-20. Retrieved 2009-07-26.
- ^ A Woman Died from Dry Ice Fumes. Here’s How It Can Happen
- ^ Three die in dry-ice incident at Moscow pool party
- ^ Specialist Public Health Lawyers Instructed After Dry Ice Cocktail Drank at The Alchemist ‘Leaves Man With Severe Stomach Burns’
- ^ Gastric hypothermic injury caused by accidental ingestion of dry ice: endoscopic features
- ^ Chillistick — Frequently Asked Questions
General bibliography[edit]
- Duane, H. D. Roller; Thilorier, M. (1952). «Thilyorier and the First Solidification of a «Permanent» Gas (1835)». Isis. 43 (2): 109–113. doi:10.1086/349402. JSTOR 227174. S2CID 144091865.
- Goroll, Allan H; Mulley, Albert G (2009). Primary Care Medicine: Office evaluation and management of the adult patient. Lippincott Williams & Wilkins. ISBN 978-0-7817-7513-7.
- Häring, Heinz-Wolfgang (2008). Industrial Gases Processing. Christine Ahner. Wiley-VCH. ISBN 978-3-527-31685-4. Retrieved 2009-07-31.
- Housecroft, Catherine; Sharpe, Alan G (2001). Inorganic chemistry. Harlow: Prentice Hall. p. 410. ISBN 978-0-582-31080-3. Retrieved 2009-07-31.
- Keyes, Conrad G (2006). Guidelines for Cloud Seeding to Augment Precipitation. American Society of Civil Engineers. ASCE Publications. ISBN 978-0-7844-0819-3.
- Verma, N. K.; Khanna, S. K.; Kapila, B. (2008). Comprehensive Chemistry for Class XI. New Delhi: Laxmi Publications. ISBN 978-81-7008-596-6. Retrieved 2009-07-31.
- McCarthy, Robert E. (1992). Secrets of Hollywood Special Effects. Boston: Focal Press. ISBN 978-0-240-80108-7.
- Mitra, Somenath (April 2004). Sample Preparation Techniques in Analytical Chemistry. Wiley-IEEE. ISBN 978-0-471-32845-2. Retrieved 2009-07-31.
- Treloar, Roy D. (2003). Plumbing Encyclopaedia (3rd ed.). Wiley-Blackwell. p. 175. ISBN 978-1-4051-0613-9. Retrieved 2009-07-31.
- Yaws, Carl (2001). Matheson Gas Data Book (7th ed.). McGraw-Hill Professional. ISBN 978-0-07-135854-5. 982 pages. Retrieved 2009-07-27.
External links[edit]
Wikimedia Commons has media related to Dry ice.
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Однажды я ходил к другу на день рождения. В праздничной программе были необычные опыты, которые проводили аниматоры. Позже я узнал, что это были опыты с сухим льдом. Они мне очень понравились. Я решил узнать, что это за вещество – сухой лёд, где его используют и в домашних условиях провести опыты с сухим льдом.
Объект исследования: сухой лёд.
Предмет исследования: процесс взаимодействия сухого льда с различными средами.
Цель работы: узнать, что такое сухой лёд, где его используют и в домашних условиях провести опыты с сухим льдом.
Задачи:
1) изучить литературу по теме исследования;
2) определить понятие «сухой лёд»;
3) узнать историю создания сухого льда;
4) познакомиться с технологией получения сухого льда;
5) узнать, в каких сферах используют сухой лёд;
6) выяснить пользу и вред сухого льда;
7) провести опыты с сухим льдом в домашних условиях.
Гипотеза: если помещать сухой лёд в различные среды, то можно наблюдать интересные, яркие и красивые явления.
Методы исследования:
1) анализ литературы;
2) наблюдение;
3) эксперимент;
4) метод обобщения результатов исследования.
При написании данной работы были использованы научная литература, статьи в периодических изданиях Российской Федерации. Основными источниками, раскрывающими теоретические основы работы, явились работы Вукаловича М.П., Алтунина В.В., Тезикова А.Д. В данных источниках подробно рассмотрены понятие, свойства, области применения, условия хранения сухого льда.
Личный вклад автора состоит в том, что обобщена и систематизирована информация о сухом льде, в проведении опытов, которые подтверждают возможность их проведения в домашних условиях.
Глава 1. Теоретическая часть исследования
Определение понятия «сухой лёд»
Как известно, вода имеет три состояния и одним из них является самый обычный лед, получить который даже в домашних условиях не составляет труда. Всё, что для этого нужно, это налить воду в формочку и охладить ее до 0°С. А вот то, что лёд может быть представлен в разном виде известно не каждому. Самым популярным на сегодняшний день является сухой лёд [7].
«Сухой лёд» - это замороженный углекислый газ CO2. При обычных
условиях (атмосферном давлении и комнатной температуре) он переходит
в парообразное состояние, минуя жидкую фазу. Данный процесс называется
сублимация или возгонка [7].
По внешнему виду он напоминает обычный лёд (отсюда название). А
сухим называется потому, что он вовсе не тает, образуя воду, а сразу
переходит в газообразное состояние. Сухой лёд имеет температуру — 78,5ºС [5].
История изобретения сухого льда
Первым создал сухой лёд французский химик Чарльз Тилори. Это произошло в 1834 году. В те времена это открытие не нашло ещё своего потребителя.
Название «сухой лёд» изначально было в 1925 году зарегистрировано как торговая марка американской компанией DryIceCorporationofAmerica, впервые в истории начавшей коммерческое производство сухого льда для продажи его как охладителя [6].
С этого времени в США стали применять «быструю заморозку» и охлаждение продукции с применением сухого льда. В основном, это были продукты питания, перевозимые железнодорожными вагонами. В 1932 году производство сухого льда значительно увеличилось и достигло цифры в 55 тысяч тонн. С этого времени производство и потребление сухого льда стало возрастать и начало приобретать промышленные масштабы.
Одним из важнейших конкурентных преимуществ сухого льда перед обычным льдом является то, что его холодопроизводительность в 2 раза выше, учитывая одинаковую температуру.
Кусочек сухого льда (или гранула) напоминает снег в прессованном виде, а не лёд. Производится сухой лёд в двух видах: гранулированный или блочный.
В настоящее время более востребованным у потребителя считается гранулированный сухой лёд, так как он обладает более плотной структурой, его дозированное применение намного экономичнее и удобнее. Также, использование блочного сухого льда во многих производствах невозможно, поэтому его приходится дробить, применяя крешер – специальный прибор для измельчения сухого льда, данная процедура занимает некоторое время, что является причиной для снижения производительности труда [3].
В промышленных масштабах сухой лёд стал производиться сравнительно недавно: в конце 70-х годов ХХ века.
1.3. Технология получения сухого льда
В промышленности
В сухой лёд переходит углекислый газ при охлаждении и сжатии. Сам газ для сухого льда получают несколькими способами. В промышленности его делают из продуктов разложения доломита или известняка, печных газов. Смесь газов обрабатывают карбонатом калия. Образуется гидрокарбонат, раствор которого при понижении давления и производит углекислоту. Для пищевой промышленности применяют газ из спиртового брожения.
Углекислый газ также получают при разделении воздуха. Он является побочным продуктом извлечения чистого кислорода, аргона и азота.
В лаборатории небольшие количества сухого льда получают путём химической реакции гидрокарбонатов и карбонатов с кислотами [4. С. 28].
В домашних условиях
Для получения сухого льда используется жидкая углекислота, находящаяся под давлением. В домашних условиях получить такое давление невозможно, поэтому можно взять уже готовое вещество. Находится оно, например, в углекислотном огнетушителе типа ОУ. Для получения сухого льда нужно надеть защитные очки и плотные перчатки. Снять пломбу и вынуть предохранительную чеку. Взять плотный мешок и надеть его на раструб огнетушителя. Нажать рычаг и выпустить немного находящейся под давлением углекислоты. Она должна попасть в мешок [4. С. 36].
Свойства сухого льда:
— температура около — 78,5ºС;
— при комнатной температуре и нормальном атмосферном давлении, переходит в парообразное состояние, минуя состояния жидкости;
— не имеет запаха, цвета и вкуса;
— не токсичен;
— не горюч [1. С. 94].
Хранение сухого льда
Сухой лёд хранят в изотермических контейнерах, которые дополнительно охлаждаются. В них сублимация значительно снижается.
В домашних условиях хранить сухой лёд можно в герметичных пенопластовых коробках (толщина стенок пенопласта должна быть не меньше 3 см) помещённых в морозильную камеру. [1. С. 108].
1.4. Области применения сухого льда
Большинство людей считает, что сухой лёд может использоваться только в промышленных целях, однако, на самом деле это не так. Области применения сухого льда обширны и разнообразны.
В пищевой промышленности для охлаждения продуктов
Применяется в морозильных блоках или камерах, где хранятся продукты питания (мороженое и т.д.). Одно из уникальных свойств: при повышении давления сухой лёд испаряется, не оставляя водяных следов, поэтому он очень удобен в эксплуатации [4. С. 48].
Для создания спецэффектов во время театральных постановок Сухой лед используют для демонстрации эффективной и безопасной дымовой завесы. Её можно получить, поместив вещество в специальную дымовую машину [4. С. 48].
В ресторанной сфере для приготовления коктейлей со спецэффектами и оформления столов
Есть целый ряд алкогольных напитков, приготовление которых основывается на использовании диоксида углерода. Если маленький кусочек сухого льда опустить в жидкость, то на её поверхности появятся белые пузыри, дым, и она забурлит. [4. С. 48].
Также с его помощью часто оформляют столы для фуршетов: выкладывают CO2 в красивую посуду на высокой ножке, а в неё помещают блюдо меньшего размера с морепродуктами или на основе свежего фарша. Такая подача эффектно смотрится и сохраняет прохладную температуру[4. С. 49].
Чтобы сделать газированную воду
Опустив небольшой кусочек сухого льда в обычную воду, за считанные секунды можно получить эффект газировки. Такие напитки и в промышленной сфере изготавливают именно с использованием диоксида углерода [4. С. 43].
Для очистки многокомпонентного оборудования, которое не разбирается на мелкие запчасти
Микрочастицы сухого льда хорошо очищают оборудование в типографиях, производственных цехах, проникая во все отверстия машин [4. С. 49].
Для тушения пожаров
По специальной технологии двуокись углерода можно сжать и наполнить ею баллоны, которые предназначены для тушения горючих жидкостей, двигателей и сооружений, находящихся под напряжением. Дело в том, что CO2 не электропроводен, попадая в воздух, он уменьшает концентрацию кислорода, и пожар прекращается [4. С. 45].
Цветоводство
Если вы хотите, чтобы цветы дольше радовали вас, насыпьте на поверхность почвы немного сухого льда, который создаст эффект охлаждения и поможет задержать момент распускания. Чтобы не навредить растению, следите за тем, чтобы оно не соприкасалось с гранулами непосредственно [4. С. 56].
Сантехнические работы
Изредка данное вещество используют в тех случаях, когда нужно изолировать небольшой участок трубопровода. Для этого на него надевают специальный кожух, под который подается жидкий углекислый газ либо закладывается сухой лёд. В процессе испарения он поглощает большое количество тепла, приводя к образованию так называемой «ледяной пробки» (это единственный способ остановить на время циркуляцию воды, если отсутствуют отсечные вентили) [4. С. 54].
Отделочные работы
Если нужно избавиться от старой керамической плитки, то для облегчения работы стоит посыпать её поверхность сухим льдом и подождать, пока он испарится. В результате отдельные элементы сожмутся, и убрать их будет легче. В целом это достаточно трудоёмкий способ, однако он идеально подходит для тех случаев, когда нужно заменить поврежденный фрагмент, состоящий всего из нескольких плиток [4. С. 52].
Медицина
Также сухой лед пользуется популярностью в медицине. С его помощью можно быстро и эффективно заморозить биологические образцы, чтобы затем подвергнуть их анализу или поместить на хранение в специальные резервуары. Сухой лед также широко используется при перевозке донорской крови и трансплантатов [4. С. 51].
1.5. Польза и вред сухого льда
Тот факт, что это вещество используют в таких разных сферах, уже говорит о том, что оно обладает целым рядом полезных свойств. Даже в повседневной жизни мы каждый день сталкиваемся с продуктами, в состав которых входит диоксид углерода, но не замечаем этого.
Полезные свойства газа
Продлевает срок годности продуктов питания.
Диоксид углерода обозначается кодом Е290 и используется как консервант в пищевой промышленности. Его наличие в продукте говорит о том, что сроки хранения увеличены, но при этом все технологические нормы учтены. Он входит в состав консервантов молочной и мясной продукции [6].
Разрыхляет тесто.
Двуокись углерода часто используется кондитерами, потому что этот ингредиент «поднимает» тесто для сладкой выпечки не хуже дрожжей [6].
Удобряет почву, способствуя увеличению урожая.
Правда, применять этот вид удобрения желательно в закрытых помещениях, например, в оранжерее. Сухой лед в газообразном состоянии благотворно влияет на почву и любые растения, улучшая их состояние, продлевая период цветения [7].
Обладает притягивающим ароматом для комаров.
Это позволяет использовать его как приманку для этих насекомых [7].
Помогает бороться с грызунами.
Часто подробленный сухой лед применяют для борьбы с мышами на производстве, где нельзя использовать химические порошки или любую другую отраву. В норку мыши нужно насыпать мелкого сухого льда — он плотно закроет отверстие, не пропуская кислород. Для получения 100% результата важно, чтобы нора не имела еще одного отверстия [6].
Вред сухого льда на организм
Углекислый газ в любом виде считается безопасным для человека веществом. Однако при контакте с CO2 нужно быть внимательным, потому что иногда это вещество всё-таки может привести к проблемам [6].
Какой вред может принести сухой лёд:
Провоцирует проблемы с желудком.
Любители газированной воды должны относиться с чувством меры к такой жидкости. В её составе также есть CO2, и если у человека имеются минимальные проблемы с желудочно-кишечным трактом, это вещество их только усугубит. Самые известные последствия — отрыжка, изжога, вздутие [8].
Может вызвать ожог.
Сухой лёд — жгуче-холодный продукт, температура которого составляет — 78,5ºС. Если работать с ним без перчаток, можно за считанные секунды получить сильный ожог [6].
При неправильном хранении может стать причиной травмы.
Для хранения сухого льда нельзя пользоваться пластиковыми или стеклянными бутылками, потому что в результате испарения это вещество имеет свойство расширяться в сотни раз. Это может стать причиной сильного взрыва, который будет опасен для человека [6].
Может вызывать головокружение.
Несмотря на то, что это вещество безопасно и нетоксично, любые манипуляции с сухим льдом советуют проводить в просторном помещении, где в любой момент можно открыть окна и проверить его. В редких случаях углекислый газ может вызывать лёгкое недомогание [6].
Чтобы не допустить возможного вредного воздействия вещества на кожу, работать стоит без колец на пальцах. Особенно тщательно нужно следить, чтобы ледяная крошка сухого льда не попала в глаза – это может привести к сильному раздражению. Если это случилось, нужно умыться прохладной водой.
Глава 2. Практическая часть исследования
Опыты с сухим льдом в домашних условиях
При проведении опытов с сухим льдом мы заметили следующие интересные явления.
1 опыт
Мы взяли ложку и прижали ею сухой лёд, услышали звук, вызванный микровибрациями ложки при возгонке льда.
2 опыт
В ёмкость с сухим льдом мы добавили воду, окрашенную пищевой краской, вода окрасилась, но газ остался белого цвета.
3 опыт
Я взял маленький кусочек сухого льда закупорил в бутылке с водой и взболтал. Лёд полностью растворился и получилась газированная вода. Но если положить слишком много сухого льда, то бутылка может взорваться. Вкус воды не изменился.
4 опыт
Мы взяли пустую колбу, налили в неё горячую воду и бросили немного сухого льда. Колбу закупорили пробкой. Через несколько секунд пробка выстрелила. Давление – удивительная вещь, именно благодаря ему, пробка выстреливает. [2. С. 73].
5 опыт
Надев перчатку, я взял сухой лёд и бросил в тёплую воду, пошёл пар белого цвета, похожий на кипение воды, вызванный переходом из твёрдого состояния льда в газообразное. Добавив воду погорячее, пар становился гуще.
6 опыт
В ёмкость с тёплой водой мы добавили сухой лёд и жидкое мыло. Появились пузырьки на поверхности воды. Прикоснувшись к пене, пузырики лопнули, газ красиво выбрался наружу.
7 опыт
Мы смазали мылом края ёмкости с водой. Взяли тряпичную ленту и погрузили её в мыло. С помощью мыльной ленты аккуратно натянули на ёмкость мыльную плёнку. Двуокись углерода оказалась запертой внутри и начал надуваться огромный мыльный пузырь.
8 опыт
Надев перчатку, я взял бутылку и в верхней части сделал отверстие. В отверстие вставил трубочку. Насыпал внутрь бутылки сухой лёд. Налил в бутылку немного воды. Опустил конец трубочки в раствор для мыльных пузырей. Получились мыльные пузыри, наполненные углекислым газом.
Заключение
Предметом нашего исследования выступалзамороженный углекислый газ CO2, также известный как сухой лёд. В работе мы рассмотрели его свойства, технологию получения, а также области применения сухого льда. Мы постарались доказать актуальность применения данного вещества и пользу его использования в различных областях жизни.
В данной исследовательской работе мы показали, что области применения сухого льда разнообразны: в домашних условиях, в творчестве (театр), на производстве и даже в медицине.
Больше всего нам понравилось проводить опыты с сухим льдом! Большая часть опытов с сухим льдом основана на одном и том же принципе: при контакте с водой сухой лёд начинает бурно переходить из твёрдого состояния в газообразное, выглядит это как кипение, только со значительно более ярким и характерным парообразованием. Причём, испаряющийся диоксид углерода, тяжелее воздуха и поэтому пар стелется по поверхности окружающей ёмкости с водой, а не поднимается вверх. Его нахождение в тёпловой воде сопровождается очень красивым выделением огромного количества газа. А главное, что этот газ совершенно безопасен.
В результате практической части нашего исследования гипотеза подтвердилась. Я увидел, что если помещать сухой лёд в различные среды, то можно наблюдать очень интересные, яркие и красивые явления.
Цель данной исследовательской работы — узнать, что такое сухой лёд, где его используют и в домашних условиях провести опыты с сухим льдом – достигнута.
Список использованных источников и литературы
Вукалович М.П., Алтунин В.В. Теплофизические свойства двуокиси углерода, – М., 1965.
Геккер. И. Научные эксперименты дома, – 2011.
Перельман Я.И. Занимательная физика. Книга 1. – 1992.
Тезиков А.Д. Производство и применение сухого льда. – М., 1960.
Интересные факты про сухой лёд. URL: https://i-fakt.ru/interesnye-fakty-pro-suxoj-led (дата обращения: 27.10.2018).
Сухой лёд. Задумка. URL: http://www.zadumka.org/suxoj-led (дата обращения: 27.10.2018).
Сухой лёд. Описание, вред и противопоказания. URL: http://vkusnoblog.net/products/suhoy-led (дата обращения: 27.10.2018).
Сухой лёд: предназначение, добыча, варианты использования. URL: https://tutknow.ru/family_and_children/5698-kak-samomu-sdelat-suhoy-led-v-domashnih-usloviyah.html (дата обращения: 27.10.2018).
Для охлаждения и заморозки продуктов, вспенивания яиц и придания блюдам более насыщенного и изысканного вкуса в молекулярной кухне используют сухой лед. Вещество представляет собой замерзшую углекислоту и применяется как альтернатива обычному льду, а также холодильным установкам.
Напоминаем, что у нас есть курс по уникальным техникам декора блюд. Курс включает в себя значительное количество техник молекулярной кухни. Курс подходит для профессионалов и любителей, ознакомиться можно, перейдя по ссылке сейчас. Мы также оставим ссылку в конце статьи, чтобы Вы могли ознакомиться с курсом после ее прочтения.
Также мы проводим онлайн мастер-классы по молекулярной кухне, анонсы можно посмотреть здесь
История применения сухого льда
Это вещество придумали во Франции в начале 19 века, но впервые в коммерции оно было применено в 20-х годах ХХ века в США. Это весьма ценный продукт, поскольку он трансформируется в газ, минуя жидкостную фазу. Кроме того, обычный лед дает в два-три раза меньше холода, чем сухой в одинаковых температурных режимах.
Обычно его используют для охлаждения продуктов питания, мороженого в розничной продаже, пива, минеральной воды и пр., когда охлаждение при помощи холодильника нежелательно или по каким-либо обстоятельствам технически невозможно.
Что такое сухой лед
Диоксид углерода (СО2) или замерзшая углекислота в стандартных условиях (при температуре ~20 °C и атмосферном давлении 760 мм) превращается в газ, не трансформируясь в жидкое состояние. В природе бывает только в виде газа без цвета и запаха, который на 59 % превышает вес воздуха. Атмосфера нашей планеты содержит 0,03 % углекислого газа, без которого невозможно существование биосферы Земли.
Как сделать сухой лед в промышленных и домашних условиях
Изготавливается сухой лед при помощи несложного, но ответственного процесса. На первом этапе углерод превращают в двуокись, затем диоксид (СО2) в газообразном состоянии. Полученную субстанцию сжимают до 5 атмосфер, равномерно и одновременно опуская температуру до минус 56,4 °C, превращая в жидкую среду. Затем давление опускают, и расширившаяся жидкость двуоксида углерода испаряется с интенсивным поглощением тепла. В промышленности, газ для синтеза диоксида в лед, получают из производных разложения известняка, доломита и печных газообразований.
Процесс быстрого охлаждения препятствует испарению всего диоксида, оставшаяся субстанция твердеет, кристаллизуется в виде снегообразных хлопьев и обращается в твердый диоксид углерода (СО2). Для превращения хлопьев в полноценный продукт, их спрессовывают в брикеты весом до 30 кг или цилиндры диаметром до 10 мм.
Ошибочно полагать, что сухой лед в домашних условиях изготовить невозможно. Технология его получения достаточно простая. Главное — найти сырье. Как источник жидкой углекислоты можно использовать огнетушитель с пометкой «ОУ» (углекислотный).
Как приготовить сухой лед своими руками? Поможет пошаговая инструкция.
- Наденьте перчатки и защитные очки.
- Вставьте в мешок раструб огнетушителя и закрепите скотчем.
- Выпустите газ из огнетушителя, сняв с предохранителя рычаг подачи. Через 3–4 секунды закройте кран.
- Извлеките шланг огнетушителя из мешка. В емкости вы обнаружите белую массу, похожую на пенопласт.
- Переложите готовый продукт в подходящий резервуар.
Как и где хранить сухой лед?
Для увеличения срока годности спрессованные брикеты помещают в предназначенные для длительного хранения сухого льда термоизоляционные боксы. Для транспортировки используют переносные контейнеры.
Использование специальных резервуаров обязательно. Если не создать правильных условий хранения, сухой лед испарится. В бытовых условиях можно воспользоваться:
- контейнером для хранения замороженной продукции;
- формой для льда с крышкой;
- термосом.
Техника безопасности при работе с сухим льдом
- Температура вещества — минус 78,5 °C, поэтому для работы необходимо надевать теплоизоляционные перчатки. Брать лед голыми руками запрещено, поскольку даже непродолжительный контакт с незащищенным кожным покровом может вызвать обморожение.
- Раскалывая или распиливая диоксид в брикетах, необходимо использовать плексигласовую защитную маску или прочные очки во избежание попадания на лицо осколков вещества.
- Работая с веществом, необходимо использовать только сухие перчатки (рукавицы), т. к. мокрые мгновенно замерзают и пристают к коже — риск обморожения гарантирован.
- Манипуляции с использованием диоксида углерода должны осуществляться в помещении с качественной вентиляцией. Если в нем присутствуют люди или домашние животные, меры предосторожности необходимо утроить.
- Категорически запрещено хранить вещество в плотно закрываемых емкостях (банках с закручивающимися крышками, ПЭТ таре и пр.) Это чрезвычайно опасно, поскольку при интенсивном испарении, диоксид расширяется в 800 раз. Взорвавшись, емкость может нанести увечья окружающим.
Углекислота, испаряемая при трансформации диоксида, в 1,5 раза тяжелее воздуха, поэтому опускается вниз. При невысокой концентрации смесь не взрывоопасна. Однако во избежание форс-мажорных ситуаций проводить долгосрочные работы с этим веществом следует на свежем воздухе или в хорошо вентилируемых, просторных помещениях.
Охлаждение продуктов посредством диоксида углерода обладает рядом существенных преимуществ.
- Хорошо известно, что длительное хранение замороженных продуктов снижает их пищевую, вкусовую и энергетическую ценность. Использование быстрого замораживания повышает срок хранения в полтора-два раза. Таким образом, удается снизить порчу продуктов на предприятиях общепита и в домашних условиях.
- На крупных предприятиях освобождаются сотрудники, ранее занимавшиеся лишней работой: переборкой и сортированием продуктов для реализации в торговых сетях либо подготовке к изготовлению субпродуктов или готовой продукции.
- Многократно снижаются затраты, ранее идущие для ведения домашних и подсобных хозяйств.
- Использование технологии сухого замораживания позволило без труда производить большие запасы продуктов питания в разнообразном ассортименте. Сухой лед дает возможность реализовать продукцию в гипермаркетах и оптово-торговых центрах круглый год.
- Предварительная обработка посредством сухого льда и быстрой заморозки возможна с любыми продуктами, получаемыми от животных и птицы: мяса, мясопродуктов, рыбы и ее производных, кисломолочных и яичных продуктов, различных жиров. Особенно эффективна быстрая заморозка при переработке мяса и мясопродуктов, т. к. они не теряют своих биологических и вкусовых характеристик.
- Быстрая заморозка сохраняет на длительное время полезные свойства продуктов, а также витамины и микроэлементы. В них приостанавливаются, но сохраняются гистологические, микробиологические, физико-химические и биохимические процессы, влияющие на энергетическую и гастрономическую ценность продуктов и отвечающие за их сохранность.
Молекулярная гастрономия с использованием диоксида углерода
В молекулярной кулинарии сухой лед —незаменимый помощник в приготовлении самых изысканных блюд и десертов. Главное преимущество: его легко достать даже начинающему кулинару — это обычная углекислота, замороженная особым способом.
Сухой лед оказывает влияние на органы осязания и обоняния, многократно усиливая их чувствительность к вкусу и аромату блюд. В ресторанах молекулярной гастрономии одним из первых открыл и сумел оценить уникальные свойства данной субстанции шеф-повар из Англии Хестон Блюменталь. Подавая гостям блюда, приготовленные в его молекулярной кухне, маэстро поливал лед изобретенной им ароматической жидкостью. Рассеиваясь по столу вместе с газом, изысканные ароматы окутывали гостей, позволяя по-новому оценить вкус ранее опробованных блюд.
При помощи этой технологии преображается и без того изысканное блюдо называемое «Перепелиный студень», суп-пюре из лангустов, трюфели и «Десерт из утиной печени». Подают блюда к столу с дубовым лотком, в который засыпаются осколки диоксида и мох дуба. После определенных манипуляций, начинает струиться густой ароматический туман. Впечатления поистине потрясающие!
Также сухой лед в молекулярной кухне используется для вспенивания яиц и кисломолочных продуктов (йогуртов, коктейлей), для газирования алкогольных и безалкогольных напитков и даже овощей и фруктов. Это вещество позволяет сохранять свежесть трюфелей и полезные свойства зеленых салатов. Уникальные физические характеристики диоксида открывают перед кулинарами колоссальные перспективы и возможности для полета творческой фантазии!
Еще раз напомним, что у нас есть курс по уникальным техникам декора блюд. Курс включает в себя значительное количество техник молекулярной кухни. Курс подходит для профессионалов и любителей, ознакомиться можно, перейдя по ссылке сейчас. Также мы проводим онлайн мастер-классы по молекулярной кухне, анонсы можно посмотреть здесь.
Сухой лёд, свойства, получение и применение.
Сухой лёд – это твёрдая форма углекислого газа – бинарного химического соединения углерода и кислорода, имеющее формулу CO2.
Сухой лёд, формула, молекула, строение, состав, вещество
Требования безопасности при обращении с сухим льдом
Физические свойства сухого льда
Получение сухого льда
Применение сухого льда
Сухой лёд, формула, молекула, строение, состав, вещество:
Сухой лёд – это твёрдый углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид).
Сухой лёд – это твёрдая форма углекислого газа – бинарного химического соединения углерода и кислорода, имеющее формулу CO2.
Химическая формула сухого льда такая же как у обычного углекислого газа CO2.
Строение молекулы сухого льда, структурная формула сухого льда аналогичны строению и структурной формуле углекислого газа:
При обычных условиях (атмосферном давлении и комнатной температуре) сухой лёд переходит в газообразное состояние, минуя жидкую фазу. Однако переход из твердого состояния в газообразное достаточно медленный. В связи с этим при контакте с твердой двуокисью углерода веществом достаточно быстро наступает обморожение, которое может стать критическим.
Температура сублимации при нормальном атмосферном давлении равна −78,5 °С (194,65 K). При возгонке поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
По внешнему виду сухой лёд напоминает обычный лёд (отсюда название) или снегоподобную массу. Но в отличие от водяного льда он имеет температуру в -78,5°C. Имеет кислый «содовый» запах.
Сухой лёд сжимается в небольшие гранулы или более крупные блоки.
Плотность сухого льда около 1560 кг/м³.
Растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Нерастворенная в воде часть углекислого газа улетучивается, вызывая быстрое понижение температуры жидкости и образуя над водой плотный туман, который представляет опасность для жизни и здоровья из-за высокого содержания в нем CO2 и снижения объемной доли кислорода. В свою очередь жидкость может затвердеть. Туман от сухого льда парит над землей или поверхностью предмета (жидкости и т.п.).
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Твердая двуокись углерода нетоксична, невзрывоопасна.
Сухой лёд (как и углекислый газ) препятствует ростку бактерий, вирусов и гниению продуктов.
В остальном свойства сухого льда аналогичны свойствам углекислого газа.
Требования безопасности при обращении с сухим льдом:
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
Твердая двуокись углерода нетоксична, невзрывоопасна.
Твердая двуокись углерода может вызывать обмораживание кожи и поражение слизистой оболочки глаз.
Брать твердую двуокись углерода незащищенными руками не разрешается. При измельчении и фасовке сухого льда рекомендуется надевать защитные очки и рукавицы.
Обслуживающий персонал должен иметь: противогаз шланговый изолирующий, защитные очки, суконные рукавицы, телогрейку.
Газообразная двуокись углерода, содержащаяся в воздухе рабочей зоны до 0,5% по объему, не представляет опасности для здоровья; при более высоком содержании – оказывает вредное влияние на здоровье человека.
Двуокись углерода тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода, снижая содержание кислорода в воздухе, что может вызвать явления кислородной недостаточности и удушья.
Помещения для производства твердой двуокиси углерода, а также помещения для хранения контейнеров, заполненных двуокисью углерода, должны быть оборудованы общеобменной приточно-вытяжной и аварийной вентиляцией.
(см. ГОСТ 12162-77 «Двуокись углерода твердая. Технические условия», ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
Физические свойства сухого льда:
| Наименование параметра: | Значение: |
| Химическая формула | CO2 |
| Синонимы и названия иностранном языке | углекислый газ (рус.)
углерода двуокись (рус.) углерода диоксид (рус.) угольный ангидрид (рус.) оксид углерода (IV) carbon dioxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | лёд или снегоподобная масса |
| Цвет | бесцветный или белый |
| Вкус | кисловатый вкус |
| Запах | кисловатый «содовый» запах |
| Агрегатное состояние (при температуре менее –78,5 °C и атмосферном давлении 1 атм.) | твердое вещество (при повышении температуры возгоняется) |
| Плотность (состояние вещества – твердое вещество, при -79 °C и атмосферном давлении 1 атм.), кг/м3 | 1561 |
| Плотность (состояние вещества – твердое вещество, при -79 °C и атмосферном давлении 1 атм.), г/см3 | 1,561 |
| Плотность (состояние вещества – жидкость, при -60 °C и атмосферном давлении 1 атм.), кг/м3 | 1190 |
| Плотность (состояние вещества – жидкость, при -60 °C и атмосферном давлении 1 атм.), г/см3 | 1,19 |
| Плотность (состояние вещества – жидкость, при -37 °C и атмосферном давлении 1 атм.), кг/м3 | 1101 |
| Плотность (состояние вещества – жидкость, при -37 °C и атмосферном давлении 1 атм.), г/см3 | 1,101 |
| Плотность (состояние вещества – жидкость, при 0 °C и атмосферном давлении 35,5 атм.), кг/м3 | 925 |
| Плотность (состояние вещества – жидкость, при 0 °C и атмосферном давлении 35,5 атм.), г/см3 | 0,925 |
| Плотность (состояние вещества – газ, при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,9768 |
| Плотность (состояние вещества – газ, при 0 °C и атмосферном давлении 1 атм.), г/см3 | 0,0019768 |
| Температура сублимации (возгонки), °C | -78,5 |
| Молярная масса, г/моль | 44,01 |
| Растворимость в воде, г/100 г | 0,3803 при 16 °C,
0,3369 при 20 °C, 0,2515 при 30 °C |
| Удельная теплота испарения, кДж/кг | 379,5 |
| Удельная теплота плавления, кДж/кг | 205 |
| Энтальпия плавления ΔHпл, кДж/моль | 8,37 |
| Энтальпия возгонки ΔHвозг, кДж/моль | 25,23 |
| Давление паров, мм.рт.ст. | 0,000001 (при -186,4°C),
0,00001 (при -180,7°C), 0,0001 (при -174,3°C), 0,001 (при -166,8°C), 0,01 (при -158°C), 2,31 (при -130°C), 9,81 (при -120°C), 34,63 (при -110°C), 104,81 (при -100°C), 279,5 (при -90°C), 672,2 (при -80°C), 1486,1 (при -70°C), 3073,1 (при -60°C), 5127,8 (при -50°C), 7545 (при -40°C), 10718 (при -30°C), 14781 (при -20°C), 19872 (при -10°C), 26142 (при 0°C), 33763 (при 10°C), 42959 (при 20°C), 54086 (при 30°C) |
Получение сухого льда:
В промышленности сухой лёд получают путем охлаждения углекислого газа при высоком давлении.
Применение сухого льда:
Сухой лёд используют в различных областях промышленности и быту:
– в качестве охлаждающего средства для сохранения и охлаждения пищевых продуктов, медикаментов и пр. при их транспортировке и хранении без использования холодильных установок. В отличии от воды сухой лёд «таит», не оставляя воды;
– в качестве охлаждающего средства для быстрой заморозки пищевых продуктов, лабораторных образцов и пр.;
– в качестве охлаждающего средства для быстрой заморозки разливов нефти;
– в качестве охлаждающего вещества в различных промышленных процессах;
– для создания визуальных эффектов (на концертах, театрах и пр.);
– в пищевой промышленности для газирования напитков, изготовления мороженого и пр.;
– как источник углекислого газа для защиты пищевых продуктов от насекомых и других вредителей без использования токсичных веществ в складских помещениях и контейнерах;
– в медицине;
– в системах пожаротушения и в огнетушителях;
– для струйной очистки различных поверхностей и оборудования (т.н. метод криогенного бластинга);
– в сельском хозяйстве для обеспечения сохранности зерна, т.к. углекислый газ замедляет процессы жизнедеятельности в заложенном на хранение зерне, что позволяет сохранять его дольше, чем без его применения, а также подавляет дыхание и препятствует жизнедеятельности вредоносных микроорганизмов и насекомых-вредителей;
– в цветоводстве для обеспечения сохранности цветов, т.к. поддержание стабильной низкой температуры значительно замедляет процесс цветения;
– в животноводстве для клеймения рогатого скота и лошадей;
– для борьбы с грызунами. Гранулированный сухой лед засыпают в нору грызуна, спустя некоторое время углекислый газ вытесняет из нее кислород;
– в химической промышленности для замедления многих химических реакций.
Примечание: © Фото https://www.pexels.com, https://pixabay.com.
Коэффициент востребованности
2 926
Муниципальное общеобразовательное учреждение города Новосибирска
«Средняя общеобразовательная
школа № 211 имени Леонида Ивановича Сидоренко»
Школьная открытая научно-практическая конференция
Секция: естественно-научная
Тема: «СУХОЙ ЛЕД»
Автор:
Зайкова Елизавета,
6в кл., МАОУ СОШ № 211
им. Л.И.Сидоренко
Калининского района г. Новосибирска
Научный руководитель:
Дудник Светлана Евгеньевна,
учитель химии высшей
квалификационной категории
конт. тел. 8-905-095-0022
Новосибирск 2018
Оглавление
Введение……………………………………………………………………………………3
1. Теоретическая часть исследования. Обзор литературы………………………………5
- Определение и свойства «сухого льда»
- История изобретения
- Производство «сухого льда»
- Применение «сухого льда»
- Кристаллическая решетка «сухого льда»
2. Практическая часть исследования……………………………………………………..9
2.1. Изготовление кристаллической решетки «сухого льда»
2.2. Сравнение кристаллических решеток «сухого льда» и воды.
Выводы……………………………………………………………………………………..11
Использованная литература и Интернет-источники……………………………………12
Введение
Актуальность темы исследования. Посмотрев видео-эксперименты с «сухим льдом», у нас сразу возникло множество вопросов:
- почему это вещество называют льдом?
- почему этот лед называется «сухим»?
- чем «сухой лед» отличается от обычного льда и какие сходства имеют эти вещества?
- какими свойствами обладает и где еще его можно использовать?
Как известно вода имеет три состояния и одним из них является обычный лед, получить который даже в домашних условиях не составляет труда. Достаточно остудить воду до температуры, близкой к 0⁰С, предварительно взяв любую формочку. В то же время, далеко не каждому известно, что лед может быть представлен в различных формах. Наиболее популярен в настоящее время «сухой лед», так как главным его преимуществом перед обычным льдом является выделение колоссального количества холода. Это и многие другие свойства «сухого льда» массово используются в различных отраслях и в быту, что подтверждает актуальность данного исследования.
Предмет исследования: «сухой лёд».
Гипотеза: «сухой лед» имеет сходство с твердым состоянием воды — льдом в строении и свойствах.
Цель исследования – изучить и экспериментально продемонстрировать строение кристаллической решетки «сухого льда».
Задачи исследования:
1. Изучить литературу о «сухом льде» и его свойствах;
2. Узнать о строении кристаллической решетки «сухого льда» и воды.
3. Изготовить модели кристаллических решеток «сухого льда» и воды.
4. Выявить сходства и отличия «сухого льда» от обычного льда;
Практическое применение: Полученные результаты могут быть использованы на уроках по физике и химии при изучении свойств веществ (твердое, газообразное, жидкое).
Положения, выносимые на защиту:
1. «Сухой лед» — это углекислый газ в твердом состоянии, обладающий уникальными свойствами;
2. «Сухой лед» — широко используемое вещество, как в промышленности, так и в повседневной жизни;
3. «Сухой лед» и обычный лед – это различные вещества, но имеющие некоторые сходства.
В работе использовались следующие методы:
1. Сбора информации;
2. Анализа и статистической обработки собранной информации;
3. Моделирования;
4. Сравнения и обобщения полученных результатов.
Данная научно-исследовательская работа нацеливает исследователя к самостоятельности, формирует интерес к научной деятельности, умению работать с дополнительной литературой, развивает исследовательские навыки, позволяет мыслить, рассуждать, делать выводы.
1. Обзор литературы
1.1. Определение и свойства «сухого льда»
«Сухой лед» — это углекислый газ в твердом состоянии, он именуется также диоксидом углерода. Формула вещества – CO2. Это стерильное, твердое, не токсичное, очень холодное вещество белого цвета без запаха и вкуса. Он не горит и не проводит ток. По внешнему виду «сухой лед» напоминает обыкновенный лёд. Свое название он получил за главную физическую особенность: под влиянием высокой температуры «сухой лед» минуя жидкое состояние, сразу превращается в газ – это называется сублимацией. Холодящее действие «сухого льда» гораздо сильнее, чем у льда обыкновенного. Один килограмм «сухого льда» может заменить 15 килограмм льда из воды, а испаряется он в 5 раз медленнее, чем тает обыкновенный лед. Температура замерзания «сухого льда» -79˚С, молекулярный вес 44,01, плотность 1560 кг/м³. Он в полтора раза тяжелее воздуха и воды, хорошо растворяется в жидкостях.
1.2. История изобретения
Впервые «сухой лед» изобрел во Франции химик Адриен-Жан-Пьер Тилори в 1834 году. В своих экспериментах ученый заметил, что при открытии крышки сосуда с жидкой углекислотой, она быстро испарялась, а в сосуде оставалось вещество, похожее на снег – это был углекислый газ в твердом состоянии. В 1835 году он опубликовал первый отчет о данном веществе. В промышленности «сухой лед» начали использовать только спустя 50 лет для производства газированных напитков. В 1924 году, Томас Слейт получил первый патент на продажу «сухого льда» в США, и стал первым, кто превратил производство «сухого льда» в целую индустрию. В 1925 году этот продукт был зарегистрирован под торговой маркой «Dry ice» (в переводе с английского «сухой лед») компанией «Dry Ice Corporation of America». В этом же году компания начала продавать «сухой лед», продвигая его как отличное средство для заморозки и охлаждения. В 1940 году научились производить жидкий углекислый газ.
Совсем недавно на Марсе были обнаружены плотные облака из «сухого льда, которые создают тень на планете. Обнаружена и первая марсианская река из «сухого льда». В ходе анализа данных, полученных автоматическими космическими станциями, было выявлено, что марсианской весной потоки несутся по каньонам, заполненным льдом и снегом из углекислого газа при температуре -130 ˚С. Вода не может течь в таких условиях, так что, скорее всего, в марсианских каньонах течет «сухой лед». Это значимое открытие может развеять все иллюзии относительно наличия жизни на Марсе. Ведь без воды в жидком состоянии жизни быть не может!
1.3. Производство «сухого льда»
Промышленный способ получения «сухого льда» был разработан в 1923 году. Производится «сухой лед» на огромных углекислых установках из газообразного или жидкого углекислого газа. При резком снижении давления из углекислого газа образуется рыхлый снег. Затем этот снег прессуется под давлением 30-50 атмосфер и получается «сухой лед». Современные установки выпускают «сухой лед» в виде крошки, гранул и брикетов.
1.4. Применение «сухого льда»
«Сухой лед» пользуется большой популярностью в медицине. Его используют используют при транспортировке донорской крови, трансплантатов, а также медицинских препаратов. Кроме того, «сухой лед» иногда используется для удаления бородавок, папиллом, сухих мозолей, а также в сфере ритуальных услуг.
В настоящее время широкое распространение получила очистка поверхностей «сухим льдом» (криогенный бластинг). При помощи «сухого льда» загрязнения мгновенно охлаждаются до -79°C, становятся хрупкими и легко удаляются. Данный метод не имеет аналогов, поскольку во время чистки не остается никаких следов и отходов. В Новосибирском электровозоремонтном заводе недавно была внедрена первая в России установка гранулированной очистки льдом «УГОЛ-1». Очистка «сухим льдом» справляется со всеми типами загрязнений, которые только могут встречаться в салоне автомобиля. Поскольку в автомобиле находится большое количество электроники, то использование любой жидкости может привести к короткому замыканию и поломке дорогостоящего устройства. В связи с тем, что гранулы «сухого льда» в процессе сублимации сразу же переходят в газообразное состояние, минуя жидкое, нет опасности короткого замыкания, и необходимости последующей сушки.
Свойство «сухого льда» выделять за короткое время большое количество холода применяется на сборочных производствах для соединения или разбора плотно соединенных друг с другом деталей. Металлы в процессе охлаждения сжимаются, в результате уменьшается размер изготовленной из них детали, что дает возможность установить ее на нужное место. По мере нагревания деталь снова расширяется, обеспечивая тем самым высокую надежность соединения.
В химической промышленности «сухой лед» выполняет функцию ингибитора, то есть вещества, замедляющего протекание некоторых химических реакций. С помощью «сухого льда» охлаждают компьютерные процессоры.
По специальной технологии углекислый газ можно сжимать и наполнить им баллоны, которые предназначены для тушения горючих жидкостей, двигателей и сооружений, находящихся под напряжением. Дело в том, что CO2 не электропроводен, попадая в воздух, он уменьшает концентрацию кислорода, и пожар прекращается.
Часто подробленный «сухой лед» применяют для борьбы с грызунами на производстве, где нельзя использовать химические порошки. «Сухой лед» используют для устранения насекомых в закрытых контейнерах, где хранятся зерновые продукты.
«Сухой лед» замедляет рост дрожжевых бактерий, что нашло широкое применение в хлебопекарной промышленности.
«Сухим льдом» удобряют почву, способствуя увеличению урожая.
Гранулы «сухого льда» используются в пищевой промышленности для охлаждения пищевых продуктов при их транспортировке и хранении. Например, «сухой лед» в самолетах попросту незаменим, так как позволяет охлаждать продукты питания. Часто его используют в уличных передвижных ларьках с мороженым. «Сухой лед» имеет замораживающую способность, многократно превышающую замораживающую способность водяного льда, это свойство используется для заморозки мясной, рыбной и плодово-ягодной продукции. Поскольку процесс происходит очень быстро, то в продуктах сохраняется больше полезных веществ, и сохраняется их внутренняя структура.
«Сухой лед» обозначается кодом Е290 и используется как консервант в пищевой промышленности. Он продлевает срок годности продуктов питания. С помощью CO2 газируют напитки: шампанское, лимонад, минеральную воду и т.д. Это вещество охотно закупают такие крупные компании, как «Кока-Кола».
«Сухой лед» способен исправить вмятины на капоте автомобиля.
В научно-исследовательских работах «сухой лед» применяется для получения низких температур (-79°С). Учёные из университета Флоренции на основе «сухого льда» открыли сверхпрочное стекло для защиты электронных устройств. С помощью «сухого льда» можно даже менять погоду. Если при ясном небе быстро сбросить «сухой лед» в восходящие потоки воздуха, то через некоторое время появятся облака.
В сфере развлечений «сухой лед» используется для образования безвредного сценического дыма при проведении концертов, спектаклей, фотосессий. Его можно получить, поместив вещество в специальную дымовую машину (генератор тумана). В состав этого генератора входят емкость с сухим льдом и емкость с подогреваемой водой. При быстром нагревании «сухого льда» его испарения создают плотный туман, который охлаждает окружающий воздух. На основе «сухого льда» создается большое количество коктейлей, которые отличаются оригинальной подачей.
1.5. Кристаллическая решетка «сухого льда»
Льдом иногда называют некоторые вещества в твёрдом агрегатном состоянии, которым свойственно иметь жидкую или газообразную форму при комнатной температуре; в частности, сухой лёд, аммиачный лёд или метановый лёд.
Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
В зависимости от частиц кристаллической решетки существуют:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- Металлическая кристаллическая решетка.
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул. Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия.
У «сухого льда» кубическая молекулярная кристаллическая решетка. В узлах таких кристаллических решеток расположены молекулы СО2 (углекислый газ).
Молекулярная кристаллическая структура твердого состояния воды – шестиугольники, в узлах которых находятся молекулы воды (Н2О).
2. Практическая часть исследования
2.1. Изготовление кристаллической решетки «сухого льда»
Изучив в литературных источниках информацию о строении «сухого льда» и кристаллической воды, мы смоделировали кристаллические решетки веществ.
Молекулярная формула «сухого льда» — СО2 (диоксид углерода, углекислый газ).
Условные обозначения: Углерод – черный
Кислород – красный
Кристаллическая решетка «сухого льда»: молекулярная кубическая объемно-центрированная.
2.2. Сравнение кристаллических решеток и свойств «сухого льда» и воды.
Проведя сравнение кристаллического состояния «сухого льда» и воды, результаты оформили в таблице.
|
Параметры сравнения |
«Сухой лед» |
Вода |
|
Химическая формула |
СО2 |
Н2О |
|
Вид кристаллической решетки |
Молекулярная |
Молекулярная |
|
Физические свойства (для твердого состояния) |
Без вкуса запаха и цвета. Цвет белый. Тяжелее воздуха и воды. Температура плавления -79оС |
Без запаха и вкуса. Прозрачный. Легче воды. Температура плавления 0оС |
|
Изменения при повышении температуры |
Из твердого состояния сразу переходит в газообразное (сублимация). |
Из твердого переходит в жидкое, затем в газообразное состояние. |
|
Отношение к горению |
Не поддерживает горение |
Поддерживает горение |
Таким образом, «Сухой лед» по своему внешнему облику очень похож на обычный лед (отсюда и название). Они оба не имеют запаха и вкуса. Однако это принципиально разные вещества с разными свойствами.
«Сухой лед» — это углекислый газ в твердом состоянии, а обычный лед – это вода в твердом состоянии. В этом я убедилась, посмотрев следующий эксперимент в Интернете: на одной салфетке — кусочек «сухого льда», а на другой – обычный. Салфетка под обычным льдом стала мокнуть, поскольку лед тает с образованием воды. «Сухой лед» стал покрываться паром, и салфетка под ним не намокла, потому что «сухой лед» не тает, а испаряется, сразу переходя в углекислый газ (сублимация). Испаряется «сухой лед» в 5 раз медленнее, чем тает обыкновенный лед.
По внешнему виду они тоже отличаются: «сухой лед» белого цвета, а обычный лед – прозрачный.
Плотность этих веществ различна: обычный лед легче воды, а «сухой лед» — тяжелее воды. Я взяла два стакана, налила в них воды. В первый стакан я бросила кусочек «сухого льда», а во второй – обычного льда. «Сухой лед» утонул, поскольку его плотность больше, чем плотность воды, а обычный лед всплыл на поверхность воды, так как его плотность меньше, чем плотность воды.
Обычный лед поддерживает горение, так как оно происходит с помощью кислорода, который входит в состав молекулы воды. В этом можно легко убедиться, если поместить обычный лед в емкость и зажечь в ней, например, свечу, то она будет продолжать гореть. А вот «сухой лед» не горюч, поэтому в емкости с ним пламя свечи моментально погаснет. Это объясняется тем, что «сухой лед» состоит из углекислого газа, который не поддерживает горение.
Температура замерзания обычного льда 0 ˚С, а «сухого льда» -79 ˚С, поэтому обычный лед можно держать в руках длительное время, а вот с «сухим льдом» нужно работать в перчатках, чтобы не получить обморожение пальцев. Холодящее действие «сухого льда» гораздо сильнее, чем у льда обыкновенного, ведь один килограмм «сухого льда» может заменить пятнадцать килограммов льда из воды. Таким образом, «сухой лед» и обычный лед – это совершенно разные вещества с различными свойствами.
Заключение
Предметом нашего исследования был «сухой лед». В данной работе мы изучили его свойства, структуру, технологию изготовления, области применения, выявили сходства и отличия от обычного льда.
Отрасли, в которых используется «сухой лед» обширнее и разнообразнее, чем кажется на первый взгляд. Хозяйкам он необходим на кухне, артистам – на сцене, инженерам – на предприятиях, врачам – в клиниках и т.д. С каждым годом возникает все больше областей для применения «сухого льда», и в перспективе перечень его использования будет только возрастать.
В результате исследования подтвердилась гипотеза о том, что «сухой лед» имеет сходство с твердым состоянием воды — льдом в строении и свойствах.
Получены новые знания о свойствах «сухого льда». Выявлены принципиальные отличия между «сухим» и обычным льдом, которые обусловлены различным строением и свойствами этих веществ.
Результатом исследования стала модель кристаллической решетки «сухого льда», которая в дальнейшем может быть использована на уроках физики и химии в изучении школьного материала.
Использованная литература и Интеренет-источники
- Гибадулин В., Краснова М. «Большая иллюстрированная энциклопедия школьника. Издательство: Махаон, 2014 г.
- https://tutknow.ru/family_and_children/5698-kak-samomu-sdelat-suhoy-led-v-domashnih-usloviyah.html
- https://suhoy-led.ru/dlya-chego-nuzhen-suhoj-lyod
- http://sd-dry-ice.ru/p/q-075.php
- https://ru.wikipedia.org/wiki/%D0%9B%D1%91%D0%B4
Интересные факты про сухой лед

По внешнему виду напоминает он напоминает обыкновенный лёд, отсюда и название. Вырабатывается такой лед на углекислотных установках и используется в основном для охлаждения пищевых продуктов, в научно-исследовательских работах для получения низких температур, при испытаниях и сборке некоторых агрегатов в машиностроении, а также при создании эффектов в шоуиндустрии, удалении бородавок и многих других областях.
Температура замерзания сухого льда при нормальном давлении — минус 78,5˚ С. Технический «сухой лёд» имеет плотность около 1560 кг/м³, при возгонке поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
ГОСТ 12162-77: Сухой лёд (диоксид углерода) — низкотемпературный продукт, получаемый из жидкой или газообразной двуокиси углерода. Нетоксичен. Цвет — белый.
Интересные факты о сухом льде:
Первым в 1834г. создал сухой лед французский химик Чарльз Тилори. Однако промышленное производство наладили только спустя полвека.
В полярных областях Марса обнаружены дюны, покрытые твердым углекислым газом — сухим льдом.
1 кг сухого льда может заменить 15 кг льда из воды. А испаряется сухой лед в 5 раз медленнее, чем тает обыкновенный лед.
Бросив в пламя несколько кусочков сухого льда, можно быстро потушить горящий бензин. Существуют даже углекислотные огнетушители.
Облака, которые не дают ни капли дождя, можно «посыпать» сверху с самолетов дробленым на мельчайшие кристаллики сухим льдом. Сухой лед охлаждает облака и вызывает осадки.
Если к куску сухого льда прижать ложку, то можно услышать писк, вызванный микровибрациями ложки при возгонке льда.
Если кусок сухого льда бросить в воду, то можно будет наблюдать эффект кипения воды, вызванный переходом из твердого состояния льда в газообразное.
Несмотря на низкую температуру сухого льда, его можно трогать без защитных перчаток непродолжительное время.
Если маленький кусочек сухого льда закупорить в бутылке с водой и взбалтывать, то он растворится и получится газированная вода. Однако, если положить слишком много, бутылка может взорваться.