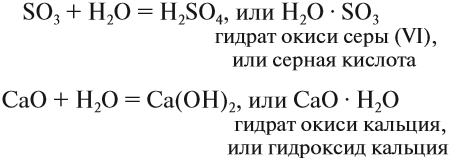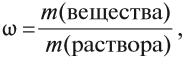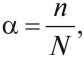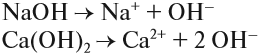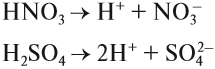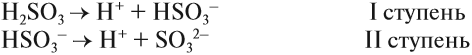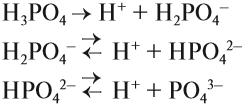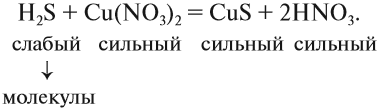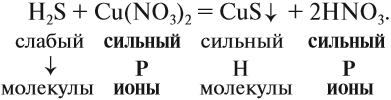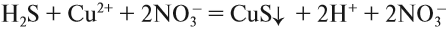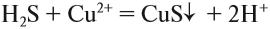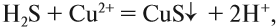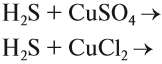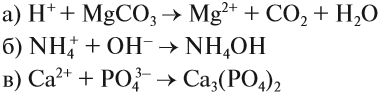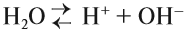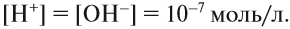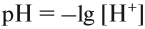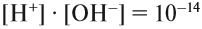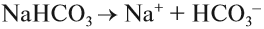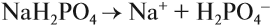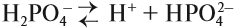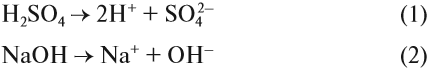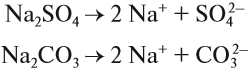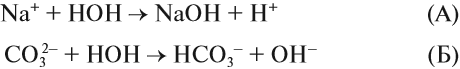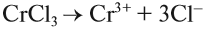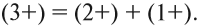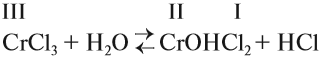Содержание
- Понятие о растворах
- Электролитическая диссоциация
- Ионно-молекулярные уравнения реакций
- Понятие о рН (водородном показателе)
- Гидролиз солей
- Выводы
Понятие о растворах
Нет на Земле человека, который никогда не видел бы растворов. А что это такое?
Раствор — это однородная (гомогенная) смесь двух или более компонентов (составных частей, или веществ).
Что такое однородная смесь? Однородность смеси предполагает, что между составляющими её веществами отсутствует поверхность раздела. В этом случае невозможно, по крайней мере, визуально, определить, сколько веществ образовало данную смесь. Например, глядя на стакан водопроводной воды, трудно предположить, что в ней, кроме молекул воды, содержится еще добрый десяток ионов и молекул (О2, СО2, Са2+ и другие). И никакой микроскоп не поможет увидеть эти частицы.
Но отсутствие поверхности раздела — не единственный признак однородности. В однородной смеси состав смеси в любой точке одинаков. Поэтому для получения раствора нужно тщательно перемешать образующие его компоненты (вещества).
Растворы могут иметь разное агрегатное состояние:
- газообразное (например, смесь газов: О2, N2, СО2, Аr образуют воздух);
- жидкое (например, одеколон, сироп, рассол);
- твёрдое (например, сплавы).
Одно из веществ, которые образуют раствор, называется растворителем. Растворитель имеет то же агрегатное состояние, что и раствор. Так, для жидких растворов — это жидкость: вода, масло, бензин и т. д. Чаще всего на практике применяются водные растворы. О них и пойдет далее речь (если не будет сделана соответствующая оговорка).
Что происходит при растворении различных веществ в воде? Почему одни вещества хорошо растворяются в воде, а другие — плохо? От чего зависит растворимость — способность вещества растворяться в воде?
Представим себе, что в стакан тёплой водой положили кусочек сахара. Полежал он, уменьшился в размерах и… исчез. Куда? Неужели нарушается Закон сохранения вещества (его массы, энергии)? Нет. Сделайте глоток полученного раствора, и вы убедитесь, что вода сладкая, сахар не исчез. Но почему его не видно?
Дело в том, что в ходе растворения происходит дробление (измельчение) вещества. В данном случае кусочек сахара распался на молекулы, а их мы видеть не можем. Да, но почему сахар, лежащий на столе, не распадается на молекулы? Почему кусочек маргарина, опущенный в воду, тоже никуда не исчезает? Дело в том, что дробление растворяемого вещества происходит под действием растворителя, например воды. Но растворитель сможет «растащить» кристалл, твёрдое вещество на молекулы, если сумеет «уцепиться» за эти частицы. Другими словами, при растворении вещества должно быть взаимодействие между веществом и растворителем. Такое взаимодействие между веществом и растворителем называется сольватацией, а в случае воды — гидратацией.
Когда возможно такое взаимодействие? Только в том случае, когда строение веществ (и растворяемого, и растворителя) похоже, подобно. Издавна известно правило алхимиков: «подобное растворяется в подобном». В наших примерах молекулы сахара полярны, и между ними и полярными молекулами воды существуют определённые силы взаимодействия. Такие силы отсутствуют между неполярными молекулами жира и полярными молекулами воды. Поэтому жиры в воде не растворяются. Таким образом, растворимость зависит от природы растворяемого вещества и растворителя.
В результате взаимодействия между растворяемым веществом и водой образуются соединения — гидраты. Это могут быть очень прочные соединения:
Такие соединения существуют как индивидуальные вещества: основания, кислородсодержащие кислоты*.
Их общее название — гидроксиды.
Естественно, при образовании таких прочных соединений возникают прочные химические связи, выделяется теплота. Так, при растворении СаО (негашёная известь) в воде выделяется так много теплоты, что смесь закипает.
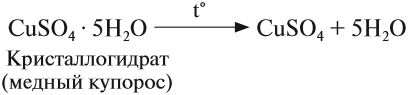
Но почему при растворении сахара или соли в воде полученный раствор не нагревается? Во-первых, далеко не все гидраты так прочны, как серная кислота или гидроксид кальция. Существуют гидраты солей (кристаллогидраты), которые легко разлагаются при нагревании:
Многие гидраты не выделены в свободном виде, а это означает, что при их образовании выделяется сравнительно мало теплоты.
Во-вторых, всегда при растворении, как уже упоминалось, идёт процесс дробления. А на это, естественно, затрачивается энергия, поглощается теплота.
Поскольку оба процесса происходят одновременно, раствор может нагреваться или охлаждаться в зависимости от того, какой процесс преобладает.
Вопрос. Какой процесс: дробление или гидратация преобладает в каждом случае:
- при растворении серной кислоты в воде, если раствор нагрелся;
- при растворении нитрата аммония в воде, если раствор охладился;
- при растворении поваренной соли в воде, если температура раствора практически не изменилась в ходе растворения.
Поскольку при растворении изменяется температура раствора, естественно предположить, что растворимость зависит от температуры. Действительно, растворимость большинства твёрдых веществ увеличивается при нагревании. Растворимость газов при нагревании уменьшается. Поэтому твёрдые вещества обычно растворяют в тёплой или горячей воде, а газированные напитки хранят на холоде.
Растворимость (способность растворяться) веществ не зависит от измельчения вещества или интенсивности перемешивания. Но, измельчая вещество, перемешивая готовый раствор, можно ускорить процесс растворения. Таким образом, изменяя условия получения раствора, можно получать растворы разных составов. Естественно, существует предел, достигнув которого легко обнаружить, что вещество больше не растворяется в воде. Такой раствор называется насыщенным. Для хорошо растворимых веществ насыщенный раствор будет содержать много растворённого вещества. Так, насыщенный раствор KNO3 при 100 °C содержит 245 граммов соли на 100 граммов воды (в 345 граммах раствора), это концентрированный раствор. Насыщенные растворы плохо растворимых веществ содержат ничтожные массы растворённых соединений. Так, насыщенный раствор хлорида серебра содержит 0,15 мг AgCl в 100 г воды. Это очень разбавленный раствор.
Таким образом, если раствор содержит много растворённого вещества по отношению к растворителю, то он называется концентрированным, если вещества мало — то разбавленным. Очень часто от состава раствора зависят его свойства, а значит, и применение.
Так, разбавленный раствор уксусной кислоты (столовый уксус) используют как вкусовую приправу, а концентрированный раствор этой кислоты (уксусная эссенция) может вызвать смертельный ожог при неосторожном применении (приёме внутрь).
Для того чтобы точно отразить состав растворов, используют величину, равную массовой доле растворенного вещества ω:
где m(вещества) — масса растворённого вещества в растворе; m(раствора) — общая масса раствора, содержащая растворённое вещество и растворитель.
Так, если 100 граммов уксуса содержат 6 граммов уксусной кислоты, то речь идёт о 6 %-ном растворе уксусной кислоты (это — столовый уксус). Способы решения задач с использованием понятия массовой доли растворённого вещества рассмотрены в уроке 30.2.
Электролитическая диссоциация
Всем известно, что металлы проводят электрическим ток. А проводят ли электрический ток растворы? Если бы мы попытались ответить на этот вопрос при помощи опыта, то убедились бы, что раствор сахара не проводит электрический ток, а раствор поваренной соли проводит. Почему? Может быть, исходные вещества — вода или сухой хлорид натрия — электропроводны? Но аналогичный опыт показывает — эти вещества, каждое само по себе, электрический ток проводить не могут.
Для того чтобы объяснить результаты этих опытов и понять смысл явления, необходимо ответить на вопрос: почему вообще некоторые вещества, например металлы, проводят электрический ток? Это происходит потому, что в металлах имеются «свободные» заряженные частицы — электроны. С направленным движением этих заряженных частиц связана электропроводность металлов. Таким образом, если раствор NаСl проводит электрический ток, то, значит, в этом растворе тоже образуются какие-то заряженные частицы. Если раствор сахара не проводит электрический ток, значит, в растворе сахара заряженных частиц не образуется. Исходя из этого, такие вещества называют:
- NаСl — электролит;
- Сахар — неэлектролит.
Итак: ЭЛЕКТРОЛИТЫ — это вещества, растворы (и расплавы) которых проводят электрический ток. А ПОЧЕМУ?
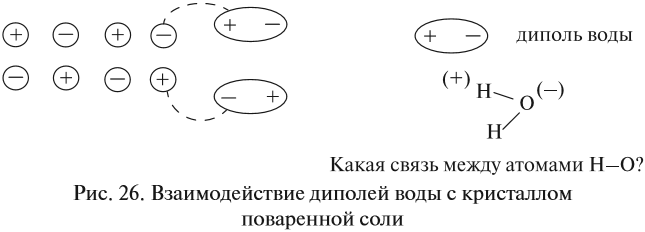
Теперь нам осталось выяснить: откуда в растворе NаСl появились заряженные частицы? Вспомните, какой тип химической связи имеется в кристалле поваренной соли? Ионная связь! То есть связь между заряженными частицами — ионами. Значит, хлорид натрия состоит из разноимённо заряженных частиц! Но почему тогда сухой хлорид натрия не проводит электрический ток? Потому что между ионами в кристалле существуют достаточно сильные электростатические взаимодействия. А в воде? Посмотрите на рис. 26.
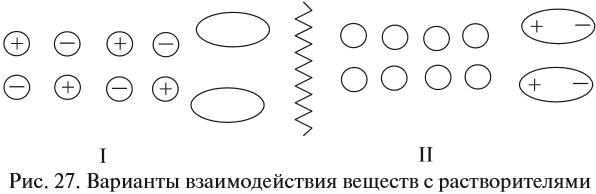
Между ионами соли и молекулами воды возникают довольно значительные силы электростатического взаимодействия. В результате молекулы воды «растаскивают» кристалл на «кусочки» (ионы). Будут ли возникать такие взаимодействия в следующих случаях (рис. 27)?
Очевидно, нет! В обоих случаях или растворитель (случай I), или вещество (случай II) неполярны, и взаимодействия, притяжение частиц друг к другу, ничтожны.
Вывод. Взаимодействие между веществом и растворителем возможно, если и вещество, и растворитель имеют достаточно полярные связи.
Следствием такого взаимодействия является диссоциация — распад вещества на ионы. При этом образуются положительно заряженные ионы — катионы и отрицательно заряженные ионы — анионы.
Электролитическая диссоциация — процесс распада электролитов на ионы под действием полярных молекул растворителя (чаще всего — воды).
Задание 6.1. Будут ли проводить электрический ток:
- раствор НСl в воде;
- раствор NаСl в бензине;
- раствор азота в воде;
- 100 %-ная серная кислота?
Дайте пояснения.
Если вы всё правильно поняли и правильно ответили, то электропроводность возникнет только в первом случае, а в остальных случаях отсутствуют необходимые для этого условия. Попробуйте сформулировать, какие это условия? Итак.
Итак.
Вещества, способные в растворах или расплавах распадаться на ионы и, как следствие, проводить в этом состоянии электрический ток, называются электролитами.
К электролитам относят:
- основания;
- кислоты;
- соли.
Это могут быть как неорганические, так и органические вещества. Правда, большинство органических веществ являются неэлектролитами. Это углеводороды (бензин), углеводы (сахар), спирты (глицерин) и другие (см. уроки 17–28 данного самоучителя).
Задание ЕГЭ. Электролитом является каждое из двух веществ:
- глюкоза и этиловый спирт;
- ацетат натрия и гидроксид калия;
- уксусная кислота и бензол;
- сахар и повареная соль.
Задание ЕГЭ. Электрический ток проводят:
- спиртовой раствор йода,
- расплав парафина,
- расплав ацетата калия,
- водный раствор глюкозы.
Если проверить электропроводность растворов электролитов одного класса, например кислот, то окажется, что в одном случае лампочка вспыхивает ярко, в другом — еле светится. Если принять во внимание, что концентрация веществ в обоих растворах одинакова, — как можно объяснить наблюдения?
Объяснение одно — в первом случае образуется большее число ионов (заряженных частиц), во втором — меньшее. То есть в первом случае электролитическая диссоциация идёт в значительней степени. Такие электролиты называются сильными, и в их растворах много ионов или почти нет (а иногда и совсем нет) молекул. Эти вещества построены по ионному типу или содержат сильнополярные ковалентные связи.
К СИЛЬНЫМ электролитам относятся:
- почти все соли;
- кислоты: НСl, НВr, НI, НNО3, Н2SО4, HClO4 и др.;
- щёлочи (кроме NН4ОН).
Вопрос. Что такое «щёлочь»? (В случае затруднений — см. урок 2.3.)
В растворах слабых электролитов много молекул вещества и мало ионов; электролитическая диссоциация идёт не полностью.
К слабым электролитам относятся:
- вода;
- кислоты: Н2СО3, Н2S, Н2SiО3, НNО2 и др.;
- NН4ОН и нерастворимые основания.
Фосфорная и сернистая кислоты — электролиты средней силы.
Задание 6.2. Выучите наизусть формулы сильных и слабых электролитов. Вспомните их названия.
Силу электролита можно оценить при помощи степени диссоциации α, которая показывает, какая часть растворённых молекул распалась на ионы:
где n — число молекул, распавшихся на ионы; N — общее число молекул электролита в растворе.
В разбавленных растворов сильных электролитов степень диссоциации α = 1 (или близка к этой величине), т. е. молекул практически нет. Для слабых электролитов α < 0,05, то есть в разбавленных растворах слабых электролитов число распавшихся молекул не превышает 5 %. В растворах таких веществ очень мало ионов по сравнению с общим числом растворённых молекул электролита.
Обратите внимание, что в обоих случаях речь идёт о разбавленных растворах, поскольку α зависит от разбавления: в концентрированном растворе даже очень сильного электролита очень мало молекул растворителя. А именно молекулы растворителя являются причиной диссоциации.
Как же происходит электролитическая диссоциация?
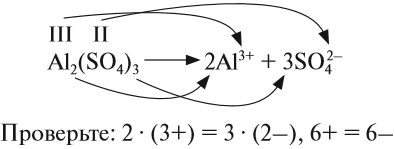
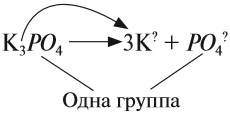
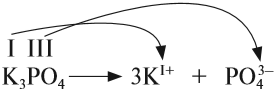
СОЛИ диссоциируют на катион металла (или аммония) и анион кислотного остатка. При составлении таких уравнений следует учитывать правила, которые необходимо запомнить:
- Заряд иона совпадает по величине с валентностью данного атома (группы атомов);
- Число катионов и анионов может быть различным, но суммарный положительный заряд катионов равен суммарному отрицательному заряду анионов. Раствор остается электронейтральным!
Вывод. Для составления уравнения электролитической диссоциации:
- составьте химическую формулу соединения, укажите валентность составных частей;
- по индексам укажите число образовавшихся ионов:
- по валентности укажите заряды ионов:
Задание 6.3. Составьте уравнения электролитической диссоциации нитрата хрома (III), карбоната натрия, сульфида калия, сульфата железа (III), сульфата железа (II).
ОСНОВАНИЯ диссоциируют на катион металла (или аммония NH4+) и анион ОН–:
Задание 6.4. Составьте уравнения диссоциации гидроксида калия; гидроксида аммония, гидроксида бария.
КИСЛОТЫ диссоциируют на катион водорода и анион кислотного остатка:
Задание 6.5. Составьте уравнения диссоциации соляной кислоты, серной кислоты, фосфорной кислоты.
Для многоосновных кислот диссоциация может происходить ступенчато. Это означает, что на каждой стадии отщепляется только один ион водорода. Например:
Задание 6.6. Составьте уравнения ступенчатой (постадийной) диссоциации фосфорной кислоты.
Проверьте себя:
Вопрос. Какой из этих процессов идёт в большей степени, то есть какие ионы образуются в большей степени: Н2РО4–, НРО42– или РО43–?
Поскольку отрыв катиона от двухзарядного аниона в высшей степени затруднён (более реальным кажется обратный процесс), то последний процесс практически не происходит. Поэтому по первой стадии Н3РО4 диссоциирует как сильная кислота, а по последней — как очень слабая, причём в растворе фосфорной кислоты фосфат-ионов РО43– практически нет.
В целом, сила кислоты определяется:
- её составом;
- степенью окисления центрального атома (чем она больше, тем сильнее кислота);
- стадией диссоциации её.
Вопрос. Предположите, какая кислота более сильная:
- азотная или азотистая;
- серная или сернистая?
Задание ЕГЭ. Какие суждения о диссоциации кислот в водных растворах верны?
- Кислоты в воде диссоциируют с образованием в качестве катиона только иона Н+.
- Среди анионов, образующихся при диссоциации кислот, могут присутствовать разные кислотные остатки.
Разумеется, верны оба суждения.
Задание ЕГЭ. В каком из растворов с одинаковой молярной концентрацией содержание фосфат-ионов наибольшее:
- NaH2PO4;
- Na2HPO4;
- H3PO4;
- Na3PO4.
Сила оснований также зависит от заряда иона (валентности) металла: чем он больше, тем слабее электролит (при прочих равных условиях). Так, гидроксид кальция слабее гидроксида натрия, а гидроксид железа (III) слабее гидроксида железа (II).
Ионно-молекулярные уравнения реакций
Из вышеизложенного следует, что в растворах большинства неорганических веществ, наряду с молекулами, находится значительное число ионов. В таком случае уравнения реакций, которые показывают состав молекул реагирующих веществ, весьма условны. Более точно отражают состав реагирующих частиц ионно-молекулярные уравнения.
Для того чтобы составить ионно-молекулярное уравнение реакции, нужно записать в виде ИОНОВ химические формулы:
- сильных и одновременно
- растворимых электролитов.
Состав всех остальных веществ изображается в виде молекул.
На практике, при составлении таких уравнений рекомендуется следовать следующему алгоритму:
1. Определить силу реагирующих электролитов:
2. Для сильных электролитов определить растворимость (по таблице растворимости):
3. Формулы сильных и одновременно растворимых электролитов записать в виде ионов, остальные формулы НЕ ИЗМЕНЯТЬ!
4. Одинаковые ионы «вычеркиваем», так как они не участвуют в реакции (не изменили ни состава, ни заряда), получаем краткое ионно-молекулярное уравнение:
Краткое ионно-молекулярное уравнение показывает:
- что реакция возможна;
- что в результате реакции образуется осадок (СuS);
- какие ионы или молекулы должны участвовать в аналогичном процессе.
Для того, чтобы переписать краткое ионно-молекулярное уравнение в молекулярном виде, необходимо вместо:
- ионов H+ написать формулу сильной кислоты;
- ионов ОH— написать формулу щёлочи;
- остальных ионов написать формулу растворимой соли.
Например, для того чтобы осуществить процесс:
вместо нитрата меди можно взять любую растворимую соль меди (II), так как она при электролитической диссоциации посылает в раствор ион меди, а анион соли в реакции не участвует:
Задание 6.7. Составьте молекулярные и ионно-молекулярные уравнения реакции для этих процессов и убедитесь, что краткие ионно-молекулярные уравнения реакций у них одинаковые.
Задание 6.8. Записать в молекулярном и молекулярно-ионном виде уравнения, соответствующие предложенным кратким молекулярно-ионным уравнениям:
При составлении ионно-молекулярных уравнений может получиться так, что все частицы будут вычеркнуты, так как не изменят ни состава, ни заряда. В этом случае говорят, что реакция в растворе не идёт. В принципе, можно заранее предсказать возможность такого процесса: реакция ионного обмена в растворе возможна, если происходит связывание ионов, т. е. образуется осадок, газ, слабый электролит или ион нового состава.
Задание 6.9. Составьте ионно-молекулярные уравнения реакций:
- фосфат натрия + хлорид кальция →
- карбонат бария + азотная кислота →
- гидроксид железа III + серная кислота →
- сульфат аммония + гидроксид калия →
- нитрат алюминия + хлорид натрия →
Сделайте заключение: возможны ли эти процессы. Укажите признаки возможных процессов (осадок, газ, слабый электролит).
Вывод: любая реакция ионного обмена протекает в сторону связывания ионов, поэтому в результате такой реакции образуется слабый электролит или осадок, или газ.
Понятие о рН (водородном показателе)
Вода — очень слабый электролит: при обычных условиях лишь одна молекула воды из 10 000 000 распадается на ионы:
Это уравнение показывает, что при диссоциации 1 моль молекул воды образуется 1 моль ионов водорода Н+ и 1 моль гидроксид-анионов ОН–. Другими словами: в чистой воде концентрация ионов водорода равна концентрации гидроксид-анионов:
Здесь: [Н+] — равновесная концентрация ионов водорода, моль/л; [OH–] — равновесная концентрация гидроксид-анионов, моль/л.
Такой раствор (среда) называется «нейтральный».
Характер среды — кислый, нейтральный — можно оценить количественно при помощи рН («пэ-аш»). Водородный показатель рН равен логарифму концентрации ионов водорода, взятому с обратным знаком*:
* Логарифм (lg) — это величина, равная показателю степени при основании 10. Например: lg 100 = lg 102 = 2.
Поэтому в случае чистой воды рН = 7.
Раствор, у которого рН = 7, называется нейтральным.
Если к чистой воде добавили кислоту, то увеличили концентрацию ионов водорода. Теперь эта концентрация составит, например 10–6 моль/л или 10–2 моль/л.
Такая среда (раствор) называется «кислая», или «кислотная». Причём в первом случае (рН = 6) среда считается слабокислой, а во втором (рН = 2) — сильнокислой, т. е. в любом случае рН < 7. Значение рН можно измерять и с большей точностью (например, рН = 5,36).
pН < 7, среда кислая.
При добавлении щёлочи увеличивается концентрация ионов ОН–, и одновременно уменьшается концентрация ионов Н+. Дело в том, что для любого водного раствора
Поэтому, если концентрация ионов ОН– составит 10–3, то [H+] = 10–11, т. е.
рН > 7, среда щелочная.
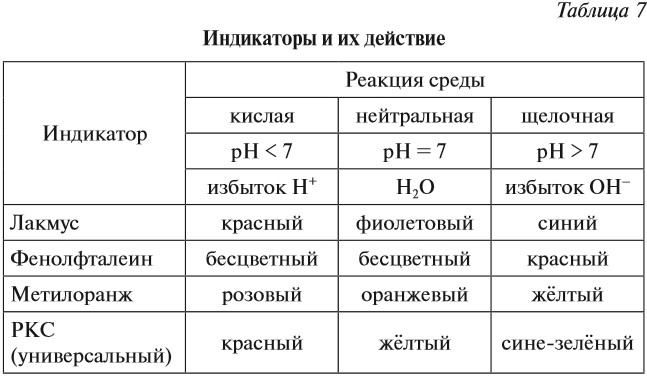
Определить реакцию среды конкретного раствора можно при помощи индикаторов.
Индикаторы — это вещества, которые изменяют свой цвет в присутствии избытка ионов Н+ или ОН–.
Ионы Н+ или ОН– действуют на молекулу индикатора, и индикатор меняет цвет по-разному в зависимости от реакции среды и вида самого индикатора (табл. 7).
Задание 6.10. Какую окраску будет иметь индикатор лакмус, если:
- рН < 7;
- [Н+] = 10–4 моль/л;
- в растворе есть избыток ОН–;
- рН = 7;
- [ОН–] = 10–8 моль/л;
- в растворе есть НNО3;
- [ОН–] = 0,1 моль/л.
Окраска индикаторов изменяется в растворах, которые содержат избыток одного из этих ионов. Ионы Н+ или ОН– могут образовываться в ходе диссоциации некоторых соединений.
Вопрос. Какие вещества при диссоциации образуют ионы Н+ или ОН–?
Эти ионы могут образовываться при диссоциации растворимых кислот, оснований, некоторых кислых и основных солей. Например, дигидрофосфат натрия образует при диссоциации ионы водорода, а гидрофосфат натрия — нет. Дело в том, что кислые соли могут диссоциировать ступенчато, если полученный на первой стадии анион соответствует сильному электролиту:
остаток слабого электролита → диссоциация не идёт;
остаток сильного электролита → диссоциация идёт:
Образуются ионы Н+, возникает кислая среда.
Кроме того, ионы Н+ или ОН– могут образовываться в ходе взаимодействия некоторых веществ с водой. Например, с водой могут взаимодействовать активные металлы, кислотные и основные оксиды.
Задание 6.11. Какую окраску будет иметь индикатор лакмус, если в воде растворить: кальций, оксид лития, оксид серы (IV)?
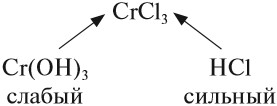
Гидролиз солей
Попробуйте ответить на вопрос: изменится ли окраска лакмуса в растворе серной кислоты? гидроксида натрия? сульфата натрия? карбоната натрия? В первых двух случаях можно уверенно сказать «да», так как при диссоциации образуются:
ионы водорода (уравнение 1) или гидроксид-анионы (уравнение 2), а индикаторы реагируют именно на избыток ионов Н+ или ОН–. Но при диссоциации упомянутых солей:
ионы Н+ и ОН– не образуются! Тем не менее раствор карбоната натрия изменяет окраску индикатора, а сульфата натрия — нет! Почему? Видимо, причина в том, что ионы карбоната натрия вступают в какую-то реакцию с молекулами воды, ведь только из молекулы воды может образоваться избыток Н+ или ОН–.
Гидролиз солей — это процесс взаимодействия ионов соли с молекулами воды, в результате чего изменяется рН раствора.
Какой ион карбоната натрия реагирует с водой? Предположим, что оба. Тогда в растворе происходят процессы:
Вспомните, что такое «сильный электролит», «слабый электролит», и ответьте на вопрос: какой из этих процессов (А или Б) НЕВОЗМОЖЕН в растворе?
Очевидно, невозможен процесс (А), так как молекул сильного электролита NаОН в растворе НЕТ, есть только ионы Na+ и ОН–, другими словами, связывания ионов не происходит.
Следовательно, происходит процесс (Б), и краткое ионномолекулярное уравнение гидролиза карбоната натрия выглядит так:
pH > 7, среда щелочная, лакмус синий.
И действительно, в растворе карбоната натрия лакмус становится синим. Почему именно карбонат-анион вступает в реакцию гидролиза? Потому что это ион, соответствующий СЛАБОМУ электролиту и в результате его взаимодействия с водой образуется СЛАБЫЙ электролит (вспомните условия протекания ионных процессов).
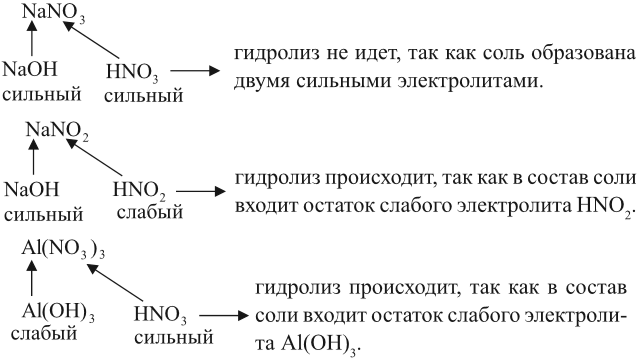
Вывод. Гидролизу подвергаются соли, содержащие остаток слабого электролита.
Например:
Задание 6.12. Определите, происходит ли гидролиз в растворах хлорида железа (III), силиката натрия, нитрата калия. Ответ поясните.
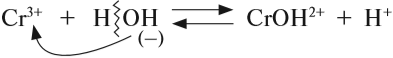
Алгоритм составления уравнений реакции гидролиза:
1. Определить какие электролиты образуют соль, отметить их силу:
2. Составить уравнение диссоциации соли, подчеркнуть ион, соответствующий слабому электролиту:
3. Для иона слабого электролита составить уравнение реакции взаимодействия с одной молекулой воды (уравнение гидролиза):
- из молекулы воды притягивается противоположно заряженный нон, в данном случае ОН–;
- сумма зарядов до и после реакции равна:
4. Определить реакцию среды в образовавшемся растворе: в данном случае образовались ионы Н+, значит, среда кислая, рН< 7.
Вопрос. Какую окраску будет иметь лакмус в этом растворе?
5. Для того чтобы составить молекулярное уравнение реакции гидролиза, следует:
- дописать к каждому иону ионы, которые образуются при диссоциации, с противоположным зарядом (в данном случае ионы Cl–);
- составить полученные формулы по валентности (валентность = заряду иона!):
Задание 6.13. Составить уравнения реакций гидролиза для: сульфата алюминия; силиката калия; хлорида натрия; нитрата меди (II); сульфида калия.
Задание 6.14. Как при помощи лакмуса различить бесцветные растворы солей: нитрата свинца (II), сульфата калия, сульфида натрия?
Выводы
Растворы — это однородная смесь двух или более компонентов. При образовании растворов в результате сольватации происходит дробление растворяемого вещества до молекул или ионов.
Истинный раствор — это однородная смесь молекул и ионов различных веществ.
Электролиты это вещества, которые в водных растворах распадаются на ионы (диссоциируют). Уравнения реакций для таких веществ составляют с учётом этого процесса в ионно-молекулярной форме. Реакции ионного обмена, в том числе гидролиз, осуществимы, если происходит связывание ионов, т. е. образуется осадок, газ или слабый электролит.
«Solute» redirects here. For the sole order of the class Homoiostelea, see Solute (echinoderm).
In chemistry, a solution is a special type of homogeneous mixture composed of two or more substances. In such a mixture, a solute is a substance dissolved in another substance, known as a solvent. If the attractive forces between the solvent and solute particles are greater than the attractive forces holding the solute particles together, the solvent particles pull the solute particles apart and surround them. These surrounded solute particles then move away from the solid solute and out into the solution. The mixing process of a solution happens at a scale where the effects of chemical polarity are involved, resulting in interactions that are specific to solvation. The solution usually has the state of the solvent when the solvent is the larger fraction of the mixture, as is commonly the case. One important parameter of a solution is the concentration, which is a measure of the amount of solute in a given amount of solution or solvent. The term «aqueous solution» is used when one of the solvents is water.[1]
Characteristics
- A solution is a homogeneous mixture of two or more substances.
- The particles of solute in a solution cannot be seen by the naked eye. By contrast, particles may be visible in a suspension.
- A solution does not cause beams of light to scatter. By contrast, the particles in a suspension can cause Tyndall scattering or Rayleigh scattering.
- A solution is stable; solutes will not precipitate unless added in excess of the mixture’s solubility, at which point the excess would remain in its solid phase, referred to as hypersaturation.
- The solute from a solution cannot be separated by filtration (or mechanically).
- It is composed of only one phase.
|
This section needs expansion with: distinguish from other types of mixture (could be a separate section). You can help by adding to it. (August 2021) |
Types
Homogeneous means that the components of the mixture form a single phase. Heterogeneous means that the components of the mixture are of different phase. The properties of the mixture (such as concentration, temperature, and density) can be uniformly distributed through the volume but only in absence of diffusion phenomena or after their completion. Usually, the substance present in the greatest amount is considered the solvent. Solvents can be gases, liquids, or solids. One or more components present in the solution other than the solvent are called solutes. The solution has the same physical state as the solvent.
Gaseous mixtures
If the solvent is a gas, only gases (non-condensable) or vapors (condensable) are dissolved under a given set of conditions. An example of a gaseous solution is air (oxygen and other gases dissolved in nitrogen). Since interactions between gaseous molecules play almost no role, non-condensable gases form rather trivial solutions. In the literature, they are not even classified as solutions, but simply addressed as homogeneous mixtures of gases. The Brownian motion and the permanent molecular agitation of gas molecules guarantee the homogeneity of the gaseous systems. Non-condensable gases mixtures (e.g., air/CO2, or air/xenon) do not spontaneously demix, nor sediment, as distinctly stratified and separate gas layers as a function of their relative density. Diffusion forces efficiently counteract gravitation forces under normal conditions prevailing on Earth. The case of condensable vapors is different: once the saturation vapor pressure at a given temperature is reached, vapor excess condenses into the liquid state.
Liquid solutions
If the solvent is a liquid, then almost all gases, liquids, and solids can be dissolved. Here are some examples:
- Gas in liquid:
- Oxygen in water
- Carbon dioxide in water – a less simple example, because the solution is accompanied by a chemical reaction (formation of ions). The visible bubbles in carbonated water are not the dissolved gas, but only an effervescence of carbon dioxide that has come out of solution; the dissolved gas itself is not visible since it is dissolved on a molecular level.
- Liquid in liquid:
- The mixing of two or more substances of the same chemistry but different concentrations to form a constant. (Homogenization of solutions)
- Alcoholic beverages are basically solutions of ethanol in water.
- Solid in liquid:
- Sucrose (table sugar) in water
- Sodium chloride (NaCl) (table salt) or any other salt in water, which forms an electrolyte: When dissolving, salt dissociates into ions.
- Solutions in water are especially common, and are called aqueous solutions.
- Non-aqueous solutions are when the liquid solvent involved is not water.[1]
Counterexamples are provided by liquid mixtures that are not homogeneous: colloids, suspensions, emulsions are not considered solutions.
Body fluids are examples of complex liquid solutions, containing many solutes. Many of these are electrolytes since they contain solute ions, such as potassium. Furthermore, they contain solute molecules like sugar and urea. Oxygen and carbon dioxide are also essential components of blood chemistry, where significant changes in their concentrations may be a sign of severe illness or injury.
Solid solutions
If the solvent is a solid, then gases, liquids, and solids can be dissolved.
- Gas in solids:
- Hydrogen dissolves rather well in metals, especially in palladium; this is studied as a means of hydrogen storage.
- Liquid in solid:
- Mercury in gold, forming an amalgam
- Water in solid salt or sugar, forming moist solids
- Hexane in paraffin wax
- Polymers containing plasticizers such as phthalate (liquid) in PVC (solid)
- Solid in solid:
- Steel, basically a solution of carbon atoms in a crystalline matrix of iron atoms[clarification needed]
- Alloys like bronze and many others
- Radium sulfate dissolved in barium sulfate: a true solid solution of Ra in BaSO4
Solubility
The ability of one compound to dissolve in another compound is called solubility.[clarification needed] When a liquid can completely dissolve in another liquid the two liquids are miscible. Two substances that can never mix to form a solution are said to be immiscible.
All solutions have a positive entropy of mixing. The interactions between different molecules or ions may be energetically favored or not. If interactions are unfavorable, then the free energy decreases with increasing solute concentration. At some point, the energy loss outweighs the entropy gain, and no more solute particles[clarification needed] can be dissolved; the solution is said to be saturated. However, the point at which a solution can become saturated can change significantly with different environmental factors, such as temperature, pressure, and contamination. For some solute-solvent combinations, a supersaturated solution can be prepared by raising the solubility (for example by increasing the temperature) to dissolve more solute and then lowering it (for example by cooling).
Usually, the greater the temperature of the solvent, the more of a given solid solute it can dissolve. However, most gases and some compounds exhibit solubilities that decrease with increased temperature. Such behavior is a result of an exothermic enthalpy of solution. Some surfactants exhibit this behaviour. The solubility of liquids in liquids is generally less temperature-sensitive than that of solids or gases.
Properties
The physical properties of compounds such as melting point and boiling point change when other compounds are added. Together they are called colligative properties. There are several ways to quantify the amount of one compound dissolved in the other compounds collectively called concentration. Examples include molarity, volume fraction, and mole fraction.
The properties of ideal solutions can be calculated by the linear combination of the properties of its components. If both solute and solvent exist in equal quantities (such as in a 50% ethanol, 50% water solution), the concepts of «solute» and «solvent» become less relevant, but the substance that is more often used as a solvent is normally designated as the solvent (in this example, water).
Liquid solution characteristics
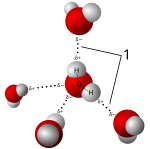
In principle, all types of liquids can behave as solvents: liquid noble gases, molten metals, molten salts, molten covalent networks, and molecular liquids. In the practice of chemistry and biochemistry, most solvents are molecular liquids. They can be classified into polar and non-polar, according to whether their molecules possess a permanent electric dipole moment. Another distinction is whether their molecules can form hydrogen bonds (protic and aprotic solvents). Water, the most commonly used solvent, is both polar and sustains hydrogen bonds.
Water is a good solvent because the molecules are polar and capable of forming hydrogen bonds (1).
Salts dissolve in polar solvents, forming positive and negative ions that are attracted to the negative and positive ends of the solvent molecule, respectively. If the solvent is water, hydration occurs when the charged solute ions become surrounded by water molecules. A standard example is aqueous saltwater. Such solutions are called electrolytes. Whenever salt dissolves in water ion association has to be taken into account.
Polar solutes dissolve in polar solvents, forming polar bonds or hydrogen bonds. As an example, all alcoholic beverages are aqueous solutions of ethanol. On the other hand, non-polar solutes dissolve better in non-polar solvents. Examples are hydrocarbons such as oil and grease that easily mix, while being incompatible with water.
An example of the immiscibility of oil and water is a leak of petroleum from a damaged tanker, that does not dissolve in the ocean water but rather floats on the surface.
Preparation from constituent ingredients
It is common practice in laboratories to make a solution directly from its constituent ingredients. There are three cases in practical calculation:
- Case 1: amount of solvent volume is given.
- Case 2: amount of solute mass is given.
- Case 3: amount of final solution volume is given.
In the following equations, A is solvent, B is solute, and C is concentration. Solute volume contribution is considered through the ideal solution model.
- Case 1: amount (mL) of solvent volume VA is given. Solute mass mB = C VA dA /(100-C/dB)
- Case 2: amount of solute mass mB is given. Solvent volume VA = mB (100/C-1/ dB )
- Case 3: amount (mL) of final solution volume Vt is given. Solute mass mB = C Vt /100; Solvent volume VA=(100/C-1/ dB) mB
- Case 2: solute mass is known, VA = mB 100/C
- Case 3: total solution volume is known, same equation as case 1. VA=Vt; mB = C VA /100
Example: Make 2 g/100mL of NaCl solution with 1 L water. The density of the resulting solution is considered to be equal to that of water, statement holding especially for dilute solutions, so the density information is not required.
- mB = C VA = ( 2 / 100 ) g/mL × 1000 mL = 20 g
Chemists often make concentrated stock solutions that may then be diluted as needed for laboratory applications. Standard solutions are those where concentrations of solutes are accurately and precisely known.
See also
- Molar solution
- Percentage solution (disambiguation)
- Solubility equilibrium
- Total dissolved solids – Measurement in environmental chemistry is a common term in a range of disciplines, and can have different meanings depending on the analytical method used. In water quality, it refers to the amount of residue remaining after the evaporation of water from a sample.
- Upper critical solution temperature – Critical temperature of miscibility in a mixture
- Lower critical solution temperature – Critical temperature below which components of a mixture are miscible for all compositions
- Coil–globule transition – Collapse of a macromolecule from an expanded coil state to a collapsed globule state
References
- ^ a b «Solutions». Washington University Chemistry Department. Washington University. Retrieved 13 April 2018.
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «solution». doi:10.1351/goldbook.S05746
External links
Media related to Solutions at Wikimedia Commons
«Solute» redirects here. For the sole order of the class Homoiostelea, see Solute (echinoderm).
In chemistry, a solution is a special type of homogeneous mixture composed of two or more substances. In such a mixture, a solute is a substance dissolved in another substance, known as a solvent. If the attractive forces between the solvent and solute particles are greater than the attractive forces holding the solute particles together, the solvent particles pull the solute particles apart and surround them. These surrounded solute particles then move away from the solid solute and out into the solution. The mixing process of a solution happens at a scale where the effects of chemical polarity are involved, resulting in interactions that are specific to solvation. The solution usually has the state of the solvent when the solvent is the larger fraction of the mixture, as is commonly the case. One important parameter of a solution is the concentration, which is a measure of the amount of solute in a given amount of solution or solvent. The term «aqueous solution» is used when one of the solvents is water.[1]
Characteristics
- A solution is a homogeneous mixture of two or more substances.
- The particles of solute in a solution cannot be seen by the naked eye. By contrast, particles may be visible in a suspension.
- A solution does not cause beams of light to scatter. By contrast, the particles in a suspension can cause Tyndall scattering or Rayleigh scattering.
- A solution is stable; solutes will not precipitate unless added in excess of the mixture’s solubility, at which point the excess would remain in its solid phase, referred to as hypersaturation.
- The solute from a solution cannot be separated by filtration (or mechanically).
- It is composed of only one phase.
|
This section needs expansion with: distinguish from other types of mixture (could be a separate section). You can help by adding to it. (August 2021) |
Types
Homogeneous means that the components of the mixture form a single phase. Heterogeneous means that the components of the mixture are of different phase. The properties of the mixture (such as concentration, temperature, and density) can be uniformly distributed through the volume but only in absence of diffusion phenomena or after their completion. Usually, the substance present in the greatest amount is considered the solvent. Solvents can be gases, liquids, or solids. One or more components present in the solution other than the solvent are called solutes. The solution has the same physical state as the solvent.
Gaseous mixtures
If the solvent is a gas, only gases (non-condensable) or vapors (condensable) are dissolved under a given set of conditions. An example of a gaseous solution is air (oxygen and other gases dissolved in nitrogen). Since interactions between gaseous molecules play almost no role, non-condensable gases form rather trivial solutions. In the literature, they are not even classified as solutions, but simply addressed as homogeneous mixtures of gases. The Brownian motion and the permanent molecular agitation of gas molecules guarantee the homogeneity of the gaseous systems. Non-condensable gases mixtures (e.g., air/CO2, or air/xenon) do not spontaneously demix, nor sediment, as distinctly stratified and separate gas layers as a function of their relative density. Diffusion forces efficiently counteract gravitation forces under normal conditions prevailing on Earth. The case of condensable vapors is different: once the saturation vapor pressure at a given temperature is reached, vapor excess condenses into the liquid state.
Liquid solutions
If the solvent is a liquid, then almost all gases, liquids, and solids can be dissolved. Here are some examples:
- Gas in liquid:
- Oxygen in water
- Carbon dioxide in water – a less simple example, because the solution is accompanied by a chemical reaction (formation of ions). The visible bubbles in carbonated water are not the dissolved gas, but only an effervescence of carbon dioxide that has come out of solution; the dissolved gas itself is not visible since it is dissolved on a molecular level.
- Liquid in liquid:
- The mixing of two or more substances of the same chemistry but different concentrations to form a constant. (Homogenization of solutions)
- Alcoholic beverages are basically solutions of ethanol in water.
- Solid in liquid:
- Sucrose (table sugar) in water
- Sodium chloride (NaCl) (table salt) or any other salt in water, which forms an electrolyte: When dissolving, salt dissociates into ions.
- Solutions in water are especially common, and are called aqueous solutions.
- Non-aqueous solutions are when the liquid solvent involved is not water.[1]
Counterexamples are provided by liquid mixtures that are not homogeneous: colloids, suspensions, emulsions are not considered solutions.
Body fluids are examples of complex liquid solutions, containing many solutes. Many of these are electrolytes since they contain solute ions, such as potassium. Furthermore, they contain solute molecules like sugar and urea. Oxygen and carbon dioxide are also essential components of blood chemistry, where significant changes in their concentrations may be a sign of severe illness or injury.
Solid solutions
If the solvent is a solid, then gases, liquids, and solids can be dissolved.
- Gas in solids:
- Hydrogen dissolves rather well in metals, especially in palladium; this is studied as a means of hydrogen storage.
- Liquid in solid:
- Mercury in gold, forming an amalgam
- Water in solid salt or sugar, forming moist solids
- Hexane in paraffin wax
- Polymers containing plasticizers such as phthalate (liquid) in PVC (solid)
- Solid in solid:
- Steel, basically a solution of carbon atoms in a crystalline matrix of iron atoms[clarification needed]
- Alloys like bronze and many others
- Radium sulfate dissolved in barium sulfate: a true solid solution of Ra in BaSO4
Solubility
The ability of one compound to dissolve in another compound is called solubility.[clarification needed] When a liquid can completely dissolve in another liquid the two liquids are miscible. Two substances that can never mix to form a solution are said to be immiscible.
All solutions have a positive entropy of mixing. The interactions between different molecules or ions may be energetically favored or not. If interactions are unfavorable, then the free energy decreases with increasing solute concentration. At some point, the energy loss outweighs the entropy gain, and no more solute particles[clarification needed] can be dissolved; the solution is said to be saturated. However, the point at which a solution can become saturated can change significantly with different environmental factors, such as temperature, pressure, and contamination. For some solute-solvent combinations, a supersaturated solution can be prepared by raising the solubility (for example by increasing the temperature) to dissolve more solute and then lowering it (for example by cooling).
Usually, the greater the temperature of the solvent, the more of a given solid solute it can dissolve. However, most gases and some compounds exhibit solubilities that decrease with increased temperature. Such behavior is a result of an exothermic enthalpy of solution. Some surfactants exhibit this behaviour. The solubility of liquids in liquids is generally less temperature-sensitive than that of solids or gases.
Properties
The physical properties of compounds such as melting point and boiling point change when other compounds are added. Together they are called colligative properties. There are several ways to quantify the amount of one compound dissolved in the other compounds collectively called concentration. Examples include molarity, volume fraction, and mole fraction.
The properties of ideal solutions can be calculated by the linear combination of the properties of its components. If both solute and solvent exist in equal quantities (such as in a 50% ethanol, 50% water solution), the concepts of «solute» and «solvent» become less relevant, but the substance that is more often used as a solvent is normally designated as the solvent (in this example, water).
Liquid solution characteristics
In principle, all types of liquids can behave as solvents: liquid noble gases, molten metals, molten salts, molten covalent networks, and molecular liquids. In the practice of chemistry and biochemistry, most solvents are molecular liquids. They can be classified into polar and non-polar, according to whether their molecules possess a permanent electric dipole moment. Another distinction is whether their molecules can form hydrogen bonds (protic and aprotic solvents). Water, the most commonly used solvent, is both polar and sustains hydrogen bonds.
Water is a good solvent because the molecules are polar and capable of forming hydrogen bonds (1).
Salts dissolve in polar solvents, forming positive and negative ions that are attracted to the negative and positive ends of the solvent molecule, respectively. If the solvent is water, hydration occurs when the charged solute ions become surrounded by water molecules. A standard example is aqueous saltwater. Such solutions are called electrolytes. Whenever salt dissolves in water ion association has to be taken into account.
Polar solutes dissolve in polar solvents, forming polar bonds or hydrogen bonds. As an example, all alcoholic beverages are aqueous solutions of ethanol. On the other hand, non-polar solutes dissolve better in non-polar solvents. Examples are hydrocarbons such as oil and grease that easily mix, while being incompatible with water.
An example of the immiscibility of oil and water is a leak of petroleum from a damaged tanker, that does not dissolve in the ocean water but rather floats on the surface.
Preparation from constituent ingredients
It is common practice in laboratories to make a solution directly from its constituent ingredients. There are three cases in practical calculation:
- Case 1: amount of solvent volume is given.
- Case 2: amount of solute mass is given.
- Case 3: amount of final solution volume is given.
In the following equations, A is solvent, B is solute, and C is concentration. Solute volume contribution is considered through the ideal solution model.
- Case 1: amount (mL) of solvent volume VA is given. Solute mass mB = C VA dA /(100-C/dB)
- Case 2: amount of solute mass mB is given. Solvent volume VA = mB (100/C-1/ dB )
- Case 3: amount (mL) of final solution volume Vt is given. Solute mass mB = C Vt /100; Solvent volume VA=(100/C-1/ dB) mB
- Case 2: solute mass is known, VA = mB 100/C
- Case 3: total solution volume is known, same equation as case 1. VA=Vt; mB = C VA /100
Example: Make 2 g/100mL of NaCl solution with 1 L water. The density of the resulting solution is considered to be equal to that of water, statement holding especially for dilute solutions, so the density information is not required.
- mB = C VA = ( 2 / 100 ) g/mL × 1000 mL = 20 g
Chemists often make concentrated stock solutions that may then be diluted as needed for laboratory applications. Standard solutions are those where concentrations of solutes are accurately and precisely known.
See also
- Molar solution
- Percentage solution (disambiguation)
- Solubility equilibrium
- Total dissolved solids – Measurement in environmental chemistry is a common term in a range of disciplines, and can have different meanings depending on the analytical method used. In water quality, it refers to the amount of residue remaining after the evaporation of water from a sample.
- Upper critical solution temperature – Critical temperature of miscibility in a mixture
- Lower critical solution temperature – Critical temperature below which components of a mixture are miscible for all compositions
- Coil–globule transition – Collapse of a macromolecule from an expanded coil state to a collapsed globule state
References
- ^ a b «Solutions». Washington University Chemistry Department. Washington University. Retrieved 13 April 2018.
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «solution». doi:10.1351/goldbook.S05746
External links
Media related to Solutions at Wikimedia Commons
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
Растворы бывают жидкие, твердые и газообразные.
Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении. В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Образование раствора зависит от характера взаимодействия частиц растворителя и растворенного вещества, и их природы.
В школьном курсе рассматриваются преимущественно растворы электролитов. В курсе ВУЗов рассматриваются также истинные и коллоидные растворы, золи и другие системы.
По способности растворяться вещества условно делят на:
- малорастворимые (от 0,001 до 1 грамма растворенного вещества на 100 грамм растворителя);
- растворимые (больше 1 г растворенного вещества на 100 г растворителя);
- нерастворимые (менее 0,001 г растворенного вещества на 100 г растворителя).
Обратите внимание!
При попадании в воду вещество может:
- раствориться в воде, то есть перемешаться с ней на атомно-молекулярном уровне;
- химически прореагировать с водой;
- не раствориться в воде и химически не прореагировать.
Коэффициент растворимости – отношение массы растворенного вещества к массе растворителя (например, 10 г соли на 100 г воды).
По концентрации растворенного вещества растворы делят на:
Ненасыщенные растворы – это растворы, в которых концентрация растворенного вещества меньше, чем в соответствующем насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое количества растворенного вещества.
Насыщенные растворы – это растворы, в которых достигнута максимальная концентрация растворенного вещества при данных условиях. Насыщенный раствор можно приготовить даже в бытовых условиях – например, раствор поваренной соли в воде. Если в стакан воды постепенно добавлять соль, рано или поздно соль перестанет растворяться. Это и будет насыщенный раствор.
Пересыщенный раствор – это раствор, в котором концентрация растворенного вещества больше, чем в насыщенном. Избыток растворенного вещества легко выпадает в осадок. Приготовить пересыщенный раствор можно, например, с помощью охлаждения насыщенного раствора поваренной соли. При понижении температуры растворимость поваренной соли уменьшается, и раствор становится пересыщенным.
По концентрации растворенного вещества растворы также разделяют на концентрированные и разбавленные:
Концентрированные растворы – это растворы с относительно высоким содержанием растворенного вещества.
Разбавленные растворы – это растворы с относительно низким содержанием растворенного вещества.
Это деление очень условно, и не связано с делением раствора по насыщенности. Разбавленный раствор может быть насыщенным, а концентрированный раствор не всегда может оказаться насыщенным.
Физические величины, характеризующие состав раствора – это массовая доля, массовый процент, молярность (молярная концентрация), мольная доля, мольный процент, мольное соотношение, растворимость (для насыщенных растворов), объемная доля, объемный процент и некоторые другие величины, которые проходятся в курсе ВУЗов (нормальность или нормальная концентрация, моляльность, титр).
Остановимся подробнее на каждой из них:
1. Массовая доля, масс. доли — это отношение массы растворенного вещества mр.в. к массе раствора mр-ра, выраженное в долях от единицы. Долю можно также выразить в процентах, умножив на 100, тогда мы получим массовый процент, масс. %.
ω = mр.в. / mр-ра
Задачи на материальный баланс с использованием массовой доли — обязательный компонент экзаменов по химии (и не только!) разных уровней. Научиться решать задачи на массовую долю и материальный баланс (смешение, разбавление, концентрирование и приготовление растворов) можно здесь!
2. Молярная концентрация (молярность), моль/л, М – это отношение количества растворенного вещества ν, моль к объему всего раствора Vр-ра, л. Концентрация 1 моль растворенного вещества на 1 литр раствора также обозначается так: 1 М. Такой раствор называют «одномолярный». Двухмолярный раствор — 2 М соответствует концентрации 2 моль растворенного вещества на 1 литр раствора и т.д.
Cm = νр.в. / Vр-ра
Задачи на молярную концентрацию, как правило, встречаются в курсе ВУЗов, в химических олимпиадах и вступительных экзаменах в ВУЗы. Научиться решать задачи на молярную концентрацию можно здесь.
3. Мольная доля, мольн. дол. – это отношение количества растворенного вещества νр.в., моль к общему количеству вещества всех компонентов в растворе νр-ра, моль:
φ = νр.в. / νр-ра
Мольная доля также может быть выражена в мольных процентах (% мольн.), если умножить долю на 100%. Задачи на мольную долю встречаются в курсе ВУЗов, олимпиадах и вступительных экзаменах. Научиться решать задачи на мольную долю можно здесь.
4. Объемная доля, объемн. дол. – это отношение объема растворенного вещества Vр.в., л к общему объему раствора или смеси Vр-ра, л:
φ = Vр.в./ Vр-ра
Объемная доля также может быть выражена в объемных процентах (% объемн.), если умножить долю на 100%. Задачи на объемную долю, как правило, сводятся к решению задач на мольную долю, т.к. для газовых смесей объемные и мольные доли компонентов в смеси равны.
5. Мольное соотношение – это отношение количества растворенного вещества к количеству вещества растворителя. Также может использоваться массовое соотношение и объемное соотношение.
6. Растворимость – это отношение массы растворенного вещества к массе растворителя (применяется, как правило, для насыщенных растворов).
7. Титр, г/мл – это отношение массы растворенного вещества mр.в., г к объему раствора, выраженному в миллилитрах Vр-ра, мл:
T = mр.в. / Vр-ра
8. Моляльность.
9. Нормальная концентрация (нормальность)
По механизму растворения растворы делят на физические и химические.
Физическое растворение — это растворение, при котором происходит разрыв и образование только межмолекулярных связей (включая водородные). Физически растворяются только некоторые вещества с молекулярной кристаллической решеткой. Например, растворение нафталина в спирте и воде — опыт.
Химическое растворение — это растворение, при котором разрушаются химические связи в веществе. Химическое растворение, как правило, сопровождается электролитической диссоциацией растворяемого вещества. Подробнее про электролитическую диссоциацию и химическое растворение здесь.
Важно! Подобное хорошо растворяется в подобном. Неполярные растворители хорошо растворяют неполярные вещества. Полярные растворители хорошо растворяют полярные вещества. Понимание механизмов растворения, природы растворяемого вещества и растворителя позволяет легко определить растворимость одного вещества в другом.
Растворение поваренной соли (NaCl) в воде
Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. «Гомогенный» — значит, каждый из компонентов распределён в массе другого в виде своих частиц, то есть атомов, молекул или ионов.[1].
Раствор — однофазная система переменного, или гетерогенного, состава, состоящая из двух или более компонентов.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает[1].
Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть, теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ[1].
По сравнению с индивидуальными веществами по структуре растворы сложнее[1].
Растворы бывают газовыми, жидкими и твёрдыми[1].
Содержание
- 1 Твёрдые, жидкие, газообразные растворы
- 2 Истинные и коллоидные растворы
- 3 Растворение
- 4 Растворы электролитов и неэлектролитов
- 5 Растворы полимеров
- 6 Концентрация растворов
- 7 Мнемонические правила
- 8 См. также
- 9 Примечания
- 10 Литература
Твёрдые, жидкие, газообразные растворы
Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твёрдым (твёрдый раствор), газообразным. Однако нередко допускается и микрогетерогенность — см. «Золи».
«Раствором» именуют и смесь цемента с водой, песком и так далее. Хотя это и не является раствором в химическом смысле этого слова.
Истинные и коллоидные растворы
Коллоидные и истинные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1·10−9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1·10−9 м — 5·10−7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Растворение
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворённого вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
Растворы электролитов и неэлектролитов
Электролиты — вещества, проводящие в расплавах или водных растворах электрический ток. В расплавах или водных растворах они диссоциируют на ионы. Неэлектролиты — вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы. Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Растворы полимеров
Растворы высокомолекулярных веществ ВМС — белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов. Средняя молекулярная масса растворенноо…
Концентрация растворов
В зависимости от цели для описания концентрации растворов используются разные физические величины.
Мнемонические правила
В случаях приготовления растворов сильных кислот согласно правилам техники безопасности кислоту нужно добавлять в воду, но ни в коем случае не наоборот. Для запоминания этого лабораторного приёма существует несколько мнемонических правил:
Сначала вода,
Потом кислота,
Иначе случится
Большая бедаХимик, запомни как оду!
Льют кислоту в воду!
- Не плюй в кислоту, а то она ответит!
- Чай с лимоном (здесь нужно представить, как в чай Вы кладете дольку лимона).
«коньяк выдержанный» (кислоту в воду)
См. также
- Эмульсия
- Суспензия
- Гель
- Золь
- Нанодисперсия
- Эвтектика
- Твёрдый раствор
- Электролитическая диссоциация
- Концентрированный раствор
- Разбавленный раствор
- Насыщенный раствор
- Ненасыщенный раствор
- Пересыщенный раствор
Примечания
- ↑ 1 2 3 4 5 Н. С. Ахметов «Общая и неорганическая химия» Раздел III, Агрегатное состояние. Растворы)
Литература
- Streitwieser Andrew Introduction to Organic Chemistry. — 4th ed.. — Macmillan Publishing Company, New York, 1992. — ISBN ISBN 0-02-418170-6
Растворы – физико-химические системы
Растворами
называют гомогенные системы из двух
или нескольких веществ, состав которых
может изменяться в довольно широких
пределах.
В
настоящее время растворы рассматривают
как физико-химические системы, занимающие
по свойствам промежуточное
положение
между механическими смесями (физическими
системами) и химическими соединениями.
В
растворах,
как в механических смесях, сохраняются
химические свойства первоначально
взятых веществ
(в химических соединениях свойства
исходных веществ исчезают и появляются
новые). Растворы
и механические смеси не
обладают постоянным составом,
состав же химических соединений строго
постоянен. Растворы – гомогенные
системы,
механические смеси – гетерогенны.
Растворение
как химическое взаимодействие
сопровождается
тепловыми эффектами,
которые не наблюдаются при простом
смешении.
По
агрегатному
состоянию
растворы делят на:
-
растворы
газов в газах (газовые смеси); -
жидкие
растворы; -
твердые
растворы.
Далее
будут рассматриваться только жидкие
растворы,
которые подразделяются на:
-
растворы
твердых тел в жидкостях; -
растворы
жидкостей в жидкостях; -
растворы
газов в жидкостях.
Растворы
являются частным случаем дисперсных
систем. Дисперсными
называют системы, состоящие из вещества,
раздробленного до частиц большей или
меньшей величины и распределенного в
другом веществе. Измельченное
(раздробленное) вещество называют
дисперсной
фазой.
Вещество, в котором распределена
дисперсная фаза, называют дисперсионной
средой.
Чем
больше степень дисперсности, тем меньше
размер частиц. По степени дисперсности
все системы можно разделить на
грубодисперсные,
коллоиднодисперсные,
молекулярнодисперсные
и ионнодисперсные.
а)
Грубодисперсные
системы (размер частиц 10ˉ5 – 10ˉ3
см)
– это суспензии, эмульсии, пены.
Суспензии
– гетерогенные системы, в которых
частицы твердой дисперсной фазы
распределены в жидкой дисперсионной
среде. Это, например, взвесь крахмала в
воде, раствор кофе, известковый и
цементный раствор.
Эмульсии
образуются двумя несмешивающимися
жидкостями. Примерами эмульсий служат
молоко, майонез, маргарин, эмульсия
бензола в воде.
Пены
состоят из ячеек, заполненных газом и
отделенных друг от друга жидкими или
твердыми пленками. Это мыльная пена,
пемза, пенопласты.
Грубодисперсные
системы видны в обычный микроскоп и
даже невооруженным глазом. Могут
задерживаться бумажным фильтром. Из-за
больших размеров частиц эти системы
неустойчивы и со временем дисперсная
фаза отделяется от дисперсионной среды.
б)
Коллоиднодисперсные
системы (коллоидные растворы).
Размер частиц дисперсной фазы составляет
10ˉ7
– 10ˉ5
см, а размер частиц дисперсионной среды
10ˉ8
см. Коллоидные частицы не оседают под
действием силы тяжести, проходят через
бумажные фильтры; но они невидимы в
обычный микроскоп. Коллоидные растворы
обычно называют золями. В зависимости
от природы дисперсионной среды золи
называют гидрозолями
– дисперсионная среда – жидкость,
аэрозолями
–
дисперсионная среда воздух.
в)
Молекулярнодисперсные
и ионнодисперсные системы (истинные
растворы).
Размеры
частиц составляют 10ˉ8
см, т.е. равны размерам молекул и ионов.
В таких системах гетерогенность исчезает
— системы становятся гомогенными,
образуются истинные растворы. К ним
относятся растворы сахара, спирта,
неэлектролитов, электролитов и слабых
электролитов.
Основной
характеристикой всякого раствора
является концентрация,
которая показывает, в каком соотношении
(весом, объемном) взяты растворитель и
растворенное вещество. В физической
химии применяют в основном следующие
способы выражения концентраций растворов:
При
постоянной массе раствора
а)
Массовая доля (масс.%)
– это масса растворенного вещества,
содержащаяся в 100 единицах массы раствора.
б)
Молярная доля – Xi
– число молей растворенного вещества
в 100 молях раствора.
При
постоянной массе растворителя
а)
Моляльная концентрация
Сm
– количество молей растворенного
вещества, содержащееся в 1 кг растворителя
[моль/кг].
При
постоянном объеме раствора
а)
Молярная концентрация
СМ
–
количество молей растворенного вещества,
содержащееся в 1 литре раствора [моль/л].
б)
Молярная
концентрация эквивалентов
(нормальная концентрация) СН
– количество молей эквивалентов
вещества, содержащееся в 1 литре раствора
[моль/л].
в)
Титр
раствора
Т
– масса растворенного вещества,
содержащаяся в 1 миллилитре раствора
[г/мл].
Растворы
твердых тел в жидкостях
Растворение
– процесс самопроизвольный, идущий с
убылью свободной энергии при соприкосновении
растворяемого вещества с растворителем.
Процесс
разрушения твердых тел в жидкостях идет
в две
стадии:
-
разрушение
кристаллической решетки
(активную роль играют молекулы
растворителя, которые ослабляют силы
связи между частицами и способствуют
переходу вещества из твердого состояния
в жидкое); -
диффузия
растворенного вещества
в объем растворителя (очень медленная
стадия, определяет общую скорость
процесса).
Скорость
растворения
изменяется во времени – уменьшается
по мере увеличения концентрации
раствора. Скорость можно
увеличить:
-
путем
измельчения вещества (возрастает
поверхность соприкосновения); -
перемешиванием;
-
нагреванием.
Если
растворитель соприкасается с большим
количеством растворенного вещества,
то через некоторое время раствор окажется
насыщенным. Насыщенным
называют такой раствор, который находится
в фазовом динамическом равновесии с
избытком растворяемого вещества. В
таком растворе в единицу времени
кристаллизуется столько вещества,
сколько его растворяется (скорость
кристаллизации равна скорости
растворения).
Всякий
раствор, концентрация которого меньше
концентрации раствора, насыщенного при
данной температуре, называется
ненасыщенным.
В таком растворе возможно дополнительное
растворение вещества до предела
насыщения.
Раствор,
концентрация которого больше концентрации
насыщенного при данных условиях,
называется пересыщенным.
Такие растворы можно получать осторожным
охлаждением ненасыщенных растворов,
концентрация которых близка к насыщению.
При понижении температуры растворимость
вещества понижается, наконец, при
некоторой температуре должна наступить
кристаллизация. Однако довольно долго
вещество не кристаллизуется, его
содержание в растворе оказывается
большим, чем это соответствует концентрации
насыщенного при данной температуре
раствора, т.е. наблюдается пересыщение.
Пересыщенные растворы метастабильны.
Сильное встряхивание или внесение
«затравки» (кристалл растворенного или
изоморфного с ним вещества) вызывает
мгновенную кристаллизацию.
Изменение
растворимости с температурой принято
изображать графически в виде кривых
растворимости.
По оси абсцисс откладывают состав
раствора, по оси ординат – температуру.
Если
кривая растворимости не содержит
изломов,
то при любой температуре из раствора
выделяется
в виде кристаллов вещество с одинаковым
составом.
Появление
одного или нескольких изломов
на кривых растворимости говорит о том,
что в составе
выпадающих кристаллов произошли какие-то
изменения
(кристаллогидрат переходит в безводную
соль, либо в кристаллогидрате уменьшилось
содержание воды – см.рис.). Иногда излом
на кривой соответствует полиморфному
превращению.
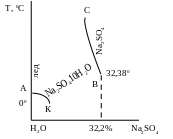
Равновесие
в системе вода – сульфат натрия
АК
– выделение кристаллов льда из растворов
с малым содержанием соли
КВС
– кривая растворимости сульфата натрия
В
– точка
перехода,
соответствует превращению кристаллогидрата
в безводную соль. При этом система
безвариантна, т.к. при наличии двух
компонентов находятся в равновесии 4
фазы: 2 соли, жидкий раствор и пар.
С
= К + 2 – Ф = 2 + 2 – 4 = 0. Равновесие в точке
В может существовать только при
температуре 32,380С
и концентрации Na2SO4
32,2%.
К
– криогидратная
точка,
соответствует одновременному равновесию
четырех фаз: кристаллов льда, Na2SO410H2O,
жидкого раствора, пара. Криогидрат имеет
постоянную температуру плавления
(кристаллизации), т.к. в системе при
указанном равновесии отсутствуют
степени свободы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
08.04.201515.64 Mб78 — Желтов В.В. Полит. соц..pdf
Коллоидная химия
Растворы.
Растворами называют однородные системы переменного состава. Химический состав и физические свойства
одного раствора во всех частях его объёма одинаковы.
В отличие от простого смешивания веществ, при растворении происходит взаимодействие между частицами, образующими раствор.
Часто для определения раствора используют понятия гомогенной и системы.
В этом случае, раствором называется гомогенная система, состоящая из двух или более компонентов.
Гомогенные и гетерогенные системы
Гомогенная система (от греч. όμός — равный, одинаковый; γένω — рождать) — однородная система,
химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно,
без скачков (между частями системы нет поверхностей раздела).
В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул,
атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
Гетерогенная система (от греч. έτερος — разный; γένω — рождать) — неоднородная система, состоящая из
однородных частей (фаз), разделённых поверхностью раздела.
Растворы могут существовать в трёх агрегатных состояниях – твёрдом, жидком и газообразном (парообразном).
Примерами твёрдых растворов могут служить некоторые сплавы металлов, например сплав золота и меди, газообразных – воздух.
Наиболее важный вид растворов – жидкие растворы.
Растворы имеют чрезвычайно важное значение в жизни человека. Так, процессы усвоения пищи человеком и
животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.).
Растворители
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно
распределены в виде молекул и ионов.
Обычно растворителем считают тот компонент, который в чистом виде существует в том же агрегатном состоянии,
что и полученный раствор. Например, в случае водного раствора соли растворителем является вода.
Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода),
то растворителем считается компонент, находящийся в большем количестве.
Истинные и коллоидные растворы
В растворах вещества могут находиться в различных степенях дисперсности (т.е. раздробленности).
Величина частиц служит важным признаком, обуславливающим многие физикохимические свойства растворов.
По величине частиц растворы делятся на:
1. Истинные растворы (размер частиц меньше 1 мкм) и
2. Коллоидные растворы (размер частиц от 1 до 100 мкм).
Смеси с частицами размером более 100 мкм образуют взвеси: суспензии и эмульсии.
Истинные растворы могут быть ионными или молекулярными в зависимости от того, диссоциирует ли растворённое вещество на
ионы или остаётся в недиссоциированном состоянии в виде молекул.
Коллоидные растворы резко отличаются по свойствам от истинных растворов. Они гетерогенны,
так как имеют поверхность раздела между фазами – растворённым веществом (дисперсной фазой) и растворителем (дисперсионной средой).
Растворы высокомолекулярных соединений: белков, полисахаридов, каучука обладают свойствами как истинных,
так и коллоидных растворов и выделяются в особую группу.
Растворы, механические смеси и химические соединения
Однородность растворов делает их очень сходными с химическими соединениями.
Химическое соединение — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов.
Раствор это не одно химическое соединение, а как минимум два смешанных соединения. В отличие от простого смешивания веществ,
при растворении происходит взаимодействие между частицами, образующими раствор.
Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом.
Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах.
Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Непостоянство состава растворов приближает их к механическим смесям.
Механическая смесь — физико-химическая система, в состав которой входят два или несколько химических соединений (компонентов).
В смеси исходные вещества включены неизменными. При смешивании не возникает никакое новое вещество.
От механических смесей растворы резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное
положение между механическими смесями и химическими соединениями.
Процесс растворения
Растворение кристалла в жидкости протекает следующим образом.
Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы.
Последние благодаря диффузии равномерно распределяются по всему объёму растворителя.

Отделение молекул от поверхности твёрдого тела вызывается, с одной стороны, их собственным колебательным движением,
а сдругой – притяжением со стороны молекул растворителя.
Этот процесс должен был бы продолжаться до полного до полного растворения любого количества кристаллов,
если бы не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность
ещё не растворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов.
Понятно, что выделение молекул из раствора будет идти тем быстрее, чем больше концентрация раствора.
А так как последняя по мере растворения вещества увеличивается, то, наконец наступает такой момент,
когда скорость растворения становится равной скорости кристаллизации. Тогда устанавливается динамическое равновесие,
при котором в единицу времени растворяется и кристаллизуется одинаковое число молекул.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Концентрация растворов
Насыщенными растворами приходится пользоваться сравнительно редко. В большинстве случаев употребляются растворы
ненасыщенные, т.е. с меньшей концентрацией растворённого вещества, чем в насыщенном растворе.
Концентрацией раствора называется количество растворённого вещества, содержащееся в определённом количестве раствора или растворителя.
Растворы с большой концентрацией растворённого вещества называются концентрированными, с малой – разбавленными.
Концентрацию раствора можно выражать по разному:
1. В процентах растворённого вещества по отношению ко всему количеству раствора.
2. Числом грам-молекул растворённого вещества, содержащегося в 1 литре раствора.
3. Числом грамм-молекул растворённого вещества, содержащегося в 1000 г растворителя
и т.д.
Растворимость
Растворимостью называется способность вещества растворяться в том или ином растворителе.
Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора.
Растворимость различных веществ колеблется в широких пределах.
- Если в 100 граммах воды растворяется более 10 г вещества, то такое вещество
принято называть хорошо растворимым. - Если растворяется менее 1 г вещества – малорастворимым.
- Если в раствор переходит менее 0,01 г вещества, то такое вещество называют
практически нерастворимым.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако, обычно вещества,
состоящие из полярных молекул, и вещества с ионным типам связи лучше растворяются в полярных растворителях (вода, спиры, жидкий амиак),
а неполярные вещества – в неполярных растворителях (бензол, сероуглерод).
Растворение большинства твёрдых тел сопровождается поглощением теплоты. Это объясняется затратой
значительного количества энергии на разрушение кристаллической решётки твёрдого тела, что обычно не полностью
компенсируется энергией, выделяющейся при образовании гидратов (сольватов).
Как правило, повышение температуры должно приводить к увеличению растворимости твёрдых тел.